国際特許分類[C07K1/06]の内容
化学;冶金 (1,075,549) | 有機化学 (230,229) | ペプチド (29,849) | ペプチドの製造のための一般方法 (1,853) | 保護基または活性化剤を使用するもの (111)
国際特許分類[C07K1/06]の下位に属する分類
活性化剤を使用するもの (16)
国際特許分類[C07K1/06]に分類される特許
41 - 50 / 95
ペプチド合成方法及び該方法に使用可能な水性分散液
【課題】水性液中での縮合反応が従来技術と比較して早く、未反応保護アミノ酸を回収可能な、ペプチドの合成方法の提供。
【解決手段】ペプチド合成に使用される保護アミノ酸及び/又は保護ペプチドの粒子径に注目し、粒子径を非常に小さくした保護アミノ酸及び/又は保護ペプチドが分散した水性分散液を利用したペプチドの合成方法。すなわち、アミノ酸及び/又はペプチドのN末端アミノ基が保護基で保護された保護アミノ酸及び/又は保護ペプチドを縮合反応させるペプチドの合成方法であって、縮合反応が平均粒子径1〜750nmの保護アミノ酸及び/又は保護ペプチドの水性分散液中で行われることを特徴とするペプチドの合成方法。
【効果】水性液中でのペプチド合成方法としては、ペプチドの縮合反応速度に優れ、また未反応の保護アミノ酸及び/ペプチドの回収及び再利用が容易である。
(もっと読む)
ペプチドを製造するための方法
メリフィールドタイプの樹脂に結合された環状ペプチドを提供し、メリフィールドタイプの樹脂から、エステル交換によって環状ペプチドを切断することを含む、環状ペプチドを製造するための方法。 (もっと読む)
ケージドペプチドの合成法
【課題】ペプチドに関するケージド化合物を提供する。
【解決手段】下記式(I)
(式中、R1はアミノ基の保護基を示す。AはGly,Pro以外のペプチドを構成するαアミノ酸の側鎖を示す。Bはαアミノ酸の側鎖を示す。Raは光解離性保護基を示す。)で表されるN保護ジペプチド化合物を、固相合成においてN保護アミノ酸の代わりに使用することを特徴とする、光解離性保護基を主鎖に導入したペプチドの固相合成法。
(もっと読む)
酵素加水分解に対する傾向が減少した薬理学的に活性なペプチド複合体
【課題】対応する遊離の薬理学的に活性なペプチドに比較して、プロテアーゼによる分解に対する感受性が低下した、ペプチド複合体の提供。
【解決手段】薬理学的に活性なペプチド(X)に、そのC末端、N末端、またはN,C両末端において、4〜20残基のアミノ酸の特定の配列からなる、安定化ペプチド(Z)を共有結合させる事により、各種プロテアーゼによる切断に対する感受性が有意に低下した、ペプチド複合体。該複合体は、生体内半減期が延長、経口吸収性が改善され、薬理学的な活性が強化される。
(もっと読む)
皮膚のトリートメントにおいて有用な合成ペプチド類および化粧品または皮膚薬剤組成物中でのその用途
本発明は、原線維発生を制御することができる一般式(I)のペプチド類、その立体異性体類およびラセミ体であってもよいその混合物類、およびその化粧学的または皮膚薬剤学的に許容できる塩類に関し、式中、Zはアラニル、アロ−イソロイシル、グリシル、イソロイシル、イソセリル、イソバリル、ロイシル、ノルロイシル、ノルバリル、プロリル、セリル、スレオニル、アロ−スレオニルまたはバリルであり;nおよびmは、1と5の間で変動し;AAは、LまたはD体でコードされた天然アミノ酸類およびコードされないアミノ酸類により形成される群から選択され;xおよびyは、0と2の間で変動し;R1はHまたはアルキル、アリール、アラルキルまたはアシル基であり;およびR2は、アミノ、ヒドロキシルまたはチオールであり、これら全てが、脂肪族または環状基により置換されているかまたは置換されていない。それらを含有する化粧品または皮膚薬剤学組成物類を得る方法、および皮膚、好適には、加齢および/または瘢痕外観の柔軟化のような原線維発生制御を必要とする皮膚状態のトリートメントのためのその用途。
【化1】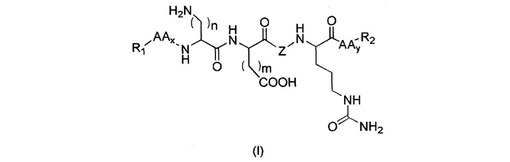
 (もっと読む)
(もっと読む)
安定同位体元素を有するポリペプチド混合物の合成方法
【課題】 改良された蛋白質のNMR測定法で利用可能な安定同位体元素でラベル化されたポリペプチド混合物の製造法を提供する。
【解決手段】下記の工程を含む、安定同位体元素でラベル化されたペプチド混合物の製造方法。1)n個のアミノ酸残基からなるペプチドのアミノ酸配列X1−・・・−Xnを決定する工程、2)アミノ酸X1、X2、・・・Xnにそれぞれ対応する合成用アミノ酸カクテルx1、x2、・・・xnを用意する工程3)2)で用意した合成用アミノ酸カクテルを用いて1)で決定したアミノ酸配列からなるペプチドを合成する工程。 従来の方法のようにアミノ酸残基の個数分のポリペプチドを、ラベル化するアミノ酸残基を変えながら用意する必要がなく、タンパク質のNMRによる測定作業を著しく簡便化する、タンパク質の新たなNMR測定法を可能にするポリペプチドを製造することができる。
(もっと読む)
ペプチド構造のライブラリーの構築およびスクリーニング方法
本発明は、薬物スクリーニング適用のためのペプチド構造のライブラリーを製造するための手段を提供し、該ペプチド構造は、人工足場または、該ペプチド構造が由来するタンパク質中のフランキング配列から独立して、その天然コンフォメーションをフォールドするか、または天然コンフォメーションをとることが可能なペプチド構造である。該ライブラリーは、それらが天然に存在するタンパク質構造のレパートリーを代表するように、非常に多様でありうる。該ライブラリーはまた、ソースデータセット中および/または天然に存在する特定構造に向かうバイアスが除去されるように、非冗長でありうるか、または正規化しうる。特に好ましい実施形態では、本発明は、本方法によって製造された30,000個の独立したフォールド構造を提供する。本発明はまた、該ペプチドライブラリーに関する構造データを含むコンピュータ可読媒体およびシステム、ならびに該ライブラリーを提示およびスクリーニングするための方法を提供する。 (もっと読む)
ペプチド合成におけるマイクロ波により向上されたN−FMOC脱保護
【課題】脱保護反応により簡単にペプチド合成を実施する方法を提供する。
【解決手段】脱保護反応に対してマイクロ波照射を適用すると同時に、Fmoc保護アミノ酸をピペラジンにより脱保護することを含み、固相ペプチド合成方法を用いて、脱保護、活性化、及びカップリングのサイクルを繰り返し、連続するアミノ酸を付加して所望のペプチドを形成する方法。マイクロ波エネルギーを適用することでペプチド及びアミノ酸の分解を防止することができる。
(もっと読む)
グルカゴンン様ペプチドの合成
GLP−1ペプチドを合成する新規な方法が案出される。 (もっと読む)
テンプレート固定ペプチド擬似体
一般式(I)[式中、Zは12個のα−アミノ酸残基のテンプレート固定鎖であり、これらのアミノ酸残基は、鎖中の残基の位置(N末端アミノ酸から開始して数えた位置)に応じて、Gly、もしくはProであるか、または特定のタイプの残基であり、上の式中の残りの記号と同様に、本明細書および特許請求の範囲に定義されている]で表わされるテンプレート固定β−ヘアピンペプチド擬似体およびその塩は、シュードモナス・アエルギノーザ[Pseudomonas aeruginosa](緑膿菌)のような微生物の増殖を選択的に阻害する、またはそれを殺す特質を有する。これらは、食品、化粧品、医薬品、および他の栄養素含有材料用の殺菌薬として、または感染を治療または予防するための医薬として用いることができる。こうしたβ−ヘアピンペプチド擬似体は、混合型固相・液相合成法に基づいた方法により製造することができる。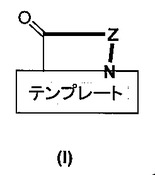 (もっと読む)
(もっと読む)
41 - 50 / 95
[ Back to top ]