アセタールの選択的脱保護法
【課題】 緩和な条件下でアルデヒド由来のアセタールを選択的に脱保護する方法を提供する。
【解決手段】 塩化メチレン中、O℃下で、アルデヒド基由来のアセタール基を有する化合物に対し、有機塩基、及びTMSOTf又はTESOTfを順次加えて反応を行うことによりアルデヒド由来のアセタール基をアルデヒド基へと変換する。
【解決手段】 塩化メチレン中、O℃下で、アルデヒド基由来のアセタール基を有する化合物に対し、有機塩基、及びTMSOTf又はTESOTfを順次加えて反応を行うことによりアルデヒド由来のアセタール基をアルデヒド基へと変換する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、有機合成分野において特定の官能基に結合された保護基を選択的に脱保護する方法に関する。
【背景技術】
【0002】
複数の官能基を持つ有機分子を用いて有機合成を行う場合、目的の官能基のみを選択的に反応させるために、その他のより反応性の高い官能基を保護基と呼ばれる反応性の低い原子団に変換して一時的に不活性化することが多い。これを官能基の「保護」といい、例えばカルボニル基はアセタール基に、水酸基はシリルエーテル基によってしばしば保護される。
また、保護基は対象とする官能基を安定に保護するだけでなく、必要に応じて容易に除去できることが重要である。このように、反応終了後に不要となった保護基を外すことを「脱保護」といい、合成を進める上で保護基によって不活性化した官能基のうち特定のものだけを反応させる必要が生じた際には、それらに結合した保護基を独立に除去する必要がある。従って、特定の官能基に結合した保護基のみを緩和な条件下で脱保護することは有機合成において有用である。
【発明の開示】
【発明が解決しようとする課題】
【0003】
カルボニル基の保護基として用いられるアセタール基は、中性及び塩基性条件下で安定であり、通常、酸性条件下で加水分解により脱保護される。このとき、アルデヒド由来のアセタールよりも、安定なカチオン中間体を経るケトン由来のアセタールの方が脱保護化されてケトンへと変換されやすいことが知られている。それに対し、ケトン由来のアセタール存在下でアルデヒド由来のアセタールを選択的に脱保護する方法は未だ知られていない。
本発明はこのような課題を解決するために成されたものであり、その目的とするところは、緩和な条件下でアルデヒド由来のアセタールを選択的に脱保護する方法を提供することにある。
【課題を解決するための手段】
【0004】
本願発明者らは上記課題の解決のため鋭意研究を行った結果、有機塩基、及びトリフルオロメタンスルホン酸トリメチルシリル(TMSOTf)又はトリフルオロメタンスルホン酸トリエチルシリル(TESOTf)によってアセタール基を脱保護できることを発見し、更に該脱保護法が特にアルデヒド由来のアセタール基に対して高い選択性を有することを見いだし、本願発明に至った。
【0005】
すなわち、上記課題を解決するために成された本発明に係るアセタールの脱保護法は、アセタール基を含む化合物に対し、有機塩基、及びトリフルオロメタンスルホン酸トリメチルシリル又はトリフルオロメタンスルホン酸トリエチルシリルを加えて反応させることにより、該アセタール基をカルボニル基に変換することを特徴とする。
【0006】
また、本発明の別の態様のものは、一分子中に水酸基及びアセタール基を含む化合物、又は水酸基を含む化合物とアセタール基を含む化合物の混合物に対し、上記脱保護法を適用することにより、該アセタール基をカルボニル基に変換すると共に、該水酸基をシリル化することを特徴とする。
【発明の効果】
【0007】
上記の手段を用いることによりアルデヒド由来のアセタール基を選択的に脱保護することができるため、例えばアルデヒド由来のアセタール基を有する化合物とケトン由来のアセタール基を有する化合物の混合物や、一分子中にアルデヒド由来のアセタール基及びケトン由来のアセタール基を有する化合物のような、ケトン由来のアセタール存在下において、アルデヒド由来のアセタールのみを選択的に脱保護することができる。
【0008】
また、上記反応により水酸基はシリル化(トリメチルシリル化又はトリエチルシリル化)されるため、アセタールの脱保護及び水酸基の保護をワンポット(one-pot)の反応によって実現することができる。
【0009】
また、本発明の脱保護法は非常に緩和な反応であるため、OAc, OTBS, オレフィン、アルコールやアリルアルコールなど他の官能基に影響を与えることなくアセタールの脱保護を行うことができる(但し、アルコールやアリルアルコールの水酸基はシリルエーテルになる)。
【0010】
なお、上記脱保護法はアセタール基の内、特にアルデヒド由来のものを高選択的に脱保護するものであるが、反応条件を適宜選択することにより、ケトン由来のアセタール基を脱保護することもできる。
【発明を実施するための最良の形態】
【0011】
【化1】

本発明において脱保護の対象となるアセタール化合物は特に限定されず、化学式1(化学式中のRは特に制限されない)に示すような、非環状アセタール及び環状アセタールのいずれのアセタール化合物も収率よく脱保護化することができる。
【0012】
【化2】

また、化学式2に示すような、同一分子内にケトン由来のアセタール基及びアルデヒド由来のアセタール基を併せ持つアセタール化合物ではアルデヒド由来のアセタール基を選択的に脱保護することができる。
【0013】
【化3】

更に、化学式3のような同一分子内に水酸基を含むアセタール型化合物に本発明の脱保護法を適用した場合には、アセタール基の脱保護と水酸基のシリル化を高収率且つワンポットで行うことができる。
【0014】
【化4】

また更に、化学式4のような、同一分子内に水酸基とケトン由来のアセタール基、及びアルデヒド由来のアセタール基を含むアセタール化合物においても、高選択的なアルデヒド由来のアセタール基の脱保護と水酸基のシリル化を高収率且つワンポットで行うことができる。
【0015】
【化5】

【化6】

【化7】

また、本発明の脱保護法をアセタール型アルコール保護基を含む化合物(例えば、MOMエーテル(化学式5)、THPエーテル(化学式6)、アセトニドなど(化学式7))に適用した場合、これらが脱保護されると共に、それによって生じた水酸基がシリル化される。
【0016】
以上のように、本発明において脱保護の対象となる化合物は、アセタール基又はアセタール型アルコール保護基を含む化合物であればいかなるものでも良く、更に、同一分子内にアセタール基及び/又はアセタール型アルコール保護基と水酸基とを含む化合物に本発明を適用し、アセタールの脱保護と水酸基のシリル化をワンポットで行うようにしてもよい。なお、これらのアセタール基、アセタール型アルコール保護基、及び水酸基は必ずしも同一分子内に存在している必要はなく、これらの基を個別に含む化合物を混合したものに対して本発明の脱保護法を適用しても良い。
【0017】
本発明の脱保護法に用いられる有機塩基としては特に限定されないが、コリジン, 2,6-ルチジン, トリエチルアミンのいずれかを用いるのが望ましい。
【0018】
反応溶媒としては、反応に悪影響を与えない限り特に制限はなく、例えば塩化メチレンなどを用いることができる。
【0019】
反応温度には特に限定はないが、0℃付近で反応を行うことが望ましい。また、反応時間は、アセタール化合物の種類や、脱保護に用いる試薬や溶媒の種類に応じて適宜選択する。
【0020】
本発明のアセタールの脱保護法によって得られた生成物は、通常の有機化合物の単離・精製に用いられる方法により単離・精製することができる。例えば、反応混合物を食塩水又は水で処理し、ジエチルエーテル、酢酸エチル、塩化メチレンなどの有機溶媒で抽出する。抽出液を無水硫酸マグネシウム、無水硫酸ナトリウムなどで乾燥し、濃縮して得られる粗生成物を必要に応じて蒸留、クロマトグラフィー、再結晶などにより精製する。
[実施例]
【0021】
以下に、本発明の実施例を示すが、本発明はこれらに限定されるものではない。
【実施例1】
【0022】
【化8】

窒素雰囲気下、アセタール(96mg)の無水塩化メチレン溶液(0.1モル濃度)に0℃で2,6-ルチジン(0.11mL、3.0当量)とTESOTf(0.14mL, 2.0当量)を滴下し、撹拌した。1時間後、原料の消失を薄層クロマトグラフィーで確認し、水を加えて0.5時間撹拌した。反応混合物を塩化メチレンで抽出し、有機層をNa2SO4で乾燥し、減圧濃縮した。粗生成物をシリカゲルフラッシュカラムクロマトグラフィー(ヘキサン:エーテル=7:1)で精製しアルデヒド(65mg, 収率79%)を得た。
colorless oil;IR(KBr): 1724cm-1;1H NMR(300MHz, CDCl3)δ:9.77(t,J=1.8 Hz, 1H),3.94-3.92(doublet like, 4H),2.44-2.39(m, 2H),1.65-1.60(m, 2H),1.31(s, 3H),1.42-1.28(m, 16H); 13C NMR (75 MHz, CDCl3)δ:21.83, 23.45, 23.84, 28.90, 29.07, 29.23, 29.22, 29.30, 29.59, 38.93, 43.66, 64.34, 109.96, 202.72.
【実施例2】
【0023】
【化9】

窒素雰囲気下、アセタール(101mg)の無水塩化メチレン溶液(3.75mL)に0℃で2,6-ルチジン(0.225mL、6.0当量)とTESOTf(0.29mL, 4.0当量)を加え、0℃で5分間撹拌した。水を加えて塩化メチレンで抽出し、有機層を飽和食塩水で洗浄後、Na2SO4で乾燥した。溶媒を減圧濃縮し、粗生成物をシリカゲルフラッシュカラムクロマトグラフィー(ヘキサン:酢酸エチル=25:1)で精製しアルデヒド(101mg, 収率82%)を得た。
colorless oil;IR(KBr): 1720cm-1;1H NMR(300MHz, CDCl3)δ:9.82(dd,J=2.7, 3.2 Hz, 1H), 5.76(dt, J=3.6, 10.0 Hz, 1H),5.57(dt, J=1.8, 10.0 Hz, 1H),3.89(dd, J=2.0, 14.5 Hz, 1H),2.63(dd, J=3.2, 15.9 Hz, 1H), 2.31(dd, J=2.7, 15.9 Hz, 1H), 2.30-2.19(m, 2H), 1.82-1.92(m, 1H), 1.54-1.64(m, 1H), 0.85-1.07(m, 18H), 0.94(t, J= 7.8 Hz, 6H), 0.88(s, 9H), 0.62(q, J=7.8 Hz, 6H), 0.08(s, 6H); 13C NMR (75 MHz, CDCl3)δ:-4.0, 7.2, 18.0, 23.1, 25.9, 28.2, 51.4, 75.8, 129.5, 130.9, 202.6.
【0024】
以下、本発明の脱保護法に関するその他の実施例について簡単に説明する。なお、これらの実施例は以下の基本操作法に従って実施した。
【0025】
基本操作法:窒素雰囲気下、アセタールの無水塩化メチレン溶液(0.1モル濃度)に0℃で2,6-ルチジン(反応部位がアセタールのみの場合は3.0当量、分子内にアセタールと水酸基がある場合は4.0当量)とTMSOTf又はTESOTf(反応部位がアセタールのみの場合は2.0当量、分子内にアセタールと水酸基がある場合には3.0当量)を加え、撹拌した。原料の消失を薄層クロマトグラフィーで確認し、水を加えて塩化メチレンで抽出し、有機層をNa2SO4で乾燥、減圧濃縮した。粗生成物をシリカゲルフラッシュカラムクロマトグラフィーで精製し、生成物を得た。
【実施例3】
【0026】
種々のアルデヒド由来のアセタール基を含む化合物及びケトン由来のアセタール基を含む化合物に対して、本発明の脱保護法を適用した例を図1に示す。アルデヒド由来のアセタール化合物(run1-6, 9-15)では殆どの場合において高い収率でアルデヒドが得られた。
一方、ケトン由来のアセタール化合物に本発明を適用した場合(run7,8)は、TESOTfを用いた場合(run8)に殆ど脱保護が起こっておらず、本発明の脱保護法が高い選択性を持つことが分かる。但し、TMSOTfを用いた場合(run7)には、ケトン由来のアセタール基の脱保護化が見られた。
【実施例4】
【0027】
同一分子内に水酸基とアルデヒド由来のアセタール基を含む化合物に対して、本発明の脱保護法を適用した例を図2に示す。その結果、第1アルコール型(run 1,2)、第2アルコール型(run 3)、第3アルコール型(run 4)、及びステロイド型(run 5)のいずれのアセタール化合物においても、アセタール基が脱保護されると共に水酸基がシリル化された生成物が高い収率で得られた。
【実施例5】
【0028】
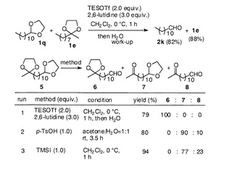
本発明の脱保護法の高い選択性を証明するため、アルデヒド由来のアセタール基を含む化合物とケトン由来のアセタール基を含む化合物の混合物、及び同一分子内にアルデヒド由来のアセタール基とケトン由来のアセタール基を併せ持つ化合物に対して本発明の脱保護法を適用した。その結果、図3に示すように、どちらの場合においても、アルデヒド由来のアセタールのみが選択的に脱保護され、ケトン由来のアセタールはそのまま残っていた。
一方、同一分子内にアルデヒド由来のアセタール基とケトン由来のアセタール基を併せ持つ化合物に対して、従来の代表的なアセタールの脱保護法であるp-TsOH処理又はTMSI処理を施した場合(run 2,3)には、このような選択性は見られなかった。
【実施例6】
【0029】
更に、図4に示すように、同一分子内にアルデヒド由来のアセタール基とケトン由来のアセタール基を併せ持つ種々の化合物に対して、本発明の脱保護法を適用したところ、いずれの場合もアルデヒド由来のアセタール基の選択的な脱保護が見られた。また、同一分子内のアセチル基やメトキシル基などはそのまま残っており、本発明における脱保護反応が緩和な反応であることが分かる。
【実施例7】
【0030】
アセタール化合物の代わりに、アセタール型アルコール保護基を含む化合物に対して本発明の脱保護法を適用したところ、図5に示すように、MOMエーテル、THPエーテル、アセトニドのいずれの保護基も脱保護されると共に、シリルエーテル化された生成物が得られた。
【比較例1】
【0031】
種々のシリル化試薬を用いてアルデヒド由来アセタールの脱保護を試みた。その結果、図6に示すように、TMSOTf又はTESOTf以外ではアルデヒド由来アセタールの脱保護化は見られなかった(図中の“n.r.”は“反応なし(no reaction)”を意味する)。
【比較例2】
【0032】
種々の有機塩基を用いてアルデヒド由来のアセタールの脱保護を試みた結果を図7(a)に示す。その結果、2,6-ルチジン、トリエチルアミン(Et3N)の順に効果が高いことが分かった。更に、図7(b)に示すように有機塩基として2,6-ルチジンを用いた場合と、コリジンを用いた場合とで比較を行ったところ、コリジンを用いた場合の方が、より高収率でアルデヒド由来のアセタールが脱保護された生成物が得られた。
【図面の簡単な説明】
【0033】
【図1】本発明の実施例3における反応条件及び結果を示す表。
【図2】本発明の実施例4における反応条件及び結果を示す表。
【図3】本発明の実施例5における反応条件及び結果を示す表。
【図4】本発明の実施例6における反応条件及び結果を示す表。
【図5】本発明の実施例7における反応条件及び結果を示す図。
【図6】本発明の比較例1における反応条件及び結果を示す表。
【図7】本発明の比較例2における(a)種々の有機塩基を用いた場合の反応条件及び結果を示す表、(b)2,6-ルチジン及びコリジンを用いた場合の反応条件及び結果を示す図。
【技術分野】
【0001】
本発明は、有機合成分野において特定の官能基に結合された保護基を選択的に脱保護する方法に関する。
【背景技術】
【0002】
複数の官能基を持つ有機分子を用いて有機合成を行う場合、目的の官能基のみを選択的に反応させるために、その他のより反応性の高い官能基を保護基と呼ばれる反応性の低い原子団に変換して一時的に不活性化することが多い。これを官能基の「保護」といい、例えばカルボニル基はアセタール基に、水酸基はシリルエーテル基によってしばしば保護される。
また、保護基は対象とする官能基を安定に保護するだけでなく、必要に応じて容易に除去できることが重要である。このように、反応終了後に不要となった保護基を外すことを「脱保護」といい、合成を進める上で保護基によって不活性化した官能基のうち特定のものだけを反応させる必要が生じた際には、それらに結合した保護基を独立に除去する必要がある。従って、特定の官能基に結合した保護基のみを緩和な条件下で脱保護することは有機合成において有用である。
【発明の開示】
【発明が解決しようとする課題】
【0003】
カルボニル基の保護基として用いられるアセタール基は、中性及び塩基性条件下で安定であり、通常、酸性条件下で加水分解により脱保護される。このとき、アルデヒド由来のアセタールよりも、安定なカチオン中間体を経るケトン由来のアセタールの方が脱保護化されてケトンへと変換されやすいことが知られている。それに対し、ケトン由来のアセタール存在下でアルデヒド由来のアセタールを選択的に脱保護する方法は未だ知られていない。
本発明はこのような課題を解決するために成されたものであり、その目的とするところは、緩和な条件下でアルデヒド由来のアセタールを選択的に脱保護する方法を提供することにある。
【課題を解決するための手段】
【0004】
本願発明者らは上記課題の解決のため鋭意研究を行った結果、有機塩基、及びトリフルオロメタンスルホン酸トリメチルシリル(TMSOTf)又はトリフルオロメタンスルホン酸トリエチルシリル(TESOTf)によってアセタール基を脱保護できることを発見し、更に該脱保護法が特にアルデヒド由来のアセタール基に対して高い選択性を有することを見いだし、本願発明に至った。
【0005】
すなわち、上記課題を解決するために成された本発明に係るアセタールの脱保護法は、アセタール基を含む化合物に対し、有機塩基、及びトリフルオロメタンスルホン酸トリメチルシリル又はトリフルオロメタンスルホン酸トリエチルシリルを加えて反応させることにより、該アセタール基をカルボニル基に変換することを特徴とする。
【0006】
また、本発明の別の態様のものは、一分子中に水酸基及びアセタール基を含む化合物、又は水酸基を含む化合物とアセタール基を含む化合物の混合物に対し、上記脱保護法を適用することにより、該アセタール基をカルボニル基に変換すると共に、該水酸基をシリル化することを特徴とする。
【発明の効果】
【0007】
上記の手段を用いることによりアルデヒド由来のアセタール基を選択的に脱保護することができるため、例えばアルデヒド由来のアセタール基を有する化合物とケトン由来のアセタール基を有する化合物の混合物や、一分子中にアルデヒド由来のアセタール基及びケトン由来のアセタール基を有する化合物のような、ケトン由来のアセタール存在下において、アルデヒド由来のアセタールのみを選択的に脱保護することができる。
【0008】
また、上記反応により水酸基はシリル化(トリメチルシリル化又はトリエチルシリル化)されるため、アセタールの脱保護及び水酸基の保護をワンポット(one-pot)の反応によって実現することができる。
【0009】
また、本発明の脱保護法は非常に緩和な反応であるため、OAc, OTBS, オレフィン、アルコールやアリルアルコールなど他の官能基に影響を与えることなくアセタールの脱保護を行うことができる(但し、アルコールやアリルアルコールの水酸基はシリルエーテルになる)。
【0010】
なお、上記脱保護法はアセタール基の内、特にアルデヒド由来のものを高選択的に脱保護するものであるが、反応条件を適宜選択することにより、ケトン由来のアセタール基を脱保護することもできる。
【発明を実施するための最良の形態】
【0011】
【化1】

本発明において脱保護の対象となるアセタール化合物は特に限定されず、化学式1(化学式中のRは特に制限されない)に示すような、非環状アセタール及び環状アセタールのいずれのアセタール化合物も収率よく脱保護化することができる。
【0012】
【化2】

また、化学式2に示すような、同一分子内にケトン由来のアセタール基及びアルデヒド由来のアセタール基を併せ持つアセタール化合物ではアルデヒド由来のアセタール基を選択的に脱保護することができる。
【0013】
【化3】

更に、化学式3のような同一分子内に水酸基を含むアセタール型化合物に本発明の脱保護法を適用した場合には、アセタール基の脱保護と水酸基のシリル化を高収率且つワンポットで行うことができる。
【0014】
【化4】

また更に、化学式4のような、同一分子内に水酸基とケトン由来のアセタール基、及びアルデヒド由来のアセタール基を含むアセタール化合物においても、高選択的なアルデヒド由来のアセタール基の脱保護と水酸基のシリル化を高収率且つワンポットで行うことができる。
【0015】
【化5】

【化6】

【化7】

また、本発明の脱保護法をアセタール型アルコール保護基を含む化合物(例えば、MOMエーテル(化学式5)、THPエーテル(化学式6)、アセトニドなど(化学式7))に適用した場合、これらが脱保護されると共に、それによって生じた水酸基がシリル化される。
【0016】
以上のように、本発明において脱保護の対象となる化合物は、アセタール基又はアセタール型アルコール保護基を含む化合物であればいかなるものでも良く、更に、同一分子内にアセタール基及び/又はアセタール型アルコール保護基と水酸基とを含む化合物に本発明を適用し、アセタールの脱保護と水酸基のシリル化をワンポットで行うようにしてもよい。なお、これらのアセタール基、アセタール型アルコール保護基、及び水酸基は必ずしも同一分子内に存在している必要はなく、これらの基を個別に含む化合物を混合したものに対して本発明の脱保護法を適用しても良い。
【0017】
本発明の脱保護法に用いられる有機塩基としては特に限定されないが、コリジン, 2,6-ルチジン, トリエチルアミンのいずれかを用いるのが望ましい。
【0018】
反応溶媒としては、反応に悪影響を与えない限り特に制限はなく、例えば塩化メチレンなどを用いることができる。
【0019】
反応温度には特に限定はないが、0℃付近で反応を行うことが望ましい。また、反応時間は、アセタール化合物の種類や、脱保護に用いる試薬や溶媒の種類に応じて適宜選択する。
【0020】
本発明のアセタールの脱保護法によって得られた生成物は、通常の有機化合物の単離・精製に用いられる方法により単離・精製することができる。例えば、反応混合物を食塩水又は水で処理し、ジエチルエーテル、酢酸エチル、塩化メチレンなどの有機溶媒で抽出する。抽出液を無水硫酸マグネシウム、無水硫酸ナトリウムなどで乾燥し、濃縮して得られる粗生成物を必要に応じて蒸留、クロマトグラフィー、再結晶などにより精製する。
[実施例]
【0021】
以下に、本発明の実施例を示すが、本発明はこれらに限定されるものではない。
【実施例1】
【0022】
【化8】

窒素雰囲気下、アセタール(96mg)の無水塩化メチレン溶液(0.1モル濃度)に0℃で2,6-ルチジン(0.11mL、3.0当量)とTESOTf(0.14mL, 2.0当量)を滴下し、撹拌した。1時間後、原料の消失を薄層クロマトグラフィーで確認し、水を加えて0.5時間撹拌した。反応混合物を塩化メチレンで抽出し、有機層をNa2SO4で乾燥し、減圧濃縮した。粗生成物をシリカゲルフラッシュカラムクロマトグラフィー(ヘキサン:エーテル=7:1)で精製しアルデヒド(65mg, 収率79%)を得た。
colorless oil;IR(KBr): 1724cm-1;1H NMR(300MHz, CDCl3)δ:9.77(t,J=1.8 Hz, 1H),3.94-3.92(doublet like, 4H),2.44-2.39(m, 2H),1.65-1.60(m, 2H),1.31(s, 3H),1.42-1.28(m, 16H); 13C NMR (75 MHz, CDCl3)δ:21.83, 23.45, 23.84, 28.90, 29.07, 29.23, 29.22, 29.30, 29.59, 38.93, 43.66, 64.34, 109.96, 202.72.
【実施例2】
【0023】
【化9】

窒素雰囲気下、アセタール(101mg)の無水塩化メチレン溶液(3.75mL)に0℃で2,6-ルチジン(0.225mL、6.0当量)とTESOTf(0.29mL, 4.0当量)を加え、0℃で5分間撹拌した。水を加えて塩化メチレンで抽出し、有機層を飽和食塩水で洗浄後、Na2SO4で乾燥した。溶媒を減圧濃縮し、粗生成物をシリカゲルフラッシュカラムクロマトグラフィー(ヘキサン:酢酸エチル=25:1)で精製しアルデヒド(101mg, 収率82%)を得た。
colorless oil;IR(KBr): 1720cm-1;1H NMR(300MHz, CDCl3)δ:9.82(dd,J=2.7, 3.2 Hz, 1H), 5.76(dt, J=3.6, 10.0 Hz, 1H),5.57(dt, J=1.8, 10.0 Hz, 1H),3.89(dd, J=2.0, 14.5 Hz, 1H),2.63(dd, J=3.2, 15.9 Hz, 1H), 2.31(dd, J=2.7, 15.9 Hz, 1H), 2.30-2.19(m, 2H), 1.82-1.92(m, 1H), 1.54-1.64(m, 1H), 0.85-1.07(m, 18H), 0.94(t, J= 7.8 Hz, 6H), 0.88(s, 9H), 0.62(q, J=7.8 Hz, 6H), 0.08(s, 6H); 13C NMR (75 MHz, CDCl3)δ:-4.0, 7.2, 18.0, 23.1, 25.9, 28.2, 51.4, 75.8, 129.5, 130.9, 202.6.
【0024】
以下、本発明の脱保護法に関するその他の実施例について簡単に説明する。なお、これらの実施例は以下の基本操作法に従って実施した。
【0025】
基本操作法:窒素雰囲気下、アセタールの無水塩化メチレン溶液(0.1モル濃度)に0℃で2,6-ルチジン(反応部位がアセタールのみの場合は3.0当量、分子内にアセタールと水酸基がある場合は4.0当量)とTMSOTf又はTESOTf(反応部位がアセタールのみの場合は2.0当量、分子内にアセタールと水酸基がある場合には3.0当量)を加え、撹拌した。原料の消失を薄層クロマトグラフィーで確認し、水を加えて塩化メチレンで抽出し、有機層をNa2SO4で乾燥、減圧濃縮した。粗生成物をシリカゲルフラッシュカラムクロマトグラフィーで精製し、生成物を得た。
【実施例3】
【0026】
種々のアルデヒド由来のアセタール基を含む化合物及びケトン由来のアセタール基を含む化合物に対して、本発明の脱保護法を適用した例を図1に示す。アルデヒド由来のアセタール化合物(run1-6, 9-15)では殆どの場合において高い収率でアルデヒドが得られた。
一方、ケトン由来のアセタール化合物に本発明を適用した場合(run7,8)は、TESOTfを用いた場合(run8)に殆ど脱保護が起こっておらず、本発明の脱保護法が高い選択性を持つことが分かる。但し、TMSOTfを用いた場合(run7)には、ケトン由来のアセタール基の脱保護化が見られた。
【実施例4】
【0027】
同一分子内に水酸基とアルデヒド由来のアセタール基を含む化合物に対して、本発明の脱保護法を適用した例を図2に示す。その結果、第1アルコール型(run 1,2)、第2アルコール型(run 3)、第3アルコール型(run 4)、及びステロイド型(run 5)のいずれのアセタール化合物においても、アセタール基が脱保護されると共に水酸基がシリル化された生成物が高い収率で得られた。
【実施例5】
【0028】
本発明の脱保護法の高い選択性を証明するため、アルデヒド由来のアセタール基を含む化合物とケトン由来のアセタール基を含む化合物の混合物、及び同一分子内にアルデヒド由来のアセタール基とケトン由来のアセタール基を併せ持つ化合物に対して本発明の脱保護法を適用した。その結果、図3に示すように、どちらの場合においても、アルデヒド由来のアセタールのみが選択的に脱保護され、ケトン由来のアセタールはそのまま残っていた。
一方、同一分子内にアルデヒド由来のアセタール基とケトン由来のアセタール基を併せ持つ化合物に対して、従来の代表的なアセタールの脱保護法であるp-TsOH処理又はTMSI処理を施した場合(run 2,3)には、このような選択性は見られなかった。
【実施例6】
【0029】
更に、図4に示すように、同一分子内にアルデヒド由来のアセタール基とケトン由来のアセタール基を併せ持つ種々の化合物に対して、本発明の脱保護法を適用したところ、いずれの場合もアルデヒド由来のアセタール基の選択的な脱保護が見られた。また、同一分子内のアセチル基やメトキシル基などはそのまま残っており、本発明における脱保護反応が緩和な反応であることが分かる。
【実施例7】
【0030】
アセタール化合物の代わりに、アセタール型アルコール保護基を含む化合物に対して本発明の脱保護法を適用したところ、図5に示すように、MOMエーテル、THPエーテル、アセトニドのいずれの保護基も脱保護されると共に、シリルエーテル化された生成物が得られた。
【比較例1】
【0031】
種々のシリル化試薬を用いてアルデヒド由来アセタールの脱保護を試みた。その結果、図6に示すように、TMSOTf又はTESOTf以外ではアルデヒド由来アセタールの脱保護化は見られなかった(図中の“n.r.”は“反応なし(no reaction)”を意味する)。
【比較例2】
【0032】
種々の有機塩基を用いてアルデヒド由来のアセタールの脱保護を試みた結果を図7(a)に示す。その結果、2,6-ルチジン、トリエチルアミン(Et3N)の順に効果が高いことが分かった。更に、図7(b)に示すように有機塩基として2,6-ルチジンを用いた場合と、コリジンを用いた場合とで比較を行ったところ、コリジンを用いた場合の方が、より高収率でアルデヒド由来のアセタールが脱保護された生成物が得られた。
【図面の簡単な説明】
【0033】
【図1】本発明の実施例3における反応条件及び結果を示す表。
【図2】本発明の実施例4における反応条件及び結果を示す表。
【図3】本発明の実施例5における反応条件及び結果を示す表。
【図4】本発明の実施例6における反応条件及び結果を示す表。
【図5】本発明の実施例7における反応条件及び結果を示す図。
【図6】本発明の比較例1における反応条件及び結果を示す表。
【図7】本発明の比較例2における(a)種々の有機塩基を用いた場合の反応条件及び結果を示す表、(b)2,6-ルチジン及びコリジンを用いた場合の反応条件及び結果を示す図。
【特許請求の範囲】
【請求項1】
アセタール基を含む化合物に対し、有機塩基、及びトリフルオロメタンスルホン酸トリメチルシリル又はトリフルオロメタンスルホン酸トリエチルシリルを加えて反応させることにより、該アセタール基をカルボニル基に変換することを特徴とするアセタールの脱保護法。
【請求項2】
一分子中に水酸基及びアセタール基を含む化合物、又は水酸基を含む化合物とアセタール基を含む化合物の混合物に対し、上記脱保護法を適用することにより、該アセタール基をカルボニル基に変換すると共に、該水酸基をシリル化することを特徴とする請求項1に記載のアセタールの脱保護法。
【請求項3】
上記アセタール基がアルデヒド由来のアセタール基であることを特徴とする請求項1又は2に記載のアセタールの脱保護法。
【請求項4】
アセタール型アルコール保護基を含む化合物に対し、有機塩基、及びトリフルオロメタンスルホン酸トリメチルシリル又はトリフルオロメタンスルホン酸トリエチルシリルを加えて反応させることにより、該アセタール型アルコール保護基を脱保護すると共に、それによって生じた水酸基をシリル化することを特徴とするアセタール型アルコール保護基の脱保護法。
【請求項5】
一分子中に水酸基及びアセタール型アルコール保護基を含む化合物、又は水酸基を含む化合物とアセタール型アルコール保護基を含む化合物の混合物に対し、上記脱保護法を適用することにより、該水酸基をシリル化すると共に、該アセタール型アルコール保護基を脱保護し、それによって生じた水酸基をシリル化することを特徴とする請求項4に記載のアセタール型アルコール保護基の脱保護法。
【請求項6】
上記有機塩基として、コリジン, 2,6-ルチジン, 又はトリエチルアミンを用いることを特徴とする請求項1〜5のいずれかに記載の脱保護法。
【請求項1】
アセタール基を含む化合物に対し、有機塩基、及びトリフルオロメタンスルホン酸トリメチルシリル又はトリフルオロメタンスルホン酸トリエチルシリルを加えて反応させることにより、該アセタール基をカルボニル基に変換することを特徴とするアセタールの脱保護法。
【請求項2】
一分子中に水酸基及びアセタール基を含む化合物、又は水酸基を含む化合物とアセタール基を含む化合物の混合物に対し、上記脱保護法を適用することにより、該アセタール基をカルボニル基に変換すると共に、該水酸基をシリル化することを特徴とする請求項1に記載のアセタールの脱保護法。
【請求項3】
上記アセタール基がアルデヒド由来のアセタール基であることを特徴とする請求項1又は2に記載のアセタールの脱保護法。
【請求項4】
アセタール型アルコール保護基を含む化合物に対し、有機塩基、及びトリフルオロメタンスルホン酸トリメチルシリル又はトリフルオロメタンスルホン酸トリエチルシリルを加えて反応させることにより、該アセタール型アルコール保護基を脱保護すると共に、それによって生じた水酸基をシリル化することを特徴とするアセタール型アルコール保護基の脱保護法。
【請求項5】
一分子中に水酸基及びアセタール型アルコール保護基を含む化合物、又は水酸基を含む化合物とアセタール型アルコール保護基を含む化合物の混合物に対し、上記脱保護法を適用することにより、該水酸基をシリル化すると共に、該アセタール型アルコール保護基を脱保護し、それによって生じた水酸基をシリル化することを特徴とする請求項4に記載のアセタール型アルコール保護基の脱保護法。
【請求項6】
上記有機塩基として、コリジン, 2,6-ルチジン, 又はトリエチルアミンを用いることを特徴とする請求項1〜5のいずれかに記載の脱保護法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2006−16351(P2006−16351A)
【公開日】平成18年1月19日(2006.1.19)
【国際特許分類】
【出願番号】特願2004−196870(P2004−196870)
【出願日】平成16年7月2日(2004.7.2)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 日本薬学会第124年会Webページ、2004年2月1日http://nenkai.pharm.or.jp/124/pc/ipdfview.asp?i=2798
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【出願人】(599063583)株式会社ケミカルソフト開発研究所 (4)
【Fターム(参考)】
【公開日】平成18年1月19日(2006.1.19)
【国際特許分類】
【出願日】平成16年7月2日(2004.7.2)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 日本薬学会第124年会Webページ、2004年2月1日http://nenkai.pharm.or.jp/124/pc/ipdfview.asp?i=2798
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【出願人】(599063583)株式会社ケミカルソフト開発研究所 (4)
【Fターム(参考)】
[ Back to top ]

