ジアセチレン誘導体
【課題】それ自体で液晶性を示し大きな屈折率異方性を有する化合物、これらを用いた液晶性組成物を提供し、さらに優れた性能を有する液晶素子を提供する。
【解決手段】下記の一般式(A)で示されるジアセチレン誘導体。R1-Sp1-(Ar1)p-(Ar3)q-(Phe)r-C≡C-C≡C-(Phe)r-(Ar4)q-(Ar2)p-Sp2-R2(A)(式中、R1およびR2は、水素原子、ハロゲン原子、シアノ基、イソチオシアネート基、アルキル基、アルケニル基、アルキニル基、または反応性基を表し、SP1およびSP2はスペーサー基を表し、Ar1およびAr2は、非置換または置換の芳香族の炭素環式または複素環式基であり、Ar3およびAr4は、非置換または置換の複素環式基であり、Pheは、非置換または置換1,4−フェニレン基を表し、p、qおよびrは、それぞれ0または1である。)
【解決手段】下記の一般式(A)で示されるジアセチレン誘導体。R1-Sp1-(Ar1)p-(Ar3)q-(Phe)r-C≡C-C≡C-(Phe)r-(Ar4)q-(Ar2)p-Sp2-R2(A)(式中、R1およびR2は、水素原子、ハロゲン原子、シアノ基、イソチオシアネート基、アルキル基、アルケニル基、アルキニル基、または反応性基を表し、SP1およびSP2はスペーサー基を表し、Ar1およびAr2は、非置換または置換の芳香族の炭素環式または複素環式基であり、Ar3およびAr4は、非置換または置換の複素環式基であり、Pheは、非置換または置換1,4−フェニレン基を表し、p、qおよびrは、それぞれ0または1である。)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規なジアセチレン骨格構造を有する化合物、それを含む液晶性組成物に関する。また液晶表示素子の構成材料や大きい屈折率異方性を利用した光学および電子光学的デバイス等の用途に関する。
【背景技術】
【0002】
近年、液晶表示素子の高性能化は、情報化社会の進展に伴い不可欠となっている。液晶組成物の物性の中で、より高速化、あるいは高性能化のためには、屈折率異方性の大きい材料が必要とされている。
屈折率異方性の大きい材料として、シッフ塩基やピリミジンの構造を有する化合物(非特許文献1)、トラン系化合物(特許文献1、2)やジアセチレン系化合物(非特許文献2,特許文献3,4,5,6)が知られている。しかし前記の特許文献はいずれも(ジ)アセチレン骨格の両端に、アルキル基やアルコキシ基を結合したフェニレン基やナフチレン基が結合された化合物であり、大きい屈折率異方性を利用して液晶表示素子の応答性能を向上するための液晶部材として使用することが述べられている。しかしながら、十分大きな屈折率異方性を有すると記載しているが当該屈折率異方性の値は示されてなく、また熱や光に対する安定性も不明である。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特表平01−502831号公報
【特許文献2】特開平06−239786号公報
【特許文献3】特開平11−001445号公報
【特許文献4】特開平06−211704号公報
【特許文献5】米国特許 第5338481号公報
【特許文献6】特表2004−518608号公報
【非特許文献】
【0004】
【非特許文献1】松本 正一、角田市良,「液晶の基礎と応用」,初版第3刷,株式会社工業調査会発行,1996年11月15日,p.123
【非特許文献2】B. Grant, Mol. Cryst. Liq. Cryst., 1978, vol. 48, 175−182
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は上記の問題を解決し、それ自体で液晶性を示し大きな屈折率異方性を有する化合物、または単体では液晶性を示さないが液晶化合物に添加すると大きな屈折率異方性を発現する化合物やこれらを用いた液晶性組成物を提供することを目的とし、さらに優れた性能を有する光学および電子光学的デバイスを提供することを目的とする。
【課題を解決するための手段】
【0006】
上記の課題を解決するため、本発明者らは鋭意検討を加えた結果、ジアセチレン(1,3−ブタジイン)骨格を有する新規なジアセチレン化合物が上記の課題を解決できることを見出し、本発明を完成するに至った。
すなわち、本発明は以下の通りである。
【0007】
〔1〕下記の一般式(A)で表されるジアセチレン誘導体。
R1-Sp1-(Ar1)p-(Ar3)q-(Phe)r-C≡C-C≡C-(Phe)r-(Ar4)q-(Ar2)p-Sp2-R2 (A)
(式中、R1およびR2は、互いに独立して、水素原子、ハロゲン原子、シアノ基、イソチオシアネート基、あるいは炭素原子1ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基若しくは反応性基により一置換若しくは多置換されたアルキル基、炭素原子2ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基若しくは反応性基により一置換若しくは多置換されたアルケニル基若しくはアルキニル基、または反応性基を表わし、ここで1個以上の非隣接−CH2−基は−O−、−CO−、−COO−および/または−OCO−により置換されていてもよく、Sp1およびSp2は互いに独立して、−O−、−S−、−CO−、−COO−、−OCO−、−OCO−O−、−CO−NR3−、−NR3−CO−、−O(CH2)n−、−(CH2)nO−、−CH=CH−COO−、−OCO−CH=CH−、−(CH2)m−、−(SiR4R5−O)n−または単結合であり、ここでmおよびnは独立して1〜10の整数を表し、R3、R4およびR5は水素原子または炭素数1〜4のアルキル基を表し、Ar1およびAr2は、互いに独立して、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの芳香族の炭素環式または複素環式基であり、縮合環を含んでいてもよく、Ar3およびAr4は、互いに独立して、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの複素環式基であり、縮合環を含んでいてもよく、単結合で連結された複数の複素環式基でもよく、Pheは、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された1,4−フェニレン基を表し、p、qおよびrは、それぞれ0または1である。)
【0008】
〔2〕下記の一般式(1)で表される化合物であることを特徴とする前記[1]に記載のジアセチレン誘導体。
R1−Sp1−Ar1−Phe−C≡C−C≡C−Phe−Ar2−Sp2−R2 (1)
【0009】
〔3〕下記の一般式(2)で表される化合物であることを特徴とする前記[1]に記載のジアセチレン誘導体。
R1−Sp1−Ar3−C≡C−C≡C−Ar4−Sp2−R2 (2)
【0010】
〔4〕下記の一般式(3)で表される化合物であることを特徴とする前記[1]に記載のジアセチレン誘導体。
R1−Sp1−Phe−C≡C−C≡C−Phe−Sp2−R2 (3)
【0011】
〔5〕前記の反応性基が、ヒドロキシル基、カルボキシル基、酸無水物基、マレイミド基、ビニロキシ基、オキシラニル基、オキセタニル基、ビニル基、(メタ)アクリレート基、またはシリル基であることを特徴とする前記〔1〕〜〔4〕に記載のジアセチレン誘導体。
【0012】
〔6〕前記のAr1およびAr2が、フラン−2,5−ジイル基、チオフェンー2,5−ジイル基、ピロール−2,5−ジイル基、1,4−フェニレン基、ナフタレン−2,6−ジイル基、ピリジン−2,5−ジイル基、ピリミジン−2,5−ジイル基、またはインダン−2,5−ジイル基であることを特徴とする前記〔1〕または[2]に記載のジアセチレン誘導体。
【0013】
〔7〕前記のAr3およびAr4が、フラン−2,5−ジイル基、チオフェン−2,5−ジイル基、ピロール−2,5−ジイル基、ピリジン−2,5−ジイル基、またはピリミジン−2,5−ジイル基であることを特徴とする前記〔1〕または〔3〕に記載のジアセチレン誘導体。
【0014】
〔8〕前記〔1〕〜〔4〕のいずれかに記載のジアセチレン誘導体の1種又2種以上を含む液晶性組成物。
〔9〕光学用又は電気光学用として用いることを特徴とする前記〔1〕〜〔7〕のいずれかに記載のジアセチレン誘導体。
〔10〕光学用又は電気光学用として用いることを特徴とする前記〔8〕に記載の液晶性組成物。
【発明の効果】
【0015】
本発明のジアセチレン誘導体は液晶性の有無を問わず大きな屈折率異方性を発現するので、光学および電子光学的デバイス等例えば液晶表示素子を構成する材料として有用である。
【図面の簡単な説明】
【0016】
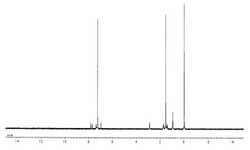
【図1】実施例1で得られたジアセチレン誘導体の1H−NMRスペクトルを示す図である。
【図2】実施例1で得られたジアセチレン誘導体と(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインとの液晶性組成物の複屈折の波長依存性を示す図である。なお、aの線は組成物の、bの線は(4−ヘキシロキシ)フェニル−1−イル)ブタ−1,3−ジインの複屈折をそれぞれ表す。
【図3】実施例2で得られたジアセチレン誘導体と(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインとの液晶性組成物の複屈折の波長依存性を示す図である。cの線は組成物の、dの線は(4−ヘキシロキシ)フェニル−1−イル)ブタ−1,3−ジインの複屈折をそれぞれ表す。
【図4】実施例3で得られたジアセチレン誘導体の1H−NMRスペクトルを示す図である。
【図5】実施例4で得られたジアセチレン誘導体の1H−NMRスペクトルを示す図である。
【図6】実施例4で得られたジアセチレン誘導体と(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインとの液晶性組成物の複屈折の波長依存性を示す図である。eの線は組成物の、fの線は(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインの複屈折をそれぞれ表す。
【図7】実施例5で得られたジアセチレン誘導体の1H−NMRスペクトルを示す図である。
【図8】実施例5で得られたジアセチレン誘導体のDSCの測定結果を示す図である。なお、gの線は昇温時の、hの線は降温時の熱挙動をそれぞれ示す。
【図9】実施例8で得られたジアセチレン誘導体と(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインとの液晶性組成物の複屈折の波長依存性を示す図である。iの線は組成物の、jの線は(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインの複屈折をそれぞれ表す。
【発明を実施するための形態】
【0017】
以下、本発明を詳細に説明する。
本発明は、下記の一般式(A)で表されるジアセチレン誘導体である。
R1-Sp1-(Ar1)p-(Ar3)q-(Phe)r-C≡C-C≡C-(Phe)r-(Ar4)q-(Ar2)p-Sp2-R2 (A)
本発明の一般式(A)で表されるジアセチレン誘導体は、ジアセチレン(1,3−ブタジイン)骨格にフェニレン基等の炭素環式基や複素環式基とスペーサー基Sp1およびSp2を介して置換基R1およびR2が結合された化合物であり、下記一般式(1)〜(3)で表わされる化合物が好ましい。
R1−Sp1−Ar1−Phe−C≡C−C≡C−Phe−Ar2−Sp2−R2 (1)
R1−Sp1−Ar3−C≡C−C≡C−Ar4−Sp2−R2 (2)
R1−Sp1−Phe−C≡C−C≡C−Phe−Sp2−R2 (3)
【0018】
1,3−ブタジイン骨格部分は、本発明の一般式(A)、(1)〜(3)の化合物の特徴である。これらの化合物は驚くほど高い化学的及び熱的安定性を持っている。一般的に、それらは高い異方性を発現し、その構造に従いネマチック液晶性および/またはスメクチック液晶性を示す。
【0019】
式(A)、(1)〜(3)において、R1、R2としてはそれぞれ独立に、水素原子、ハロゲン原子、シアノ基、イソチオシアネート基、あるいは炭素原子1ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基または反応性基により一置換若しくは多置換されたアルキル基、炭素原子2ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基または反応性基により一置換若しくは多置換されたアルケニル基若しくはアルキニル基、または反応性基を表わし、ここで1個以上の非隣接−CH2−基は−O−、−CO−、−COO−および/または−OCO−により置換されていてもよい。
【0020】
具体的には、例えば、メチル、エチル、プロピル、ブチル、ペンチル、ヘキシル、ヘプチル、オクチル、ノニル、デシル、ウンデシル、ドデシル、エテニル、プロペニル、ブテニル、ペンテニル、ヘキセニル、ヘプテニル、オクテニル、ノネニル、デセニル、ウンデセニル、ドデセニル、プロピニル、ブチニル、ペンチニル、ヘキシニル、ヘプチニル、オクチニル、ノニニル、デシニル、ドデシニル、エチニル、プロペニル、ブテニル、ペンテニル、ヘキセニル、ヘプテニル、オクテニル、ノネニル、デセニル、ウンデセニル、ドデセニル、2−メチルプロピル、2−メチルブチル、3−メチルブチル、3−メチルペンチル、2−メチルヘキシル、2−メチルデシル、2−フルオロエチル、3−フルオロプロピル、4−フルオロブチル、6−フルオロヘキシル、4,4−ジフルオロブチル、6,6−ジフルオロヘキシル、2−クロロエチル、3−クロロプロピル、4−クロロブチル、6−クロロヘキシル、ペルフルオロエチル、ペルフルオロブチル、1−シアノエチル、1−シアノブチル、2−シアノブチル、1−トリフルオロメチルエチル、1−トリフルオロメチルブチル、メトキシ、エトキシ、ブチルオキシ、ペンチルオキシ、ヘキシルオキシ、オクチルオキシ、デシルオキシ、ドデシルオキシ、トリフルオロメトキシ、2−フルオロブチルオキシ、2−フルオロヘキシルオキシ、2−フルオロブチルオキシカルボニルやこれらの基に後述の反応性基を結合した基、水素原子、フッ素原子、トリフロロメチル基、シアノ基、イソチオシアネート基や反応性基等が挙げられる。
【0021】
式(A)、(1)におけるAr1、Ar2としては、それぞれ独立に、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの芳香族の炭素環式または複素環式基であり、縮合環を含んでいてもよい。好ましくは芳香族基または5員もしくは6員の複素環式基、あるいは2個または3個の縮合芳香族環または複素環の5員環もしくは6員環を含む基であり、これらの環は2個以上のヘテロ原子、特にN、OおよびSから選択されるヘテロ原子を含んでいてもよい。これらのすべての基は無置換、または、F、Cl、CN、OH、NO2、CH3、C2H5、OCH3、OC2H5、COCH3、COC2H5、COOCH3、COOC2H5、CF3、OCF3、OCHF2またはOC2F5により単置換もしくは多置換されることもできる。特にF、Cl、CN、CH3、C2H5、OCH3、またはOCF3が好ましい。
【0022】
Ar1およびAr2の好ましい基の例としては、例えば、フラン、ピロール、チオフェン、オキサゾール、チアゾール、チアジアゾール、イミダゾール、フェニレン、ピリジン、ピリミジン、ピラジン、インダン、ナフタレン、テトラヒドロナフタレン、アントラセンおよびフェナントレン等が挙げられる。
特に好ましいAr1およびAr2は、フラン−2,5−ジイル、チオフェン−2,5−ジイル、ピロール−2,5−ジイル、1,4−フェニレン、ピリジン−2,5−ジイル、ピリミジン−2,5−ジイル、ナフタレン−2,6−ジイル、1,2,3,4−テトラヒドロナフタレン−2,6−ジイル、インダン−2,5−ジイルである。
【0023】
式(A)、(1)および(3)におけるPheは、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された1,4−フェニレン基を表す。例えば、1,4−フェニレン、2−フルオロ−1,4−フェニレン、3−フルオロ−1,4−フェニレン、2,3−ジフルオロ−1,4−フェニレン、2−クロロ−1,4−フェニレン、2−シアノ−1,4−フェニレン、2−メチル−1,4−フェニレン、3−メチル−1,4−フェニレンなどの基を挙げることができる。
【0024】
また、式(A)、(2)におけるAr3、Ar4としては、それぞれ独立に、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの複素環式基であり、縮合環を含んでいてもよくまた単結合で連結された複数の複素環式基でもよい。好ましくは5員もしくは6員の複素環式基、あるいは複素環式基を含む2個または3個の縮合環を含む基であり、複素環式基を構成する原子は1個または2個以上のヘテロ原子、特にN、OおよびSから選択されるヘテロ原子が好ましい。これらのすべての基は無置換、または、F、Cl、CN、CH3、C2H5、OCH3、OC2H5、CF3、OCF3、OCHF2またはOC2F5により単置換もしくは多置換されることもできる。特にF、Cl、CN、CH3、C2H5、OCH3、またはOCF3が好ましい。
Ar3およびAr4の好ましい基の例としては、例えば、フラン、ピロール、チオフェン、オキサゾール、チアゾール、チアジアゾール、イミダゾール、ピリジン、ピリミジン、ピラジン等から誘導される基を挙げることができる。特に好ましいAr3およびAr4は、フラン−2,5−ジイル、チオフェン−2,5−ジイル、ピロール−2,5−ジイル、ピリジン−2,5−ジイル、ピリミジン−2,5−ジイルである。
【0025】
Sp1およびSp2はスペーサー基とも呼ばれる基であり、当業者にこの目的のために知られているすべての基を使用することができる。
Sp1およびSp2は互いに独立して、−O−、−S−、−CO−、−COO−、−OCO−、−OCO−O−、−CO−NR3−、−NR3−CO−、−O(CH2)n−、−(CH2)nO−、−CH=CH−COO−、−OCO−CH=CH−、−(CH2)m−、−(SiR4R5−O)n−または単結合であり、ここでmおよびnは独立して1〜10の整数を表し、R3、R4およびR5は水素原子または炭素数1〜4のアルキル基を表す。
好ましいスペーサー基は、例えばエチレン、プロピレン、ブチレン、ペンチレン、ヘキシレン、ヘプチレン、オクチレン、ノニレン、デシレン、ウンデシレン、ドデシレン、オクタデシレン、エチレンオキシエチレン、メチレンオキシブチレン、エチレン−N−メチル−イミノエチレン、エテニレン、プロペニレンおよびブテニレンなどが挙げられる。
【0026】
前記の反応性基とは、適宜な条件を選択することにより反応して高分子を形成することのできる基であり、ヒドロキシル基、カルボキシル基、酸無水物基、マレイミド基、ビニル基、ビニロキシ基、オキシラニル基、オキセタニル基、(メタ)アクリレート基、シリル基などが挙げられ、これらの中でも重合や縮合の容易な基が好ましく、例えば、好ましくはCH2=CW1−COO−、
【化1】

CH2=CW2−(O)k1−、CH3−CH=CH−O−、(CH2=CH)2CH−OCO−、(CH2=CH−CH2)2CH−OCO−、(CH2=CH)2CH−O−、(CH2=CH−CH2)2N−、HO−CW2W3−、HS−CW2W3−、HW2N−、HO−CW2W3−NH−、CH2=CW1−CO−NH−、CH2=CH−(COO)k1−Phe−(O)k2−、Ph−CH=CH−、HOOC−、OCN−およびW4W5W6Siから選択される。
【0027】
ここで、W1はH、Cl、CN、フェニルまたは炭素原子1〜5個を有するアルキルであり、特にH、ClまたはCH3であり、W2およびW3は相互に独立して、Hまたは炭素原子1〜5個を有するアルキルであり、特にメチル、エチルまたはn−プロピルであり、W4、W5およびW6は、相互に独立してCl、炭素原子1〜5個を有するオキサアルキルもしくはオキサカルボニルアルキルであり、Phはフェニル、Pheは1,4−フェニレンであり、ならびにkは0,1または2であり、k1およびk2は相互に独立して0または1である。殊に好ましい基は、ビニル基、(メタ)アクリレート基、オキシラニル基またはオキセタニル基であり、最も好ましくは(メタ)アクリレート基である。
【0028】
次に、式(1)〜(3)で表されるジアセチレン誘導体の合成方法について説明する。
式(1)〜(3)で表される化合物は、それ自体公知の非常に簡単な方法で製造することができる。例えば有機化学の標準的学術書であるHouben-Weyl, “ Methoden der Organischen Chemie ”, Thime-Verlag, Stuttgartなどに記載されている方法またはそれと類似の方法により合成することができる。より具体的には、例えばL.Brandsma,“ Preparative Acetylenic Chemistry ”2nd Ed. Elsevier, Amsterdam NL, (1988) や Cadiot-Chodkiewicz(G.Eglinton,W.Mc Grae in Raphael, Taylor and Wynberg(eds) “ Advances in Organic Chemistry ”, Vol.4, Interscience publishers, N.Y. (1963) に記載されたように、銅錯体の存在下に末端アルキンをハロアルキン誘導体とカップリングさせることにより製造することができる。
【0029】
それぞれカップリングの相手として必要な末端アルキン類及びハロアルキン類は、公知であるか、又は公知化合物と類似であり、それ自体公知の方法により製造することができる。例えば、アルデヒドはCBr4/PPh3を用いるウィッティヒ反応、続く脱離反応により必要なアルキンに変換することができる。必要ならば、それらのアルキンはそれ自体公知の方法、金属化、続いてハロゲン化により相当するハロアルケンから変換することができる。R1またはR2がキラルである場合には、本発明の誘導体はキラルな添加物(dopant)として用いることができる。
反応性基を導入する場合は、反応性基を結合した化合物とジアセチレン基を有する化合物との反応や反応性基を結合したアセチレン化合物と他のアセチレン化合物とのカップリングなど、目的とするジアセチレン基を有する化合物の合成に支障のないように行えばよい。
【0030】
かくして得られる本発明のジアセチレン誘導体は、単独では液晶性を示さない場合もあるが、液晶性を示す場合は当該誘導体に導入された基や全体の構造により液晶相挙動(相転移温度)や屈折率異方性(複屈折)が異なるが、等方相転移温度(Ti℃)より10℃低い液晶相温度で測定した複屈折Δn(550nmで測定)は好ましくは0.25以上、特に0.30以上を示すことが好ましい。
【0031】
本発明の液晶性組成物は、本発明の式(1)〜(3)で表されるジアセチレン誘導体を少なくとも1種含有する液晶性組成物である。組成物を構成する他の成分は異なる式(1)〜(3)の化合物同士であってもよく特に限定されるものではないが、液晶相を示す化合物が好ましい。
式(1)〜(3)の化合物は組成物の光学異方性に大きく貢献している。式(1)〜(3)の化合物の混合割合は液晶性組成物に要求される性能に合わせて広い範囲で変えることができ、一概に決定はできないが、通常は0.1〜100質量%、好ましくは1〜80質量%である。
【0032】
本発明の液晶性組成物は前述のように本発明のジアセチレン誘導体を少なくとも1種含有する組成物であり、組成物を構成する他の成分はネマチック液晶相を示すものが好ましい。
本発明の式(1)〜(3)で表されるジアセチレン誘導体は他の液晶化合物との混和性が良好であり、液晶セルに要求される性能に応じて適宜混合してその性能を改良することができる。
【0033】
前記の組成物を構成する他の成分としてはネマチック相を示す化合物が好ましく、例えば、アゾキシベンゼン類、ベンジリデン−アニリン類、ビフェニル類、ターフェニル類、安息香酸フェニルまたはシクロヘキシル類、シクロヘキサンカルボン酸のフェニルエステルまたはシクロヘキシルエステル類、シクロヘキシル安息香酸のフェニルエステルまたはシクロヘキシルエステル類、シクロヘキシルシクロヘキサンカルボン酸のフェニルエステルまたはシクロヘキシルエステル類、安息香酸の、シクロヘキサンカルボン酸のおよびシクロヘキシルシクロヘキサンカルボン酸のシクロヘキシルフェニルエステル類、フェニルシクロヘキサン類、シクロヘキシルビフェニル類、フェニルシクロヘキシルシクロヘキサン類、シクロヘキシルシクロヘキサン類、シクロヘキシルシクロヘキセン類、シクロヘキシルシクロヘキシルシクロヘキセン類、1,4−ビス−シクロヘキシルベンゼン類、4,4’−ビス−シクロヘキシルビフェニル類、フェニル−またはシクロヘキシルピリミジン類、フェニル−またはシクロヘキシルピリジン類、フェニル−またはシクロヘキシルピリダジン類、フェニル−またはシクロヘキシルジオキサン類、フェニル−またはシクロヘキシル−1,3−ジチアン類、1,2−ジフェニル−エタン類、1,2−ジシクロヘキシルエタン類、1−フェニル−2−シクロヘキシルエタン類、1−シクロヘキシル−2−(4−フェニルシクロヘキシル)−エタン類、1−シクロヘキシル−2−ビフェニル−エタン類、1−フェニル−2−シクロヘキシル−フェニルエタン類や、ハロゲン化スチルベン類、ベンジルフェニルエーテル、トラン類等やこれらの混合物を挙げることができる。
【0034】
本発明の式(1)〜(3)で表される化合物および/または液晶性組成物は、光学又は電気光学用として用いることができる。たとえば、TNまたはSTNディスプレイ、IPS(インプレーンスイッチング)ディスプレイまたはVAN(垂直配向ネマティック)もしくはVAC(垂直配向コレステリック)などのVA(垂直配向)モード、ECB(電気制御複屈折率)ディスプレイ、DAP(配列相変形)、CSH(カラースーパーホメオトロピック)またはASM(軸対称ミクロセル)モード、相変化、ゲスト−ホスト、フレキソエレクトリック、強誘電性ディスプレイ、双安定(bistable)ネマチックおよびPSCT(ポリマー安定化コレステリック組織)などのコレステリックディスプレイ、またはPDLC、ポリマーゲルまたはポリマーネットワークディスプレイなどのディスプレイ用の液晶混合物に使用することができる。
液晶性組成物及び電気−光学装置(液晶表示素子)の製造は、それ自体公知の方法で行なうことができる。
【実施例】
【0035】
以下に実施例および比較例を挙げ、本発明を具体的に説明するが本発明はこれらの例に制限されるものではない。実施例および比較例で用いた各種測定法等を説明する。
【0036】
1.複屈折の測定
下記の機器を用いて測定した。
偏光顕微鏡: ECLIPSE LV 100 POL、(株)ニコン製)
光ファイバー: BIF600-VIS-NIR、Ocean optics, Inc. 製
分光器: USB4000、Ocean optics, Inc. 製
評価用液晶セル:KSRP-03/B311P1NSS05、(株)イーエッチシー製)
測定温度は等方相転移温度より10℃低い液晶相温度で、波長400〜1000nmの範囲でスペクトルを測定し、下記にしたがって求めた。
【0037】
(1)セルギャップの測定
液晶を封入しない状態でセルの下から光を当て、透過干渉光を測定することにより、空気層の厚さを求め((1)式)、その空気層の厚さをセルギャップとする。
2d=mλ (1)
【0038】
(2)顕微分光分析
上記(1)で求めたセルギャップがdのセルに液晶を封入しホモジニアス配向させて作成した複屈折体を、偏光軸が互いに直交する2枚の偏光子の間に挟持して測定される分光透過率が最大または最小となる波長の値((2)式)と、各波長における複屈折体のリタデーション((3)式)を、4次まで展開したコーシーの分散式((4)式)でフィッテングを行い、複屈折体の複屈折率ΔnおよびリタデーションRの波長分散を決定した。
【0039】
【数1】

【0040】
2.DSCの測定
Perkin−Elmer社製 DSC7を用い、窒素雰囲気下で昇降温速度10℃/minで測定した。
【0041】
3.偏光顕微鏡観察(液晶相挙動の判定)
温度調節装置Mettler社製FP90セントラルプロセッサーを付したMettler社製FP82ホットステージを具備したOlympus社製偏光顕微鏡(型式BX50)により、液晶の相挙動をDSCの測定結果と合わせて調べた。
Crは結晶相を、Sはスメクチック相を、Nはネマチック相を、そしてIsoは等方相を示す。
【0042】
4.NMRスペクトルの測定
テトラメチルシラン(TMS)を内標として重水素化クルロホルム、重水素化ジメチルホルムアミドまたは重水素化ジメチルスルホキシド溶媒に試料を溶解してNMR装置(JEOL LNM−EX400)により1Hおよび/または13C−NMRスペクトルを測定した。
【0043】
5.その他、必要に応じて以下の機器を用いた。
FT−IR: JASCO FT-IR 460 plus spectrometer
UV−visスペクトル: Beckman Coutler DU800 UV-vis Spectrometer
高分解能マス スペクトル:JEOL JMS700 mass spectrometer
【0044】
[実施例1(1,4−ビス(4−ブチルベンゾ[b]チオフェニル−5−イル)ブタ−1,3−ジインの合成)]
【化2】

【0045】
(略号)
n-BuLi n-ブチルリチウム
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DIPEA ジイソプロピルエチルアミン
MeOH メタノール
Ph フェニル基
TBAF テトラブチルアンモニウム フルオライド
THF テトラヒドロフラン
TIPS トリイソプロピルシリル基
TMEDA N,N,N’,N’-テトラメチルエチレンジアミン
【0046】
(1)1−ブロモ−4−(2,2−ジメトキシエチル−スルファニル)ベンゼンの合成
4−ブロモベンゼンチオール(3.0g,15.8mmol)の乾燥THF(20ml)溶液にNaH(1.2g,20.5mmol,60% in mineral oil)を加え、室温で10分間反応させた。ついで、ブロモアセトアルデヒドジメチルアセタール(2.8mL,23.7mmol)を加え、還流下、2日間反応させた。
溶媒を除去し残存物をジエチルエーテルで抽出し、水洗、MgSO4で乾燥した後、エーテルを留去した。エーテル留去後の残存物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理して目的物を得た(4.9g,収率:99%)。
<スペクトルデータ>
1H-NMR (CDCl3, ppm): δ 7.40 (d, J = 8.28 Hz, 2H), 7.25 (d, J = 8.52 Hz, 2H), 4.51 (t, J = 5.5 Hz, 1H), 3.36 (s, 6H), 3.09 (d, J = 5.6 Hz, 2H) .
【0047】
(2)5−ブロモベンゾ[b]チオフェンの合成
ポリリン酸(5.0g)およびクロロベンゼン(100mL)の混合物を3h還流下で処理し、ついで1−ブロモ−4−(2,2−ジメトキシエチル−スルファニル)ベンゼン(2.50g,9.00mmol)を加えた。反応混合物を180℃で2日間攪拌した。
溶媒を留去し、残存物をジエチルエーテルで抽出し、有機層を炭酸水素ナトリウム水溶液で洗浄し、MgSO4で乾燥した後エーテルを留去し、残存物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(1.15g,収率:60%)。
<スペクトルデータ>
1H-NMR (CDCl3, ppm) δ 7.97 (d, J = 1.72 Hz, 1H), 7.74 (d, J = 8.56 Hz, 1H), 7.48 (d, J = 5.4 Hz, 1H), 7.44 (dd, J1 = 8.52 and 1.96 Hz, 1H), 7.28 (s, 1H).
【0048】
(3)5−(2−トリイソプロピルシリル)ベンゾ[b]チオフェンの合成(Sonogashira カップリング)
5−ブロモベンゾ[b]チオフェン(1.1g,5.3mmol),トリイソプロピルシリルアセチレン(2.2ml,9.6mmol),N−ジイソプロピルエチルアミン(10ml),THF(20ml),Pd(PPh3)4(0.31g,0.27mmol),CuI(51mg,0.27mmol)およびPPh3 70mg,0.27mmol)を用いてSonogashiraカップリング反応を行った。
生成物を常法に従って処理し目的物を得た(1.3g,収率:78%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm):δ 7.96 (d, J = 0.96 Hz, 1H), 7.80 (d, J = 8.56 Hz, 1H), 7.89-7.42 (m, J = 9.52 Hz, 1H),7.30 (dd, J = 9.4 and 0.72 Hz, 1H), 1.15 (s, 21H).
【0049】
(4)2−ブチル−5−(2−トリイソプロピルシリル)ベンゾ[b]チオフェンの合成
−78℃に冷却した5−(2−トリイソプロピルシリル)ベンゾ[b]チオフェン(0.50g,1.6mmol)/THF(30mL)溶液にn−BuLi(0.73mL,2.6M/L,1.9mmol)/n−hexane溶液を滴下した。同温度で1h反応させ、ついで1−ヨードブタン(0.27ml,1.9mmol)を加えた後、混合物をゆっくりと室温まで昇温し続けて14h攪拌した。水を添加した混合物をジエチルエーテルで抽出し、有機層をMgSO4で乾燥してから濃縮した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し目的物を得た(0.48g,収率:81%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.78 (s, 1H), 7.68-7.66 (m, 1H), 7.35 (dd, J = 8.32 and 1.48 Hz, 1H), 6.94 (s, 1H) 2.89 (t, J = 6.66 Hz, 2H), 1.46-1.37 (m, 2H), 1.15 (s, 21H), 0.95 (t, J = 7.32 Hz, 3H).
【0050】
(5)2−ブチル−5−エチニルベンゾ[b]チオフェンの合成
2−ブチル−5−(2−トリイソプロピルシリル)ベンゾ[b]チオフェン(0.44g,1.2mmol),テトラブチルアンモニウムフルオライド(2.2ml,2.2mmol)およびTHF(30ml)の混合物を室温で30分攪拌した後、減圧下に溶媒を除去した。得られた残存物をジエチルエーテルで抽出し、水洗後MgSO4で乾燥してからエーテルを留去した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し、目的物を得た(0.27g,収率:99%)。
【0051】
(6)1,4−ビス(4−ブチルベンゾ[b]チオフェニル−5−イル)ブタ−1,3−ジインの合成
2−ブチル−5−エチニルベンゾ[b]チオフェン(0.27g,1.2mmol), DBU(0.19ml,1.2mmol),TMEDA(0.019ml,0.12mmol),CuCl(12mg,0.019mmol) およびアセトニトリル(20ml)を用いてGlaserカップリング反応を行った後、常法により処理し目的物を得た。1H−MRスペクトルを図1に示す。
【0052】
(7)液晶性組成物の調製
上記で得られた1,4−ビス(4−ブチルベンゾ[b]チオフェニル−5−イル)ブタ−1,3−ジイン50質量%と1,4−ビス(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジイン50質量%とからなる液晶性組成物を調製し、複屈折を測定した。結果を図2に示す。
なお、1,4−ビス(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジイン単独の液晶相挙動は次のようであった。
Cr 115.3℃ N 147.5℃ Iso
【0053】
[実施例2(1,4−ビス(5−ヘキシル−チエノ[3,2−b]チオフェニル−2−イル)ブタ−1,3−ジインの合成)]
【化3】

【0054】
(略号)
n-BuLi n-ブチルリチウム
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DIPEA ジイソプロピルエチルアミン
DMF ジメチルホルムアミド
MeOH メタノール
NBS N-ブロモコハク酸イミド
Ph フェニル基
TBAF テトラブチルアンモニウム フルオライド
THF テトラヒドロフラン
TMEDA N,N,N’,N’-テトラメチルエチレンジアミン
TMS トリメチルシリル基
【0055】
(1)2−ヘキシル−チエノ[3,2−b]チオフェンの合成
チエノ[3,2−]チオフェン(0.90g,6.40mmol)/THF(30mL)溶液に−78℃でn−BuLi(2.58ml,2.6M/L,6.72mmol)/n−ヘキサン溶液を滴下し、1h反応させた後、1−ブロモヘキサン(1.07ml,7.68mmol)を同温度で加えた。混合物をゆっくりと室温に戻し、さらに2h反応させた。混合物をジエチルエーテルで抽出し、エーテル層を水洗、MgSO4で乾燥してから溶媒を減圧下に除去した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.80g,収率:56%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.26 (d, J = 5.12 Hz, 1H), 7.18 (d, J = 5.12 Hz, 1H), 6.95 (s, 1H), 2.87 (t, J = 7.70 Hz, 2H), 1.71 (quin, J = 7.57 Hz, 2H), 1.43-1.27 (m, 6H), 0.89 (t, J = 7.08 Hz, 3H).
【0056】
(2)2−ブロモ−5−ヘキシル−チエノ[3,2−b]チオフェンの合成
遮光下に0℃で、2−ヘキシル−チエノ[3,2−b]チオフェン(0.80g,3.56mmol)/DMF(5ml)溶液に、NBS(0.70g,3.92mmol)/DMF(20mL)溶液を滴下し、3h反応させた。反応混合物をジエチルエーテルで抽出し、有機層を水洗、MgSO4で乾燥してから溶媒を除去した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(1.03g,収率:96%)。
<スペクトルデータ>
1H NMR (400 MHz, CDCl3, ppm) δ 7.17 (s, 1H), 6.85 (s, 1H), 2.84 (t, J = 7.68 Hz, 2H), 1.69 (quin, J = 7.38 Hz, 2H), 1.43-1.24 (m, 6H), 0.89 (t, J = 6.96 Hz, 3H).
【0057】
(3)2−(2’−トリメチルシリルエチニル)−5−チエノ[3,2−b]チオフェンの合成
2−ブロモ−5−ヘキシル−チエノ[3,2−b]チオフェン(0.30g,0.99mmol),トリメチルシリルアセチレン(0.21ml,1.58mmol),N−ジイソプロピルエチルアミン(2ml),Pd(PPh3)4(57mg,0.050mmol),CuI(9.4mg,0.050mmol)およびPPh3(13mg,0.050mmol)をTHF(5ml)中でSonogashiraクロスカップリング反応を行わせた後、常法に従って処理し、目的物を得た(収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.30 (d, J = 0.72 Hz, 1H), 6.87 (d, J = 0.72 Hz, 1H), 2.87 (t, J = 7.56 Hz, 2H), 1.70 (quin, J = 7.56 Hz, 2H), 1.43-1.24 (m, 6H), 0.89 (t, J = 7.06 Hz, 3H), 0.25 (s, 9H).
【0058】
(4)2−エチニル−5−ヘキシル−チエノ[3,2−b]チオフェンの合成
2−(2’−トリメチルシリルエチニル)−5−ヘキシル−チエノ[3,2−b]チオフェン(0.33g,1.03mmol),炭酸カリウム(0.71g,5.10mmol),THF(20ml)およびMeOH(20ml)を室温で4h反応させた後、溶媒を減圧下に除去した。
残存物をジエチルエーテルで抽出し、有機層を水洗、MgSO4で乾燥してから溶媒を減圧下に除去し粗生成物を得た。シリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.20g,収率:78%)。
<スペクトルデータ>
1H NMR (400 MHz, CDCl3, ppm): δ 7.35 (s, 1H), 6.88 (s, 1H), 3.40 (s, 1H), 2.87 (t, J = 7.56 Hz, 2H), 1.70 (quin, J = 7.51 Hz, 2H), 1.44-1.27 (m, 6H), 0.89 (t, J = 7.08 Hz, 3H).
【0059】
(5)1,4−ビス(5−ヘキシル−チエノ[3,2−b]チオフェニル−2−イル)ブタ−1,3−ジインの合成
2−エチニル−5−ヘキシル−チエノ[3,2−b]チオフェン(0.19g,0.76mmol),DBU(0.11ml,0.76mmol),TMEDA(0.011ml,0.076mmol),CuCl(9.1mg,0.092mmol)をアセトニトリル(20ml)中でGlaserカップリング反応を行わせた後、常法に従って処理し目的物を得た(収率:99%)。
DSCの測定から液晶相の挙動は次のようであった。
Cr 103℃ N 175℃ Iso
【0060】
(6)液晶性組成物の調製
上記で得られた1,4−ビス(5−ヘキシル−チエノ[3,2−b]チオフェニル−2−イル)ブタ−1,3−ジイン50質量%と1,4−ビス(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジイン50質量%とからなる液晶性組成物を調製し、複屈折を測定した。結果を図3に示す。
【0061】
[実施例3(1,4−ビス(2−ヘキシロキシピリジニル−5−イル)ブタ−1,3−ジインの合成)]
【化4】

【0062】
(略号)
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DIPEA ジイソプロピルエチルアミン
MeOH メタノール
Ph フェニル基
THF テトラヒドロフラン
TMEDA N,N, N’,N’-テトラメチルエチレンジアミン
【0063】
(1)5−ブロモ−2−ヘキシロキシピリジン
2−ヒドロキシピリジン(1.0g,5.7mmol),1−ブロモヘキサン(2.8g,17mmol),炭酸カリウム(2.4g,17mmol)およびアセトニトリル(60ml)の混合物を還流下に4h反応した。
減圧下に溶媒を除去した残存物をジエチルエーテルで抽出し、有機層を水洗しMgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理し、目的物を得た(1.0g,収率:67%)。
<スペクトルデータ>
1H NMR (400 MHz, CDCl3, ppm): δ 7.37 (d, J = 2.68 Hz, 1H), 7.32 (dd, J = 9.52 and 2.68 Hz, 1H), 6.47 (d, J = 9.52 Hz, 1H), 3.88 (t, J = 7.44 Hz, 2H), 1.73 (quant, J = 7.38 Hz, 2H), 1.38-1.29 (m, 6H), 0.89 (t, J = 7.06 Hz, 3H) .
【0064】
(2)2−ヘキシロキシ−5−(2’−トリメチルシリル)エチニルピリジンの合成
5−ブロモ−2−ヘキシロキシピリジン(0.99g,3.8mmol),トリメチルシリルアセチレン(0.95ml,6.9mmol),N−ジイソプロピルエチルアミン(6.5ml),THF(10ml),Pd(PPh3)4(0.13g,0.11mmol),CuI(22mg,0.11mmol)およびPPh3(30mg,0.11 mmol)を用いて.Sonogashiraカップリング反応を行った後、常法により処理し目的物を得た(収率:96%.)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.48 (d, J = 2.44 Hz, 1H), 7.31 (dd, J = 9.26 and 2.44 Hz, 1H), 6.47 (d, J = 9.52 Hz, 1H), 3.88 (t, J = 7.44 Hz, 2H), 1.77-1.68 (m, 2H), 1.39-1.28 (m, 6H), 0.88 (t, J = 6.58 Hz, 3H).
【0065】
(3)5−エチニル−2−ヘキシルピリジンの合成
2−ヘキシロキシ−5−(2’−トリメチルシリル)エチニルピリジン(0.96g,3.5mmol),炭酸カリウム(2.4g,17.5mmol),MeOH(30ml)およびTHF(30ml)の混合物を室温で2日間攪拌した。
減圧下に溶媒を除去した残存物をジエチルエーテルで抽出し、有機層を水洗しMgSO4で乾燥した後、溶媒を除去した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理し目的物を得た(0.56g,79%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ δ 7.51 (d, J = 2.44 Hz, 1H), 7.33 (dd, J = 9.52 and 2.44 Hz, 1H), 6.50 (d, J = 9.58 Hz, 1H), 3.90 (t, J = 7.58 Hz, 2H), 3.01 (s, 1H), 1.73 (quant, J = 7.44 Hz, 2H), 1.38-1.28 (m, 6H), 0.89 (t, J = 6.96 Hz, 3H).
【0066】
(4)1,4−ビス(2−ヘキシロキシピリジニル−5−イル)ブタ−1,3−ジインの合成
5−エチニル−2−ヘキシルピリジン(0.56g,2.75mmol),DBU(0.41ml,2.75mmol),TMEDA(41μmol,6.2μml),CuCl(5.5μmol,5.4mg)およびアセトニトリル(20ml)を用いて、Glaserカップリング反応を行った後、常法に従い処理し目的物(下記)を得た。図4に1H−NMRスペクトルを示す。
【0067】
【化5】

【0068】
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.56 (d, J = 2.44, 1H), 7.33 (dd, J = 9.52 and 2.44 Hz, 1H), 6.51 (d, J = 9.44 Hz, 1H), 3.90 (t, J = 7.44 Hz, 2H), 1.73 (quant, J = 7.26 Hz, 2H), 1.38-1.26 (m, 6H), 0.89 (t, J = 6.72 Hz, 3H);
13C NMR (100MHz CDCl3) δ 161.04, 142.84, 141.14, 121.03, 100.64, 77.63, 74.31, 50.36, 31.33, 29.19, 26.22, 22.44, 13.95
【0069】
[実施例4(1,4−ビス(4−(5−ヘキシルチオフェニル)フェニル−1−イル)ブタ−1,3−ジインの合成)]
【化6】

【0070】
(略号)
n-BuLi n-ブチルリチウム
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DMF ジメチルホルムアミド
MeOH メタノール
NBS N-ブロモコハク酸イミド
Ph フェニル基
THF テトラヒドロフラン
TMEDA N,N,N‘,N’-テトラメチルエチレンジアミン
TMS トリメチルシリル基
【0071】
(1)2−ヘキシルチオフェンの合成
チオフェン(2.0g,23.8mmol)/THF(30mL)溶液に−78℃でn−BuLi(8.2mL,2.6M/L,21.0mmol)ヘキサン溶液を滴下し、同温度で1h反応させ、ついで1−ブロモヘキサン(2.95mL,21.0mmol)を滴下した。混合物をゆっくりと室温まで昇温し14h反応を行った。水を添加し、混合物をジエチルエーテルで抽出し、有機層をMgSO4で乾燥後濃縮した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し、目的物を得た(3.26g,収率:92%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.10 (dd, J = 5.12 and 1.24, 1H), 6.90 (dd, J = 5.12 and 3.4, 1H), 6.78-6.76 (m, 1H), 2.82 (t, J = 7.44, 2H), 1.71-1.62 ( m, 2H), 1.40-1.27 (m, 6H), 0.89 (t, J = 6.96, 3H).
【0072】
(2)2−ブロモ−5−ヘキシルチオフェンの合成
遮光下、0℃で、NBS(4.11g,23.1mmol)/DMF(30mL)溶液を2−ヘキシルチオフェン(3.06g,18.2mmol)/DMF(20mL)溶液に滴下し、同温度で1h反応させた。
水を添加した後、ジエチルエーテルで抽出し、有機層をMgSO4で乾燥してからエーテルを除去した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し、目的物を得た(3.97g,収率:88%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 6.84 (d, J = 3.64 Hz, 1H) ; 6.52 (d, J = 3.68 Hz, 1H), 2.73 (t, J = 7.68 Hz, 2H), 1.66-1.54 (m, 2H), 1.38-1.17 (m, 6H), 0.88 (t, J = 6.84Hz, 3H).
【0073】
(3)2−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−5−ヘキシルチオフェンの合成
2−ブロモ−5−ヘキシルチオフェン(1.6g,6.3mmol)、4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(ピナコールボラン)(1.4ml,9.5mmol)、TEA(2.6ml,19mmol)およびジオキサン(15ml)の混合物をアルゴンで脱気し、PdCl2(PPh3)2(0.22g,0.32mmol)を加えた。還流下に16h反応後、クロロホルムで抽出し、有機層をMgSO4で乾燥した。
減圧下に溶媒を除去し、粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理し、目的物を得た(0.51g,収率:93%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.47 (d, J = 3.40 Hz, 1H), 6.86 (d, J = 3.40 Hz, 1H), 2.85 (t, J = 7.56 Hz, 2H), 1.68 (quant, J = 7.44 Hz, 2H), 1.38-1.24 (m, 18H), 0.88 (t, J = 6.60 Hz, 3H).
【0074】
(4)2−(4−ブロモフェニル)−5−ヘキシルチオフェンの合成(鈴木 クロスカップリング)
脱気した2−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−5−ヘキシルチオフェン(0.50g,1.7mmol)、THF(15ml)溶液に4−ブロモヨードベンゼン(0.72g,2.5mmol)、Cs2CO3(1.1g,3.4mmol),Pd(PPh3)4 0.06g,0.05mmol)を加え、還流下に4h反応した。
反応混合物をジエチルエーテルで抽出し、有機層をMgSO4で乾燥した後、減圧下に溶媒を除去した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.51g,収率:93%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.47-7.41 (m, 4H), 7.11 (d, J = 3.64 Hz, 1H), 6.74 (d, J = 3.40 Hz, 1H), 2.81 (t, J = 7.70 Hz, 2H), 1.69 (quant, J = 7.50 Hz, 2H), 1.43-1.28 (m, 6H), 0.89 (t, J = 6.70 Hz, 3H).
【0075】
(5)2−(4−(2’−トリメチルシリル)エチニルフェニル)−5−ヘキシルチオフェンの合成(Sonogashira カップリング)
アルゴン雰囲気下でジイソプロピルエチルアミン(3ml)、トリメチルシリルアセチレン(0.38ml,2.8mmol)および2−(4−ブロモフェニル)−5−ヘキシルチオフェン(0.50g,1.54mmol)の混合物をPd(PPh3)4(89mg,77μmol),CuI(91mg,77μmol)およびPPh3(20mg,77μmol)の混合物に加えた。混合物を45℃で1日間反応させた。
反応混合物にジエチルエーテルを加え不溶塩を濾過で除去した溶液を、塩酸水溶液および水で洗浄し、有機層をMgSO4で乾燥した後、溶媒を減圧下に除去した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.35g,収率:66%)。
【0076】
(6)2−(4−エチニルフェニル)−5−ヘキシルチオフェンの合成
2−(4−(2’−トリメチルシリル)エチニルフェニル)−5−ヘキシルチオフェン(0.34g,1.0mmol),炭酸カリウム(0.71g,5.0mmol),THF(30ml)およびMeOH(30ml)混合物を室温で2日間攪拌した。溶媒を減圧下に除去し残存物をジエチルエーテルで抽出、水洗してMgSO4で乾燥した後、減圧下に濃縮した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.29g,収率:99%)。
【0077】
(7)1,4−ビス(4−(5−ヘキシルチオフェニル)フェニル−1−イル)ブタ−1,3−ジインの合成
DBU(0.06ml,0.41mmol),TMEDA(0.006ml,0.041 mmol),CuCl(0.006mmol,4.0mg)およびアセトニトリル(15ml)の混合物に酸素を5分間吹き込んだ後、2−(4−エチニルフェニル)−5−ヘキシルチオフェン(0.11g,0.41mmol)を添加して、室温で4h反応させた。
溶媒を減圧下に除き、残存物をジエチルエーテルで抽出、水洗後MgSO4で乾燥した後、溶媒を除去、粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し、再結晶して目的物(下記)を得た(73mg,66%)。
DSCの測定から、液晶相の転移挙動は、「Cr 126℃ N 200℃ Iso」であった。
【0078】
【化7】

【0079】
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.52-7.47 (m, 4H), 7.15 (d, J = 3.44 Hz, 1H), 6.74 (d, J = 3.64 Hz, 1H), 2.81 (t, J = 7.58 Hz, 2H), 1.70 (quant, J = 7.44 Hz, 2H), 1.43-1.29 (m, 6H), 0.90 (t, J = 6.96 Hz, 3H);
13C NMR (100MHz CDCl3, ppm) δ 147.04, 140.70, 135.62, 132.97, 125.31, 125.25, 123.68, 120.14, 82.16, 74.88, 31.57, 31.55, 30.33, 28.76, 22.54, 13.98
【0080】
(8)液晶性組成物の調製
上記で得られた1,4−ビス(4−(5−ヘキシルチオフェニル)フェニル−1−イル)ブタ−1,3−ジイン50質量%と1,4−ビス(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジイン50質量%とからなる液晶性組成物を調製し、複屈折を測定した。結果を図6に示す。
【0081】
[実施例5]
【化8】

【0082】
(略号)
n-BuLi n-ブチルリチウム
DIPEA ジイソプロピルエチルアミン
DMF ジメチルホルムアミド
MeOH メタノール,
MMACl メタクリロリルクロリド
Ph フェニル基
TBAF テトラブチルアンモニウム フルオライド
TBDMSCl tert-ブチルジメチルシリルクロリド
TEA トリエチルアミン
THF テトラヒドロフラン
TMS トリメチルシリル基
【0083】
(1)化合物1の合成
4−ヨードフェノール(5.5g,25.1mmol),6−ブロモ−1−ヘキサノール(5.0g,27.6mmol),炭酸カリウム(4.2g,30.1mmol)およびDMF(50ml)の混合物を還流温度で18h反応させた。減圧下に溶媒を除去し、残存物をジエチルエーテルで抽出して、水洗後MgSO4で乾燥し、ジエチルエーテルを留去した。残存物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理して化合物1を得た(8.1g,収率:99%)。
<スペクトルデータ>
1H NMR (400 MHz, CDCl3, ppm) δ 7.54 (d, J = 8.52 Hz, 2H), 6.67 (d, J = 8.56 Hz, 2H), 3.92 (t, J = 6.40 Hz, 2H), 3.67(q, J = 6.01 Hz, 2H), 1.79 (quint, J = 6.95 Hz,, 2H), 1.64-1.1.36 ( m, 6H), 1.26 (s, 1H).
【0084】
(2)化合物2の合成
アルゴンで脱気したTEA(20ml)およびトリメチルシリルアセチレン(5.5ml,40mmol)の混合物を、上記で得た化合物1(8.0g,25mmol),Pd(PPh3)4(0.58g,0.050mmol),CuI(95mg,0.050mmol)およびPPh3(0.13g,0.050mmol)の混合物に加え、45℃で2日間攪拌・反応させた。
反応混合物にジエチルエーテルを加え、不溶塩を濾過して除き塩酸水溶液、水で洗浄後、MgSO4で乾燥、ジエチルエーテルを留去し残存物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/2)処理して化合物2を得た(収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.34 (d, J = 8.32 Jz, 2H), 6.80 (d, J = 8.08 Hz, 2H), 4.12 (q, J = 7.41 Hz, 2H), 3.95 (t, J = 6.58 Hz, 2H), 1.82-1.75 (m, 2H), 1.64-1.1.39 ( m, 6H), 1.26 (s, 1H).
【0085】
(3)化合物3の合成
得られた化合物2(3.07g,14.1mmol),TBAF(16ml,16mmol)およびTHF(50ml)を15分間攪拌した後、溶媒を減圧下に除去した。残存物をジエチルエーテルで抽出し水洗、MgSO4.で乾燥してからジエチルエーテルを除去した。
残存物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理して化合物3を得た(化合物2に対する収率:68%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.41, (d, J = 8.76 Hz, 2H), 6.82 (d, J = 8.80 Hz, 2H), 3.96 (t, J = 6.52 Hz, 2H), 3.66 (t, J = 6.48 Hz, 2H), 2.99 (s, 1H), 1.80 (quint, J = 6.89 Hz, 2H), 1.64-1.35 (m, 6H), 1.29 (s, 1H)
【0086】
(4)化合物4の合成
化合物3(1.10g,5.00mmol)およびイミダゾール(0.45g,6.50mmol)をCH2Cl2(30mL)に溶解した溶液にtert−ブチル−ジメチル−シリルクロリド(0.98g,6.50mmol)を加え、室温で3h攪拌した。反応混合物をCH2Cl2で抽出し、水洗、MgSO4で乾燥後濃縮した。
粗生成物をシリカゲルを用いたフラッシュカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)で処理し化合物4を得た(収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.41, (d, J = 8.56 Hz, 2H), 6.82 (d, J = 8.76 Hz, 2H), 3.95 (t, J = 6.46 Hz, 2H), 3.61 (t, J = 6.48 Hz, 2H), 2.99 (s, 1H), 1.79 (quin, J = 6.90 Hz, 2H), 1.56-1.34 (m, 6H), 0.89 (s, 9H), 0.04 (s, 6H)
【0087】
(5)化合物5の合成
0℃で、四臭化炭素(6.6g,20mmol)をPPh3(10.5g,40mmol)を溶解したCH2Cl2溶液に加え15分間攪拌後、4−ヘキシロキシベンツアルデヒド(2.10g,10mmol)を加えた。3h後、メタノールを添加して反応を停止し、クロロホルムで抽出して有機層をチオ硫酸ナトリウム水溶液、塩化ナトリウム水溶液で洗浄しMgSO4で乾燥した。
減圧下に溶媒を留去後、シリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理して化合物5を得た(1.79g,収率:49%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.50, (d, J = 8.80 Hz, 2H), 7.40 (s, 1H), 6.88 (d, J = 7.68 Hz, 2H), 3.96 (t, J = 6.58 Hz, 2H), 1.78 (quin, J = 7.02 Hz, 2H), 1.49-1.29 (m, 6H), 0.91 (t, 3H).
【0088】
(6)化合物6の合成
化合物4(1.9g,5.7mmol)/THF(30mL)溶液を−78℃に冷却し、n−BuLi(2.2mL,2.6M,5.8mmol)を加え30分反応後、無水ZnCl2(0.79g,5.8mmol)/THF(15mL) 溶液を−78℃で加えた。15分間同温度に保った後30分以上かけて0℃に戻した。
この亜鉛を含む溶液に化合物5(2.0g,5.7mmol)を加えた溶液をPd(PPh3)4(0.33g,0.28mmol)/THF(5mL)に加えて0℃で2日間攪拌反応した。NH4Cl水溶液を添加して反応を停止し、ジエチルエーテルで抽出し、有機層をNaHCO3水溶液、飽和塩化ナトリウム水溶液で洗浄し.MgSO4で乾燥した。減圧下に濃縮し、シリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理し化合物6を得た。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.69 (d, J = 9.04, 2H), 7.41 (d, J = 8.56 Hz, 2H), 7.21 (s, 1H), 6.89 (d, J = 8.80, 2H), 6.85 (d, J = 8.76 Hz, 2H), 3.97 (q, J = 6.35 Hz, 4H), 3.62 (t, J = 6.46 Hz, 2H), 1.86-1.73 (m, 4H).
【0089】
(7)化合物7の合成
化合物6(1.60g,2.60mmol)/THF(20ml)溶液にアルゴン雰囲気下で1.0M/LのTBAF/THF溶液(4.80mL,4.80mmol)を加え、室温で1日反応させた。
有機層をクロロホルムで抽出し水洗後MgSO4で乾燥した。溶媒を除去し、シリカゲルカラムクロマトグラフィー(溶出液:クロロホルム/酢酸エチル/ヘキサン=1/1/1)処理し化合物7を得た(1.05g)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.44 (d, J = 8.80 Hz, 4H), 6.83 (d, J = 8.56 Hz, 4H),3.98-3.94 (m, 4H), 3.70-3.62 (m, 2H), 1.83-1.74 (m, 4H), 1.64-1.33 (m, 12H), 0.90 (t, J = 6.84 Hz, 3H).
【0090】
(8)化合物8の合成
化合物7(0.97g,2.30mmol)およびTEA(3.00ml,3.00mmol)/CH2Cl2(35ml)溶液にメタクリロイルクロリド(0.29ml,3.00mmol)を添加し室温で7h反応させた。
反応混合物をクロロホルムで抽出し有機層をMgSO4で乾燥した後溶媒を留去し、粗生成物をシリカゲルを用いたフラッシュカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/2)処理し化合物8(下記)を得た。1H−NMRスペクトルを図7に、DSCの測定結果を図8にそれぞれ示す。
【0091】
【化9】

【0092】
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.47-7.40 (m, 4H), 6.83 (dd, J = 9.04 and 2.44 Hz, 4H), 6.10 (s, 1H), 5.55 (s, 1H), 4.16 (t, J = 6.58 Hz, 2H), 3.98-3.94 (m, 4H), 1.94 (s, 3H), 1.82-1.67 (m, 6H), 1.53-1.31 (m, 10H), 0.91 (t, J = 6.72 Hz, 3H).
【0093】
[実施例6(1,4−ビス(5’−ヘキシル−2,2’−ビチオフェン−5−イル)ブタ−1,3−ジインの合成)]
【化10】

【0094】
(略号)
n-BuLi n-ブチルリチウム
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DIPEA ジイソプロピルエチルアミン
DMF ジメチルホルムアミド
MeOH メタノール
NBS N-ブロモコハク酸イミド
Ph フェニル基
TBAF テトラブチルアンモニウム フルオライド
THF テトラヒドロフラン
TMEDA N,N,N’,N’-テトラメチルエチレンジアミン
TMS トリメチルシリル基
【0095】
(1)5−ヘキシル−2,2’−ビチオフェンの合成
−78℃に冷却した2,2’−ビチオフェン(0.57g,3.43mmol)/THF(20ml)溶液にn−BuLi(1.30mL,2.6M/L,3.43mmol)/n−ヘキサン溶液を滴下し、同温度で1h反応させた後、1−ブロモヘキサン(0.48ml,3.43mmol)を加えてから室温までゆっくりと昇温し、12h反応させた。水を加えてからジエチルエーテルで抽出し、有機層をMgSO4で乾燥してから濃縮した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.78g,91%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.16-6.63 (m, 5H), 2.80-2.74 (m, 2H), 1.42-1.27 ( m, 6H), 0.89 (t, J = 6.34 Hz, 3H).
【0096】
(2)5−ブロモ−5’−ヘキシル−2,2’−ビチオフェンの合成
遮光下に、5−ヘキシル−2,2’−ビチオフェン(0.66g,2.63mmol)/DMF(10mL)溶液をNBS(0.56g,3.16mmol)に加え1h反応後、反応混合物を水洗し、ジエチルエーテルで抽出した。有機層をMgSO4で乾燥してから溶媒を除去した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:石油エーテル)処理し、目的とする白色固体を得た(0.46g,収率:53%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 6.93 (d, J = 3.68 Hz, 1H), 6.91 (d, J = 3.68 Hz, 1H), 6.83 (d, J = 3.68 Hz, 1H), 6.66 (d, J = 3.68 Hz, 1H), 2.77 (t, J = 7.56 Hz, 2H), 1.69-1.63 ( m, 2H), 1.41-1.26 (m, 6H), 0.89 (t, J = 6.96 Hz, 3H).
【0097】
(3)5−ヘキシル−5’−(2−トリメチルシリルエチニル)−2,2’−ビチオフェンの合成
5−ブロモ−5’−ヘキシル−2,2’−ビチオフェン(0.46g,1.39mmol),トリメチルシリルアセチレン(0.35ml,3.50mmol),N−ジイソプロピルエチルアミン(4.8ml),Pd(PPh3)4(80mg,0.070mmol),CuI(13mg,0.070mmol)およびTHF(10ml)を用いてSonogashiraクロスカップリング反応を行った後、常法に従って処理し、目的物を得た(収率:62%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.09 (d, J = 3.92 Hz, 1H), 6.98 (d, J = 3.44 Hz, 1H), 6.91 (d, J = 3.92 Hz, 1H), 6.67 (d, J = 3.64 Hz, 1H), 2.78 (t, J = 7.56 Hz, 2H), 1.67 (quin, J = 7.50 Hz, 2H), 1.42-1.27 (m, 6H), 0.89 (t, J = 6.82 Hz, 3H), 0.25 (s, 9H).
【0098】
(4)5−エチニル−5’−ヘキシル−2,2’−ビチオフェンの合成
5−ヘキシル−5’−(2−トリメチルシリルエチニル)−2,2’−ビチオフェン(0.29g,0.85mmol),炭酸カリウム(0.66g,4.78mmol),THF(30ml)およびMeOH(30ml)の混合物を3h反応させた後、溶媒を除去した。残存物をジエチルエーテルで抽出し、有機層を水洗、MgSO4で乾燥してから溶媒を除去した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し、目的物を得た(0.23g,収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.15 (d, J = 3.88 Hz, 1H), 6.99 (d, J = 3.68 Hz, 1H), 6.93 (d, J = 3.64 Hz, 1H), 6.68 (d, J = 2.92 Hz, 1H), 3.38 (s, 1H), 2.79 (t, J = 7.70 Hz, 2H), 1.67 (quant, J = 7.38 Hz, 2H), 1.41-1.27 (m, 6H), 0.89 (t, J = 6.72 Hz, 3H).
【0099】
(5)1,4−ビス(5’−ヘキシル−2,2’−ビチオフェン−5−イル)ブタ−1,3−ジインの合成
5−エチニル−5’−ヘキシル−2,2’−ビチオフェン(0.23g,0.83mmol),DBU(0.12ml,0.83mmol),TMEDA(1.87μl,1.24μmol),CuCl(1.60mg,1.66μmol)およびアセトニトリル(20ml)を用いてGlacerカップリング反応を行った後、常法に従って処理し、目的物を得た(収率:90%)。
DSCの測定から液晶相挙動は次のようであった。
Cr 111.2℃ N 147.2℃ Iso
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.21 (d, J = 3.68, 1H), 7.02 (d, J = 3.44 Hz, 1H), 6.95 (d, J = 3.92 Hz, 1H), 6.69 (d, J = 3.16 Hz, 1H), 2.79 (t, J = 7.58 Hz, 2H), 1.67 (quin, J = 7.38 Hz, 2H), 1.45-1.25 (m, 6H), 0.89 (t, J = 6.34 Hz, 3H).;
13C NMR (100MHz CDCl3, ppm) δ146.82, 141.21, 135.37, 133.70, 125.03, 124.44, 122.69, 119.56, 78.81, 77.56, 35.51(35.51), 30.19, 28.72, 22.55, 14.08.;
【0100】
[実施例7(1−(4−ヘキシロキシフェニル)−4−(4’−ヒドロキシヘキシロキシフェニル)ブタ−1,3−ジインの合成)]
【化11】

【0101】
(略号)
n-BuLi n-ブチルリチウム
DIPEA ジイソプロピルエチルアミン
DMF ジメチルホルムアミド
MeOH メタノール
Ph フェニル基
TBAF テトラブチルアンモニウム フルオライド
TBDMS tert-ブチル ジメチルシリル
TEA トリエチルアミン
THF テトラヒドロフラン
TMEDA N,N,N’,N’-テトラメチルエチレンジアミン
TMS トリメチルシリル基
【0102】
(1)化合物1の合成
1−ヨードフェノール(5.5g,25.1mmol)、6−ブロモ−1−ヘキサノール(5.0g,27.6mmol),炭酸カリウム(4.2g,30.1mmol)およびDMF(50ml)の混合物を還流下に18h反応させた。減圧下に溶媒を除去した残存物をジエチルエーテルで抽出し、有機層を水洗後MgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理して目的物の化合物1を得た(8.1g,収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.54 (d, J = 8.52 Hz, 2H), 6.67 (d, J = 8.56 Hz, 2H), 3.92 (t, J = 6.40 Hz, 2H), 3.67(q, J = 6.01 Hz, 2H), 1.79 (quint, J = 6.95 Hz,, 2H), 1.64-1.1.36 ( m, 6H), 1.26 (s, 1H).
【0103】
(2)化合物2の合成
化合物1(8.0g,25mmol),Pd(PPh3)4(0.58g,0.050mmol),CuI(95mg,0.050mmol)およびPPh3(0.13g,0.050mmol)の混合物に、アルゴン雰囲気下でTEA(20ml)およびトリメチルシリルアセチレン(5.5ml,40mmol)を加え、45℃で2日間反応させたのち、 ジエチルエーテルを加え不溶塩を濾過で除き、塩酸水溶液および水で洗浄後、MgSO4で乾燥した
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/2)処理して目的物の化合物2を得た(収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.34 (d, J = 8.32 Jz, 2H), 6.80 (d, J = 8.08 Hz, 2H), 4.12 (q, J = 7.41 Hz, 2H), 3.95 (t, J = 6.58 Hz, 2H), 1.82-1.75 (m, 2H), 1.64-1.1.39 ( m, 6H), 1.26 (s, 1H).
【0104】
(3)化合物3の合成
化合物2(3.07g,14.1mmol),TBAF(16ml,16mmol)およびTHF(50ml)の混合物を室温で15分攪拌した後、溶媒を減圧下に除去した。得られた残存物をジエチルエーテルで抽出し、有機層を水洗後MgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理し目的物の化合物3を得た(収率:68%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.41, (d, J = 8.76 Hz, 2H), 6.82 (d, J = 8.80 Hz, 2H), 3.96 (t, J = 6.52 Hz, 2H), 3.66 (t, J = 6.48 Hz, 2H), 2.99 (s, 1H), 1.80 (quint, J = 6.89 Hz, 2H), 1.64-1.35 (m, 6H), 1.29 (s, 1H).
【0105】
(4)化合物4の合成
化合物3(1.10g,5.00mmol)、イミダゾール(0.45g,6.50mmol)/CH2Cl2(30mL)溶液にtert−ブチル−ジメチルシリル−クロリド(0.98g,6.50mmol)を加え、室温で3h反応した。反応混合物をCH2Cl2で抽出し、有機層を水洗後MgSO4で乾燥してから濃縮した。
粗生成物をシリカゲルを用いたフラッシュカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理して目的物の化合物4を得た(収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.41, (d, J = 8.56 Hz, 2H), 6.82 (d, J = 8.76 Hz, 2H), 3.95 (t, J = 6.46 Hz, 2H), 3.61 (t, J = 6.48 Hz, 2H), 2.99 (s, 1H), 1.79 (quin, J = 6.90 Hz, 2H), 1.56-1.34 (m, 6H), 0.89 (s, 9H), 0.04 (s, 6H).
【0106】
(5)化合物5の合成
トリフェニルホスヒン(10.5g,40mmol)/CH2Cl2溶液に四臭化炭素(6.6g,20mmol)を0℃で加えて15分攪拌し、4−ヘキシロキシベンツアルデヒド(2.10g,10mmol)を加えて3h反応させた後、メタノールを加えて反応を停止した。反応混合物をクロロホルムで抽出し、チオ硫酸ナトリウム水溶液および塩化ナトリウム飽和水溶液で洗浄しMgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理して目的物を得た(1.79g,収率:49%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.50, (d, J = 8.80 Hz, 2H), 7.40 (s, 1H), 6.88 (d, J = 7.68 Hz, 2H), 3.96 (t, J = 6.58 Hz, 2H), 1.78 (quin, J = 7.02 Hz, 2H), 1.49-1.29 (m, 6H), 0.91 (t, 3H).
【0107】
(6)化合物6の合成
−78℃で、化合物4(1.9g,5.7mmol)/THF(30mL)溶液にn−BuLi(2.2mL,2.6M/L,5.8mmol)を添加し、30分反応させた後、ZnCl2(0.79g,5.8mmol)/THF(15mL)溶液を同温度で加えて15分反応し、混合物を30分以上掛けて室温に戻した。
上記で調製した亜鉛を含む溶液に化合物5(2.0g,5.7mmol)を加えた溶液を、0℃でPd(PPh3)4(0.33g,0.28mmol)/THF(5mL)溶液を加えて、0℃で2日間反応させた。
NH4Cl水溶液を添加して反応を停止してからジエチルエーテルで抽出し、有機層をNaHCO3水溶液で洗浄してからMgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理して目的物の化合物6を得た。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.69 (d, J = 9.04, 2H), 7.41 (d, J = 8.56 Hz, 2H), 7.21 (s, 1H), 6.89 (d, J = 8.80, 2H), 6.85 (d, J = 8.76 Hz, 2H), 3.97 (q, J = 6.35 Hz, 4H), 3.62 (t, J = 6.46 Hz, 2H), 1.86-1.73 (m, 4H).
【0108】
(7)化合物7の合成
化合物6(1.60g,2.60mmol)/THF(20ml)溶液にtetra−n−ブチルアンモニウムフルオライド(4.80mL,4.80mmol)/THF溶液を加え、室温で1日反応させた。反応混合物をクロロホルムで抽出し、抽出層を水洗後MgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:クロロホルム/酢酸エチル/ヘキサン=1/1/1)処理して目的物の化合物7を得た。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.44, (d, J = 8.80 Hz, 4H), 6.83 (d, J = 8.56 Hz, 4H),3.98-3.94 (m, 4H), 3.70-3.62 (m, 2H), 1.83-1.74 (m, 4H), 1.64-1.33 (m, 12H), 0.90 (t, J = 6.84 Hz, 3H).
【0109】
[実施例8(1,4−ビス(4−ブチルチオフェニル−1−イル)ブタ−1,3−ジインの合成)]
【化12】

【0110】
(略号)
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DIPEA ジイソプロピルエチルアミン
MeOH メタノール
Ph フェニル基
THF テトラヒドロフラン
TMEDA N,N,N’,N’-テトラメチルエチレンジアミン
TMS トリメチルシリル基
【0111】
(1)化合物1の合成
4−ブロモベンゼンチオール(0.50g,2.64mmol),水素化ナトリウム(0.21g,3.43mmol)およびTHF(15ml)の混合物を室温で10分攪拌した後、1−ヨードブタン(0.45ml,4.0mmol)を加え、1日還流下に反応させた。減圧下に溶媒を除去し、残存物をジエチルエーテルで抽出し有機層を水洗しMgSO4で乾燥した後、溶媒を除去し、粗生成物をシリカゲルカラムクロマトグラフィー処理して目的物の化合物1を得た(収率:99%)。
【0112】
(2)化合物2の合成
磁気攪拌子を入れ還流冷却器および3方コックを付した丸底フラスコに、Pd(PPh3)4(0.16g,0.14mmol)、CuI(27 mg,0.14mmol)およびPPh3(037mlg,0.16mmol)を入れアルゴンで置換した後、ジイソプロピルエチルアミン(5ml),トリメチルシリルアセチレン(0.63ml,4.6mmol)および化合物1(0.70g,2.85mmol)を添加して、45℃で1日反応させたのち、ジエチルエーテルを加え、不溶塩を濾過して除いた溶液を塩酸水溶液および水で洗浄した。
有機層をMgSO4で乾燥した後、溶媒を除去して得た粗生成物をシリカゲルカラムクロマトグラフィー処理して目的物の化合物2を得た(収率:99%)。
【0113】
(3)化合物3の合成
化合物2(0.67g,2.55mmol),炭酸カリウム(1.77g,12.8mmol),THF(20ml)およびMeOH(20ml)の混合物を室温で30分攪拌した後、減圧下に溶媒を除き、残存物をジエチルエーテルで抽出した。有機層を水洗しMgSO4で乾燥してから溶媒を減圧下に除去して得られた粗生成物をシリカゲルカラムクロマトグラフィー処理して目的物の化合物3を得た(収率:87%)。
【0114】
(4)化合物4の合成
DBU(0.31ml,2.05mmol),TMEDA 0.030ml,0.20mmol),CuCl(10mg,0.10mmol)およびアセトニトリル(20ml)の混合物に酸素を5分吹き込んだ後、化合物3(0.39g,2.05mmol)を加え、室温で3h反応させた。溶媒を減圧下に除去し、得られた残存物ジエチルエーテルで抽出し、有機層を水洗、MgSO4で乾燥し溶媒を除去した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー処理し、メタノールで再結晶して目的物の化合物4を得た(収率:89%)。
【0115】
(5)液晶性組成物の調製
上記で得られた1,4−ビス(4−ブチルチオフェニル−1−イル)ブタ−1,3−ジイン50質量%と1,4−ビス(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジイン50質量%とからなる液晶性組成物を調製し、複屈折を測定した。結果を図9に示す。
【産業上の利用可能性】
【0116】
本発明のジアセチレン誘導体は発現する屈折率異方性が大きく、優れた性能を有する光学および電子光学的デバイス、例えば液晶表示素子を構成する材料として有用であり、応答性向上に寄与するものである。
【技術分野】
【0001】
本発明は、新規なジアセチレン骨格構造を有する化合物、それを含む液晶性組成物に関する。また液晶表示素子の構成材料や大きい屈折率異方性を利用した光学および電子光学的デバイス等の用途に関する。
【背景技術】
【0002】
近年、液晶表示素子の高性能化は、情報化社会の進展に伴い不可欠となっている。液晶組成物の物性の中で、より高速化、あるいは高性能化のためには、屈折率異方性の大きい材料が必要とされている。
屈折率異方性の大きい材料として、シッフ塩基やピリミジンの構造を有する化合物(非特許文献1)、トラン系化合物(特許文献1、2)やジアセチレン系化合物(非特許文献2,特許文献3,4,5,6)が知られている。しかし前記の特許文献はいずれも(ジ)アセチレン骨格の両端に、アルキル基やアルコキシ基を結合したフェニレン基やナフチレン基が結合された化合物であり、大きい屈折率異方性を利用して液晶表示素子の応答性能を向上するための液晶部材として使用することが述べられている。しかしながら、十分大きな屈折率異方性を有すると記載しているが当該屈折率異方性の値は示されてなく、また熱や光に対する安定性も不明である。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】特表平01−502831号公報
【特許文献2】特開平06−239786号公報
【特許文献3】特開平11−001445号公報
【特許文献4】特開平06−211704号公報
【特許文献5】米国特許 第5338481号公報
【特許文献6】特表2004−518608号公報
【非特許文献】
【0004】
【非特許文献1】松本 正一、角田市良,「液晶の基礎と応用」,初版第3刷,株式会社工業調査会発行,1996年11月15日,p.123
【非特許文献2】B. Grant, Mol. Cryst. Liq. Cryst., 1978, vol. 48, 175−182
【発明の概要】
【発明が解決しようとする課題】
【0005】
本発明は上記の問題を解決し、それ自体で液晶性を示し大きな屈折率異方性を有する化合物、または単体では液晶性を示さないが液晶化合物に添加すると大きな屈折率異方性を発現する化合物やこれらを用いた液晶性組成物を提供することを目的とし、さらに優れた性能を有する光学および電子光学的デバイスを提供することを目的とする。
【課題を解決するための手段】
【0006】
上記の課題を解決するため、本発明者らは鋭意検討を加えた結果、ジアセチレン(1,3−ブタジイン)骨格を有する新規なジアセチレン化合物が上記の課題を解決できることを見出し、本発明を完成するに至った。
すなわち、本発明は以下の通りである。
【0007】
〔1〕下記の一般式(A)で表されるジアセチレン誘導体。
R1-Sp1-(Ar1)p-(Ar3)q-(Phe)r-C≡C-C≡C-(Phe)r-(Ar4)q-(Ar2)p-Sp2-R2 (A)
(式中、R1およびR2は、互いに独立して、水素原子、ハロゲン原子、シアノ基、イソチオシアネート基、あるいは炭素原子1ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基若しくは反応性基により一置換若しくは多置換されたアルキル基、炭素原子2ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基若しくは反応性基により一置換若しくは多置換されたアルケニル基若しくはアルキニル基、または反応性基を表わし、ここで1個以上の非隣接−CH2−基は−O−、−CO−、−COO−および/または−OCO−により置換されていてもよく、Sp1およびSp2は互いに独立して、−O−、−S−、−CO−、−COO−、−OCO−、−OCO−O−、−CO−NR3−、−NR3−CO−、−O(CH2)n−、−(CH2)nO−、−CH=CH−COO−、−OCO−CH=CH−、−(CH2)m−、−(SiR4R5−O)n−または単結合であり、ここでmおよびnは独立して1〜10の整数を表し、R3、R4およびR5は水素原子または炭素数1〜4のアルキル基を表し、Ar1およびAr2は、互いに独立して、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの芳香族の炭素環式または複素環式基であり、縮合環を含んでいてもよく、Ar3およびAr4は、互いに独立して、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの複素環式基であり、縮合環を含んでいてもよく、単結合で連結された複数の複素環式基でもよく、Pheは、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された1,4−フェニレン基を表し、p、qおよびrは、それぞれ0または1である。)
【0008】
〔2〕下記の一般式(1)で表される化合物であることを特徴とする前記[1]に記載のジアセチレン誘導体。
R1−Sp1−Ar1−Phe−C≡C−C≡C−Phe−Ar2−Sp2−R2 (1)
【0009】
〔3〕下記の一般式(2)で表される化合物であることを特徴とする前記[1]に記載のジアセチレン誘導体。
R1−Sp1−Ar3−C≡C−C≡C−Ar4−Sp2−R2 (2)
【0010】
〔4〕下記の一般式(3)で表される化合物であることを特徴とする前記[1]に記載のジアセチレン誘導体。
R1−Sp1−Phe−C≡C−C≡C−Phe−Sp2−R2 (3)
【0011】
〔5〕前記の反応性基が、ヒドロキシル基、カルボキシル基、酸無水物基、マレイミド基、ビニロキシ基、オキシラニル基、オキセタニル基、ビニル基、(メタ)アクリレート基、またはシリル基であることを特徴とする前記〔1〕〜〔4〕に記載のジアセチレン誘導体。
【0012】
〔6〕前記のAr1およびAr2が、フラン−2,5−ジイル基、チオフェンー2,5−ジイル基、ピロール−2,5−ジイル基、1,4−フェニレン基、ナフタレン−2,6−ジイル基、ピリジン−2,5−ジイル基、ピリミジン−2,5−ジイル基、またはインダン−2,5−ジイル基であることを特徴とする前記〔1〕または[2]に記載のジアセチレン誘導体。
【0013】
〔7〕前記のAr3およびAr4が、フラン−2,5−ジイル基、チオフェン−2,5−ジイル基、ピロール−2,5−ジイル基、ピリジン−2,5−ジイル基、またはピリミジン−2,5−ジイル基であることを特徴とする前記〔1〕または〔3〕に記載のジアセチレン誘導体。
【0014】
〔8〕前記〔1〕〜〔4〕のいずれかに記載のジアセチレン誘導体の1種又2種以上を含む液晶性組成物。
〔9〕光学用又は電気光学用として用いることを特徴とする前記〔1〕〜〔7〕のいずれかに記載のジアセチレン誘導体。
〔10〕光学用又は電気光学用として用いることを特徴とする前記〔8〕に記載の液晶性組成物。
【発明の効果】
【0015】
本発明のジアセチレン誘導体は液晶性の有無を問わず大きな屈折率異方性を発現するので、光学および電子光学的デバイス等例えば液晶表示素子を構成する材料として有用である。
【図面の簡単な説明】
【0016】
【図1】実施例1で得られたジアセチレン誘導体の1H−NMRスペクトルを示す図である。
【図2】実施例1で得られたジアセチレン誘導体と(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインとの液晶性組成物の複屈折の波長依存性を示す図である。なお、aの線は組成物の、bの線は(4−ヘキシロキシ)フェニル−1−イル)ブタ−1,3−ジインの複屈折をそれぞれ表す。
【図3】実施例2で得られたジアセチレン誘導体と(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインとの液晶性組成物の複屈折の波長依存性を示す図である。cの線は組成物の、dの線は(4−ヘキシロキシ)フェニル−1−イル)ブタ−1,3−ジインの複屈折をそれぞれ表す。
【図4】実施例3で得られたジアセチレン誘導体の1H−NMRスペクトルを示す図である。
【図5】実施例4で得られたジアセチレン誘導体の1H−NMRスペクトルを示す図である。
【図6】実施例4で得られたジアセチレン誘導体と(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインとの液晶性組成物の複屈折の波長依存性を示す図である。eの線は組成物の、fの線は(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインの複屈折をそれぞれ表す。
【図7】実施例5で得られたジアセチレン誘導体の1H−NMRスペクトルを示す図である。
【図8】実施例5で得られたジアセチレン誘導体のDSCの測定結果を示す図である。なお、gの線は昇温時の、hの線は降温時の熱挙動をそれぞれ示す。
【図9】実施例8で得られたジアセチレン誘導体と(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインとの液晶性組成物の複屈折の波長依存性を示す図である。iの線は組成物の、jの線は(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジインの複屈折をそれぞれ表す。
【発明を実施するための形態】
【0017】
以下、本発明を詳細に説明する。
本発明は、下記の一般式(A)で表されるジアセチレン誘導体である。
R1-Sp1-(Ar1)p-(Ar3)q-(Phe)r-C≡C-C≡C-(Phe)r-(Ar4)q-(Ar2)p-Sp2-R2 (A)
本発明の一般式(A)で表されるジアセチレン誘導体は、ジアセチレン(1,3−ブタジイン)骨格にフェニレン基等の炭素環式基や複素環式基とスペーサー基Sp1およびSp2を介して置換基R1およびR2が結合された化合物であり、下記一般式(1)〜(3)で表わされる化合物が好ましい。
R1−Sp1−Ar1−Phe−C≡C−C≡C−Phe−Ar2−Sp2−R2 (1)
R1−Sp1−Ar3−C≡C−C≡C−Ar4−Sp2−R2 (2)
R1−Sp1−Phe−C≡C−C≡C−Phe−Sp2−R2 (3)
【0018】
1,3−ブタジイン骨格部分は、本発明の一般式(A)、(1)〜(3)の化合物の特徴である。これらの化合物は驚くほど高い化学的及び熱的安定性を持っている。一般的に、それらは高い異方性を発現し、その構造に従いネマチック液晶性および/またはスメクチック液晶性を示す。
【0019】
式(A)、(1)〜(3)において、R1、R2としてはそれぞれ独立に、水素原子、ハロゲン原子、シアノ基、イソチオシアネート基、あるいは炭素原子1ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基または反応性基により一置換若しくは多置換されたアルキル基、炭素原子2ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基または反応性基により一置換若しくは多置換されたアルケニル基若しくはアルキニル基、または反応性基を表わし、ここで1個以上の非隣接−CH2−基は−O−、−CO−、−COO−および/または−OCO−により置換されていてもよい。
【0020】
具体的には、例えば、メチル、エチル、プロピル、ブチル、ペンチル、ヘキシル、ヘプチル、オクチル、ノニル、デシル、ウンデシル、ドデシル、エテニル、プロペニル、ブテニル、ペンテニル、ヘキセニル、ヘプテニル、オクテニル、ノネニル、デセニル、ウンデセニル、ドデセニル、プロピニル、ブチニル、ペンチニル、ヘキシニル、ヘプチニル、オクチニル、ノニニル、デシニル、ドデシニル、エチニル、プロペニル、ブテニル、ペンテニル、ヘキセニル、ヘプテニル、オクテニル、ノネニル、デセニル、ウンデセニル、ドデセニル、2−メチルプロピル、2−メチルブチル、3−メチルブチル、3−メチルペンチル、2−メチルヘキシル、2−メチルデシル、2−フルオロエチル、3−フルオロプロピル、4−フルオロブチル、6−フルオロヘキシル、4,4−ジフルオロブチル、6,6−ジフルオロヘキシル、2−クロロエチル、3−クロロプロピル、4−クロロブチル、6−クロロヘキシル、ペルフルオロエチル、ペルフルオロブチル、1−シアノエチル、1−シアノブチル、2−シアノブチル、1−トリフルオロメチルエチル、1−トリフルオロメチルブチル、メトキシ、エトキシ、ブチルオキシ、ペンチルオキシ、ヘキシルオキシ、オクチルオキシ、デシルオキシ、ドデシルオキシ、トリフルオロメトキシ、2−フルオロブチルオキシ、2−フルオロヘキシルオキシ、2−フルオロブチルオキシカルボニルやこれらの基に後述の反応性基を結合した基、水素原子、フッ素原子、トリフロロメチル基、シアノ基、イソチオシアネート基や反応性基等が挙げられる。
【0021】
式(A)、(1)におけるAr1、Ar2としては、それぞれ独立に、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの芳香族の炭素環式または複素環式基であり、縮合環を含んでいてもよい。好ましくは芳香族基または5員もしくは6員の複素環式基、あるいは2個または3個の縮合芳香族環または複素環の5員環もしくは6員環を含む基であり、これらの環は2個以上のヘテロ原子、特にN、OおよびSから選択されるヘテロ原子を含んでいてもよい。これらのすべての基は無置換、または、F、Cl、CN、OH、NO2、CH3、C2H5、OCH3、OC2H5、COCH3、COC2H5、COOCH3、COOC2H5、CF3、OCF3、OCHF2またはOC2F5により単置換もしくは多置換されることもできる。特にF、Cl、CN、CH3、C2H5、OCH3、またはOCF3が好ましい。
【0022】
Ar1およびAr2の好ましい基の例としては、例えば、フラン、ピロール、チオフェン、オキサゾール、チアゾール、チアジアゾール、イミダゾール、フェニレン、ピリジン、ピリミジン、ピラジン、インダン、ナフタレン、テトラヒドロナフタレン、アントラセンおよびフェナントレン等が挙げられる。
特に好ましいAr1およびAr2は、フラン−2,5−ジイル、チオフェン−2,5−ジイル、ピロール−2,5−ジイル、1,4−フェニレン、ピリジン−2,5−ジイル、ピリミジン−2,5−ジイル、ナフタレン−2,6−ジイル、1,2,3,4−テトラヒドロナフタレン−2,6−ジイル、インダン−2,5−ジイルである。
【0023】
式(A)、(1)および(3)におけるPheは、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された1,4−フェニレン基を表す。例えば、1,4−フェニレン、2−フルオロ−1,4−フェニレン、3−フルオロ−1,4−フェニレン、2,3−ジフルオロ−1,4−フェニレン、2−クロロ−1,4−フェニレン、2−シアノ−1,4−フェニレン、2−メチル−1,4−フェニレン、3−メチル−1,4−フェニレンなどの基を挙げることができる。
【0024】
また、式(A)、(2)におけるAr3、Ar4としては、それぞれ独立に、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの複素環式基であり、縮合環を含んでいてもよくまた単結合で連結された複数の複素環式基でもよい。好ましくは5員もしくは6員の複素環式基、あるいは複素環式基を含む2個または3個の縮合環を含む基であり、複素環式基を構成する原子は1個または2個以上のヘテロ原子、特にN、OおよびSから選択されるヘテロ原子が好ましい。これらのすべての基は無置換、または、F、Cl、CN、CH3、C2H5、OCH3、OC2H5、CF3、OCF3、OCHF2またはOC2F5により単置換もしくは多置換されることもできる。特にF、Cl、CN、CH3、C2H5、OCH3、またはOCF3が好ましい。
Ar3およびAr4の好ましい基の例としては、例えば、フラン、ピロール、チオフェン、オキサゾール、チアゾール、チアジアゾール、イミダゾール、ピリジン、ピリミジン、ピラジン等から誘導される基を挙げることができる。特に好ましいAr3およびAr4は、フラン−2,5−ジイル、チオフェン−2,5−ジイル、ピロール−2,5−ジイル、ピリジン−2,5−ジイル、ピリミジン−2,5−ジイルである。
【0025】
Sp1およびSp2はスペーサー基とも呼ばれる基であり、当業者にこの目的のために知られているすべての基を使用することができる。
Sp1およびSp2は互いに独立して、−O−、−S−、−CO−、−COO−、−OCO−、−OCO−O−、−CO−NR3−、−NR3−CO−、−O(CH2)n−、−(CH2)nO−、−CH=CH−COO−、−OCO−CH=CH−、−(CH2)m−、−(SiR4R5−O)n−または単結合であり、ここでmおよびnは独立して1〜10の整数を表し、R3、R4およびR5は水素原子または炭素数1〜4のアルキル基を表す。
好ましいスペーサー基は、例えばエチレン、プロピレン、ブチレン、ペンチレン、ヘキシレン、ヘプチレン、オクチレン、ノニレン、デシレン、ウンデシレン、ドデシレン、オクタデシレン、エチレンオキシエチレン、メチレンオキシブチレン、エチレン−N−メチル−イミノエチレン、エテニレン、プロペニレンおよびブテニレンなどが挙げられる。
【0026】
前記の反応性基とは、適宜な条件を選択することにより反応して高分子を形成することのできる基であり、ヒドロキシル基、カルボキシル基、酸無水物基、マレイミド基、ビニル基、ビニロキシ基、オキシラニル基、オキセタニル基、(メタ)アクリレート基、シリル基などが挙げられ、これらの中でも重合や縮合の容易な基が好ましく、例えば、好ましくはCH2=CW1−COO−、
【化1】

CH2=CW2−(O)k1−、CH3−CH=CH−O−、(CH2=CH)2CH−OCO−、(CH2=CH−CH2)2CH−OCO−、(CH2=CH)2CH−O−、(CH2=CH−CH2)2N−、HO−CW2W3−、HS−CW2W3−、HW2N−、HO−CW2W3−NH−、CH2=CW1−CO−NH−、CH2=CH−(COO)k1−Phe−(O)k2−、Ph−CH=CH−、HOOC−、OCN−およびW4W5W6Siから選択される。
【0027】
ここで、W1はH、Cl、CN、フェニルまたは炭素原子1〜5個を有するアルキルであり、特にH、ClまたはCH3であり、W2およびW3は相互に独立して、Hまたは炭素原子1〜5個を有するアルキルであり、特にメチル、エチルまたはn−プロピルであり、W4、W5およびW6は、相互に独立してCl、炭素原子1〜5個を有するオキサアルキルもしくはオキサカルボニルアルキルであり、Phはフェニル、Pheは1,4−フェニレンであり、ならびにkは0,1または2であり、k1およびk2は相互に独立して0または1である。殊に好ましい基は、ビニル基、(メタ)アクリレート基、オキシラニル基またはオキセタニル基であり、最も好ましくは(メタ)アクリレート基である。
【0028】
次に、式(1)〜(3)で表されるジアセチレン誘導体の合成方法について説明する。
式(1)〜(3)で表される化合物は、それ自体公知の非常に簡単な方法で製造することができる。例えば有機化学の標準的学術書であるHouben-Weyl, “ Methoden der Organischen Chemie ”, Thime-Verlag, Stuttgartなどに記載されている方法またはそれと類似の方法により合成することができる。より具体的には、例えばL.Brandsma,“ Preparative Acetylenic Chemistry ”2nd Ed. Elsevier, Amsterdam NL, (1988) や Cadiot-Chodkiewicz(G.Eglinton,W.Mc Grae in Raphael, Taylor and Wynberg(eds) “ Advances in Organic Chemistry ”, Vol.4, Interscience publishers, N.Y. (1963) に記載されたように、銅錯体の存在下に末端アルキンをハロアルキン誘導体とカップリングさせることにより製造することができる。
【0029】
それぞれカップリングの相手として必要な末端アルキン類及びハロアルキン類は、公知であるか、又は公知化合物と類似であり、それ自体公知の方法により製造することができる。例えば、アルデヒドはCBr4/PPh3を用いるウィッティヒ反応、続く脱離反応により必要なアルキンに変換することができる。必要ならば、それらのアルキンはそれ自体公知の方法、金属化、続いてハロゲン化により相当するハロアルケンから変換することができる。R1またはR2がキラルである場合には、本発明の誘導体はキラルな添加物(dopant)として用いることができる。
反応性基を導入する場合は、反応性基を結合した化合物とジアセチレン基を有する化合物との反応や反応性基を結合したアセチレン化合物と他のアセチレン化合物とのカップリングなど、目的とするジアセチレン基を有する化合物の合成に支障のないように行えばよい。
【0030】
かくして得られる本発明のジアセチレン誘導体は、単独では液晶性を示さない場合もあるが、液晶性を示す場合は当該誘導体に導入された基や全体の構造により液晶相挙動(相転移温度)や屈折率異方性(複屈折)が異なるが、等方相転移温度(Ti℃)より10℃低い液晶相温度で測定した複屈折Δn(550nmで測定)は好ましくは0.25以上、特に0.30以上を示すことが好ましい。
【0031】
本発明の液晶性組成物は、本発明の式(1)〜(3)で表されるジアセチレン誘導体を少なくとも1種含有する液晶性組成物である。組成物を構成する他の成分は異なる式(1)〜(3)の化合物同士であってもよく特に限定されるものではないが、液晶相を示す化合物が好ましい。
式(1)〜(3)の化合物は組成物の光学異方性に大きく貢献している。式(1)〜(3)の化合物の混合割合は液晶性組成物に要求される性能に合わせて広い範囲で変えることができ、一概に決定はできないが、通常は0.1〜100質量%、好ましくは1〜80質量%である。
【0032】
本発明の液晶性組成物は前述のように本発明のジアセチレン誘導体を少なくとも1種含有する組成物であり、組成物を構成する他の成分はネマチック液晶相を示すものが好ましい。
本発明の式(1)〜(3)で表されるジアセチレン誘導体は他の液晶化合物との混和性が良好であり、液晶セルに要求される性能に応じて適宜混合してその性能を改良することができる。
【0033】
前記の組成物を構成する他の成分としてはネマチック相を示す化合物が好ましく、例えば、アゾキシベンゼン類、ベンジリデン−アニリン類、ビフェニル類、ターフェニル類、安息香酸フェニルまたはシクロヘキシル類、シクロヘキサンカルボン酸のフェニルエステルまたはシクロヘキシルエステル類、シクロヘキシル安息香酸のフェニルエステルまたはシクロヘキシルエステル類、シクロヘキシルシクロヘキサンカルボン酸のフェニルエステルまたはシクロヘキシルエステル類、安息香酸の、シクロヘキサンカルボン酸のおよびシクロヘキシルシクロヘキサンカルボン酸のシクロヘキシルフェニルエステル類、フェニルシクロヘキサン類、シクロヘキシルビフェニル類、フェニルシクロヘキシルシクロヘキサン類、シクロヘキシルシクロヘキサン類、シクロヘキシルシクロヘキセン類、シクロヘキシルシクロヘキシルシクロヘキセン類、1,4−ビス−シクロヘキシルベンゼン類、4,4’−ビス−シクロヘキシルビフェニル類、フェニル−またはシクロヘキシルピリミジン類、フェニル−またはシクロヘキシルピリジン類、フェニル−またはシクロヘキシルピリダジン類、フェニル−またはシクロヘキシルジオキサン類、フェニル−またはシクロヘキシル−1,3−ジチアン類、1,2−ジフェニル−エタン類、1,2−ジシクロヘキシルエタン類、1−フェニル−2−シクロヘキシルエタン類、1−シクロヘキシル−2−(4−フェニルシクロヘキシル)−エタン類、1−シクロヘキシル−2−ビフェニル−エタン類、1−フェニル−2−シクロヘキシル−フェニルエタン類や、ハロゲン化スチルベン類、ベンジルフェニルエーテル、トラン類等やこれらの混合物を挙げることができる。
【0034】
本発明の式(1)〜(3)で表される化合物および/または液晶性組成物は、光学又は電気光学用として用いることができる。たとえば、TNまたはSTNディスプレイ、IPS(インプレーンスイッチング)ディスプレイまたはVAN(垂直配向ネマティック)もしくはVAC(垂直配向コレステリック)などのVA(垂直配向)モード、ECB(電気制御複屈折率)ディスプレイ、DAP(配列相変形)、CSH(カラースーパーホメオトロピック)またはASM(軸対称ミクロセル)モード、相変化、ゲスト−ホスト、フレキソエレクトリック、強誘電性ディスプレイ、双安定(bistable)ネマチックおよびPSCT(ポリマー安定化コレステリック組織)などのコレステリックディスプレイ、またはPDLC、ポリマーゲルまたはポリマーネットワークディスプレイなどのディスプレイ用の液晶混合物に使用することができる。
液晶性組成物及び電気−光学装置(液晶表示素子)の製造は、それ自体公知の方法で行なうことができる。
【実施例】
【0035】
以下に実施例および比較例を挙げ、本発明を具体的に説明するが本発明はこれらの例に制限されるものではない。実施例および比較例で用いた各種測定法等を説明する。
【0036】
1.複屈折の測定
下記の機器を用いて測定した。
偏光顕微鏡: ECLIPSE LV 100 POL、(株)ニコン製)
光ファイバー: BIF600-VIS-NIR、Ocean optics, Inc. 製
分光器: USB4000、Ocean optics, Inc. 製
評価用液晶セル:KSRP-03/B311P1NSS05、(株)イーエッチシー製)
測定温度は等方相転移温度より10℃低い液晶相温度で、波長400〜1000nmの範囲でスペクトルを測定し、下記にしたがって求めた。
【0037】
(1)セルギャップの測定
液晶を封入しない状態でセルの下から光を当て、透過干渉光を測定することにより、空気層の厚さを求め((1)式)、その空気層の厚さをセルギャップとする。
2d=mλ (1)
【0038】
(2)顕微分光分析
上記(1)で求めたセルギャップがdのセルに液晶を封入しホモジニアス配向させて作成した複屈折体を、偏光軸が互いに直交する2枚の偏光子の間に挟持して測定される分光透過率が最大または最小となる波長の値((2)式)と、各波長における複屈折体のリタデーション((3)式)を、4次まで展開したコーシーの分散式((4)式)でフィッテングを行い、複屈折体の複屈折率ΔnおよびリタデーションRの波長分散を決定した。
【0039】
【数1】

【0040】
2.DSCの測定
Perkin−Elmer社製 DSC7を用い、窒素雰囲気下で昇降温速度10℃/minで測定した。
【0041】
3.偏光顕微鏡観察(液晶相挙動の判定)
温度調節装置Mettler社製FP90セントラルプロセッサーを付したMettler社製FP82ホットステージを具備したOlympus社製偏光顕微鏡(型式BX50)により、液晶の相挙動をDSCの測定結果と合わせて調べた。
Crは結晶相を、Sはスメクチック相を、Nはネマチック相を、そしてIsoは等方相を示す。
【0042】
4.NMRスペクトルの測定
テトラメチルシラン(TMS)を内標として重水素化クルロホルム、重水素化ジメチルホルムアミドまたは重水素化ジメチルスルホキシド溶媒に試料を溶解してNMR装置(JEOL LNM−EX400)により1Hおよび/または13C−NMRスペクトルを測定した。
【0043】
5.その他、必要に応じて以下の機器を用いた。
FT−IR: JASCO FT-IR 460 plus spectrometer
UV−visスペクトル: Beckman Coutler DU800 UV-vis Spectrometer
高分解能マス スペクトル:JEOL JMS700 mass spectrometer
【0044】
[実施例1(1,4−ビス(4−ブチルベンゾ[b]チオフェニル−5−イル)ブタ−1,3−ジインの合成)]
【化2】

【0045】
(略号)
n-BuLi n-ブチルリチウム
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DIPEA ジイソプロピルエチルアミン
MeOH メタノール
Ph フェニル基
TBAF テトラブチルアンモニウム フルオライド
THF テトラヒドロフラン
TIPS トリイソプロピルシリル基
TMEDA N,N,N’,N’-テトラメチルエチレンジアミン
【0046】
(1)1−ブロモ−4−(2,2−ジメトキシエチル−スルファニル)ベンゼンの合成
4−ブロモベンゼンチオール(3.0g,15.8mmol)の乾燥THF(20ml)溶液にNaH(1.2g,20.5mmol,60% in mineral oil)を加え、室温で10分間反応させた。ついで、ブロモアセトアルデヒドジメチルアセタール(2.8mL,23.7mmol)を加え、還流下、2日間反応させた。
溶媒を除去し残存物をジエチルエーテルで抽出し、水洗、MgSO4で乾燥した後、エーテルを留去した。エーテル留去後の残存物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理して目的物を得た(4.9g,収率:99%)。
<スペクトルデータ>
1H-NMR (CDCl3, ppm): δ 7.40 (d, J = 8.28 Hz, 2H), 7.25 (d, J = 8.52 Hz, 2H), 4.51 (t, J = 5.5 Hz, 1H), 3.36 (s, 6H), 3.09 (d, J = 5.6 Hz, 2H) .
【0047】
(2)5−ブロモベンゾ[b]チオフェンの合成
ポリリン酸(5.0g)およびクロロベンゼン(100mL)の混合物を3h還流下で処理し、ついで1−ブロモ−4−(2,2−ジメトキシエチル−スルファニル)ベンゼン(2.50g,9.00mmol)を加えた。反応混合物を180℃で2日間攪拌した。
溶媒を留去し、残存物をジエチルエーテルで抽出し、有機層を炭酸水素ナトリウム水溶液で洗浄し、MgSO4で乾燥した後エーテルを留去し、残存物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(1.15g,収率:60%)。
<スペクトルデータ>
1H-NMR (CDCl3, ppm) δ 7.97 (d, J = 1.72 Hz, 1H), 7.74 (d, J = 8.56 Hz, 1H), 7.48 (d, J = 5.4 Hz, 1H), 7.44 (dd, J1 = 8.52 and 1.96 Hz, 1H), 7.28 (s, 1H).
【0048】
(3)5−(2−トリイソプロピルシリル)ベンゾ[b]チオフェンの合成(Sonogashira カップリング)
5−ブロモベンゾ[b]チオフェン(1.1g,5.3mmol),トリイソプロピルシリルアセチレン(2.2ml,9.6mmol),N−ジイソプロピルエチルアミン(10ml),THF(20ml),Pd(PPh3)4(0.31g,0.27mmol),CuI(51mg,0.27mmol)およびPPh3 70mg,0.27mmol)を用いてSonogashiraカップリング反応を行った。
生成物を常法に従って処理し目的物を得た(1.3g,収率:78%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm):δ 7.96 (d, J = 0.96 Hz, 1H), 7.80 (d, J = 8.56 Hz, 1H), 7.89-7.42 (m, J = 9.52 Hz, 1H),7.30 (dd, J = 9.4 and 0.72 Hz, 1H), 1.15 (s, 21H).
【0049】
(4)2−ブチル−5−(2−トリイソプロピルシリル)ベンゾ[b]チオフェンの合成
−78℃に冷却した5−(2−トリイソプロピルシリル)ベンゾ[b]チオフェン(0.50g,1.6mmol)/THF(30mL)溶液にn−BuLi(0.73mL,2.6M/L,1.9mmol)/n−hexane溶液を滴下した。同温度で1h反応させ、ついで1−ヨードブタン(0.27ml,1.9mmol)を加えた後、混合物をゆっくりと室温まで昇温し続けて14h攪拌した。水を添加した混合物をジエチルエーテルで抽出し、有機層をMgSO4で乾燥してから濃縮した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し目的物を得た(0.48g,収率:81%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.78 (s, 1H), 7.68-7.66 (m, 1H), 7.35 (dd, J = 8.32 and 1.48 Hz, 1H), 6.94 (s, 1H) 2.89 (t, J = 6.66 Hz, 2H), 1.46-1.37 (m, 2H), 1.15 (s, 21H), 0.95 (t, J = 7.32 Hz, 3H).
【0050】
(5)2−ブチル−5−エチニルベンゾ[b]チオフェンの合成
2−ブチル−5−(2−トリイソプロピルシリル)ベンゾ[b]チオフェン(0.44g,1.2mmol),テトラブチルアンモニウムフルオライド(2.2ml,2.2mmol)およびTHF(30ml)の混合物を室温で30分攪拌した後、減圧下に溶媒を除去した。得られた残存物をジエチルエーテルで抽出し、水洗後MgSO4で乾燥してからエーテルを留去した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し、目的物を得た(0.27g,収率:99%)。
【0051】
(6)1,4−ビス(4−ブチルベンゾ[b]チオフェニル−5−イル)ブタ−1,3−ジインの合成
2−ブチル−5−エチニルベンゾ[b]チオフェン(0.27g,1.2mmol), DBU(0.19ml,1.2mmol),TMEDA(0.019ml,0.12mmol),CuCl(12mg,0.019mmol) およびアセトニトリル(20ml)を用いてGlaserカップリング反応を行った後、常法により処理し目的物を得た。1H−MRスペクトルを図1に示す。
【0052】
(7)液晶性組成物の調製
上記で得られた1,4−ビス(4−ブチルベンゾ[b]チオフェニル−5−イル)ブタ−1,3−ジイン50質量%と1,4−ビス(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジイン50質量%とからなる液晶性組成物を調製し、複屈折を測定した。結果を図2に示す。
なお、1,4−ビス(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジイン単独の液晶相挙動は次のようであった。
Cr 115.3℃ N 147.5℃ Iso
【0053】
[実施例2(1,4−ビス(5−ヘキシル−チエノ[3,2−b]チオフェニル−2−イル)ブタ−1,3−ジインの合成)]
【化3】

【0054】
(略号)
n-BuLi n-ブチルリチウム
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DIPEA ジイソプロピルエチルアミン
DMF ジメチルホルムアミド
MeOH メタノール
NBS N-ブロモコハク酸イミド
Ph フェニル基
TBAF テトラブチルアンモニウム フルオライド
THF テトラヒドロフラン
TMEDA N,N,N’,N’-テトラメチルエチレンジアミン
TMS トリメチルシリル基
【0055】
(1)2−ヘキシル−チエノ[3,2−b]チオフェンの合成
チエノ[3,2−]チオフェン(0.90g,6.40mmol)/THF(30mL)溶液に−78℃でn−BuLi(2.58ml,2.6M/L,6.72mmol)/n−ヘキサン溶液を滴下し、1h反応させた後、1−ブロモヘキサン(1.07ml,7.68mmol)を同温度で加えた。混合物をゆっくりと室温に戻し、さらに2h反応させた。混合物をジエチルエーテルで抽出し、エーテル層を水洗、MgSO4で乾燥してから溶媒を減圧下に除去した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.80g,収率:56%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.26 (d, J = 5.12 Hz, 1H), 7.18 (d, J = 5.12 Hz, 1H), 6.95 (s, 1H), 2.87 (t, J = 7.70 Hz, 2H), 1.71 (quin, J = 7.57 Hz, 2H), 1.43-1.27 (m, 6H), 0.89 (t, J = 7.08 Hz, 3H).
【0056】
(2)2−ブロモ−5−ヘキシル−チエノ[3,2−b]チオフェンの合成
遮光下に0℃で、2−ヘキシル−チエノ[3,2−b]チオフェン(0.80g,3.56mmol)/DMF(5ml)溶液に、NBS(0.70g,3.92mmol)/DMF(20mL)溶液を滴下し、3h反応させた。反応混合物をジエチルエーテルで抽出し、有機層を水洗、MgSO4で乾燥してから溶媒を除去した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(1.03g,収率:96%)。
<スペクトルデータ>
1H NMR (400 MHz, CDCl3, ppm) δ 7.17 (s, 1H), 6.85 (s, 1H), 2.84 (t, J = 7.68 Hz, 2H), 1.69 (quin, J = 7.38 Hz, 2H), 1.43-1.24 (m, 6H), 0.89 (t, J = 6.96 Hz, 3H).
【0057】
(3)2−(2’−トリメチルシリルエチニル)−5−チエノ[3,2−b]チオフェンの合成
2−ブロモ−5−ヘキシル−チエノ[3,2−b]チオフェン(0.30g,0.99mmol),トリメチルシリルアセチレン(0.21ml,1.58mmol),N−ジイソプロピルエチルアミン(2ml),Pd(PPh3)4(57mg,0.050mmol),CuI(9.4mg,0.050mmol)およびPPh3(13mg,0.050mmol)をTHF(5ml)中でSonogashiraクロスカップリング反応を行わせた後、常法に従って処理し、目的物を得た(収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.30 (d, J = 0.72 Hz, 1H), 6.87 (d, J = 0.72 Hz, 1H), 2.87 (t, J = 7.56 Hz, 2H), 1.70 (quin, J = 7.56 Hz, 2H), 1.43-1.24 (m, 6H), 0.89 (t, J = 7.06 Hz, 3H), 0.25 (s, 9H).
【0058】
(4)2−エチニル−5−ヘキシル−チエノ[3,2−b]チオフェンの合成
2−(2’−トリメチルシリルエチニル)−5−ヘキシル−チエノ[3,2−b]チオフェン(0.33g,1.03mmol),炭酸カリウム(0.71g,5.10mmol),THF(20ml)およびMeOH(20ml)を室温で4h反応させた後、溶媒を減圧下に除去した。
残存物をジエチルエーテルで抽出し、有機層を水洗、MgSO4で乾燥してから溶媒を減圧下に除去し粗生成物を得た。シリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.20g,収率:78%)。
<スペクトルデータ>
1H NMR (400 MHz, CDCl3, ppm): δ 7.35 (s, 1H), 6.88 (s, 1H), 3.40 (s, 1H), 2.87 (t, J = 7.56 Hz, 2H), 1.70 (quin, J = 7.51 Hz, 2H), 1.44-1.27 (m, 6H), 0.89 (t, J = 7.08 Hz, 3H).
【0059】
(5)1,4−ビス(5−ヘキシル−チエノ[3,2−b]チオフェニル−2−イル)ブタ−1,3−ジインの合成
2−エチニル−5−ヘキシル−チエノ[3,2−b]チオフェン(0.19g,0.76mmol),DBU(0.11ml,0.76mmol),TMEDA(0.011ml,0.076mmol),CuCl(9.1mg,0.092mmol)をアセトニトリル(20ml)中でGlaserカップリング反応を行わせた後、常法に従って処理し目的物を得た(収率:99%)。
DSCの測定から液晶相の挙動は次のようであった。
Cr 103℃ N 175℃ Iso
【0060】
(6)液晶性組成物の調製
上記で得られた1,4−ビス(5−ヘキシル−チエノ[3,2−b]チオフェニル−2−イル)ブタ−1,3−ジイン50質量%と1,4−ビス(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジイン50質量%とからなる液晶性組成物を調製し、複屈折を測定した。結果を図3に示す。
【0061】
[実施例3(1,4−ビス(2−ヘキシロキシピリジニル−5−イル)ブタ−1,3−ジインの合成)]
【化4】

【0062】
(略号)
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DIPEA ジイソプロピルエチルアミン
MeOH メタノール
Ph フェニル基
THF テトラヒドロフラン
TMEDA N,N, N’,N’-テトラメチルエチレンジアミン
【0063】
(1)5−ブロモ−2−ヘキシロキシピリジン
2−ヒドロキシピリジン(1.0g,5.7mmol),1−ブロモヘキサン(2.8g,17mmol),炭酸カリウム(2.4g,17mmol)およびアセトニトリル(60ml)の混合物を還流下に4h反応した。
減圧下に溶媒を除去した残存物をジエチルエーテルで抽出し、有機層を水洗しMgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理し、目的物を得た(1.0g,収率:67%)。
<スペクトルデータ>
1H NMR (400 MHz, CDCl3, ppm): δ 7.37 (d, J = 2.68 Hz, 1H), 7.32 (dd, J = 9.52 and 2.68 Hz, 1H), 6.47 (d, J = 9.52 Hz, 1H), 3.88 (t, J = 7.44 Hz, 2H), 1.73 (quant, J = 7.38 Hz, 2H), 1.38-1.29 (m, 6H), 0.89 (t, J = 7.06 Hz, 3H) .
【0064】
(2)2−ヘキシロキシ−5−(2’−トリメチルシリル)エチニルピリジンの合成
5−ブロモ−2−ヘキシロキシピリジン(0.99g,3.8mmol),トリメチルシリルアセチレン(0.95ml,6.9mmol),N−ジイソプロピルエチルアミン(6.5ml),THF(10ml),Pd(PPh3)4(0.13g,0.11mmol),CuI(22mg,0.11mmol)およびPPh3(30mg,0.11 mmol)を用いて.Sonogashiraカップリング反応を行った後、常法により処理し目的物を得た(収率:96%.)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.48 (d, J = 2.44 Hz, 1H), 7.31 (dd, J = 9.26 and 2.44 Hz, 1H), 6.47 (d, J = 9.52 Hz, 1H), 3.88 (t, J = 7.44 Hz, 2H), 1.77-1.68 (m, 2H), 1.39-1.28 (m, 6H), 0.88 (t, J = 6.58 Hz, 3H).
【0065】
(3)5−エチニル−2−ヘキシルピリジンの合成
2−ヘキシロキシ−5−(2’−トリメチルシリル)エチニルピリジン(0.96g,3.5mmol),炭酸カリウム(2.4g,17.5mmol),MeOH(30ml)およびTHF(30ml)の混合物を室温で2日間攪拌した。
減圧下に溶媒を除去した残存物をジエチルエーテルで抽出し、有機層を水洗しMgSO4で乾燥した後、溶媒を除去した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理し目的物を得た(0.56g,79%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ δ 7.51 (d, J = 2.44 Hz, 1H), 7.33 (dd, J = 9.52 and 2.44 Hz, 1H), 6.50 (d, J = 9.58 Hz, 1H), 3.90 (t, J = 7.58 Hz, 2H), 3.01 (s, 1H), 1.73 (quant, J = 7.44 Hz, 2H), 1.38-1.28 (m, 6H), 0.89 (t, J = 6.96 Hz, 3H).
【0066】
(4)1,4−ビス(2−ヘキシロキシピリジニル−5−イル)ブタ−1,3−ジインの合成
5−エチニル−2−ヘキシルピリジン(0.56g,2.75mmol),DBU(0.41ml,2.75mmol),TMEDA(41μmol,6.2μml),CuCl(5.5μmol,5.4mg)およびアセトニトリル(20ml)を用いて、Glaserカップリング反応を行った後、常法に従い処理し目的物(下記)を得た。図4に1H−NMRスペクトルを示す。
【0067】
【化5】

【0068】
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.56 (d, J = 2.44, 1H), 7.33 (dd, J = 9.52 and 2.44 Hz, 1H), 6.51 (d, J = 9.44 Hz, 1H), 3.90 (t, J = 7.44 Hz, 2H), 1.73 (quant, J = 7.26 Hz, 2H), 1.38-1.26 (m, 6H), 0.89 (t, J = 6.72 Hz, 3H);
13C NMR (100MHz CDCl3) δ 161.04, 142.84, 141.14, 121.03, 100.64, 77.63, 74.31, 50.36, 31.33, 29.19, 26.22, 22.44, 13.95
【0069】
[実施例4(1,4−ビス(4−(5−ヘキシルチオフェニル)フェニル−1−イル)ブタ−1,3−ジインの合成)]
【化6】

【0070】
(略号)
n-BuLi n-ブチルリチウム
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DMF ジメチルホルムアミド
MeOH メタノール
NBS N-ブロモコハク酸イミド
Ph フェニル基
THF テトラヒドロフラン
TMEDA N,N,N‘,N’-テトラメチルエチレンジアミン
TMS トリメチルシリル基
【0071】
(1)2−ヘキシルチオフェンの合成
チオフェン(2.0g,23.8mmol)/THF(30mL)溶液に−78℃でn−BuLi(8.2mL,2.6M/L,21.0mmol)ヘキサン溶液を滴下し、同温度で1h反応させ、ついで1−ブロモヘキサン(2.95mL,21.0mmol)を滴下した。混合物をゆっくりと室温まで昇温し14h反応を行った。水を添加し、混合物をジエチルエーテルで抽出し、有機層をMgSO4で乾燥後濃縮した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し、目的物を得た(3.26g,収率:92%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.10 (dd, J = 5.12 and 1.24, 1H), 6.90 (dd, J = 5.12 and 3.4, 1H), 6.78-6.76 (m, 1H), 2.82 (t, J = 7.44, 2H), 1.71-1.62 ( m, 2H), 1.40-1.27 (m, 6H), 0.89 (t, J = 6.96, 3H).
【0072】
(2)2−ブロモ−5−ヘキシルチオフェンの合成
遮光下、0℃で、NBS(4.11g,23.1mmol)/DMF(30mL)溶液を2−ヘキシルチオフェン(3.06g,18.2mmol)/DMF(20mL)溶液に滴下し、同温度で1h反応させた。
水を添加した後、ジエチルエーテルで抽出し、有機層をMgSO4で乾燥してからエーテルを除去した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し、目的物を得た(3.97g,収率:88%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 6.84 (d, J = 3.64 Hz, 1H) ; 6.52 (d, J = 3.68 Hz, 1H), 2.73 (t, J = 7.68 Hz, 2H), 1.66-1.54 (m, 2H), 1.38-1.17 (m, 6H), 0.88 (t, J = 6.84Hz, 3H).
【0073】
(3)2−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−5−ヘキシルチオフェンの合成
2−ブロモ−5−ヘキシルチオフェン(1.6g,6.3mmol)、4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン(ピナコールボラン)(1.4ml,9.5mmol)、TEA(2.6ml,19mmol)およびジオキサン(15ml)の混合物をアルゴンで脱気し、PdCl2(PPh3)2(0.22g,0.32mmol)を加えた。還流下に16h反応後、クロロホルムで抽出し、有機層をMgSO4で乾燥した。
減圧下に溶媒を除去し、粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理し、目的物を得た(0.51g,収率:93%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.47 (d, J = 3.40 Hz, 1H), 6.86 (d, J = 3.40 Hz, 1H), 2.85 (t, J = 7.56 Hz, 2H), 1.68 (quant, J = 7.44 Hz, 2H), 1.38-1.24 (m, 18H), 0.88 (t, J = 6.60 Hz, 3H).
【0074】
(4)2−(4−ブロモフェニル)−5−ヘキシルチオフェンの合成(鈴木 クロスカップリング)
脱気した2−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−5−ヘキシルチオフェン(0.50g,1.7mmol)、THF(15ml)溶液に4−ブロモヨードベンゼン(0.72g,2.5mmol)、Cs2CO3(1.1g,3.4mmol),Pd(PPh3)4 0.06g,0.05mmol)を加え、還流下に4h反応した。
反応混合物をジエチルエーテルで抽出し、有機層をMgSO4で乾燥した後、減圧下に溶媒を除去した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.51g,収率:93%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.47-7.41 (m, 4H), 7.11 (d, J = 3.64 Hz, 1H), 6.74 (d, J = 3.40 Hz, 1H), 2.81 (t, J = 7.70 Hz, 2H), 1.69 (quant, J = 7.50 Hz, 2H), 1.43-1.28 (m, 6H), 0.89 (t, J = 6.70 Hz, 3H).
【0075】
(5)2−(4−(2’−トリメチルシリル)エチニルフェニル)−5−ヘキシルチオフェンの合成(Sonogashira カップリング)
アルゴン雰囲気下でジイソプロピルエチルアミン(3ml)、トリメチルシリルアセチレン(0.38ml,2.8mmol)および2−(4−ブロモフェニル)−5−ヘキシルチオフェン(0.50g,1.54mmol)の混合物をPd(PPh3)4(89mg,77μmol),CuI(91mg,77μmol)およびPPh3(20mg,77μmol)の混合物に加えた。混合物を45℃で1日間反応させた。
反応混合物にジエチルエーテルを加え不溶塩を濾過で除去した溶液を、塩酸水溶液および水で洗浄し、有機層をMgSO4で乾燥した後、溶媒を減圧下に除去した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.35g,収率:66%)。
【0076】
(6)2−(4−エチニルフェニル)−5−ヘキシルチオフェンの合成
2−(4−(2’−トリメチルシリル)エチニルフェニル)−5−ヘキシルチオフェン(0.34g,1.0mmol),炭酸カリウム(0.71g,5.0mmol),THF(30ml)およびMeOH(30ml)混合物を室温で2日間攪拌した。溶媒を減圧下に除去し残存物をジエチルエーテルで抽出、水洗してMgSO4で乾燥した後、減圧下に濃縮した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.29g,収率:99%)。
【0077】
(7)1,4−ビス(4−(5−ヘキシルチオフェニル)フェニル−1−イル)ブタ−1,3−ジインの合成
DBU(0.06ml,0.41mmol),TMEDA(0.006ml,0.041 mmol),CuCl(0.006mmol,4.0mg)およびアセトニトリル(15ml)の混合物に酸素を5分間吹き込んだ後、2−(4−エチニルフェニル)−5−ヘキシルチオフェン(0.11g,0.41mmol)を添加して、室温で4h反応させた。
溶媒を減圧下に除き、残存物をジエチルエーテルで抽出、水洗後MgSO4で乾燥した後、溶媒を除去、粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し、再結晶して目的物(下記)を得た(73mg,66%)。
DSCの測定から、液晶相の転移挙動は、「Cr 126℃ N 200℃ Iso」であった。
【0078】
【化7】

【0079】
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.52-7.47 (m, 4H), 7.15 (d, J = 3.44 Hz, 1H), 6.74 (d, J = 3.64 Hz, 1H), 2.81 (t, J = 7.58 Hz, 2H), 1.70 (quant, J = 7.44 Hz, 2H), 1.43-1.29 (m, 6H), 0.90 (t, J = 6.96 Hz, 3H);
13C NMR (100MHz CDCl3, ppm) δ 147.04, 140.70, 135.62, 132.97, 125.31, 125.25, 123.68, 120.14, 82.16, 74.88, 31.57, 31.55, 30.33, 28.76, 22.54, 13.98
【0080】
(8)液晶性組成物の調製
上記で得られた1,4−ビス(4−(5−ヘキシルチオフェニル)フェニル−1−イル)ブタ−1,3−ジイン50質量%と1,4−ビス(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジイン50質量%とからなる液晶性組成物を調製し、複屈折を測定した。結果を図6に示す。
【0081】
[実施例5]
【化8】

【0082】
(略号)
n-BuLi n-ブチルリチウム
DIPEA ジイソプロピルエチルアミン
DMF ジメチルホルムアミド
MeOH メタノール,
MMACl メタクリロリルクロリド
Ph フェニル基
TBAF テトラブチルアンモニウム フルオライド
TBDMSCl tert-ブチルジメチルシリルクロリド
TEA トリエチルアミン
THF テトラヒドロフラン
TMS トリメチルシリル基
【0083】
(1)化合物1の合成
4−ヨードフェノール(5.5g,25.1mmol),6−ブロモ−1−ヘキサノール(5.0g,27.6mmol),炭酸カリウム(4.2g,30.1mmol)およびDMF(50ml)の混合物を還流温度で18h反応させた。減圧下に溶媒を除去し、残存物をジエチルエーテルで抽出して、水洗後MgSO4で乾燥し、ジエチルエーテルを留去した。残存物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理して化合物1を得た(8.1g,収率:99%)。
<スペクトルデータ>
1H NMR (400 MHz, CDCl3, ppm) δ 7.54 (d, J = 8.52 Hz, 2H), 6.67 (d, J = 8.56 Hz, 2H), 3.92 (t, J = 6.40 Hz, 2H), 3.67(q, J = 6.01 Hz, 2H), 1.79 (quint, J = 6.95 Hz,, 2H), 1.64-1.1.36 ( m, 6H), 1.26 (s, 1H).
【0084】
(2)化合物2の合成
アルゴンで脱気したTEA(20ml)およびトリメチルシリルアセチレン(5.5ml,40mmol)の混合物を、上記で得た化合物1(8.0g,25mmol),Pd(PPh3)4(0.58g,0.050mmol),CuI(95mg,0.050mmol)およびPPh3(0.13g,0.050mmol)の混合物に加え、45℃で2日間攪拌・反応させた。
反応混合物にジエチルエーテルを加え、不溶塩を濾過して除き塩酸水溶液、水で洗浄後、MgSO4で乾燥、ジエチルエーテルを留去し残存物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/2)処理して化合物2を得た(収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.34 (d, J = 8.32 Jz, 2H), 6.80 (d, J = 8.08 Hz, 2H), 4.12 (q, J = 7.41 Hz, 2H), 3.95 (t, J = 6.58 Hz, 2H), 1.82-1.75 (m, 2H), 1.64-1.1.39 ( m, 6H), 1.26 (s, 1H).
【0085】
(3)化合物3の合成
得られた化合物2(3.07g,14.1mmol),TBAF(16ml,16mmol)およびTHF(50ml)を15分間攪拌した後、溶媒を減圧下に除去した。残存物をジエチルエーテルで抽出し水洗、MgSO4.で乾燥してからジエチルエーテルを除去した。
残存物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理して化合物3を得た(化合物2に対する収率:68%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.41, (d, J = 8.76 Hz, 2H), 6.82 (d, J = 8.80 Hz, 2H), 3.96 (t, J = 6.52 Hz, 2H), 3.66 (t, J = 6.48 Hz, 2H), 2.99 (s, 1H), 1.80 (quint, J = 6.89 Hz, 2H), 1.64-1.35 (m, 6H), 1.29 (s, 1H)
【0086】
(4)化合物4の合成
化合物3(1.10g,5.00mmol)およびイミダゾール(0.45g,6.50mmol)をCH2Cl2(30mL)に溶解した溶液にtert−ブチル−ジメチル−シリルクロリド(0.98g,6.50mmol)を加え、室温で3h攪拌した。反応混合物をCH2Cl2で抽出し、水洗、MgSO4で乾燥後濃縮した。
粗生成物をシリカゲルを用いたフラッシュカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)で処理し化合物4を得た(収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.41, (d, J = 8.56 Hz, 2H), 6.82 (d, J = 8.76 Hz, 2H), 3.95 (t, J = 6.46 Hz, 2H), 3.61 (t, J = 6.48 Hz, 2H), 2.99 (s, 1H), 1.79 (quin, J = 6.90 Hz, 2H), 1.56-1.34 (m, 6H), 0.89 (s, 9H), 0.04 (s, 6H)
【0087】
(5)化合物5の合成
0℃で、四臭化炭素(6.6g,20mmol)をPPh3(10.5g,40mmol)を溶解したCH2Cl2溶液に加え15分間攪拌後、4−ヘキシロキシベンツアルデヒド(2.10g,10mmol)を加えた。3h後、メタノールを添加して反応を停止し、クロロホルムで抽出して有機層をチオ硫酸ナトリウム水溶液、塩化ナトリウム水溶液で洗浄しMgSO4で乾燥した。
減圧下に溶媒を留去後、シリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理して化合物5を得た(1.79g,収率:49%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.50, (d, J = 8.80 Hz, 2H), 7.40 (s, 1H), 6.88 (d, J = 7.68 Hz, 2H), 3.96 (t, J = 6.58 Hz, 2H), 1.78 (quin, J = 7.02 Hz, 2H), 1.49-1.29 (m, 6H), 0.91 (t, 3H).
【0088】
(6)化合物6の合成
化合物4(1.9g,5.7mmol)/THF(30mL)溶液を−78℃に冷却し、n−BuLi(2.2mL,2.6M,5.8mmol)を加え30分反応後、無水ZnCl2(0.79g,5.8mmol)/THF(15mL) 溶液を−78℃で加えた。15分間同温度に保った後30分以上かけて0℃に戻した。
この亜鉛を含む溶液に化合物5(2.0g,5.7mmol)を加えた溶液をPd(PPh3)4(0.33g,0.28mmol)/THF(5mL)に加えて0℃で2日間攪拌反応した。NH4Cl水溶液を添加して反応を停止し、ジエチルエーテルで抽出し、有機層をNaHCO3水溶液、飽和塩化ナトリウム水溶液で洗浄し.MgSO4で乾燥した。減圧下に濃縮し、シリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理し化合物6を得た。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.69 (d, J = 9.04, 2H), 7.41 (d, J = 8.56 Hz, 2H), 7.21 (s, 1H), 6.89 (d, J = 8.80, 2H), 6.85 (d, J = 8.76 Hz, 2H), 3.97 (q, J = 6.35 Hz, 4H), 3.62 (t, J = 6.46 Hz, 2H), 1.86-1.73 (m, 4H).
【0089】
(7)化合物7の合成
化合物6(1.60g,2.60mmol)/THF(20ml)溶液にアルゴン雰囲気下で1.0M/LのTBAF/THF溶液(4.80mL,4.80mmol)を加え、室温で1日反応させた。
有機層をクロロホルムで抽出し水洗後MgSO4で乾燥した。溶媒を除去し、シリカゲルカラムクロマトグラフィー(溶出液:クロロホルム/酢酸エチル/ヘキサン=1/1/1)処理し化合物7を得た(1.05g)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.44 (d, J = 8.80 Hz, 4H), 6.83 (d, J = 8.56 Hz, 4H),3.98-3.94 (m, 4H), 3.70-3.62 (m, 2H), 1.83-1.74 (m, 4H), 1.64-1.33 (m, 12H), 0.90 (t, J = 6.84 Hz, 3H).
【0090】
(8)化合物8の合成
化合物7(0.97g,2.30mmol)およびTEA(3.00ml,3.00mmol)/CH2Cl2(35ml)溶液にメタクリロイルクロリド(0.29ml,3.00mmol)を添加し室温で7h反応させた。
反応混合物をクロロホルムで抽出し有機層をMgSO4で乾燥した後溶媒を留去し、粗生成物をシリカゲルを用いたフラッシュカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/2)処理し化合物8(下記)を得た。1H−NMRスペクトルを図7に、DSCの測定結果を図8にそれぞれ示す。
【0091】
【化9】

【0092】
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.47-7.40 (m, 4H), 6.83 (dd, J = 9.04 and 2.44 Hz, 4H), 6.10 (s, 1H), 5.55 (s, 1H), 4.16 (t, J = 6.58 Hz, 2H), 3.98-3.94 (m, 4H), 1.94 (s, 3H), 1.82-1.67 (m, 6H), 1.53-1.31 (m, 10H), 0.91 (t, J = 6.72 Hz, 3H).
【0093】
[実施例6(1,4−ビス(5’−ヘキシル−2,2’−ビチオフェン−5−イル)ブタ−1,3−ジインの合成)]
【化10】

【0094】
(略号)
n-BuLi n-ブチルリチウム
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DIPEA ジイソプロピルエチルアミン
DMF ジメチルホルムアミド
MeOH メタノール
NBS N-ブロモコハク酸イミド
Ph フェニル基
TBAF テトラブチルアンモニウム フルオライド
THF テトラヒドロフラン
TMEDA N,N,N’,N’-テトラメチルエチレンジアミン
TMS トリメチルシリル基
【0095】
(1)5−ヘキシル−2,2’−ビチオフェンの合成
−78℃に冷却した2,2’−ビチオフェン(0.57g,3.43mmol)/THF(20ml)溶液にn−BuLi(1.30mL,2.6M/L,3.43mmol)/n−ヘキサン溶液を滴下し、同温度で1h反応させた後、1−ブロモヘキサン(0.48ml,3.43mmol)を加えてから室温までゆっくりと昇温し、12h反応させた。水を加えてからジエチルエーテルで抽出し、有機層をMgSO4で乾燥してから濃縮した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理して目的物を得た(0.78g,91%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.16-6.63 (m, 5H), 2.80-2.74 (m, 2H), 1.42-1.27 ( m, 6H), 0.89 (t, J = 6.34 Hz, 3H).
【0096】
(2)5−ブロモ−5’−ヘキシル−2,2’−ビチオフェンの合成
遮光下に、5−ヘキシル−2,2’−ビチオフェン(0.66g,2.63mmol)/DMF(10mL)溶液をNBS(0.56g,3.16mmol)に加え1h反応後、反応混合物を水洗し、ジエチルエーテルで抽出した。有機層をMgSO4で乾燥してから溶媒を除去した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:石油エーテル)処理し、目的とする白色固体を得た(0.46g,収率:53%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 6.93 (d, J = 3.68 Hz, 1H), 6.91 (d, J = 3.68 Hz, 1H), 6.83 (d, J = 3.68 Hz, 1H), 6.66 (d, J = 3.68 Hz, 1H), 2.77 (t, J = 7.56 Hz, 2H), 1.69-1.63 ( m, 2H), 1.41-1.26 (m, 6H), 0.89 (t, J = 6.96 Hz, 3H).
【0097】
(3)5−ヘキシル−5’−(2−トリメチルシリルエチニル)−2,2’−ビチオフェンの合成
5−ブロモ−5’−ヘキシル−2,2’−ビチオフェン(0.46g,1.39mmol),トリメチルシリルアセチレン(0.35ml,3.50mmol),N−ジイソプロピルエチルアミン(4.8ml),Pd(PPh3)4(80mg,0.070mmol),CuI(13mg,0.070mmol)およびTHF(10ml)を用いてSonogashiraクロスカップリング反応を行った後、常法に従って処理し、目的物を得た(収率:62%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.09 (d, J = 3.92 Hz, 1H), 6.98 (d, J = 3.44 Hz, 1H), 6.91 (d, J = 3.92 Hz, 1H), 6.67 (d, J = 3.64 Hz, 1H), 2.78 (t, J = 7.56 Hz, 2H), 1.67 (quin, J = 7.50 Hz, 2H), 1.42-1.27 (m, 6H), 0.89 (t, J = 6.82 Hz, 3H), 0.25 (s, 9H).
【0098】
(4)5−エチニル−5’−ヘキシル−2,2’−ビチオフェンの合成
5−ヘキシル−5’−(2−トリメチルシリルエチニル)−2,2’−ビチオフェン(0.29g,0.85mmol),炭酸カリウム(0.66g,4.78mmol),THF(30ml)およびMeOH(30ml)の混合物を3h反応させた後、溶媒を除去した。残存物をジエチルエーテルで抽出し、有機層を水洗、MgSO4で乾燥してから溶媒を除去した。
粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:ヘキサン)処理し、目的物を得た(0.23g,収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.15 (d, J = 3.88 Hz, 1H), 6.99 (d, J = 3.68 Hz, 1H), 6.93 (d, J = 3.64 Hz, 1H), 6.68 (d, J = 2.92 Hz, 1H), 3.38 (s, 1H), 2.79 (t, J = 7.70 Hz, 2H), 1.67 (quant, J = 7.38 Hz, 2H), 1.41-1.27 (m, 6H), 0.89 (t, J = 6.72 Hz, 3H).
【0099】
(5)1,4−ビス(5’−ヘキシル−2,2’−ビチオフェン−5−イル)ブタ−1,3−ジインの合成
5−エチニル−5’−ヘキシル−2,2’−ビチオフェン(0.23g,0.83mmol),DBU(0.12ml,0.83mmol),TMEDA(1.87μl,1.24μmol),CuCl(1.60mg,1.66μmol)およびアセトニトリル(20ml)を用いてGlacerカップリング反応を行った後、常法に従って処理し、目的物を得た(収率:90%)。
DSCの測定から液晶相挙動は次のようであった。
Cr 111.2℃ N 147.2℃ Iso
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.21 (d, J = 3.68, 1H), 7.02 (d, J = 3.44 Hz, 1H), 6.95 (d, J = 3.92 Hz, 1H), 6.69 (d, J = 3.16 Hz, 1H), 2.79 (t, J = 7.58 Hz, 2H), 1.67 (quin, J = 7.38 Hz, 2H), 1.45-1.25 (m, 6H), 0.89 (t, J = 6.34 Hz, 3H).;
13C NMR (100MHz CDCl3, ppm) δ146.82, 141.21, 135.37, 133.70, 125.03, 124.44, 122.69, 119.56, 78.81, 77.56, 35.51(35.51), 30.19, 28.72, 22.55, 14.08.;
【0100】
[実施例7(1−(4−ヘキシロキシフェニル)−4−(4’−ヒドロキシヘキシロキシフェニル)ブタ−1,3−ジインの合成)]
【化11】

【0101】
(略号)
n-BuLi n-ブチルリチウム
DIPEA ジイソプロピルエチルアミン
DMF ジメチルホルムアミド
MeOH メタノール
Ph フェニル基
TBAF テトラブチルアンモニウム フルオライド
TBDMS tert-ブチル ジメチルシリル
TEA トリエチルアミン
THF テトラヒドロフラン
TMEDA N,N,N’,N’-テトラメチルエチレンジアミン
TMS トリメチルシリル基
【0102】
(1)化合物1の合成
1−ヨードフェノール(5.5g,25.1mmol)、6−ブロモ−1−ヘキサノール(5.0g,27.6mmol),炭酸カリウム(4.2g,30.1mmol)およびDMF(50ml)の混合物を還流下に18h反応させた。減圧下に溶媒を除去した残存物をジエチルエーテルで抽出し、有機層を水洗後MgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理して目的物の化合物1を得た(8.1g,収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.54 (d, J = 8.52 Hz, 2H), 6.67 (d, J = 8.56 Hz, 2H), 3.92 (t, J = 6.40 Hz, 2H), 3.67(q, J = 6.01 Hz, 2H), 1.79 (quint, J = 6.95 Hz,, 2H), 1.64-1.1.36 ( m, 6H), 1.26 (s, 1H).
【0103】
(2)化合物2の合成
化合物1(8.0g,25mmol),Pd(PPh3)4(0.58g,0.050mmol),CuI(95mg,0.050mmol)およびPPh3(0.13g,0.050mmol)の混合物に、アルゴン雰囲気下でTEA(20ml)およびトリメチルシリルアセチレン(5.5ml,40mmol)を加え、45℃で2日間反応させたのち、 ジエチルエーテルを加え不溶塩を濾過で除き、塩酸水溶液および水で洗浄後、MgSO4で乾燥した
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/2)処理して目的物の化合物2を得た(収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm): δ 7.34 (d, J = 8.32 Jz, 2H), 6.80 (d, J = 8.08 Hz, 2H), 4.12 (q, J = 7.41 Hz, 2H), 3.95 (t, J = 6.58 Hz, 2H), 1.82-1.75 (m, 2H), 1.64-1.1.39 ( m, 6H), 1.26 (s, 1H).
【0104】
(3)化合物3の合成
化合物2(3.07g,14.1mmol),TBAF(16ml,16mmol)およびTHF(50ml)の混合物を室温で15分攪拌した後、溶媒を減圧下に除去した。得られた残存物をジエチルエーテルで抽出し、有機層を水洗後MgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/3)処理し目的物の化合物3を得た(収率:68%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.41, (d, J = 8.76 Hz, 2H), 6.82 (d, J = 8.80 Hz, 2H), 3.96 (t, J = 6.52 Hz, 2H), 3.66 (t, J = 6.48 Hz, 2H), 2.99 (s, 1H), 1.80 (quint, J = 6.89 Hz, 2H), 1.64-1.35 (m, 6H), 1.29 (s, 1H).
【0105】
(4)化合物4の合成
化合物3(1.10g,5.00mmol)、イミダゾール(0.45g,6.50mmol)/CH2Cl2(30mL)溶液にtert−ブチル−ジメチルシリル−クロリド(0.98g,6.50mmol)を加え、室温で3h反応した。反応混合物をCH2Cl2で抽出し、有機層を水洗後MgSO4で乾燥してから濃縮した。
粗生成物をシリカゲルを用いたフラッシュカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理して目的物の化合物4を得た(収率:99%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.41, (d, J = 8.56 Hz, 2H), 6.82 (d, J = 8.76 Hz, 2H), 3.95 (t, J = 6.46 Hz, 2H), 3.61 (t, J = 6.48 Hz, 2H), 2.99 (s, 1H), 1.79 (quin, J = 6.90 Hz, 2H), 1.56-1.34 (m, 6H), 0.89 (s, 9H), 0.04 (s, 6H).
【0106】
(5)化合物5の合成
トリフェニルホスヒン(10.5g,40mmol)/CH2Cl2溶液に四臭化炭素(6.6g,20mmol)を0℃で加えて15分攪拌し、4−ヘキシロキシベンツアルデヒド(2.10g,10mmol)を加えて3h反応させた後、メタノールを加えて反応を停止した。反応混合物をクロロホルムで抽出し、チオ硫酸ナトリウム水溶液および塩化ナトリウム飽和水溶液で洗浄しMgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理して目的物を得た(1.79g,収率:49%)。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.50, (d, J = 8.80 Hz, 2H), 7.40 (s, 1H), 6.88 (d, J = 7.68 Hz, 2H), 3.96 (t, J = 6.58 Hz, 2H), 1.78 (quin, J = 7.02 Hz, 2H), 1.49-1.29 (m, 6H), 0.91 (t, 3H).
【0107】
(6)化合物6の合成
−78℃で、化合物4(1.9g,5.7mmol)/THF(30mL)溶液にn−BuLi(2.2mL,2.6M/L,5.8mmol)を添加し、30分反応させた後、ZnCl2(0.79g,5.8mmol)/THF(15mL)溶液を同温度で加えて15分反応し、混合物を30分以上掛けて室温に戻した。
上記で調製した亜鉛を含む溶液に化合物5(2.0g,5.7mmol)を加えた溶液を、0℃でPd(PPh3)4(0.33g,0.28mmol)/THF(5mL)溶液を加えて、0℃で2日間反応させた。
NH4Cl水溶液を添加して反応を停止してからジエチルエーテルで抽出し、有機層をNaHCO3水溶液で洗浄してからMgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:酢酸エチル/ヘキサン=1/10)処理して目的物の化合物6を得た。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.69 (d, J = 9.04, 2H), 7.41 (d, J = 8.56 Hz, 2H), 7.21 (s, 1H), 6.89 (d, J = 8.80, 2H), 6.85 (d, J = 8.76 Hz, 2H), 3.97 (q, J = 6.35 Hz, 4H), 3.62 (t, J = 6.46 Hz, 2H), 1.86-1.73 (m, 4H).
【0108】
(7)化合物7の合成
化合物6(1.60g,2.60mmol)/THF(20ml)溶液にtetra−n−ブチルアンモニウムフルオライド(4.80mL,4.80mmol)/THF溶液を加え、室温で1日反応させた。反応混合物をクロロホルムで抽出し、抽出層を水洗後MgSO4で乾燥した。
溶媒を除去した粗生成物をシリカゲルカラムクロマトグラフィー(溶出液:クロロホルム/酢酸エチル/ヘキサン=1/1/1)処理して目的物の化合物7を得た。
<スペクトルデータ>
1H-NMR (400 MHz, CDCl3, ppm) δ 7.44, (d, J = 8.80 Hz, 4H), 6.83 (d, J = 8.56 Hz, 4H),3.98-3.94 (m, 4H), 3.70-3.62 (m, 2H), 1.83-1.74 (m, 4H), 1.64-1.33 (m, 12H), 0.90 (t, J = 6.84 Hz, 3H).
【0109】
[実施例8(1,4−ビス(4−ブチルチオフェニル−1−イル)ブタ−1,3−ジインの合成)]
【化12】

【0110】
(略号)
DBU 1,8-ジアザビシクロ[5.4.0]ウンデカ-7-エン
DIPEA ジイソプロピルエチルアミン
MeOH メタノール
Ph フェニル基
THF テトラヒドロフラン
TMEDA N,N,N’,N’-テトラメチルエチレンジアミン
TMS トリメチルシリル基
【0111】
(1)化合物1の合成
4−ブロモベンゼンチオール(0.50g,2.64mmol),水素化ナトリウム(0.21g,3.43mmol)およびTHF(15ml)の混合物を室温で10分攪拌した後、1−ヨードブタン(0.45ml,4.0mmol)を加え、1日還流下に反応させた。減圧下に溶媒を除去し、残存物をジエチルエーテルで抽出し有機層を水洗しMgSO4で乾燥した後、溶媒を除去し、粗生成物をシリカゲルカラムクロマトグラフィー処理して目的物の化合物1を得た(収率:99%)。
【0112】
(2)化合物2の合成
磁気攪拌子を入れ還流冷却器および3方コックを付した丸底フラスコに、Pd(PPh3)4(0.16g,0.14mmol)、CuI(27 mg,0.14mmol)およびPPh3(037mlg,0.16mmol)を入れアルゴンで置換した後、ジイソプロピルエチルアミン(5ml),トリメチルシリルアセチレン(0.63ml,4.6mmol)および化合物1(0.70g,2.85mmol)を添加して、45℃で1日反応させたのち、ジエチルエーテルを加え、不溶塩を濾過して除いた溶液を塩酸水溶液および水で洗浄した。
有機層をMgSO4で乾燥した後、溶媒を除去して得た粗生成物をシリカゲルカラムクロマトグラフィー処理して目的物の化合物2を得た(収率:99%)。
【0113】
(3)化合物3の合成
化合物2(0.67g,2.55mmol),炭酸カリウム(1.77g,12.8mmol),THF(20ml)およびMeOH(20ml)の混合物を室温で30分攪拌した後、減圧下に溶媒を除き、残存物をジエチルエーテルで抽出した。有機層を水洗しMgSO4で乾燥してから溶媒を減圧下に除去して得られた粗生成物をシリカゲルカラムクロマトグラフィー処理して目的物の化合物3を得た(収率:87%)。
【0114】
(4)化合物4の合成
DBU(0.31ml,2.05mmol),TMEDA 0.030ml,0.20mmol),CuCl(10mg,0.10mmol)およびアセトニトリル(20ml)の混合物に酸素を5分吹き込んだ後、化合物3(0.39g,2.05mmol)を加え、室温で3h反応させた。溶媒を減圧下に除去し、得られた残存物ジエチルエーテルで抽出し、有機層を水洗、MgSO4で乾燥し溶媒を除去した。
得られた粗生成物をシリカゲルカラムクロマトグラフィー処理し、メタノールで再結晶して目的物の化合物4を得た(収率:89%)。
【0115】
(5)液晶性組成物の調製
上記で得られた1,4−ビス(4−ブチルチオフェニル−1−イル)ブタ−1,3−ジイン50質量%と1,4−ビス(4−ヘキシロキシフェニル−1−イル)ブタ−1,3−ジイン50質量%とからなる液晶性組成物を調製し、複屈折を測定した。結果を図9に示す。
【産業上の利用可能性】
【0116】
本発明のジアセチレン誘導体は発現する屈折率異方性が大きく、優れた性能を有する光学および電子光学的デバイス、例えば液晶表示素子を構成する材料として有用であり、応答性向上に寄与するものである。
【特許請求の範囲】
【請求項1】
下記の一般式(A)で表されるジアセチレン誘導体。
R1-Sp1-(Ar1)p-(Ar3)q-(Phe)r-C≡C-C≡C-(Phe)r-(Ar4)q-(Ar2)p-Sp2-R2 (A)
(式中、R1およびR2は、互いに独立して、水素原子、ハロゲン原子、シアノ基、イソチオシアネート基、あるいは炭素原子1ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基若しくは反応性基により一置換若しくは多置換されたアルキル基、炭素原子2ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基若しくは反応性基により一置換若しくは多置換されたアルケニル基若しくはアルキニル基、または反応性基を表わし、ここで1個以上の非隣接−CH2−基は−O−、−CO−、−COO−および/または−OCO−により置換されていてもよく、Sp1およびSp2は互いに独立して、−O−、−S−、−CO−、−COO−、−OCO−、−OCO−O−、−CO−NR3−、−NR3−CO−、−O(CH2)n−、−(CH2)nO−、−CH=CH−COO−、−OCO−CH=CH−、−(CH2)m−、−(SiR4R5−O)n−または単結合であり、ここでmおよびnは独立して1〜10の整数を表し、R3、R4およびR5は水素原子または炭素数1〜4のアルキル基を表し、Ar1およびAr2は、互いに独立して、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの芳香族の炭素環式または複素環式基であり、縮合環を含んでいてもよく、Ar3およびAr4は、互いに独立して、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの複素環式基であり、縮合環を含んでいてもよく、単結合で連結された複数の複素環式基でもよく、Pheは、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された1,4−フェニレン基を表し、p、qおよびrは、それぞれ0または1である。)
【請求項2】
下記の一般式(1)で表される化合物であることを特徴とする請求項1に記載のジアセチレン誘導体。
R1−Sp1−Ar1−Phe−C≡C−C≡C−Phe−Ar2−Sp2−R2 (1)
【請求項3】
下記の一般式(2)で表される化合物であることを特徴とする請求項1に記載のジアセチレン誘導体。
R1−Sp1−Ar3−C≡C−C≡C−Ar4−Sp2−R2 (2)
【請求項4】
下記の一般式(3)で表される化合物であることを特徴とする請求項1に記載のジアセチレン誘導体。
R1−Sp1−Phe−C≡C−C≡C−Phe−Sp2−R2 (3)
【請求項5】
前記の反応性基が、ヒドロキシル基、カルボキシル基、酸無水物基、マレイミド基、ビニロキシ基、オキシラニル基、オキセタニル基、ビニル基、(メタ)アクリレート基、またはシリル基であることを特徴とする請求項1〜4のいずれかに記載のジアセチレン誘導体。
【請求項6】
前記のAr1およびAr2が、フラン−2,5−ジイル基、チオフェンー2,5−ジイル基、ピロール−2,5−ジイル基、1,4−フェニレン基、ナフタレン−2,6−ジイル基、ピリジン−2,5−ジイル基、ピリミジン−2,5−ジイル基、またはインダン−2,5−ジイル基であることを特徴とする請求項1または2に記載のジアセチレン誘導体。
【請求項7】
前記のAr3およびAr4が、フラン−2,5−ジイル基、チオフェン−2,5−ジイル基、ピロール−2,5−ジイル基、ピリジン−2,5−ジイル基、またはピリミジン−2,5−ジイル基であることを特徴とする請求項1または3に記載のジアセチレン誘導体。
【請求項8】
請求項1〜4のいずれかに記載のジアセチレン誘導体の1種又2種以上を含む液晶性組成物。
【請求項9】
光学用又は電気光学用として用いることを特徴とする請求項1〜7のいずれかに記載のジアセチレン誘導体。
【請求項10】
光学用又は電気光学用として用いることを特徴とする請求項8に記載の液晶性組成物。
【請求項1】
下記の一般式(A)で表されるジアセチレン誘導体。
R1-Sp1-(Ar1)p-(Ar3)q-(Phe)r-C≡C-C≡C-(Phe)r-(Ar4)q-(Ar2)p-Sp2-R2 (A)
(式中、R1およびR2は、互いに独立して、水素原子、ハロゲン原子、シアノ基、イソチオシアネート基、あるいは炭素原子1ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基若しくは反応性基により一置換若しくは多置換されたアルキル基、炭素原子2ないし15個を有して非置換又はハロゲン原子、シアノ基、トリフルオロメチル基若しくは反応性基により一置換若しくは多置換されたアルケニル基若しくはアルキニル基、または反応性基を表わし、ここで1個以上の非隣接−CH2−基は−O−、−CO−、−COO−および/または−OCO−により置換されていてもよく、Sp1およびSp2は互いに独立して、−O−、−S−、−CO−、−COO−、−OCO−、−OCO−O−、−CO−NR3−、−NR3−CO−、−O(CH2)n−、−(CH2)nO−、−CH=CH−COO−、−OCO−CH=CH−、−(CH2)m−、−(SiR4R5−O)n−または単結合であり、ここでmおよびnは独立して1〜10の整数を表し、R3、R4およびR5は水素原子または炭素数1〜4のアルキル基を表し、Ar1およびAr2は、互いに独立して、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの芳香族の炭素環式または複素環式基であり、縮合環を含んでいてもよく、Ar3およびAr4は、互いに独立して、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された炭素数16までの複素環式基であり、縮合環を含んでいてもよく、単結合で連結された複数の複素環式基でもよく、Pheは、非置換またはハロゲン原子、シアノ基、トリフルオロメチル基、メチル基、エチル基、メトキシ基若しくはエトキシ基により一置換若しくは多置換された1,4−フェニレン基を表し、p、qおよびrは、それぞれ0または1である。)
【請求項2】
下記の一般式(1)で表される化合物であることを特徴とする請求項1に記載のジアセチレン誘導体。
R1−Sp1−Ar1−Phe−C≡C−C≡C−Phe−Ar2−Sp2−R2 (1)
【請求項3】
下記の一般式(2)で表される化合物であることを特徴とする請求項1に記載のジアセチレン誘導体。
R1−Sp1−Ar3−C≡C−C≡C−Ar4−Sp2−R2 (2)
【請求項4】
下記の一般式(3)で表される化合物であることを特徴とする請求項1に記載のジアセチレン誘導体。
R1−Sp1−Phe−C≡C−C≡C−Phe−Sp2−R2 (3)
【請求項5】
前記の反応性基が、ヒドロキシル基、カルボキシル基、酸無水物基、マレイミド基、ビニロキシ基、オキシラニル基、オキセタニル基、ビニル基、(メタ)アクリレート基、またはシリル基であることを特徴とする請求項1〜4のいずれかに記載のジアセチレン誘導体。
【請求項6】
前記のAr1およびAr2が、フラン−2,5−ジイル基、チオフェンー2,5−ジイル基、ピロール−2,5−ジイル基、1,4−フェニレン基、ナフタレン−2,6−ジイル基、ピリジン−2,5−ジイル基、ピリミジン−2,5−ジイル基、またはインダン−2,5−ジイル基であることを特徴とする請求項1または2に記載のジアセチレン誘導体。
【請求項7】
前記のAr3およびAr4が、フラン−2,5−ジイル基、チオフェン−2,5−ジイル基、ピロール−2,5−ジイル基、ピリジン−2,5−ジイル基、またはピリミジン−2,5−ジイル基であることを特徴とする請求項1または3に記載のジアセチレン誘導体。
【請求項8】
請求項1〜4のいずれかに記載のジアセチレン誘導体の1種又2種以上を含む液晶性組成物。
【請求項9】
光学用又は電気光学用として用いることを特徴とする請求項1〜7のいずれかに記載のジアセチレン誘導体。
【請求項10】
光学用又は電気光学用として用いることを特徴とする請求項8に記載の液晶性組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−167068(P2012−167068A)
【公開日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願番号】特願2011−30115(P2011−30115)
【出願日】平成23年2月15日(2011.2.15)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度、独立行政法人科学技術振興機構産学イノベーション加速事業(戦略的イノベーション創出推進)高分子ナノ配向制御による新規デバイス技術の開発、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【出願人】(000004444)JX日鉱日石エネルギー株式会社 (1,898)
【Fターム(参考)】
【公開日】平成24年9月6日(2012.9.6)
【国際特許分類】
【出願日】平成23年2月15日(2011.2.15)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成22年度、独立行政法人科学技術振興機構産学イノベーション加速事業(戦略的イノベーション創出推進)高分子ナノ配向制御による新規デバイス技術の開発、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(304021417)国立大学法人東京工業大学 (1,821)
【出願人】(000004444)JX日鉱日石エネルギー株式会社 (1,898)
【Fターム(参考)】
[ Back to top ]

