分析チップおよび溶液の攪拌方法
【課題】本発明は、微粒子を用いて被検物質が含まれた溶液を攪拌する際に、微粒子を反応溶液中で局在化しない様に配置させることで、反応溶液全体を均一に撹拌することが可能な分析チップおよび溶液の攪拌方法を提供する。
【解決手段】表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に封入された、溶液を攪拌するための微粒子と、を含む分析チップであって、該空隙内の該容器表面上に、該微粒子が局在化することなく配置されるための区画構造を有する分析チップ。
【解決手段】表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に封入された、溶液を攪拌するための微粒子と、を含む分析チップであって、該空隙内の該容器表面上に、該微粒子が局在化することなく配置されるための区画構造を有する分析チップ。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、被検物質と選択的に結合する物質を固定化した担体を備え、被検物質を含む溶液と選択結合性物質とを選択的に結合させて、担体上に選択結合性物質を介して結合した被検物質を分析するための分析チップおよび溶液の攪拌方法に関する。
【背景技術】
【0002】
各種生物の遺伝情報解析の研究が始められており、ヒト遺伝子をはじめとして、多数の遺伝子とその塩基配列、また遺伝子配列にコードされる蛋白質およびこれら蛋白質から二次的に作られる糖鎖に関する情報が急速に明らかにされつつある。配列の明らかにされた遺伝子、蛋白質、糖鎖などの高分子体の機能は、各種の方法で調べることができる。例えば、核酸は、ノーザンブロッティング、あるいはサザンブロッティングのような、各種の核酸/核酸間の相補性を利用して、各種遺伝子とその生体機能発現との関係を調べることができる。蛋白質は、ウエスタンブロッティングに代表される蛋白質/蛋白質間の反応を利用し蛋白質の機能および発現について調べることができる。
【0003】
近年、多数の遺伝子発現を一度に解析する手法として、DNAマイクロアレイ法(DNAチップ法)と呼ばれる新しい分析法が開発され、注目を集めている。この方法は、核酸/核酸間ハイブリダイゼーション反応に基づく核酸検出・定量法である点で原理的には上記の従来の方法と同じである。このDNAチップ法は、蛋白質/蛋白質間あるいは糖鎖/糖鎖間や糖鎖/蛋白質間の特異的な反応に基づく蛋白質や糖鎖検出・定量に応用が可能である。この技術は、マイクロアレイ又はDNAチップと呼ばれるガラスの平面基板片上に、多数のDNA断片や蛋白質、糖鎖が高密度に整列固定化されたものが用いられている点に大きな特徴がある。
【0004】
DNAチップ法の具体的使用法としては、例えば、研究対象細胞の発現遺伝子等を蛍光色素等で標識したサンプルを平面基板片上でハイブリダイゼーションさせ、互いに相補的な核酸(DNAあるいはRNA)同士を結合させ、その箇所を高解像度検出装置(スキャナー)で高速に読みとる方法や、電気化学反応にもとづく電流値等の応答を検出する方法が挙げられる。このようして、サンプル中のそれぞれの遺伝子量を迅速に推定できる。また、DNAチップの応用分野は、発現遺伝子の量を推定する遺伝子発現解析のみならず、遺伝子の一塩基置換(SNP)を検出する手段としても大きく期待されている。
【0005】
現在、DNAチップは、チップ上に数千から数万種類の多数の遺伝子を載せ、一度に多種類の遺伝子の発現を調べる研究用として使用されていることが多い。今後、診断用途でDNAチップが使用されることが期待されている。DNAチップを診断用途として使用する場合、一般に採取できる被検物質量が非常に少ないことがあり、その場合、現行のDNAチップでは感度が十分ではないため、被検物質の測定が困難であることがある。また、発現量の少ない遺伝子では、ハイブリダイゼーション後に得られる蛍光シグナル強度が非常に微弱であるため、このような遺伝子は実質上解析できないこともある。以上のように、従来のDNAチップでは、被検物質の量が少ない場合や発現量の少ない遺伝子の場合、ハイブリダイゼーション後の蛍光シグナル強度をいかに大きくするかということが課題である。
【0006】
この課題を解決するためには、被検物質であるDNAとプローブDNAとをいかに効率よく反応させるかが1つのポイントとなる。被検物質であるDNAとプローブDNAを効率よく反応させる方法として、被検物質の自然拡散では不十分であるため、溶液を人為的に攪拌し、効率よくプローブDNAと被検物質であるDNAとの反応を促進することが考えられている。
【0007】
被検物質が含まれた溶液を攪拌する例として、特許文献1には、微粒子または気泡を混合した被検物質が含まれた溶液を、被検物質と反応する選択結合性物質を固定化させた担体に接触させ、被検物質が含まれた溶液を、容器を用いてシーリングし、微粒子または気泡を移動させることにより被検物質の溶液を攪拌して、被検物質との反応効率を上げ、ハイブリダイゼーション後のシグナル強度を大きくする方法が開示されている。
【0008】
また、特許文献2には、選択結合性物質が固定化された凸部をマトリクス状に形成させた複数のサブブロック領域を構成させ、サブブロック領域内の凹部とサブブロック領域間の凹部を微粒子またはマイクロロッドが移動することにより被検物質が含まれた溶液を攪拌させて、被検物質との反応効率を上げる方法が開示されている。このサブブロック領域間の凹部の幅は、サブブロック領域内の凹部の幅よりも広い構造を有している。
【0009】
さらに、特許文献3、特許文献4には、被検物質が含まれた溶液中で磁気ビーズを磁力により動かすことで、被検物質の溶液を撹拌し、被検物質との反応効率を上げる方法が開示されている。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】国際公開第2005/090997号パンフレット
【特許文献2】特開2007−212446号公報
【特許文献3】特開2003−248008号公報
【特許文献4】特開2003−339375号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
上記特許文献1で開示されている分析チップでは、選択結合性物質が固定化されている部分に微粒子が接触しないように担体または容器に特別の構造を設ける必要があり、また使用できる微粒子の大きさを担体または容器の構造に適合させる必要がある。
【0012】
特許文献2で開示されている分析チップは、微粒子またはマイクロロッドが移動するための担体上の領域として、サブブロック領域内での凹部の他に、サブブロック領域間により広い凹部が設けられた構造を有している。そのため、微粒子またはマイクロロッドは、サブブロック領域内の凹部よりも、サブブロック領域間にあるより広い凹部を優先的に移動する可能性があり、攪拌時に微粒子またはマイクロロッドが担体の一部に局在化し(担体の全体に分散せず)、攪拌が不均一となる可能性がある。
【0013】
特許文献3および特許文献4で開示されている分析チップでは、攪拌用の複数の磁気ビーズが磁気により凝集して大きな塊となり、攪拌効率が低下したり、攪拌が不均一となる可能性がある。
【0014】
本発明は、分析チップにおいて、微粒子を用いて被検物質を含む溶液を攪拌する際に、攪拌用の微粒子が反応溶液中で局在化しないように配置させる、換言すれば、微粒子が反応溶液で満たされた選択結合性物質が固定化された担体の領域全体に分散(拡散)するようにすることで、反応溶液全体を均一に撹拌して反応ムラを低減し、その結果分析精度や再現性を高めることが可能な分析チップおよび溶液の攪拌方法を提供することにある。
【課題を解決するための手段】
【0015】
本発明は、分析チップの容器表面に、微粒子が反応溶液で満たされた選択結合性物質が固定化された担体の領域全体に分散(拡散)させ、一部に局在化することなく配置されるための区画構造を設けることにより、上記課題を解決した。
【0016】
すなわち、本発明は、以下の構成からなる。
[1]表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に格納された、溶液を攪拌するための微粒子と、を含む分析チップであって、該容器表面に、溶液を攪拌するときに該微粒子が局在化することなく配置されるための区画構造を有する分析チップ。
[2]区画構造が突起構造である、[1]に記載の分析チップ。
[3]区画構造が凹陥構造である、[1]に記載の分析チップ。
[4]表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に格納された、溶液を攪拌するための微粒子と、を含む分析チップを用いる溶液の攪拌方法であって、分析チップの該容器表面に、該微粒子が局在化することなく配置されるための区画構造を設けることを特徴とする、溶液の撹拌方法。
【発明の効果】
【0017】
本発明により、微粒子を用いて被検物質を含む溶液を攪拌して被検物質と固定化された選択結合性物質とを反応させる際に、微粒子が反応溶液中で局在化することなく選択結合性物質が固定化された担体全体に分散(拡散)した状態(ばらけた状態)で配置させることが可能になる。その結果、反応溶液全体を均一に撹拌することができるため、反応溶液全体の反応を均一に行わせること、すなわち担体全体での反応ムラを低減することが可能となる。その結果、分析の精度、再現性を高めることが可能となる。
【0018】
また、従来の分析チップでは、被検物質と固定化された選択結合性物質とを反応させる際に、分析チップ設置面の傾きのために球状の微粒子が該傾き方向に偏ってしまうことがあるため、分析チップを厳密に水平に設置する必要があったが、本発明の分析チップでは、容器表面に設けられた区画構造により攪拌時に微粒子をばらけた状態で配置させることが可能であるため、分析チップを設置するにあたり水平性を厳密に設定する必要がない。
【0019】
また、使用する微粒子のサイズに合わせて区画構造のサイズを設定できるため、微粒子サイズを所望のとおり任意に選択して使用することができる。。
【図面の簡単な説明】
【0020】
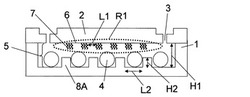
【図1】図1は、本発明の分析チップの一例を概略的に示す斜視図である。
【図2】図2は、図1に示される本発明の分析チップの一例を、矢印A1に沿った面で切断した断面図である。
【図3】図3は、図1に示される本発明の分析チップの一例を、矢印A1に沿った面で切断した断面図である。
【図4】図4は、図1および図2に示される本発明の分析チップの一例を、担体2を除いた状態で上方から見た外観図である。
【図5】図5は、図1および図3に示される本発明の分析チップの一例を、担体2を除いた状態で上方から見た外観図である。
【図6】図6は、図1に示される本発明の分析チップの一例を、矢印A1に沿った面で切断した断面図である。
【図7】図7は、図1に示される本発明の分析チップの一例を、矢印A1に沿った面で切断した断面図である。
【図8】図8は、図1および図6に示される本発明の分析チップ、あるいは図1および図7に示される本発明の分析チップの一例を、担体2を除いた状態で上方から見た外観図ある。
【図9】図9は、実施例及び比較例における、プローブDNAの固定化工程を示す概略図である。
【図10】図10は、実施例及び比較例で用いた分析チップの容器における、微粒子の分散度を評価するための8区分の領域を示す図である。
【図11】図11は、実施例及び比較例で用いた分析チップの担体における、スポット1〜8の位置を示す図である。
【発明を実施するための形態】
【0021】
本発明の分析チップは、表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に格納された、溶液を攪拌するための微粒子と、を含み、該容器表面に、該微粒子が局在化することなく配置されるための区画構造を備える。
【0022】
ここで、担体は、その表面に選択結合性物質が固定化された基材である。また、容器は、担体の選択結合性物質が固定化された表面を覆う基材であって、被検物質溶液を保持する空隙を形成する様に担体と接着されて使用される。また、区画構造は、空隙内に格納された微粒子が凝集することを防ぎ、空隙内でばらけて配置された状態を保持するための構造体として、容器表面上に設けられる。
【0023】
本発明の分析チップは、担体表面を重力方向に垂直な方向(水平方向)に向けて使用するものであり、担体上の選択結合性物質が固定化された表面を、下方(重力方向)に向けて使用できる。例えば、後述する図1〜8に例示する分析チップは、全て重力方向に垂直な方向(水平方向)に向けて使用する場合を示しており、選択結合性物質が固定化された表面は下方を向いており、この場合、容器は担体下部から覆設される。
【0024】
本発明の分析チップは、被検物質を含む溶液を当該チップにアプライし、被検物質の存在の有無や、被検物質の量や、被検物質の性状等を測定するために用いるチップである。具体的には、担体表面に固定化された選択結合性物質と被検物質との反応により、被検物質の量や、被検物質の有無を測定するバイオチップが挙げられる。具体的なバイオチップとしては、核酸を担体表面に固定化したDNAチップ、抗体に代表されるタンパク質を担体表面に固定化したタンパク質チップ、糖鎖を担体表面に固定化した糖鎖チップ、及び担体表面に細胞を固定化した細胞チップ等が挙げられる。
【0025】
まず、本発明の分析チップの具体的な態様について、図面を用いて例示する。
【0026】
図1に示す分析チップの例は、担体2の下部から容器1が覆設されている。図2、図3、図6、図7は、図1で示される分析チップのそれぞれ異なる態様であって、それぞれ図1の矢印A1方向に沿った面での断面図を示す。図4、図5は、それぞれ図2、図3で示される分析チップにおいて、担体2が設置されていない状態の分析チップを上方から見た外観を示す。図8は、図6、図7で示される分析チップにおいて、担体2が設置されていない状態の分析チップを上方から見た外観を示す。
【0027】
図2、図3、図6、図7の分析チップの例では、担体2と容器1とで、選択結合性物質が固定化された固定化領域R1を含む空隙5を形成しており、空隙5は、必要に応じて設けることのできる貫通孔3を介して外部と連通する他は、外部と連通しない閉じた空間となっている。図2、図6の担体1の表面は平面構造(選択結合性物質がその表面に固定化される平坦部6)を有しており、図3、図7の担体2の表面は凹凸構造(選択結合性物質がその表面に固定化される凸部9)を有している。また、図2、図3の容器1の表面には区画構造である複数の突起構造8Aが設けられており、微粒子4は、この突起構造の隙間に配置される。図6、図7の容器1の表面には区画構造である凹陥構造8Bが設けられており、微粒子4はこの凹陥構造の内部に収納される。
【0028】
ここで、本発明における容器について述べる。
【0029】
本発明の分析チップにおける容器には、微粒子によって反応溶液を攪拌する際に、反応溶液が満たされた容器の表面に微粒子が分散(拡散)し、その一部に局在化しないような手段として、区画構造が設けられる。この区画構造は、選択結合性物質が固定化された領域(R1)の全体を略均等にカバーするように設けられることが好ましい。ここで、微粒子が分散または拡散する状態とは、微粒子が容器表面の全体にばらばらに散らばって存在する状態を意味する。また、微粒子が局在化する状態とは、微粒子が容器表面の一部の限られた領域に偏って存在する状態を意味する。
【0030】
微粒子の分散度は、例えば、以下のような判定基準で評価することができる。分析チップの容器表面を複数の領域(例えば、図10に示すような2×4の8個の領域)に面積が略均等になるように区分けして、微粒子によって溶液を攪拌した後に、区分けされた個々の領域内にどれだけの量の微粒子が占有しているかどうかを評価する。ここで、容器表面において区分けされた領域は、実際に構造上設けられた領域ではなく、形式上区切られた領域である。分析チップに格納される微粒子の全量を、分析チップの容器表面上の約半分の面積を占める量に設定した場合には、容器表面を観察(例えば目視で観察)し、区分けした全ての領域において微粒子が容器表面の約半分の面積を占めている場合は、微粒子が分散された状態、いわゆる「局在化なし」と判定することができる。一方、区分けした領域のうち微粒子が占める面積が約半分に満たない状態の領域が1つ以上ある場合は、微粒子の「局在化あり」と判定することができる。
【0031】
本発明の分析チップの容器には、区画構造として、好ましくは以下に述べる突起構造または凹陥構造が設けられる。
【0032】
突起構造とは、容器表面上に設けられる区画構造であって、空隙内に格納された微粒子が容器表面上を移動する際に衝突する程度に容器表面から突出した構造である。突起構造は、微粒子が容器表面上を移動する際に衝突する形状を有する構造体であれば特に限定されない。突起構造は、容器表面上に複数設けられることが好ましく、この場合、微粒子は容器表面上に設けられた複数の突起構造の隙間に配置される。この複数の突起構造の隙間に配置された微粒子は、溶液を攪拌するための外場(磁場や重力や振動)を加えたときに、この突起構造が障壁となり、突起構造に衝突して跳ね返ることでランダムな動きが生じるため、微粒子は容器表面上で局在化せず、分散された状態が保持される。
【0033】
突起構造の配置の仕方としては、微粒子にランダムな動きを生じさせるように配置されていれば特に限定されないが、容器のどの領域においても微粒子に同程度のランダムな動きを生じさせるために、一定の繰り返しパターンで容器表面全体に配置されているのが好ましい。突起構造の間隔が広すぎると微粒子の分散度が低下するため好ましくなく、間隔が狭すぎると、使用できる微粒子のサイズが小さくなり、また微粒子の動きの自由度が低減することにより、撹拌効果が低下するため好ましくない。
【0034】
突起構造のサイズは、微粒子のサイズや微粒子が収納される空隙の容積を考慮して選択することができる。小さすぎると微粒子の衝突効率が低減し分散度が低下するため好ましくなく、大きすぎると空隙内に格納できる微粒子の量に制限が生じ、撹拌効果が低下するため好ましくない。
【0035】
突起構造の高さ(図2、図3のH2)としては、後述するような微粒子を用いる場合には、10μm以上、500μm以下が好ましく、50μm以上、300μm以下が特に好ましい。突起構造の高さがこれより低いと、微粒子が突起構造を乗り越えてしまい、微粒子を分散させにくくなる。また、突起構造の高さが500μm以上であると、分析チップにおける空隙の容積が増大し、この空隙を満たすために多量の検体溶液が必要となるため好ましくない。
【0036】
突起構造の形状は、微粒子が衝突してランダムな動きを生じさせる形状であれば特に限定されない。例えば、円柱状、楕円柱状、角柱状、円錐状、角錐状等が挙げられる。突起構造の具体的な態様としては、例えば図4、図5のような構造がある。図4では突起構造が円柱であり、図5では四角柱である。微粒子は容器表面上でこれら突起構造の隙間に配置され、外場(磁場や重力や振動)が加えられると、微粒子は突起構造に衝突ながら、空隙内を移動する。
【0037】
凹陥構造とは、容器表面上に設けられる区画構造であって、微粒子が納まる程度に容器表面より凹んだ構造である。凹陥構造は、微粒子を容器表面の一定の領域に納めてしまう構造体であれば特に限定されない。凹陥構造は、容器表面上に複数設けられることが好ましく、この場合、微粒子はこれら複数の凹陥構造の内部に略均等に収納される。この複数の凹陥構造に収納された微粒子は、外場(磁場や重力や振動)を加えると、この凹陥構造の内部を自由に移動する。基板表面上に複数の凹陥構造を略均等に偏りなく分布させて設けることにより、容器表面全体からみると、微粒子が分散された状態を保持することができる。
【0038】
凹陥構造の配置の仕方としては、基板表面上に複数の凹陥構造を略均等に偏りなく分布させて設けることが好ましく、一定の繰り返しパターンで容器表面全体に配置されていることがより好ましい。
【0039】
凹陥構造のサイズは、微粒子のサイズや微粒子が格納される空隙の容積を考慮して選択することができる。小さすぎると使用できる微粒子のサイズが小さくなり、また微粒子の動きの自由度が低減することにより、撹拌効果が低下するため好ましくない。
【0040】
凹陥構造の深さ(図6、図7のH3)としては、後述するような微粒子を用いる場合には、10μm以上、500μm以下が好ましく、50μm以上、300μm以下が特に好ましい。凹陥構造の深さがこれより深いと、微粒子が凹陥構造から外に飛び出てしまう可能性があり、微粒子を分散させにくくなる。また、凹陥構造の深さが500μm以上であると、分析チップにおける空隙の容積が増大し、この空隙を満たすために多量の検体溶液が必要となるため好ましくない。
【0041】
凹陥構造の形状は、微粒子が収納され、その内部で自由に移動できる形状であれば特に限定されない。例えば、円柱状、楕円柱状、角柱状に凹んだ形状等が挙げられる。凹陥構造の具体的な態様としては、例えば図8のような構造がある。図8では、凹陥構造が円柱状に凹んだ形状である。微粒子は容器表面上で凹陥構造の内部に収納され、外場(磁場や重力や振動)が加えられると、微粒子は凹陥構造の内部で自由に移動する。このような凹陥構造が容器表面上に略均等に分布するように一定の繰り返しパターンで複数設けられている。
【0042】
本発明の分析チップにおける容器は、担体に脱離可能に接着されていても、担体に脱離不可能に接着されていてもよい。容器が担体に脱離可能に接着されている場合は、被検物質とのハイブリダイゼーション反応を行った後、容器を脱離させ、担体のみをスキャナーにセットして蛍光等のシグナル強度を測定することができる。
【0043】
本発明の分析チップの容器の材質は、特に限定されるものではないが、好ましく用いられる容器の材質として、ガラス、ポリマー、あるいはこれらを組み合わせたもの等が挙げられる。上記のような突起構造や凹陥構造等の区画構造が設けられた容器は、例えば切削加工や射出成型法により容易に作製可能という点から、ポリマーが好ましい。ポリマーとしては、ポリスチレン、ポリメチルメタクリレート、ポリカーボネート等のポリマーを好ましく用いることが出来る。
【0044】
容器は、被検物質溶液をアプライした際に、溶液の様子を観察可能とするためには、透明な材料が好ましい。また、分析チップから容器を脱離させることなくスキャナーで読み取る分析チップにおいては、容器を透過して光を照射して検出する場合、容器の光が透過する部分は十分透明で、またノイズの要因となる自家蛍光を生じない材質であることが好ましい。
【0045】
本発明における微粒子の好ましい形状について述べる。
【0046】
本発明における微粒子の大きさ(微粒子の最大径)は、10μm以上のものが好ましい。微粒子の大きさが10μmより小さいと、溶液の抵抗により外場(磁場や重力や振動)を加えても微粒子がほとんど動かないことがあり、微粒子による攪拌効果が得られないことがある。微粒子の大きさは20μm以上がより好ましい。
【0047】
本発明の分析チップでは、溶液を攪拌することができれば、どのような形の微粒子も用いることができる。特に好ましくは、微粒子の形状は、球状、すなわちビーズである。微粒子が球状であると、回転により反応液中で滞ることなくスムーズに移動でき、検体溶液の攪拌が良好に行えるので好ましい。球状の微粒子として、好ましくは、直径が20μm〜500μmの球状微粒子(ビーズ)を用いることができる。直径がこの範囲であると、容易に重力、振動、旋回等による加速度などを加えることにより溶液中を移動でき、溶液の攪拌を十分に行うことができるため、良好な結果を得ることができる。
【0048】
本発明の分析チップでは、微粒子の材質としては特に限定されない。微粒子の材質としては、金属、ガラス、セラミック、ポリマー(ポリスチレン、ポリプロピレン、ナイロンなど)等を用いることができる。この中でも、比重が水よりも大きい材質(ガラス、石英、ジルコニアセラミック)が、重力や振動を加えることにより容易に溶液中を移動できるので好ましい。また、磁気ビーズを使用することも可能である。これらのうち、特に、ジルコニアセラミックからなる微粒子は、比重が大きいことから、重力、振動、旋回等による加速度などを加えることにより、移動が容易に行えることから最も好ましく用いることができる。また、ガラス、石英、ジルコニアセラミックは、検体溶液中に微粒子の成分が溶出することが少ないので好ましい。
【0049】
ジルコニアセラミック(イットリア安定化ジルコニア)からなる微粒子は、密度が6g/cm3程度であり、石英ガラスの2.2g/cm3などに比べて大きいので、攪拌効果がより発揮でき、容器でシーリングする際の溶液の動きに対してもビーズが舞い上がって動いてしまうことが少ないので、セッティングがより容易に行え、特に好ましい。
【0050】
本発明の分析チップでは、微粒子を移動させることによって溶液を撹拌する。好ましくは、重力、磁力(磁気ビーズの場合)、振動・振盪、旋回等による加速度などを加えることにより、またはこれらの組合せにより、微粒子を移動させる。
【0051】
これらの中でも、担体を水平又は水平に近い面に沿って旋回したり、上下や左右に振盪(素早く移動)したりして、加速度を加えることにより、溶液中の微粒子を動かす方法は、簡便に実施でき、十分な効果が得られることから好ましい。特に、担体を水平又は水平に近い面に沿って旋回(公転)させて加速度(遠心力)を加える方法が好ましい。この時の回転速度としては、100rpmから500rpmが好ましい。100rpm未満であると十分な撹拌が行われない場合があり、500rpmを超えると、分析チップから容器が剥がれてしまう可能性がある。特に好ましくは、200rpmから300rpmである。水平に近い方向とは、担体を回転させた場合に微粒子が分析チップの片側に寄らない程度の傾きを持たせた方向を意味し、例えば、水平面を基準として0度から3度の間が好ましい。
【0052】
また、前記微粒子においても、分析チップを解体することなくスキャナーで読み取る際、微粒子から自家蛍光が生じる場合には、その発光がノイズとなり検出精度の低下に繋がることがある。これを防ぎ、微粒子自身からの自家蛍光を低減させるために、光照射により発光を生じない物質を含有させたポリマーで、微粒子表面にコーティング等を施して被覆処理することにより表面を形成することが好ましい。このような微粒子を用いることにより、検出の際、微粒子からの自家蛍光を低減できる。
【0053】
選択結合性物質が固定化される担体について述べる。
【0054】
本発明の分析チップに用いる選択結合性物質が固定化された担体には、その表面形状が平面構造を有するものや凹凸構造を有するものを利用できる。表面が凹凸構造である担体を用いた場合、凹凸構造の凸部上面に選択性適合物質が固定化されていることが好ましい。
【0055】
本発明の分析チップで用いられる担体の材質は、特に限定されない。好ましく用いられる担体の材質は、ガラス又は各種のポリマー(例えばポリスチレン、ポリメチルメタクリレート、ポリカーボネート、ポリオレフィン)である。切削加工や射出成型法等により容易に作製可能という点から、ポリマーが好ましい。ポリマーとしては、ポリスチレン、ポリメチルメタクリレート、ポリカーボネート等のポリマーを好ましく用いることが出来る。
【0056】
本発明の分析チップにおいて、選択結合性物質を固定化するための担体表面は、官能基を含むポリマーであることが好ましい。官能基を含むポリマーで好ましいものとしては、例えば、ポリメチルメタクリレート(PMMA)、ポリエチルメタクリレート(PEMA)またはポリプロピルメタクリレートのポリメタクリル酸アルキル(PAMA)等がある。これらの中で特に好ましいものは、ポリメチルメタクリレートである。さらに、ポリ酢酸ビニル、ポリメタクリル酸シクロヘキシルまたはポリメタクリル酸フェニル等も用いることができる。
【0057】
官能基(カルボキシル基、エステル基、酸無水物)を含むポリマーを有する担体表面に選択結合性物質を固定化するためには、これに前処理を施して、例えば担体表面にカルボキシル基を形成させ、これを利用して選択結合性物質を共有結合させることが好ましい。担体表面にカルボキシル基を生成する手段としては、アルカリ、酸などで処理するほか、温水中での超音波処理、酸素プラズマ、アルゴンプラズマ、放射線に担体を晒す方法などが挙げられるが、担体の損傷が少なく、また、容易に実施できるという点から、アルカリ又は酸に担体を漬け込んで表面にカルボキシル基を生成させることが好ましい。具体的な例としては、水酸化ナトリウムや硫酸の水溶液(好ましい濃度は、1N〜20N)に担体を漬け込み、好ましくは30℃から80℃の温度にして、1時間から100時間の間保持すればよい。
【0058】
担体表面にカルボキシル基や酸無水物が存在する場合は、アミノ基や水酸基を有する選択結合性物質を担体表面に共有結合で固定化することが可能となる。担体表面にカルボキシル基がある場合には、これらの結合の反応を助長するため、ジシクロヘキシルカルボジイミド、N−エチル−5−フェニルイソオキサゾリウム−3’−スルホナート、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)などの様々な縮合剤を用いることができる。
【0059】
上記のような材質がポリマーである担体の作製は、射出成形方法やホットエンボス法などを適用することができる。特に射出成型法は大量生産が容易であることから好ましく用いることができる。
【0060】
本発明において、選択結合性物質とは、被検物質と直接的又は間接的に、選択的に結合し得る物質を意味し、代表的な例として、核酸、タンパク質、糖類及び他の抗原性化合物等を挙げることができる。
【0061】
選択結合性物質として、特に好ましいものは、核酸である。核酸は、DNA、RNA、PNAのいずれでもよい。特定の塩基配列を有する一本鎖核酸は、該塩基配列又はその一部と相補的な塩基配列を有する一本鎖核酸と選択的にハイブリダイズして結合するので、本発明でいう選択結合性物質に該当する。核酸の中でも、オリゴ核酸と呼ばれる、長さが10塩基から100塩基までの核酸は、合成機で容易に人工的に合成が可能であり、また核酸末端のアミノ基修飾が容易であるため、担体表面への固定化が容易となることから好ましい。さらに、20塩基未満ではハイブリダイゼーションの安定性が低いという観点から20〜100塩基がより好ましい。ハイブリダイゼーションの安定性を保持するため、特に好ましくは40〜100塩基の範囲である。
【0062】
また、タンパク質としては、抗体及びFabフラグメントやF(ab')2フラグメントのような、抗体の抗原結合性断片、並びに種々の抗原を挙げることができる。抗体やその抗原結合性断片は、対応する抗原と選択的に結合し、抗原は対応する抗体と選択的に結合するので、選択結合性物質に該当する。糖類としては、多糖類が好ましく、種々の抗原を挙げることができる。また、タンパク質や糖類以外の抗原性を有する物質を選択結合性物質として固定化することもできる。
【0063】
本発明に用いる選択結合性物質は、市販のものでもよく、また、生細胞などから得られたものでもよい。
【0064】
被検物質を含む溶液は、例えば図1〜図8に例示する分析チップの場合、貫通孔3から空隙内にアプライすることができる。分析チップに複数の貫通孔を設けることで、被検物質を含む溶液をアプライする際、気泡の流入を抑制することができ、操作性が向上する。
【0065】
本発明では、被検物質として、測定すべき核酸、例えば、病原菌やウイルス等の遺伝子や、遺伝病の原因遺伝子等並びにその一部分、抗原性を有する各種生体成分、病原菌やウイルス等に対する抗体等を挙げることができるが、これらに限定されるものではない。本発明では、これらの被検物質を含む溶液としては、血液、血清、血漿、尿、便、髄液、唾液、各種組織液等の体液や、各種飲食物並びにそれらの希釈物等を挙げることができるがこれらに限定されるものではない。被検物質となる核酸は、血液や細胞から常法により抽出した核酸を標識してもよいし、該核酸を鋳型として、PCR等の核酸増幅法によって増幅したものであってもよい。核酸を鋳型として、PCR等の核酸増幅法によって増幅したものの場合には、測定感度を大幅に向上させることが可能である。核酸増幅産物を被検物質とする場合には、蛍光物質等で標識したヌクレオチド三リン酸の存在下で増幅を行うことにより、増幅核酸を標識することが可能である。また、被検物質が抗原又は抗体の場合には、被検物質である抗原や抗体を常法により直接標識してもよい。被検物質である抗原又は抗体を選択結合性物質と結合させた後、担体を洗浄し、該抗原又は抗体と抗原抗体反応する標識した抗体又は抗原を反応させ、担体に結合した標識を測定することもできる。
【0066】
担体上の選択結合性物質に被検物質とを接触させて相互作用させ、被検物質と選択結合性物質とを選択的に結合させる(ハイブリダイゼーション反応)させる工程は、従来と全く同様に行うことができる。反応温度及び時間は、ハイブリダイズさせる核酸の鎖長や、免疫反応に関与する抗原及び/又は抗体の種類等に応じて適宜選択されるが、核酸のハイブリダイゼーションの場合、通常、35℃〜70℃程度で1分間〜十数時間、免疫反応の場合には、通常、室温〜40℃程度で1分間〜数時間程度である。
【0067】
担体上に選択結合性物質を介して結合した被検物質量の測定は、従来の方法に従って行うことができる。例えば、被検物質と選択結合性物質とを選択的に結合させた後の分析チップ又は容器を脱離させた担体を、既存のスキャナー等の装置にセットし、蛍光等のシグナル強度を測定することによって行うことができる。
【実施例】
【0068】
本発明を以下の実施例によってさらに詳細に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0069】
実施例1
実施例1では、図2および図4に示される、選択結合性物質が平坦部6に固定化された担体2と、容器内部表面に円柱状の突起構造8Aを有する容器1とで構成される分析チップを作成し、評価を行った。
【0070】
(DNA固定化担体の作製)
公知の方法であるLIGA(Lithographie Galvanoformung Abformung)プロセスを用いて、射出成形用の型を作製し、射出成型法により、図2および図4に示す、貫通孔3を4つ有し、表面が平坦構造を有するPMMA製の担体2を得た。この実施例で用いたPMMAの平均分子量は5万であり、PMMA中には1重量%の割合で、カーボンブラック(三菱化学製 #3050B)を含有させており、担体は黒色である。担体の形状は、大きさが縦76mm、横26mm、厚み1mmであり、担体表面は平坦であった。
【0071】
次に上記のPMMA担体を10Nの水酸化ナトリウム水溶液に70℃で12時間浸漬した。これを、純水、0.1NのHCl水溶液、純水の順で洗浄し、担体表面にカルボキシル基を生成した。
【0072】
(プローブDNAの固定化)
配列番号1で表される塩基配列を有するDNA(60塩基、5’末端アミノ化)を合成した。このDNAは5’末端がアミノ化されている。
【0073】
このDNAを、純水に0.3nmol/μLの濃度となるよう溶解させて、ストックソリューションとした。担体に点着する際は、PBS(NaClを8g、Na2HPO4・12H2Oを2.9g、KClを0.2g、KH2PO4を0.2g純水に溶かし1LにメスアップしたものにpH調整用の塩酸を加えたもの、pH5.5)で10倍希釈して、プローブDNAの終濃度を0.03nmol/μLとし、かつ、担体表面のカルボン酸とプローブDNAの末端のアミノ基とを縮合させるため、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)を加え、この終濃度を50mg/mLとした。そして、これらの混合溶液をアレイヤー(日本レーザー電子製;Gene Stamp−II)で担体表面上に256(16×16)スポットした。次いで、担体を密閉したプラスチック容器に入れて、37℃、湿度100%の条件で20時間程度インキュベートした。最後に純水で洗浄し、スピンドライヤーで遠心して乾燥した。この反応スキームを図9に示す。
【0074】
(液体を保持する容器)
射出成形法により、図2および図4に示す容器1を作製した。容器の形状は、大きさが縦17mm、横19.5mm、厚み1mmであり、容器の中央に、縦11.0mm、横13.5mm、深さ0.25mmの凹んだ部分が設けられており、この凹みの中に、直径0.15mm、高さ0.15mmの突起構造を256箇所設けた。そして、これを洗浄剤(クリーンエース(アズワンカタログ、品番:4−078−01)25倍希釈溶液)に浸漬して5分間超音波洗浄した後、逆浸透水(RO水)で十分にすすぎ、エアブローにより乾燥させた。
【0075】
(チップの組み立て)
プローブDNAを固定化した担体の領域を覆うように液体を保持する容器を配置し、担体と液体を保持する容器をPDMSポリマーにより接着した。接着条件は42℃、2時間である。
【0076】
(微粒子の調製と封入)
表面粗さが20nm、平均粒径が300μmの市販ジルコニア製微粒子(東レ株式会社製)を、炭化珪素質研磨材(粒度#20)を用い遠心式バレル研磨機で1時間、水中にて研磨を行い、水洗して乾燥した。前記微粒子の表面粗さは、Ra=165nmであった。かかる微粒子の表面粗さの測定は、その表面をAuで真空蒸着した後、走査型電子顕微鏡(株式会社エリオニクス製、型式ESA−2000)で表面粗さRa(nm)を測定した。前記表面粗さは、観察倍率を10,000倍、カットオフ値を0とし、任意の10個について測定し、その平均値を求めた。かかる微粒子の粒径は、実体顕微鏡で任意の100個以上の微粒子の画像を50〜150倍で撮影した後、画像処理解析ソフト(三谷商事社株式会社製、Win Roof)により円相当径を求めて平均値を算出し、それを平均粒径とした。その後エタノール溶液に浸漬し、超音波洗浄を5分間行った。さらに同様の洗浄を2回繰り返した。この微粒子を、担体の貫通孔から、容器表面上の突起構造の隙間に適切量封入した。適切量とは、分析チップの空隙内を半分程度埋め尽くす量であり、十分であることが分かっている。
【0077】
(被検物質DNAの調製)
被検物質DNAとして、上記DNA固定化担体に固定化されたプローブDNAとハイブリダイズ可能な配列番号4で表される塩基配列を持つDNA(968塩基、以下、配列番号4のDNAともいう)を用いた。調製方法を以下に示す。
【0078】
配列番号2で表される塩基配列を有するDNA(以下、配列番号2のDNAともいう)と配列番号3で表される塩基配列を有するDNA(以下、配列番号3のDNAともいう)を合成した。これを純水に溶解して濃度を100μMとした。次いで、pKF3 プラスミドDNA(タカラバイオ(株))(配列番号5で表される塩基配列を有するDNA:2246塩基)を用意して、これをテンプレートとし、配列番号2および配列番号3のDNAをプライマーとして、PCR反応(Polymerase Chain Reaction)により増幅を行った。
【0079】
PCRの条件は以下の通りである。すなわち、ExTaq 2μl、10×ExBuffer 40μl、dNTP Mix 32μl(タカラバイオ(株)製)、配列番号2のDNAの溶液を2μl、配列番号3のDNAの溶液を2μl、テンプレート(配列番号5で表される塩基配列を有するDNA)を0.2μl加え、純水によりトータル400μlにメスアップした。これらの混合液を、4つのマイクロチューブに分け、サーマルサイクラーを用いてPCR反応を行った。これを、エタノール沈殿により精製し、40μlの純水に溶解した。PCR反応後の溶液の一部をとり電気泳動で確認したところ、増幅したDNAの塩基長は、およそ960塩基であり配列番号4のDNA(968塩基)が増幅されていることを確認した。
【0080】
次いで、9塩基のランダムプライマー(タカラバイオ(株)製)を6mg/mlの濃度に溶かし、上記のPCR反応後精製したDNA溶液に2μl加えた。この溶液を100℃に加熱した後、氷上で急冷した。これらにKlenow Fragment(タカラバイオ(株)製)付属のバッファーを5μl、dNTP混合物(dATP、dTTP、dGTPの濃度はそれぞれ2.5mM、dCTPの濃度は400μM)を2.5μl加えた。さらに、Cy3−dCTP(GEヘルスケアバイオサイエンス製)を2μl加えた。この溶液に10UのKlenow Fragmentを加え、37℃で20時間インキュベートし、Cy3で標識された被検物質DNAを得た。なお、標識の際ランダムプライマーを用いたので、被検物質DNAの長さにはばらつきがある。最も長い被検物質DNAは配列番号4のDNA(968塩基)となる。なお、被検物質DNAの溶液を取り出して、電気泳動で確認したところ、960塩基に相当する付近にもっとも強いバンドが現れ、それより短い塩基長に対応する領域に薄くスメアがかかった状態であった。そして、これをエタノール沈殿により精製し、乾燥した。
【0081】
この標識化された被検物質DNAを、1重量%BSA(ウシ血清アルブミン)、5×SSC(5×SSCとは、20×SSC(シグマ製)を純水にて4倍に希釈した液を指す。同様に、20×SSCを純水で2倍に希釈した液を10×SSC、100倍に希釈した液を0.2×SSCと表記する)、0.1重量%SDS(ドデシル硫酸ナトリウム)、0.01重量%サケ精子DNAの溶液(各濃度はいずれも終濃度)、400μlに溶解し、ハイブリダイゼーション用のストック溶液とした。
【0082】
以下の実施例、比較例において、ハイブリダイゼーション用の被検物質DNA溶液は、特に断りのない限り、上記で調製したストック溶液を、1重量%BSA、5×SSC、0.01重量%サケ精子DNA、0.1重量%SDSの溶液(各濃度はいずれも終濃度)で200倍に希釈したものを用いた。なお、この溶液の被検物質DNA濃度を測定したところ、3ng/μLであった。
【0083】
(ハイブリダイゼーション)
マイクロピペットを用いて、担体と容器とで囲まれた空隙(空間)5に上記で調製したハイブリダイゼーション用の被検物質溶液を貫通孔3からあふれないように注入した。封止材としてシリコンテープ(アズワン)を用い、4つの貫通孔を塞いだ。ハイブリダイゼーションチャンバー(Takara Hybridization chamber(タカラバイオ(株))をシート振盪台(東京理化器械(株)製 MMS FIT−S)に密着させて固定し、担体をハイブリダイゼーションチャンバー内にセットした。このとき、担体をセットする位置の両端の凹みに、15μLずつ超純水を滴下した。ハイブリダイゼーションチャンバーのふたを閉めて6本の固定ネジを締めて固定後、42℃に設定した恒温チャンバー(東京理化器械(株)製 FMS−1000)内に据え付けた振盪機(東京理化器械(株)製 MMS−310)の上に載せて固定した。恒温チャンバーの前面をアルミホイルで遮光して、250回転/分で旋回振盪しながら、42℃で16時間インキュベートした。インキュベート後、ハイブリダイゼーションチャンバーから担体を取り出し、溶液を保持する容器を剥がし、PDMSポリマーを脱離した後、微粒子を除いて担体を洗浄、乾燥した。
【0084】
(測定)
インキュベート後、担体から容器を剥がす前に、DNAチップの空隙内の容器表面における微粒子の分散度について、目視検査を行った。分散度は、以下の基準で評価した。分析チップに格納されている微粒子の全量は、分析チップの容器表面を約半分埋め尽くす量である。図10に示すように、分析チップの容器表面を区分線11(破線)で示すように8等分に区分けし、区分けされた各領域において微粒子によって占められた面積の割合を目視にて観察した。全ての領域において微粒子が約半分の面積を占めている場合は、微粒子の局在化なしと判定した。一方、区分けされた領域のうち微粒子が占める面積が約半分に満たない状態の領域が1つ以上ある場合は、微粒子の局在化ありと判定した。
【0085】
微粒子の分散度を評価した後、DNAチップ用のスキャナー(Axon Instruments社製 GenePix 4000B)に、容器を剥がした後の担体をセットし、レーザー出力33%、フォトマルチプライヤーの電圧設定を450にした状態で蛍光強度の測定を行った。ここでは、担体上のプローブDNAを固定化した8箇所の領域(スポット1〜8)の蛍光強度を測定して、検体DNAとプローブDNAとのハイブリダイゼーション結果を評価した。蛍光強度とはスポット内の蛍光強度の平均値である。測定対象のスポット1〜8は、図11に示すように、担体上の4隅に位置する4つのスポット(スポット1〜4)と、中心部に位置する4つのスポット(スポット5〜8)の合計8つのスポットである。結果を表1に示す。
【0086】
ハイブリダイゼーション反応後、空隙内における微粒子の分散度を目視検査した結果、空隙内の8つの領域各々において、微粒子により半分程度埋め尽くされていた。この結果から、微粒子は空隙内で局在化することなく、空隙内全体に分散して存在していることが確認できた。
【0087】
スポット1〜8における蛍光強度は、全てにおいて同程度の十分な蛍光強度が得られた。この結果から、スポットの位置による反応のむらは発生せず、反応溶液が容器内で均一に撹拌されたと考えられる。
【0088】
実施例2
実施例2では、図6および図8に示される、選択結合性物質が平坦部6に固定化された担体2と、容器内部表面に円柱状の凹陥構造8Bを有する容器1とで構成される分析チップを実施例1と同様にして作成し、実施例1と同様の評価を行った。
【0089】
プローブの固定化位置は、実施例1と同じ、担体の中央とし、溶液を保持する容器の配置位置は、実施例1と同様に中央にした。測定対象のスポット1〜8は、実施例1と同じく、図11に示すように、担体上の4隅に位置する4つのスポット(スポット1〜4)と、中心部に位置する4つのスポット(スポット5〜8)の合計8つのスポットである。結果を表1に示す。
【0090】
ハイブリダイゼーション反応後、空隙内における微粒子の分散度を目視検査した結果、微粒子は空隙内で局在化することなく、空隙内全体に分散して存在していることが確認できた。
【0091】
スポット1〜8における蛍光強度は、実施例1と同様、全てのスポットにおいて同程度の十分な蛍光強度が得られた。この結果から、スポットの位置による反応のむらは発生せず、反応溶液が容器内で均一に撹拌されたと考えられる。
【0092】
比較例1
比較例1では、容器内部表面に凹陥構造8Aを設けず平面のままとした容器を用いたこと以外は実施例1と同様に分析チップを作成し、実施例1と同様の評価を行った。結果を表1に示す。
【0093】
ハイブリダイゼーション反応後、空隙内における微粒子の分散度を目視検査した結果、微粒子は容器表面の中心部の4つの領域全てを埋め尽くしており、外部の4つの領域には殆ど微粒子は存在しなかった。この結果から、微粒子は空隙内で局在化していることが確認された。
【0094】
スポット1〜8における蛍光強度は、中心部に位置するスポットにおいては強い蛍光強度が得られたが、四隅に位置するスポットからは弱い蛍光強度が得られた。中心部に位置するスポットの中でも、スポット位置による蛍光強度のばらつきが見られた。スポット位置により反応むらが発生したことから、反応溶液の撹拌が均一に行われなかったと考えられる。
【0095】
【表1】

【符号の説明】
【0096】
1 容器
2 担体
3 貫通孔
4 微粒子
5 空隙(空間)
6 選択結合性物質がその表面に固定化される平坦部
7 選択結合性物質
8A 突起構造
8B 凹陥構造
9 選択結合性物質がその表面に固定化される凸部
10 DNA
11 微粒子の分散度評価用の8領域の区分線
R1 選択結合性物質が固定化された領域
L1 選択結合性物質が固定化されたピッチ
L2 容器表面の突起構造ピッチ
L3 容器表面の凹陥構造内部の最大径
H1 容器の空隙部深さ
H2 容器表面の突起構造の高さ
H3 容器表面の凹陥構造の深さ
H4 選択結合性物質をその表面に固定化する凸部高さ
【技術分野】
【0001】
本発明は、被検物質と選択的に結合する物質を固定化した担体を備え、被検物質を含む溶液と選択結合性物質とを選択的に結合させて、担体上に選択結合性物質を介して結合した被検物質を分析するための分析チップおよび溶液の攪拌方法に関する。
【背景技術】
【0002】
各種生物の遺伝情報解析の研究が始められており、ヒト遺伝子をはじめとして、多数の遺伝子とその塩基配列、また遺伝子配列にコードされる蛋白質およびこれら蛋白質から二次的に作られる糖鎖に関する情報が急速に明らかにされつつある。配列の明らかにされた遺伝子、蛋白質、糖鎖などの高分子体の機能は、各種の方法で調べることができる。例えば、核酸は、ノーザンブロッティング、あるいはサザンブロッティングのような、各種の核酸/核酸間の相補性を利用して、各種遺伝子とその生体機能発現との関係を調べることができる。蛋白質は、ウエスタンブロッティングに代表される蛋白質/蛋白質間の反応を利用し蛋白質の機能および発現について調べることができる。
【0003】
近年、多数の遺伝子発現を一度に解析する手法として、DNAマイクロアレイ法(DNAチップ法)と呼ばれる新しい分析法が開発され、注目を集めている。この方法は、核酸/核酸間ハイブリダイゼーション反応に基づく核酸検出・定量法である点で原理的には上記の従来の方法と同じである。このDNAチップ法は、蛋白質/蛋白質間あるいは糖鎖/糖鎖間や糖鎖/蛋白質間の特異的な反応に基づく蛋白質や糖鎖検出・定量に応用が可能である。この技術は、マイクロアレイ又はDNAチップと呼ばれるガラスの平面基板片上に、多数のDNA断片や蛋白質、糖鎖が高密度に整列固定化されたものが用いられている点に大きな特徴がある。
【0004】
DNAチップ法の具体的使用法としては、例えば、研究対象細胞の発現遺伝子等を蛍光色素等で標識したサンプルを平面基板片上でハイブリダイゼーションさせ、互いに相補的な核酸(DNAあるいはRNA)同士を結合させ、その箇所を高解像度検出装置(スキャナー)で高速に読みとる方法や、電気化学反応にもとづく電流値等の応答を検出する方法が挙げられる。このようして、サンプル中のそれぞれの遺伝子量を迅速に推定できる。また、DNAチップの応用分野は、発現遺伝子の量を推定する遺伝子発現解析のみならず、遺伝子の一塩基置換(SNP)を検出する手段としても大きく期待されている。
【0005】
現在、DNAチップは、チップ上に数千から数万種類の多数の遺伝子を載せ、一度に多種類の遺伝子の発現を調べる研究用として使用されていることが多い。今後、診断用途でDNAチップが使用されることが期待されている。DNAチップを診断用途として使用する場合、一般に採取できる被検物質量が非常に少ないことがあり、その場合、現行のDNAチップでは感度が十分ではないため、被検物質の測定が困難であることがある。また、発現量の少ない遺伝子では、ハイブリダイゼーション後に得られる蛍光シグナル強度が非常に微弱であるため、このような遺伝子は実質上解析できないこともある。以上のように、従来のDNAチップでは、被検物質の量が少ない場合や発現量の少ない遺伝子の場合、ハイブリダイゼーション後の蛍光シグナル強度をいかに大きくするかということが課題である。
【0006】
この課題を解決するためには、被検物質であるDNAとプローブDNAとをいかに効率よく反応させるかが1つのポイントとなる。被検物質であるDNAとプローブDNAを効率よく反応させる方法として、被検物質の自然拡散では不十分であるため、溶液を人為的に攪拌し、効率よくプローブDNAと被検物質であるDNAとの反応を促進することが考えられている。
【0007】
被検物質が含まれた溶液を攪拌する例として、特許文献1には、微粒子または気泡を混合した被検物質が含まれた溶液を、被検物質と反応する選択結合性物質を固定化させた担体に接触させ、被検物質が含まれた溶液を、容器を用いてシーリングし、微粒子または気泡を移動させることにより被検物質の溶液を攪拌して、被検物質との反応効率を上げ、ハイブリダイゼーション後のシグナル強度を大きくする方法が開示されている。
【0008】
また、特許文献2には、選択結合性物質が固定化された凸部をマトリクス状に形成させた複数のサブブロック領域を構成させ、サブブロック領域内の凹部とサブブロック領域間の凹部を微粒子またはマイクロロッドが移動することにより被検物質が含まれた溶液を攪拌させて、被検物質との反応効率を上げる方法が開示されている。このサブブロック領域間の凹部の幅は、サブブロック領域内の凹部の幅よりも広い構造を有している。
【0009】
さらに、特許文献3、特許文献4には、被検物質が含まれた溶液中で磁気ビーズを磁力により動かすことで、被検物質の溶液を撹拌し、被検物質との反応効率を上げる方法が開示されている。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】国際公開第2005/090997号パンフレット
【特許文献2】特開2007−212446号公報
【特許文献3】特開2003−248008号公報
【特許文献4】特開2003−339375号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
上記特許文献1で開示されている分析チップでは、選択結合性物質が固定化されている部分に微粒子が接触しないように担体または容器に特別の構造を設ける必要があり、また使用できる微粒子の大きさを担体または容器の構造に適合させる必要がある。
【0012】
特許文献2で開示されている分析チップは、微粒子またはマイクロロッドが移動するための担体上の領域として、サブブロック領域内での凹部の他に、サブブロック領域間により広い凹部が設けられた構造を有している。そのため、微粒子またはマイクロロッドは、サブブロック領域内の凹部よりも、サブブロック領域間にあるより広い凹部を優先的に移動する可能性があり、攪拌時に微粒子またはマイクロロッドが担体の一部に局在化し(担体の全体に分散せず)、攪拌が不均一となる可能性がある。
【0013】
特許文献3および特許文献4で開示されている分析チップでは、攪拌用の複数の磁気ビーズが磁気により凝集して大きな塊となり、攪拌効率が低下したり、攪拌が不均一となる可能性がある。
【0014】
本発明は、分析チップにおいて、微粒子を用いて被検物質を含む溶液を攪拌する際に、攪拌用の微粒子が反応溶液中で局在化しないように配置させる、換言すれば、微粒子が反応溶液で満たされた選択結合性物質が固定化された担体の領域全体に分散(拡散)するようにすることで、反応溶液全体を均一に撹拌して反応ムラを低減し、その結果分析精度や再現性を高めることが可能な分析チップおよび溶液の攪拌方法を提供することにある。
【課題を解決するための手段】
【0015】
本発明は、分析チップの容器表面に、微粒子が反応溶液で満たされた選択結合性物質が固定化された担体の領域全体に分散(拡散)させ、一部に局在化することなく配置されるための区画構造を設けることにより、上記課題を解決した。
【0016】
すなわち、本発明は、以下の構成からなる。
[1]表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に格納された、溶液を攪拌するための微粒子と、を含む分析チップであって、該容器表面に、溶液を攪拌するときに該微粒子が局在化することなく配置されるための区画構造を有する分析チップ。
[2]区画構造が突起構造である、[1]に記載の分析チップ。
[3]区画構造が凹陥構造である、[1]に記載の分析チップ。
[4]表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に格納された、溶液を攪拌するための微粒子と、を含む分析チップを用いる溶液の攪拌方法であって、分析チップの該容器表面に、該微粒子が局在化することなく配置されるための区画構造を設けることを特徴とする、溶液の撹拌方法。
【発明の効果】
【0017】
本発明により、微粒子を用いて被検物質を含む溶液を攪拌して被検物質と固定化された選択結合性物質とを反応させる際に、微粒子が反応溶液中で局在化することなく選択結合性物質が固定化された担体全体に分散(拡散)した状態(ばらけた状態)で配置させることが可能になる。その結果、反応溶液全体を均一に撹拌することができるため、反応溶液全体の反応を均一に行わせること、すなわち担体全体での反応ムラを低減することが可能となる。その結果、分析の精度、再現性を高めることが可能となる。
【0018】
また、従来の分析チップでは、被検物質と固定化された選択結合性物質とを反応させる際に、分析チップ設置面の傾きのために球状の微粒子が該傾き方向に偏ってしまうことがあるため、分析チップを厳密に水平に設置する必要があったが、本発明の分析チップでは、容器表面に設けられた区画構造により攪拌時に微粒子をばらけた状態で配置させることが可能であるため、分析チップを設置するにあたり水平性を厳密に設定する必要がない。
【0019】
また、使用する微粒子のサイズに合わせて区画構造のサイズを設定できるため、微粒子サイズを所望のとおり任意に選択して使用することができる。。
【図面の簡単な説明】
【0020】
【図1】図1は、本発明の分析チップの一例を概略的に示す斜視図である。
【図2】図2は、図1に示される本発明の分析チップの一例を、矢印A1に沿った面で切断した断面図である。
【図3】図3は、図1に示される本発明の分析チップの一例を、矢印A1に沿った面で切断した断面図である。
【図4】図4は、図1および図2に示される本発明の分析チップの一例を、担体2を除いた状態で上方から見た外観図である。
【図5】図5は、図1および図3に示される本発明の分析チップの一例を、担体2を除いた状態で上方から見た外観図である。
【図6】図6は、図1に示される本発明の分析チップの一例を、矢印A1に沿った面で切断した断面図である。
【図7】図7は、図1に示される本発明の分析チップの一例を、矢印A1に沿った面で切断した断面図である。
【図8】図8は、図1および図6に示される本発明の分析チップ、あるいは図1および図7に示される本発明の分析チップの一例を、担体2を除いた状態で上方から見た外観図ある。
【図9】図9は、実施例及び比較例における、プローブDNAの固定化工程を示す概略図である。
【図10】図10は、実施例及び比較例で用いた分析チップの容器における、微粒子の分散度を評価するための8区分の領域を示す図である。
【図11】図11は、実施例及び比較例で用いた分析チップの担体における、スポット1〜8の位置を示す図である。
【発明を実施するための形態】
【0021】
本発明の分析チップは、表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に格納された、溶液を攪拌するための微粒子と、を含み、該容器表面に、該微粒子が局在化することなく配置されるための区画構造を備える。
【0022】
ここで、担体は、その表面に選択結合性物質が固定化された基材である。また、容器は、担体の選択結合性物質が固定化された表面を覆う基材であって、被検物質溶液を保持する空隙を形成する様に担体と接着されて使用される。また、区画構造は、空隙内に格納された微粒子が凝集することを防ぎ、空隙内でばらけて配置された状態を保持するための構造体として、容器表面上に設けられる。
【0023】
本発明の分析チップは、担体表面を重力方向に垂直な方向(水平方向)に向けて使用するものであり、担体上の選択結合性物質が固定化された表面を、下方(重力方向)に向けて使用できる。例えば、後述する図1〜8に例示する分析チップは、全て重力方向に垂直な方向(水平方向)に向けて使用する場合を示しており、選択結合性物質が固定化された表面は下方を向いており、この場合、容器は担体下部から覆設される。
【0024】
本発明の分析チップは、被検物質を含む溶液を当該チップにアプライし、被検物質の存在の有無や、被検物質の量や、被検物質の性状等を測定するために用いるチップである。具体的には、担体表面に固定化された選択結合性物質と被検物質との反応により、被検物質の量や、被検物質の有無を測定するバイオチップが挙げられる。具体的なバイオチップとしては、核酸を担体表面に固定化したDNAチップ、抗体に代表されるタンパク質を担体表面に固定化したタンパク質チップ、糖鎖を担体表面に固定化した糖鎖チップ、及び担体表面に細胞を固定化した細胞チップ等が挙げられる。
【0025】
まず、本発明の分析チップの具体的な態様について、図面を用いて例示する。
【0026】
図1に示す分析チップの例は、担体2の下部から容器1が覆設されている。図2、図3、図6、図7は、図1で示される分析チップのそれぞれ異なる態様であって、それぞれ図1の矢印A1方向に沿った面での断面図を示す。図4、図5は、それぞれ図2、図3で示される分析チップにおいて、担体2が設置されていない状態の分析チップを上方から見た外観を示す。図8は、図6、図7で示される分析チップにおいて、担体2が設置されていない状態の分析チップを上方から見た外観を示す。
【0027】
図2、図3、図6、図7の分析チップの例では、担体2と容器1とで、選択結合性物質が固定化された固定化領域R1を含む空隙5を形成しており、空隙5は、必要に応じて設けることのできる貫通孔3を介して外部と連通する他は、外部と連通しない閉じた空間となっている。図2、図6の担体1の表面は平面構造(選択結合性物質がその表面に固定化される平坦部6)を有しており、図3、図7の担体2の表面は凹凸構造(選択結合性物質がその表面に固定化される凸部9)を有している。また、図2、図3の容器1の表面には区画構造である複数の突起構造8Aが設けられており、微粒子4は、この突起構造の隙間に配置される。図6、図7の容器1の表面には区画構造である凹陥構造8Bが設けられており、微粒子4はこの凹陥構造の内部に収納される。
【0028】
ここで、本発明における容器について述べる。
【0029】
本発明の分析チップにおける容器には、微粒子によって反応溶液を攪拌する際に、反応溶液が満たされた容器の表面に微粒子が分散(拡散)し、その一部に局在化しないような手段として、区画構造が設けられる。この区画構造は、選択結合性物質が固定化された領域(R1)の全体を略均等にカバーするように設けられることが好ましい。ここで、微粒子が分散または拡散する状態とは、微粒子が容器表面の全体にばらばらに散らばって存在する状態を意味する。また、微粒子が局在化する状態とは、微粒子が容器表面の一部の限られた領域に偏って存在する状態を意味する。
【0030】
微粒子の分散度は、例えば、以下のような判定基準で評価することができる。分析チップの容器表面を複数の領域(例えば、図10に示すような2×4の8個の領域)に面積が略均等になるように区分けして、微粒子によって溶液を攪拌した後に、区分けされた個々の領域内にどれだけの量の微粒子が占有しているかどうかを評価する。ここで、容器表面において区分けされた領域は、実際に構造上設けられた領域ではなく、形式上区切られた領域である。分析チップに格納される微粒子の全量を、分析チップの容器表面上の約半分の面積を占める量に設定した場合には、容器表面を観察(例えば目視で観察)し、区分けした全ての領域において微粒子が容器表面の約半分の面積を占めている場合は、微粒子が分散された状態、いわゆる「局在化なし」と判定することができる。一方、区分けした領域のうち微粒子が占める面積が約半分に満たない状態の領域が1つ以上ある場合は、微粒子の「局在化あり」と判定することができる。
【0031】
本発明の分析チップの容器には、区画構造として、好ましくは以下に述べる突起構造または凹陥構造が設けられる。
【0032】
突起構造とは、容器表面上に設けられる区画構造であって、空隙内に格納された微粒子が容器表面上を移動する際に衝突する程度に容器表面から突出した構造である。突起構造は、微粒子が容器表面上を移動する際に衝突する形状を有する構造体であれば特に限定されない。突起構造は、容器表面上に複数設けられることが好ましく、この場合、微粒子は容器表面上に設けられた複数の突起構造の隙間に配置される。この複数の突起構造の隙間に配置された微粒子は、溶液を攪拌するための外場(磁場や重力や振動)を加えたときに、この突起構造が障壁となり、突起構造に衝突して跳ね返ることでランダムな動きが生じるため、微粒子は容器表面上で局在化せず、分散された状態が保持される。
【0033】
突起構造の配置の仕方としては、微粒子にランダムな動きを生じさせるように配置されていれば特に限定されないが、容器のどの領域においても微粒子に同程度のランダムな動きを生じさせるために、一定の繰り返しパターンで容器表面全体に配置されているのが好ましい。突起構造の間隔が広すぎると微粒子の分散度が低下するため好ましくなく、間隔が狭すぎると、使用できる微粒子のサイズが小さくなり、また微粒子の動きの自由度が低減することにより、撹拌効果が低下するため好ましくない。
【0034】
突起構造のサイズは、微粒子のサイズや微粒子が収納される空隙の容積を考慮して選択することができる。小さすぎると微粒子の衝突効率が低減し分散度が低下するため好ましくなく、大きすぎると空隙内に格納できる微粒子の量に制限が生じ、撹拌効果が低下するため好ましくない。
【0035】
突起構造の高さ(図2、図3のH2)としては、後述するような微粒子を用いる場合には、10μm以上、500μm以下が好ましく、50μm以上、300μm以下が特に好ましい。突起構造の高さがこれより低いと、微粒子が突起構造を乗り越えてしまい、微粒子を分散させにくくなる。また、突起構造の高さが500μm以上であると、分析チップにおける空隙の容積が増大し、この空隙を満たすために多量の検体溶液が必要となるため好ましくない。
【0036】
突起構造の形状は、微粒子が衝突してランダムな動きを生じさせる形状であれば特に限定されない。例えば、円柱状、楕円柱状、角柱状、円錐状、角錐状等が挙げられる。突起構造の具体的な態様としては、例えば図4、図5のような構造がある。図4では突起構造が円柱であり、図5では四角柱である。微粒子は容器表面上でこれら突起構造の隙間に配置され、外場(磁場や重力や振動)が加えられると、微粒子は突起構造に衝突ながら、空隙内を移動する。
【0037】
凹陥構造とは、容器表面上に設けられる区画構造であって、微粒子が納まる程度に容器表面より凹んだ構造である。凹陥構造は、微粒子を容器表面の一定の領域に納めてしまう構造体であれば特に限定されない。凹陥構造は、容器表面上に複数設けられることが好ましく、この場合、微粒子はこれら複数の凹陥構造の内部に略均等に収納される。この複数の凹陥構造に収納された微粒子は、外場(磁場や重力や振動)を加えると、この凹陥構造の内部を自由に移動する。基板表面上に複数の凹陥構造を略均等に偏りなく分布させて設けることにより、容器表面全体からみると、微粒子が分散された状態を保持することができる。
【0038】
凹陥構造の配置の仕方としては、基板表面上に複数の凹陥構造を略均等に偏りなく分布させて設けることが好ましく、一定の繰り返しパターンで容器表面全体に配置されていることがより好ましい。
【0039】
凹陥構造のサイズは、微粒子のサイズや微粒子が格納される空隙の容積を考慮して選択することができる。小さすぎると使用できる微粒子のサイズが小さくなり、また微粒子の動きの自由度が低減することにより、撹拌効果が低下するため好ましくない。
【0040】
凹陥構造の深さ(図6、図7のH3)としては、後述するような微粒子を用いる場合には、10μm以上、500μm以下が好ましく、50μm以上、300μm以下が特に好ましい。凹陥構造の深さがこれより深いと、微粒子が凹陥構造から外に飛び出てしまう可能性があり、微粒子を分散させにくくなる。また、凹陥構造の深さが500μm以上であると、分析チップにおける空隙の容積が増大し、この空隙を満たすために多量の検体溶液が必要となるため好ましくない。
【0041】
凹陥構造の形状は、微粒子が収納され、その内部で自由に移動できる形状であれば特に限定されない。例えば、円柱状、楕円柱状、角柱状に凹んだ形状等が挙げられる。凹陥構造の具体的な態様としては、例えば図8のような構造がある。図8では、凹陥構造が円柱状に凹んだ形状である。微粒子は容器表面上で凹陥構造の内部に収納され、外場(磁場や重力や振動)が加えられると、微粒子は凹陥構造の内部で自由に移動する。このような凹陥構造が容器表面上に略均等に分布するように一定の繰り返しパターンで複数設けられている。
【0042】
本発明の分析チップにおける容器は、担体に脱離可能に接着されていても、担体に脱離不可能に接着されていてもよい。容器が担体に脱離可能に接着されている場合は、被検物質とのハイブリダイゼーション反応を行った後、容器を脱離させ、担体のみをスキャナーにセットして蛍光等のシグナル強度を測定することができる。
【0043】
本発明の分析チップの容器の材質は、特に限定されるものではないが、好ましく用いられる容器の材質として、ガラス、ポリマー、あるいはこれらを組み合わせたもの等が挙げられる。上記のような突起構造や凹陥構造等の区画構造が設けられた容器は、例えば切削加工や射出成型法により容易に作製可能という点から、ポリマーが好ましい。ポリマーとしては、ポリスチレン、ポリメチルメタクリレート、ポリカーボネート等のポリマーを好ましく用いることが出来る。
【0044】
容器は、被検物質溶液をアプライした際に、溶液の様子を観察可能とするためには、透明な材料が好ましい。また、分析チップから容器を脱離させることなくスキャナーで読み取る分析チップにおいては、容器を透過して光を照射して検出する場合、容器の光が透過する部分は十分透明で、またノイズの要因となる自家蛍光を生じない材質であることが好ましい。
【0045】
本発明における微粒子の好ましい形状について述べる。
【0046】
本発明における微粒子の大きさ(微粒子の最大径)は、10μm以上のものが好ましい。微粒子の大きさが10μmより小さいと、溶液の抵抗により外場(磁場や重力や振動)を加えても微粒子がほとんど動かないことがあり、微粒子による攪拌効果が得られないことがある。微粒子の大きさは20μm以上がより好ましい。
【0047】
本発明の分析チップでは、溶液を攪拌することができれば、どのような形の微粒子も用いることができる。特に好ましくは、微粒子の形状は、球状、すなわちビーズである。微粒子が球状であると、回転により反応液中で滞ることなくスムーズに移動でき、検体溶液の攪拌が良好に行えるので好ましい。球状の微粒子として、好ましくは、直径が20μm〜500μmの球状微粒子(ビーズ)を用いることができる。直径がこの範囲であると、容易に重力、振動、旋回等による加速度などを加えることにより溶液中を移動でき、溶液の攪拌を十分に行うことができるため、良好な結果を得ることができる。
【0048】
本発明の分析チップでは、微粒子の材質としては特に限定されない。微粒子の材質としては、金属、ガラス、セラミック、ポリマー(ポリスチレン、ポリプロピレン、ナイロンなど)等を用いることができる。この中でも、比重が水よりも大きい材質(ガラス、石英、ジルコニアセラミック)が、重力や振動を加えることにより容易に溶液中を移動できるので好ましい。また、磁気ビーズを使用することも可能である。これらのうち、特に、ジルコニアセラミックからなる微粒子は、比重が大きいことから、重力、振動、旋回等による加速度などを加えることにより、移動が容易に行えることから最も好ましく用いることができる。また、ガラス、石英、ジルコニアセラミックは、検体溶液中に微粒子の成分が溶出することが少ないので好ましい。
【0049】
ジルコニアセラミック(イットリア安定化ジルコニア)からなる微粒子は、密度が6g/cm3程度であり、石英ガラスの2.2g/cm3などに比べて大きいので、攪拌効果がより発揮でき、容器でシーリングする際の溶液の動きに対してもビーズが舞い上がって動いてしまうことが少ないので、セッティングがより容易に行え、特に好ましい。
【0050】
本発明の分析チップでは、微粒子を移動させることによって溶液を撹拌する。好ましくは、重力、磁力(磁気ビーズの場合)、振動・振盪、旋回等による加速度などを加えることにより、またはこれらの組合せにより、微粒子を移動させる。
【0051】
これらの中でも、担体を水平又は水平に近い面に沿って旋回したり、上下や左右に振盪(素早く移動)したりして、加速度を加えることにより、溶液中の微粒子を動かす方法は、簡便に実施でき、十分な効果が得られることから好ましい。特に、担体を水平又は水平に近い面に沿って旋回(公転)させて加速度(遠心力)を加える方法が好ましい。この時の回転速度としては、100rpmから500rpmが好ましい。100rpm未満であると十分な撹拌が行われない場合があり、500rpmを超えると、分析チップから容器が剥がれてしまう可能性がある。特に好ましくは、200rpmから300rpmである。水平に近い方向とは、担体を回転させた場合に微粒子が分析チップの片側に寄らない程度の傾きを持たせた方向を意味し、例えば、水平面を基準として0度から3度の間が好ましい。
【0052】
また、前記微粒子においても、分析チップを解体することなくスキャナーで読み取る際、微粒子から自家蛍光が生じる場合には、その発光がノイズとなり検出精度の低下に繋がることがある。これを防ぎ、微粒子自身からの自家蛍光を低減させるために、光照射により発光を生じない物質を含有させたポリマーで、微粒子表面にコーティング等を施して被覆処理することにより表面を形成することが好ましい。このような微粒子を用いることにより、検出の際、微粒子からの自家蛍光を低減できる。
【0053】
選択結合性物質が固定化される担体について述べる。
【0054】
本発明の分析チップに用いる選択結合性物質が固定化された担体には、その表面形状が平面構造を有するものや凹凸構造を有するものを利用できる。表面が凹凸構造である担体を用いた場合、凹凸構造の凸部上面に選択性適合物質が固定化されていることが好ましい。
【0055】
本発明の分析チップで用いられる担体の材質は、特に限定されない。好ましく用いられる担体の材質は、ガラス又は各種のポリマー(例えばポリスチレン、ポリメチルメタクリレート、ポリカーボネート、ポリオレフィン)である。切削加工や射出成型法等により容易に作製可能という点から、ポリマーが好ましい。ポリマーとしては、ポリスチレン、ポリメチルメタクリレート、ポリカーボネート等のポリマーを好ましく用いることが出来る。
【0056】
本発明の分析チップにおいて、選択結合性物質を固定化するための担体表面は、官能基を含むポリマーであることが好ましい。官能基を含むポリマーで好ましいものとしては、例えば、ポリメチルメタクリレート(PMMA)、ポリエチルメタクリレート(PEMA)またはポリプロピルメタクリレートのポリメタクリル酸アルキル(PAMA)等がある。これらの中で特に好ましいものは、ポリメチルメタクリレートである。さらに、ポリ酢酸ビニル、ポリメタクリル酸シクロヘキシルまたはポリメタクリル酸フェニル等も用いることができる。
【0057】
官能基(カルボキシル基、エステル基、酸無水物)を含むポリマーを有する担体表面に選択結合性物質を固定化するためには、これに前処理を施して、例えば担体表面にカルボキシル基を形成させ、これを利用して選択結合性物質を共有結合させることが好ましい。担体表面にカルボキシル基を生成する手段としては、アルカリ、酸などで処理するほか、温水中での超音波処理、酸素プラズマ、アルゴンプラズマ、放射線に担体を晒す方法などが挙げられるが、担体の損傷が少なく、また、容易に実施できるという点から、アルカリ又は酸に担体を漬け込んで表面にカルボキシル基を生成させることが好ましい。具体的な例としては、水酸化ナトリウムや硫酸の水溶液(好ましい濃度は、1N〜20N)に担体を漬け込み、好ましくは30℃から80℃の温度にして、1時間から100時間の間保持すればよい。
【0058】
担体表面にカルボキシル基や酸無水物が存在する場合は、アミノ基や水酸基を有する選択結合性物質を担体表面に共有結合で固定化することが可能となる。担体表面にカルボキシル基がある場合には、これらの結合の反応を助長するため、ジシクロヘキシルカルボジイミド、N−エチル−5−フェニルイソオキサゾリウム−3’−スルホナート、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)などの様々な縮合剤を用いることができる。
【0059】
上記のような材質がポリマーである担体の作製は、射出成形方法やホットエンボス法などを適用することができる。特に射出成型法は大量生産が容易であることから好ましく用いることができる。
【0060】
本発明において、選択結合性物質とは、被検物質と直接的又は間接的に、選択的に結合し得る物質を意味し、代表的な例として、核酸、タンパク質、糖類及び他の抗原性化合物等を挙げることができる。
【0061】
選択結合性物質として、特に好ましいものは、核酸である。核酸は、DNA、RNA、PNAのいずれでもよい。特定の塩基配列を有する一本鎖核酸は、該塩基配列又はその一部と相補的な塩基配列を有する一本鎖核酸と選択的にハイブリダイズして結合するので、本発明でいう選択結合性物質に該当する。核酸の中でも、オリゴ核酸と呼ばれる、長さが10塩基から100塩基までの核酸は、合成機で容易に人工的に合成が可能であり、また核酸末端のアミノ基修飾が容易であるため、担体表面への固定化が容易となることから好ましい。さらに、20塩基未満ではハイブリダイゼーションの安定性が低いという観点から20〜100塩基がより好ましい。ハイブリダイゼーションの安定性を保持するため、特に好ましくは40〜100塩基の範囲である。
【0062】
また、タンパク質としては、抗体及びFabフラグメントやF(ab')2フラグメントのような、抗体の抗原結合性断片、並びに種々の抗原を挙げることができる。抗体やその抗原結合性断片は、対応する抗原と選択的に結合し、抗原は対応する抗体と選択的に結合するので、選択結合性物質に該当する。糖類としては、多糖類が好ましく、種々の抗原を挙げることができる。また、タンパク質や糖類以外の抗原性を有する物質を選択結合性物質として固定化することもできる。
【0063】
本発明に用いる選択結合性物質は、市販のものでもよく、また、生細胞などから得られたものでもよい。
【0064】
被検物質を含む溶液は、例えば図1〜図8に例示する分析チップの場合、貫通孔3から空隙内にアプライすることができる。分析チップに複数の貫通孔を設けることで、被検物質を含む溶液をアプライする際、気泡の流入を抑制することができ、操作性が向上する。
【0065】
本発明では、被検物質として、測定すべき核酸、例えば、病原菌やウイルス等の遺伝子や、遺伝病の原因遺伝子等並びにその一部分、抗原性を有する各種生体成分、病原菌やウイルス等に対する抗体等を挙げることができるが、これらに限定されるものではない。本発明では、これらの被検物質を含む溶液としては、血液、血清、血漿、尿、便、髄液、唾液、各種組織液等の体液や、各種飲食物並びにそれらの希釈物等を挙げることができるがこれらに限定されるものではない。被検物質となる核酸は、血液や細胞から常法により抽出した核酸を標識してもよいし、該核酸を鋳型として、PCR等の核酸増幅法によって増幅したものであってもよい。核酸を鋳型として、PCR等の核酸増幅法によって増幅したものの場合には、測定感度を大幅に向上させることが可能である。核酸増幅産物を被検物質とする場合には、蛍光物質等で標識したヌクレオチド三リン酸の存在下で増幅を行うことにより、増幅核酸を標識することが可能である。また、被検物質が抗原又は抗体の場合には、被検物質である抗原や抗体を常法により直接標識してもよい。被検物質である抗原又は抗体を選択結合性物質と結合させた後、担体を洗浄し、該抗原又は抗体と抗原抗体反応する標識した抗体又は抗原を反応させ、担体に結合した標識を測定することもできる。
【0066】
担体上の選択結合性物質に被検物質とを接触させて相互作用させ、被検物質と選択結合性物質とを選択的に結合させる(ハイブリダイゼーション反応)させる工程は、従来と全く同様に行うことができる。反応温度及び時間は、ハイブリダイズさせる核酸の鎖長や、免疫反応に関与する抗原及び/又は抗体の種類等に応じて適宜選択されるが、核酸のハイブリダイゼーションの場合、通常、35℃〜70℃程度で1分間〜十数時間、免疫反応の場合には、通常、室温〜40℃程度で1分間〜数時間程度である。
【0067】
担体上に選択結合性物質を介して結合した被検物質量の測定は、従来の方法に従って行うことができる。例えば、被検物質と選択結合性物質とを選択的に結合させた後の分析チップ又は容器を脱離させた担体を、既存のスキャナー等の装置にセットし、蛍光等のシグナル強度を測定することによって行うことができる。
【実施例】
【0068】
本発明を以下の実施例によってさらに詳細に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0069】
実施例1
実施例1では、図2および図4に示される、選択結合性物質が平坦部6に固定化された担体2と、容器内部表面に円柱状の突起構造8Aを有する容器1とで構成される分析チップを作成し、評価を行った。
【0070】
(DNA固定化担体の作製)
公知の方法であるLIGA(Lithographie Galvanoformung Abformung)プロセスを用いて、射出成形用の型を作製し、射出成型法により、図2および図4に示す、貫通孔3を4つ有し、表面が平坦構造を有するPMMA製の担体2を得た。この実施例で用いたPMMAの平均分子量は5万であり、PMMA中には1重量%の割合で、カーボンブラック(三菱化学製 #3050B)を含有させており、担体は黒色である。担体の形状は、大きさが縦76mm、横26mm、厚み1mmであり、担体表面は平坦であった。
【0071】
次に上記のPMMA担体を10Nの水酸化ナトリウム水溶液に70℃で12時間浸漬した。これを、純水、0.1NのHCl水溶液、純水の順で洗浄し、担体表面にカルボキシル基を生成した。
【0072】
(プローブDNAの固定化)
配列番号1で表される塩基配列を有するDNA(60塩基、5’末端アミノ化)を合成した。このDNAは5’末端がアミノ化されている。
【0073】
このDNAを、純水に0.3nmol/μLの濃度となるよう溶解させて、ストックソリューションとした。担体に点着する際は、PBS(NaClを8g、Na2HPO4・12H2Oを2.9g、KClを0.2g、KH2PO4を0.2g純水に溶かし1LにメスアップしたものにpH調整用の塩酸を加えたもの、pH5.5)で10倍希釈して、プローブDNAの終濃度を0.03nmol/μLとし、かつ、担体表面のカルボン酸とプローブDNAの末端のアミノ基とを縮合させるため、1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド(EDC)を加え、この終濃度を50mg/mLとした。そして、これらの混合溶液をアレイヤー(日本レーザー電子製;Gene Stamp−II)で担体表面上に256(16×16)スポットした。次いで、担体を密閉したプラスチック容器に入れて、37℃、湿度100%の条件で20時間程度インキュベートした。最後に純水で洗浄し、スピンドライヤーで遠心して乾燥した。この反応スキームを図9に示す。
【0074】
(液体を保持する容器)
射出成形法により、図2および図4に示す容器1を作製した。容器の形状は、大きさが縦17mm、横19.5mm、厚み1mmであり、容器の中央に、縦11.0mm、横13.5mm、深さ0.25mmの凹んだ部分が設けられており、この凹みの中に、直径0.15mm、高さ0.15mmの突起構造を256箇所設けた。そして、これを洗浄剤(クリーンエース(アズワンカタログ、品番:4−078−01)25倍希釈溶液)に浸漬して5分間超音波洗浄した後、逆浸透水(RO水)で十分にすすぎ、エアブローにより乾燥させた。
【0075】
(チップの組み立て)
プローブDNAを固定化した担体の領域を覆うように液体を保持する容器を配置し、担体と液体を保持する容器をPDMSポリマーにより接着した。接着条件は42℃、2時間である。
【0076】
(微粒子の調製と封入)
表面粗さが20nm、平均粒径が300μmの市販ジルコニア製微粒子(東レ株式会社製)を、炭化珪素質研磨材(粒度#20)を用い遠心式バレル研磨機で1時間、水中にて研磨を行い、水洗して乾燥した。前記微粒子の表面粗さは、Ra=165nmであった。かかる微粒子の表面粗さの測定は、その表面をAuで真空蒸着した後、走査型電子顕微鏡(株式会社エリオニクス製、型式ESA−2000)で表面粗さRa(nm)を測定した。前記表面粗さは、観察倍率を10,000倍、カットオフ値を0とし、任意の10個について測定し、その平均値を求めた。かかる微粒子の粒径は、実体顕微鏡で任意の100個以上の微粒子の画像を50〜150倍で撮影した後、画像処理解析ソフト(三谷商事社株式会社製、Win Roof)により円相当径を求めて平均値を算出し、それを平均粒径とした。その後エタノール溶液に浸漬し、超音波洗浄を5分間行った。さらに同様の洗浄を2回繰り返した。この微粒子を、担体の貫通孔から、容器表面上の突起構造の隙間に適切量封入した。適切量とは、分析チップの空隙内を半分程度埋め尽くす量であり、十分であることが分かっている。
【0077】
(被検物質DNAの調製)
被検物質DNAとして、上記DNA固定化担体に固定化されたプローブDNAとハイブリダイズ可能な配列番号4で表される塩基配列を持つDNA(968塩基、以下、配列番号4のDNAともいう)を用いた。調製方法を以下に示す。
【0078】
配列番号2で表される塩基配列を有するDNA(以下、配列番号2のDNAともいう)と配列番号3で表される塩基配列を有するDNA(以下、配列番号3のDNAともいう)を合成した。これを純水に溶解して濃度を100μMとした。次いで、pKF3 プラスミドDNA(タカラバイオ(株))(配列番号5で表される塩基配列を有するDNA:2246塩基)を用意して、これをテンプレートとし、配列番号2および配列番号3のDNAをプライマーとして、PCR反応(Polymerase Chain Reaction)により増幅を行った。
【0079】
PCRの条件は以下の通りである。すなわち、ExTaq 2μl、10×ExBuffer 40μl、dNTP Mix 32μl(タカラバイオ(株)製)、配列番号2のDNAの溶液を2μl、配列番号3のDNAの溶液を2μl、テンプレート(配列番号5で表される塩基配列を有するDNA)を0.2μl加え、純水によりトータル400μlにメスアップした。これらの混合液を、4つのマイクロチューブに分け、サーマルサイクラーを用いてPCR反応を行った。これを、エタノール沈殿により精製し、40μlの純水に溶解した。PCR反応後の溶液の一部をとり電気泳動で確認したところ、増幅したDNAの塩基長は、およそ960塩基であり配列番号4のDNA(968塩基)が増幅されていることを確認した。
【0080】
次いで、9塩基のランダムプライマー(タカラバイオ(株)製)を6mg/mlの濃度に溶かし、上記のPCR反応後精製したDNA溶液に2μl加えた。この溶液を100℃に加熱した後、氷上で急冷した。これらにKlenow Fragment(タカラバイオ(株)製)付属のバッファーを5μl、dNTP混合物(dATP、dTTP、dGTPの濃度はそれぞれ2.5mM、dCTPの濃度は400μM)を2.5μl加えた。さらに、Cy3−dCTP(GEヘルスケアバイオサイエンス製)を2μl加えた。この溶液に10UのKlenow Fragmentを加え、37℃で20時間インキュベートし、Cy3で標識された被検物質DNAを得た。なお、標識の際ランダムプライマーを用いたので、被検物質DNAの長さにはばらつきがある。最も長い被検物質DNAは配列番号4のDNA(968塩基)となる。なお、被検物質DNAの溶液を取り出して、電気泳動で確認したところ、960塩基に相当する付近にもっとも強いバンドが現れ、それより短い塩基長に対応する領域に薄くスメアがかかった状態であった。そして、これをエタノール沈殿により精製し、乾燥した。
【0081】
この標識化された被検物質DNAを、1重量%BSA(ウシ血清アルブミン)、5×SSC(5×SSCとは、20×SSC(シグマ製)を純水にて4倍に希釈した液を指す。同様に、20×SSCを純水で2倍に希釈した液を10×SSC、100倍に希釈した液を0.2×SSCと表記する)、0.1重量%SDS(ドデシル硫酸ナトリウム)、0.01重量%サケ精子DNAの溶液(各濃度はいずれも終濃度)、400μlに溶解し、ハイブリダイゼーション用のストック溶液とした。
【0082】
以下の実施例、比較例において、ハイブリダイゼーション用の被検物質DNA溶液は、特に断りのない限り、上記で調製したストック溶液を、1重量%BSA、5×SSC、0.01重量%サケ精子DNA、0.1重量%SDSの溶液(各濃度はいずれも終濃度)で200倍に希釈したものを用いた。なお、この溶液の被検物質DNA濃度を測定したところ、3ng/μLであった。
【0083】
(ハイブリダイゼーション)
マイクロピペットを用いて、担体と容器とで囲まれた空隙(空間)5に上記で調製したハイブリダイゼーション用の被検物質溶液を貫通孔3からあふれないように注入した。封止材としてシリコンテープ(アズワン)を用い、4つの貫通孔を塞いだ。ハイブリダイゼーションチャンバー(Takara Hybridization chamber(タカラバイオ(株))をシート振盪台(東京理化器械(株)製 MMS FIT−S)に密着させて固定し、担体をハイブリダイゼーションチャンバー内にセットした。このとき、担体をセットする位置の両端の凹みに、15μLずつ超純水を滴下した。ハイブリダイゼーションチャンバーのふたを閉めて6本の固定ネジを締めて固定後、42℃に設定した恒温チャンバー(東京理化器械(株)製 FMS−1000)内に据え付けた振盪機(東京理化器械(株)製 MMS−310)の上に載せて固定した。恒温チャンバーの前面をアルミホイルで遮光して、250回転/分で旋回振盪しながら、42℃で16時間インキュベートした。インキュベート後、ハイブリダイゼーションチャンバーから担体を取り出し、溶液を保持する容器を剥がし、PDMSポリマーを脱離した後、微粒子を除いて担体を洗浄、乾燥した。
【0084】
(測定)
インキュベート後、担体から容器を剥がす前に、DNAチップの空隙内の容器表面における微粒子の分散度について、目視検査を行った。分散度は、以下の基準で評価した。分析チップに格納されている微粒子の全量は、分析チップの容器表面を約半分埋め尽くす量である。図10に示すように、分析チップの容器表面を区分線11(破線)で示すように8等分に区分けし、区分けされた各領域において微粒子によって占められた面積の割合を目視にて観察した。全ての領域において微粒子が約半分の面積を占めている場合は、微粒子の局在化なしと判定した。一方、区分けされた領域のうち微粒子が占める面積が約半分に満たない状態の領域が1つ以上ある場合は、微粒子の局在化ありと判定した。
【0085】
微粒子の分散度を評価した後、DNAチップ用のスキャナー(Axon Instruments社製 GenePix 4000B)に、容器を剥がした後の担体をセットし、レーザー出力33%、フォトマルチプライヤーの電圧設定を450にした状態で蛍光強度の測定を行った。ここでは、担体上のプローブDNAを固定化した8箇所の領域(スポット1〜8)の蛍光強度を測定して、検体DNAとプローブDNAとのハイブリダイゼーション結果を評価した。蛍光強度とはスポット内の蛍光強度の平均値である。測定対象のスポット1〜8は、図11に示すように、担体上の4隅に位置する4つのスポット(スポット1〜4)と、中心部に位置する4つのスポット(スポット5〜8)の合計8つのスポットである。結果を表1に示す。
【0086】
ハイブリダイゼーション反応後、空隙内における微粒子の分散度を目視検査した結果、空隙内の8つの領域各々において、微粒子により半分程度埋め尽くされていた。この結果から、微粒子は空隙内で局在化することなく、空隙内全体に分散して存在していることが確認できた。
【0087】
スポット1〜8における蛍光強度は、全てにおいて同程度の十分な蛍光強度が得られた。この結果から、スポットの位置による反応のむらは発生せず、反応溶液が容器内で均一に撹拌されたと考えられる。
【0088】
実施例2
実施例2では、図6および図8に示される、選択結合性物質が平坦部6に固定化された担体2と、容器内部表面に円柱状の凹陥構造8Bを有する容器1とで構成される分析チップを実施例1と同様にして作成し、実施例1と同様の評価を行った。
【0089】
プローブの固定化位置は、実施例1と同じ、担体の中央とし、溶液を保持する容器の配置位置は、実施例1と同様に中央にした。測定対象のスポット1〜8は、実施例1と同じく、図11に示すように、担体上の4隅に位置する4つのスポット(スポット1〜4)と、中心部に位置する4つのスポット(スポット5〜8)の合計8つのスポットである。結果を表1に示す。
【0090】
ハイブリダイゼーション反応後、空隙内における微粒子の分散度を目視検査した結果、微粒子は空隙内で局在化することなく、空隙内全体に分散して存在していることが確認できた。
【0091】
スポット1〜8における蛍光強度は、実施例1と同様、全てのスポットにおいて同程度の十分な蛍光強度が得られた。この結果から、スポットの位置による反応のむらは発生せず、反応溶液が容器内で均一に撹拌されたと考えられる。
【0092】
比較例1
比較例1では、容器内部表面に凹陥構造8Aを設けず平面のままとした容器を用いたこと以外は実施例1と同様に分析チップを作成し、実施例1と同様の評価を行った。結果を表1に示す。
【0093】
ハイブリダイゼーション反応後、空隙内における微粒子の分散度を目視検査した結果、微粒子は容器表面の中心部の4つの領域全てを埋め尽くしており、外部の4つの領域には殆ど微粒子は存在しなかった。この結果から、微粒子は空隙内で局在化していることが確認された。
【0094】
スポット1〜8における蛍光強度は、中心部に位置するスポットにおいては強い蛍光強度が得られたが、四隅に位置するスポットからは弱い蛍光強度が得られた。中心部に位置するスポットの中でも、スポット位置による蛍光強度のばらつきが見られた。スポット位置により反応むらが発生したことから、反応溶液の撹拌が均一に行われなかったと考えられる。
【0095】
【表1】

【符号の説明】
【0096】
1 容器
2 担体
3 貫通孔
4 微粒子
5 空隙(空間)
6 選択結合性物質がその表面に固定化される平坦部
7 選択結合性物質
8A 突起構造
8B 凹陥構造
9 選択結合性物質がその表面に固定化される凸部
10 DNA
11 微粒子の分散度評価用の8領域の区分線
R1 選択結合性物質が固定化された領域
L1 選択結合性物質が固定化されたピッチ
L2 容器表面の突起構造ピッチ
L3 容器表面の凹陥構造内部の最大径
H1 容器の空隙部深さ
H2 容器表面の突起構造の高さ
H3 容器表面の凹陥構造の深さ
H4 選択結合性物質をその表面に固定化する凸部高さ
【特許請求の範囲】
【請求項1】
表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に格納された、溶液を攪拌するための微粒子と、を含む分析チップであって、該容器表面に、溶液を攪拌するときに該微粒子が局在化することなく配置されるための区画構造を有する分析チップ。
【請求項2】
区画構造が突起構造である、請求項1に記載の分析チップ。
【請求項3】
区画構造が凹陥構造である、請求項1に記載の分析チップ。
【請求項4】
表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に格納された、溶液を攪拌するための微粒子と、を含む分析チップを用いる溶液の攪拌方法であって、分析チップの該容器表面に、該微粒子が局在化することなく配置されるための区画構造を設けることを特徴とする、溶液の撹拌方法。
【請求項1】
表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に格納された、溶液を攪拌するための微粒子と、を含む分析チップであって、該容器表面に、溶液を攪拌するときに該微粒子が局在化することなく配置されるための区画構造を有する分析チップ。
【請求項2】
区画構造が突起構造である、請求項1に記載の分析チップ。
【請求項3】
区画構造が凹陥構造である、請求項1に記載の分析チップ。
【請求項4】
表面に選択結合性物質が固定化された担体と、選択結合性物質と反応する被検物質を含む溶液を保持する容器と、該担体と該容器とによって形成される空隙内に格納された、溶液を攪拌するための微粒子と、を含む分析チップを用いる溶液の攪拌方法であって、分析チップの該容器表面に、該微粒子が局在化することなく配置されるための区画構造を設けることを特徴とする、溶液の撹拌方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2011−106897(P2011−106897A)
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願番号】特願2009−260633(P2009−260633)
【出願日】平成21年11月16日(2009.11.16)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願日】平成21年11月16日(2009.11.16)
【出願人】(000003159)東レ株式会社 (7,677)
【Fターム(参考)】
[ Back to top ]

