基質プローブ、多重核磁気共鳴法による酵素活性の検出方法および酵素活性のイメージング方法
【課題】酵素活性を高精度に検出することが可能な基質プローブならびにそれを用いた多重核磁気共鳴法による酵素活性の検出方法を提供すること。
【解決手段】多重核磁気共鳴法を用いた酵素活性測定用の基質プローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される酵素認識部位を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記酵素認識部位に特異的に存在することを特徴とする基質プローブを用いて、多重核磁気共鳴測定を行い、それらのプローブの存在と酵素活性とを検出する、或いは多重核磁気共鳴イメージング法により、酵素活性をイメージングする。
【解決手段】多重核磁気共鳴法を用いた酵素活性測定用の基質プローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される酵素認識部位を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記酵素認識部位に特異的に存在することを特徴とする基質プローブを用いて、多重核磁気共鳴測定を行い、それらのプローブの存在と酵素活性とを検出する、或いは多重核磁気共鳴イメージング法により、酵素活性をイメージングする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、酵素活性を測定するための基質プローブに関する。また、本発明は該プローブを使用した多重核磁気共鳴法による酵素活性測定方法、並びに多重核磁気共鳴イメージングによる酵素活性のイメージング方法に関する。
【背景技術】
【0002】
酵素は生体中で起こる化学反応を触媒する重要なタンパク質であり、これらの局在、活性は厳密に制御されている。様々な疾病の組織、細胞において、酵素局在の変化や酵素活性の異常な増大あるいは減少が起こっていることがわかっている。
【0003】
腫瘍細胞におけるエネルギー生産では、グルコースを原料とする解糖系が重要な役割を果たす。特に、低酸素環境である固形腫瘍では、主要なエネルギー供給ルートである。解糖系では、様々な酵素が作用しており、例えば、乳酸デヒドロゲナーゼは、嫌気的解糖系の最終段階に働くピルビン酸を乳酸に変える酵素である。解糖系の酵素活性をモニタリング(代謝マッピング)することは、低酸素環境にある固形腫瘍の早期検出に繋がるものとして期待されている。
【0004】
タンパク分解酵素、プロテアーゼは、ペプチド結合の加水分解を触媒する酵素の総称である。生体内におけるプロテアーゼは、タンパク質を栄養源としてのアミノ酸へと消化したり、細胞内で不要なタンパク質の分解機構に寄与したりしているなど、生理的な意義は極めて大きい。
【0005】
マトリックスメタロプロテアーゼ(matrixmetalloproteinase、MMP)は、腫瘍に代表される異常を呈した疾病部位において中心的な役割を果たす酵素である。非特許文献1に記載されているように、MMPは、局所的な腫瘍の成長、腫瘍の転移・浸潤にとって必要な細胞外マトリックスの分解プロセスを触媒している。細胞外マトリックスとは、生体内で細胞を支持している物質であり、例えば、コラーゲン、エラスチン、プロテオグリカン、グルコサミノグリカン、フィブロネクチン、ラミニン、ビトロネクチンなどから成る。腫瘍部位では、多くの種類のMMP発現が時空間的に制御され、その多くは高発現していることが分かっており、また腫瘍の転移・浸潤においても、しばしばMMP発現の増加を伴う。そのため、MMPファミリーは腫瘍マーカーや抗癌剤開発の有効なターゲットとして期待されている。
【0006】
疾病と密接に関連するMMP等の酵素活性をモニタリングすることは、医学生物学研究、臨床検査分野ならびに体内画像診断領域において、極めて重要かつ有効であることに異論は無い。これを高感度かつ高精度で実現するためには、酵素活性を高感度にモニタリングするプローブ分子やそれらを検出する手法の開発が必要である。
【0007】
プロテアーゼを含む酵素活性を検出するためのプローブは、インビトロ、インビボに使用されるいずれの形態についても、文献に開示されている。一般には分解酵素の基質を発色団もしくは発光団で標識し、分解酵素による基質の切断後に発生する発色もしくは発光を検出することで酵素活性を測定する方法がとられる。画像診断領域においては、ガドリニウムを用いたベータ−ガラクトシダーゼ活性MRI(核磁気共鳴イメージング)プローブ(例えば非特許文献2参照)、近赤外蛍光色素を用いたプロテアーゼ活性化蛍光プローブ(例えば特許文献1、非特許文献3参照)、磁性微粒子を用いた酵素活性MRIプローブ(例えば非特許文献4参照)などが報告されている。
【0008】
これらの従来技術には、以下のような問題が残されている。まず、MRIのプローブを用いた場合には、酵素的に活性化された結果引き起こされる緩和度変化が比較的小さく、緩和度変化を観察しているのかプローブの存在濃度の違いを観察しているのか明確に判別できない。また、発光あるいは蛍光プローブを用いた場合には、生体の低い光透過性や生体内散乱により体内深部からの信号を明確に捉えることは困難である。さらには、化学修飾や標識によるプローブの基質特異性の低下も問題となる。また、プローブの生体適合性の低さから、投与量を制限することになり、その結果、酵素活性のモニタリング時のシグナル/ノイズ比を減少させる。これらの課題を解決する基質プローブならびに酵素活性検出手法はこれまでに知られていない。
【0009】
ところで、生体内における関心対象物の分布や構造を経時的に測定することを目的とする、安定同位体標識化合物を用いたNMR(核磁気共鳴)検出が試みられている(特許文献2ならびに非特許文献5参照)。特許文献2では、13C及び15Nで標識したオリゴヌクレオチドの検出を生体成分中で行っている。非特許文献5では、生体内に投与された13Cグルコースの代謝マッピングを行っている。しかしながら、これまでに、安定同位体標識された基質プローブを用いた3重共鳴以上の多重核磁気共鳴法による酵素活性の検出の試みは行われておらず、また、それに用いることのできる基質プローブも明らかにされていない。
【特許文献1】特表2002-514610号公報
【特許文献2】特開2000-290291号公報
【非特許文献1】Deryugina EI et al. Cancer Metastasis Rev. v25, 9-34. (2006)
【非特許文献2】Moats RA et al., Angew. Chem. Int. Ed. Engl., v36, 726-728 (1997)
【非特許文献3】Bremer C et al., Nature medicine, v7, 743-748 (2001)
【非特許文献4】Perez JM et al., Nature Biotechnology, v20, 816 - 820 (2002)
【非特許文献5】Watanabe H et al. Manetic Resonance in Medicine v43, 525-533 (2000)
【発明の開示】
【発明が解決しようとする課題】
【0010】
酵素活性検出の感度と精度を信頼できるレベルに高めるためには、酵素活性の基質プローブの存在を検出でき、かつ酵素活性をモニタリングできる系において検出することが好ましい。さらには、該プローブは高い生体適合性を有し、かつ低侵襲性の検出系が実用的にも望ましい。
【0011】
そこで、本発明は、新規な基質プローブならびにそれを用いた多重核磁気共鳴法による酵素活性の検出方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明者らは、酵素認識部位に安定同位体標識された基質プローブを用いた多重核磁気共鳴法を組み合わせることにより、微量の酵素の活性が、高感度でしかも簡便に測定できることを見いだし、本発明を完成した。
【0013】
第1の本発明は、多重核磁気共鳴法を用いた酵素活性測定用の基質プローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される部位(以下、単に「酵素認識部位」ということもある)を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記酵素認識部位に特異的に存在することを特徴とする基質プローブである。
【0014】
第2の本発明は、第1の発明にかかる基質プローブによる多重核磁気共鳴を利用した酵素活性の測定方法であって、活性状態の酵素による前記基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法による酵素活性の測定方法である。
【0015】
第3の本発明は、第1の発明にかかる基質プローブによる多重核磁気共鳴イメージングを利用した酵素活性のイメージング方法であって、活性状態の酵素による基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする酵素活性のイメージング方法である。
【0016】
第4の本発明は、疾病に関連した異常な酵素活性を検出するための、第1の発明にかかる基質プローブからなる核磁気共鳴イメージング用の基質プローブである。
【0017】
第5の本発明は、疾病に関連した異常な酵素活性を検出するための、第1の発明にかかる基質プローブを用いた核磁気共鳴イメージング方法である。
【0018】
第6の本発明は、多重核磁気共鳴法を用いたプロテアーゼ活性測定用の基質ペプチドプローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態のプロテアーゼによって選択的に認識され、切断されるプロテアーゼ切断部位を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記プロテアーゼ切断部位に特異的に存在することを特徴とする基質ペプチドプローブである。
【0019】
第7の本発明は、第6の発明にかかる基質ペプチドプローブによる多重核磁気共鳴法を利用したプロテアーゼ活性の測定方法であって、
活性状態のプロテアーゼによる前記基質ペプチドプローブの切断に伴う多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法によるプロテアーゼ活性の測定方法である。
【0020】
第8の本発明は、第6の発明にかかる基質ペプチドプローブによる多重核磁気共鳴イメージングを利用したプロテアーゼ活性のイメージング方法であって、
活性状態のプロテアーゼによる基質ペプチドプローブの切断に伴う多重核磁気共鳴信号の変化を測定することを特徴とするプロテアーゼ活性のイメージング方法である。
【0021】
第9の本願発明は、疾病に関連した異常なプロテアーゼ活性を検出するための、第6の発明にかかる基質ペプチドプローブからなる核磁気共鳴イメージング用基質プローブである。
【0022】
第10の本願発明は、疾病に関連した異常なプロテアーゼ活性を検出するための、第6の発明にかかる基質ペプチドプローブを用いた核磁気共鳴イメージング方法である。
【0023】
第11の本願発明は、多重核磁気共鳴法を用いた酵素活性測定用の基質プローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される部位を含み、酵素反応によって、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が存在するようになることを特徴とする基質プローブである。
【0024】
第12の本願発明は、第11の発明にかかる基質プローブによる多重核磁気共鳴を利用した酵素活性の測定方法であって、
活性状態の酵素による前記基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法による酵素活性の測定方法である。
【0025】
第13の本願発明は、第11の発明にかかる基質プローブによる多重核磁気共鳴イメージングを利用した酵素活性のイメージング方法であって、
活性状態の酵素による基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする酵素活性のイメージング方法である。
【0026】
第14の本願発明は、疾病に関連した異常な酵素活性を検出するための、第11の発明にかかる基質プローブからなる核磁気共鳴イメージング用の基質プローブである。
【0027】
第15の本願発明は、疾病に関連した異常な酵素活性を検出するための、第11の発明にかかる基質プローブを用いた核磁気共鳴イメージング方法である。
【発明の効果】
【0028】
本発明の酵素活性測定用の基質プローブは、該酵素によって選択的に認識される部位を含み、この認識部位に特異的に、核スピンを持ち異なる共鳴周波数を有する少なくとも3つのNMR活性核が連結しているので、多重核磁気共鳴法により、プローブのみを選択的に観測でき、酵素活性の高感度検出が可能になる。さらには、該プローブは高い生体適合性を有しており、多重核磁気共鳴イメージングによって、生体内の酵素活性を位置情報と共に詳細に解析することが可能である。
【0029】
本発明によれば、新規な高い生体適合性を有する酵素活性測定用の基質プローブ、並びにそれを用いた高シグナル/ノイズ比を持った酵素活性の検出方法及び酵素活性のイメージング方法を提供することができる。
【発明を実施するための最良の形態】
【0030】
本発明で提供される酵素活性測定用の基質プローブは、酵素によって認識される部位を含む化合物、すなわち酵素により特異的に認識され、その一部が化学変化する部位もしくはドメインを構成単位として持った基質化合物である。構成単位として持つとは、当該酵素認識部位を少なくとも一つ以上有することを意味し、本発明の基質プローブは、複数の酵素認識部位を有するものであってもよい。本実施形態においては、この酵素認識部位に、核スピンを持ち共鳴周波数の異なる少なくとも3つの核磁気共鳴活性核(NMR活性核)が連結した基が、特異的に存在している。なお、本発明において、「認識部位に特異的に」というのは、機能的にいえば、酵素反応の前後で、共鳴が生じる/共鳴が生じない、といった変化を生じたり、酵素反応の前後で共鳴周波数がシフトしたりするような位置に、という意味である。
【0031】
本発明において、酵素とは、酵素反応を触媒するタンパク質のことをいう。例えば、酸化還元酵素、転移酵素、加水分解酵素、リアーゼ、異性化酵素、リガーゼ等が挙げられる。
【0032】
本発明において、酵素の基質とは、該酵素反応の作用を受ける物質のことをいう。これらの酵素の基質であり、基質プローブとして用いることができる物質として、低分子化合物、高分子化合物、アミノ酸、ペプチド、タンパク質、核酸、ポリヌクレオチド等が挙げられる。より具体的には、プロテアーゼ認識ペプチド、ピルビン酸、アセチルコリン、コリンエステル、コリン、グルコースなどが挙げられる。
【0033】
本発明で提供される酵素活性測定用の基質プローブとして、細胞の嫌気的な解糖系代謝に関与する酵素に対する基質を用いることができる。嫌気的な解糖系代謝では、グルコースからATPが提供され、乳酸ならびにアラニンが生成される。腫瘍組織では嫌気的な解糖系代謝が亢進していることが知られており、グルコースの取り込みや乳酸生成が活発化している。解糖系代謝に関与する酵素は、ヘキソキナーゼ、グルコースリン酸イソメラーゼ、ホスホフルクトキナーゼ、アルドラーゼ、トリオースリン酸イソメラーゼ、グリセルアルデヒド-3-リン酸デヒドロゲナーゼ、ホスホグリセリン酸キナーゼ、ホスホグリセロムターゼ、エノラーゼ、ピルビン酸キナーゼ、乳酸デヒドロゲナーゼなどがある。これらの酵素に対する基質を基質プローブとして用いて酵素の活性を検出することで、解糖系代謝の状態をモニタリングすることが可能になり、さらには解糖系代謝が亢進している腫瘍組織を検出することが可能になる。
【0034】
乳酸デヒドロゲナーゼの活性を検出するために、下記式(2)で示される同位体標識ピルビン酸、又はその塩を好適に用いることができる。この基質プローブでは、ピルビン酸の2位炭素と3位炭素が13Cで標識されている。乳酸デヒドロゲナーゼはピルビン酸を乳酸に変換する酵素であり、実施例で後述するように、同位体標識ピルビン酸を投与された細胞により生成した、下記式(3)で示される乳酸のメチンプロトンの多重核磁気共鳴信号を選択的に検出することができる。
【0035】
【化1】

【0036】
【化2】

【0037】
また、解糖系酵素の全体活性、すなわち解糖系代謝活性を検出するために、下記式(4)で示される重水素化された同位体標識グルコースD-Glucose-13C6,1,2,3,4,5,6,6-d7(以下、13C6,2H7-D-glucoseと略すことがある)を好適に用いることができる。この基質プローブでは、式(4)に示すとおり、グルコースの1位〜6位の全ての炭素原子が13Cで標識され、これら1位〜6位の炭素原子に結合する全ての水素原子7個が重水素化されている。式(5)に示すように、この基質プローブは、解糖系代謝反応を受け、乳酸あるいはアラニンへと変換した際に、検出しうるプロトンが存在するようになる。従って、この基質プローブを用いることで、グルコースの解糖系代謝産物である乳酸あるいはアラニンの多重核磁気共鳴信号を選択的に取得することができ、解糖系代謝活性を検出することが出来る。
【0038】
【化3】

【0039】
【化4】

【0040】
次に、基質プローブとして、プロテアーゼ認識ペプチド配列を有するペプチド又はタンパク質を用いる場合について説明する。
【0041】
本発明で提供されるプロテアーゼ活性測定用の基質ペプチドプローブは、プロテアーゼによって切断される部位(以下、プロテアーゼ切断部位という)を含むペプチド、すなわちプロテアーゼにより特異的に認識され、その一部が切断されるアミノ酸配列を有する部位もしくはドメインを構成単位として持ったペプチドである。構成単位として持つとは、当該プロテアーゼ切断部位を少なくとも一つ以上有することを意味し、本発明の基質ペプチドプローブは、複数のプロテアーゼ切断部位を有するものであってもよい。本実施形態においては、このプロテアーゼ切断部位に、核スピンを持ち共鳴周波数の異なる少なくとも3つの核磁気共鳴活性核(NMR活性核)が連結した基が、特異的に存在している。なお、本発明において、「切断部位に特異的に」というのは、機能的にいえば、切断の前後で、共鳴が生じる/共鳴が生じない、といった変化を生じたり、切断の前後で共鳴周波数がシフトしたりするような位置に、という意味である。
【0042】
本発明でペプチドとは、アミノ酸が複数の結合したアミノ酸が結合したポリペプチドを意味する。なお、アミノ酸の結合数が30〜50個程度以下のポリペプチドをオリゴペプチドと呼ぶことがある。オリゴペプチドや蛋白質も当然本発明でいうペプチドの範疇に入る。アミノ酸は通常はL体であるが、プロテアーゼの認識配列部分以外のアミノ酸はD体でもよく、さらには非天然アミノ酸でもよい。
【0043】
より具体的には、本発明の基質ペプチドプローブにおけるプロテアーゼ切断部位とは、プロテアーゼに特異的に認識されるアミノ酸配列を有しており、そのアミノ酸配列が活性状態のプロテアーゼに特異的に認識され、特異的に加水分解される部位を意味する。プロテアーゼ切断部位は、一般には、部位またはドメイン、すなわち約2から約20アミノ酸残基、通常は3から20、しばしば4または5から15アミノ酸残基である。
【0044】
本発明で測定できるプロテアーゼ活性は、ペプチドを基質とするものであれば制限されない。プロテアーゼは、ペプチド結合の加水分解を触媒とする酵素の総称であり、生体防御、活性調節、栄養吸収、タンパク質分解と再利用機構など、多岐にわたって機能している。基質プローブは、検出すべき対象プロテアーゼによって任意のアミノ酸配列を選択することができ、例えば、マトリックスメタロプロテアーゼ(MMP)は対象プロテアーゼとして好適である。MMPの中で、例えば、マトリックスメタロプロテアーゼ2(MMP2)活性の検出に用いるのであれば、アミノ酸配列GPLGVRGKを利用できる(非特許文献3及びSeltzer JL et al., The Journal of Biological Chemistry v265, 20409-20413 (1990)を参照のこと)。このような基質ペプチドプローブは、例えば通常のペプチド合成法あるいは微生物や培養細胞を使った生産系により製造することができる。
【0045】
本発明に用いる共鳴周波数の異なるNMR活性核としては、たとえば、1H、13C、15N、17O、19F、31P、29Siなどの安定同位体があげられる。これらの中で、1Hに加えて、13C(天然存在比=1.1%)、15N(天然存在比:0.366%)、17O(天然存在比=0.038%)のいずれかを用いることが好ましい。さらには、測定感度の観点からは、1Hに加えて13C又は15Nを用いることが好ましい。
【0046】
基質プローブの酵素認識部位特異的に少なくとも3つのNMR活性核の連結が形成されるように、化合物骨格における炭素、窒素等の原子を上記安定同位体で置換(標識)することで、天然存在比より人工的に濃縮してNMR活性核を有する基質プローブを得ることができる。基質ペプチドプローブの切断部位特異的に少なくとも3つのNMR活性核の連結が形成されるように、アミノ酸骨格における炭素、窒素等の原子を上記安定同位体で置換(標識)することで、天然存在比より人工的に濃縮してNMR活性核を有する基質ペプチドプローブを得ることができる。なお、本発明において、「人工的に濃縮」というのは、天然存在比よりも多い比率のNMR活性核を導入するという意味であり、NMR活性核を用いて基質プローブを人工的に合成することも包含するものである。また、本発明において、酵素認識部位に特異的に存在する核スピンを持つ核磁気共鳴活性核が人工的に濃縮されている基質プローブには、「少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される部位(酵素認識部位)を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記酵素認識部位に特異的に存在する同位体化合物」が天然存在比を超えて含有されている。
【0047】
これらの標識を基質中に導入すると、基質の分子量がごくわずかに変化するが、その分子の化学的、物理的特性は事実上変化しないため、本発明の基質プローブは天然基質と同等とみなすことができる。この点は、従来の酵素活性プローブとの大きな違いであり、生体への負担を低減し、ならびに良好な基質特異性を維持できる。
【0048】
本発明の酵素活性の検出方法(NMR法による酵素活性測定)は、基質プローブを関心対象の酵素と接触させた後に導入された安定同位体を含むNMR活性核の磁化移動による多重核磁気共鳴を測定すること、より好ましくは、二重核磁気共鳴法(二重共鳴NMR法)と三重核磁気共鳴法(三重共鳴NMR法)を組み合わせて測定することを特徴とする。
【0049】
本発明の提供する基質プローブには、酵素認識部位特異的に異なる共鳴周波数を有するNMR活性核(互いに異なる種類のNMR活性核)が少なくとも3つ連続して結合している構造を有している。NMR活性核が少なくとも3つ連続して結合している構造を酵素認識部位特異的に有することで、酵素によるプローブの認識と反応の有無を反映して核磁気共鳴信号を検出することができる。すなわち、本発明の基質プローブは核磁気共鳴イメージング用基質プローブとして機能する。好ましくは、プローブ骨格内における、1H−15N−13C、1H−13C−13C、1H−13C−15Nの配列である。このような配列を有していれば、3核間での磁化移動による3重共鳴を起こすことが可能となり、基質プローブ由来の核磁気共鳴信号を選択的に検出可能となる。なお、1H−13C−13Cのように、13Cが隣接している場合であっても、隣あう13Cに結合している基が互いに異なる場合には、これらの13Cの共鳴周波数は互いに異なるので、これらは互いに異なる核種である。これらは、1H−15N、1H−13Cの2核間での磁化移動と同様に2重核磁気共鳴測定も行うことが出来る。
【0050】
より具体的には、基質プローブの核磁気共鳴信号を、同時に励起可能な磁気共鳴装置によって、各核間の磁化移動を経由する磁気共鳴信号を、前記磁化移動を経由する第一の核(1H)の磁気共鳴信号を観測可能なパルス系列を用いて、前記同位体標識したプローブの第二の核(13Cもしくは15N)および第三の核(13Cもしくは15N)の磁気共鳴信号の情報を、第一の核(1H)の磁気共鳴信号に転嫁することにより、同位体標識されたプローブのみを選択的に観測する。前記の多重共鳴パルス系列、特に二重共鳴と三重共鳴を組み合わせて測定し、すなわち、基質プローブの存在情報と構造情報をそれぞれのパルス系列で観察する。
【0051】
一方、酵素によって、これらの3核間あるいは3核の近傍が酵素反応を受けると、3核間での磁化移動による3重共鳴を起こすことが不可能となったり、その核磁気共鳴信号が大幅に変化したりするため、これに基づき、酵素による基質の認識と反応、すなわち酵素活性を検出できる。例えば、プロテアーゼによって、これらの3核間あるいは3核の近傍が切断されると、3核間での磁化移動による3重共鳴を起こすことが不可能となったり、その核磁気共鳴信号が大幅に変化したりするため、これに基づき、プロテアーゼによるペプチドの切断を検出できる。本発明のプローブは、2核間での磁化移動による二重共鳴信号はプロテアーゼの切断に関わらず検出されるので、これはプローブの存在を示し、活性測定の内部標準として用いられる。また他の例として、前記の式(4)に示されるグルコースプローブのように、酵素反応後に初めて3重共鳴を起こすことが可能になるプローブならびにその検出系も利用できる。
【0052】
このように、本発明は、上記基質プローブによる多重核磁気共鳴を利用した酵素活性の測定方法であって、活性状態の酵素による前記基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法による酵素活性の測定方法を包含する。より詳しくは、多重核磁気共鳴法を利用した酵素活性の測定方法であって、本発明にかかる基質プローブを関心対象の酵素と接触させる工程と、二重核磁気共鳴測定による基質プローブのNMR信号から基質プローブの存在を検出する工程と、三重核磁気共鳴測定による基質プローブのNMR信号から酵素活性を検出する工程とを有することを特徴とする、酵素活性の測定方法を包含する。
【0053】
ここで、前記核磁気共鳴法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を少なくとも有することが好ましい。また、基質プローブの存在を二重核磁気共鳴信号を用いて検出し、該基質プローブが酵素反応を受けた後の物質を三重核磁気共鳴信号を用いて検出することで、前記基質プローブの存在量と前記酵素の活性とを測定することも好ましい。
【0054】
また、本発明は、単に多重核磁気共鳴法による酵素活性の検出にとどまらず、多重共鳴NMRイメージングによる酵素活性イメージングを行うことも原理的に可能にするものである。
【0055】
より具体的には、基質プローブの核磁気共鳴信号を、同時に励起可能な磁気共鳴装置によって、各核間の分極移動を経由する磁気共鳴信号を、前記分極移動を経由する第一の核(1H)の磁気共鳴信号を観測可能なパルス系列を用いて、前記同位体標識したプローブの第二の核(13Cもしくは15N)および第三の核(13Cもしくは15N)の磁気共鳴信号の情報を、第一の核(1H)の磁気共鳴信号に転嫁することにより、プローブのみを選択的に観測し、次いで、x軸、y軸およびz軸に関する勾配磁場パルスを共に印加されることにより前記プローブに由来する第一の核(1H)の磁気共鳴信号の位置情報を取得する。前記の多重共鳴パルス系列、特に二重共鳴NMR法と三重共鳴NMR法を組み合わせてイメージングし、すなわち、基質プローブの位置情報と構造情報をそれぞれのパルス系列でイメージングする。基質プローブに由来するNMR信号(二重共鳴NMR信号および三重共鳴NMR信号)の出現、消失、強度変化は基質の位置、存在量、もしくは構造情報を示す。したがって、プローブの経時的且つ定量的な検出、構造変化の検出を通して、生体内の酵素活性をイメージングすることが可能になる。
【0056】
このように、本発明は、上記プローブによる多重核磁気共鳴イメージングを利用した酵素活性のイメージング方法であって、活性状態の酵素による基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とするものを包含する。より詳しくは、多重核磁気共鳴法を利用した酵素活性のイメージング方法であって、前記基質プローブを関心対象の酵素と接触させる工程と、二重核磁気共鳴測定による前記プローブのNMR信号からプローブの存在を検出する工程と、三重核磁気共鳴測定による前記プローブのNMR信号から酵素活性を検出する工程とを有することを特徴とする酵素活性イメージング方法(多重共鳴MRIによる酵素活性のイメージング方法)を包含する。
【0057】
ここで、前記核磁気共鳴イメージング法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を有することが好ましい。また、基質プローブの存在を二重核磁気共鳴信号を用いて検出し、該基質プローブが酵素反応を受けた後の物質を三重核磁気共鳴信号で検出することで、前記基質プローブの存在量と前記酵素の活性を測定することが好ましい。
【0058】
本発明の酵素の基質プローブは、酵素の活性との相関を有する疾病の診断に用いることができ、好ましくは、MRIによる疾病に関連した異常な酵素活性のイメージング方法に用いることができる。MRI基質プローブの使用は、培養された細胞や組織を測定試料として疾病の研究を目的として使用することができる。また、当該疾病の患者の状態の診断や健常者における疾病の予防のための診断を目的として、当該基質プローブを生体、あるいは生体から取得した細胞もしくは組織に導入して、MRIによる酵素活性のイメージング方法に用いることもできる。
【0059】
本発明の基質プローブを用いる核磁気共鳴法による診断方法は、基質プローブを培養細胞、生体から採取した細胞もしくは組織、又は生体に導入する工程と、
疾病に関連した異常な酵素活性を検出することにより疾病の位置と状態をモニタリングする工程と、を有する。
【0060】
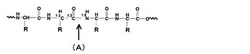
図1は、本発明のプロテアーゼ活性の検出方法に用いられるペプチドプローブの一般式における、同位体標識される核の好ましい実施形態の一つを示している。当該実施形態では、プロテアーゼ切断部位の2つのアミノ酸残基において、N末端側のアミノ酸骨格の1位炭素及び2位炭素が13Cによって標識され、かつC末端側アミノ酸はアミノ酸骨格の窒素が15Nによって標識されている。図中、Rは互いに異なっていても良いアミノ酸側鎖を示し、矢印はプロテアーゼ切断部位を示す。
【0061】
また、図2は、図1に示されるペプチドプローブがプロテアーゼによりペプチド結合加水分解された後の状態を示している。
【0062】
図3は、本発明で提供されるプロテアーゼ活性の検出方法の模式図を示している。プロテアーゼによるペプチド結合加水分解(E)が生じると、プロテアーゼ切断部位(A)でペプチド結合が切断されて、基質ペプチドプローブ(F)は、2つの断片に分割される。基質ペプチドプローブ(F)のプロテアーゼ切断部位(A)となるペプチド結合を形成するアミノ酸の一方を安定同位体標識アミノ酸(C)とし、他方を安定同位体標識アミノ酸もしくは非標識アミノ酸(D)とする。そして、それぞれの安定同位体標識アミノ酸を含む3つのNMR活性核が連結されるように対応する安定同位体により置換する。そうすると、3核間での磁化移動による3重共鳴を起こすことで得られる核磁気共鳴信号が、ペプチド結合の切断の前後で異なるので、プロテアーゼによるペプチド結合加水分解の有無を検出することができる。
【実施例】
【0063】
以下、実施例によって本発明を具体的に説明するが、本発明の範囲は実施例によって限定されるものではない。なお、以下、プロテアーゼのことを単に「酵素」と記載する場合がある。
【0064】
(実施例1:MMP2の活性検出)
(実施例1−1:MMP2の同位体標識基質ペプチドプローブの合成)
ペプチドGPLGVRGK(H-Gly-Pro-Leu-Gly-Val-Arg-Gly-Lys-NH2;配列番号1)を通常のFmoc法にて合成した。N末端側から4番目のGlyのアミノ酸骨格の1位炭素および2位炭素が13Cで標識され、N末端側から5番目のValのアミノ酸骨格の窒素が15Nで標識されているものを得るため、合成にあたって、これらの位置のGlyおよびValを結合させる際は、予めそのように同位体標識されたアミノ酸を用いた。合成は、Rink amide樹脂(Novabiochem社製)を用い、0.2 mmolスケールで合成した。合成に用いた同位体標識アミノ酸試薬(L-Valine-15N, N-FMOC誘導体、GLYCINE-13C2, F-MOC誘導体)はISOTEC社から購入した。特に断らない限り、本実験で用いた非同位体標識アミノ酸、ならびにアミノ酸合成試薬、溶媒は渡辺化学工業株式会社から購入した。アルギニン残基は、ペンタメチルジヒドロベンゾフラン− 5 − スルフォニル(pdf)基を用いて側鎖保護されたもの、一方リジン残基はt−ブトキシカルボニル(Boc)基で側鎖保護されたものを用いた。
【0065】
Fmocの脱保護は、N−メチルピロリドン(NMP)中20%ピペリジンを用いて行った。洗浄溶媒にはNMPを用いた。当該ペプチドの合成は、3等量のFmoc−アミノ酸とNMP中の3等量の2−(1H−ベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロホスフェート(HBTU)、1−ヒドロキシベンゾトリアゾール(HOBt)、ならびに6等量のジイソプロピルエチルアミン(DIEA)で、30分間のカップリングサイクルにて行った。脱保護およびカップリング後の樹脂上の遊離アミノ基の存在は、Kaiser試験(E. Kaiser, et al. (1970) Anal. Biochem., 34, 595参照)により確認した。得られたペプチド樹脂をNMP、ジクロロメタン(DCM)、及びメタノールで洗浄し、真空乾燥した。
【0066】
ペプチドからの側鎖保護基の除去、ならびに樹脂からのペプチドの解離は、ペプチド樹脂を、トリイソプロピルシラン(1%)、H2O(5%)、チオアニソール(5%)、エタンジチオール(2.5%)およびフェノール(5%)を含むトリフルオロ酢酸(TFA)中で室温2時間処理することで行った。樹脂残留物をガラスフィルターで濾別し、濾液にt−ブチルメチルエーテルを加えることで粗ペプチドを沈殿させ、遠心分離で沈殿を回収した。さらにt−ブチルメチルエーテルで洗浄し、真空乾燥させた後、30%酢酸1mLに溶解させた。
【0067】
ペプチドをHPLC(A=H2O/0.1%TFAおよびC=CH3CN/0.1%TFAで、25分に渡って勾配5〜30%C、HPLCカラムは株式会社ワイエムシィ製、YMC HPLC COLUMN、YMC−Pack ODS−A(AA12S05−2546WT),長さ250x内径4.6mm、粒子径5μm,細孔径12nm,流量は0.8mL/分、検出はUV220nm)で分析し、溶出時間18.6分のメジャーピークを分取した。MALDI−TOF質量分析計を使って、ペプチドの質量を調べた結果、同位体標識ペプチドGPLGVRGK 理論値M+H+ 785.5に対し、実測値785.6であった。分取した溶液を凍結乾燥し、精製ペプチドを得た(収量93mg,収率60%)。得られたペプチドの構造式を図4に示す。
【0068】
(実施例1−2:MMP2と基質ペプチドプローブの反応)
酵素反応用緩衝液として、TCNBバッファー(50mM Tris,10mM CaCl2,150mM NaCl,0.05% Brij 35,pH7.5 )を使用した。MMP2前駆体(R&Dシステムズ社)を、製品のプロトコールに従い、1mMの4−アミノフェニル酢酸水銀(APMA;シグマ社製)によって活性化し、活性化MMP2(以後単に、MMP2という)を得た。1μgのMMP2を反応用緩衝液0.9mLに溶解させ、前記で合成した基質ペプチドを780μg加え(ペプチド濃度1 mM)、25℃で18時間、インキュベートした。
【0069】
酵素MMP2によるペプチドの切断を、酵素反応前後のペプチド溶液のHPLC分析(A=H2O/0.1%TFAおよびC=CH3CN/0.1%TFAで、0から5分までは0%C、5分から35分に渡って勾配0〜30%C、HPLCカラムは株式会社ワイエムシィ製、YMC HPLC COLUMN、YMC−Pack ODS−A(AA12S05−2546WT),長さ250x内径4.6mm、粒子径5μm,細孔径12nm, 流量は0.8mL/分、検出はUV220nm)によりモニタリングした。酵素未処理のペプチド溶液(MMP−)と酵素反応後ペプチド溶液(MMP+)のHPLC溶出プロフィールを図5に示す。
【0070】
図5に示すように、酵素反応前(MMP−)では、シングルピークが得られた(溶出時間25.8分)。このピークを分取し、MALDI−TOF−MS分析を行った結果、同位体標識ペプチドGPLGVRGK理論値M+H+785.5に対し、実測値は785.6であった。酵素反応後(MMP+)では、2本のピークが出現した(溶出時間8.9分、24分)。これらのピークを分取し、MALDI-TOF-MS分析を行った結果、M+H+ 345.3(溶出時間24分)ならびに M+H+ 459.4(溶出時間8.9分)であった。MMP2による切断後、当該ペプチドGPLGVRGKは、GPLG(理論値M+H+ 345.2)とVRGK(理論値M+H+ 459.3)に分割される。したがって、早期に溶出される8.9分のピークはVRGKであり、遅れて溶出された24分のピークはGPLGであった。以上の結果より、合成した同位体標識ペプチドは、室温18時間の条件では、MMP2によって完全に切断されることがわかった。
【0071】
(実施例1−3:多重NMR測定(二重共鳴、三重共鳴))
得られた同位体標識ペプチドの酵素反応前と反応後の試料について、Bruker社製DRX700装置を用いて多重NMR測定を行った。試料には10%の重水を添加して、25℃、積算回数2〜512回で測定を行った。
【0072】
図6に酵素反応前(MMP−)の同位体標識ペプチド(GPLGVRGK)の1H−13C 二重共鳴のプロトンNMRスペクトルを示す。13C標識グリシンのα炭素に結合しているプロトンシグナルが3.8ppm付近に観測された。
【0073】
一方、図7には、酵素反応後(MMP+)の1H−13C二重共鳴のプロトンNMRスペクトルを示す。13C標識グリシンのα炭素に結合しているプロトンシグナルが3.6〜3.7ppm付近に観測された。
【0074】
図8に、酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドの1H−13C−13C 多重共鳴のプロトンNMRスペクトルを示す。この多重共鳴NMR観測法によれば、未切断のペプチド内1H−13C−13C−15N(グリシン−バリン)の結合は検出されず、切断後のグリシン1H−13C−13Cを選択的に観測するようになっている。従って、酵素反応前(MMP−)にはシグナルは検出されず、一方で、酵素反応後(MMP+)には3.6〜3.7ppm付近にプロトンシグナルが観測された。
【0075】
図9に、酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドの1H−13C−13C−15N多重共鳴のプロトンNMRスペクトルを示す。この多重共鳴NMR観測法では、1H−13C−13C−15Nの結合を検出するため、酵素切断部位のグリシン−バリンのペプチド結合を直接観測することになる。図9から明らかなように、酵素反応前(MMP−)には3.8ppm付近にシグナルが検出されたが、酵素反応後(MMP+)には当プロトンシグナルが完全に消失した。
【0076】
図10に、酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドの1H−15N−13C三重共鳴のプロトンNMRスペクトルを示す。この観測法では、1H−15N−13Cの結合を検出するため、酵素切断部位のグリシン−バリンのペプチド結合を直接観測することになる。図10から明らかなように、酵素反応前(MMP−)にはバリンのアミドプロトンに由来するシグナルが7.9ppm付近に検出されたが、酵素反応後(MMP+)にはそのシグナルが完全に消失した。
【0077】
図11は以上の測定結果をまとめたものである。基質ペプチドの切断に関わらず、1H−13C二重共鳴シグナルは観測され、一方、三重以上の多重共鳴シグナルは、ペプチドの切断前後でシグナルの出現もしくは消失が観測された。
【0078】
このように二重共鳴シグナルと三重以上の多重共鳴シグナルを観測することで、基質ペプチドの存在量ならびに基質ペプチドの切断に基づく酵素活性レベルをモニタリングすることが可能であった。
【0079】
(実施例2:ピルビン酸代謝反応による乳酸生成の多重共鳴NMR解析)
(実施例2−1:13Cラベル化ピルビン酸含有培地内でのHeLa細胞培養実験)
13Cラベル化ピルビン酸をDMEM(+FBS)溶液に溶解させ、7mM溶液(30ml)になるように調整し、滅菌濾過を行った。13Cラベル化ピルビン酸含有DMEM(+FBS)溶液(9ml)を入れたディッシュを3枚用意した。一枚のディッシュにつき70万個/mlのHeLa細胞を含むDMEM(+FBS, +AB)溶液(1ml)を添加し、37℃, 5% CO2の条件下で、三日間培養した。
【0080】
培養液を回収した後、各ディッシュをPBS溶液(3ml)で洗浄を行い、この洗浄液も培養液と共に回収した。その後、Trypsin-EDTA溶液(1.5ml)を添加し、セルスクレイパーを用いて細胞をディッシュから剥がした後、この溶液を別のチューブに回収した。再びPBS溶液(3ml)で洗浄を行い、細胞溶液と共に回収した。回収した培養液及び細胞溶液を凍結乾燥した。凍結乾燥後、析出してきた固体に重水(3ml)を加え、超音波処理・遠心操作(5min, 4500 rpm)した後、上澄み液を回収した。重水で更に10倍希釈した上澄み液を用いて多重共鳴NMR解析を行った。
【0081】
図12には、培養液の多重共鳴NMR測定結果を示す。1H-NMRでは、培地成分由来のピークが多数検出されたのに対し、1H-13C-13C三重共鳴では4.0ppmに乳酸のメチンプロトンのシグナルのみが検出された。ピルビン酸のメチルプロトンのシグナルは検出されなかった。図13には、培養液の1H-13C二重共鳴測定ならびに1H-13C-13C三重共鳴測定を示した。二重共鳴では培地成分由来と思われるシグナルも多数検出されが、三重共鳴ではラベル化ピルビン酸より生じた乳酸のシグナルのみが検出された。図14には、培養液の三重共鳴ならびに1H-13C HSQCの測定結果を示す。1H-13C-13C三重共鳴で検出された4.0ppmの1Hシグナルは、約60ppmにピークを有する13Cに結合している1Hであることから、乳酸のメチンプロトン由来であると考えられる。図15には、培養液ならびに細胞の1H-13C-13C三重共鳴NMR測定の結果を示す。細胞の系では、何も検出されなかった。両者ともにピルビン酸のメチルプロトンのシグナルは検出されず、乳酸のシグナルが培地のみから検出された。このことから、投与したラベル化ピルビン酸は全て消費されたと考えられる。細胞を含む溶液中での乳酸デヒドロゲナーゼ活性に基づくラベル化ピルビン酸の乳酸への変化を検出できた。
【0082】
(実施例2−2:HeLa細胞非存在下での13Cラベル化ピルビン酸含有培地内の多重共鳴測定)
次に、ネガティブコントロール実験として、上記条件でHela細胞非存在下での測定を行い、乳酸はHela細胞由来の酵素による代謝産物であることの確認を試みた。13Cラベル化ピルビン酸をDMEM(+FBS)溶液に溶解させ、7mMの溶液(10ml)になるように調整し、滅菌濾過を行った。13Cラベル化ピルビン酸含有DMEM(+FBS)溶液(9ml)を入れたディッシュを1枚用意した。HeLa細胞を含まないDMEM(+FBS, +AB)溶液(1ml)を添加し、37℃, 5% CO2の条件下で、三日間培養した。培養液を回収した後、ディッシュをPBS溶液(3ml)で洗浄を行い、この洗浄液も培養液と共に回収した。回収した培養液を凍結乾燥した。凍結乾燥後、析出してきた固体に重水(1ml)を加え、超音波処理・遠心操作(5min, 4500 rpm)を行った。上澄み液(50ml)を重水で更に10倍希釈し、多重共鳴NMR解析を行った。
【0083】
図16には、細胞非存在下のネガティブコントロール実験とHeLa細胞培養実験の1H-13C-13C三重共鳴測定結果を示した。無細胞条件下で培養した場合は、乳酸のピークは検出されず、ピルビン酸のメチルプロトン由来のピーク(約2.2ppm)が検出された。このことから、ピルビン酸が乳酸へと代謝されたのは、細胞由来の酵素による代謝反応によるものであることがわかった。以上の結果より、乳酸デヒドロゲナーゼによる13Cラベル化ピルビン酸の乳酸への代謝反応を三重共鳴測定により、高コントラストで検出することが可能であった。
【0084】
(実施例3:同位体標識グルコース(13C6,2H7-D-glucose)を用いた解糖反応の選択的検出)
(実施例3−1:担癌マウスの作製)
colon-26細胞を培養していたディッシュから培地を除去し、PBSで洗浄した後、Trypsin(5ml)を加え細胞を剥がした。その細胞浮遊液に培地を加えてチューブに移し遠心分離で細胞を沈殿させた後、上澄み液を除去し、PBS(10ml)に溶解させた。細胞数をカウントして、4.0×107 個/mlになるように調整したcolon-26細胞溶液を、BALB/cマウスの左足の皮下に100 ml投与した。その後、ほぼ1日間絶食させた。
【0085】
(実施例3−2:13C6,2H7-D-glucoseの投与・解剖・NMR解析)
担癌マウスの体重比で5g/kgとなるように13C6,2H7-D-glucose のPBS溶液(200ml)を担癌マウスに、尻尾の静脈から投与した。1時間経過後、マウスを開切し、必要な臓器 (血液(200ml)・肝臓・腎臓・癌部位・心臓) を順に取り出した。血液以外の組織を生理食塩水で洗浄した後、それぞれエッペンチューブに回収した。これに10% trichloroacetic acid (500 ml) を加え、ビーズを用いて各臓器をすり潰した後、氷上で30分間インキュベートした。遠心分離(4℃, 12000rpm, 5min)で不溶物を沈殿させた後、上澄み液を回収した。再び沈殿物に10% trichloroacetic acid (200 ml)を加え、遠心分離(4℃, 12000rpm, 5min)した後、この上澄み液も回収し、全上澄み液を凍結乾燥した。凍結乾燥した各組織の抽出物に重水(700ml)を加え、多重共鳴NMR解析を行った。
【0086】
図17には、13C6,2H7-D-glucoseを投与してから1時間後の担癌マウスの癌部位のNMR測定結果を示す。1H-NMRでは内在物のシグナルが多数検出され、1H-13C二重共鳴においても多くのシグナルが消去されたが、複数のシグナルが検出された。1H-13C-13C三重共鳴になると、二つのシグナルだけが検出された。一方が乳酸のシグナルで、もう一方はアラニンのシグナルであると予想される。図18には、癌部位の1H-13C-13C三重共鳴NMR測定結果と1H-13C HSQC測定結果との比較を示した。4.2ppmの1Hシグナルは、約67ppmに13Cピークを有する炭素に結合していることから、乳酸のメチンプロトン由来であることがわかる。4.0ppmの1Hシグナルは、約50ppmに13Cシグナルを有するので、アラニン由来1H-13C-13Cであることがわかる。以上の結果より、13C6,2D7グルコースを用いた三重共鳴解析により、解糖反応の最終段階のみを選択的に検出することが可能であった。
【0087】
図19には、心臓、腎臓、肝臓、血液、癌部位におけるスペクトルを示した。強度はそれぞれの臓器重量で規格化した(単位重量あたりのシグナル強度)。癌部位において最大のシグナル強度を示した。ラベル化グルコースが癌に高い選択性をもって集積していることが示された。特にアラニンのシグナルは血液や肝臓、腎臓においては極めて低強度であり、癌部位での高い選択的検出が可能であった。
【0088】
図20には、担癌マウスの体重比で3g/kgとなるように13C6,2H7-D-glucoseを投与したときの結果を示す。シグナル強度は臓器重量で規格化されている。癌部位において乳酸のシグナルが最大となった。一方、心臓においては、アラニンのシグナルが殆ど検出できなかった。
【図面の簡単な説明】
【0089】
【図1】本発明で提供される基質ペプチドプローブの構造式を示す略図である(Rは各アミノ酸の側鎖部分を示す)。
【図2】プロテアーゼ切断後の基質ペプチドプローブの構造式を示す略図である。
【図3】本発明で提供されるプロテアーゼ活性の検出方法の模式図である。
【図4】合成した同位体標識ペプチドGPLGVRGKの構造式を示す図である。
【図5】MMP2による同位体標識ペプチドGPLGVRGKの切断前後のHPLC溶出プロフィールを示す図である。
【図6】酵素反応前の同位体標識ペプチドGPLGVRGKの1H−13C二重共鳴のプロトンNMRスペクトルを示す図である。
【図7】酵素反応後の同位体標識ペプチドGPLGVRGKの1H−13C二重共鳴のプロトンNMRスペクトルを示す図である。
【図8】酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドGPLGVRGKの1H−13C−13C多重共鳴のプロトンNMRスペクトルを示す図である。
【図9】酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドGPLGVRGKの1H−13C−13C−15N多重共鳴のプロトンNMRスペクトルを示す図である。
【図10】酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドGPLGVRGKの1H−15N−13C三重共鳴のプロトンNMRスペクトルを示す図である。
【図11】酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドGPLGVRGKの二重共鳴NMRならびに三重以上の多重共鳴NMRのプロトンシグナルの化学シフトを示す表である。
【図12】13Cラベル化ピルビン酸含有培地内でのHeLa細胞培養液の1H-NMR、1H-13C-13C 三重共鳴NMRのスペクトルを示す図である。
【図13】13Cラベル化ピルビン酸含有培地内でのHeLa細胞培養液の1H-13C二重共鳴NMR、1H-13C-13C三重共鳴NMRスペクトルを示す図である。
【図14】13Cラベル化ピルビン酸含有培地内でのHeLa細胞培養液の1H-13C-13C三重共鳴NMRと1H-13C HSQCスペクトルを示す図である。
【図15】13Cラベル化ピルビン酸含有培地内でのHeLa細胞培養液およびHeLa細胞の1H-13C-13C三重共鳴NMRのスペクトルを示す図である。
【図16】細胞非存在下のネガティブコントロール実験とHeLa細胞存在下の培養液の1H-13C-13C三重共鳴NMRスペクトルを示す図である。
【図17】13C6,2H7-D-glucoseを投与された担癌マウスの癌部位のNMRスペクトルを示す図である。
【図18】13C6,2H7-D-glucoseを投与された担癌マウスの癌部位の1H-13C-13C三重共鳴NMRスペクトルと1H-13C HSQCスペクトルを示す図である。
【図19】13C6,2H7-D-glucoseを投与(5g/kg)された担癌マウスの心臓、腎臓、肝臓、血液、癌部位の1H-13C-13C三重共鳴NMRスペクトルを示す図である。
【図20】13C6,2H7-D-glucoseを投与(3g/kg)された担癌マウスの心臓、腎臓、肝臓、血液、癌部位の1H-13C-13C三重共鳴NMRスペクトルを示す図である。
【符号の説明】
【0090】
A:プロテアーゼ切断部位
B:非標識アミノ酸
C:安定同位体標識アミノ酸
D:安定同位体標識アミノ酸もしくは非標識アミノ酸
E:プロテアーゼによるペプチド結合加水分解
F:基質ペプチドプローブ
G:多重核磁気共鳴測定によるプローブ検出ならびに結合切断検出
【技術分野】
【0001】
本発明は、酵素活性を測定するための基質プローブに関する。また、本発明は該プローブを使用した多重核磁気共鳴法による酵素活性測定方法、並びに多重核磁気共鳴イメージングによる酵素活性のイメージング方法に関する。
【背景技術】
【0002】
酵素は生体中で起こる化学反応を触媒する重要なタンパク質であり、これらの局在、活性は厳密に制御されている。様々な疾病の組織、細胞において、酵素局在の変化や酵素活性の異常な増大あるいは減少が起こっていることがわかっている。
【0003】
腫瘍細胞におけるエネルギー生産では、グルコースを原料とする解糖系が重要な役割を果たす。特に、低酸素環境である固形腫瘍では、主要なエネルギー供給ルートである。解糖系では、様々な酵素が作用しており、例えば、乳酸デヒドロゲナーゼは、嫌気的解糖系の最終段階に働くピルビン酸を乳酸に変える酵素である。解糖系の酵素活性をモニタリング(代謝マッピング)することは、低酸素環境にある固形腫瘍の早期検出に繋がるものとして期待されている。
【0004】
タンパク分解酵素、プロテアーゼは、ペプチド結合の加水分解を触媒する酵素の総称である。生体内におけるプロテアーゼは、タンパク質を栄養源としてのアミノ酸へと消化したり、細胞内で不要なタンパク質の分解機構に寄与したりしているなど、生理的な意義は極めて大きい。
【0005】
マトリックスメタロプロテアーゼ(matrixmetalloproteinase、MMP)は、腫瘍に代表される異常を呈した疾病部位において中心的な役割を果たす酵素である。非特許文献1に記載されているように、MMPは、局所的な腫瘍の成長、腫瘍の転移・浸潤にとって必要な細胞外マトリックスの分解プロセスを触媒している。細胞外マトリックスとは、生体内で細胞を支持している物質であり、例えば、コラーゲン、エラスチン、プロテオグリカン、グルコサミノグリカン、フィブロネクチン、ラミニン、ビトロネクチンなどから成る。腫瘍部位では、多くの種類のMMP発現が時空間的に制御され、その多くは高発現していることが分かっており、また腫瘍の転移・浸潤においても、しばしばMMP発現の増加を伴う。そのため、MMPファミリーは腫瘍マーカーや抗癌剤開発の有効なターゲットとして期待されている。
【0006】
疾病と密接に関連するMMP等の酵素活性をモニタリングすることは、医学生物学研究、臨床検査分野ならびに体内画像診断領域において、極めて重要かつ有効であることに異論は無い。これを高感度かつ高精度で実現するためには、酵素活性を高感度にモニタリングするプローブ分子やそれらを検出する手法の開発が必要である。
【0007】
プロテアーゼを含む酵素活性を検出するためのプローブは、インビトロ、インビボに使用されるいずれの形態についても、文献に開示されている。一般には分解酵素の基質を発色団もしくは発光団で標識し、分解酵素による基質の切断後に発生する発色もしくは発光を検出することで酵素活性を測定する方法がとられる。画像診断領域においては、ガドリニウムを用いたベータ−ガラクトシダーゼ活性MRI(核磁気共鳴イメージング)プローブ(例えば非特許文献2参照)、近赤外蛍光色素を用いたプロテアーゼ活性化蛍光プローブ(例えば特許文献1、非特許文献3参照)、磁性微粒子を用いた酵素活性MRIプローブ(例えば非特許文献4参照)などが報告されている。
【0008】
これらの従来技術には、以下のような問題が残されている。まず、MRIのプローブを用いた場合には、酵素的に活性化された結果引き起こされる緩和度変化が比較的小さく、緩和度変化を観察しているのかプローブの存在濃度の違いを観察しているのか明確に判別できない。また、発光あるいは蛍光プローブを用いた場合には、生体の低い光透過性や生体内散乱により体内深部からの信号を明確に捉えることは困難である。さらには、化学修飾や標識によるプローブの基質特異性の低下も問題となる。また、プローブの生体適合性の低さから、投与量を制限することになり、その結果、酵素活性のモニタリング時のシグナル/ノイズ比を減少させる。これらの課題を解決する基質プローブならびに酵素活性検出手法はこれまでに知られていない。
【0009】
ところで、生体内における関心対象物の分布や構造を経時的に測定することを目的とする、安定同位体標識化合物を用いたNMR(核磁気共鳴)検出が試みられている(特許文献2ならびに非特許文献5参照)。特許文献2では、13C及び15Nで標識したオリゴヌクレオチドの検出を生体成分中で行っている。非特許文献5では、生体内に投与された13Cグルコースの代謝マッピングを行っている。しかしながら、これまでに、安定同位体標識された基質プローブを用いた3重共鳴以上の多重核磁気共鳴法による酵素活性の検出の試みは行われておらず、また、それに用いることのできる基質プローブも明らかにされていない。
【特許文献1】特表2002-514610号公報
【特許文献2】特開2000-290291号公報
【非特許文献1】Deryugina EI et al. Cancer Metastasis Rev. v25, 9-34. (2006)
【非特許文献2】Moats RA et al., Angew. Chem. Int. Ed. Engl., v36, 726-728 (1997)
【非特許文献3】Bremer C et al., Nature medicine, v7, 743-748 (2001)
【非特許文献4】Perez JM et al., Nature Biotechnology, v20, 816 - 820 (2002)
【非特許文献5】Watanabe H et al. Manetic Resonance in Medicine v43, 525-533 (2000)
【発明の開示】
【発明が解決しようとする課題】
【0010】
酵素活性検出の感度と精度を信頼できるレベルに高めるためには、酵素活性の基質プローブの存在を検出でき、かつ酵素活性をモニタリングできる系において検出することが好ましい。さらには、該プローブは高い生体適合性を有し、かつ低侵襲性の検出系が実用的にも望ましい。
【0011】
そこで、本発明は、新規な基質プローブならびにそれを用いた多重核磁気共鳴法による酵素活性の検出方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
本発明者らは、酵素認識部位に安定同位体標識された基質プローブを用いた多重核磁気共鳴法を組み合わせることにより、微量の酵素の活性が、高感度でしかも簡便に測定できることを見いだし、本発明を完成した。
【0013】
第1の本発明は、多重核磁気共鳴法を用いた酵素活性測定用の基質プローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される部位(以下、単に「酵素認識部位」ということもある)を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記酵素認識部位に特異的に存在することを特徴とする基質プローブである。
【0014】
第2の本発明は、第1の発明にかかる基質プローブによる多重核磁気共鳴を利用した酵素活性の測定方法であって、活性状態の酵素による前記基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法による酵素活性の測定方法である。
【0015】
第3の本発明は、第1の発明にかかる基質プローブによる多重核磁気共鳴イメージングを利用した酵素活性のイメージング方法であって、活性状態の酵素による基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする酵素活性のイメージング方法である。
【0016】
第4の本発明は、疾病に関連した異常な酵素活性を検出するための、第1の発明にかかる基質プローブからなる核磁気共鳴イメージング用の基質プローブである。
【0017】
第5の本発明は、疾病に関連した異常な酵素活性を検出するための、第1の発明にかかる基質プローブを用いた核磁気共鳴イメージング方法である。
【0018】
第6の本発明は、多重核磁気共鳴法を用いたプロテアーゼ活性測定用の基質ペプチドプローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態のプロテアーゼによって選択的に認識され、切断されるプロテアーゼ切断部位を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記プロテアーゼ切断部位に特異的に存在することを特徴とする基質ペプチドプローブである。
【0019】
第7の本発明は、第6の発明にかかる基質ペプチドプローブによる多重核磁気共鳴法を利用したプロテアーゼ活性の測定方法であって、
活性状態のプロテアーゼによる前記基質ペプチドプローブの切断に伴う多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法によるプロテアーゼ活性の測定方法である。
【0020】
第8の本発明は、第6の発明にかかる基質ペプチドプローブによる多重核磁気共鳴イメージングを利用したプロテアーゼ活性のイメージング方法であって、
活性状態のプロテアーゼによる基質ペプチドプローブの切断に伴う多重核磁気共鳴信号の変化を測定することを特徴とするプロテアーゼ活性のイメージング方法である。
【0021】
第9の本願発明は、疾病に関連した異常なプロテアーゼ活性を検出するための、第6の発明にかかる基質ペプチドプローブからなる核磁気共鳴イメージング用基質プローブである。
【0022】
第10の本願発明は、疾病に関連した異常なプロテアーゼ活性を検出するための、第6の発明にかかる基質ペプチドプローブを用いた核磁気共鳴イメージング方法である。
【0023】
第11の本願発明は、多重核磁気共鳴法を用いた酵素活性測定用の基質プローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される部位を含み、酵素反応によって、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が存在するようになることを特徴とする基質プローブである。
【0024】
第12の本願発明は、第11の発明にかかる基質プローブによる多重核磁気共鳴を利用した酵素活性の測定方法であって、
活性状態の酵素による前記基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法による酵素活性の測定方法である。
【0025】
第13の本願発明は、第11の発明にかかる基質プローブによる多重核磁気共鳴イメージングを利用した酵素活性のイメージング方法であって、
活性状態の酵素による基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする酵素活性のイメージング方法である。
【0026】
第14の本願発明は、疾病に関連した異常な酵素活性を検出するための、第11の発明にかかる基質プローブからなる核磁気共鳴イメージング用の基質プローブである。
【0027】
第15の本願発明は、疾病に関連した異常な酵素活性を検出するための、第11の発明にかかる基質プローブを用いた核磁気共鳴イメージング方法である。
【発明の効果】
【0028】
本発明の酵素活性測定用の基質プローブは、該酵素によって選択的に認識される部位を含み、この認識部位に特異的に、核スピンを持ち異なる共鳴周波数を有する少なくとも3つのNMR活性核が連結しているので、多重核磁気共鳴法により、プローブのみを選択的に観測でき、酵素活性の高感度検出が可能になる。さらには、該プローブは高い生体適合性を有しており、多重核磁気共鳴イメージングによって、生体内の酵素活性を位置情報と共に詳細に解析することが可能である。
【0029】
本発明によれば、新規な高い生体適合性を有する酵素活性測定用の基質プローブ、並びにそれを用いた高シグナル/ノイズ比を持った酵素活性の検出方法及び酵素活性のイメージング方法を提供することができる。
【発明を実施するための最良の形態】
【0030】
本発明で提供される酵素活性測定用の基質プローブは、酵素によって認識される部位を含む化合物、すなわち酵素により特異的に認識され、その一部が化学変化する部位もしくはドメインを構成単位として持った基質化合物である。構成単位として持つとは、当該酵素認識部位を少なくとも一つ以上有することを意味し、本発明の基質プローブは、複数の酵素認識部位を有するものであってもよい。本実施形態においては、この酵素認識部位に、核スピンを持ち共鳴周波数の異なる少なくとも3つの核磁気共鳴活性核(NMR活性核)が連結した基が、特異的に存在している。なお、本発明において、「認識部位に特異的に」というのは、機能的にいえば、酵素反応の前後で、共鳴が生じる/共鳴が生じない、といった変化を生じたり、酵素反応の前後で共鳴周波数がシフトしたりするような位置に、という意味である。
【0031】
本発明において、酵素とは、酵素反応を触媒するタンパク質のことをいう。例えば、酸化還元酵素、転移酵素、加水分解酵素、リアーゼ、異性化酵素、リガーゼ等が挙げられる。
【0032】
本発明において、酵素の基質とは、該酵素反応の作用を受ける物質のことをいう。これらの酵素の基質であり、基質プローブとして用いることができる物質として、低分子化合物、高分子化合物、アミノ酸、ペプチド、タンパク質、核酸、ポリヌクレオチド等が挙げられる。より具体的には、プロテアーゼ認識ペプチド、ピルビン酸、アセチルコリン、コリンエステル、コリン、グルコースなどが挙げられる。
【0033】
本発明で提供される酵素活性測定用の基質プローブとして、細胞の嫌気的な解糖系代謝に関与する酵素に対する基質を用いることができる。嫌気的な解糖系代謝では、グルコースからATPが提供され、乳酸ならびにアラニンが生成される。腫瘍組織では嫌気的な解糖系代謝が亢進していることが知られており、グルコースの取り込みや乳酸生成が活発化している。解糖系代謝に関与する酵素は、ヘキソキナーゼ、グルコースリン酸イソメラーゼ、ホスホフルクトキナーゼ、アルドラーゼ、トリオースリン酸イソメラーゼ、グリセルアルデヒド-3-リン酸デヒドロゲナーゼ、ホスホグリセリン酸キナーゼ、ホスホグリセロムターゼ、エノラーゼ、ピルビン酸キナーゼ、乳酸デヒドロゲナーゼなどがある。これらの酵素に対する基質を基質プローブとして用いて酵素の活性を検出することで、解糖系代謝の状態をモニタリングすることが可能になり、さらには解糖系代謝が亢進している腫瘍組織を検出することが可能になる。
【0034】
乳酸デヒドロゲナーゼの活性を検出するために、下記式(2)で示される同位体標識ピルビン酸、又はその塩を好適に用いることができる。この基質プローブでは、ピルビン酸の2位炭素と3位炭素が13Cで標識されている。乳酸デヒドロゲナーゼはピルビン酸を乳酸に変換する酵素であり、実施例で後述するように、同位体標識ピルビン酸を投与された細胞により生成した、下記式(3)で示される乳酸のメチンプロトンの多重核磁気共鳴信号を選択的に検出することができる。
【0035】
【化1】

【0036】
【化2】

【0037】
また、解糖系酵素の全体活性、すなわち解糖系代謝活性を検出するために、下記式(4)で示される重水素化された同位体標識グルコースD-Glucose-13C6,1,2,3,4,5,6,6-d7(以下、13C6,2H7-D-glucoseと略すことがある)を好適に用いることができる。この基質プローブでは、式(4)に示すとおり、グルコースの1位〜6位の全ての炭素原子が13Cで標識され、これら1位〜6位の炭素原子に結合する全ての水素原子7個が重水素化されている。式(5)に示すように、この基質プローブは、解糖系代謝反応を受け、乳酸あるいはアラニンへと変換した際に、検出しうるプロトンが存在するようになる。従って、この基質プローブを用いることで、グルコースの解糖系代謝産物である乳酸あるいはアラニンの多重核磁気共鳴信号を選択的に取得することができ、解糖系代謝活性を検出することが出来る。
【0038】
【化3】

【0039】
【化4】

【0040】
次に、基質プローブとして、プロテアーゼ認識ペプチド配列を有するペプチド又はタンパク質を用いる場合について説明する。
【0041】
本発明で提供されるプロテアーゼ活性測定用の基質ペプチドプローブは、プロテアーゼによって切断される部位(以下、プロテアーゼ切断部位という)を含むペプチド、すなわちプロテアーゼにより特異的に認識され、その一部が切断されるアミノ酸配列を有する部位もしくはドメインを構成単位として持ったペプチドである。構成単位として持つとは、当該プロテアーゼ切断部位を少なくとも一つ以上有することを意味し、本発明の基質ペプチドプローブは、複数のプロテアーゼ切断部位を有するものであってもよい。本実施形態においては、このプロテアーゼ切断部位に、核スピンを持ち共鳴周波数の異なる少なくとも3つの核磁気共鳴活性核(NMR活性核)が連結した基が、特異的に存在している。なお、本発明において、「切断部位に特異的に」というのは、機能的にいえば、切断の前後で、共鳴が生じる/共鳴が生じない、といった変化を生じたり、切断の前後で共鳴周波数がシフトしたりするような位置に、という意味である。
【0042】
本発明でペプチドとは、アミノ酸が複数の結合したアミノ酸が結合したポリペプチドを意味する。なお、アミノ酸の結合数が30〜50個程度以下のポリペプチドをオリゴペプチドと呼ぶことがある。オリゴペプチドや蛋白質も当然本発明でいうペプチドの範疇に入る。アミノ酸は通常はL体であるが、プロテアーゼの認識配列部分以外のアミノ酸はD体でもよく、さらには非天然アミノ酸でもよい。
【0043】
より具体的には、本発明の基質ペプチドプローブにおけるプロテアーゼ切断部位とは、プロテアーゼに特異的に認識されるアミノ酸配列を有しており、そのアミノ酸配列が活性状態のプロテアーゼに特異的に認識され、特異的に加水分解される部位を意味する。プロテアーゼ切断部位は、一般には、部位またはドメイン、すなわち約2から約20アミノ酸残基、通常は3から20、しばしば4または5から15アミノ酸残基である。
【0044】
本発明で測定できるプロテアーゼ活性は、ペプチドを基質とするものであれば制限されない。プロテアーゼは、ペプチド結合の加水分解を触媒とする酵素の総称であり、生体防御、活性調節、栄養吸収、タンパク質分解と再利用機構など、多岐にわたって機能している。基質プローブは、検出すべき対象プロテアーゼによって任意のアミノ酸配列を選択することができ、例えば、マトリックスメタロプロテアーゼ(MMP)は対象プロテアーゼとして好適である。MMPの中で、例えば、マトリックスメタロプロテアーゼ2(MMP2)活性の検出に用いるのであれば、アミノ酸配列GPLGVRGKを利用できる(非特許文献3及びSeltzer JL et al., The Journal of Biological Chemistry v265, 20409-20413 (1990)を参照のこと)。このような基質ペプチドプローブは、例えば通常のペプチド合成法あるいは微生物や培養細胞を使った生産系により製造することができる。
【0045】
本発明に用いる共鳴周波数の異なるNMR活性核としては、たとえば、1H、13C、15N、17O、19F、31P、29Siなどの安定同位体があげられる。これらの中で、1Hに加えて、13C(天然存在比=1.1%)、15N(天然存在比:0.366%)、17O(天然存在比=0.038%)のいずれかを用いることが好ましい。さらには、測定感度の観点からは、1Hに加えて13C又は15Nを用いることが好ましい。
【0046】
基質プローブの酵素認識部位特異的に少なくとも3つのNMR活性核の連結が形成されるように、化合物骨格における炭素、窒素等の原子を上記安定同位体で置換(標識)することで、天然存在比より人工的に濃縮してNMR活性核を有する基質プローブを得ることができる。基質ペプチドプローブの切断部位特異的に少なくとも3つのNMR活性核の連結が形成されるように、アミノ酸骨格における炭素、窒素等の原子を上記安定同位体で置換(標識)することで、天然存在比より人工的に濃縮してNMR活性核を有する基質ペプチドプローブを得ることができる。なお、本発明において、「人工的に濃縮」というのは、天然存在比よりも多い比率のNMR活性核を導入するという意味であり、NMR活性核を用いて基質プローブを人工的に合成することも包含するものである。また、本発明において、酵素認識部位に特異的に存在する核スピンを持つ核磁気共鳴活性核が人工的に濃縮されている基質プローブには、「少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される部位(酵素認識部位)を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記酵素認識部位に特異的に存在する同位体化合物」が天然存在比を超えて含有されている。
【0047】
これらの標識を基質中に導入すると、基質の分子量がごくわずかに変化するが、その分子の化学的、物理的特性は事実上変化しないため、本発明の基質プローブは天然基質と同等とみなすことができる。この点は、従来の酵素活性プローブとの大きな違いであり、生体への負担を低減し、ならびに良好な基質特異性を維持できる。
【0048】
本発明の酵素活性の検出方法(NMR法による酵素活性測定)は、基質プローブを関心対象の酵素と接触させた後に導入された安定同位体を含むNMR活性核の磁化移動による多重核磁気共鳴を測定すること、より好ましくは、二重核磁気共鳴法(二重共鳴NMR法)と三重核磁気共鳴法(三重共鳴NMR法)を組み合わせて測定することを特徴とする。
【0049】
本発明の提供する基質プローブには、酵素認識部位特異的に異なる共鳴周波数を有するNMR活性核(互いに異なる種類のNMR活性核)が少なくとも3つ連続して結合している構造を有している。NMR活性核が少なくとも3つ連続して結合している構造を酵素認識部位特異的に有することで、酵素によるプローブの認識と反応の有無を反映して核磁気共鳴信号を検出することができる。すなわち、本発明の基質プローブは核磁気共鳴イメージング用基質プローブとして機能する。好ましくは、プローブ骨格内における、1H−15N−13C、1H−13C−13C、1H−13C−15Nの配列である。このような配列を有していれば、3核間での磁化移動による3重共鳴を起こすことが可能となり、基質プローブ由来の核磁気共鳴信号を選択的に検出可能となる。なお、1H−13C−13Cのように、13Cが隣接している場合であっても、隣あう13Cに結合している基が互いに異なる場合には、これらの13Cの共鳴周波数は互いに異なるので、これらは互いに異なる核種である。これらは、1H−15N、1H−13Cの2核間での磁化移動と同様に2重核磁気共鳴測定も行うことが出来る。
【0050】
より具体的には、基質プローブの核磁気共鳴信号を、同時に励起可能な磁気共鳴装置によって、各核間の磁化移動を経由する磁気共鳴信号を、前記磁化移動を経由する第一の核(1H)の磁気共鳴信号を観測可能なパルス系列を用いて、前記同位体標識したプローブの第二の核(13Cもしくは15N)および第三の核(13Cもしくは15N)の磁気共鳴信号の情報を、第一の核(1H)の磁気共鳴信号に転嫁することにより、同位体標識されたプローブのみを選択的に観測する。前記の多重共鳴パルス系列、特に二重共鳴と三重共鳴を組み合わせて測定し、すなわち、基質プローブの存在情報と構造情報をそれぞれのパルス系列で観察する。
【0051】
一方、酵素によって、これらの3核間あるいは3核の近傍が酵素反応を受けると、3核間での磁化移動による3重共鳴を起こすことが不可能となったり、その核磁気共鳴信号が大幅に変化したりするため、これに基づき、酵素による基質の認識と反応、すなわち酵素活性を検出できる。例えば、プロテアーゼによって、これらの3核間あるいは3核の近傍が切断されると、3核間での磁化移動による3重共鳴を起こすことが不可能となったり、その核磁気共鳴信号が大幅に変化したりするため、これに基づき、プロテアーゼによるペプチドの切断を検出できる。本発明のプローブは、2核間での磁化移動による二重共鳴信号はプロテアーゼの切断に関わらず検出されるので、これはプローブの存在を示し、活性測定の内部標準として用いられる。また他の例として、前記の式(4)に示されるグルコースプローブのように、酵素反応後に初めて3重共鳴を起こすことが可能になるプローブならびにその検出系も利用できる。
【0052】
このように、本発明は、上記基質プローブによる多重核磁気共鳴を利用した酵素活性の測定方法であって、活性状態の酵素による前記基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法による酵素活性の測定方法を包含する。より詳しくは、多重核磁気共鳴法を利用した酵素活性の測定方法であって、本発明にかかる基質プローブを関心対象の酵素と接触させる工程と、二重核磁気共鳴測定による基質プローブのNMR信号から基質プローブの存在を検出する工程と、三重核磁気共鳴測定による基質プローブのNMR信号から酵素活性を検出する工程とを有することを特徴とする、酵素活性の測定方法を包含する。
【0053】
ここで、前記核磁気共鳴法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を少なくとも有することが好ましい。また、基質プローブの存在を二重核磁気共鳴信号を用いて検出し、該基質プローブが酵素反応を受けた後の物質を三重核磁気共鳴信号を用いて検出することで、前記基質プローブの存在量と前記酵素の活性とを測定することも好ましい。
【0054】
また、本発明は、単に多重核磁気共鳴法による酵素活性の検出にとどまらず、多重共鳴NMRイメージングによる酵素活性イメージングを行うことも原理的に可能にするものである。
【0055】
より具体的には、基質プローブの核磁気共鳴信号を、同時に励起可能な磁気共鳴装置によって、各核間の分極移動を経由する磁気共鳴信号を、前記分極移動を経由する第一の核(1H)の磁気共鳴信号を観測可能なパルス系列を用いて、前記同位体標識したプローブの第二の核(13Cもしくは15N)および第三の核(13Cもしくは15N)の磁気共鳴信号の情報を、第一の核(1H)の磁気共鳴信号に転嫁することにより、プローブのみを選択的に観測し、次いで、x軸、y軸およびz軸に関する勾配磁場パルスを共に印加されることにより前記プローブに由来する第一の核(1H)の磁気共鳴信号の位置情報を取得する。前記の多重共鳴パルス系列、特に二重共鳴NMR法と三重共鳴NMR法を組み合わせてイメージングし、すなわち、基質プローブの位置情報と構造情報をそれぞれのパルス系列でイメージングする。基質プローブに由来するNMR信号(二重共鳴NMR信号および三重共鳴NMR信号)の出現、消失、強度変化は基質の位置、存在量、もしくは構造情報を示す。したがって、プローブの経時的且つ定量的な検出、構造変化の検出を通して、生体内の酵素活性をイメージングすることが可能になる。
【0056】
このように、本発明は、上記プローブによる多重核磁気共鳴イメージングを利用した酵素活性のイメージング方法であって、活性状態の酵素による基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とするものを包含する。より詳しくは、多重核磁気共鳴法を利用した酵素活性のイメージング方法であって、前記基質プローブを関心対象の酵素と接触させる工程と、二重核磁気共鳴測定による前記プローブのNMR信号からプローブの存在を検出する工程と、三重核磁気共鳴測定による前記プローブのNMR信号から酵素活性を検出する工程とを有することを特徴とする酵素活性イメージング方法(多重共鳴MRIによる酵素活性のイメージング方法)を包含する。
【0057】
ここで、前記核磁気共鳴イメージング法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を有することが好ましい。また、基質プローブの存在を二重核磁気共鳴信号を用いて検出し、該基質プローブが酵素反応を受けた後の物質を三重核磁気共鳴信号で検出することで、前記基質プローブの存在量と前記酵素の活性を測定することが好ましい。
【0058】
本発明の酵素の基質プローブは、酵素の活性との相関を有する疾病の診断に用いることができ、好ましくは、MRIによる疾病に関連した異常な酵素活性のイメージング方法に用いることができる。MRI基質プローブの使用は、培養された細胞や組織を測定試料として疾病の研究を目的として使用することができる。また、当該疾病の患者の状態の診断や健常者における疾病の予防のための診断を目的として、当該基質プローブを生体、あるいは生体から取得した細胞もしくは組織に導入して、MRIによる酵素活性のイメージング方法に用いることもできる。
【0059】
本発明の基質プローブを用いる核磁気共鳴法による診断方法は、基質プローブを培養細胞、生体から採取した細胞もしくは組織、又は生体に導入する工程と、
疾病に関連した異常な酵素活性を検出することにより疾病の位置と状態をモニタリングする工程と、を有する。
【0060】
図1は、本発明のプロテアーゼ活性の検出方法に用いられるペプチドプローブの一般式における、同位体標識される核の好ましい実施形態の一つを示している。当該実施形態では、プロテアーゼ切断部位の2つのアミノ酸残基において、N末端側のアミノ酸骨格の1位炭素及び2位炭素が13Cによって標識され、かつC末端側アミノ酸はアミノ酸骨格の窒素が15Nによって標識されている。図中、Rは互いに異なっていても良いアミノ酸側鎖を示し、矢印はプロテアーゼ切断部位を示す。
【0061】
また、図2は、図1に示されるペプチドプローブがプロテアーゼによりペプチド結合加水分解された後の状態を示している。
【0062】
図3は、本発明で提供されるプロテアーゼ活性の検出方法の模式図を示している。プロテアーゼによるペプチド結合加水分解(E)が生じると、プロテアーゼ切断部位(A)でペプチド結合が切断されて、基質ペプチドプローブ(F)は、2つの断片に分割される。基質ペプチドプローブ(F)のプロテアーゼ切断部位(A)となるペプチド結合を形成するアミノ酸の一方を安定同位体標識アミノ酸(C)とし、他方を安定同位体標識アミノ酸もしくは非標識アミノ酸(D)とする。そして、それぞれの安定同位体標識アミノ酸を含む3つのNMR活性核が連結されるように対応する安定同位体により置換する。そうすると、3核間での磁化移動による3重共鳴を起こすことで得られる核磁気共鳴信号が、ペプチド結合の切断の前後で異なるので、プロテアーゼによるペプチド結合加水分解の有無を検出することができる。
【実施例】
【0063】
以下、実施例によって本発明を具体的に説明するが、本発明の範囲は実施例によって限定されるものではない。なお、以下、プロテアーゼのことを単に「酵素」と記載する場合がある。
【0064】
(実施例1:MMP2の活性検出)
(実施例1−1:MMP2の同位体標識基質ペプチドプローブの合成)
ペプチドGPLGVRGK(H-Gly-Pro-Leu-Gly-Val-Arg-Gly-Lys-NH2;配列番号1)を通常のFmoc法にて合成した。N末端側から4番目のGlyのアミノ酸骨格の1位炭素および2位炭素が13Cで標識され、N末端側から5番目のValのアミノ酸骨格の窒素が15Nで標識されているものを得るため、合成にあたって、これらの位置のGlyおよびValを結合させる際は、予めそのように同位体標識されたアミノ酸を用いた。合成は、Rink amide樹脂(Novabiochem社製)を用い、0.2 mmolスケールで合成した。合成に用いた同位体標識アミノ酸試薬(L-Valine-15N, N-FMOC誘導体、GLYCINE-13C2, F-MOC誘導体)はISOTEC社から購入した。特に断らない限り、本実験で用いた非同位体標識アミノ酸、ならびにアミノ酸合成試薬、溶媒は渡辺化学工業株式会社から購入した。アルギニン残基は、ペンタメチルジヒドロベンゾフラン− 5 − スルフォニル(pdf)基を用いて側鎖保護されたもの、一方リジン残基はt−ブトキシカルボニル(Boc)基で側鎖保護されたものを用いた。
【0065】
Fmocの脱保護は、N−メチルピロリドン(NMP)中20%ピペリジンを用いて行った。洗浄溶媒にはNMPを用いた。当該ペプチドの合成は、3等量のFmoc−アミノ酸とNMP中の3等量の2−(1H−ベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロホスフェート(HBTU)、1−ヒドロキシベンゾトリアゾール(HOBt)、ならびに6等量のジイソプロピルエチルアミン(DIEA)で、30分間のカップリングサイクルにて行った。脱保護およびカップリング後の樹脂上の遊離アミノ基の存在は、Kaiser試験(E. Kaiser, et al. (1970) Anal. Biochem., 34, 595参照)により確認した。得られたペプチド樹脂をNMP、ジクロロメタン(DCM)、及びメタノールで洗浄し、真空乾燥した。
【0066】
ペプチドからの側鎖保護基の除去、ならびに樹脂からのペプチドの解離は、ペプチド樹脂を、トリイソプロピルシラン(1%)、H2O(5%)、チオアニソール(5%)、エタンジチオール(2.5%)およびフェノール(5%)を含むトリフルオロ酢酸(TFA)中で室温2時間処理することで行った。樹脂残留物をガラスフィルターで濾別し、濾液にt−ブチルメチルエーテルを加えることで粗ペプチドを沈殿させ、遠心分離で沈殿を回収した。さらにt−ブチルメチルエーテルで洗浄し、真空乾燥させた後、30%酢酸1mLに溶解させた。
【0067】
ペプチドをHPLC(A=H2O/0.1%TFAおよびC=CH3CN/0.1%TFAで、25分に渡って勾配5〜30%C、HPLCカラムは株式会社ワイエムシィ製、YMC HPLC COLUMN、YMC−Pack ODS−A(AA12S05−2546WT),長さ250x内径4.6mm、粒子径5μm,細孔径12nm,流量は0.8mL/分、検出はUV220nm)で分析し、溶出時間18.6分のメジャーピークを分取した。MALDI−TOF質量分析計を使って、ペプチドの質量を調べた結果、同位体標識ペプチドGPLGVRGK 理論値M+H+ 785.5に対し、実測値785.6であった。分取した溶液を凍結乾燥し、精製ペプチドを得た(収量93mg,収率60%)。得られたペプチドの構造式を図4に示す。
【0068】
(実施例1−2:MMP2と基質ペプチドプローブの反応)
酵素反応用緩衝液として、TCNBバッファー(50mM Tris,10mM CaCl2,150mM NaCl,0.05% Brij 35,pH7.5 )を使用した。MMP2前駆体(R&Dシステムズ社)を、製品のプロトコールに従い、1mMの4−アミノフェニル酢酸水銀(APMA;シグマ社製)によって活性化し、活性化MMP2(以後単に、MMP2という)を得た。1μgのMMP2を反応用緩衝液0.9mLに溶解させ、前記で合成した基質ペプチドを780μg加え(ペプチド濃度1 mM)、25℃で18時間、インキュベートした。
【0069】
酵素MMP2によるペプチドの切断を、酵素反応前後のペプチド溶液のHPLC分析(A=H2O/0.1%TFAおよびC=CH3CN/0.1%TFAで、0から5分までは0%C、5分から35分に渡って勾配0〜30%C、HPLCカラムは株式会社ワイエムシィ製、YMC HPLC COLUMN、YMC−Pack ODS−A(AA12S05−2546WT),長さ250x内径4.6mm、粒子径5μm,細孔径12nm, 流量は0.8mL/分、検出はUV220nm)によりモニタリングした。酵素未処理のペプチド溶液(MMP−)と酵素反応後ペプチド溶液(MMP+)のHPLC溶出プロフィールを図5に示す。
【0070】
図5に示すように、酵素反応前(MMP−)では、シングルピークが得られた(溶出時間25.8分)。このピークを分取し、MALDI−TOF−MS分析を行った結果、同位体標識ペプチドGPLGVRGK理論値M+H+785.5に対し、実測値は785.6であった。酵素反応後(MMP+)では、2本のピークが出現した(溶出時間8.9分、24分)。これらのピークを分取し、MALDI-TOF-MS分析を行った結果、M+H+ 345.3(溶出時間24分)ならびに M+H+ 459.4(溶出時間8.9分)であった。MMP2による切断後、当該ペプチドGPLGVRGKは、GPLG(理論値M+H+ 345.2)とVRGK(理論値M+H+ 459.3)に分割される。したがって、早期に溶出される8.9分のピークはVRGKであり、遅れて溶出された24分のピークはGPLGであった。以上の結果より、合成した同位体標識ペプチドは、室温18時間の条件では、MMP2によって完全に切断されることがわかった。
【0071】
(実施例1−3:多重NMR測定(二重共鳴、三重共鳴))
得られた同位体標識ペプチドの酵素反応前と反応後の試料について、Bruker社製DRX700装置を用いて多重NMR測定を行った。試料には10%の重水を添加して、25℃、積算回数2〜512回で測定を行った。
【0072】
図6に酵素反応前(MMP−)の同位体標識ペプチド(GPLGVRGK)の1H−13C 二重共鳴のプロトンNMRスペクトルを示す。13C標識グリシンのα炭素に結合しているプロトンシグナルが3.8ppm付近に観測された。
【0073】
一方、図7には、酵素反応後(MMP+)の1H−13C二重共鳴のプロトンNMRスペクトルを示す。13C標識グリシンのα炭素に結合しているプロトンシグナルが3.6〜3.7ppm付近に観測された。
【0074】
図8に、酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドの1H−13C−13C 多重共鳴のプロトンNMRスペクトルを示す。この多重共鳴NMR観測法によれば、未切断のペプチド内1H−13C−13C−15N(グリシン−バリン)の結合は検出されず、切断後のグリシン1H−13C−13Cを選択的に観測するようになっている。従って、酵素反応前(MMP−)にはシグナルは検出されず、一方で、酵素反応後(MMP+)には3.6〜3.7ppm付近にプロトンシグナルが観測された。
【0075】
図9に、酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドの1H−13C−13C−15N多重共鳴のプロトンNMRスペクトルを示す。この多重共鳴NMR観測法では、1H−13C−13C−15Nの結合を検出するため、酵素切断部位のグリシン−バリンのペプチド結合を直接観測することになる。図9から明らかなように、酵素反応前(MMP−)には3.8ppm付近にシグナルが検出されたが、酵素反応後(MMP+)には当プロトンシグナルが完全に消失した。
【0076】
図10に、酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドの1H−15N−13C三重共鳴のプロトンNMRスペクトルを示す。この観測法では、1H−15N−13Cの結合を検出するため、酵素切断部位のグリシン−バリンのペプチド結合を直接観測することになる。図10から明らかなように、酵素反応前(MMP−)にはバリンのアミドプロトンに由来するシグナルが7.9ppm付近に検出されたが、酵素反応後(MMP+)にはそのシグナルが完全に消失した。
【0077】
図11は以上の測定結果をまとめたものである。基質ペプチドの切断に関わらず、1H−13C二重共鳴シグナルは観測され、一方、三重以上の多重共鳴シグナルは、ペプチドの切断前後でシグナルの出現もしくは消失が観測された。
【0078】
このように二重共鳴シグナルと三重以上の多重共鳴シグナルを観測することで、基質ペプチドの存在量ならびに基質ペプチドの切断に基づく酵素活性レベルをモニタリングすることが可能であった。
【0079】
(実施例2:ピルビン酸代謝反応による乳酸生成の多重共鳴NMR解析)
(実施例2−1:13Cラベル化ピルビン酸含有培地内でのHeLa細胞培養実験)
13Cラベル化ピルビン酸をDMEM(+FBS)溶液に溶解させ、7mM溶液(30ml)になるように調整し、滅菌濾過を行った。13Cラベル化ピルビン酸含有DMEM(+FBS)溶液(9ml)を入れたディッシュを3枚用意した。一枚のディッシュにつき70万個/mlのHeLa細胞を含むDMEM(+FBS, +AB)溶液(1ml)を添加し、37℃, 5% CO2の条件下で、三日間培養した。
【0080】
培養液を回収した後、各ディッシュをPBS溶液(3ml)で洗浄を行い、この洗浄液も培養液と共に回収した。その後、Trypsin-EDTA溶液(1.5ml)を添加し、セルスクレイパーを用いて細胞をディッシュから剥がした後、この溶液を別のチューブに回収した。再びPBS溶液(3ml)で洗浄を行い、細胞溶液と共に回収した。回収した培養液及び細胞溶液を凍結乾燥した。凍結乾燥後、析出してきた固体に重水(3ml)を加え、超音波処理・遠心操作(5min, 4500 rpm)した後、上澄み液を回収した。重水で更に10倍希釈した上澄み液を用いて多重共鳴NMR解析を行った。
【0081】
図12には、培養液の多重共鳴NMR測定結果を示す。1H-NMRでは、培地成分由来のピークが多数検出されたのに対し、1H-13C-13C三重共鳴では4.0ppmに乳酸のメチンプロトンのシグナルのみが検出された。ピルビン酸のメチルプロトンのシグナルは検出されなかった。図13には、培養液の1H-13C二重共鳴測定ならびに1H-13C-13C三重共鳴測定を示した。二重共鳴では培地成分由来と思われるシグナルも多数検出されが、三重共鳴ではラベル化ピルビン酸より生じた乳酸のシグナルのみが検出された。図14には、培養液の三重共鳴ならびに1H-13C HSQCの測定結果を示す。1H-13C-13C三重共鳴で検出された4.0ppmの1Hシグナルは、約60ppmにピークを有する13Cに結合している1Hであることから、乳酸のメチンプロトン由来であると考えられる。図15には、培養液ならびに細胞の1H-13C-13C三重共鳴NMR測定の結果を示す。細胞の系では、何も検出されなかった。両者ともにピルビン酸のメチルプロトンのシグナルは検出されず、乳酸のシグナルが培地のみから検出された。このことから、投与したラベル化ピルビン酸は全て消費されたと考えられる。細胞を含む溶液中での乳酸デヒドロゲナーゼ活性に基づくラベル化ピルビン酸の乳酸への変化を検出できた。
【0082】
(実施例2−2:HeLa細胞非存在下での13Cラベル化ピルビン酸含有培地内の多重共鳴測定)
次に、ネガティブコントロール実験として、上記条件でHela細胞非存在下での測定を行い、乳酸はHela細胞由来の酵素による代謝産物であることの確認を試みた。13Cラベル化ピルビン酸をDMEM(+FBS)溶液に溶解させ、7mMの溶液(10ml)になるように調整し、滅菌濾過を行った。13Cラベル化ピルビン酸含有DMEM(+FBS)溶液(9ml)を入れたディッシュを1枚用意した。HeLa細胞を含まないDMEM(+FBS, +AB)溶液(1ml)を添加し、37℃, 5% CO2の条件下で、三日間培養した。培養液を回収した後、ディッシュをPBS溶液(3ml)で洗浄を行い、この洗浄液も培養液と共に回収した。回収した培養液を凍結乾燥した。凍結乾燥後、析出してきた固体に重水(1ml)を加え、超音波処理・遠心操作(5min, 4500 rpm)を行った。上澄み液(50ml)を重水で更に10倍希釈し、多重共鳴NMR解析を行った。
【0083】
図16には、細胞非存在下のネガティブコントロール実験とHeLa細胞培養実験の1H-13C-13C三重共鳴測定結果を示した。無細胞条件下で培養した場合は、乳酸のピークは検出されず、ピルビン酸のメチルプロトン由来のピーク(約2.2ppm)が検出された。このことから、ピルビン酸が乳酸へと代謝されたのは、細胞由来の酵素による代謝反応によるものであることがわかった。以上の結果より、乳酸デヒドロゲナーゼによる13Cラベル化ピルビン酸の乳酸への代謝反応を三重共鳴測定により、高コントラストで検出することが可能であった。
【0084】
(実施例3:同位体標識グルコース(13C6,2H7-D-glucose)を用いた解糖反応の選択的検出)
(実施例3−1:担癌マウスの作製)
colon-26細胞を培養していたディッシュから培地を除去し、PBSで洗浄した後、Trypsin(5ml)を加え細胞を剥がした。その細胞浮遊液に培地を加えてチューブに移し遠心分離で細胞を沈殿させた後、上澄み液を除去し、PBS(10ml)に溶解させた。細胞数をカウントして、4.0×107 個/mlになるように調整したcolon-26細胞溶液を、BALB/cマウスの左足の皮下に100 ml投与した。その後、ほぼ1日間絶食させた。
【0085】
(実施例3−2:13C6,2H7-D-glucoseの投与・解剖・NMR解析)
担癌マウスの体重比で5g/kgとなるように13C6,2H7-D-glucose のPBS溶液(200ml)を担癌マウスに、尻尾の静脈から投与した。1時間経過後、マウスを開切し、必要な臓器 (血液(200ml)・肝臓・腎臓・癌部位・心臓) を順に取り出した。血液以外の組織を生理食塩水で洗浄した後、それぞれエッペンチューブに回収した。これに10% trichloroacetic acid (500 ml) を加え、ビーズを用いて各臓器をすり潰した後、氷上で30分間インキュベートした。遠心分離(4℃, 12000rpm, 5min)で不溶物を沈殿させた後、上澄み液を回収した。再び沈殿物に10% trichloroacetic acid (200 ml)を加え、遠心分離(4℃, 12000rpm, 5min)した後、この上澄み液も回収し、全上澄み液を凍結乾燥した。凍結乾燥した各組織の抽出物に重水(700ml)を加え、多重共鳴NMR解析を行った。
【0086】
図17には、13C6,2H7-D-glucoseを投与してから1時間後の担癌マウスの癌部位のNMR測定結果を示す。1H-NMRでは内在物のシグナルが多数検出され、1H-13C二重共鳴においても多くのシグナルが消去されたが、複数のシグナルが検出された。1H-13C-13C三重共鳴になると、二つのシグナルだけが検出された。一方が乳酸のシグナルで、もう一方はアラニンのシグナルであると予想される。図18には、癌部位の1H-13C-13C三重共鳴NMR測定結果と1H-13C HSQC測定結果との比較を示した。4.2ppmの1Hシグナルは、約67ppmに13Cピークを有する炭素に結合していることから、乳酸のメチンプロトン由来であることがわかる。4.0ppmの1Hシグナルは、約50ppmに13Cシグナルを有するので、アラニン由来1H-13C-13Cであることがわかる。以上の結果より、13C6,2D7グルコースを用いた三重共鳴解析により、解糖反応の最終段階のみを選択的に検出することが可能であった。
【0087】
図19には、心臓、腎臓、肝臓、血液、癌部位におけるスペクトルを示した。強度はそれぞれの臓器重量で規格化した(単位重量あたりのシグナル強度)。癌部位において最大のシグナル強度を示した。ラベル化グルコースが癌に高い選択性をもって集積していることが示された。特にアラニンのシグナルは血液や肝臓、腎臓においては極めて低強度であり、癌部位での高い選択的検出が可能であった。
【0088】
図20には、担癌マウスの体重比で3g/kgとなるように13C6,2H7-D-glucoseを投与したときの結果を示す。シグナル強度は臓器重量で規格化されている。癌部位において乳酸のシグナルが最大となった。一方、心臓においては、アラニンのシグナルが殆ど検出できなかった。
【図面の簡単な説明】
【0089】
【図1】本発明で提供される基質ペプチドプローブの構造式を示す略図である(Rは各アミノ酸の側鎖部分を示す)。
【図2】プロテアーゼ切断後の基質ペプチドプローブの構造式を示す略図である。
【図3】本発明で提供されるプロテアーゼ活性の検出方法の模式図である。
【図4】合成した同位体標識ペプチドGPLGVRGKの構造式を示す図である。
【図5】MMP2による同位体標識ペプチドGPLGVRGKの切断前後のHPLC溶出プロフィールを示す図である。
【図6】酵素反応前の同位体標識ペプチドGPLGVRGKの1H−13C二重共鳴のプロトンNMRスペクトルを示す図である。
【図7】酵素反応後の同位体標識ペプチドGPLGVRGKの1H−13C二重共鳴のプロトンNMRスペクトルを示す図である。
【図8】酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドGPLGVRGKの1H−13C−13C多重共鳴のプロトンNMRスペクトルを示す図である。
【図9】酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドGPLGVRGKの1H−13C−13C−15N多重共鳴のプロトンNMRスペクトルを示す図である。
【図10】酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドGPLGVRGKの1H−15N−13C三重共鳴のプロトンNMRスペクトルを示す図である。
【図11】酵素反応前(MMP−)ならびに酵素反応後(MMP+)の同位体標識ペプチドGPLGVRGKの二重共鳴NMRならびに三重以上の多重共鳴NMRのプロトンシグナルの化学シフトを示す表である。
【図12】13Cラベル化ピルビン酸含有培地内でのHeLa細胞培養液の1H-NMR、1H-13C-13C 三重共鳴NMRのスペクトルを示す図である。
【図13】13Cラベル化ピルビン酸含有培地内でのHeLa細胞培養液の1H-13C二重共鳴NMR、1H-13C-13C三重共鳴NMRスペクトルを示す図である。
【図14】13Cラベル化ピルビン酸含有培地内でのHeLa細胞培養液の1H-13C-13C三重共鳴NMRと1H-13C HSQCスペクトルを示す図である。
【図15】13Cラベル化ピルビン酸含有培地内でのHeLa細胞培養液およびHeLa細胞の1H-13C-13C三重共鳴NMRのスペクトルを示す図である。
【図16】細胞非存在下のネガティブコントロール実験とHeLa細胞存在下の培養液の1H-13C-13C三重共鳴NMRスペクトルを示す図である。
【図17】13C6,2H7-D-glucoseを投与された担癌マウスの癌部位のNMRスペクトルを示す図である。
【図18】13C6,2H7-D-glucoseを投与された担癌マウスの癌部位の1H-13C-13C三重共鳴NMRスペクトルと1H-13C HSQCスペクトルを示す図である。
【図19】13C6,2H7-D-glucoseを投与(5g/kg)された担癌マウスの心臓、腎臓、肝臓、血液、癌部位の1H-13C-13C三重共鳴NMRスペクトルを示す図である。
【図20】13C6,2H7-D-glucoseを投与(3g/kg)された担癌マウスの心臓、腎臓、肝臓、血液、癌部位の1H-13C-13C三重共鳴NMRスペクトルを示す図である。
【符号の説明】
【0090】
A:プロテアーゼ切断部位
B:非標識アミノ酸
C:安定同位体標識アミノ酸
D:安定同位体標識アミノ酸もしくは非標識アミノ酸
E:プロテアーゼによるペプチド結合加水分解
F:基質ペプチドプローブ
G:多重核磁気共鳴測定によるプローブ検出ならびに結合切断検出
【特許請求の範囲】
【請求項1】
多重核磁気共鳴法を用いた酵素活性測定用の基質プローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される部位(酵素認識部位)を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記酵素認識部位に特異的に存在することを特徴とする基質プローブ。
【請求項2】
前記酵素認識部位に特異的に存在する核スピンを持つ核磁気共鳴活性核が人工的に濃縮されている請求項1に記載の基質プローブ。
【請求項3】
前記酵素認識部位に特異的に存在する核スピンを持つ核磁気共鳴活性核が、1H、13Cおよび15Nから選択される請求項1又は2に記載の基質プローブ。
【請求項4】
前記基質プローブが、2位炭素と3位炭素が13Cで標識されているピルビン酸、もしくはその塩である請求項3に記載の基質プローブ。
【請求項5】
前記基質プローブがグルコースであり、この1位〜6位の全ての炭素が13Cで標識され、1位〜6位の炭素に結合する全ての水素原子7個が重水素化されている請求項3に記載の基質プローブ。
【請求項6】
前記酵素が、解糖系酵素であることを特徴とする請求項1から5のいずれかに記載の基質プローブ。
【請求項7】
前記解糖系酵素が乳酸デヒドロゲナーゼであることを特徴とする請求項6に記載の基質プローブ。
【請求項8】
請求項1から7のいずれかに記載の基質プローブによる多重核磁気共鳴を利用した酵素活性の測定方法であって、
活性状態の酵素による前記基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法による酵素活性の測定方法。
【請求項9】
前記核磁気共鳴法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を少なくとも有することを特徴とする請求項8に記載の酵素活性の測定方法。
【請求項10】
基質プローブの存在を二重核磁気共鳴信号を用いて検出し、酵素反応を受けた該基質プローブを三重核磁気共鳴信号を用いて検出することで、前記基質プローブの存在量と前記酵素の活性とを測定することを特徴とする請求項9に記載の酵素活性の測定方法。
【請求項11】
請求項1から7のいずれかに記載のプローブによる多重核磁気共鳴イメージングを利用した酵素活性のイメージング方法であって、
活性状態の酵素による基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする酵素活性のイメージング方法。
【請求項12】
前記核磁気共鳴イメージング法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を有することを特徴とする請求項11に記載の酵素活性のイメージング方法。
【請求項13】
基質プローブの存在を二重核磁気共鳴信号を用いて検出し、酵素反応を受けた該基質プローブを三重核磁気共鳴信号を用いて検出することで、前記基質プローブの存在量と前記酵素の活性を測定することを特徴とする請求項12に記載の酵素活性のイメージング方法。
【請求項14】
疾病に関連した異常な酵素活性を検出するための、請求項1から7のいずれかに記載の基質プローブからなる核磁気共鳴イメージング用の基質プローブ。
【請求項15】
疾病に関連した異常な酵素活性を検出するための、請求項1から7のいずれかに記載の基質プローブを用いた核磁気共鳴イメージング方法。
【請求項16】
解糖系代謝産物の乳酸を検出するための、請求項4に記載の基質プローブ。
【請求項17】
多重核磁気共鳴法を用いたプロテアーゼ活性測定用の基質ペプチドプローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態のプロテアーゼによって選択的に認識され、切断されるプロテアーゼ切断部位を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記プロテアーゼ切断部位に特異的に存在することを特徴とする基質ペプチドプローブ。
【請求項18】
前記プロテアーゼ切断部位に特異的に存在する核スピンを持つ核磁気共鳴活性核が人工的に濃縮されている請求項17に記載の基質ペプチドプローブ。
【請求項19】
前記プロテアーゼ切断部位に特異的に存在する核スピンを持つ核磁気共鳴活性核が、1H、13Cおよび15Nから選択される請求項17又は18に記載の基質ペプチドプローブ。
【請求項20】
一般式(1)で示される構造を有し、プロテアーゼ切断部位の2つのアミノ酸残基のうちN末端側のアミノ酸骨格の1位炭素及び2位炭素が13Cによって標識され、かつC末端側アミノ酸のアミノ酸骨格の窒素が15Nによって標識されたオリゴペプチドである請求項19に記載の基質ペプチドプローブ。
【化1】

(一般式(1)中、Rは互いに異なっていても良いアミノ酸側鎖を示し、矢印はプロテアーゼ切断部位を示す。)
【請求項21】
基質ペプチドのアミノ酸配列がGly-Pro-Leu-Gly-Val-Arg-Gly-Lys(配列番号1)であり、N末端側から4番目のGlyのアミノ酸骨格の1位炭素および2位炭素が13Cで標識され、N末端側から5番目のValのアミノ酸骨格の窒素が15Nで標識されている請求項20に記載の基質ペプチドプローブ。
【請求項22】
前記プロテアーゼがマトリックスメタロプロテアーゼ(MMP)であることを特徴とする請求項17から21のいずれかに記載の基質ペプチドプローブ。
【請求項23】
前記プロテアーゼがマトリックスメタロプロテアーゼ2(MMP2)であることを特徴とする請求項21に記載の基質ペプチドプローブ。
【請求項24】
請求項17から23のいずれかに記載の基質ペプチドプローブによる多重核磁気共鳴を利用したプロテアーゼ活性の測定方法であって、
活性状態のプロテアーゼによる前記基質ペプチドプローブの切断に伴う多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法によるプロテアーゼ活性の測定方法。
【請求項25】
前記核磁気共鳴法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を少なくとも有することを特徴とする請求項24に記載のプロテアーゼ活性の測定方法。
【請求項26】
基質ペプチドプローブの存在を二重核磁気共鳴信号を用いて検出し、該基質ペプチドプローブがプロテアーゼによって切断された後の物質を三重核磁気共鳴信号を用いて検出することで、前記基質ペプチドプローブの存在量と前記プロテアーゼの活性とを測定することを特徴とする請求項25に記載のプロテアーゼ活性の測定方法。
【請求項27】
請求項17から23のいずれかに記載のプローブによる多重核磁気共鳴イメージングを利用したプロテアーゼ活性のイメージング方法であって、
活性状態のプロテアーゼによる基質プローブの切断に伴う多重核磁気共鳴信号の変化を測定することを特徴とするプロテアーゼ活性のイメージング方法。
【請求項28】
前記核磁気共鳴イメージング法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を有することを特徴とする請求項27に記載のプロテアーゼ活性のイメージング方法。
【請求項29】
基質プローブの存在を二重核磁気共鳴信号を用いて検出し、該基質ペプチドプローブがプロテアーゼによって切断された後の物質を三重核磁気共鳴信号で検出することで、前記基質プローブの存在量と前記プロテアーゼの活性を測定することを特徴とする請求項28に記載のプロテアーゼ活性のイメージング方法。
【請求項30】
疾病に関連した異常なプロテアーゼ活性を検出するための、請求項17から23のいずれかに記載の基質ペプチドプローブからなる核磁気共鳴イメージング用の基質プローブ。
【請求項31】
疾病に関連した異常なプロテアーゼ活性を検出するための、請求項17から23のいずれかに記載の基質ペプチドプローブを用いた核磁気共鳴イメージング方法。
【請求項32】
多重核磁気共鳴法を用いた酵素活性測定用の基質プローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される部位を含み、酵素反応によって、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が存在するようになることを特徴とする基質プローブ。
【請求項33】
前記基質プローブがグルコースであり、この1位〜6位の全ての炭素が13Cで標識され、1位〜6位の炭素に結合する全ての水素原子7個が重水素化されている請求項32に記載の基質プローブ。
【請求項34】
請求項32又は33に記載の基質プローブによる多重核磁気共鳴を利用した酵素活性の測定方法であって、
活性状態の酵素による前記基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法による酵素活性の測定方法。
【請求項35】
請求項32又は33に記載の基質プローブによる多重核磁気共鳴イメージングを利用した酵素活性のイメージング方法であって、
活性状態の酵素による基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする酵素活性のイメージング方法。
【請求項36】
疾病に関連した異常な酵素活性を検出するための、請求項32又は33に記載の基質プローブからなる核磁気共鳴イメージング用の基質プローブ。
【請求項37】
疾病に関連した異常な酵素活性を検出するための、請求項32又は33に記載の基質プローブを用いた核磁気共鳴イメージング方法。
【請求項38】
解糖系代謝産物の乳酸あるいはアラニンを検出するための、請求項33に記載の基質プローブ。
【請求項1】
多重核磁気共鳴法を用いた酵素活性測定用の基質プローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される部位(酵素認識部位)を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記酵素認識部位に特異的に存在することを特徴とする基質プローブ。
【請求項2】
前記酵素認識部位に特異的に存在する核スピンを持つ核磁気共鳴活性核が人工的に濃縮されている請求項1に記載の基質プローブ。
【請求項3】
前記酵素認識部位に特異的に存在する核スピンを持つ核磁気共鳴活性核が、1H、13Cおよび15Nから選択される請求項1又は2に記載の基質プローブ。
【請求項4】
前記基質プローブが、2位炭素と3位炭素が13Cで標識されているピルビン酸、もしくはその塩である請求項3に記載の基質プローブ。
【請求項5】
前記基質プローブがグルコースであり、この1位〜6位の全ての炭素が13Cで標識され、1位〜6位の炭素に結合する全ての水素原子7個が重水素化されている請求項3に記載の基質プローブ。
【請求項6】
前記酵素が、解糖系酵素であることを特徴とする請求項1から5のいずれかに記載の基質プローブ。
【請求項7】
前記解糖系酵素が乳酸デヒドロゲナーゼであることを特徴とする請求項6に記載の基質プローブ。
【請求項8】
請求項1から7のいずれかに記載の基質プローブによる多重核磁気共鳴を利用した酵素活性の測定方法であって、
活性状態の酵素による前記基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法による酵素活性の測定方法。
【請求項9】
前記核磁気共鳴法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を少なくとも有することを特徴とする請求項8に記載の酵素活性の測定方法。
【請求項10】
基質プローブの存在を二重核磁気共鳴信号を用いて検出し、酵素反応を受けた該基質プローブを三重核磁気共鳴信号を用いて検出することで、前記基質プローブの存在量と前記酵素の活性とを測定することを特徴とする請求項9に記載の酵素活性の測定方法。
【請求項11】
請求項1から7のいずれかに記載のプローブによる多重核磁気共鳴イメージングを利用した酵素活性のイメージング方法であって、
活性状態の酵素による基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする酵素活性のイメージング方法。
【請求項12】
前記核磁気共鳴イメージング法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を有することを特徴とする請求項11に記載の酵素活性のイメージング方法。
【請求項13】
基質プローブの存在を二重核磁気共鳴信号を用いて検出し、酵素反応を受けた該基質プローブを三重核磁気共鳴信号を用いて検出することで、前記基質プローブの存在量と前記酵素の活性を測定することを特徴とする請求項12に記載の酵素活性のイメージング方法。
【請求項14】
疾病に関連した異常な酵素活性を検出するための、請求項1から7のいずれかに記載の基質プローブからなる核磁気共鳴イメージング用の基質プローブ。
【請求項15】
疾病に関連した異常な酵素活性を検出するための、請求項1から7のいずれかに記載の基質プローブを用いた核磁気共鳴イメージング方法。
【請求項16】
解糖系代謝産物の乳酸を検出するための、請求項4に記載の基質プローブ。
【請求項17】
多重核磁気共鳴法を用いたプロテアーゼ活性測定用の基質ペプチドプローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態のプロテアーゼによって選択的に認識され、切断されるプロテアーゼ切断部位を含み、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が前記プロテアーゼ切断部位に特異的に存在することを特徴とする基質ペプチドプローブ。
【請求項18】
前記プロテアーゼ切断部位に特異的に存在する核スピンを持つ核磁気共鳴活性核が人工的に濃縮されている請求項17に記載の基質ペプチドプローブ。
【請求項19】
前記プロテアーゼ切断部位に特異的に存在する核スピンを持つ核磁気共鳴活性核が、1H、13Cおよび15Nから選択される請求項17又は18に記載の基質ペプチドプローブ。
【請求項20】
一般式(1)で示される構造を有し、プロテアーゼ切断部位の2つのアミノ酸残基のうちN末端側のアミノ酸骨格の1位炭素及び2位炭素が13Cによって標識され、かつC末端側アミノ酸のアミノ酸骨格の窒素が15Nによって標識されたオリゴペプチドである請求項19に記載の基質ペプチドプローブ。
【化1】

(一般式(1)中、Rは互いに異なっていても良いアミノ酸側鎖を示し、矢印はプロテアーゼ切断部位を示す。)
【請求項21】
基質ペプチドのアミノ酸配列がGly-Pro-Leu-Gly-Val-Arg-Gly-Lys(配列番号1)であり、N末端側から4番目のGlyのアミノ酸骨格の1位炭素および2位炭素が13Cで標識され、N末端側から5番目のValのアミノ酸骨格の窒素が15Nで標識されている請求項20に記載の基質ペプチドプローブ。
【請求項22】
前記プロテアーゼがマトリックスメタロプロテアーゼ(MMP)であることを特徴とする請求項17から21のいずれかに記載の基質ペプチドプローブ。
【請求項23】
前記プロテアーゼがマトリックスメタロプロテアーゼ2(MMP2)であることを特徴とする請求項21に記載の基質ペプチドプローブ。
【請求項24】
請求項17から23のいずれかに記載の基質ペプチドプローブによる多重核磁気共鳴を利用したプロテアーゼ活性の測定方法であって、
活性状態のプロテアーゼによる前記基質ペプチドプローブの切断に伴う多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法によるプロテアーゼ活性の測定方法。
【請求項25】
前記核磁気共鳴法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を少なくとも有することを特徴とする請求項24に記載のプロテアーゼ活性の測定方法。
【請求項26】
基質ペプチドプローブの存在を二重核磁気共鳴信号を用いて検出し、該基質ペプチドプローブがプロテアーゼによって切断された後の物質を三重核磁気共鳴信号を用いて検出することで、前記基質ペプチドプローブの存在量と前記プロテアーゼの活性とを測定することを特徴とする請求項25に記載のプロテアーゼ活性の測定方法。
【請求項27】
請求項17から23のいずれかに記載のプローブによる多重核磁気共鳴イメージングを利用したプロテアーゼ活性のイメージング方法であって、
活性状態のプロテアーゼによる基質プローブの切断に伴う多重核磁気共鳴信号の変化を測定することを特徴とするプロテアーゼ活性のイメージング方法。
【請求項28】
前記核磁気共鳴イメージング法が、二重核磁気共鳴法と三重核磁気共鳴法の各パルス系列を用いて各核磁気共鳴信号を取得する工程と、これらの信号を組み合わせて解析する工程と、を有することを特徴とする請求項27に記載のプロテアーゼ活性のイメージング方法。
【請求項29】
基質プローブの存在を二重核磁気共鳴信号を用いて検出し、該基質ペプチドプローブがプロテアーゼによって切断された後の物質を三重核磁気共鳴信号で検出することで、前記基質プローブの存在量と前記プロテアーゼの活性を測定することを特徴とする請求項28に記載のプロテアーゼ活性のイメージング方法。
【請求項30】
疾病に関連した異常なプロテアーゼ活性を検出するための、請求項17から23のいずれかに記載の基質ペプチドプローブからなる核磁気共鳴イメージング用の基質プローブ。
【請求項31】
疾病に関連した異常なプロテアーゼ活性を検出するための、請求項17から23のいずれかに記載の基質ペプチドプローブを用いた核磁気共鳴イメージング方法。
【請求項32】
多重核磁気共鳴法を用いた酵素活性測定用の基質プローブにおいて、該プローブが、少なくとも一つの構成単位として活性状態の酵素によって選択的に認識される部位を含み、酵素反応によって、核スピンを持ち異なる共鳴周波数を有する少なくとも3つの核磁気共鳴活性核が連結した基が存在するようになることを特徴とする基質プローブ。
【請求項33】
前記基質プローブがグルコースであり、この1位〜6位の全ての炭素が13Cで標識され、1位〜6位の炭素に結合する全ての水素原子7個が重水素化されている請求項32に記載の基質プローブ。
【請求項34】
請求項32又は33に記載の基質プローブによる多重核磁気共鳴を利用した酵素活性の測定方法であって、
活性状態の酵素による前記基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする核磁気共鳴法による酵素活性の測定方法。
【請求項35】
請求項32又は33に記載の基質プローブによる多重核磁気共鳴イメージングを利用した酵素活性のイメージング方法であって、
活性状態の酵素による基質プローブの認識、その後の化学反応に伴う基質プローブ由来の多重核磁気共鳴信号の変化を測定することを特徴とする酵素活性のイメージング方法。
【請求項36】
疾病に関連した異常な酵素活性を検出するための、請求項32又は33に記載の基質プローブからなる核磁気共鳴イメージング用の基質プローブ。
【請求項37】
疾病に関連した異常な酵素活性を検出するための、請求項32又は33に記載の基質プローブを用いた核磁気共鳴イメージング方法。
【請求項38】
解糖系代謝産物の乳酸あるいはアラニンを検出するための、請求項33に記載の基質プローブ。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【公開番号】特開2009−77710(P2009−77710A)
【公開日】平成21年4月16日(2009.4.16)
【国際特許分類】
【出願番号】特願2008−228433(P2008−228433)
【出願日】平成20年9月5日(2008.9.5)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度、文部科学省、「先端融合領域イノベーション創出拠点の形成(高次生体イメージング先端テクノハブ)」に係わる委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504132272)国立大学法人京都大学 (1,269)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成21年4月16日(2009.4.16)
【国際特許分類】
【出願日】平成20年9月5日(2008.9.5)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度、文部科学省、「先端融合領域イノベーション創出拠点の形成(高次生体イメージング先端テクノハブ)」に係わる委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(504132272)国立大学法人京都大学 (1,269)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

