Fターム[4C085BB12]の内容
抗原、抗体含有医薬:生体内診断剤 (92,173) | ハプテン抗原又は抗体 (10,241) | タンパク質、ポリペプチド (3,477) | 糖タンパク (132)
Fターム[4C085BB12]に分類される特許
101 - 120 / 132
多価初代HIV−1糖タンパク質DNAワクチンおよびワクチン接種方法
HIVに対する免疫応答を誘導するための多価初代分離株核酸組成物を開示する。本明細書に記載した組成物および方法は、1つまたは複数の異なるHIVエンベロープ糖タンパク質をコードするDNA組成物の使用にかかわる。本DNA組成物はHIV Gagタンパク質をコードしうる。1つまたは複数のHIVタンパク質をコードするDNAは、HIV主要群(major group)の異なる遺伝学的クレードの初代分離株DNAおよび/または異なるタンパク質から作製された、異なる核酸(DNAプラスミドなど)の組み合わせである。HIVに対する免疫応答を誘導するためのHIVタンパク質組成物を開示する。タンパク質組成物をDNA組成物の投与後の追加免疫原として用いるための方法を提供する。 (もっと読む)
C型肝炎ウイルスに対するワクチン組成物
本発明は、C型肝炎の治療処置及び予防治療のためのワクチン組成物に関する。本発明の組成物は、C型肝炎ウイルスに対する免疫応答の発生に増強効果を発揮する、適当な割合のC型肝炎ウイルス構造タンパク質を含有する。本発明はまた、前記ワクチン組成物を含む、病原性実体に対する複数の混合ワクチンにも関する。 (もっと読む)
ワクチンとしての合成グリコリポペプチド
少なくとも1の病気関連エピトープからなり、および少なくとも1のリピド化内部アミノ酸またはMUC1の存在によって特徴づけられるグリコリポペプチドは、ワクチンに、好ましくはリポソームと共に使用することができる。 (もっと読む)
生物学的製剤
CD22に対する特異性を有するマウスモノクローナル抗体から得られる少なくとも1つのCDRを含む抗体が開示される。少なくとも1つのCDRが修飾CDRであるCDR移植抗体も開示される。さらに、抗体分子の鎖をコードするDNA配列、ベクター、形質転換宿主細胞、およびCD22を発現する細胞により仲介される疾患の治療における抗体分子の使用が開示される。 (もっと読む)
糖質エピトープを含む糖結合体、それらの合成方法、およびガンの処置または予防のためのそれらの使用
本発明は、新規なグリコシドおよび糖結合体、糖アミノ酸、およびその合成のための方法を提供する。別の局面において、本発明は、新規なクラスター化糖ペプチドおよびその合成のための方法を提供する。なお別の局面において、本発明は、癌の処置のため、好ましくは癌の再発の予防のための方法、ならびに被験体において抗体を誘導するための方法を提供し、これらの方法は、その必要性がある被験体に、本明細書中に開示される本発明の糖ペプチドのいずれかの有効量を、結合体化形態または非結合体化形態のいずれかで、適切な免疫原性キャリアと組み合わせて投与する工程を包含する。 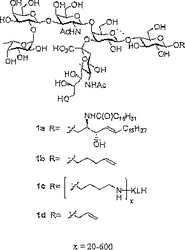 (もっと読む)
(もっと読む)
免疫原複合体、その調製方法および薬学組成物における利用
本発明は、小型の担体ペプチドとのカップリングにより、免疫原、抗原またはハプテンの免疫原性の改善を可能にする方法に関するものである。より特定的には、本発明は、免疫原複合体の調製方法およびかかる方法によって得られる可能性のある複合体、ならびに免疫原の免疫原性を増大させるための薬剤としてのかかる複合体の利用に関するものである。本発明は特に、呼吸器合胞体ウイルス(RSV)のGタンパク質由来のペプチドとカップリングした担体ペプチド、およびRSVに関連する呼吸器感染症の治療のためのワクチンとしてのその利用を含むものである。
【配列表】
SEQUENCE LISTING
<110> PIERRE FABRE MEDICAMENT
<120> IMMUNOGENIC COMPLEXES, PREPARATION METHOD THEREOF AND USE
OF SAME IN PHARMACEUTICAL COMPOSITIONS
<130> D22398
<140> PCT/FR2005/001913
<141> 2005-07-25
<150> FR0408175
<151> 2004-07-23
<160> 4
<170> Patent In version 3.1
<210> 1
<211> 246
<212> PRT
<213> Streptococcus
<400> 1
Met Lys Ile Phe Val Leu Asn Ala Gln His Asp Glu Ala Val Asp Ala
1 5 10 15
Asn Phe Asp Gln Phe Asn Lys Tyr Gly Val Ser Asp Tyr Tyr Lys Asn
20 25 30
Leu Ile Asn Asn Ala Lys Thr Val Glu Gly Val Lys Asp Leu Gln Ala
35 40 45
Gln Val Val Glu Ser Ala Lys Lys Ala Arg Ile Ser Glu Ala Thr Asp
50 55 60
Gly Leu Ser Asp Phe Leu Gln Ser Gln Thr Pro Ala Glu Asp Thr Val
65 70 75 80
Lys Ser Ile Glu Leu Ala Glu Ala Lys Val Leu Ala Asn Arg Glu Leu
85 90 95
Asp Lys Tyr Gly Val Ser Asp Tyr His Lys Asn Leu Ile Asn Asn Ala
100 105 110
Lys Thr Val Glu Gly Val Lys Asp Leu Gln Ala Gln Val Val Glu Ser
115 120 125
Ala Lys Lys Ala Arg Ile Ser Glu Ala Thr Asp Gly Leu Ser Asp Phe
130 135 140
Leu Lys Ser Gln Thr Pro Ala Glu Asp Thr Val Lys Ser Ile Glu Leu
145 150 155 160
Ala Glu Ala Lys Val Leu Ala Asn Arg Glu Leu Asp Lys Tyr Gly Val
165 170 175
Ser Asp Tyr Tyr Lys Asn Leu Ile Asn Asn Ala Lys Thr Val Glu Gly
180 185 190
Val Lys Ala Leu Ile Asp Glu Ile Leu Ala Ala Leu Pro Lys Thr Asp
195 200 205
Thr Tyr Lys Leu Ile Leu Asn Gly Lys Thr Leu Lys Gly Glu Thr Thr
210 215 220
Thr Glu Ala Val Asp Ala Ala Thr Ala Arg Ser Phe Asn Phe Pro Ile
225 230 235 240
Leu Glu Asn Ser Arg Gly
245
<210> 2
<211> 3
<212> PRT
<213> Artificial sequence
<220>
<223> Support peptide
<400> 2
Met Glu Phe
1
<210> 3
<211> 101
<212> PRT
<213> Respiratory syncytial virus
<400> 3
Thr Val Lys Thr Lys Asn Thr Thr Thr Thr Gln Thr Gln Pro Ser Lys
1 5 10 15
Pro Thr Thr Lys Gln Arg Gln Asn Lys Pro Pro Asn Lys Pro Asn Asn
20 25 30
Asp Phe His Phe Glu Val Phe Asn Phe Val Pro Cys Ser Ile Cys Ser
35 40 45
Asn Asn Pro Thr Cys Trp Ala Ile Cys Lys Arg Ile Pro Asn Lys Lys
50 55 60
Pro Gly Lys Lys Thr Thr Thr Lys Pro Thr Lys Lys Pro Thr Phe Lys
65 70 75 80
Thr Thr Lys Lys Asp His Lys Pro Gln Thr Thr Lys Pro Lys Glu Val
85 90 95
Pro Thr Thr Lys Pro
100
<210> 4
<211> 104
<212> PRT
<213> Artificial sequence
<220>
<223> MEFG2Na peptide
<400> 4
Met Glu Phe Thr Val Lys Thr Lys Asn Thr Thr Thr Thr Gln Thr Gln
1 5 10 15
Pro Ser Lys Pro Thr Thr Lys Gln Arg Gln Asn Lys Pro Pro Asn Lys
20 25 30
Pro Asn Asn Asp Phe His Phe Glu Val Phe Asn Phe Val Pro Cys Ser
35 40 45
Ile Cys Ser Asn Asn Pro Thr Cys Trp Ala Ile Cys Lys Arg Ile Pro
50 55 60
Asn Lys Lys Pro Gly Lys Lys Thr Thr Thr Lys Pro Thr Lys Lys Pro
65 70 75 80
Thr Phe Lys Thr Thr Lys Lys Asp His Lys Pro Gln Thr Thr Lys Pro
85 90 95
Lys Glu Val Pro Thr Thr Lys Pro
100
(もっと読む)
細胞表面糖タンパク質
本発明は、本明細書で細胞表面糖タンパク質として同定された新規なタンパク質(INSP201と称される)並びに疾患の診断、予防及び治療における前記タンパク質及びそのコード遺伝子に由来する核酸の使用に関する。 (もっと読む)
発現増強ポリペプチド
所望のポリペプチドおよび発現増強ドメイン(「EED」)を含む複合体ポリペプチドであって、該EEDは第一および第二のシステインアミノ酸残基Cys1およびCys2をそれぞれ含み、Cys1は複合体ポリペプチド分子のN末端に対してCys2よりも近くに位置し、ここでCys1およびCys2はポリペプチドリンカーによって分離され、該リンカーは、- システインおよびプロリンを含まず; - Cys1およびCys2が分子内ジスルフィド結合で互いと結合する事を可能にするために十分な長さを定義し;かつ - 水溶液中で第二のポリペプチド構造を本質的に含まない、柔軟なポリペプチド高次構造を有し、ここで少なくとも1つのCys1およびCys2は、誘導体化部分によって誘導体化される複合体ポリペプチドが提供される。 (もっと読む)
HIVワクチン処方物
本発明において提供されるのは、PLGおよび/あるいはHIVタンパク質を吸収するHIVポリペプチドをコードするDNAを含む、HIVワクチンである。被験体において免疫応答を生じさせるための、これらのワクチンの使用方法もまた、提供される。1つの側面において、本発明は少なくとも1つのHIV Gagコード配列またはEnvコード配列を含む核酸発現ベクター(例えば、プラスミド、ウィルス性ベクターなど)およびPLGを含むHIV DNAワクチン組成物を包含する。好ましくは、この核酸発現ベクターが、PLGに吸収される。 (もっと読む)
抗体
免疫グロブリン鎖またはP−セレクチン糖タンパク質リガンド−1に結合する抗体の軽鎖もしくは重鎖相補性決定領域を有する抗体。また、免疫グロブリン鎖をコード化する核酸、当該核酸を有するベクター及び宿主細胞、ならびに活性化T細胞の死の誘導方法及び患者のT細胞が仲介する免疫応答の調節方法もまた開示される。 (もっと読む)
多種ワクチン候補としての保存された内側コアリポ多糖体エピトープ:アクチノバシラス・プレウロニューモニー、マンヘイミア・ヘモリティカ及びパスツレラ・マルトシダを含む畜獣の病原菌によって起きる病気の予防のためのワクチン候補としての内核リポ多糖体エピトープ
アクチノバシラス・プレウロニューモニー(Ap)、マンヘイミア・ヘモリティカ(Mh)及びパスツレラ・マルトシダ(Pm)を含む病気を引き起こす病原性の細菌分離株の範囲のリポ多糖に発現する保存された内側コアオリゴ糖エピトープが、開示されている。末端が露出した構造としての保存された内側コアオリゴ糖エピトープを専ら発現する突然変異菌株の構成が、三つの全ての微生物に共通の内側コアLPSの同定、生成及び分離を可能にした。さらに、関連するワクチン、保存されたLPS内側コアに対して仕立てられた抗体及び免疫原性の担体と結合したLPS内側コアを含む複合糖質も提供される。
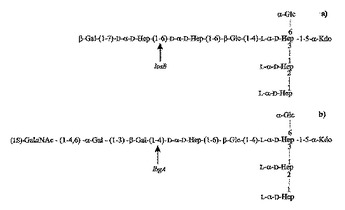 (もっと読む)
(もっと読む)
膵構造から誘導される糖ペプチド、抗体ならびに診断および治療におけるそれらの応用
本発明は、BSDLまたはFAPPの、11アミノ酸を伴う1〜40の間の反復C末端ポリペプチドを含んでなる糖ペプチドに関し、ここで、上記ポリペプチドは、グリコシル化され、1型糖尿病を患う患者において誘導される抗体と特異的免疫反応を惹起するグリコシル化エピトープを有し、ならびに/あるいはヒトもしくは動物由来の生物学的液体から精製されるかまたは組換え体であり、グリコシル化を引き起こすのに必要な酵素材料を含んでなる標準的な宿主細胞における発現によって産生され、前記宿主細胞は、上記ポリペプチドをコードする遺伝子およびグリコシルトランスフェラーゼの中から選択される1つもしくはそれ以上の酵素をコードする遺伝子、抗糖ペプチド抗体を含んでなるように遺伝子改変されている。本発明はまた、治療および診断におけるその応用に関する。 (もっと読む)
免疫グロブリン
本発明は、オンコスタチンM(OSM)、特にヒトOSM(hOSM)に特異的に結合し、かつOSMとgp130の相互作用をモジュレートする、抗体のような免疫グロブリンに関する。典型的な実施形態では、OSMはグリコシル化されている。本発明はまた、OSMのサイトIIおよびサイトIIIと、それらに対応する相互作用パートナーとの相互作用をモジュレートする抗体に関する。医薬組成物、スクリーニング方法および医学的治療法についてもさらに開示する。 (もっと読む)
高活性糖タンパク質−製造条件、及びその効率的製造方法
本発明は、特定のシアル酸付加度(sialylation degree)を有する高活性糖タンパク質、診断又は治療に用いるための該糖タンパク質を含む医薬組成物、高活性糖タンパク質及びその製造のための条件の決定方法、高活性糖タンパク質の製造方法、並びに分泌性糖タンパク質の示差的シアル酸付加方法に関する。また本発明は、生物学的目的のため、並びに、疾患(特に骨髄移植、好中球減少症、血球減少症、AML及び骨髄異形成症候群、癌、HIV及び/又は造血系疾患)の予防的及び/若しくは治療的処置、又は診断のための、組換え発現された高活性糖タンパク質の使用に関する。 (もっと読む)
免疫応答障害に対する処置ストラテジーのための診断法としてのFcレセプター多型の使用
インターロイキン−2(IL−2)免疫療法での介入のための診断薬としてのFcγ受容体(Fc&ggr;R)多型の使用方法が提供される。この方法には、個体のFc&ggr;RIIIA遺伝子の対立遺伝子パターンまたはFc&ggr;RIIA遺伝子の対立遺伝子パターンを検出すること、および、対立遺伝子パターンがIL−2免疫療法に対するポジティブな治療応答の予測であるかどうかを決定することが含まれる。Fc&ggr;RIIIA 158F/Fホモ接合遺伝子型の存在、および/または、Fc&ggr;RIIIA 48L対立遺伝子の1つもしくは両方のコピー存在、および/または、Fc&ggr;RIIA 131R対立遺伝子の1つまたは両方のコピー存在は、IL−2免疫療法に対するポジティブな治療応答の指標であり、したがって、免疫疾患の処置のためのIL−2免疫療法での医学的な介入の指標である。 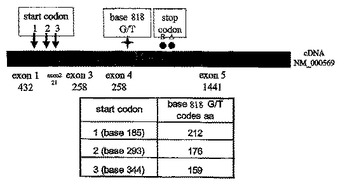 (もっと読む)
(もっと読む)
糖尿病の抗CD52抗体治療法
本発明は、CD52特異抗体、例えばCAMPATH-1Hを用いる、I型糖尿病の予防法および/または治療法を提供する。 (もっと読む)
長いペントラキシンPTX3の阻害剤を含む医薬
自己免疫疾患ならびに骨および軟骨の変性疾患の予防および処置のための医薬の調製のための長いペントラキシンPTX3の阻害剤の使用が記載される。 (もっと読む)
小オリゴヌクレオチドに基づく化合物による免疫刺激特性の調節
前述の発明について明確さと理解のためにある程度詳細に記述したが、この開示を読んだ当業者には、本発明および付属のクレームの真の範囲から乖離することなく、形態および詳細についての種々の改変が可能であることが理解される。 (もっと読む)
貯蔵安定性を有する複合エマルジョンの製造方法
1または複数の活性成分を含み、且つ貯蔵時に安定であるW/O/W型複合エマルジョンの製造方法に関する。該方法は、a)水相に活性成分を入れて攪拌する工程、b)該水相を、大きな孔を有する多孔質膜を介して油相に通すことにより、水相を乳化する工程、c)混合物を少なくとも0.3K/minの冷却速度で冷却することにより、b)のエマルジョンを転相する工程を含んで成り、工程a)における水相、もしくは工程b)における油相、または両相には乳化剤が添加されている。 (もっと読む)
C型肝炎ウイルス糖タンパク質をコードする新規配列
本発明は、E1糖タンパク質およびE1/E2糖タンパク質ヘテロ二量体からなる群から選択される完全長C型肝炎ウイルス(HCV)糖タンパク質をコードするヌクレオチド配列を含有し、少なくとも1つのヌクレオチドの変化を有し、この変化のために、RNAスプライス受容部位およびRNAスプライス供与部位からなる群から選択される少なくとも1つのRNAスプライス部位が本コード配列から削除される、改変された核酸分子に関する。本発明はまた、過半数が完全長であるHCV糖タンパク質を細胞表面および偽ビリオンで発現させるための方法にも関する。本発明はさらに、このような糖タンパク質を発現する細胞および偽ビリオン提供する。本発明はまたさらに、薬剤が標的細胞とのHCV融合および標的細胞への侵入を阻害するか否かを決定するための方法を提供する。本発明はまた、標的細胞とのHCV融合および標的細胞への侵入を阻害する薬剤を提供する。本発明はさらに、HCV関連疾患に罹患した対象を治療するための、対象においてHCV感染を予防するための、および対照においてHCV関連疾患の発症を抑制するための方法を提供する。 (もっと読む)
101 - 120 / 132
[ Back to top ]

