Fターム[4H045BA20]の内容
Fターム[4H045BA20]に分類される特許
61 - 80 / 170
改変されたペプチドYYおよびそれらの結合体
【課題】治療用ペプチドを改変して、これらをペプチダーゼ活性から保護し、そしてインビボでの作用のより長い持続時間を提供し、一方で低い毒性を維持し、なお改変されたペプチドの治療の利点を保持するための方法を提供する。
【解決手段】改変された治療用ペプチドであって、その治療用ペプチドは、ペプチダーゼ安定化治療用ペプチド結合体を形成し得、そのペプチドは、カルボキシ末端アミノ酸、アミノ末端アミノ酸、構造活性関係分析によって同定される治療的活性な領域およびより低い治療的活性な領域を含む。そのペプチドは、それが、アミノ酸のそのより低い治療的活性な領域に位置するアミノ酸に結合される反応性基を有する、ペプチドYY、あるいはそれらの誘導体を含む。
(もっと読む)
合成ポリペプチド保湿剤
【課題】保湿性に優れるポリペプチドを提供する。
【解決手段】L−チロシン、L−ドーパ、L−ドーパキノン、L−リジンの4種類の化合物と、グリシン、L−アラニン、L−ロイシン、L−バリンの4種の化合物から選ばれる1種の共重合体であるポリペプチド。ドーパ残基及びドーパキノン残基の導入は、N-カルボン酸無水物法により調整した前駆体ポリペプチドに対し、アスコルビン酸とチロシナーゼ酵素を作用させチロシン残基の一部を変換することにより行った。
(もっと読む)
アセチル−(Ala10,11)−RANTES(1−14)および/またはカルシトニンの、抗血管新生剤としての使用
本発明は、癌、自己免疫疾患、線維性疾患、炎症性疾患、神経変性疾患、感染症、肺疾患、心臓および脈管の疾患ならびに代謝性疾患を予防および/または治療するための治療剤としての、Ac-Ser-Pro-Tyr-Ser-Ser-Asp-Thr-Thr-Pro-Ala-Ala-Phe-Ala-Tyr-NH2のペプチド化合物の使用に関する。さらに、本発明は、Ac-Ser-Pro-Tyr-Ser-Ser-Asp-Thr-Thr-Pro-Ala-Ala-Phe-Ala-Tyr-NH2のペプチドと、必要に応じて少なくとも1つの薬学的に受容可能なキャリア、凍結保護剤、分散保護剤、賦形剤および/または希釈剤とを含んでいる、好ましくは凍結乾燥物、緩衝液、人工母乳製剤、または母乳代替物の形態である薬学的組成物に関する。 (もっと読む)
治療剤としての、C型ナトリウム利尿ペプチド単独または神経ペプチドAFとの組合せの使用
本発明は、癌、自己免疫疾患、線維性疾患、炎症性疾患、神経変性疾患、感染症、肺疾患、心臓および脈管の疾患ならびに代謝性疾患を予防および/または治療するための治療剤としての、Asp-Leu-Arg-Val-Asp-Thr-Lys-Ser-Arg-Ala-Ala-Trp-Ala-Arg-Leu-Leu-Gln-Glu-His-Pro-Asn-Ala-Arg-Lys-Tyr-Lys-Gly-Ala-Asn-Lys-Lys-Gly-Leu-Ser-Lys-Gly-Cys-Phe-Gly-Leu-Lys-Leu-Asp-Arg-Ile-Gly-Ser-Met-Ser-Gly-Leu-Gly-Cys-OHのペプチド化合物の使用に関する。さらに、本発明は、Asp-Leu-Arg-Val-Asp-Thr-Lys-Ser-Arg-Ala-Ala-Trp-Ala-Arg-Leu-Leu-Gln-Glu-His-Pro-Asn-Ala-Arg-Lys-Tyr-Lys-Gly-Ala-Asn-Lys-Lys-Gly-Leu-Ser-Lys-Gly-Cys-Phe-Gly-Leu-Lys-Leu-Asp-Arg-Ile-Gly-Ser-Met-Ser-Gly-Leu-Gly-Cys-OHのペプチドと、必要に応じて少なくとも1つの薬学的に受容可能なキャリア、少なくとも1つの凍結保護剤、少なくとも1つの分散保護剤、少なくとも1つの賦形剤および/または少なくとも1つの希釈剤とを含んでいる、好ましくは凍結乾燥物、緩衝液、人工母乳製剤、または母乳代替物の形態である薬学的組成物に関する。 (もっと読む)
NAP様ペプチド擬似体およびSAL様ペプチド擬似体を用いた神経保護法
本発明は、神経保護ペプチドNAPVISPQ(NAP)およびSALLRSIPA(SAL)を模倣するペプチド、ならびに神経細胞機能不全、神経変性障害、認知障害、神経精神障害、および自己免疫疾患の治療における、その使用に関する。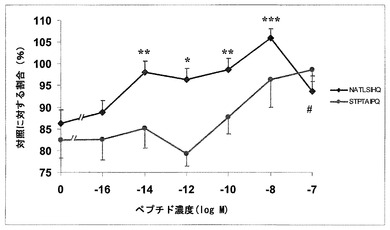
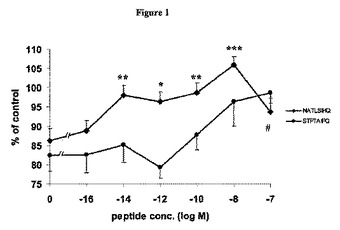 (もっと読む)
(もっと読む)
過敏症反応の調節因子
本発明は、免疫応答を調節するためのペプチドであって、Src相同性3(SH3)ドメイン、Src相同性2(SH2)ドメイン、又はプレクストリン相同性(PH)ドメインの1つの少なくとも一部分に対応するアミノ酸配列を含むペプチドに関する。 (もっと読む)
共重合体安定化エマルション
【課題】
【解決手段】実質的に連続な液体媒体と実質的に連続な液体媒体内に分散する複数の液滴構造を含むエマルション。複数の液滴構造の各液滴構造は、外部表面を有する第1の液の外側液滴と、第1の液の外側液滴の外部表面に内包される内部表面を有する第2の液の内側液滴とを含み、第2の液は第1の液に非混和性であり、内側液滴と外側液滴は両者間に境界表面領域を有し、ブロック共重合体の外層が外側液滴の外部表面に配置され、ブロック共重合体の内層が内側液滴の内部表面に配置されている。ブロック共重合体は親水性高分子ブロックと疎水性高分子ブロックとを含み、それらが共同して液滴構造の安定化に作用し、第1の液は実質的に連続な液体媒体に非混和性である。  (もっと読む)
(もっと読む)
腫瘍関連ペプチドおよび関連抗癌ワクチンの組成物
本発明は、免疫療法ペプチド、および免疫療法 (特に癌の免疫療法)におけるそれらの使用に関する。 本発明は、単独として、もしくは他の腫瘍関連ペプチドとの組み合わせとして、抗腫瘍免疫応答を刺激するワクチン組成物の有効医薬成分として作用する腫瘍関連Tヘルパー細胞ペプチドエピトープを開示する。 具体的には、本発明のペプチド組成物は、結腸直腸癌に対する抗腫瘍免疫応答を引き出すワクチン組成物に使用することができる。 (もっと読む)
生物活性ペプチドの発現および精製のための可溶性タグ
不溶性融合ペプチドの生成に有用な、本明細書中で封入体タグと称されるペプチドタグが開示される。融合ペプチドは、目的のペプチドに作動可能に連結された少なくとも1つの封入体タグを含む。宿主細胞内での融合ペプチドの発現により、不溶性でありかつ細胞内および/または細胞溶解液中の封入体中に含まれる生成物が生成される。次いで、封入体は精製され、目的のタンパク質は封入体タグからの切断後に単離されうる。  (もっと読む)
(もっと読む)
キウイアレルゲンであるアクチニジンのエピトープを含むペプチドとその利用
【課題】 キウイアクチニジンのエピトープを決定すること。
【解決手段】 以下の(a)又は(b)のペプチド。
(a) N-Y-P-Y-T-A-Q-D-G-E-C-N-V-D-L-Q-N-E-K-Y-V-T-I-D-T-Y-E(配列番号1)で表されるアミノ酸配列からなるペプチド
(b) N-Y-P-Y-T-A-Q-D-G-E-C-N-V-D-L-Q-N-E-K-Y-V-T-I-D-T-Y-E(配列番号1)で表されるアミノ酸配列において1若しくは数個のアミノ酸が欠失、置換若しくは付加されたアミノ酸配列からなり、かつ抗原活性を有するペプチド
(もっと読む)
リジン及びシステイン残基を含まないタンパク質の製造方法
【課題】本発明は、タンパク質をカルボキシ末端を介して特異的且つ効率よく固定化担体に結合させること行わせることができるアミノ酸配列を有する新規なタンパク質の製造方法を提供することを課題とする。
【解決手段】一般式 S1-R1-R2のアミノ酸配列において、R1部分の配列が、天然由来のタンパク質のアミノ酸配列、又はそのアミノ酸配列中のすべてのリジン残基及びシステイン残基を、リジン残基及びシステイン残基以外のアミノ酸残基に置換することにより得られる、リジン残基及びシステイン残基を含まないアミノ酸配列に改変されたアミノ酸配列からなるタンパク質であって、前記天然由来のタンパク質と同等の機能を有するタンパク質のアミノ酸配列であることを特徴とする、一般式 S1-R1-R2で表されるアミノ酸配列からなるタンパク質を製造する方法。
(もっと読む)
シグナル伝達ペプチド
本発明は、特定の配列の新規なペプチドおよびシグナルペプチドまたは膜固定ペプチドとしてのそれらの使用を提供する。本発明はまた、1以上のこのようなペプチドと目的のポリペプチドを含むキメラポリペプチド、ならびにこのようなペプチドおよびキメラポリペプチドをコードする核酸分子、ベクター、感染性ウイルス粒子および宿主細胞に関する。本発明はまた、このような要素と薬学上許容されるビヒクルを含む医薬組成物に関する。本発明はまた、特に細胞外で、または原形質膜の表面に固定された目的のポリペプチドを発現させるために、このようなペプチドを用いてポリペプチドを組換え的に生産する方法も提供する。 (もっと読む)
高分子電解質および活性成分を基にした放出制御粒子および該粒子を含む製剤
本発明は、活性成分(AP)、特にタンパク質およびペプチド活性成分の輸送体である高分子電解質ポリマーを有する新規の粒子と、前記AP微粒子を有する新規の放出制御製剤とに関するものである。
これらAPを有する新規の粒子は、数日間、さらには数週間の長期間にわたってAPを放出する。
本発明は、第1態様において、
a)帯電状態で疎水側基(GH)を有する第1高分子電解質ポリマー(PE1)であって、pH3〜8のうち少なくとも一つのpHm値で粒子のコロイド溶液を水中で自発的に形成する第1高分子電解質ポリマー(PE1)と、
b)第1高分子電解質ポリマー(PE1)と異極性である第2高分子電解質ポリマー(PE2)であって、前記pHのうち少なくとも一つの前記pHm値で溶液またはコロイド溶液を水中で形成する第2高分子電解質ポリマー(PE2)と、
c)第1高分子電解質ポリマー(PE1)のコロイド溶液の粒子と非共有で会合した少なくとも一つの活性成分(AP)と、
を有する粒子に関し、前記粒子が、pHmと等しいpHで、活性成分(AP)と会合した粒子のコロイド溶液の形の第1高分子電解質ポリマー(PE1)を、溶液またはコロイド溶液の形の第2高分子電解質ポリマー(PE2)と混合することで得られる。
本発明はまた、これらの粒子を調製する方法と、かかる粒子を有する製剤と、薬剤を調製する方法とに関するものである。
(もっと読む)
癒着の予防および他のバリア適用のための組成物
癒着の形成に対するバリアを形成する自己集合物質を、出血または流体の漏出がないかまたは実質的に停止した後に、それを必要とする部位に投与することにより癒着の形成を予防または制限する方法を開発した。一つの実施形態において、自己集合物質は、以下の式I〜IVの一つ以上に適合するアミノ酸残基の配列を有するペプチドを含む:((Xaaneu−Xaa+)x(Xaaneu−Xaa−)y)n(I)、((Xaaneu−Xaa)x(Xaaneu−Xaa+)y)n(II)、((Xaa+−Xaaneu)x(Xaa―−Xaaneu)y)n(III)、((Xaa―−Xaaneu)x(Xaa+−Xaaneu)y)n(IV)、式中Xaa+は正電荷を有すアミノ酸残基を、Xaa―は負電荷を有すアミノ酸残基を示し、xおよびyは、それぞれ1、2、3、または4の値を有す整数であり、そしてnは1〜5の値を有す整数である。 (もっと読む)
癌の治療のための方法および組成物
癌を治療するために使用することができるオリゴペプチドを開示する。乳癌、皮膚癌、前立腺癌および多発性骨髄腫(MM)を含む癌を治療する方法をさらに開示する。これらの方法は、Mesd遺伝子によってコードされるポリペプチド、またはMesdポリペプチドの連続サブ配列を含んでなるオリゴペプチドの投与を含む。 (もっと読む)
ヘムタンパク質ポリマー製造用モノマーおよびそのモノマーから得られるポリマー
【課題】大分子量を有するタンパク質を規則的に配列させることにより得られる、さらに大分子量を有するタンパク質ポリマーの提供を提供する。
【解決手段】一般式(I)で表わされるヘムタンパク質モノマーまたはその塩を用いることにより、大分子量を有するタンパク質ポリマーを得ることができる。前記式(I)中、 R1、R2、R3、R4、は低級アルキル基または低級アルケニル基を意味し、Yは特定の基を、Xはヘムタンパク質の変異体を意味する。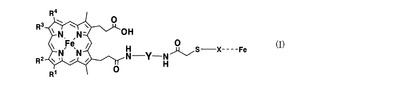 (もっと読む)
(もっと読む)
ウナギ蛍光タンパク質
【課題】ウナギ由来の蛍光タンパク質を提供する。
【解決手段】特定のアミノ酸配列を有し、分子量が16kDa〜17kDa、好ましくは16.5kDa、であり、蛍光波長が480nm〜600nm、好ましくは527nm、及び励起波長が480nm〜540nm、好ましくは493nm、であるウナギ蛍光タンパク質。
【効果】前記ウナギ蛍光タンパク質と外来タンパク質とを連結した融合タンパク質を形質転換体で発現させることにより、前記外来タンパク質の発現、局在又は相互作用を評価することができる。
(もっと読む)
コイルドコイル構造を有するリポペプチドのヘリックスバンドルおよび合成ウイルス様粒子
本発明は、コイルドコイルドメインを含むペプチド鎖と、該ペプチド鎖に共有結合で連結された、長いアルキルまたはアルケニル鎖を含む脂質部分と、ペプチド鎖に任意選択で連結された抗原とにより構成されるリポペプチドビルディングブロック;ならびに凝集によって形成されたリポペプチドヘリックスバンドルおよび合成ウイルス様粒子に関する。これらのバンドルおよび粒子の、ナノメートル規模の大きさおよび形状、水性の生理学的条件下における安定性、化学組成、B細胞エピトープおよびT細胞エピトープを組込む実現性、ならびに化学合成による生産は、該バンドルおよび粒子をワクチン送達手段として非常に適したものにしている。  (もっと読む)
(もっと読む)
クニッツドメインから誘導されたヒトプラスミンの阻害剤
【課題】プラスミンを阻害するヒトリポ蛋白質結合凝集阻害剤(LACI)の第1のクニッツドメイン(K1)の新規の変異体、および、プラスミンを阻害する他の改変されたクニッツドメイン、および他のプラスミン阻害剤を提供すること。
【解決手段】ヒトプラスミンの阻害に有効なBPTI相同のクニッツドメインの変異体、特に、ヒトに非免疫原性のヒトLACIの1個のドメインの変異体に関し、好ましくは約5nM以下、さらに好ましくは約300pM以下、そして最も好ましくは約100pM以下のKDでプラスミンを阻害することができ、治療、診断に使用することができる。
(もっと読む)
アミノ酸残基又はペプチド残基を有する化合物、及びその製造方法
【課題】本発明の目的は、様々な化合物や保持担体に結合可能であり、アミノ酸又はオリゴペプチドを有する側鎖が主鎖に結合した構造の新規化合物を提供することである。
【解決手段】以下の一般式(1)で示される化合物を提供する。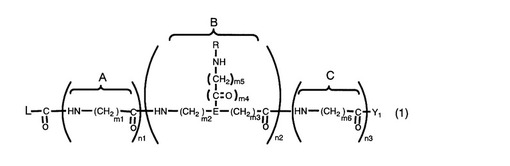
[式(1)中、n1は0〜10の整数、n2は1〜50の整数、及びn3は1〜10の整数を示し;m1は0〜100の整数、m2は0〜100の整数、m3は0〜100の整数、m4は0又は1の整数、m5は0〜100の整数、及びm6は0〜100の整数を示し;Y1は、水酸基又はアミノ基を示し;Eは、N又はCHを示し;Rは、アミノ酸残基、又は2〜100個のアミノ酸残基からなるペプチド残基を示し;Lは、ペプチド結合、ジスルフィド結合又はビオチンアビジン結合を形成可能な官能基(但し、アミノ基を除く)がリンカーを介して結合しているアミノ基を示す。]
(もっと読む)
61 - 80 / 170
[ Back to top ]