国際特許分類[A61K9/26]の内容
生活必需品 (1,310,238) | 医学または獣医学;衛生学 (978,171) | 医薬用,歯科用又は化粧用製剤 (357,440) | 特別な物理的形態によって特徴づけられた医薬品の製剤 (28,445) | 丸剤,ひし形剤または錠剤 (5,066) | 持続または徐放型のもの (669) | 支持体中に別個の粒子を有するもの (201)
国際特許分類[A61K9/26]に分類される特許
81 - 90 / 201
ビタミンDの含量均一性が改善された薬剤剤形
改善された含量均一性を有するビタミンD及び炭酸カルシウムの新規剤形が望ましい。改善は、処方、原材料の規格、及び製造プロセスの改良を通して認識される。 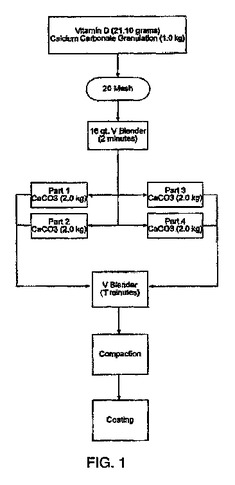 (もっと読む)
(もっと読む)
剤形用の粒状物質
平均粒径150〜800マイクロメートル;ならびに、沈降させていない状態での嵩密度0.1〜0.35g/cm3、および/または圧密圧力266MPaに供したときに引張強度少なくとも1.7MPaの圧密物をもたらす圧密化能を有する粒状物質であって;主成分が、セルロース誘導体またはアルキレンオキサイドホモ−もしくはコポリマーまたはこれらのブレンド物である粒状物質は、制御放出プロファイルを有する剤形の製造のために有用である。 (もっと読む)
結晶形およびその使用
本発明は、末梢μオピオイド受容体アンタゴニストとして有用な、(R)−N−メチルナルトレキソンの新しい形態およびその組成物を提供する。 (もっと読む)
8−[{1−(3,5−ビス−(トリフルオロメチル)フェニル)−エトキシ}−メチル]−8−フェニル−1,7−ジアザ−スピロ[4.5]デカン−2−オンの塩を含む錠剤処方物およびそれから作製される錠剤
錠剤型剤形を形成させるのに適した、式Iで表される(5S,8S)−8−[{(1R)−1−(3,5−ビス−(トリフルオロメチル)フェニル)−エトキシ}−メチル]−8−フェニル−1,7−ジアザスピロ[4.5]デカン−2−オンの塩を含む医薬処方物、ならびにその錠剤型剤形を開示する。そうした剤形を用いた治療方法も開示する。一態様では、(a)少なくとも1つの式Iの結晶塩、顆粒内在の微結晶性セルロース、ラクトース一水和物、第1の崩壊剤および結合剤を含む顆粒;ならびにそれと乾式ブレンドされた、(b)顆粒外在の微結晶性セルロース、第2の崩壊剤およびステアリン酸マグネシウムを含む粉末医薬処方物であって、前記顆粒を調製するために用いられる成分の量および凝集技術は、錠剤プレスで圧縮して少なくとも10kpの硬さを有する圧縮錠剤を得る処方をもたらすように選択される粉末医薬処方物を提供する。 (もっと読む)
時間特異的遅延/パルス放出剤形
少なくとも1種の有効成分および少なくとも1種の崩壊剤を含むコアと、コアを取り囲み、1種または複数の水溶性または非水溶性のpH非依存性ポリマーから本質的になる密封層と、1種または複数の親水性pH非依存性ポリマーから本質的になる外側被膜とを含み、少なくとも1種の崩壊剤が、コアに対して1〜20重量%の量で存在し、少なくとも1種の有効成分が、コアに対して1〜80重量%の量で存在し、密封層が、コアに対して0.1〜10重量%を占め、外側被膜が、コアに対して5〜500重量%を占める、時間特異的遅延/パルス放出剤形。このような被覆コアは、哺乳動物の胃腸管内で起こる物理的pHの変化とは無関係に、予め規定した遅延時間後に有効成分の即時放出を確実にすることができる。  (もっと読む)
(もっと読む)
シロスタゾールを含む制御放出製剤及びその製造方法
本発明は、シロスタゾールを含む制御放出製剤及び前記製剤の製造方法に関する。シロスタゾール又はその薬学的に許容される塩、可溶化剤、膨潤剤、膨潤調節剤及び気体発生物質を含む本発明の制御放出製剤は、シロスタゾールが胃腸で長期間滞留しながら徐々に放出されて血中のシロスタゾール濃度を一定に維持させて、シロスタゾールの主要吸収部位である小腸におけるシロスタゾールの吸収を高めるだけでなく、速放性放出による副作用を最小化して患者の服薬を容易にするという利点を有する。 (もっと読む)
口腔内速崩錠の製造方法
【課題】従来から存する通常の医薬品製造設備をそのまま使用して、優れた崩壊性と通常の取り扱いにおいて十分な硬度と耐摩損性を有し、かつ服用感の良い口腔内速崩錠を製造できる方法を提供すること。
【解決手段】結晶乳糖の粒子核に、ポリビニルピロリドンK−30の50%エタノール水溶液を添加し、次いで、前記ポリビニルピロリドンK−30の50%エタノール水溶液上に、予めエテンザミドに無水ケイ酸を添加・混合し、前記エテンザミドの粉末物性を改質した難溶性薬物エテンザミドをかけて、粉末コーティングし、次いで、この粉末コーティングした粒子を乾燥・整粒して粉末コーティング粒子とし、次いで、この粉末コーティング粒子に、造粒乳糖、結晶セルロース、クロスポビドンおよびマルチトールを加え、混合して混合物とし、次いで、この混合物に、ステアリン酸マグネシュウムを添加・混合した後、打錠して口腔内速崩錠を得る。
(もっと読む)
錠剤中錠剤組成物
本発明は、第1の層に1つまたは複数のエストロゲン、第2の層に治療剤を含む錠剤中錠剤組成物、およびそれらの製造方法に関する。 (もっと読む)
非ステロイド系抗炎症薬およびオメガ−3脂肪酸を用いる治療ならびにその組合せ生成物
本発明は、一または複数のNSAIDと、オメガ−3脂肪酸の混合物との組み合わせ、かかる組み合わせを投与する方法、およびかかる組み合わせの単位剤形を提供する。 (もっと読む)
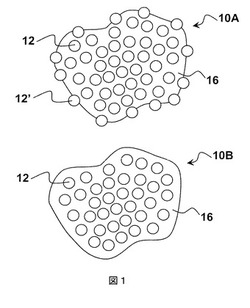
腸溶ポリマーを含むナノ粒子とカゼインを含む医薬組成物
【課題】低溶解性薬および腸溶ポリマーを含むナノ粒子、ならびにカゼインまたはその薬学的に許容できる形態を含む組成物の提供。
【解決手段】(a)低水溶性薬および腸溶ポリマーを含むナノ粒子12であって、(i)前記低水溶性薬の水中溶解度がpH範囲6.5〜7.5にわたって5mg/mL未満であり、(ii)前記ナノ粒子中の前記薬物の少なくとも90wt%が非結晶形態であり、(iii)前記ナノ粒子の平均サイズが500nm未満であり、(iv)前記低水溶性薬と前記腸溶ポリマーの質量比が9未満:1であるナノ粒子と、(b)カゼイン16またはその薬学的に許容できる形態とを含み、(1)前記カゼインと(2)前記低水溶性薬および前記腸溶ポリマーの合計質量の質量比が少なくとも1:20である固体医薬組成物。
(もっと読む)
81 - 90 / 201
[ Back to top ]