テクネチウム−及びレニウム−ビス(ヘテロアリール)錯体及びPSMAを阻害するその使用方法
式Iの化合物、その薬学的に許容可能な塩、又は溶媒和化合物は、レニウム、テクネチウム、又は他の金属と錯化して、特に金属が放射性である場合、組織を撮像する又は疾患を治療する錯体を提供する。このような錯体はPSMAタンパク質に特異的であり、したがって前立腺の癌及び該タンパク質が発現する他の組織の撮像又は処置に使用することができる。


【発明の詳細な説明】
【技術分野】
【0001】
(関連特許への相互参照)
本出願は、2008年12月5日出願の米国仮特許出願第61/120,226号及び2009年5月21日出願の第61/180,341号に対する優先権を主張し、これらは両方とも、いかなる意味においても参照により全体を本明細書に組み込むものとする。
【背景技術】
【0002】
本発明は、概して、放射性医薬品の分野に関し、トレーサ、撮像剤として核医学に、及び様々な疾患状態の治療のためにそれらを使用することに関する。腫瘍は、その悪性表現型を伴う独特のタンパク質を発現するか、又は正常な成分のタンパク質を正常な細胞より多数、過剰発現することがあることが知られている。腫瘍細胞の表面に独特のタンパク質が発現すると、腫瘍の表現型アイデンティティ及び生化学的組成及び活性を探索することによって疾患を診断し、特徴付ける機会が提供される。特定の癌細胞の表面タンパク質に選択的に結合する放射性分子は、非侵襲的状態で腫瘍を撮像し、治療するための魅力的な経路を提供する。特に、本発明の発明者らは、往々にして多くの癌細胞に過剰発現するPSMAタンパク質に対する放射性標識付き配位子が、癌細胞を非侵襲的に撮像するため及び選択的に標的にするための魅力的な経路を提供することを発見した。
【0003】
少なくとも100万人の男性が前立腺癌を患い、この病気は60歳から80歳の米国人男性のうち6人に1人に発症していると推定される。毎年、新たに30万人以上の前立腺癌の症例が診断されている。前立腺癌は米国の男性6人に1人に発症し、この病気の死亡率は肺ガンのみに次いで2位である。外科処置、放射線治療、薬物療法及び最小侵襲的治療に世界中で現在、推定20億ドルが費やされ、米国の支出は10億ドルである。現在、再発性、転移性、男性ホルモン非依存性前立腺癌に対して有効な治療法はない。放射線治療をもたらすことができるように、前立腺癌を迅速に視覚化し、明確に標的にすることができる新しい作用物質が必要とされている。
【0004】
グルタミン酸カルボキシペプチダーゼII(GCPII)としても周知のN−アセチル化アルファ連鎖酸性ジペプチダーゼ(NAALADase)は、神経系内でN−アセチルアスパラギン酸−グルタミン酸塩(NAAG)をN−アセチルアスパラギン酸とグルタミン酸塩に分割する神経ペプチダーゼであり、これについては、四面体中間体を介したNAALADaseによるNAAGの加水分解を示している以下を参照されたい。この酵素は、金属ペプチダーゼの助触媒クラスのタイプIIタンパクであり、活性部位に2つの亜鉛原子を含有する。
【化1】

【0005】
神経系におけるその特性決定とは関係なく、NAALADaseの一形態が、ヒトの前立腺癌内に高レベルで発現することが示され、前立腺特異性膜抗原(PSMA)と命名された。NAALADase/PSMA遺伝子は、複数のmRNA接合形態を生成することが周知であり、これまでの免疫組織化学的エビデンスに基づき、ヒトの脳及び前立腺は異なるイソ型の酵素を発現すると推定されている。
【0006】
葉酸ヒドロラーゼI(FOLH1)としても知られているヒト前立腺特異性膜抗原(PSMA)は、経膜的な750アミノ酸タイプII糖タンパクであり、これは主に正常なヒトの前立腺上皮に発現するが、転移性疾患を含む前立腺癌に上方制御される。PSMAは、ポリγ−グルタミン酸化葉酸に対する反応性を有する独特のエキソペプチダーゼであり、ポリγ−グルタミル末端を順番に除去することができる。PSMAは事実上すべての前立腺癌によって発現し、その発現は、あまり区別されない転移性癌とホルモン不応性癌でさらに増加するので、前立腺の撮像及び治療にとって非常に魅力的な標的である。PSMAと相互作用し、適切な放射性核種を有する配位子を開発すると、前立腺癌の検出、治療及び管理のために有望かつ新しい標的決定の選択肢を提供することができる。
【0007】
前立腺癌の転移及び再発を診断するために、PROSTASCINTスキャンとしても知られている抗PSMAモノクローナル抗体(mAb)7E11の放射免疫複合体の形態が現在使用されている。より最近では、PSMAの細胞外領域に結合するモノクローナル抗体が開発され、放射性標識が付けられて、動物のPSMA陽性の前立腺腫瘍モデル内に蓄積することが示されている。
【0008】
モノクローナル抗体は、腫瘍の検出及び治療にとって有望であるが、固形腫瘍内の浸透性が低いので、リンパ腫以外での臨床的成功は限られている。分子量が小さく、固体腫瘍内の浸透性を高めた模倣体は、1グラム当たりの高いパーセント及び高いパーセンテージの特異的結合を獲得するのに明確な利点を有する。
【0009】
撮像又は治療の目的で、放射性医薬品で癌細胞を選択的に標的とすることは大きな課題がある。Ga−67、Tc−99m、In−111、I−123及びI−131を含め、様々な放射性核種が放射線撮像に有用であることが知られている。医療用撮像に好ましい放射性同位元素はTc−99mである。何故なら、これは、半減期が短く(6時間)、比較的低コストで容易に入手可能であり、140keVのガンマ光子を放出するからである。さらに、水と空気安定性Tc(I)複合体[99mTc(OH2)3(CO)3]+錯体のようなTc−99m錯体は、1気圧の一酸化炭素(CO)下にて食塩水中で容易に調製することができる。
【発明の概要】
【課題を解決するための手段】
【0010】
一態様では、式Iの化合物、又はその薬学的に許容可能な塩若しくは溶媒和化合物を提供する。
【化2】

式中、Rは、H、アンモニウムイオン、アルキルアンモニウムイオン、アルカリ土類金属イオン、希土類金属イオン、又はアルキル基であり、Wは結合、−NHC(O)−、−CH(NH2)−、−NH−C(O)−NH−、−C(O)−NH−、−C(O)−NH−CH(COOH)−、−O−(CH2)n−O−(CH2)n−、−(CH2)nO(CH2)nO(CH2)n−、−CH(NHFmoc)−であり、Zは結合、−CO(O)−、−NH−、−NHC(O)−、−NH−C(O)−NH−、−NH−C(O)−(CH2)n−、−NH−C(O)−CH(NH2)−、−C(O)−NH−CH(COOH)−、又は−NH−C(O)−C6H4(CH2)n−NH−であり、NRaRbは下式のいずれかのキレート基であり、
【化3】

Rtは、H、C1−C8アルキル基、アンモニウムイオン、アルキルアンモニウムイオン、又はアルカリ又はアルカリ土類金属イオンであり、Rvはアルキルアルキル、置換アミノアルキル、アミノアルキル、又はアセトアミドアルキルであり、eは0から15の整数であり、fは0から15の整数であり、gは0から15の整数であり、nは0から10の整数であるが、ただしNRaRbは下式のいずれかであり、
【化4】

式中、Wが結合である場合、Zは結合、−C(O)−NH−又は−NHC(O)−以外であり、Zが結合である場合、Wは結合、−C(O)−NH−又は−NHC(O)−以外である。
【0011】
幾つかの実施形態では、Rvはメチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、tert−ブチル、アミノアルキル、ヒドロキシアルキル、又はカルボキシアルキルである。幾つかの実施形態では、Rvはメチルである。幾つかの実施形態では、Rtはそれぞれ独立に、H又はtert−ブチルである。幾つかの実施形態では、RtはHである。幾つかの実施形態では、eは0から4の整数であり、fは0から12の整数であり、gは0から6の整数である。幾つかの実施形態では、Wは−C(O)−NH−である。
【0012】
幾つかの実施形態では、式Iの化合物は、下式のいずれか、
【化5】

【化6】

【化7】

又はその薬学的に許容可能な塩若しくは溶媒和化合物であり、eは0から10の整数であり、fは0から12の整数であり、gは0から12の整数であり、nは0から10の整数である。
【0013】
幾つかの実施形態では、Zは−NH−C(O)−である。幾つかの実施形態では、Zは−C(O)−NH−CH(COOH)−である。幾つかの実施形態では、Zは−NH−C(O)−CH(NH2)−である。
【0014】
別の態様では、金属及び式Iの化合物を含む錯体を提供する。幾つかの実施形態では、金属はRe、Tc、Y、Lu、Ga、In、又はCuである。幾つかの実施形態では、金属は放射性核種である。幾つかの実施形態では、金属はテクネチウム−99m、レニウム−186又はレニウム−188である。
【0015】
幾つかの実施形態では、錯体中の金属はY、Lu、Ga、In、又はCuであり、式中、錯体は下式の基としてNRaRbを含む。
【化8】

【0016】
幾つかの実施形態では、錯体は、下式のいずれか、
【化9】

【化10】

【化11】

又はその薬学的に許容可能な塩及び溶媒和化合物、Re、Tc、Y、Lu、Ga、Cuであり、eは0から10の整数であり、fは0から12の整数であり、gは0から12の整数であり、nは0から10の整数である。
【0017】
別の態様では、式Iの化合物、その薬学的に許容可能な塩又は溶媒和化合物、及び薬学的に許容可能な補形剤を含む医薬組成物を提供する。
【0018】
別の態様では、患者内の部位を撮像する方法であって、診断上有効な量の式Iの化合物、その薬学的に許容可能な塩又は溶媒和化合物を患者に投与することと、患者の部位の像を入手することとを含む方法を提供する。
【0019】
別の態様では、脾臓組織、腎臓組織、又はPSMA発現腫瘍組織のような組織を撮像する方法であって、放射性金属及び下式のいずれかの基を含む化合物、
【化12】

又はその薬学的に許容可能な塩若しくは溶媒和化合物を含む錯体に組織を接触させることを含む方法を提供する。幾つかの実施形態では、組織はPSMA発現腫瘍組織である。他の実施形態では、PSMA発現腫瘍組織は前立腺癌である。
【図面の簡単な説明】
【0020】
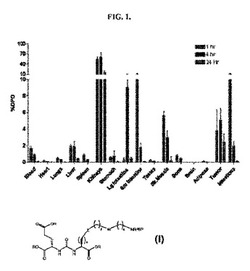
【図1】LNCaP異種移植マウスにおける実施例3の化合物の99mTc錯体の組織分布を%DPO単位で示したグラフである。
【図2】PSMAタンパク質に関する式Iによる比較化合物及び例示的化合物の競合結合曲線を示す。
【図3】実施例8の化合物の99mTc錯体の組織生体内分布を%ID/gとして表したグラフである。
【図4】実施例7の化合物の99mTc錯体の組織生体内分布を%ID/gとして表したグラフである。
【図5】LNCaP異種移植マウスにおける99mTc錯体の組織生体内分布を比較し、%ID/gで示したグラフである。
【図6】様々な時間隔で、及び幾つかの実施形態に従ってLNCaP異種移植マウスにおける実施例6の化合物の99mTc錯体の組織生体内分布を示す画像である。
【発明を実施するための形態】
【0021】
放射性医薬品には2つのカテゴリがある。すなわち、(i)血流又は灌流によって厳密に測定され、糸球体濾過、食菌作用、肝細胞クリアランス及び骨吸収のような高容量の構造を標的とする生物学的分布があるもの、及び(ii)低容量の部位である特異的な酵素又は受容体の結合相互作用によって決定される分布があるものである。本発明の放射性医薬品は第2のカテゴリに属し、放射性核種の配位錯体を特定のタンパク質又は関連する受容体に選択的な生物学的に活性の分子に結合させることによって合成される。
【0022】
様々な生物活性分子(BAM)を担体として使用することができるが、小分子及び小ペプチドは抗体又はタンパク質より利点を有する。例えば、小分子及び小ペプチドは、拡散の向上、血液クリアランスの高速化、及び背景放射の低下を示す。これらの担体によって、高いスループットの方法で容易な合成が可能になる。また、小ペプチドは、安定性が向上し、標的酵素又は受容体に対する親和性が改善されたペプチド模倣体又は小分子類似体に容易に変換することができる。
【0023】
一態様では、癌細胞を治療し、撮像するための新規の放射性医薬品として、式I〜IVによるPSMA選択的テクネチウム及びレニウム錯体の合成及び使用方法を提供する。特に、化合物を使用して、前立腺の癌腫を標的にすることができる。
【化13】

【0024】
定義
便宜上、本明細書及び添付の特許請求の範囲内で使用する特定の用語をここに集めた。
【0025】
本明細書で使用する場合、「約」は当業者に理解され、それが使用する文脈に応じて多少変動する。それが使用されている文脈から当業者に明白でない用語の使用がある場合、「約」は特定の用語の±10%までを意味する。
【0026】
本明細書で例示的に記載される実施形態は、本明細書で個別に開示されていない任意の1つ又は複数の要素、1つ又は複数の制限がない状態で適切に実践することができる。したがって、例えば「含む」、「備える」、「含有する」などの用語は、広義に制限なしに読まれるものとする。また、本明細書で使用される用語及び表現は、制限するためではなく説明の意味で使用されており、そのような用語及び表現を使用する際には、図示及び記載された特徴又はその一部のいかなる均等物も排除するものではなく、特許請求の範囲にある技術の範囲内で様々な変化が可能であることを理解されたい。また、「基本的に、〜で構成される」という句は、特許請求の範囲にある技術の基本的及び新規の特徴に具体的に影響しない、個別に列挙された要素、及び追加の要素を含むものと理解されたい。「〜のみで構成される」という句は、指定されていないいかなる要素も除外する。
【0027】
要素を説明する文脈において(特に添付の特許請求の範囲の文脈において)「a」、「an」及び「the」という用語を使用し、同様のことに言及するのは、本明細書に別段の指定がない限り、又は文脈と明らかに矛盾していない限り、単数及び複数の両方を含むものと解釈すべきである。
【0028】
本明細書で使用する「親油基」及び「親油性部分」という用語は、極性又は水性環境に対して非極性又は非水性環境により大きい親和性を有する基、部分又は置換基を指す。例えばMerriam Websterのオンライン辞書は、「親油性」を「(脂肪としての)脂質に対して親和性を有する」と定義している。例示的な親油性部分は、脂肪族炭化水素基、例えばアルキル基、芳香族炭化水素基、及び長鎖アシル基を含み、これはすべて、成分炭素の数が増加するにつれて親油性が増大する。一般的に、特定の化合物に親油性部分を添加すると、標準的なオクタノール/水分配係数決定プロトコルにおいて、オクタノールに対する化合物の親和性が増大し、このプロトコルを使用して、化合物の相対的な疎水性(親油性)及び親水性を測定することができる。
【0029】
「ルイス塩基」及び「ルイス塩基の」という用語は、特定の反応状態で一対の電子を供与することができる化学的部分を指す。ルイス塩基を、ルイス塩基及び金属イオンのアイデンティティに応じて、特定の錯体内で1つの電子を供与するものと特徴付けることが可能なこともあるが、大部分の趣旨では、ルイス塩基を2つの電子の供与体と理解するのが最善である。ルイス塩基部分の例は、アルコール、チオール及びアミンのような無電荷化合物、及びアルコキシド、チオレート、カルボニオン、及び様々な他の有機陰イオンのような荷電部分を含む。特定の例では、ルイス塩基は酸化物(O2−)のような1つの原子で構成することができる。それほど一般的ではない特定の状況では、ルイス塩基又は配位子は正の荷電状態であってもよい。ルイス塩基は、金属イオンと配位結合されると、配位子と呼ばれることが多い。
【0030】
「配位子」という用語は、何らかの方法で別の種と相互作用する種を指す。一例では、配位子は、ルイス酸と配位結合を形成することができるルイス塩基とすることができる。他の例では、配位子は、金属イオンと配位結合を形成する種であり、往々にして有機体である。配位子は、配位結合して金属イオンになると、当業者に周知の様々な結合モードを有することができ、それは例えば末端(すなわち、1つの金属イオンに結合する)及び架橋(すなわち、ルイス塩基の1つの原子が複数の金属イオンと結合する)を含む。
【0031】
「キレート剤」という用語は、当該技術分野において理解されるように、金属イオンへの供与に使用可能な2つ以上の非共有電子対を有する分子を指し、往々にして有機分子であり、往々にしてルイス塩基である。金属イオンは通常、2つ以上の電子対によってキレート剤に配位結合する。「二座キレート剤」、「三座キレート剤」及び「四座キレート剤」という用語は、キレート剤によって配位結合した金属イオンに同時に供与するためにすぐ使用可能なそれぞれ2つ、3つ、及び4つの電子対を有するキレート剤を指す。通常、キレート剤の電子対は、1つの金属イオンとの配位結合を形成するが、特定の例では、キレート剤は、複数の金属イオンと配位結合を形成することができ、様々な結合モードが可能である。
【0032】
「配位結合」という用語は、複数の電子対がある1つの供与体が1つの金属イオンと配位結合する(「配位結合される」)相互作用である。
【0033】
「錯体」という用語は、それぞれが別々に存在することができる1つ又は複数の電子が少ない分子とともに、これも別々に存在することができる1つ又は複数の電子が多い、及び電子が少ない分子又は原子が結合することによって形成された化合物を指す。
【0034】
Fmocは、化学基のフルオレニルメチルオキシカルボニルの略である。
【0035】
本明細書で使用する「治療的に有効な量」という句は、任意の治療に適用可能な妥当なベネフィット/リスクの比率で、動物の細胞の少なくとも部分集団に何らかの所望の治療効果を生じるために有効である、化合物、材料、又は化合物を含む組成物の量を意味する。
【0036】
本明細書で使用する「治療する」又は「治療」という用語は、診断、予防、治療及び治癒も含むものとする。この治療を受ける患者は、これを必要としている任意の動物であり、霊長類、特に人間、及びウマ、ウシ、ブタ及びヒツジのような他の哺乳動物、及び一般に家禽及び愛玩動物を含む。
【0037】
「薬学的に許容可能」という句は、本明細書では、健全な薬学的判断の範囲内で、妥当なベネフィット/リスクの比率に対応した過度の毒性、刺激、アレルギー反応、又は他の問題又は合併症がない状態で、人間及び動物の組織との接触状態で使用するのに適切な化合物、材料、組成物及び/又は剤形を指すために使用される。
【0038】
本明細書で使用する「薬学的に許容可能な担体」という句は、対象化合物を1つの器官又は体の一部から別の器官又は体の一部へと運ぶ又は輸送することに係わる液体又は固体充填剤、希釈剤、補形剤、又は溶媒封入材料のような薬学的に許容可能な材料、組成物又は賦形剤を意味する。各担体は、組成物の他の成分と適合性であり、患者にとって有害ではないという意味で、「許容可能」でなければならない。薬学的に許容可能な担体として働くことができる材料の幾つかの例は、(1)乳糖、ブドウ糖及び蔗糖のような糖類、(2)コーンスターチ及びジャガイモデンプンのようなデンプン、(3)カルボキシルメチルセルロースナトリウム、エチルセルロース及び酢酸セルロースのようなセルロース及びその誘導体、(4)粉末状トラガカントゴム、(5)麦芽、(6)ゼラチン、(7)滑石、(8)カカオ脂及び座剤ワックスのような補形剤、(9)落花生油、綿実油、ヒマワリ油、ごま油、オリーブ油、トウモロコシ油及び大豆油のような油、(10)プロピレングリコールのようなグリコール、(11)グリセリン、ソルビトール、マンニトール及びポリエチレングリコールのようなポリオール、(12)オレイン酸エチル及びラウリン酸エチルのようなエステル、(13)寒天、(14)水酸化マグネシウム及び水酸化アルミニウムのような緩衝剤、(15)アルギン酸、(16)発熱性物質を含まない水、(17)等張食塩水、(18)リンゲル液、(19)エチルアルコール、(20)pH緩衝液、(21)ポリエステル、ポリカーボネート及び/又はポリ無水物、及び(22)薬学的な処方に使用されるその他の無毒性で適合性の物質を含む。
【0039】
本明細書で使用する「非経口投与」及び「非経口投与した」という句は、経腸及び局所投与以外で通常は注射による投与モードを意味し、静脈内、筋内、動脈内、髄腔内、嚢内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、被膜下、蜘蛛膜下、脊椎内及び胸骨内注射及び注入などが挙げられるが、これらに限定されない。
【0040】
本明細書で使用する「全身投与」、「全身投与する」、「末梢投与」及び「末梢投与する」という句は、患者の器官系に入り、したがって代謝及び他の同様のプロセスの支配下にあるように、中枢神経系への直接投与以外に、化合物、薬剤又は他の材料を投与することを意味し、例えば皮下投与である。
【0041】
「アミノ酸」という用語は、アミノ酸類似体及び誘導体など、アミノ官能基及び酸官能基の両方を含む天然であれ、合成であれ、すべての化合物を指す。
【0042】
「ヘテロ原子」という用語は、炭素又は水素以外の任意の元素の原子を指す。例示的なヘテロ原子はホウ素、窒素、酸素、リン、硫黄及びセレンを含む。
【0043】
通常、「置換」は、以下で定義されるように(例えばアルキル基)、自身に含有される水素原子への1つ又は複数の結合が非水素又は非炭素原子への結合に取って代わられるアルキル又はアルケニル基を指す。置換基は、炭素又は水素原子への1つ又は複数の結合が、ヘテロ原子への二重結合又は三重結合を含む1つ又は複数の結合によって取って代わられる基も含む。したがって、置換基は他に指定されていない限り、1つ又は複数の置換基で置換される。幾つかの実施形態では、置換基は1、2、3、4、5又は6個の置換基で置換される。置換基の例としては、ハロゲン(すなわち、F、Cl、Br及びI);水酸基;アルコキシ、アルケノキシ、アルキノキシ、アリールオキシ、アラルキルオキシ、ヘテロシクリルオキシ、及びヘテロシクリルアルコキシ基;カルボニル(オキソ);カルボキシル;エステル;ウレタン;オキシム;ヒドロキシルアミン;アルコキシアミン;アラルコキシアミン;チオール;硫化物;スルホキシド;スルホン;スルホニル;スルホンアミド;アミン;N酸化物;ヒドラジン;ヒドラジド;ヒドラゾン;アジド;アミド;尿素;アミジン;グアニジン;エナミン;イミド;イソシアネート;イソチオシアネート;シアネート;チオシアネート;イミン;ニトロ基;ニトリル(すなわち、CN)などが挙げられる。
【0044】
アルキル基は、1〜12個の炭素原子、代表的には1〜10個の炭素、幾つかの実施形態では1〜8個、1〜6個、又は1〜4個の炭素原子を有する直鎖状及び分岐状のアルキル基を含む。直鎖状のアルキル基の例としては、メチル、エチル、n−プロピル、n−ブチル、n−ペンチル、n−ヘキシル、n−ヘプチル、及びn−オクチル基のような基が挙げられる。分岐状のアルキル基の例としては、イソプロピル、イソブチル、sec−ブチル、tert−ブチル、ネオペンチル、イソペンチル、及び2,2−ジメチルプロピル基が挙げられるが、これらに限定されない。アルキル基は置換していても又は置換していなくてもよい。炭素の数が他で指定されていない限り、「低級アルキル」とは以上で定義した通りであるが、その主鎖構造に1〜約10個の炭素、或いは1〜約6個の炭素原子を有するアルキル基を指す。同様に、「低級アルケニル」及び「低級アルキニル」は同様の鎖長を有する。
【0045】
「アルキルカルボニル」という用語は、C1−C8アルキル基の1つ又は複数のメチレンがC(O)基と置換した−(C1−C8)アルキル−C(O)基を指す。代表的な例としては、アセチル、プロピオニル、及びCH3(CH2)2C(O)−基が挙げられるが、これらに限定されない。
【0046】
「環式アルキル」又は「シクロアルキル」という用語は、3〜14個の炭素原子があり、環ヘテロ原子がなく、縮合及び橋かけ環構造を含む1つの環又は複数の環を有する飽和状又は部分飽和状の非芳香族環式アルキル基を指す。シクロアルキル基は置換していても又は置換していなくてもよい。シクロアルキル又は環式アルキル基は、環に3〜14個の炭素原子、又は幾つかの実施形態では3〜12個、3〜10個、3〜8個、又は3〜4、5、6又は7個の炭素原子を有する1環、2環、又は3環アルキル基を含む。例示的な1環シクロアルキル基としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、及びシクロオクチル基が挙げられるが、これらに限定されない。2環系及び3環系としては、これらに限定されないが、ビシクロ[2.1.1]ヘキサン、アダマンタイル、デカリニルなどの橋かけシクロアルキル基及び縮合環の両方が挙げられる。
【0047】
アルケニル基は、以上で定義したような直鎖状及び分岐状及びシクロアルキル基を含むが、2つの炭素原子間に少なくとも1つの二重結合が存在する。したがって、アルケニル基は、幾つかの実施形態では2〜約12個の炭素原子、他の実施形態では2〜10個の炭素原子、及び他の実施形態では2〜8個の炭素原子を有する。その例としては、ビニル、アリール、−CH=CH(CH3)、−CH=C(CH3)2、−C(CH3)=CH2、−C(CH3)=CH(CH3)、−C(CH2CH3)=CH2、シクロヘキセニル、シクロペンテニル、シクロヘキサジエニル、ブタジエニル、ペンタジエニル、及びヘキサジエニルが挙げられるが、これらに限定されない。アルケニル基は置換していても又は置換していなくてもよい。代表的な置換アルケニル基としては、一置換又は複数回置換することができ、以上で列挙したような置換基で一置換、二置換又は三置換されるが、これらに限定されない。
【0048】
アルキニル基は、直鎖状及び分岐鎖状及び以上で定義したようなシクロアルキル基を含むが、ただし2つの炭素原子間に少なくとも1つの三重結合が存在する。(C2−C8)アルキニル基の例としては、アセチレン、プロピン、1−ブチン、2−ブチン、1−ペンチン、2−ペンチン、1−ヘキシン、2−ヘキシン、3−ヘキシン、1−ヘプチン、2−ヘプチン、3−ヘプチン、1−オクチン、2−オクチン、3−オクチン及び4−オクチンが挙げられるが、これらに限定されない。アルキニル基は置換していなくてもよく、又は任意選択で以下で述べるような1つ又は複数の置換基で置換していてもよい。
【0049】
アリール基は、ヘテロ原子を含有しない環状芳香族炭化水素である。アリール基は1環、2環及び多環式環系を含む。したがってアリール基としては、フェニル、アズレニル、ヘプタレニル、ビフェニレニル、インダセニル、フルオレニル、フェナントレニル、トリフェニレニル、ピレニル、ナフタセニル、クリセニル、ビフェニル、アントラセニル、インデニル、インダニル、ペンタレニル、及びナフチル基が挙げられるが、これらに限定されない。幾つかの実施形態では、アリール基は、基の環部分に6から14個の炭素、及び他の実施形態では6〜12個、さらには6〜10個の炭素原子を含有する。アリール基は置換及び非置換アリール基の両方を含む。置換アリール基は一置換又は複数回置換することができる。例えば、一置換アリール基としては、以上で列挙したような置換基で置換することができる2−、3−、4−、5−又は6−置換フェニル又はナフチル基が挙げられるが、これらに限定されない。
【0050】
アラルキル基は、アルキル基の水素又は炭素結合が以上で定義したようなアリール基との結合で置換される、以上で定義したようなアルキル基である。幾つかの実施形態では、アラルキル基は7〜20個の炭素原子、7〜14個の炭素原子又は7〜10個の炭素原子を含む。
【0051】
複素環基は、3個以上の環員を含有し、そのうち1個以上がN、O及びS(これに限定されない)のようなヘテロ原子である非芳香族環化合物を含むことを指す。幾つかの実施形態では、ヘテロシクリル基は3〜20個の環員を含み、他のこのような基は3〜6個、3〜10個、3〜12個、又は3〜15個の環員を有する。ヘテロシクリル基は、例えばイミダゾリル、イミダゾリニル及びイミダゾリジニル基のような不飽和、部分飽和、及び飽和環式構造を包含する。ヘテロシクリル基は置換していても又は置換していなくてもよい。ヘテロシクリル基としては、アジリジニル、アゼチジニル、ピロリジニル、イミダゾリジニル、ピラゾリジニル、チアゾリジニル、テトラヒドロチオフェニル、テトラヒドロフラニル、ジオキソリル、フラニル、チオフェニル、ピロリル、ピロリニル、イミダゾリル、イミダゾリニル、ピラゾリル、ピラゾリニル、トリアゾリル、テトラゾリル、オキサゾリル、イソオキサゾリル、チアゾリル、チアゾリニル、イソチアゾリル、チアジアゾリル、オキサジアゾリル、ピペリジル、ピペラジニル、モルホリニル、チオモルホリニル、テトラヒドロピラニル、テトラヒドロチオピラニル、オキサチアン、ジオキシル、ジチアニル、ピラニル、ピリジル、ピリミジニル、ピリダジニル、ピラジニル、トリアジニル、ジヒドロピリジル、ジヒドロジチイニル、ジヒドロジチオニル、ホモピペラジニル、キヌクリジル、インドリル、インドリニル、イソインドリル、アザインドリル(ピロロピリジル)、インダゾリル、インドリジニル、ベンゾトリアゾリル、ベンゾイミダゾリル、ベンゾフラニル、ベンゾチオフェニル、ベンゾチアゾリル、ベンゾオキサジアゾリル、ベンゾオキサジニル、ベンゾジチイニル、ベンゾオキサチイニル、ベンゾチアジニル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、ベンゾ[1,3]ジオキソリル、ピラゾロピリジル、イミダゾピリジル(アザベンゾイミダゾリル)、トリアゾロピリジル、イソチアゾロピリジル、プリニル、キサンチニル、アデニニル、グアニニル、キノリニル、イソキノリニル、キノリジニル、キノキサリニル、キナゾリニル、シンノリニル、フタラジニル、ナフチリジニル、プテリジニル、チアナフタレニル、ジヒドロベンゾチアジニル、ジヒドロベンゾフラニル、ジヒドロインドリル、ジヒドロベンゾジオキシニル、テトラヒドロインドリル、テトラヒドロインダゾリル、テトラヒドロベンゾイミダゾリル、テトラヒドロベンゾトリアゾリル、テトラヒドロピロロピリジル、テトラヒドロピラゾロピリジル、テトラヒドロイミダゾピリジル、テトラヒドロトリアゾロピリジル、及びテトラヒドロキノリニル基が挙げられるが、これらに限定されない。ヘテロシクリル基は置換していても又は置換していなくてもよい。代表的な置換ヘテロシクリル基としては、1置換又は複数回置換することができ、以上で列挙したような様々な置換基で2、3、4、5又は6置換される、又は置換されないピリジル又はモルホリニル基が挙げられるが、これらに限定されない。
【0052】
ヘテロアリール基は、5個以上の環員を含有し、そのうち1個以上が、これらに限定されないが、N、O、及びSのようなヘテロ原子である、芳香族環式化合物である。ヘテロアリール基は置換していても又は置換していなくてもよい。ヘテロアリール基としては、ピロリル、ピラゾリル、トリアゾリル、テトラゾリル、オキサゾリル、イソオキサゾリル、チアゾリル、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、チオフェニル、ベンゾチオフェニル、フラニル、ベンゾフラニル、インドリル、アザインドリル(ピロロピリジル)、インダゾリル、ベンゾイミダゾリル、イミダゾピリジル(アザベンゾイミダゾリル)、ピラゾロピリジル、トリアゾロピリジル、ベンゾトリアゾリル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、イミダゾピリジル、イソチアゾロピリジル、チアナフタレニル、プリニル、キサンチニル、アデニニル、グアニニル、キノリニル、イソキノリニル、テトラヒドロキノリニル、キノキサリニル、及びキナゾリニル基のような基が挙げられるが、これらに限定されない。
【0053】
アルコキシ基は、水素原子との結合が以上で定義したような置換又は非置換アルキル基の炭素原子との結合に置き換えられた水酸基(−OH)である。直鎖状のアルコキシ基の例としては、メトキシ、エトキシ、プロポキシ、ブトキシ、ペントキシ、ヘキソキシなどが挙げられるが、これらに限定されない。分岐状のアルコキシ基の例としては、イソプロポキシ、sec−ブトキシ、tert−ブトキシ、イソペントキシ、イソヘキソキシなどが挙げられるが、これらに限定されない。シクロアルコキシ基の例としては、シクロプロピルオキシ、シクロブチルオキシ、シクロペンチルオキシ、シクロヘキシルオキシなどが挙げられるが、これらに限定されない。アルコキシ基は置換していても又は置換していなくてもよい。代表的な置換アルコキシ基は、以上に列挙したような置換基で1回又は複数回置換することができる。
【0054】
「ポリシクリル」又は「多環基」という用語は、2つ以上の炭素が2つの隣接する環に共通である2つ以上の環(例えばシクロアルキル、シクロアルケニル、シクロアルキニル、アリール及び/又はヘテロシクリル)を指し、例えば環は「縮合環」である。隣接していない原子を通して結合された環は「橋かけ」環と呼ばれる。多環の環はそれぞれ、上述したような置換基、例えばハロゲン、アルキル、アラルキル、アルケニル、アルキニル、シクロアルキル、水酸基、アミノ、モノアルキルアミノ、ジアルキルアミノ、ニトロ、スルフヒドリル、イミノ、アミド、ホスホン酸塩、ホスフィン酸塩、カルボニル、カルボキシル、シリル、エーテル、アルキルチオ、スルホニル、ケトン、アルデヒド、エステル、ヘテロシクリル、芳香族又はヘテロ芳香族部分、−CF3、−CNなどで置換することができる。
【0055】
「炭素環」という用語は、環の各原子が炭素である芳香族又は非芳香族環を指す。
【0056】
「ニトロ」という用語は−NO2を指し、「ハロゲン」という用語は当技術分野で認識され、−F、−Cl、−Br又は−Iを指し、「スルフヒドリル」という用語は当技術分野で認識され、−SHを指し、「ヒドロキシ」という用語は−OHを意味し、「スルホニル」という用語は当技術分野で認識され、−SO2−を指す。「ハライド」は、ハロゲンの対応する陰イオンを示し、「擬ハライド」は、Cotton及びWilkinsonによる「Advanced Inorganic Chemistry」の560ページで記載された定義を有する。
【0057】
「アミン又はアミノ」という用語は、−NRcRd基を指し、Rc及びRdはそれぞれ独立に、水素、(C1−C8)アルキル、アリール、ヘテロアリール及びヘテロシクロアルキル基を指す。Rc及びRdが同じ窒素原子に結合している場合、これは、窒素原子と組み合わされて5−、6−又は7−員環を形成することができる。例えば、−NRcRdは、1−ピロリジニル、ピリジニル又は4−モルホリニル環を含むものとする。
【0058】
「アミド」という用語は、当技術分野でアミノ置換カルボニルと認識され、一般式C(O)NRcRd基によって表すことができる部分を含み、式中、Rc及びRdは、以上で定義した通りである。幾つかの実施形態によれば、アミドは、不安定になり得るイミドを含まない。
【0059】
「カルボキシ」及び「カルボン酸塩」という用語は、以下のいずれかの一般式で表すことができるような部分を含む。
【化14】

式中、Eは結合であるか、又はO又はSを表し、Rf及びRf’は、個々にH、アルキル、アルケニル、アリール又は薬学的に許容可能な塩である。EがOでありRfが以上で定義された通りである場合、この部分は本明細書ではカルボキシル基と呼び、特にRfが水素である場合、式は「カルボン酸」を表す。一般的に、明示された酸素が硫黄と置換された場合、式は「チオカルボニル」基を表す。
【0060】
「アルコキシル」又は「アルコキシ」という用語は、以上で定義したように、自身に結合した酸素ラジカルを有するアルキル基を指す。代表的なアルコキシル基はメトキシ、エトキシ、プロポキシ、ブトキシ、tert−ブトキシなどを含む。「エーテル」は酸素によって共有結合された2個の炭化水素である。「エーテル」は、複数のエーテル基又は結合を所与の基内で表すことができるポリエーテルも含む。「エーテル」は、環状エーテル及びクラウンエーテルも含み、エーテル結合は環式基内にある。
【0061】
「スルホン酸塩」という用語は、一般式−S(O)2ORgで表すことができる部分を指し、Rgは、電子対、水素、アルキル、シクロアルキル又はアリールである。「硫酸塩」という用語は、一般式−OS(O)2ORgで表すことができる部分を含み、式中、Rgは、以上で定義した通りである。「スルホンアミド」という用語は、一般式−N(Rf)S(O)2ORf’で表すことができる部分を含み、式中、Rf及びRf’は、以上で定義した通りである。「スルファミド」という用語は、一般式−S(O)2NReRfで表すことができる部分を指し、Re及びRfは、水素、(C1−C8)アルキル又はアリールである。「スルホニル」という用語は、一般式−S(O)2Rhで表すことができる部分を指し、Rhは、水素、アルキル、アルケニル、アルキニル、シクロアルキル、ヘテロシクリル、アリール又はヘテロアリールのうちの1つである。
【0062】
各表現、例えばアルキル、m、nなどの定義は、任意の構造で2回以上出現した場合、同じ構造の他の場所におけるその定義とは無関係であるものとする。
【0063】
トリフリル、トシル、メシル、及びノナフリルという用語は、それぞれトリフルオロメタンスルホニル、p−トルエンスルホニル、メタンスルホニル、及びノナフルオロブタンスルホニル基を指す。トリフレート、トシレート、メシレート、及びノナフレートという用語は当技術分野で認識され、それぞれトリフルオロメタンスルホネートエステル、p−トルエンスルホネートエステル、メタンスルホネートエステル、及びノナフルオロブタンスルホネートエステル官能基及び該基を含有する分子を指す。略語Me、Et、Ph、Tf、Nf、Ts及びMsは、それぞれメチル、エチル、フェニル、トリフルオロメタンスルホニル、ノナフルオロブタンスルホニル、p−トルエンスルホニル及びメタンスルホニルを表す。当業者の有機化学者が使用する略語のさらに包括的なリストは、Journal of Organic Chemistryの各巻の第1号にあり、このリストは通常、Standard List of Abbreviationsと題した表で表される。
【0064】
組成物に含有される特定の化合物は、特定の幾何学的又は立体異性形態で存在することができる。また、化合物は光学活性でもよい。また、化合物は、シス及びトランス異性体、R−及びS−鏡像体、ジアステレオ異性体、(D)−異性体、(L)−異性体、そのラセミ混合物、及び他のその混合物も含むことができる。追加の非対称炭素原子がアリール基のような置換基内に存在することができる。例えば化合物の特定の鏡像体が望ましい場合、これは不斉合成によって、又はキラル助剤によって調製することができ、その結果のジアステレオ異性混合物が分離され、助剤基が分割されて純粋な所望の鏡像体を提供する。あるいは、分子がアミノのような塩基性官能基、又はカルボキシルのような酸性官能基を含有する場合、ジアステレオ異性塩が適切な光学活性酸又は塩基で形成され、その後に分別結晶化又は当技術分野で周知のクロマトグラフィ法によってこのように形成されたジアステレオ異性体が分割され、それに続いて純粋な鏡像体が回収される。
【0065】
本明細書で使用する「保護基」という句は、潜在的に反応性の官能基を望ましくない化学的変換から保護する一時的置換基を意味する。このような保護基の例としては、カルボキシル酸のエステル、アルコールのシリルエーテル、及びそれぞれアルデヒド及びケトンのアセタール及びケタールが挙げられる。保護基の化学的性質の分野はレビューされている(T.W.Greene、P.G.M.Wuts、Protective Groups in Organic Synthesis、第3版、Wiley、ニューヨーク、1999)。
【0066】
他に別段の指定がない限り、「立体異性体」とは、化合物の1つの立体異性体で、その化合物に他の立体異性体が実質的にないことを意味する。したがって、立体異性体的に純粋で1つのキラル中心を有する化合物は、化合物の反対の鏡像体を実質的に含まない。立体異性体的に純粋で2つのキラル中心を有する化合物は、化合物の他のジアステレオ異性体を実質的に含まない。立体異性体的に純粋な典型的化合物は、化合物の約80重量%より多い1つの立体異性体、及び化合物の約20重量%未満の他の立体異性体を含み、例えば化合物の約90重量%より多い1つの立体異性体及び化合物の約10重量%未満の他の立体異性体、又は化合物の約95重量%より多い1つの立体異性体及び化合物の約5重量%未満の他の立体異性体、又は化合物の約97重量%より多い1つの立体異性体及び化合物の約3重量%未満の他の立体異性体を含む。
【0067】
図示の構造とその構造に与えられた名前との間に矛盾がある場合は、図示の構造が支配する。また、構造又は構造の一部の立体化学を、例えば太線又は点線で示していない場合、その構造又は構造の一部はその全立体異性体を包含するものと解釈されたい。
【0068】
キレート化合物及びその合成
一態様では、式Iの化合物、その薬学的に許容可能な塩及び溶媒和化合物を提供する。
【化15】

式中、RはH、アンモニウムイオン、アルキルアンモニウムイオン、アルカリ土類金属イオン、希土類金属イオン、又はアルキル基であり、Wは結合、−NHC(O)−、−CH(NH2)−、−NH−C(O)−NH−、−C(O)−NH−、−C(O)−NH−CH(COOH)−、−O−(CH2)n−O−(CH2)n−、−(CH2)nO(CH2)nO(CH2)n−、−CH(NHFmoc)−であり、Zは結合、−CO(O)−、−NH−、−NHC(O)−、−NH−C(O)−NH−、−NH−C(O)−(CH2)n−、−NH−C(O)−CH(NH2)−、−C(O)−NH−CH(COOH)−、又は−NH−C(O)−C6H4−(CH2)n−NH−であり、NRaRbは存在しないか、又は下式のいずれかのキレート基であり、
【化16】

Rtは、H、C1−C8アルキル基、アンモニウムイオン、アルキルアンモニウムイオン、又はアルカリ又はアルカリ土類金属イオンであり、Rvはアルキルであり、eは0から15の整数であり、fは0から15の整数であり、gは0から15の整数であり、nは0から10の整数であるが、ただし、NRaRbが下式のいずれかであって、
【化17】

Wが結合である場合、Zは結合、−C(O)−NH−又は−NHC(O)−以外であり、Zが結合である場合、Wは結合、−C(O)−NH−又は−NHC(O)−以外である。幾つかの実施形態では、Rはアルキルである。他の実施形態では、Rvは、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、又はtert−ブチルである。さらに他の実施形態では、Rvはメチルである。さらに他の実施形態では、Rtはそれぞれ独立に、H又はtert−ブチルである。さらに他の実施形態では、RtはHである。
【0069】
式Iによる例示的化合物としては、下式のいずれか、
【化18】

【化19】

【化20】

又はその薬学的に許容可能な塩及び溶媒和化合物が挙げられるが、これらに限定されず、式中、eは0から10の整数であり、fは0から12の整数であり、gは0から12の整数であり、nは0から10の整数である。
【0070】
様々な実施形態によれば、化合物のNRaRb基は、さらに金属とキレート化することができる。幾つかの実施形態では、金属は放射性核種である。例えば金属は、テクネチウム−99m、又はレニウム−186m/188mであってもよい。[NEt4]2[MBr3(CO)3]のような錯体(MはTc又はReである)は、アルコール系溶媒中で式Iの化合物と反応させることができる。このような反応は、以下でさらに述べるように、式I−Mのキレート化錯体を提供する。
【化21】

【0071】
式I−Mによる例示的化合物としては、下式のいずれか1つ、
【化22】

【化23】

【化24】

又はその薬学的に許容可能な塩及び溶媒和化合物が挙げられるが、これらに限定されず、式中、MはRe又はTcであり、eは0から10の整数であり、fは0から12の整数であり、gは0から12の整数であり、nは0から10の整数である。
【0072】
幾つかの実施形態では、化合物はその薬学的に許容可能な塩及び溶媒和化合物ばかりでなく、このような化合物の立体異性体、互変異性体、及びプロドラッグも含む。
【0073】
上述したように、式Iの化合物の錯体は、放射線撮像剤として、及び急速に増殖する細胞を処置するための治療薬として使用するのに適切な1つ又は複数の放射性核種を含むことができる。したがって1つの実施形態では、金属及び式Iの化合物、その塩、溶媒和化合物、立体異性体、又は互変異性体、及び薬学的に許容可能な担体を含む錯体を含む医薬組成物を提供する。
【0074】
一般的に、式Iの化合物の金属錯体又はその医薬組成物は、経口的に、又は腸管外経路を介して、通常は注射によって投与することができる。非経口的経路は、静脈内、筋内、動脈内、髄腔内、嚢内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、被膜下、蜘蛛膜下、脊椎内及び胸骨内注射及び注入を含むが、これらに限定されない。幾つかの実施形態では、化合物、又はその薬学的組成物が経口投与される。このような組成物は、錠剤、丸剤、カプセル、半固体、粉末、溶液、懸濁液、エリキシル、エアロゾル、又は任意の他の適切な組成物の形態をとることができる。
【0075】
別の態様によれば、in vivo撮像に適切な薬学的組成物を提供する。このような適切な薬学的撮像組成物は、薬学的に許容可能な放射線医学媒体とともに、元素として放射性核種を、すなわち、放射性ヨウ素、又は式Iの化合物の放射性金属キレート錯体を撮像に十分な量だけ有する撮像剤を含有する。放射線医学賦形剤は、ヒト血清アルブミンや、例えばトリス(ヒドロメチル)アミノメタン(及びその塩)、リン酸塩、クエン酸塩、重炭酸塩などの緩衝水溶液や、滅菌水や、生理食塩水や、塩化物及び/又は重炭酸塩、又はカルシウム、カリウム、ナトリウム及びマグネシウムのような正常な血漿陽イオンを含有する平衡イオン溶液のように、注入又は吸入に適切でなければならない。
【0076】
放射線医学賦形剤中の撮像剤の濃度は、満足できる撮像を提供するのに十分でなければならない。例えば、水溶液を使用する場合、線量は約1.0〜50ミリキュリーである。撮像剤は、約1時間〜24時間、患者の体内に留まるように投与しなければならないが、これより長い期間及び短い期間の両方が許容可能である。したがって、1〜10mLの水溶液を含有する都合の良いアンプルを調製することとしてもよい。
【0077】
撮像は通常の方法で、例えば適切な撮像を提供するのに十分な量の撮像組成物を注入し、次にガンマカメラのような適切な機械で走査することによって実行することができる。特定の実施形態では、患者内の部位を撮像する方法は、放射性核種で錯化した化合物を診断上有効な量、患者に投与するステップと、上記患者の部位を放射線に曝露するステップと、上記患者の上記部位の像を入手するステップとを含む。特定の実施形態では、撮像される部位は頭部又は胸郭である。他の実施形態では、式Iの化合物及び錯体は、PSMAタンパク質を標的とする。
【0078】
したがって幾つかの実施形態では、脾臓組織、腎臓組織、又はPSMA発現腫瘍組織のような組織を撮像する方法であって、放射性金属及び下式のいずれかの基を含む化合物、又はその薬学的に許容可能な塩又は溶媒和化合物を含む化合物を含む錯体に組織を接触させることを含む方法を提供する。
【化25】

幾つかの実施形態では、組織はPSMA発現腫瘍組織である。このような化合物の特異性を図5に示す。
【0079】
このように概略的に述べた本発明は、本発明の例示として提供され、それを限定するものではない以下の実施例を参照することにより、さらに容易に理解される。
【実施例】
【0080】
基本的な合成方法
化合物を金属と錯化する基本手順。本明細書で例示するように、非放射性同位元素の入手可能性及び作業者の安全性を考慮し、前記金属にはレニウムを使用する。しかし、理解されるように、テクネチウム類似体を使用して同様の合成手順に従ってもよい。何故なら、テクネチウム及びレニウムはランタニド収縮により同様の反応化学現象を有し、同様のサイズだからである。したがって、Reを特に示すことができる場合、Tc錯体も同様に含むことが理解される。
【0081】
レニウム錯体を形成する基本実験条件
式Iの化合物のレニウム/テクネチウム錯体は、容易に入手可能な先駆物質[NEt4]2[Re(CO)3Br3]と化合物との反応から、都合よく分離される。SAAC末端によって提供される供与体のセットは、{M(CO)3}+1の核の効果的キレーターとして詳細に文書化されており、金属部位の周囲の必要な面構成に適応するように設計されていて、錯体の調製も例外ではない。
【0082】
{Re(I)(CO)3}+構造は、99mTc−トリカルボニルの核のそれと同様の反応化学現象を辿る。開始材料として[NEt4]2[ReBr3(CO)3]を使用すると、fac−{Re(CO)3(L)3}の核が容易に形成される。[NEt4]2[ReBr3(CO)3]は、[ReBr(CO)5]から容易に誘導される。Re(I)錯体の合成は、10mlのメタノール中で[NEt4]2[ReBr3(CO)3]を適切なキレート化配位子と1:1.2の比率で反応させることによって達成される。反応混合物は、80℃で4時間加熱できるようにする。冷却後、反応生成物はすべて、C18 Sep Pakカラムを使用して精製し、収率は20〜50%の範囲である。
【0083】
他に記載していない限り、Re(I)錯体の合成は、10mLのメタノール中で[NEt4]2[ReBr3(CO)3](又は[99mTc(CO)3(H2O)3]+)を適切な配位子(10−6M〜10−4M)と1:1.2の割合で反応させることによって達成した。密封したバイアルを100℃で4時間加熱した。冷却した後、RP−HPLC(逆相HPLC)によって反応物の純度を分析し、溶離剤としてメタノールを使用し、シリカカラムを使用して生成物を精製した。HPLC精製後は「担体なし」生成物となり、その放射化学的純度(RCP)は、HPLCによって測定され、一貫して95%以上になることが示された。初期結果は、10−6Mという低い濃度の放射性標識付けを示したが、RCYは80%以下であった。RCYは放射化学的収率の略語である。75℃でRCYが95%超を達成するには、反応濃度を10−4Mまで増加させる必要があった。多くの場合、試験及び取り扱いの目的で非放射性類似体を調製するために、Re錯体として対応するTc錯体が調製され、試験される。
【0084】
化合物の放射性標識付け
式Iの化合物の放射性標識付けを行い、同様の方法を使用して遊離α−アミノ酸か、又は適切にN保護したアミノ酸誘導体として錯体を形成した。99mTc(I)(CO)3+の放射性標識付けは、2ステップで行い、市販のIsoLink(商標)キット(Covidien)を使用して、[99mTc(CO)3(H2O)3]+中間体を形成し、これを1:1のアセトニトリルとリン酸緩衝液の等量混合液中で式Iの適切な化合物(10−6M〜10−4M)と反応させた。密封したバイアルを100℃で30分間加熱した。冷却した後、RP−HPLCによって反応物の純度を分析した。HPLC精製の後は「担体なし」生成物となり、その放射化学的純度(RCP)はHPLCによって測定され、一貫して95%以上になることが示された。初期結果は、10−6Mという低濃度での放射性標識付けを実証し、RCYは80%以下であった。75℃でRCY>95%を達成するには、反応濃度を10−4Mまで増加させる必要があった。多くの場合、試験及び取り扱いの目的で非放射性類似体を調製するために、対応するRe錯体が調製され、Tc錯体として試験される。したがって、Reを特に示すことができるが、Tc錯体も含むことが理解される。
【0085】
例示的な式Iの化合物の合成
スキーム1は、Glu−尿素−イミダゾール系化合物の基本的な合成経路を示す。スキーム1に示された第1のステップは、0℃で不活性状態にて実行し、塩基の存在下でCDIを有するグルタミン酸のジ−t−ブチルエステルを使用し、中間体のGlu−尿素−イミダゾール誘導体2を形成する。この中間体を塩基性状態でMeOTfで活性化させて、メチル化イミダゾールを生成し、これは不活性状態でアミンに容易に反応する。DCM中の20%のTFAを使用し、室温で1〜4時間かけてtert−ブチルエステル保護基を除去する。保護解除が終了したら、反応混合物をロータリーエバポレータで濃縮するか、窒素を吹きつけて乾燥させ、シリカカラムで精製するか、又は再結晶化させる。
スキーム1
【化26】

【0086】
スキーム2に示す基本経路を使用し、10〜50%の範囲の全体的収率で一般構造Eの化合物を調製した。重要な合成中間体を、適切なアルデヒドを室温で1時間反応させることによって形成し、中間体シッフ塩基を形成した。シッフ塩基は分離しなかったが、トリアセトキシ水素化ホウ素ナトリウムでin situで還元し、二誘導体化アミン(B)を形成した。誘導体化アミンは、末端カルボン酸、HATU(2−(1H−7−アザベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロリン酸メタンアミニウム)及び塩基を使用して2−[3−(5−アミノ−1−tert−ブトキシカルボニル−ペンチル)−ウレイド]−ペンタンジオン酸ジーtert−ブチルエステル(A)と結合し、保護された中間体Cを形成した。Re(I)錯体(D)の合成は、10mlのメタノール中で[NEt4]2[ReBr3(CO)3]を適切な配位子と1:1.2の比率で反応させることによって達成された。反応物を80℃で4時間加熱されるようにした。冷却後、以下の反応生成物はすべて、C18 Sep Pakカラムを使用して精製し、収率は20〜50%の範囲であった。
スキーム2.M−Glu−尿素−Lys−X類似体(E)の合成の基本経路
【化27】

【0087】
DCM中の50%TFAを使用し室温12時間で、tert−ブチルエステル保護基を除去した。保護解除が終了したら、反応物をロータリーエバポレータで濃縮し、HPLC又はフラッシュクロマトグラフィで精製して、10〜50%の収率で所望の生成物(E)を生成した。
【0088】
実施例1:[Re(CO)3{(S)−2−(3−((R)−5−(ビス((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)アミノ)−1−カルボキシペンチル)ウレイド)ペンタンジオン酸}]
【化28】

スキーム1に示した基本手順と同様に、2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(S)−2−(3−((R)−5−(ビス((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)アミノ)−1−カルボキシペンチル)ウレイド)ペンタンジオン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。TFAを使用する上記方法を使用して、化合物の保護を解除し、オフホワイトの固体として所望の生成物(4.0mg、29%)を産生した。1H NMR (400 MHz, DMSO-d6)δ7.2 (s, 2H), 7.0 (s, 2H), 6.3 (s, 2H), 4.85 (s, 4H), 4.55 (d, 2H), 4.4 (d, 2H), 4.10 (s, 2H), 3.5 (s, 2H), 2.2 (m, 2H), 1.7 (m, 6H), 1.25 (m, 2H). ESMS m/z: 866 (M+H)+.
【0089】
実施例2:[Re(CO)3{(14R,18S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸}]
【化29】

スキーム1に示した基本手順と同様に、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(14R,18S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。TFAを使用する上記方法を使用して、化合物の保護を解除し、オフホワイトの固体として所望の生成物(8.0mg、13%)を産生した。1H NMR (400 MHz, DMSO-d6)δ7.9 (s, H), 7.2 (s, 2H), 7.0 (2, 2H), 6.3 (s, 2H), 4.85 (s, 4H), 4.55 (d, 2H), 4.4 (d, 2H), 4.1 (m, 2H), 3.5 (s, 2H), 2.9 (s, 4H), 2.2 (m, 2H), 2.05 (m, 2H), 1.85 (m, 2H), 1.6 (m, 6H), 1.3 (m, 4H). ESMS m/z: 979 (M+H)+.
【0090】
実施例3:[Re(CO)3{(19R,23S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボン酸}]
【化30】

スキーム1に示した基本手順と同様に、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(19R,23S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。TFAを使用する上記方法を使用して、化合物の保護を解除し、オフホワイトの固体として所望の生成物(7.0mg、24%)を産生した。1H NMR (400 MHz, DMSO-d6)δ7.8 (s, H), 7.2 (s, 2H), 7.0 (2, 2H), 6.3 (s, 2H), 4.8 (s, 4H), 4.55 (d, 2H), 4.4 (d, 2H), 4.1 (m, 2H), 3.5 (m, 2H), 2.9 (m, 2H), 2.2 (m, 2H), 2.05 (m, 4H), 1.9 (m, 4H), 1.6 (m, 4H), 1.4 (m, 2H) 1.3 (m, 16H). ESMS m/z: 525 (M/2).
【0091】
実施例4:[Re(CO)3{(17R,21S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−11,19−ジオキソ−5,8−ジオキサ−2,12,18,20−テトラアザトリコサン−17,21,23−トリカルボン酸}]
【化31】

スキーム1に示した基本手順と同様に、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(17R,21S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−11,19−ジオキソ−5,8−ジオキサ−2,12,18,20−テトラアザトリコサン−17,21,23−トリカルボン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。TFAを使用する上記方法を使用して、化合物の保護を解除し、オフホワイトの固体として所望の生成物(6.0mg、38%)を産生した。1H NMR (400 MHz, DMSO-d6)δ7.9 (s, H), 7.2 (s, 2H), 7.0 (s, 2H), 6.3 (s, 2H), 4.85 (s, 4H), 4.6 (d, 2H), 4.5 (d, 2H), 3.80 (m, 12H), 3.5 (m, 10H), 2.4 (m, 4H). ESMS m/z: 738 (M+H)+.
【0092】
実施例5
【化32】

【0093】
実施例5a(n=2):Glu−尿素−Lys−PEG2−ReDP:[Re(CO)3{(17R,21S)−11,19−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8−ジオキサ−2,12,18,20−テトラアザトリコサン−17,21,23−トリカルボン酸}][Br]。スキーム1に記載のものと同じ基本手順を使用し、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(17R,21S)−11,19−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8−ジオキサ−2,12,18,20−テトラアザトリコサン−17,21,23−トリカルボン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。上記方法を使用して、化合物の保護を解除し、オフホワイトの固体として所望の生成物(2mg、20%)を産生した。1H NMR (400 MHz, DMSO-d6)δ8.8 (d), 8.00 (dd), 7.55 (d), 7.42 (dd), 6.45 (s), 3.95 (m), 3.4-3.6 (m), 2.45 (m), 1.25 (m), 1.1 (m), 0.8 (m). ESMS m/z: 931 (M+H)+.
【0094】
実施例5b(n=4):Glu−尿素−Lys−PEG4−ReDP:[Re(CO)3{(23R,27S)−17,25−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8,11,14−テトラオキサ−2,18,24,26−テトラアザノナコサン−23,27,29−トリカルボン酸}][Br]。実施例6aの基本手順と同様に、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(23R,27S)−17,25−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8,11,14−テトラオキサ−2,18,24,26−テトラアザノナコサン−23,27,29−トリカルボン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。上記方法を使用して、化合物の保護を解除し、白い固体として所望の生成物(5.1mg、29.6%)を産生した。ESMS m/z: 1019 (M+H)+.
【0095】
実施例5c(n=8):Glu−尿素−Lys−PEG8−ReDP:[Re(CO)3{(35R,39S)−29,37−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8,11,14,17,20,23,26−オクタオキサ−2,30,36,38−テトラアザヘンテトラコンタン−35,39,41−トリカルボン酸}][Br]。実施例6aと同じ基本手順を使用し、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、PEG8ジピリジル化合物、(35R,39S)−29,37−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8,11,14,17,20,23,26−オクタオキサ−2,30,36,38−テトラアザヘンテトラコンタン−35,39,41−トリカルボン酸を調製した。レニウムの基本実験で述べた手順と同様に、レニウムエステル錯体を調製した。上記方法を使用して、化合物の保護を解除し、白い固体として所望の生成物(8.0mg、30.4%)を産生した。ESMS m/z: 1195 (M+H)+.
【0096】
実施例6:[Re(CO)3][(19S,23S)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボン酸]
【化33】

【0097】
ステップ1.11−((2−tert−ブトキシ−2−オキソエチル)((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)−メチル)アミノ)ウンデカン酸
【化34】

DCE(20mL)中に11−アミノウンデカン酸(603mg、3.0mmol)、2−ピリジンカルボキサルデヒド(630mg、3.0mmol)及びAcOH(0.20mL)を含む懸濁液を、窒素下で30分間還流した。反応混合物を0℃まで冷却し、NaBH(OAc)3(1.908g、9.0mmol)及び精製されていないtert−ブチルグリオキシレート(1.50g、11.5mmol)で順番に処理した。反応混合物を室温で一晩攪拌し、水で分解した。反応混合物をDCMで抽出した。有機層を減圧して乾燥・濃縮した。残留物をbiotageのシリカゲルカラムで精製し、黄色い油として11−((2−tert−ブトキシ−2−オキソエチル)((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ウンデカン酸(343mg、22%)を産生した。1H NMR (400 MHz, CDCl3) 7.01 (d, J = 1.2 Hz, 0.46 H), 6.99 (d, J = 1.2 Hz, 0.54 H), 6.88 (d, J = 1.2 Hz, 0.54 H), 6.86 (d, J = 1.2 Hz, 0.46 H), 5.30 (s, 1.08 H), 5.07 (s, 0.92 H), 4.67 (s, 2 H), 4.66 (s, 2 H), 3.83 (s, 0.92 H), 3.17 (s, 1.08 H), 2.41-2.32 (m, 2 H), 1.66-1.63 (m, 2 H), 1.47 (s, 9 H), 1.45 (s, 9 H), 1.42-1.10 (m, 14 H); MS (ESI), 510 (M+H)+.
【0098】
ステップ2.(19S,23S)−テトラ−tert−ブチル2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)−メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボキシラート
【化35】

DCM(5.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−6−アミノ−1−tert−ブトキシ−1−オキソヘキサン−2−イル)ウレイド)ペンタンジオン酸(85mg、0.175mmol)、11−((2−tert−ブトキシ−2−オキソエチル)((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ウンデカン酸(89mg、0.175mmol)、EDCI(1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド)(38mg、0.20mmol)、HOBt(1−ヒドロキシベンゾトリアゾール)(26mg、0.20)及びDIPEA(0.30mL)を含む溶液を室温で3日間攪拌した。反応混合物をDCM中の1%〜10%のMeOHでbiotageで溶出することによって精製し、黄色い油として(19S,23S)−テトラ−tert−ブチル2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボキシラート(111mg、65%)を産生した。MS (ESI), 490.5 (M/2+H)+.
【0099】
ステップ3.[Re(CO)3][(19S,23S)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボン酸](221)。TFA(1.0mL)/DCM(1.0mL)中に(19S,23S)−テトラ−tert−ブチル2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボキシラート(18.8mg、0.019mmol)を含む溶液を室温で一晩攪拌した。溶媒を蒸発させ、無色の油として19S,23S)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボン酸を生成した。水(1.0mL)中で保護を解除し、2NのNaOHでpH=9に調節した上記生成物の溶液に、Re(CO)3(H2O)OTf(0.50mL、0.10mL/mmol)を添加した。反応混合物を室温で一晩攪拌し、HPLCで精製して、白い固体として標題の化合物(4.0mg、19%)を生じた。1H NMR (400 MHz, DMSO-d6) 7.70 (t, J = 5.6 Hz, 1 H), 7.33 (s, 1 H), 7.13 (s, 2 H), 6.29 (d, J = 8.4 Hz, 1 H), 6.26 (d, J = 8.4 Hz, 1 H), 4.96 (d, J = 4.8 Hz, 2 H), 4.56 (d, J = 16.4 Hz, 1 H), 4.12 (d, J = 16.8 Hz, 1 H), 4.07-3.90 (m, 2 H), 3.70 (d, J = 17.2 Hz, 1 H), 3.40 (d, J = 17.2 Hz, 1 H), 2.98-2.94 (m, 4 H), 2.21 (q, J = 7.73, 2 H), 1.99 (t, J = 7.6 Hz, 2 H), 1.70-1.22 (m, 24 H); MS (ESI), 485.2 (M/2+H)+.
【0100】
実施例7:[Re(CO)3][(7S,14S,18S)−7−アミノ−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸]
【化36】

【0101】
ステップ1.(5S,12S,16S)−トリ−tert−ブチル5−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−1−(9H−フルオレン−9−イル)−3,6,14−トリオキソ−2−オキサ−4,7,13,15−テトラアザ−オクタデカン−12,16,18−トリカルボキシラート
【化37】

DCM(5.0mL)中に(S)−ジ−tert−ブチル2(3−((S)−6−アミノ−1−tert−ブトキシ−1−オキソヘキサン−2−イル)ウレイド)ペンタンジオアート(97mg、0.20mmol)、化合物2(151mg、0.20mmol)、EDCI(38mg、0.20mmol)、HOBt(26mg、0.20)及びDIPEA(0.30mL)を含む溶液を室温で一晩攪拌した。反応混合物をDCM中の1%〜10%のMeOHでbiotageで溶出することによって精製し、白い固体として(5S,12S,16S)−トリ−tert−ブチル5−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−1−(9H−フルオレン−9−イル)−3,6,14−トリオキソ−2−オキサ−4,7,13,15−テトラアザオクタデカン−12,16,18−トリカルボキシラート(85.7mg、35%)を生じた。1H NMR (400 MHz, CDCl3) 7.75 (d, J = 7.6 Hz, 2 H), 7.64 (d, J = 7.6 Hz, 2 H), 7.38 (t, J = 7.4 Hz, 2 H), 7.29 (dd, J = 7.6, 4.4 Hz, 2 H), 7.02 (brs, 1 H), 6.93 (s, 2 H), 6.80 (s, 2 H), 6.08 (d, J = 8.0 Hz, 1 H), 5.75 (d, J = 8.8 Hz, 1 H), 5.67 (d, J = 7.6 Hz, 1 H), 4.58 (s, 2 H), 4.56 (s, 2 H), 4.55-4.52 (m, 1 H), 4.36-4.29 (m, 3 H), 4.21 (d, J = 7.0 Hz, 1 H), 4.13 (t, J = 6.8 Hz, 1 H), 3.63 (s, 4 H), 3.48-3.46 (m, 1 H), 3.05-3.01 (m, 1 H), 2.53 (t, J = 7.2 Hz, 2 H), 2.33-2.26 (m, 2 H), 2.07-2.00 (m, 2 H), 1.77-1.26 (m, 55 H); MS (ESI), 614.0 (M/2+H)+.
【0102】
ステップ2.(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート
【化38】

DMF(0.50mL)中に(5S,12S,16S)−トリ−tert−ブチル5−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−1−(9H−フルオレン−9−イル)−3,6,14−トリオキソ−2−オキサ−4,7,13,15−テトラアザオクタデカン−12,16,18−トリカルボキシラート(84mg、0.069mmol)を含む溶液に、ピペリジン(0.50mL)を添加した。混合物を室温で2時間攪拌した。溶媒を減圧して蒸発させ、残留物を生じた。これを、DCM中の5%のMeOHから25%のMeOHでbiotageで溶出することによって精製し、(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート(59mg、86%)を生じた。1H NMR (400 MHz, , CDCl3) 6.96 (d, J = 0.8 Hz, 2 H), 6.85 (d, J = 0.8 Hz, 2 H), 5.55 (brs, 1 H), 5.43 (brs, 1 H), 4.59 (s, 4 H), 4.37-4.28 (m, 2 H), 3.61 (s, 4 H), 3.35-3.27 (m, 2 H), 3.18-3.12 (m, 1 H), 2.53 (t, J = 7.4 Hz, 2 H), 2.34-2.28 (m, 2 H), 2.10-2.00 (m, 2 H), 1.85-1.26 (m, 55 H); MS (ESI), 503.0 (M/2+H)+.
【0103】
ステップ3.[Re(CO)3][(7S,14S,18S)−7−アミノ−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸]。MeOH(5mL)中に(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート(42mg、0.042mmol)及び[NEt4]2[Re(CO)3Br3](42mg、0.055mmol)を含む溶液を圧力管にて90℃で4時間攪拌した。溶媒を蒸発させ、残留物を生成した。これは次のステップに直接使用した。TFA(3.0mL)/DCM(3.0mL)中に以上の生成物を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて、精製されていない生成物が得られ、これをHPLCで精製して白い固体として標題の化合物(27.9mg、2ステップで67%)を生成した。1H NMR (400 MHz, DMSO-d6) 8.42 (brs, 1 H), 8.10 (brs, 2 H), 7.18 (s, 2 H), 7.04 (s, 2 H), 6.32 (d, J = 8.4 Hz, 1 H), 6.29 (d, J = 8.0 Hz, 1 H), 4.02 (s, 4 H), 4.56-4.37 (m, 4 H), 4.08-4.01 (m, 2 H), 3.68-3.61 (m, 3 H), 3.11-3.08 (m, 2 H), 2.23-1.29 (m, 16 H); MS (ESI), 497.7 (M/2+H)+.
【0104】
実施例8:[Re(CO)3][(19S,23S)−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボン酸]
【化39】

【0105】
ステップ1.tert−ブチル2,2’−(2−ブロモアセチルアザンジイル)ジアセテート。DCM(100mL)中にtert−ブチル2,2’−二酢酸アザンジイル(3.00g、12.24mmol)及び2−臭化ブロモアセチル(1.39mL、3.23g、16.00mmol)を含む溶液に、室温でEt3N(2.0mL)を添加した。反応混合物を室温で2時間攪拌した。反応混合物をDCM(300mL)で希釈し、水で洗浄して、Na2SO4で乾燥した。溶媒を減圧して蒸発させ、残留物を生じた。これをEtOAc中の10%のヘキサンからEtOAc中の50%のヘキサンでbiotageで溶出することによって精製し、tert−ブチル2,2’−(2−ブロモアセチルアザンジイル)ジアセテート(4.68g、100%)にした。1H NMR (400 MHz, CDCl3) 4.09 (s, 2 H), 4.07 (s, 2 H), 3.86 (s, 2 H), 1.49 (s, 9 H), 1.46 (s, 9 H); MS (ESI), 388, 390 (M+Na)+.
【0106】
ステップ2.tert−ブチル2,2’−(2−(2−ホルミル−1H−イミダゾール−1−イル)アセチルアザンジイル)ジアセテート
【化40】

tert−ブチル2,2’−(2−ブロモアセチルアザンジイル)ジアセテート(4.55g、12.43mmol)、1H−イミダゾール−2−カルバルデヒド(1.536g、16.0mmol)、DIPEA(5.0mL)、及びKI(0.64g、4.0mmol)の溶液を80℃で一晩攪拌した。溶液を減圧して蒸発させた後、反応混合物をDCMで希釈し、水で洗浄して、乾燥した。溶媒を減圧して蒸発させ、残留物を生じ、これをDCMでDCM中の3%のMeOHに対してbiotageで溶出することによって精製し、tert−ブチル2,2’−(2−(2−ホルミル−1H−イミダゾール−1−イル)アセチルアザンジイル)ジアセテート(3.96g、84%)にした。1H NMR (400 MHz, CDCl3) 9.76 (s, 1 H), 7.31 (s, 1 H), 7.25 (s, 1 H), 5.30 (s, 2 H), 4.14 (s, 2 H), 4.07 (s, 2 H), 1.51 (s, 9 H), 1.43 (s, 9 H); MS (ESI), 382 (M+H)+.
【0107】
ステップ3.11−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ウンデカン酸
【化41】

DCE(30mL)中に11−アミノウンデカン酸(100mg、0.50mmol)、tert−ブチル2,2’−(2−(2−ホルミル−1H−イミダゾール−1−イル)アセチルアザンジイル)ジアセテート(381mg、1.0mmol)及びAcOH(0.02mL)を含む溶液を、窒素下で75℃で30分間攪拌した。反応混合物を0℃まで冷却し、NaBH(OAc)3(0.3165g、1.5mmol)で処理した。反応混合物を室温で一晩攪拌し、水で分解した。溶媒を減圧して蒸発させ、残留物を生じ、これをDCM中の1〜10%のMeOHでbiotageで溶出し、11−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ウンデカン酸(368mg、79%)にした。1H NMR (400 MHz, DMSO-d6) 6.93 (s, 2 H), 6.76 (s, 2 H), 5.02 (s, 4 H), 4.29 (s, 4 H), 3.93 (s, 4 H), 3.44 (s, 4 H), 2.30 (t, J = 7.6 Hz, 2 H), 2.09 (t, J = 7.6 Hz, 2 H), 1.43 (s, 18 H), 1.35 (s, 18 H), 1.29-1.00 (m, 16 H); MS (ESI), 466.9 (M/2+H)+.
【0108】
ステップ4.(19S,23S)−トリ−tert−ブチル1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボキシラート
【化42】

DCM(5.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−6−アミノ−1−tert−ブトキシ−1−オキソヘキサン−2−イル)ウレイド)ペンタンジオン酸(85mg、0.174mmol)、11−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ウンデカン酸(118mg、0.127mmol)、EDCI(38mg、0.20mmol)、HOBt(26mg、0.20)及びDIPEA(0.30mL)を含む溶液を室温で一晩攪拌した。反応混合物をDCM中に1%〜10%のMeOHでbiotageで溶出することによって精製し、無色の油として(19S,23S)−トリ−tert−ブチル1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボキシラート(38mg、21%)を生じた。1H NMR (400 MHz, CDCl3) 6.95 (d, J = 1.2 Hz, 2 H), 6.83 (d, J = 0.80 Hz, 2 H), 5.97 (s, 1 H), 5.28 (d, J = 7.6 Hz, 1 H), 5.23 (d, J = 8.4 Hz, 1 H), 4.94 (s, 4 H), 4.33-4.25 (m, 2 H), 4.12 (s, 4 H), 4.03 (s, 4 H), 3.63 (s, 4 H), 3.25-3.16 (m, 2 H), 2.53 (t, J = 7.4 Hz, 2 H), 2.33-2.24 (m, 2 H), 2.15 (t, J = 7.6 Hz, 2 H), 2.08-2.03 (m, 2 H), 2.02-1.20 (m, 85 H); MS (ESI), 701.6 (M/2+H)+.
【0109】
ステップ5.[Re(CO)3][(19S,23S)−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボン酸](223)。MeOH(5mL)中に(19S,23S)−トリ−tert−ブチル1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボキシラート(28mg、0.02mmol)及び[NEt4]2[Re(CO)3Br3](30mg、0.039mmol)を含む溶液を圧力管にて90℃で一晩攪拌した。溶媒を蒸発させて残留物を生成し、これは次のステップで直接使用した。TFA(3.0mL)/DCM(3.0mL)中に以上の生成物を含む溶液を室温で3時間攪拌した。溶媒を蒸発させて精製されていない生成物が得られ、これをHPLCによって精製して、白い固体として標題の化合物(17.6mg、2ステップで69%)を生成した。1H NMR (400 MHz, DMSO-d6) 7.70 (t, J = 4.8 Hz, 1 H), 7.10 (s, 2 H), 7.03 (s, 2 H), 6.29 (d, J = 8.4 Hz, 1 H), 6.26 (d, J = 8.4 Hz, 1 H), 5.02 (s, 4 H), 4.37-3.97 (m, 14 H), 3.60-3.57 (m, 2 H), 3.01-2.94 (m, 2 H), 2.24-1.22 (m, 28 H); MS (ESI), 640.3 (M/2+H)+.
【0110】
実施例9:[Re(CO)3][(7S,14S,18S)−7−アミノ−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸]
【化43】

【0111】
ステップ1.2−(((9H−フルオレン−9−イル)メトキシ)カルボニルアミノ)−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸
【化44】

DCE(30mL)中にL−Fmoc−リジン−OH(0.202g、0.50mmol)、tert−ブチル2,2’−(2−(2−ホルミル−1H−イミダゾール−1−イル)アセチルアザンジイル)ジアセテート(0.381g、1.00mmol)を含む溶液を80℃で30分間加熱した。反応混合物を0℃に冷却し、NaBH(OAc)3(0.3165g、1.50mmol)で処理した。反応物を室温で12時間攪拌し、水で分解した。反応混合物をDCMで抽出した。有機層を減圧して乾燥・濃縮した。残留物を、DCM中に5〜25%のメタノールという勾配法でBiotage SP4によって精製し、白い固体として2−(((9H−フルオレン−9−イル)メトキシ)カルボニルアミノ)−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(0.408g、74%収率)を生じた。1H NMR (400 MHz, CDCl3) 7.74 (d, J = 7.6 Hz, 2 H), 7.67 (t, J = 6.0 Hz, 2 H), 7.38 (t, J = 7.4 Hz, 2 H), 7.29 (d, J = 7.6 Hz, 2 H), 6.92 (s, 2 H), 6.29 (s, 2 H), 6.19 (brs, 1 H), 5.09-5.04 (m, 2 H), 4.81-4.79 (m, 1 H), 4.39-4.30 (m, 4 H), 4.23 (t, J = 7.2 Hz, 1 H), 4.22-3.58 (m, 10 H), 3.48 (s, 2 H), 2.34-2.30 (m, 2 H), 1.67-1.26 (m, 6 H), 1.50 (s, 18 H), 1.42 (s, 18 H). ESMS m/z: 550.5 (M/2+H)+.
【0112】
ステップ2.(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート
【化45】

DCM(5.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−6−アミノ−1−tert−ブトキシ−1−オキソヘキサン−2−イル)ウレイド)ペンタンジオアート(97mg、0.20mmol)、2−(((9H−フルオレン−9−イル)メトキシ)カルボニルアミノ)−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(132mg、0.12mmol)、EDCI(38mg、0.20mmol)、HOBt(26mg、0.20)及びDIPEA(0.30mL)を含む溶液を室温で2日間攪拌した。反応混合物をDCM中の1%のMeOHでbiotageで溶出することによって精製し、油として(5S,12S,16S)−トリ−tert−ブチル5−(4−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−1−(9H−フルオレン−9−イル)−3,6,14−トリオキソ−2−オキサ−4,7,13,15−テトラアザオクタデカン−12,16,18−トリカルボキシラート(不純)を生じた。
【0113】
DMF(1.0mL)中に以上の生成物、すなわち、(5S,12S,16S)−トリ−tert−ブチル5−(4−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−1−(9H−フルオレン−9−イル)−3,6,14−トリオキソ−2−オキサ−4,7,13,15−テトラアザオクタデカン−12,16,18−トリカルボキシラートを含む溶液に、ピペリジン(0.50mL)を添加した。混合物を室温で2時間攪拌した。溶媒を減圧して蒸発させて、残留物を生じ、これをDCM中の5%のMeOHから50%のMeOHでbiotageで溶出させることによって精製し、白い固体として(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート(40mg、25%)を生じた。1H NMR (400 MHz, , CDCl3) 6.96 (s, 2 H), 6.83 (d, 2 H), 6.37 (brs, 1 H), 6.33 (brs, 1 H), 5.05 (s, 4 H), 4.87 (brs, 2 H), 4.27-4.24 (m, 2 H), 4.18 (s, 4 H), 4.10 (s, 4 H), 3.88 (d, J = 15.2 Hz, 2 H), 3.62 (d, J = 15.2 Hz, 2 H), 3.14-3.12 (m, 1 H), 2.30-1.24 (m, 83 H); MS (ESI), 674.1 (M/2+H)+.
【0114】
ステップ3.[Re(CO)3][(7S,14S,18S)−7−アミノ−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸](224)。MeOH(3mL)中に(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート(19mg、0.014mmol)及び[NEt4]2[Re(CO)3Br3](19mg、0.024mmol)を含む溶液を圧力管にて90℃で3時間攪拌した。溶媒を蒸発させて、残留物を生成し、これは次のステップで直接使用した。TFA(3.0mL)/DCM(3.0mL)中に以上の生成物を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて、精製されていない生成物が得られ、これをHPLCによって精製し、白い固体として[Re(CO)3][(7S,14S,18S)−7−アミノ−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸](14.1mg、2ステップで82%)を生成した。1H NMR (400 MHz, DMSO-d6) 8.43 (brs, 1 H), 8.09 (brs, 3 H), 7.10 (s, 2 H), 7.03 (s, 2 H), 6.51 (brs, 1 H), 6.31 (d, J = 8.0 Hz, 1 H), 6.28 (d, J = 8.4 Hz, 1 H), 5.00 (s, 4 H), 4.40-4.01 (m, 14 H), 3.70-3.64 (m, 3 H), 3.11-3.08 (m, 2 H), 2.26-1.29 (m, 16 H); MS (ESI), 612.8 (M+H)/2+.
【0115】
実施例10:Re(CO)3][(7S,14S,16S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−9,14−ジオキソ−2,8,13,15−テトラアザオクタデカン−7,12,16,18−テトラカルボン酸]
【化46】

【0116】
ステップ1.(S)−ジ−tert−ブチル2−(3−((S)−1−tert−ブトキシ−5−(2,5−ジオキソピロリジン−1−イルオキシ)−1,5−ジオキソペンタン−2−イル)ウレイド)ペンタンジオアート
【化47】

CH3CN(5.0mL)中に(S)−5−tert−ブトキシ−4−(3−((S)−1,5−ジ−tert−ブトキシ−1,5−ジオキソペンタン−2−イル)ウレイド)−5−オキソペンタン酸(S.A.Kularatne他、Mol.Pharmaceutics、2009、6、790〜800)(164mg、0.336mmol)、N,N’−炭酸ジスクシンイミジル(128mg、0.50mmol)及びピリジン(0.10mL)を含む溶液を室温で一晩攪拌した。溶媒を減圧して除去し、残留物を生成し、これをヘキサン中の10%〜70%のEtOAcでbiotageで溶出することによって精製し、白い固体として(S)−ジ−tert−ブチル2−(3−((S)−1−tert−ブトキシ−5−(2,5−ジオキソピロリジン−1−イルオキシ)−1,5−ジオキソペンタン−2−イル)ウレイド)ペンタンジオアート(190mg、97%)を生じた。
【0117】
ステップ2.(2S,7S,11S)−2−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−15−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸
【化48】

DMF(1.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−1−tert−ブトキシ−5−(2,5−ジオキソピロリジン−1−イルオキシ)−1,5−ジオキソペンタン−2−イル)ウレイド)ペンタンジオアート(138mg、0.236mmol)、(S)−2−アミノ−6−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(127mg、0.237mmol)及びDIPEA(0.50mL)を含む溶液を室温で一晩攪拌した。溶媒を減圧して除去し、残留物を生成し、これをDCM中の1%〜50%のMeOHでbiotageで溶出することによって精製し、白い固体として(2S,7S,11S)−2−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−15−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸(203mg、86%)を生じた。1H NMR (400 MHz, CDCl3) 7.40 (brs, 1 H), 6.99 (s, 2 H), 6.79 (s, 2 H), 6.12 (brs, 1 H), 5.62 (brs, 1 H), 4.67-4.28 (m, 7 H), 3.68 (d, J = 14.0 Hz, 2 H), 3.62 (d, J = 14.0 Hz, 2 H), 2.62-2.53 (m, 2 H), 2.34-2.02 (m, 8 H), 1.83-1.42 (m, 51 H); MS (ESI), 503.5 (M/2+H)+.
【0118】
ステップ3.[Re(CO)3][(7S,12S,16S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−9,14−ジオキソ−2,8,13,15−テトラアザオクタデカン−7,12,16,18−テトラカルボン酸](225)。MeOH(5mL)中に((2S,7S,11S)−2−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−15−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸(45mg、0.0448mmol)及び[NEt4]2[Re(CO)3Br3](45mg、0.058mmol)を含む溶液を圧力管にて90℃で4時間攪拌した。溶媒を蒸発させて残留物を生成し、これは次のステップで直接使用した。TFA(2.0mL)/DCM(3.0mL)中に以上の生成物を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて精製されていない生成物が得られ、これをHPLCで精製して、白い固体として[Re(CO)3][(7S,12S,16S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−9,14−ジオキソ−2,8,13,15−テトラアザオクタデカン−7,12,16,18−テトラカルボン酸](30mg、2ステップで67%)を生成した。1H NMR (400 MHz, DMSO-d6) 8.14 (d, J = 7.2 Hz, 1 H), 7.19 (d, J = 0.8 Hz, 2 H), 7.05 (d, J = 1.2 Hz, 2 H), 6.37-6.34 (m, 2 H), 4.85 (s, 4 H), 4.58 (dd, J = 16.4, 2.8 Hz, 2 H), 4.40 (dd, J = 16.0, 2.8 Hz, 2 H), 4.22-4.04 (m, 3 H), 3.65 (t, J = 7.6 Hz, 2 H), 2.25-1.32 (m, 16 H); MS (ESI), 995.3 M+.
【0119】
実施例11:[Re(CO)3][(7S,12S,16S)−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−9,14−ジオキソ−2,8,13,15−テトラアザオクタデカン−7,12,16,18−テトラカルボン酸]
【化49】

【0120】
ステップ1.(S)−2−アミノ−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸
【化50】

DMF(0.50mL)中に2−(((9H−フルオレン−9−イル)メトキシ)カルボニルアミノ)−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(190mg、0.173mmol)及びピペリジン(0.50mL)を含む溶液を室温で1時間攪拌した。溶媒を減圧して蒸発させ、精製されていない生成物が得られた。精製されていない生成物を、DCM中に5〜50%のメタノールという勾配法でBiotage SP4によって精製し、(S)−2−アミノ−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(0.120g、79%)を生成した。1H NMR (400 MHz, DMSO-d6) 6.92 (s, 2 H), 6.76 (s, 2 H), 5.01 (s, 4 H), 4.32 (s, 2 H), 4.31 (s, 2 H), 3.92 (s, 4 H), 3.44 (s, 4 H), 3.01-2.99 (m, 1 H), 2.30 (t, J = 7.2 Hz, 2 H), 1.60-1.57 (m, 2 H), 1.43 (s, 18 H), 1.35 (m, 18 H). 1.30-1.12 (m, 4 H); MS (ESI), 439.4 (M/2+H)+.
【0121】
ステップ2.(2S,7S,11S)−2−(4−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−5−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸
【化51】

DMF(2.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−1−tert−ブトキシ−5−(2,5−ジオキソピロリジン−1−イルオキシ)−1,5−ジオキソペンタン−2−イル)ウレイド)ペンタンジオン酸(82mg、0.14mmol)、((S)−2−アミノ−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(98mg、0.11mmol)及びDIPEA(0.50mL)を含む溶液を室温で一晩攪拌した。溶媒を減圧して除去し、残留物を生成し、これをDCM中の1%〜40%のMeOHでbiotageで溶出することによって精製し、白い固体として(2S,7S,11S)−2−(4−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−15−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸(125mg、84%)を生じた。MS (ESI), 674.6 (M/2+H)+.
【0122】
ステップ3.[Re(CO)3][(7S,12S,16S)−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−9,14−ジオキソ−2,8,13,15−テトラアザオクタデカン−7,12,16,18−テトラカルボン酸](226)。MeOH(5mL)中に(2S,7S,11S)−2−(4−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−15−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸(54mg、0.040mmol)及び[NEt4]2[Re(CO)3Br3](47mg、0.060mmol)を含む溶液を圧力管にて90℃で4時間攪拌した。溶媒を蒸発させて残留物を生成し、これは次のステップで直接使用した。TFA(2.0mL)/DCM(3.0mL)中に以上の生成物を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて精製されていない生成物が得られ、これをHPLCで精製して、白い固体として標題の化合物(44.8mg、2ステップで91%)を生成した。1H NMR (400 MHz, DMSO-d6) 8.17 (d, J = 7.6 Hz, 1 H), 7.11 (d, J = 1.2 Hz, 2 H), 7.03 (d, J = 1.2 Hz, 2 H), 6.37-6.33 (m, 2 H), 5.02 (s, 4 H), 4.40-3.98 (m, 15 H), 3.65 (t, J = 7.6 Hz, 2 H), 2.25-1.32 (m, 14 H); MS (ESI), 613.3 (M+H)/2+.
【0123】
以上の方法で適切な試薬を選択して調製した追加の化合物には、下記の実施例14〜20が含まれる。
【0124】
実施例12:(7S,22S,26S)−9,16,24−トリオキソ−1−(キノリン−2−イル)−2−(キノリン−2−イルメチル)−2,8,17,23,25−ペンタアザオクタコサン−7,22,26,28−テトラカルボン酸
【化52】

【0125】
実施例13:(7S,22S,26S)−9,16,24−トリオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−2,8,17,23,25−ペンタアザオクタコサン−7,22,26,28−テトラカルボン酸
【化53】

【0126】
実施例14:(22S,26S)−9,16,24−トリオキソ−2−(ピリジン−2−イルメチル)−2,8,17,23,25−ペンタアザオクタコサン−1,7,22,26,28−ペンタカルボン酸
【化54】

【0127】
実施例15:(7S,22S,26S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((3−(カルボキシメチル)−3H−ピロル−2−イル)メチル)−9,16,24−トリオキソ−2,8,17,23,25−ペンタアザオクタコサン−7,22,26,28−テトラカルボン酸
【化55】

【0128】
実施例16:(19S,23S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボン酸
【化56】

【0129】
実施例17:(7S,11S,26S)−26−(4−(ビス((1−メチル−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−2,2−ジメチル−4,9,17,24−テトラオキソ−3−オキサ−8,10,16,25−テトラアザヘプタコサン−27−オイック酸
【化57】

【0130】
1,4,7,10−テトラアザシクロドデカン−1,4,7,10−テトラ酢酸(DOTA)に基づいたキレーターを組み込んで他の化合物を調製することができる。このようなDOTA系のキレーターは、イットリウム、ルテチウム、ガリウム及びインジウムを含むが、これらに限定されない撮像金属をキレート化するために使用することができる。DOTA系のキレーターは、以上で概略したように、DOTAの酸基のうち1つを利用し、他のR基に結合して調製することができる。例示的なDOTA系の化合物は下式を含むが、これらに限定されず、式中、MはY、Lu、Ga又はInであり、nは0〜20である。
【化58】

【0131】
実施例18.(7S,22S,26S)−1−(1−メチル−1H−イミダゾール−2−イル)−2−((1−メチル−1H−イミダゾール−2−イル)メチル)−9,16,24−トリオキソ−2,8,17,23,25−ペンタアザオクタコサン−7,22,26,28−テトラカルボン酸のRe(CO)3錯体。
【化59】

【0132】
DMF(5.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−1−tert−ブトキシ−6−(8−(2,5−ジオキソピロリジン−1−イルオキシ)−8−オキソオクタンアミド)−1−オキソヘキサン−2−イル)ウレイド)ペンタンジオアート(0.356g、0.48mmol)、化合物13の化合物(0.16g、0.48mmol)及びDIPEA(1.0mL)を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて残留物を生成し、これをDCM/MeOHでBiotageで溶出することによって精製し、(7S,11S,26S)−26−(4−(ビス((1−メチル−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−2,2−ジメチル−4,9,17,24−テトラオキソ−3−オキサ−8,10,16,25−テトラアザヘプタコサン−27−オイック酸(81mg、18%)を生成した。MS (ESI), 481 (M/2+H)+.
【0133】
MeOH(4mL)中に(7S,11S,26S)−26−(4−(ビス((1−メチル−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−2,2−ジメチル−4,9,17,24−テトラオキソ−3−オキサ−8,10,16,25−テトラアザヘプタコサン−27−オイック酸(72mg、0.075mmol)及び[NEt4]2[Re(CO)3Br3](72mg、0.094mmol)を含む溶液を圧力管にて95℃で4時間攪拌した。溶媒を蒸発させて残留物を生成し、これは次のステップで直接使用した。TFA/DCM中に以上の生成物を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて精製されていない生成物が得られ、これをHPLCによって精製し、白い固体として[Re(CO)3][(7S,22S,26S)−1−(1−メチル−1H−イミダゾール−2−イル)−2−((1−メチル−1H−イミダゾール−2−イル)メチル)−9,16,24−トリオキソ−2,8,17,23,25−ペンタアザオクタコサン−7,22,26,28−テトラカルボン酸](4.0mg)を生成した。1H NMR (400 MHz, DMSO-d6) 8.08 (d, J = 8.0 Hz, 1 H), 7.72 (t, J = 5.4 Hz, 1 H), 7.24 (d, J = 1.2 Hz, 2 H), 7.05 (d, J = 1.2 Hz, 2 H), 6.31 (d, J = 8.4 Hz, 1 H), 6.28 (d, J = 8.0 Hz, 1 H), 4.69 (d, J = 16.8 Hz, 2 H), 4.54 (d, J = 16.8 Hz, 2 H), 4.28-4.23 (m, 1 H), 4.11-4.03 (m, 2 H), 3.78 (s, 6 H), 2.97-2.92 (m, 2 H), 2.26-2.20 (m, 2 H), 2.11 (t, J = 7.2 Hz, 2 H), 1.99 (t, J = 7.6 Hz, 2 H), 1.90-1.20 (m, 24 H); MS (ESI), 531.8 (M/2+H)+.
【0134】
レニウム、テクネチウム、又は他の金属キレート化錯体を有する式Iの化合物の他の錯体は、以上で例示された方法で調製することができる。ランタニド収縮により、レニウム及びテクネチウムは同様のサイズ及び反応性を有する。したがって、レニウムは放射性ではない安定した同位元素を幾つか有するので、レニウム錯体は、対応する放射性テクネチウム錯体の挙動について、合成し、試験する良好なモデルになる。このようにレニウム錯体が例示によって提供されているが、テクネチウム錯体も調製することができ、その逆もあり得る。
【0135】
表1に示す下記の例は、保護基について単離するか、上述したようにin situで、上述の方法によって調製された、又は調製される。
【表1−1】

【表1−2】

【表1−3】

【表1−4】

【表1−5】

【表1−6】

【0136】
基本的な生物学的性質
PSMA陽性(+)のLnCap細胞を使用し、一般構造5の新たに調製した類似体を、ヒト前立腺癌細胞結合測定法にて3nMの濃度でスクリーニングした。このスクリーニングの結果は、化合物がPSMA(+)細胞に特異な結合を示すかどうかを実証した。PSMA(+)細胞に特異的な結合を示した化合物を、PSMAの既知の阻害剤である、N−[N−[(S)−1,3−ジカルボキシプロピル]カルバモイル]−S−3−ヨード−L−チロシン(DCIT)との競合結合測定法でさらに評価し、IC50値を計算した。
【0137】
In vitro予備スクリーニング
LNCaP及びPC3ヒト前立腺癌細胞は、メリーランド州RockvilleのAmerican Type Culture Collectionから入手した。LNCaP細胞を、10%のウシ胎児血清(FBS)で補ったRPMI−1640培地中に維持した。LNCaP細胞に対する放射性標識付き化合物の結合、及び低温誘導体との競合は、適切な修正をして、既知の手順に従って実行された。細胞を、12ウェルプレートに約4×105個/ウェルとし、37℃/5%二酸化炭素の加湿したインキュベータ内で48時間インキュベートしてから化合物を加えた。Glu−尿素−X誘導体をそれぞれ調製し、3nMの123I−DCIT(既知の阻害剤)と組み合わせた0.5%のウシ血清アルブミン(BSA)を含有する無血清細胞培養培地で希釈した。全結合量は、試験化合物がない状態で123I−DCITをインキュベートすることによって測定した。プレートを室温で1時間インキュベートした。細胞をプレートから取り出し、エッペンドルフ管に移した。サンプルを15秒間、10K×gでマイクロ遠心分離器にかけた。培地を吸引し、新しいアッセイ培地中に分散させることによってペレットを2回洗浄し、その後にマイクロ遠心分離した。123I−DCITの細胞結合量は、自動ガンマカウンタで細胞ペレットを数えることによって求めた。非特異的結合量は、2uMの放射性標識なし化合物又は2ホスホノメチル−ペンタンジオン酸(PMPA)でインキュベートした後に、細胞に関連するカウントとして測定された。重要な対照標準化合物を下図に示す。
【化60】

【0138】
バイオアッセイ
組織の生体内分布結果はin vitroデータと一致し、LNCaP(PSMA陽性)腫瘍内の有意の取り込みを実証した。この結果は、またPC3(PSMA陰性)腫瘍における高度の特異性及び非常に小さい活性も示した。
【0139】
「低温」錯体に対してN−[N−[(S)−1,3−ジカルボキシプロピル]カルバモイル]−S−3−ヨード−L−チロシン(I−131−DCIT)を使用した生物学的評価は、迅速な第1のスクリーニングであり、そして投与量曲線からIC50値を正確に求められることが判明した。一連のリード化合物は50nM未満のIC50値を示した。一連のリード化合物のin vivoデータは、LNCaP腫瘍内で3%ID/g蓄積という高い親和性、及びLNCaP対PC3の比率が15:1を超えるという高い特異性を実証した。
【0140】
NAALADaseのアッセイ
以下のようにNAAGの結合を測定し、PSMAを測定する。(a)反応混合物の調製:反応混合物は、LNCaP細胞溶解物(200μg)を600uLの反応緩衝液(反応緩衝液:50mMのTris−HCl、pH7.4、20mMのCoCl2、32mMのNaCl)と組み合わせることによって調製する。混合物は、使用前に37℃で3分間プレインキュベートさせる。(b)放射性標識付きNAAG溶液の調製:放射性標識付きNAAG溶液原料は、反応緩衝液(1mM)を使用して1μlの100mMの原料を100μlに希釈することによって調製する。(c)アッセイ:アッセイは、(1mMの最終濃度のために)1,000,000CPMの3H−NAAG(100μLの1mMのNAAG+10μLの3H−NAAG(10μCi))を加えた6μLの1mMのNAAGを反応混合物に添加することによって実行する。競合結合の研究のために、PMPA[濃度]を添加し、その結果の溶液を30分間37℃でインキュベートする。100uLの反応混合物を移し、等量の氷温の0.25MのKH2PO4(pH4.3)を添加することによって、特定の時点で反応を停止する。緩衝した混合物の約1/2を250mgAGの50W−X4陽イオン交換カラム(200〜400メッシュ、H+型、使用前にDI H2Oで膨張した樹脂)に注入する。注入したカラムを500μLの1:1のRxn緩衝液/0.25MのKH2PO4で洗浄し、3MのKCl(1.5mL)で溶出する。カラムに結合した放射性標識の濃度は、消光効果を最小化するためにシンチレーションカウンタ及び100μLの溶出剤(1:6で希釈)を使用して測定する。
【0141】
治療処置
本発明の化合物を使用して、治療処置のためにNAALADaseを阻害することができる。NAALADase処置を受けいれ得る疾患には、疼痛性及び感覚性の糖尿病性神経障害、神経障害損傷及び前立腺癌、統合失調症、結腸直腸癌、炎症、筋萎縮性側索硬化症、糖尿病性神経障害を含む。本発明の化合物は鎮痛剤としても使用することができる。このような治療処置をモデリングするための案内は、Goodman & Gilman’s The Pharmacological Basis of Therapeutics(McGraw Hill、第10版、2001)、Pharmaceutical Preformulation and Formulation:A Practical Guide from Candidate Drug Selection to Commercial Dosage Form(CRC、2001)、及びHandbook of Pharmaceutical Excipients(AphA Publications、第5版、2005)に見ることができる。
【0142】
図では、比較のために幾つかの化合物を参照している。これらの比較用の化合物及びその構造を以下に示す。
【表2−1】

【表2−2】

【0143】
例示的放射性医薬品の組織分布
本明細書で調製した幾つかの化合物及び錯体の組織分布について、また場合によっては比較用の化合物と比較して評価した。図1、図3、図4及び図5は、このデータの幾つかをグラフで提示する。図6は、実施例6の化合物の99mTc錯体の組織生体内分布を示す放射線画像である。
【0144】
均等物
特定の実施形態を図示し、説明してきたが、添付の特許請求の範囲で定義されるようなより広義の態様における技術から逸脱することなく、当技術分野の通常の技術に従って、変更及び修正をできることを理解されたい。
【0145】
本開示は、本出願で述べた特定の実施形態によって制限されるものではない。当業者には明白なように、その精神及び範囲から逸脱することなく、多くの変更及び変形が可能である。本明細書で列挙されているものに加えて、開示の範囲内にある機能的に同等の方法及び組成物が、以上の説明から当業者には明白になる。このような修正及び変形は、特許請求の範囲に入るものとする。本開示は、特許請求の範囲、及びこのような請求項によって資格を与えられた均等物の全範囲によってのみ限定される。本開示は、特定の方法、試薬、化合物、組成物又は生物学的構造に限定されず、これが言うまでもなく変化できることを理解されたい。本明細書で使用される用語は、特定の実施形態を説明することのみを目的とし、限定するものではないことも理解されたい。
【0146】
また、マーカッシュグループに関して開示の特徴又は態様を述べる場合、その開示はマーカッシュグループの個々のメンバ又はメンバのサブグループに関しても述べられることが、当業者には認識される。
【0147】
当業者には理解されるように、いかなる意味でも、特に書面による説明の提供に関して、本明細書で開示された範囲はすべて、任意かつすべての可能な部分範囲及びその部分範囲の組合せも含む。列挙されたいかなる範囲も、同じ範囲を少なくとも均等の2分の1、3分の1、4分の1、5分の1、10分の1などに分割することを十分に説明し、それを可能にすると容易に認識することができる。非限定的な例として、本明細書で検討した各範囲は、下位3分の1、中位3分の1及び上位3分の1などに容易に分割することができる。も当業者に理解されるように、「最大」、「少なくとも」、「より大きい」、「未満」などの言語はすべて、列挙された数を含み、以上で検討したように後で部分範囲に分割することができる範囲を指す。最後に、当業者に理解されるように、ある範囲は個々の数をそれぞれ含み、範囲を示す最初と最後の数字を含む。
【0148】
本明細書で言及されたすべての出版物、特許出願、発行された特許、又は他の文書は、個々の各出版物、特許出願、発行された特許、又は他の文書が参照により全体が特に個別に組み込まれたかのように、参照により本明細書に組み込まれる。参照により組み込まれた文章に含まれる定義は、本開示の定義と矛盾する場合は除外される。
【0149】
他の実施形態は、添付の特許請求の範囲に記載されている。
【技術分野】
【0001】
(関連特許への相互参照)
本出願は、2008年12月5日出願の米国仮特許出願第61/120,226号及び2009年5月21日出願の第61/180,341号に対する優先権を主張し、これらは両方とも、いかなる意味においても参照により全体を本明細書に組み込むものとする。
【背景技術】
【0002】
本発明は、概して、放射性医薬品の分野に関し、トレーサ、撮像剤として核医学に、及び様々な疾患状態の治療のためにそれらを使用することに関する。腫瘍は、その悪性表現型を伴う独特のタンパク質を発現するか、又は正常な成分のタンパク質を正常な細胞より多数、過剰発現することがあることが知られている。腫瘍細胞の表面に独特のタンパク質が発現すると、腫瘍の表現型アイデンティティ及び生化学的組成及び活性を探索することによって疾患を診断し、特徴付ける機会が提供される。特定の癌細胞の表面タンパク質に選択的に結合する放射性分子は、非侵襲的状態で腫瘍を撮像し、治療するための魅力的な経路を提供する。特に、本発明の発明者らは、往々にして多くの癌細胞に過剰発現するPSMAタンパク質に対する放射性標識付き配位子が、癌細胞を非侵襲的に撮像するため及び選択的に標的にするための魅力的な経路を提供することを発見した。
【0003】
少なくとも100万人の男性が前立腺癌を患い、この病気は60歳から80歳の米国人男性のうち6人に1人に発症していると推定される。毎年、新たに30万人以上の前立腺癌の症例が診断されている。前立腺癌は米国の男性6人に1人に発症し、この病気の死亡率は肺ガンのみに次いで2位である。外科処置、放射線治療、薬物療法及び最小侵襲的治療に世界中で現在、推定20億ドルが費やされ、米国の支出は10億ドルである。現在、再発性、転移性、男性ホルモン非依存性前立腺癌に対して有効な治療法はない。放射線治療をもたらすことができるように、前立腺癌を迅速に視覚化し、明確に標的にすることができる新しい作用物質が必要とされている。
【0004】
グルタミン酸カルボキシペプチダーゼII(GCPII)としても周知のN−アセチル化アルファ連鎖酸性ジペプチダーゼ(NAALADase)は、神経系内でN−アセチルアスパラギン酸−グルタミン酸塩(NAAG)をN−アセチルアスパラギン酸とグルタミン酸塩に分割する神経ペプチダーゼであり、これについては、四面体中間体を介したNAALADaseによるNAAGの加水分解を示している以下を参照されたい。この酵素は、金属ペプチダーゼの助触媒クラスのタイプIIタンパクであり、活性部位に2つの亜鉛原子を含有する。
【化1】

【0005】
神経系におけるその特性決定とは関係なく、NAALADaseの一形態が、ヒトの前立腺癌内に高レベルで発現することが示され、前立腺特異性膜抗原(PSMA)と命名された。NAALADase/PSMA遺伝子は、複数のmRNA接合形態を生成することが周知であり、これまでの免疫組織化学的エビデンスに基づき、ヒトの脳及び前立腺は異なるイソ型の酵素を発現すると推定されている。
【0006】
葉酸ヒドロラーゼI(FOLH1)としても知られているヒト前立腺特異性膜抗原(PSMA)は、経膜的な750アミノ酸タイプII糖タンパクであり、これは主に正常なヒトの前立腺上皮に発現するが、転移性疾患を含む前立腺癌に上方制御される。PSMAは、ポリγ−グルタミン酸化葉酸に対する反応性を有する独特のエキソペプチダーゼであり、ポリγ−グルタミル末端を順番に除去することができる。PSMAは事実上すべての前立腺癌によって発現し、その発現は、あまり区別されない転移性癌とホルモン不応性癌でさらに増加するので、前立腺の撮像及び治療にとって非常に魅力的な標的である。PSMAと相互作用し、適切な放射性核種を有する配位子を開発すると、前立腺癌の検出、治療及び管理のために有望かつ新しい標的決定の選択肢を提供することができる。
【0007】
前立腺癌の転移及び再発を診断するために、PROSTASCINTスキャンとしても知られている抗PSMAモノクローナル抗体(mAb)7E11の放射免疫複合体の形態が現在使用されている。より最近では、PSMAの細胞外領域に結合するモノクローナル抗体が開発され、放射性標識が付けられて、動物のPSMA陽性の前立腺腫瘍モデル内に蓄積することが示されている。
【0008】
モノクローナル抗体は、腫瘍の検出及び治療にとって有望であるが、固形腫瘍内の浸透性が低いので、リンパ腫以外での臨床的成功は限られている。分子量が小さく、固体腫瘍内の浸透性を高めた模倣体は、1グラム当たりの高いパーセント及び高いパーセンテージの特異的結合を獲得するのに明確な利点を有する。
【0009】
撮像又は治療の目的で、放射性医薬品で癌細胞を選択的に標的とすることは大きな課題がある。Ga−67、Tc−99m、In−111、I−123及びI−131を含め、様々な放射性核種が放射線撮像に有用であることが知られている。医療用撮像に好ましい放射性同位元素はTc−99mである。何故なら、これは、半減期が短く(6時間)、比較的低コストで容易に入手可能であり、140keVのガンマ光子を放出するからである。さらに、水と空気安定性Tc(I)複合体[99mTc(OH2)3(CO)3]+錯体のようなTc−99m錯体は、1気圧の一酸化炭素(CO)下にて食塩水中で容易に調製することができる。
【発明の概要】
【課題を解決するための手段】
【0010】
一態様では、式Iの化合物、又はその薬学的に許容可能な塩若しくは溶媒和化合物を提供する。
【化2】

式中、Rは、H、アンモニウムイオン、アルキルアンモニウムイオン、アルカリ土類金属イオン、希土類金属イオン、又はアルキル基であり、Wは結合、−NHC(O)−、−CH(NH2)−、−NH−C(O)−NH−、−C(O)−NH−、−C(O)−NH−CH(COOH)−、−O−(CH2)n−O−(CH2)n−、−(CH2)nO(CH2)nO(CH2)n−、−CH(NHFmoc)−であり、Zは結合、−CO(O)−、−NH−、−NHC(O)−、−NH−C(O)−NH−、−NH−C(O)−(CH2)n−、−NH−C(O)−CH(NH2)−、−C(O)−NH−CH(COOH)−、又は−NH−C(O)−C6H4(CH2)n−NH−であり、NRaRbは下式のいずれかのキレート基であり、
【化3】

Rtは、H、C1−C8アルキル基、アンモニウムイオン、アルキルアンモニウムイオン、又はアルカリ又はアルカリ土類金属イオンであり、Rvはアルキルアルキル、置換アミノアルキル、アミノアルキル、又はアセトアミドアルキルであり、eは0から15の整数であり、fは0から15の整数であり、gは0から15の整数であり、nは0から10の整数であるが、ただしNRaRbは下式のいずれかであり、
【化4】

式中、Wが結合である場合、Zは結合、−C(O)−NH−又は−NHC(O)−以外であり、Zが結合である場合、Wは結合、−C(O)−NH−又は−NHC(O)−以外である。
【0011】
幾つかの実施形態では、Rvはメチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、tert−ブチル、アミノアルキル、ヒドロキシアルキル、又はカルボキシアルキルである。幾つかの実施形態では、Rvはメチルである。幾つかの実施形態では、Rtはそれぞれ独立に、H又はtert−ブチルである。幾つかの実施形態では、RtはHである。幾つかの実施形態では、eは0から4の整数であり、fは0から12の整数であり、gは0から6の整数である。幾つかの実施形態では、Wは−C(O)−NH−である。
【0012】
幾つかの実施形態では、式Iの化合物は、下式のいずれか、
【化5】

【化6】

【化7】

又はその薬学的に許容可能な塩若しくは溶媒和化合物であり、eは0から10の整数であり、fは0から12の整数であり、gは0から12の整数であり、nは0から10の整数である。
【0013】
幾つかの実施形態では、Zは−NH−C(O)−である。幾つかの実施形態では、Zは−C(O)−NH−CH(COOH)−である。幾つかの実施形態では、Zは−NH−C(O)−CH(NH2)−である。
【0014】
別の態様では、金属及び式Iの化合物を含む錯体を提供する。幾つかの実施形態では、金属はRe、Tc、Y、Lu、Ga、In、又はCuである。幾つかの実施形態では、金属は放射性核種である。幾つかの実施形態では、金属はテクネチウム−99m、レニウム−186又はレニウム−188である。
【0015】
幾つかの実施形態では、錯体中の金属はY、Lu、Ga、In、又はCuであり、式中、錯体は下式の基としてNRaRbを含む。
【化8】

【0016】
幾つかの実施形態では、錯体は、下式のいずれか、
【化9】

【化10】

【化11】

又はその薬学的に許容可能な塩及び溶媒和化合物、Re、Tc、Y、Lu、Ga、Cuであり、eは0から10の整数であり、fは0から12の整数であり、gは0から12の整数であり、nは0から10の整数である。
【0017】
別の態様では、式Iの化合物、その薬学的に許容可能な塩又は溶媒和化合物、及び薬学的に許容可能な補形剤を含む医薬組成物を提供する。
【0018】
別の態様では、患者内の部位を撮像する方法であって、診断上有効な量の式Iの化合物、その薬学的に許容可能な塩又は溶媒和化合物を患者に投与することと、患者の部位の像を入手することとを含む方法を提供する。
【0019】
別の態様では、脾臓組織、腎臓組織、又はPSMA発現腫瘍組織のような組織を撮像する方法であって、放射性金属及び下式のいずれかの基を含む化合物、
【化12】

又はその薬学的に許容可能な塩若しくは溶媒和化合物を含む錯体に組織を接触させることを含む方法を提供する。幾つかの実施形態では、組織はPSMA発現腫瘍組織である。他の実施形態では、PSMA発現腫瘍組織は前立腺癌である。
【図面の簡単な説明】
【0020】
【図1】LNCaP異種移植マウスにおける実施例3の化合物の99mTc錯体の組織分布を%DPO単位で示したグラフである。
【図2】PSMAタンパク質に関する式Iによる比較化合物及び例示的化合物の競合結合曲線を示す。
【図3】実施例8の化合物の99mTc錯体の組織生体内分布を%ID/gとして表したグラフである。
【図4】実施例7の化合物の99mTc錯体の組織生体内分布を%ID/gとして表したグラフである。
【図5】LNCaP異種移植マウスにおける99mTc錯体の組織生体内分布を比較し、%ID/gで示したグラフである。
【図6】様々な時間隔で、及び幾つかの実施形態に従ってLNCaP異種移植マウスにおける実施例6の化合物の99mTc錯体の組織生体内分布を示す画像である。
【発明を実施するための形態】
【0021】
放射性医薬品には2つのカテゴリがある。すなわち、(i)血流又は灌流によって厳密に測定され、糸球体濾過、食菌作用、肝細胞クリアランス及び骨吸収のような高容量の構造を標的とする生物学的分布があるもの、及び(ii)低容量の部位である特異的な酵素又は受容体の結合相互作用によって決定される分布があるものである。本発明の放射性医薬品は第2のカテゴリに属し、放射性核種の配位錯体を特定のタンパク質又は関連する受容体に選択的な生物学的に活性の分子に結合させることによって合成される。
【0022】
様々な生物活性分子(BAM)を担体として使用することができるが、小分子及び小ペプチドは抗体又はタンパク質より利点を有する。例えば、小分子及び小ペプチドは、拡散の向上、血液クリアランスの高速化、及び背景放射の低下を示す。これらの担体によって、高いスループットの方法で容易な合成が可能になる。また、小ペプチドは、安定性が向上し、標的酵素又は受容体に対する親和性が改善されたペプチド模倣体又は小分子類似体に容易に変換することができる。
【0023】
一態様では、癌細胞を治療し、撮像するための新規の放射性医薬品として、式I〜IVによるPSMA選択的テクネチウム及びレニウム錯体の合成及び使用方法を提供する。特に、化合物を使用して、前立腺の癌腫を標的にすることができる。
【化13】

【0024】
定義
便宜上、本明細書及び添付の特許請求の範囲内で使用する特定の用語をここに集めた。
【0025】
本明細書で使用する場合、「約」は当業者に理解され、それが使用する文脈に応じて多少変動する。それが使用されている文脈から当業者に明白でない用語の使用がある場合、「約」は特定の用語の±10%までを意味する。
【0026】
本明細書で例示的に記載される実施形態は、本明細書で個別に開示されていない任意の1つ又は複数の要素、1つ又は複数の制限がない状態で適切に実践することができる。したがって、例えば「含む」、「備える」、「含有する」などの用語は、広義に制限なしに読まれるものとする。また、本明細書で使用される用語及び表現は、制限するためではなく説明の意味で使用されており、そのような用語及び表現を使用する際には、図示及び記載された特徴又はその一部のいかなる均等物も排除するものではなく、特許請求の範囲にある技術の範囲内で様々な変化が可能であることを理解されたい。また、「基本的に、〜で構成される」という句は、特許請求の範囲にある技術の基本的及び新規の特徴に具体的に影響しない、個別に列挙された要素、及び追加の要素を含むものと理解されたい。「〜のみで構成される」という句は、指定されていないいかなる要素も除外する。
【0027】
要素を説明する文脈において(特に添付の特許請求の範囲の文脈において)「a」、「an」及び「the」という用語を使用し、同様のことに言及するのは、本明細書に別段の指定がない限り、又は文脈と明らかに矛盾していない限り、単数及び複数の両方を含むものと解釈すべきである。
【0028】
本明細書で使用する「親油基」及び「親油性部分」という用語は、極性又は水性環境に対して非極性又は非水性環境により大きい親和性を有する基、部分又は置換基を指す。例えばMerriam Websterのオンライン辞書は、「親油性」を「(脂肪としての)脂質に対して親和性を有する」と定義している。例示的な親油性部分は、脂肪族炭化水素基、例えばアルキル基、芳香族炭化水素基、及び長鎖アシル基を含み、これはすべて、成分炭素の数が増加するにつれて親油性が増大する。一般的に、特定の化合物に親油性部分を添加すると、標準的なオクタノール/水分配係数決定プロトコルにおいて、オクタノールに対する化合物の親和性が増大し、このプロトコルを使用して、化合物の相対的な疎水性(親油性)及び親水性を測定することができる。
【0029】
「ルイス塩基」及び「ルイス塩基の」という用語は、特定の反応状態で一対の電子を供与することができる化学的部分を指す。ルイス塩基を、ルイス塩基及び金属イオンのアイデンティティに応じて、特定の錯体内で1つの電子を供与するものと特徴付けることが可能なこともあるが、大部分の趣旨では、ルイス塩基を2つの電子の供与体と理解するのが最善である。ルイス塩基部分の例は、アルコール、チオール及びアミンのような無電荷化合物、及びアルコキシド、チオレート、カルボニオン、及び様々な他の有機陰イオンのような荷電部分を含む。特定の例では、ルイス塩基は酸化物(O2−)のような1つの原子で構成することができる。それほど一般的ではない特定の状況では、ルイス塩基又は配位子は正の荷電状態であってもよい。ルイス塩基は、金属イオンと配位結合されると、配位子と呼ばれることが多い。
【0030】
「配位子」という用語は、何らかの方法で別の種と相互作用する種を指す。一例では、配位子は、ルイス酸と配位結合を形成することができるルイス塩基とすることができる。他の例では、配位子は、金属イオンと配位結合を形成する種であり、往々にして有機体である。配位子は、配位結合して金属イオンになると、当業者に周知の様々な結合モードを有することができ、それは例えば末端(すなわち、1つの金属イオンに結合する)及び架橋(すなわち、ルイス塩基の1つの原子が複数の金属イオンと結合する)を含む。
【0031】
「キレート剤」という用語は、当該技術分野において理解されるように、金属イオンへの供与に使用可能な2つ以上の非共有電子対を有する分子を指し、往々にして有機分子であり、往々にしてルイス塩基である。金属イオンは通常、2つ以上の電子対によってキレート剤に配位結合する。「二座キレート剤」、「三座キレート剤」及び「四座キレート剤」という用語は、キレート剤によって配位結合した金属イオンに同時に供与するためにすぐ使用可能なそれぞれ2つ、3つ、及び4つの電子対を有するキレート剤を指す。通常、キレート剤の電子対は、1つの金属イオンとの配位結合を形成するが、特定の例では、キレート剤は、複数の金属イオンと配位結合を形成することができ、様々な結合モードが可能である。
【0032】
「配位結合」という用語は、複数の電子対がある1つの供与体が1つの金属イオンと配位結合する(「配位結合される」)相互作用である。
【0033】
「錯体」という用語は、それぞれが別々に存在することができる1つ又は複数の電子が少ない分子とともに、これも別々に存在することができる1つ又は複数の電子が多い、及び電子が少ない分子又は原子が結合することによって形成された化合物を指す。
【0034】
Fmocは、化学基のフルオレニルメチルオキシカルボニルの略である。
【0035】
本明細書で使用する「治療的に有効な量」という句は、任意の治療に適用可能な妥当なベネフィット/リスクの比率で、動物の細胞の少なくとも部分集団に何らかの所望の治療効果を生じるために有効である、化合物、材料、又は化合物を含む組成物の量を意味する。
【0036】
本明細書で使用する「治療する」又は「治療」という用語は、診断、予防、治療及び治癒も含むものとする。この治療を受ける患者は、これを必要としている任意の動物であり、霊長類、特に人間、及びウマ、ウシ、ブタ及びヒツジのような他の哺乳動物、及び一般に家禽及び愛玩動物を含む。
【0037】
「薬学的に許容可能」という句は、本明細書では、健全な薬学的判断の範囲内で、妥当なベネフィット/リスクの比率に対応した過度の毒性、刺激、アレルギー反応、又は他の問題又は合併症がない状態で、人間及び動物の組織との接触状態で使用するのに適切な化合物、材料、組成物及び/又は剤形を指すために使用される。
【0038】
本明細書で使用する「薬学的に許容可能な担体」という句は、対象化合物を1つの器官又は体の一部から別の器官又は体の一部へと運ぶ又は輸送することに係わる液体又は固体充填剤、希釈剤、補形剤、又は溶媒封入材料のような薬学的に許容可能な材料、組成物又は賦形剤を意味する。各担体は、組成物の他の成分と適合性であり、患者にとって有害ではないという意味で、「許容可能」でなければならない。薬学的に許容可能な担体として働くことができる材料の幾つかの例は、(1)乳糖、ブドウ糖及び蔗糖のような糖類、(2)コーンスターチ及びジャガイモデンプンのようなデンプン、(3)カルボキシルメチルセルロースナトリウム、エチルセルロース及び酢酸セルロースのようなセルロース及びその誘導体、(4)粉末状トラガカントゴム、(5)麦芽、(6)ゼラチン、(7)滑石、(8)カカオ脂及び座剤ワックスのような補形剤、(9)落花生油、綿実油、ヒマワリ油、ごま油、オリーブ油、トウモロコシ油及び大豆油のような油、(10)プロピレングリコールのようなグリコール、(11)グリセリン、ソルビトール、マンニトール及びポリエチレングリコールのようなポリオール、(12)オレイン酸エチル及びラウリン酸エチルのようなエステル、(13)寒天、(14)水酸化マグネシウム及び水酸化アルミニウムのような緩衝剤、(15)アルギン酸、(16)発熱性物質を含まない水、(17)等張食塩水、(18)リンゲル液、(19)エチルアルコール、(20)pH緩衝液、(21)ポリエステル、ポリカーボネート及び/又はポリ無水物、及び(22)薬学的な処方に使用されるその他の無毒性で適合性の物質を含む。
【0039】
本明細書で使用する「非経口投与」及び「非経口投与した」という句は、経腸及び局所投与以外で通常は注射による投与モードを意味し、静脈内、筋内、動脈内、髄腔内、嚢内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、被膜下、蜘蛛膜下、脊椎内及び胸骨内注射及び注入などが挙げられるが、これらに限定されない。
【0040】
本明細書で使用する「全身投与」、「全身投与する」、「末梢投与」及び「末梢投与する」という句は、患者の器官系に入り、したがって代謝及び他の同様のプロセスの支配下にあるように、中枢神経系への直接投与以外に、化合物、薬剤又は他の材料を投与することを意味し、例えば皮下投与である。
【0041】
「アミノ酸」という用語は、アミノ酸類似体及び誘導体など、アミノ官能基及び酸官能基の両方を含む天然であれ、合成であれ、すべての化合物を指す。
【0042】
「ヘテロ原子」という用語は、炭素又は水素以外の任意の元素の原子を指す。例示的なヘテロ原子はホウ素、窒素、酸素、リン、硫黄及びセレンを含む。
【0043】
通常、「置換」は、以下で定義されるように(例えばアルキル基)、自身に含有される水素原子への1つ又は複数の結合が非水素又は非炭素原子への結合に取って代わられるアルキル又はアルケニル基を指す。置換基は、炭素又は水素原子への1つ又は複数の結合が、ヘテロ原子への二重結合又は三重結合を含む1つ又は複数の結合によって取って代わられる基も含む。したがって、置換基は他に指定されていない限り、1つ又は複数の置換基で置換される。幾つかの実施形態では、置換基は1、2、3、4、5又は6個の置換基で置換される。置換基の例としては、ハロゲン(すなわち、F、Cl、Br及びI);水酸基;アルコキシ、アルケノキシ、アルキノキシ、アリールオキシ、アラルキルオキシ、ヘテロシクリルオキシ、及びヘテロシクリルアルコキシ基;カルボニル(オキソ);カルボキシル;エステル;ウレタン;オキシム;ヒドロキシルアミン;アルコキシアミン;アラルコキシアミン;チオール;硫化物;スルホキシド;スルホン;スルホニル;スルホンアミド;アミン;N酸化物;ヒドラジン;ヒドラジド;ヒドラゾン;アジド;アミド;尿素;アミジン;グアニジン;エナミン;イミド;イソシアネート;イソチオシアネート;シアネート;チオシアネート;イミン;ニトロ基;ニトリル(すなわち、CN)などが挙げられる。
【0044】
アルキル基は、1〜12個の炭素原子、代表的には1〜10個の炭素、幾つかの実施形態では1〜8個、1〜6個、又は1〜4個の炭素原子を有する直鎖状及び分岐状のアルキル基を含む。直鎖状のアルキル基の例としては、メチル、エチル、n−プロピル、n−ブチル、n−ペンチル、n−ヘキシル、n−ヘプチル、及びn−オクチル基のような基が挙げられる。分岐状のアルキル基の例としては、イソプロピル、イソブチル、sec−ブチル、tert−ブチル、ネオペンチル、イソペンチル、及び2,2−ジメチルプロピル基が挙げられるが、これらに限定されない。アルキル基は置換していても又は置換していなくてもよい。炭素の数が他で指定されていない限り、「低級アルキル」とは以上で定義した通りであるが、その主鎖構造に1〜約10個の炭素、或いは1〜約6個の炭素原子を有するアルキル基を指す。同様に、「低級アルケニル」及び「低級アルキニル」は同様の鎖長を有する。
【0045】
「アルキルカルボニル」という用語は、C1−C8アルキル基の1つ又は複数のメチレンがC(O)基と置換した−(C1−C8)アルキル−C(O)基を指す。代表的な例としては、アセチル、プロピオニル、及びCH3(CH2)2C(O)−基が挙げられるが、これらに限定されない。
【0046】
「環式アルキル」又は「シクロアルキル」という用語は、3〜14個の炭素原子があり、環ヘテロ原子がなく、縮合及び橋かけ環構造を含む1つの環又は複数の環を有する飽和状又は部分飽和状の非芳香族環式アルキル基を指す。シクロアルキル基は置換していても又は置換していなくてもよい。シクロアルキル又は環式アルキル基は、環に3〜14個の炭素原子、又は幾つかの実施形態では3〜12個、3〜10個、3〜8個、又は3〜4、5、6又は7個の炭素原子を有する1環、2環、又は3環アルキル基を含む。例示的な1環シクロアルキル基としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチル、及びシクロオクチル基が挙げられるが、これらに限定されない。2環系及び3環系としては、これらに限定されないが、ビシクロ[2.1.1]ヘキサン、アダマンタイル、デカリニルなどの橋かけシクロアルキル基及び縮合環の両方が挙げられる。
【0047】
アルケニル基は、以上で定義したような直鎖状及び分岐状及びシクロアルキル基を含むが、2つの炭素原子間に少なくとも1つの二重結合が存在する。したがって、アルケニル基は、幾つかの実施形態では2〜約12個の炭素原子、他の実施形態では2〜10個の炭素原子、及び他の実施形態では2〜8個の炭素原子を有する。その例としては、ビニル、アリール、−CH=CH(CH3)、−CH=C(CH3)2、−C(CH3)=CH2、−C(CH3)=CH(CH3)、−C(CH2CH3)=CH2、シクロヘキセニル、シクロペンテニル、シクロヘキサジエニル、ブタジエニル、ペンタジエニル、及びヘキサジエニルが挙げられるが、これらに限定されない。アルケニル基は置換していても又は置換していなくてもよい。代表的な置換アルケニル基としては、一置換又は複数回置換することができ、以上で列挙したような置換基で一置換、二置換又は三置換されるが、これらに限定されない。
【0048】
アルキニル基は、直鎖状及び分岐鎖状及び以上で定義したようなシクロアルキル基を含むが、ただし2つの炭素原子間に少なくとも1つの三重結合が存在する。(C2−C8)アルキニル基の例としては、アセチレン、プロピン、1−ブチン、2−ブチン、1−ペンチン、2−ペンチン、1−ヘキシン、2−ヘキシン、3−ヘキシン、1−ヘプチン、2−ヘプチン、3−ヘプチン、1−オクチン、2−オクチン、3−オクチン及び4−オクチンが挙げられるが、これらに限定されない。アルキニル基は置換していなくてもよく、又は任意選択で以下で述べるような1つ又は複数の置換基で置換していてもよい。
【0049】
アリール基は、ヘテロ原子を含有しない環状芳香族炭化水素である。アリール基は1環、2環及び多環式環系を含む。したがってアリール基としては、フェニル、アズレニル、ヘプタレニル、ビフェニレニル、インダセニル、フルオレニル、フェナントレニル、トリフェニレニル、ピレニル、ナフタセニル、クリセニル、ビフェニル、アントラセニル、インデニル、インダニル、ペンタレニル、及びナフチル基が挙げられるが、これらに限定されない。幾つかの実施形態では、アリール基は、基の環部分に6から14個の炭素、及び他の実施形態では6〜12個、さらには6〜10個の炭素原子を含有する。アリール基は置換及び非置換アリール基の両方を含む。置換アリール基は一置換又は複数回置換することができる。例えば、一置換アリール基としては、以上で列挙したような置換基で置換することができる2−、3−、4−、5−又は6−置換フェニル又はナフチル基が挙げられるが、これらに限定されない。
【0050】
アラルキル基は、アルキル基の水素又は炭素結合が以上で定義したようなアリール基との結合で置換される、以上で定義したようなアルキル基である。幾つかの実施形態では、アラルキル基は7〜20個の炭素原子、7〜14個の炭素原子又は7〜10個の炭素原子を含む。
【0051】
複素環基は、3個以上の環員を含有し、そのうち1個以上がN、O及びS(これに限定されない)のようなヘテロ原子である非芳香族環化合物を含むことを指す。幾つかの実施形態では、ヘテロシクリル基は3〜20個の環員を含み、他のこのような基は3〜6個、3〜10個、3〜12個、又は3〜15個の環員を有する。ヘテロシクリル基は、例えばイミダゾリル、イミダゾリニル及びイミダゾリジニル基のような不飽和、部分飽和、及び飽和環式構造を包含する。ヘテロシクリル基は置換していても又は置換していなくてもよい。ヘテロシクリル基としては、アジリジニル、アゼチジニル、ピロリジニル、イミダゾリジニル、ピラゾリジニル、チアゾリジニル、テトラヒドロチオフェニル、テトラヒドロフラニル、ジオキソリル、フラニル、チオフェニル、ピロリル、ピロリニル、イミダゾリル、イミダゾリニル、ピラゾリル、ピラゾリニル、トリアゾリル、テトラゾリル、オキサゾリル、イソオキサゾリル、チアゾリル、チアゾリニル、イソチアゾリル、チアジアゾリル、オキサジアゾリル、ピペリジル、ピペラジニル、モルホリニル、チオモルホリニル、テトラヒドロピラニル、テトラヒドロチオピラニル、オキサチアン、ジオキシル、ジチアニル、ピラニル、ピリジル、ピリミジニル、ピリダジニル、ピラジニル、トリアジニル、ジヒドロピリジル、ジヒドロジチイニル、ジヒドロジチオニル、ホモピペラジニル、キヌクリジル、インドリル、インドリニル、イソインドリル、アザインドリル(ピロロピリジル)、インダゾリル、インドリジニル、ベンゾトリアゾリル、ベンゾイミダゾリル、ベンゾフラニル、ベンゾチオフェニル、ベンゾチアゾリル、ベンゾオキサジアゾリル、ベンゾオキサジニル、ベンゾジチイニル、ベンゾオキサチイニル、ベンゾチアジニル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、ベンゾ[1,3]ジオキソリル、ピラゾロピリジル、イミダゾピリジル(アザベンゾイミダゾリル)、トリアゾロピリジル、イソチアゾロピリジル、プリニル、キサンチニル、アデニニル、グアニニル、キノリニル、イソキノリニル、キノリジニル、キノキサリニル、キナゾリニル、シンノリニル、フタラジニル、ナフチリジニル、プテリジニル、チアナフタレニル、ジヒドロベンゾチアジニル、ジヒドロベンゾフラニル、ジヒドロインドリル、ジヒドロベンゾジオキシニル、テトラヒドロインドリル、テトラヒドロインダゾリル、テトラヒドロベンゾイミダゾリル、テトラヒドロベンゾトリアゾリル、テトラヒドロピロロピリジル、テトラヒドロピラゾロピリジル、テトラヒドロイミダゾピリジル、テトラヒドロトリアゾロピリジル、及びテトラヒドロキノリニル基が挙げられるが、これらに限定されない。ヘテロシクリル基は置換していても又は置換していなくてもよい。代表的な置換ヘテロシクリル基としては、1置換又は複数回置換することができ、以上で列挙したような様々な置換基で2、3、4、5又は6置換される、又は置換されないピリジル又はモルホリニル基が挙げられるが、これらに限定されない。
【0052】
ヘテロアリール基は、5個以上の環員を含有し、そのうち1個以上が、これらに限定されないが、N、O、及びSのようなヘテロ原子である、芳香族環式化合物である。ヘテロアリール基は置換していても又は置換していなくてもよい。ヘテロアリール基としては、ピロリル、ピラゾリル、トリアゾリル、テトラゾリル、オキサゾリル、イソオキサゾリル、チアゾリル、ピリジル、ピリダジニル、ピリミジニル、ピラジニル、チオフェニル、ベンゾチオフェニル、フラニル、ベンゾフラニル、インドリル、アザインドリル(ピロロピリジル)、インダゾリル、ベンゾイミダゾリル、イミダゾピリジル(アザベンゾイミダゾリル)、ピラゾロピリジル、トリアゾロピリジル、ベンゾトリアゾリル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、イミダゾピリジル、イソチアゾロピリジル、チアナフタレニル、プリニル、キサンチニル、アデニニル、グアニニル、キノリニル、イソキノリニル、テトラヒドロキノリニル、キノキサリニル、及びキナゾリニル基のような基が挙げられるが、これらに限定されない。
【0053】
アルコキシ基は、水素原子との結合が以上で定義したような置換又は非置換アルキル基の炭素原子との結合に置き換えられた水酸基(−OH)である。直鎖状のアルコキシ基の例としては、メトキシ、エトキシ、プロポキシ、ブトキシ、ペントキシ、ヘキソキシなどが挙げられるが、これらに限定されない。分岐状のアルコキシ基の例としては、イソプロポキシ、sec−ブトキシ、tert−ブトキシ、イソペントキシ、イソヘキソキシなどが挙げられるが、これらに限定されない。シクロアルコキシ基の例としては、シクロプロピルオキシ、シクロブチルオキシ、シクロペンチルオキシ、シクロヘキシルオキシなどが挙げられるが、これらに限定されない。アルコキシ基は置換していても又は置換していなくてもよい。代表的な置換アルコキシ基は、以上に列挙したような置換基で1回又は複数回置換することができる。
【0054】
「ポリシクリル」又は「多環基」という用語は、2つ以上の炭素が2つの隣接する環に共通である2つ以上の環(例えばシクロアルキル、シクロアルケニル、シクロアルキニル、アリール及び/又はヘテロシクリル)を指し、例えば環は「縮合環」である。隣接していない原子を通して結合された環は「橋かけ」環と呼ばれる。多環の環はそれぞれ、上述したような置換基、例えばハロゲン、アルキル、アラルキル、アルケニル、アルキニル、シクロアルキル、水酸基、アミノ、モノアルキルアミノ、ジアルキルアミノ、ニトロ、スルフヒドリル、イミノ、アミド、ホスホン酸塩、ホスフィン酸塩、カルボニル、カルボキシル、シリル、エーテル、アルキルチオ、スルホニル、ケトン、アルデヒド、エステル、ヘテロシクリル、芳香族又はヘテロ芳香族部分、−CF3、−CNなどで置換することができる。
【0055】
「炭素環」という用語は、環の各原子が炭素である芳香族又は非芳香族環を指す。
【0056】
「ニトロ」という用語は−NO2を指し、「ハロゲン」という用語は当技術分野で認識され、−F、−Cl、−Br又は−Iを指し、「スルフヒドリル」という用語は当技術分野で認識され、−SHを指し、「ヒドロキシ」という用語は−OHを意味し、「スルホニル」という用語は当技術分野で認識され、−SO2−を指す。「ハライド」は、ハロゲンの対応する陰イオンを示し、「擬ハライド」は、Cotton及びWilkinsonによる「Advanced Inorganic Chemistry」の560ページで記載された定義を有する。
【0057】
「アミン又はアミノ」という用語は、−NRcRd基を指し、Rc及びRdはそれぞれ独立に、水素、(C1−C8)アルキル、アリール、ヘテロアリール及びヘテロシクロアルキル基を指す。Rc及びRdが同じ窒素原子に結合している場合、これは、窒素原子と組み合わされて5−、6−又は7−員環を形成することができる。例えば、−NRcRdは、1−ピロリジニル、ピリジニル又は4−モルホリニル環を含むものとする。
【0058】
「アミド」という用語は、当技術分野でアミノ置換カルボニルと認識され、一般式C(O)NRcRd基によって表すことができる部分を含み、式中、Rc及びRdは、以上で定義した通りである。幾つかの実施形態によれば、アミドは、不安定になり得るイミドを含まない。
【0059】
「カルボキシ」及び「カルボン酸塩」という用語は、以下のいずれかの一般式で表すことができるような部分を含む。
【化14】

式中、Eは結合であるか、又はO又はSを表し、Rf及びRf’は、個々にH、アルキル、アルケニル、アリール又は薬学的に許容可能な塩である。EがOでありRfが以上で定義された通りである場合、この部分は本明細書ではカルボキシル基と呼び、特にRfが水素である場合、式は「カルボン酸」を表す。一般的に、明示された酸素が硫黄と置換された場合、式は「チオカルボニル」基を表す。
【0060】
「アルコキシル」又は「アルコキシ」という用語は、以上で定義したように、自身に結合した酸素ラジカルを有するアルキル基を指す。代表的なアルコキシル基はメトキシ、エトキシ、プロポキシ、ブトキシ、tert−ブトキシなどを含む。「エーテル」は酸素によって共有結合された2個の炭化水素である。「エーテル」は、複数のエーテル基又は結合を所与の基内で表すことができるポリエーテルも含む。「エーテル」は、環状エーテル及びクラウンエーテルも含み、エーテル結合は環式基内にある。
【0061】
「スルホン酸塩」という用語は、一般式−S(O)2ORgで表すことができる部分を指し、Rgは、電子対、水素、アルキル、シクロアルキル又はアリールである。「硫酸塩」という用語は、一般式−OS(O)2ORgで表すことができる部分を含み、式中、Rgは、以上で定義した通りである。「スルホンアミド」という用語は、一般式−N(Rf)S(O)2ORf’で表すことができる部分を含み、式中、Rf及びRf’は、以上で定義した通りである。「スルファミド」という用語は、一般式−S(O)2NReRfで表すことができる部分を指し、Re及びRfは、水素、(C1−C8)アルキル又はアリールである。「スルホニル」という用語は、一般式−S(O)2Rhで表すことができる部分を指し、Rhは、水素、アルキル、アルケニル、アルキニル、シクロアルキル、ヘテロシクリル、アリール又はヘテロアリールのうちの1つである。
【0062】
各表現、例えばアルキル、m、nなどの定義は、任意の構造で2回以上出現した場合、同じ構造の他の場所におけるその定義とは無関係であるものとする。
【0063】
トリフリル、トシル、メシル、及びノナフリルという用語は、それぞれトリフルオロメタンスルホニル、p−トルエンスルホニル、メタンスルホニル、及びノナフルオロブタンスルホニル基を指す。トリフレート、トシレート、メシレート、及びノナフレートという用語は当技術分野で認識され、それぞれトリフルオロメタンスルホネートエステル、p−トルエンスルホネートエステル、メタンスルホネートエステル、及びノナフルオロブタンスルホネートエステル官能基及び該基を含有する分子を指す。略語Me、Et、Ph、Tf、Nf、Ts及びMsは、それぞれメチル、エチル、フェニル、トリフルオロメタンスルホニル、ノナフルオロブタンスルホニル、p−トルエンスルホニル及びメタンスルホニルを表す。当業者の有機化学者が使用する略語のさらに包括的なリストは、Journal of Organic Chemistryの各巻の第1号にあり、このリストは通常、Standard List of Abbreviationsと題した表で表される。
【0064】
組成物に含有される特定の化合物は、特定の幾何学的又は立体異性形態で存在することができる。また、化合物は光学活性でもよい。また、化合物は、シス及びトランス異性体、R−及びS−鏡像体、ジアステレオ異性体、(D)−異性体、(L)−異性体、そのラセミ混合物、及び他のその混合物も含むことができる。追加の非対称炭素原子がアリール基のような置換基内に存在することができる。例えば化合物の特定の鏡像体が望ましい場合、これは不斉合成によって、又はキラル助剤によって調製することができ、その結果のジアステレオ異性混合物が分離され、助剤基が分割されて純粋な所望の鏡像体を提供する。あるいは、分子がアミノのような塩基性官能基、又はカルボキシルのような酸性官能基を含有する場合、ジアステレオ異性塩が適切な光学活性酸又は塩基で形成され、その後に分別結晶化又は当技術分野で周知のクロマトグラフィ法によってこのように形成されたジアステレオ異性体が分割され、それに続いて純粋な鏡像体が回収される。
【0065】
本明細書で使用する「保護基」という句は、潜在的に反応性の官能基を望ましくない化学的変換から保護する一時的置換基を意味する。このような保護基の例としては、カルボキシル酸のエステル、アルコールのシリルエーテル、及びそれぞれアルデヒド及びケトンのアセタール及びケタールが挙げられる。保護基の化学的性質の分野はレビューされている(T.W.Greene、P.G.M.Wuts、Protective Groups in Organic Synthesis、第3版、Wiley、ニューヨーク、1999)。
【0066】
他に別段の指定がない限り、「立体異性体」とは、化合物の1つの立体異性体で、その化合物に他の立体異性体が実質的にないことを意味する。したがって、立体異性体的に純粋で1つのキラル中心を有する化合物は、化合物の反対の鏡像体を実質的に含まない。立体異性体的に純粋で2つのキラル中心を有する化合物は、化合物の他のジアステレオ異性体を実質的に含まない。立体異性体的に純粋な典型的化合物は、化合物の約80重量%より多い1つの立体異性体、及び化合物の約20重量%未満の他の立体異性体を含み、例えば化合物の約90重量%より多い1つの立体異性体及び化合物の約10重量%未満の他の立体異性体、又は化合物の約95重量%より多い1つの立体異性体及び化合物の約5重量%未満の他の立体異性体、又は化合物の約97重量%より多い1つの立体異性体及び化合物の約3重量%未満の他の立体異性体を含む。
【0067】
図示の構造とその構造に与えられた名前との間に矛盾がある場合は、図示の構造が支配する。また、構造又は構造の一部の立体化学を、例えば太線又は点線で示していない場合、その構造又は構造の一部はその全立体異性体を包含するものと解釈されたい。
【0068】
キレート化合物及びその合成
一態様では、式Iの化合物、その薬学的に許容可能な塩及び溶媒和化合物を提供する。
【化15】

式中、RはH、アンモニウムイオン、アルキルアンモニウムイオン、アルカリ土類金属イオン、希土類金属イオン、又はアルキル基であり、Wは結合、−NHC(O)−、−CH(NH2)−、−NH−C(O)−NH−、−C(O)−NH−、−C(O)−NH−CH(COOH)−、−O−(CH2)n−O−(CH2)n−、−(CH2)nO(CH2)nO(CH2)n−、−CH(NHFmoc)−であり、Zは結合、−CO(O)−、−NH−、−NHC(O)−、−NH−C(O)−NH−、−NH−C(O)−(CH2)n−、−NH−C(O)−CH(NH2)−、−C(O)−NH−CH(COOH)−、又は−NH−C(O)−C6H4−(CH2)n−NH−であり、NRaRbは存在しないか、又は下式のいずれかのキレート基であり、
【化16】

Rtは、H、C1−C8アルキル基、アンモニウムイオン、アルキルアンモニウムイオン、又はアルカリ又はアルカリ土類金属イオンであり、Rvはアルキルであり、eは0から15の整数であり、fは0から15の整数であり、gは0から15の整数であり、nは0から10の整数であるが、ただし、NRaRbが下式のいずれかであって、
【化17】

Wが結合である場合、Zは結合、−C(O)−NH−又は−NHC(O)−以外であり、Zが結合である場合、Wは結合、−C(O)−NH−又は−NHC(O)−以外である。幾つかの実施形態では、Rはアルキルである。他の実施形態では、Rvは、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、又はtert−ブチルである。さらに他の実施形態では、Rvはメチルである。さらに他の実施形態では、Rtはそれぞれ独立に、H又はtert−ブチルである。さらに他の実施形態では、RtはHである。
【0069】
式Iによる例示的化合物としては、下式のいずれか、
【化18】

【化19】

【化20】

又はその薬学的に許容可能な塩及び溶媒和化合物が挙げられるが、これらに限定されず、式中、eは0から10の整数であり、fは0から12の整数であり、gは0から12の整数であり、nは0から10の整数である。
【0070】
様々な実施形態によれば、化合物のNRaRb基は、さらに金属とキレート化することができる。幾つかの実施形態では、金属は放射性核種である。例えば金属は、テクネチウム−99m、又はレニウム−186m/188mであってもよい。[NEt4]2[MBr3(CO)3]のような錯体(MはTc又はReである)は、アルコール系溶媒中で式Iの化合物と反応させることができる。このような反応は、以下でさらに述べるように、式I−Mのキレート化錯体を提供する。
【化21】

【0071】
式I−Mによる例示的化合物としては、下式のいずれか1つ、
【化22】

【化23】

【化24】

又はその薬学的に許容可能な塩及び溶媒和化合物が挙げられるが、これらに限定されず、式中、MはRe又はTcであり、eは0から10の整数であり、fは0から12の整数であり、gは0から12の整数であり、nは0から10の整数である。
【0072】
幾つかの実施形態では、化合物はその薬学的に許容可能な塩及び溶媒和化合物ばかりでなく、このような化合物の立体異性体、互変異性体、及びプロドラッグも含む。
【0073】
上述したように、式Iの化合物の錯体は、放射線撮像剤として、及び急速に増殖する細胞を処置するための治療薬として使用するのに適切な1つ又は複数の放射性核種を含むことができる。したがって1つの実施形態では、金属及び式Iの化合物、その塩、溶媒和化合物、立体異性体、又は互変異性体、及び薬学的に許容可能な担体を含む錯体を含む医薬組成物を提供する。
【0074】
一般的に、式Iの化合物の金属錯体又はその医薬組成物は、経口的に、又は腸管外経路を介して、通常は注射によって投与することができる。非経口的経路は、静脈内、筋内、動脈内、髄腔内、嚢内、眼窩内、心臓内、皮内、腹腔内、経気管、皮下、表皮下、関節内、被膜下、蜘蛛膜下、脊椎内及び胸骨内注射及び注入を含むが、これらに限定されない。幾つかの実施形態では、化合物、又はその薬学的組成物が経口投与される。このような組成物は、錠剤、丸剤、カプセル、半固体、粉末、溶液、懸濁液、エリキシル、エアロゾル、又は任意の他の適切な組成物の形態をとることができる。
【0075】
別の態様によれば、in vivo撮像に適切な薬学的組成物を提供する。このような適切な薬学的撮像組成物は、薬学的に許容可能な放射線医学媒体とともに、元素として放射性核種を、すなわち、放射性ヨウ素、又は式Iの化合物の放射性金属キレート錯体を撮像に十分な量だけ有する撮像剤を含有する。放射線医学賦形剤は、ヒト血清アルブミンや、例えばトリス(ヒドロメチル)アミノメタン(及びその塩)、リン酸塩、クエン酸塩、重炭酸塩などの緩衝水溶液や、滅菌水や、生理食塩水や、塩化物及び/又は重炭酸塩、又はカルシウム、カリウム、ナトリウム及びマグネシウムのような正常な血漿陽イオンを含有する平衡イオン溶液のように、注入又は吸入に適切でなければならない。
【0076】
放射線医学賦形剤中の撮像剤の濃度は、満足できる撮像を提供するのに十分でなければならない。例えば、水溶液を使用する場合、線量は約1.0〜50ミリキュリーである。撮像剤は、約1時間〜24時間、患者の体内に留まるように投与しなければならないが、これより長い期間及び短い期間の両方が許容可能である。したがって、1〜10mLの水溶液を含有する都合の良いアンプルを調製することとしてもよい。
【0077】
撮像は通常の方法で、例えば適切な撮像を提供するのに十分な量の撮像組成物を注入し、次にガンマカメラのような適切な機械で走査することによって実行することができる。特定の実施形態では、患者内の部位を撮像する方法は、放射性核種で錯化した化合物を診断上有効な量、患者に投与するステップと、上記患者の部位を放射線に曝露するステップと、上記患者の上記部位の像を入手するステップとを含む。特定の実施形態では、撮像される部位は頭部又は胸郭である。他の実施形態では、式Iの化合物及び錯体は、PSMAタンパク質を標的とする。
【0078】
したがって幾つかの実施形態では、脾臓組織、腎臓組織、又はPSMA発現腫瘍組織のような組織を撮像する方法であって、放射性金属及び下式のいずれかの基を含む化合物、又はその薬学的に許容可能な塩又は溶媒和化合物を含む化合物を含む錯体に組織を接触させることを含む方法を提供する。
【化25】

幾つかの実施形態では、組織はPSMA発現腫瘍組織である。このような化合物の特異性を図5に示す。
【0079】
このように概略的に述べた本発明は、本発明の例示として提供され、それを限定するものではない以下の実施例を参照することにより、さらに容易に理解される。
【実施例】
【0080】
基本的な合成方法
化合物を金属と錯化する基本手順。本明細書で例示するように、非放射性同位元素の入手可能性及び作業者の安全性を考慮し、前記金属にはレニウムを使用する。しかし、理解されるように、テクネチウム類似体を使用して同様の合成手順に従ってもよい。何故なら、テクネチウム及びレニウムはランタニド収縮により同様の反応化学現象を有し、同様のサイズだからである。したがって、Reを特に示すことができる場合、Tc錯体も同様に含むことが理解される。
【0081】
レニウム錯体を形成する基本実験条件
式Iの化合物のレニウム/テクネチウム錯体は、容易に入手可能な先駆物質[NEt4]2[Re(CO)3Br3]と化合物との反応から、都合よく分離される。SAAC末端によって提供される供与体のセットは、{M(CO)3}+1の核の効果的キレーターとして詳細に文書化されており、金属部位の周囲の必要な面構成に適応するように設計されていて、錯体の調製も例外ではない。
【0082】
{Re(I)(CO)3}+構造は、99mTc−トリカルボニルの核のそれと同様の反応化学現象を辿る。開始材料として[NEt4]2[ReBr3(CO)3]を使用すると、fac−{Re(CO)3(L)3}の核が容易に形成される。[NEt4]2[ReBr3(CO)3]は、[ReBr(CO)5]から容易に誘導される。Re(I)錯体の合成は、10mlのメタノール中で[NEt4]2[ReBr3(CO)3]を適切なキレート化配位子と1:1.2の比率で反応させることによって達成される。反応混合物は、80℃で4時間加熱できるようにする。冷却後、反応生成物はすべて、C18 Sep Pakカラムを使用して精製し、収率は20〜50%の範囲である。
【0083】
他に記載していない限り、Re(I)錯体の合成は、10mLのメタノール中で[NEt4]2[ReBr3(CO)3](又は[99mTc(CO)3(H2O)3]+)を適切な配位子(10−6M〜10−4M)と1:1.2の割合で反応させることによって達成した。密封したバイアルを100℃で4時間加熱した。冷却した後、RP−HPLC(逆相HPLC)によって反応物の純度を分析し、溶離剤としてメタノールを使用し、シリカカラムを使用して生成物を精製した。HPLC精製後は「担体なし」生成物となり、その放射化学的純度(RCP)は、HPLCによって測定され、一貫して95%以上になることが示された。初期結果は、10−6Mという低い濃度の放射性標識付けを示したが、RCYは80%以下であった。RCYは放射化学的収率の略語である。75℃でRCYが95%超を達成するには、反応濃度を10−4Mまで増加させる必要があった。多くの場合、試験及び取り扱いの目的で非放射性類似体を調製するために、Re錯体として対応するTc錯体が調製され、試験される。
【0084】
化合物の放射性標識付け
式Iの化合物の放射性標識付けを行い、同様の方法を使用して遊離α−アミノ酸か、又は適切にN保護したアミノ酸誘導体として錯体を形成した。99mTc(I)(CO)3+の放射性標識付けは、2ステップで行い、市販のIsoLink(商標)キット(Covidien)を使用して、[99mTc(CO)3(H2O)3]+中間体を形成し、これを1:1のアセトニトリルとリン酸緩衝液の等量混合液中で式Iの適切な化合物(10−6M〜10−4M)と反応させた。密封したバイアルを100℃で30分間加熱した。冷却した後、RP−HPLCによって反応物の純度を分析した。HPLC精製の後は「担体なし」生成物となり、その放射化学的純度(RCP)はHPLCによって測定され、一貫して95%以上になることが示された。初期結果は、10−6Mという低濃度での放射性標識付けを実証し、RCYは80%以下であった。75℃でRCY>95%を達成するには、反応濃度を10−4Mまで増加させる必要があった。多くの場合、試験及び取り扱いの目的で非放射性類似体を調製するために、対応するRe錯体が調製され、Tc錯体として試験される。したがって、Reを特に示すことができるが、Tc錯体も含むことが理解される。
【0085】
例示的な式Iの化合物の合成
スキーム1は、Glu−尿素−イミダゾール系化合物の基本的な合成経路を示す。スキーム1に示された第1のステップは、0℃で不活性状態にて実行し、塩基の存在下でCDIを有するグルタミン酸のジ−t−ブチルエステルを使用し、中間体のGlu−尿素−イミダゾール誘導体2を形成する。この中間体を塩基性状態でMeOTfで活性化させて、メチル化イミダゾールを生成し、これは不活性状態でアミンに容易に反応する。DCM中の20%のTFAを使用し、室温で1〜4時間かけてtert−ブチルエステル保護基を除去する。保護解除が終了したら、反応混合物をロータリーエバポレータで濃縮するか、窒素を吹きつけて乾燥させ、シリカカラムで精製するか、又は再結晶化させる。
スキーム1
【化26】

【0086】
スキーム2に示す基本経路を使用し、10〜50%の範囲の全体的収率で一般構造Eの化合物を調製した。重要な合成中間体を、適切なアルデヒドを室温で1時間反応させることによって形成し、中間体シッフ塩基を形成した。シッフ塩基は分離しなかったが、トリアセトキシ水素化ホウ素ナトリウムでin situで還元し、二誘導体化アミン(B)を形成した。誘導体化アミンは、末端カルボン酸、HATU(2−(1H−7−アザベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロリン酸メタンアミニウム)及び塩基を使用して2−[3−(5−アミノ−1−tert−ブトキシカルボニル−ペンチル)−ウレイド]−ペンタンジオン酸ジーtert−ブチルエステル(A)と結合し、保護された中間体Cを形成した。Re(I)錯体(D)の合成は、10mlのメタノール中で[NEt4]2[ReBr3(CO)3]を適切な配位子と1:1.2の比率で反応させることによって達成された。反応物を80℃で4時間加熱されるようにした。冷却後、以下の反応生成物はすべて、C18 Sep Pakカラムを使用して精製し、収率は20〜50%の範囲であった。
スキーム2.M−Glu−尿素−Lys−X類似体(E)の合成の基本経路
【化27】

【0087】
DCM中の50%TFAを使用し室温12時間で、tert−ブチルエステル保護基を除去した。保護解除が終了したら、反応物をロータリーエバポレータで濃縮し、HPLC又はフラッシュクロマトグラフィで精製して、10〜50%の収率で所望の生成物(E)を生成した。
【0088】
実施例1:[Re(CO)3{(S)−2−(3−((R)−5−(ビス((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)アミノ)−1−カルボキシペンチル)ウレイド)ペンタンジオン酸}]
【化28】

スキーム1に示した基本手順と同様に、2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(S)−2−(3−((R)−5−(ビス((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)アミノ)−1−カルボキシペンチル)ウレイド)ペンタンジオン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。TFAを使用する上記方法を使用して、化合物の保護を解除し、オフホワイトの固体として所望の生成物(4.0mg、29%)を産生した。1H NMR (400 MHz, DMSO-d6)δ7.2 (s, 2H), 7.0 (s, 2H), 6.3 (s, 2H), 4.85 (s, 4H), 4.55 (d, 2H), 4.4 (d, 2H), 4.10 (s, 2H), 3.5 (s, 2H), 2.2 (m, 2H), 1.7 (m, 6H), 1.25 (m, 2H). ESMS m/z: 866 (M+H)+.
【0089】
実施例2:[Re(CO)3{(14R,18S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸}]
【化29】

スキーム1に示した基本手順と同様に、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(14R,18S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。TFAを使用する上記方法を使用して、化合物の保護を解除し、オフホワイトの固体として所望の生成物(8.0mg、13%)を産生した。1H NMR (400 MHz, DMSO-d6)δ7.9 (s, H), 7.2 (s, 2H), 7.0 (2, 2H), 6.3 (s, 2H), 4.85 (s, 4H), 4.55 (d, 2H), 4.4 (d, 2H), 4.1 (m, 2H), 3.5 (s, 2H), 2.9 (s, 4H), 2.2 (m, 2H), 2.05 (m, 2H), 1.85 (m, 2H), 1.6 (m, 6H), 1.3 (m, 4H). ESMS m/z: 979 (M+H)+.
【0090】
実施例3:[Re(CO)3{(19R,23S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボン酸}]
【化30】

スキーム1に示した基本手順と同様に、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(19R,23S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。TFAを使用する上記方法を使用して、化合物の保護を解除し、オフホワイトの固体として所望の生成物(7.0mg、24%)を産生した。1H NMR (400 MHz, DMSO-d6)δ7.8 (s, H), 7.2 (s, 2H), 7.0 (2, 2H), 6.3 (s, 2H), 4.8 (s, 4H), 4.55 (d, 2H), 4.4 (d, 2H), 4.1 (m, 2H), 3.5 (m, 2H), 2.9 (m, 2H), 2.2 (m, 2H), 2.05 (m, 4H), 1.9 (m, 4H), 1.6 (m, 4H), 1.4 (m, 2H) 1.3 (m, 16H). ESMS m/z: 525 (M/2).
【0091】
実施例4:[Re(CO)3{(17R,21S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−11,19−ジオキソ−5,8−ジオキサ−2,12,18,20−テトラアザトリコサン−17,21,23−トリカルボン酸}]
【化31】

スキーム1に示した基本手順と同様に、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(17R,21S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−11,19−ジオキソ−5,8−ジオキサ−2,12,18,20−テトラアザトリコサン−17,21,23−トリカルボン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。TFAを使用する上記方法を使用して、化合物の保護を解除し、オフホワイトの固体として所望の生成物(6.0mg、38%)を産生した。1H NMR (400 MHz, DMSO-d6)δ7.9 (s, H), 7.2 (s, 2H), 7.0 (s, 2H), 6.3 (s, 2H), 4.85 (s, 4H), 4.6 (d, 2H), 4.5 (d, 2H), 3.80 (m, 12H), 3.5 (m, 10H), 2.4 (m, 4H). ESMS m/z: 738 (M+H)+.
【0092】
実施例5
【化32】

【0093】
実施例5a(n=2):Glu−尿素−Lys−PEG2−ReDP:[Re(CO)3{(17R,21S)−11,19−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8−ジオキサ−2,12,18,20−テトラアザトリコサン−17,21,23−トリカルボン酸}][Br]。スキーム1に記載のものと同じ基本手順を使用し、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(17R,21S)−11,19−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8−ジオキサ−2,12,18,20−テトラアザトリコサン−17,21,23−トリカルボン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。上記方法を使用して、化合物の保護を解除し、オフホワイトの固体として所望の生成物(2mg、20%)を産生した。1H NMR (400 MHz, DMSO-d6)δ8.8 (d), 8.00 (dd), 7.55 (d), 7.42 (dd), 6.45 (s), 3.95 (m), 3.4-3.6 (m), 2.45 (m), 1.25 (m), 1.1 (m), 0.8 (m). ESMS m/z: 931 (M+H)+.
【0094】
実施例5b(n=4):Glu−尿素−Lys−PEG4−ReDP:[Re(CO)3{(23R,27S)−17,25−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8,11,14−テトラオキサ−2,18,24,26−テトラアザノナコサン−23,27,29−トリカルボン酸}][Br]。実施例6aの基本手順と同様に、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、(23R,27S)−17,25−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8,11,14−テトラオキサ−2,18,24,26−テトラアザノナコサン−23,27,29−トリカルボン酸を調製した。レニウムの基本実験で述べたものと同じ手順を使用し、レニウムエステル錯体を調製した。上記方法を使用して、化合物の保護を解除し、白い固体として所望の生成物(5.1mg、29.6%)を産生した。ESMS m/z: 1019 (M+H)+.
【0095】
実施例5c(n=8):Glu−尿素−Lys−PEG8−ReDP:[Re(CO)3{(35R,39S)−29,37−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8,11,14,17,20,23,26−オクタオキサ−2,30,36,38−テトラアザヘンテトラコンタン−35,39,41−トリカルボン酸}][Br]。実施例6aと同じ基本手順を使用し、既に調製して保護した2−[3−(5−アミノ−1−カルボキシ−ペンチル)−ウレイド]−ペンタンジオン酸ジt−ブチルエステルを使用して、PEG8ジピリジル化合物、(35R,39S)−29,37−ジオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−5,8,11,14,17,20,23,26−オクタオキサ−2,30,36,38−テトラアザヘンテトラコンタン−35,39,41−トリカルボン酸を調製した。レニウムの基本実験で述べた手順と同様に、レニウムエステル錯体を調製した。上記方法を使用して、化合物の保護を解除し、白い固体として所望の生成物(8.0mg、30.4%)を産生した。ESMS m/z: 1195 (M+H)+.
【0096】
実施例6:[Re(CO)3][(19S,23S)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボン酸]
【化33】

【0097】
ステップ1.11−((2−tert−ブトキシ−2−オキソエチル)((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)−メチル)アミノ)ウンデカン酸
【化34】

DCE(20mL)中に11−アミノウンデカン酸(603mg、3.0mmol)、2−ピリジンカルボキサルデヒド(630mg、3.0mmol)及びAcOH(0.20mL)を含む懸濁液を、窒素下で30分間還流した。反応混合物を0℃まで冷却し、NaBH(OAc)3(1.908g、9.0mmol)及び精製されていないtert−ブチルグリオキシレート(1.50g、11.5mmol)で順番に処理した。反応混合物を室温で一晩攪拌し、水で分解した。反応混合物をDCMで抽出した。有機層を減圧して乾燥・濃縮した。残留物をbiotageのシリカゲルカラムで精製し、黄色い油として11−((2−tert−ブトキシ−2−オキソエチル)((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ウンデカン酸(343mg、22%)を産生した。1H NMR (400 MHz, CDCl3) 7.01 (d, J = 1.2 Hz, 0.46 H), 6.99 (d, J = 1.2 Hz, 0.54 H), 6.88 (d, J = 1.2 Hz, 0.54 H), 6.86 (d, J = 1.2 Hz, 0.46 H), 5.30 (s, 1.08 H), 5.07 (s, 0.92 H), 4.67 (s, 2 H), 4.66 (s, 2 H), 3.83 (s, 0.92 H), 3.17 (s, 1.08 H), 2.41-2.32 (m, 2 H), 1.66-1.63 (m, 2 H), 1.47 (s, 9 H), 1.45 (s, 9 H), 1.42-1.10 (m, 14 H); MS (ESI), 510 (M+H)+.
【0098】
ステップ2.(19S,23S)−テトラ−tert−ブチル2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)−メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボキシラート
【化35】

DCM(5.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−6−アミノ−1−tert−ブトキシ−1−オキソヘキサン−2−イル)ウレイド)ペンタンジオン酸(85mg、0.175mmol)、11−((2−tert−ブトキシ−2−オキソエチル)((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ウンデカン酸(89mg、0.175mmol)、EDCI(1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド)(38mg、0.20mmol)、HOBt(1−ヒドロキシベンゾトリアゾール)(26mg、0.20)及びDIPEA(0.30mL)を含む溶液を室温で3日間攪拌した。反応混合物をDCM中の1%〜10%のMeOHでbiotageで溶出することによって精製し、黄色い油として(19S,23S)−テトラ−tert−ブチル2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボキシラート(111mg、65%)を産生した。MS (ESI), 490.5 (M/2+H)+.
【0099】
ステップ3.[Re(CO)3][(19S,23S)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボン酸](221)。TFA(1.0mL)/DCM(1.0mL)中に(19S,23S)−テトラ−tert−ブチル2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボキシラート(18.8mg、0.019mmol)を含む溶液を室温で一晩攪拌した。溶媒を蒸発させ、無色の油として19S,23S)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−1,19,23,25−テトラカルボン酸を生成した。水(1.0mL)中で保護を解除し、2NのNaOHでpH=9に調節した上記生成物の溶液に、Re(CO)3(H2O)OTf(0.50mL、0.10mL/mmol)を添加した。反応混合物を室温で一晩攪拌し、HPLCで精製して、白い固体として標題の化合物(4.0mg、19%)を生じた。1H NMR (400 MHz, DMSO-d6) 7.70 (t, J = 5.6 Hz, 1 H), 7.33 (s, 1 H), 7.13 (s, 2 H), 6.29 (d, J = 8.4 Hz, 1 H), 6.26 (d, J = 8.4 Hz, 1 H), 4.96 (d, J = 4.8 Hz, 2 H), 4.56 (d, J = 16.4 Hz, 1 H), 4.12 (d, J = 16.8 Hz, 1 H), 4.07-3.90 (m, 2 H), 3.70 (d, J = 17.2 Hz, 1 H), 3.40 (d, J = 17.2 Hz, 1 H), 2.98-2.94 (m, 4 H), 2.21 (q, J = 7.73, 2 H), 1.99 (t, J = 7.6 Hz, 2 H), 1.70-1.22 (m, 24 H); MS (ESI), 485.2 (M/2+H)+.
【0100】
実施例7:[Re(CO)3][(7S,14S,18S)−7−アミノ−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸]
【化36】

【0101】
ステップ1.(5S,12S,16S)−トリ−tert−ブチル5−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−1−(9H−フルオレン−9−イル)−3,6,14−トリオキソ−2−オキサ−4,7,13,15−テトラアザ−オクタデカン−12,16,18−トリカルボキシラート
【化37】

DCM(5.0mL)中に(S)−ジ−tert−ブチル2(3−((S)−6−アミノ−1−tert−ブトキシ−1−オキソヘキサン−2−イル)ウレイド)ペンタンジオアート(97mg、0.20mmol)、化合物2(151mg、0.20mmol)、EDCI(38mg、0.20mmol)、HOBt(26mg、0.20)及びDIPEA(0.30mL)を含む溶液を室温で一晩攪拌した。反応混合物をDCM中の1%〜10%のMeOHでbiotageで溶出することによって精製し、白い固体として(5S,12S,16S)−トリ−tert−ブチル5−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−1−(9H−フルオレン−9−イル)−3,6,14−トリオキソ−2−オキサ−4,7,13,15−テトラアザオクタデカン−12,16,18−トリカルボキシラート(85.7mg、35%)を生じた。1H NMR (400 MHz, CDCl3) 7.75 (d, J = 7.6 Hz, 2 H), 7.64 (d, J = 7.6 Hz, 2 H), 7.38 (t, J = 7.4 Hz, 2 H), 7.29 (dd, J = 7.6, 4.4 Hz, 2 H), 7.02 (brs, 1 H), 6.93 (s, 2 H), 6.80 (s, 2 H), 6.08 (d, J = 8.0 Hz, 1 H), 5.75 (d, J = 8.8 Hz, 1 H), 5.67 (d, J = 7.6 Hz, 1 H), 4.58 (s, 2 H), 4.56 (s, 2 H), 4.55-4.52 (m, 1 H), 4.36-4.29 (m, 3 H), 4.21 (d, J = 7.0 Hz, 1 H), 4.13 (t, J = 6.8 Hz, 1 H), 3.63 (s, 4 H), 3.48-3.46 (m, 1 H), 3.05-3.01 (m, 1 H), 2.53 (t, J = 7.2 Hz, 2 H), 2.33-2.26 (m, 2 H), 2.07-2.00 (m, 2 H), 1.77-1.26 (m, 55 H); MS (ESI), 614.0 (M/2+H)+.
【0102】
ステップ2.(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート
【化38】

DMF(0.50mL)中に(5S,12S,16S)−トリ−tert−ブチル5−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−1−(9H−フルオレン−9−イル)−3,6,14−トリオキソ−2−オキサ−4,7,13,15−テトラアザオクタデカン−12,16,18−トリカルボキシラート(84mg、0.069mmol)を含む溶液に、ピペリジン(0.50mL)を添加した。混合物を室温で2時間攪拌した。溶媒を減圧して蒸発させ、残留物を生じた。これを、DCM中の5%のMeOHから25%のMeOHでbiotageで溶出することによって精製し、(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート(59mg、86%)を生じた。1H NMR (400 MHz, , CDCl3) 6.96 (d, J = 0.8 Hz, 2 H), 6.85 (d, J = 0.8 Hz, 2 H), 5.55 (brs, 1 H), 5.43 (brs, 1 H), 4.59 (s, 4 H), 4.37-4.28 (m, 2 H), 3.61 (s, 4 H), 3.35-3.27 (m, 2 H), 3.18-3.12 (m, 1 H), 2.53 (t, J = 7.4 Hz, 2 H), 2.34-2.28 (m, 2 H), 2.10-2.00 (m, 2 H), 1.85-1.26 (m, 55 H); MS (ESI), 503.0 (M/2+H)+.
【0103】
ステップ3.[Re(CO)3][(7S,14S,18S)−7−アミノ−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸]。MeOH(5mL)中に(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート(42mg、0.042mmol)及び[NEt4]2[Re(CO)3Br3](42mg、0.055mmol)を含む溶液を圧力管にて90℃で4時間攪拌した。溶媒を蒸発させ、残留物を生成した。これは次のステップに直接使用した。TFA(3.0mL)/DCM(3.0mL)中に以上の生成物を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて、精製されていない生成物が得られ、これをHPLCで精製して白い固体として標題の化合物(27.9mg、2ステップで67%)を生成した。1H NMR (400 MHz, DMSO-d6) 8.42 (brs, 1 H), 8.10 (brs, 2 H), 7.18 (s, 2 H), 7.04 (s, 2 H), 6.32 (d, J = 8.4 Hz, 1 H), 6.29 (d, J = 8.0 Hz, 1 H), 4.02 (s, 4 H), 4.56-4.37 (m, 4 H), 4.08-4.01 (m, 2 H), 3.68-3.61 (m, 3 H), 3.11-3.08 (m, 2 H), 2.23-1.29 (m, 16 H); MS (ESI), 497.7 (M/2+H)+.
【0104】
実施例8:[Re(CO)3][(19S,23S)−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボン酸]
【化39】

【0105】
ステップ1.tert−ブチル2,2’−(2−ブロモアセチルアザンジイル)ジアセテート。DCM(100mL)中にtert−ブチル2,2’−二酢酸アザンジイル(3.00g、12.24mmol)及び2−臭化ブロモアセチル(1.39mL、3.23g、16.00mmol)を含む溶液に、室温でEt3N(2.0mL)を添加した。反応混合物を室温で2時間攪拌した。反応混合物をDCM(300mL)で希釈し、水で洗浄して、Na2SO4で乾燥した。溶媒を減圧して蒸発させ、残留物を生じた。これをEtOAc中の10%のヘキサンからEtOAc中の50%のヘキサンでbiotageで溶出することによって精製し、tert−ブチル2,2’−(2−ブロモアセチルアザンジイル)ジアセテート(4.68g、100%)にした。1H NMR (400 MHz, CDCl3) 4.09 (s, 2 H), 4.07 (s, 2 H), 3.86 (s, 2 H), 1.49 (s, 9 H), 1.46 (s, 9 H); MS (ESI), 388, 390 (M+Na)+.
【0106】
ステップ2.tert−ブチル2,2’−(2−(2−ホルミル−1H−イミダゾール−1−イル)アセチルアザンジイル)ジアセテート
【化40】

tert−ブチル2,2’−(2−ブロモアセチルアザンジイル)ジアセテート(4.55g、12.43mmol)、1H−イミダゾール−2−カルバルデヒド(1.536g、16.0mmol)、DIPEA(5.0mL)、及びKI(0.64g、4.0mmol)の溶液を80℃で一晩攪拌した。溶液を減圧して蒸発させた後、反応混合物をDCMで希釈し、水で洗浄して、乾燥した。溶媒を減圧して蒸発させ、残留物を生じ、これをDCMでDCM中の3%のMeOHに対してbiotageで溶出することによって精製し、tert−ブチル2,2’−(2−(2−ホルミル−1H−イミダゾール−1−イル)アセチルアザンジイル)ジアセテート(3.96g、84%)にした。1H NMR (400 MHz, CDCl3) 9.76 (s, 1 H), 7.31 (s, 1 H), 7.25 (s, 1 H), 5.30 (s, 2 H), 4.14 (s, 2 H), 4.07 (s, 2 H), 1.51 (s, 9 H), 1.43 (s, 9 H); MS (ESI), 382 (M+H)+.
【0107】
ステップ3.11−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ウンデカン酸
【化41】

DCE(30mL)中に11−アミノウンデカン酸(100mg、0.50mmol)、tert−ブチル2,2’−(2−(2−ホルミル−1H−イミダゾール−1−イル)アセチルアザンジイル)ジアセテート(381mg、1.0mmol)及びAcOH(0.02mL)を含む溶液を、窒素下で75℃で30分間攪拌した。反応混合物を0℃まで冷却し、NaBH(OAc)3(0.3165g、1.5mmol)で処理した。反応混合物を室温で一晩攪拌し、水で分解した。溶媒を減圧して蒸発させ、残留物を生じ、これをDCM中の1〜10%のMeOHでbiotageで溶出し、11−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ウンデカン酸(368mg、79%)にした。1H NMR (400 MHz, DMSO-d6) 6.93 (s, 2 H), 6.76 (s, 2 H), 5.02 (s, 4 H), 4.29 (s, 4 H), 3.93 (s, 4 H), 3.44 (s, 4 H), 2.30 (t, J = 7.6 Hz, 2 H), 2.09 (t, J = 7.6 Hz, 2 H), 1.43 (s, 18 H), 1.35 (s, 18 H), 1.29-1.00 (m, 16 H); MS (ESI), 466.9 (M/2+H)+.
【0108】
ステップ4.(19S,23S)−トリ−tert−ブチル1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボキシラート
【化42】

DCM(5.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−6−アミノ−1−tert−ブトキシ−1−オキソヘキサン−2−イル)ウレイド)ペンタンジオン酸(85mg、0.174mmol)、11−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ウンデカン酸(118mg、0.127mmol)、EDCI(38mg、0.20mmol)、HOBt(26mg、0.20)及びDIPEA(0.30mL)を含む溶液を室温で一晩攪拌した。反応混合物をDCM中に1%〜10%のMeOHでbiotageで溶出することによって精製し、無色の油として(19S,23S)−トリ−tert−ブチル1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボキシラート(38mg、21%)を生じた。1H NMR (400 MHz, CDCl3) 6.95 (d, J = 1.2 Hz, 2 H), 6.83 (d, J = 0.80 Hz, 2 H), 5.97 (s, 1 H), 5.28 (d, J = 7.6 Hz, 1 H), 5.23 (d, J = 8.4 Hz, 1 H), 4.94 (s, 4 H), 4.33-4.25 (m, 2 H), 4.12 (s, 4 H), 4.03 (s, 4 H), 3.63 (s, 4 H), 3.25-3.16 (m, 2 H), 2.53 (t, J = 7.4 Hz, 2 H), 2.33-2.24 (m, 2 H), 2.15 (t, J = 7.6 Hz, 2 H), 2.08-2.03 (m, 2 H), 2.02-1.20 (m, 85 H); MS (ESI), 701.6 (M/2+H)+.
【0109】
ステップ5.[Re(CO)3][(19S,23S)−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボン酸](223)。MeOH(5mL)中に(19S,23S)−トリ−tert−ブチル1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボキシラート(28mg、0.02mmol)及び[NEt4]2[Re(CO)3Br3](30mg、0.039mmol)を含む溶液を圧力管にて90℃で一晩攪拌した。溶媒を蒸発させて残留物を生成し、これは次のステップで直接使用した。TFA(3.0mL)/DCM(3.0mL)中に以上の生成物を含む溶液を室温で3時間攪拌した。溶媒を蒸発させて精製されていない生成物が得られ、これをHPLCによって精製して、白い固体として標題の化合物(17.6mg、2ステップで69%)を生成した。1H NMR (400 MHz, DMSO-d6) 7.70 (t, J = 4.8 Hz, 1 H), 7.10 (s, 2 H), 7.03 (s, 2 H), 6.29 (d, J = 8.4 Hz, 1 H), 6.26 (d, J = 8.4 Hz, 1 H), 5.02 (s, 4 H), 4.37-3.97 (m, 14 H), 3.60-3.57 (m, 2 H), 3.01-2.94 (m, 2 H), 2.24-1.22 (m, 28 H); MS (ESI), 640.3 (M/2+H)+.
【0110】
実施例9:[Re(CO)3][(7S,14S,18S)−7−アミノ−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸]
【化43】

【0111】
ステップ1.2−(((9H−フルオレン−9−イル)メトキシ)カルボニルアミノ)−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸
【化44】

DCE(30mL)中にL−Fmoc−リジン−OH(0.202g、0.50mmol)、tert−ブチル2,2’−(2−(2−ホルミル−1H−イミダゾール−1−イル)アセチルアザンジイル)ジアセテート(0.381g、1.00mmol)を含む溶液を80℃で30分間加熱した。反応混合物を0℃に冷却し、NaBH(OAc)3(0.3165g、1.50mmol)で処理した。反応物を室温で12時間攪拌し、水で分解した。反応混合物をDCMで抽出した。有機層を減圧して乾燥・濃縮した。残留物を、DCM中に5〜25%のメタノールという勾配法でBiotage SP4によって精製し、白い固体として2−(((9H−フルオレン−9−イル)メトキシ)カルボニルアミノ)−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(0.408g、74%収率)を生じた。1H NMR (400 MHz, CDCl3) 7.74 (d, J = 7.6 Hz, 2 H), 7.67 (t, J = 6.0 Hz, 2 H), 7.38 (t, J = 7.4 Hz, 2 H), 7.29 (d, J = 7.6 Hz, 2 H), 6.92 (s, 2 H), 6.29 (s, 2 H), 6.19 (brs, 1 H), 5.09-5.04 (m, 2 H), 4.81-4.79 (m, 1 H), 4.39-4.30 (m, 4 H), 4.23 (t, J = 7.2 Hz, 1 H), 4.22-3.58 (m, 10 H), 3.48 (s, 2 H), 2.34-2.30 (m, 2 H), 1.67-1.26 (m, 6 H), 1.50 (s, 18 H), 1.42 (s, 18 H). ESMS m/z: 550.5 (M/2+H)+.
【0112】
ステップ2.(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート
【化45】

DCM(5.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−6−アミノ−1−tert−ブトキシ−1−オキソヘキサン−2−イル)ウレイド)ペンタンジオアート(97mg、0.20mmol)、2−(((9H−フルオレン−9−イル)メトキシ)カルボニルアミノ)−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(132mg、0.12mmol)、EDCI(38mg、0.20mmol)、HOBt(26mg、0.20)及びDIPEA(0.30mL)を含む溶液を室温で2日間攪拌した。反応混合物をDCM中の1%のMeOHでbiotageで溶出することによって精製し、油として(5S,12S,16S)−トリ−tert−ブチル5−(4−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−1−(9H−フルオレン−9−イル)−3,6,14−トリオキソ−2−オキサ−4,7,13,15−テトラアザオクタデカン−12,16,18−トリカルボキシラート(不純)を生じた。
【0113】
DMF(1.0mL)中に以上の生成物、すなわち、(5S,12S,16S)−トリ−tert−ブチル5−(4−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−1−(9H−フルオレン−9−イル)−3,6,14−トリオキソ−2−オキサ−4,7,13,15−テトラアザオクタデカン−12,16,18−トリカルボキシラートを含む溶液に、ピペリジン(0.50mL)を添加した。混合物を室温で2時間攪拌した。溶媒を減圧して蒸発させて、残留物を生じ、これをDCM中の5%のMeOHから50%のMeOHでbiotageで溶出させることによって精製し、白い固体として(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート(40mg、25%)を生じた。1H NMR (400 MHz, , CDCl3) 6.96 (s, 2 H), 6.83 (d, 2 H), 6.37 (brs, 1 H), 6.33 (brs, 1 H), 5.05 (s, 4 H), 4.87 (brs, 2 H), 4.27-4.24 (m, 2 H), 4.18 (s, 4 H), 4.10 (s, 4 H), 3.88 (d, J = 15.2 Hz, 2 H), 3.62 (d, J = 15.2 Hz, 2 H), 3.14-3.12 (m, 1 H), 2.30-1.24 (m, 83 H); MS (ESI), 674.1 (M/2+H)+.
【0114】
ステップ3.[Re(CO)3][(7S,14S,18S)−7−アミノ−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸](224)。MeOH(3mL)中に(7S,14S,18S)−トリ−tert−ブチル7−アミノ−1−(1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボキシラート(19mg、0.014mmol)及び[NEt4]2[Re(CO)3Br3](19mg、0.024mmol)を含む溶液を圧力管にて90℃で3時間攪拌した。溶媒を蒸発させて、残留物を生成し、これは次のステップで直接使用した。TFA(3.0mL)/DCM(3.0mL)中に以上の生成物を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて、精製されていない生成物が得られ、これをHPLCによって精製し、白い固体として[Re(CO)3][(7S,14S,18S)−7−アミノ−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−8,16−ジオキソ−2,9,15,17−テトラアザイコサン−14,18,20−トリカルボン酸](14.1mg、2ステップで82%)を生成した。1H NMR (400 MHz, DMSO-d6) 8.43 (brs, 1 H), 8.09 (brs, 3 H), 7.10 (s, 2 H), 7.03 (s, 2 H), 6.51 (brs, 1 H), 6.31 (d, J = 8.0 Hz, 1 H), 6.28 (d, J = 8.4 Hz, 1 H), 5.00 (s, 4 H), 4.40-4.01 (m, 14 H), 3.70-3.64 (m, 3 H), 3.11-3.08 (m, 2 H), 2.26-1.29 (m, 16 H); MS (ESI), 612.8 (M+H)/2+.
【0115】
実施例10:Re(CO)3][(7S,14S,16S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−9,14−ジオキソ−2,8,13,15−テトラアザオクタデカン−7,12,16,18−テトラカルボン酸]
【化46】

【0116】
ステップ1.(S)−ジ−tert−ブチル2−(3−((S)−1−tert−ブトキシ−5−(2,5−ジオキソピロリジン−1−イルオキシ)−1,5−ジオキソペンタン−2−イル)ウレイド)ペンタンジオアート
【化47】

CH3CN(5.0mL)中に(S)−5−tert−ブトキシ−4−(3−((S)−1,5−ジ−tert−ブトキシ−1,5−ジオキソペンタン−2−イル)ウレイド)−5−オキソペンタン酸(S.A.Kularatne他、Mol.Pharmaceutics、2009、6、790〜800)(164mg、0.336mmol)、N,N’−炭酸ジスクシンイミジル(128mg、0.50mmol)及びピリジン(0.10mL)を含む溶液を室温で一晩攪拌した。溶媒を減圧して除去し、残留物を生成し、これをヘキサン中の10%〜70%のEtOAcでbiotageで溶出することによって精製し、白い固体として(S)−ジ−tert−ブチル2−(3−((S)−1−tert−ブトキシ−5−(2,5−ジオキソピロリジン−1−イルオキシ)−1,5−ジオキソペンタン−2−イル)ウレイド)ペンタンジオアート(190mg、97%)を生じた。
【0117】
ステップ2.(2S,7S,11S)−2−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−15−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸
【化48】

DMF(1.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−1−tert−ブトキシ−5−(2,5−ジオキソピロリジン−1−イルオキシ)−1,5−ジオキソペンタン−2−イル)ウレイド)ペンタンジオアート(138mg、0.236mmol)、(S)−2−アミノ−6−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(127mg、0.237mmol)及びDIPEA(0.50mL)を含む溶液を室温で一晩攪拌した。溶媒を減圧して除去し、残留物を生成し、これをDCM中の1%〜50%のMeOHでbiotageで溶出することによって精製し、白い固体として(2S,7S,11S)−2−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−15−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸(203mg、86%)を生じた。1H NMR (400 MHz, CDCl3) 7.40 (brs, 1 H), 6.99 (s, 2 H), 6.79 (s, 2 H), 6.12 (brs, 1 H), 5.62 (brs, 1 H), 4.67-4.28 (m, 7 H), 3.68 (d, J = 14.0 Hz, 2 H), 3.62 (d, J = 14.0 Hz, 2 H), 2.62-2.53 (m, 2 H), 2.34-2.02 (m, 8 H), 1.83-1.42 (m, 51 H); MS (ESI), 503.5 (M/2+H)+.
【0118】
ステップ3.[Re(CO)3][(7S,12S,16S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−9,14−ジオキソ−2,8,13,15−テトラアザオクタデカン−7,12,16,18−テトラカルボン酸](225)。MeOH(5mL)中に((2S,7S,11S)−2−(4−(ビス((1−(2−tert−ブトキシ−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−15−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸(45mg、0.0448mmol)及び[NEt4]2[Re(CO)3Br3](45mg、0.058mmol)を含む溶液を圧力管にて90℃で4時間攪拌した。溶媒を蒸発させて残留物を生成し、これは次のステップで直接使用した。TFA(2.0mL)/DCM(3.0mL)中に以上の生成物を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて精製されていない生成物が得られ、これをHPLCで精製して、白い固体として[Re(CO)3][(7S,12S,16S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−9,14−ジオキソ−2,8,13,15−テトラアザオクタデカン−7,12,16,18−テトラカルボン酸](30mg、2ステップで67%)を生成した。1H NMR (400 MHz, DMSO-d6) 8.14 (d, J = 7.2 Hz, 1 H), 7.19 (d, J = 0.8 Hz, 2 H), 7.05 (d, J = 1.2 Hz, 2 H), 6.37-6.34 (m, 2 H), 4.85 (s, 4 H), 4.58 (dd, J = 16.4, 2.8 Hz, 2 H), 4.40 (dd, J = 16.0, 2.8 Hz, 2 H), 4.22-4.04 (m, 3 H), 3.65 (t, J = 7.6 Hz, 2 H), 2.25-1.32 (m, 16 H); MS (ESI), 995.3 M+.
【0119】
実施例11:[Re(CO)3][(7S,12S,16S)−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−9,14−ジオキソ−2,8,13,15−テトラアザオクタデカン−7,12,16,18−テトラカルボン酸]
【化49】

【0120】
ステップ1.(S)−2−アミノ−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸
【化50】

DMF(0.50mL)中に2−(((9H−フルオレン−9−イル)メトキシ)カルボニルアミノ)−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(190mg、0.173mmol)及びピペリジン(0.50mL)を含む溶液を室温で1時間攪拌した。溶媒を減圧して蒸発させ、精製されていない生成物が得られた。精製されていない生成物を、DCM中に5〜50%のメタノールという勾配法でBiotage SP4によって精製し、(S)−2−アミノ−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(0.120g、79%)を生成した。1H NMR (400 MHz, DMSO-d6) 6.92 (s, 2 H), 6.76 (s, 2 H), 5.01 (s, 4 H), 4.32 (s, 2 H), 4.31 (s, 2 H), 3.92 (s, 4 H), 3.44 (s, 4 H), 3.01-2.99 (m, 1 H), 2.30 (t, J = 7.2 Hz, 2 H), 1.60-1.57 (m, 2 H), 1.43 (s, 18 H), 1.35 (m, 18 H). 1.30-1.12 (m, 4 H); MS (ESI), 439.4 (M/2+H)+.
【0121】
ステップ2.(2S,7S,11S)−2−(4−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−5−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸
【化51】

DMF(2.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−1−tert−ブトキシ−5−(2,5−ジオキソピロリジン−1−イルオキシ)−1,5−ジオキソペンタン−2−イル)ウレイド)ペンタンジオン酸(82mg、0.14mmol)、((S)−2−アミノ−6−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ヘキサン酸(98mg、0.11mmol)及びDIPEA(0.50mL)を含む溶液を室温で一晩攪拌した。溶媒を減圧して除去し、残留物を生成し、これをDCM中の1%〜40%のMeOHでbiotageで溶出することによって精製し、白い固体として(2S,7S,11S)−2−(4−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−15−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸(125mg、84%)を生じた。MS (ESI), 674.6 (M/2+H)+.
【0122】
ステップ3.[Re(CO)3][(7S,12S,16S)−1−(1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)−2−((1−(2−(ビス(カルボキシメチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)−9,14−ジオキソ−2,8,13,15−テトラアザオクタデカン−7,12,16,18−テトラカルボン酸](226)。MeOH(5mL)中に(2S,7S,11S)−2−(4−(ビス((1−(2−(ビス(2−tert−ブトキシ−2−オキソエチル)アミノ)−2−オキソエチル)−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−16,16−ジメチル−4,9,14−トリオキソ−15−オキサ−3,8,10−トリアザヘプタデカン−1−オイック酸(54mg、0.040mmol)及び[NEt4]2[Re(CO)3Br3](47mg、0.060mmol)を含む溶液を圧力管にて90℃で4時間攪拌した。溶媒を蒸発させて残留物を生成し、これは次のステップで直接使用した。TFA(2.0mL)/DCM(3.0mL)中に以上の生成物を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて精製されていない生成物が得られ、これをHPLCで精製して、白い固体として標題の化合物(44.8mg、2ステップで91%)を生成した。1H NMR (400 MHz, DMSO-d6) 8.17 (d, J = 7.6 Hz, 1 H), 7.11 (d, J = 1.2 Hz, 2 H), 7.03 (d, J = 1.2 Hz, 2 H), 6.37-6.33 (m, 2 H), 5.02 (s, 4 H), 4.40-3.98 (m, 15 H), 3.65 (t, J = 7.6 Hz, 2 H), 2.25-1.32 (m, 14 H); MS (ESI), 613.3 (M+H)/2+.
【0123】
以上の方法で適切な試薬を選択して調製した追加の化合物には、下記の実施例14〜20が含まれる。
【0124】
実施例12:(7S,22S,26S)−9,16,24−トリオキソ−1−(キノリン−2−イル)−2−(キノリン−2−イルメチル)−2,8,17,23,25−ペンタアザオクタコサン−7,22,26,28−テトラカルボン酸
【化52】

【0125】
実施例13:(7S,22S,26S)−9,16,24−トリオキソ−1−(ピリジン−2−イル)−2−(ピリジン−2−イルメチル)−2,8,17,23,25−ペンタアザオクタコサン−7,22,26,28−テトラカルボン酸
【化53】

【0126】
実施例14:(22S,26S)−9,16,24−トリオキソ−2−(ピリジン−2−イルメチル)−2,8,17,23,25−ペンタアザオクタコサン−1,7,22,26,28−ペンタカルボン酸
【化54】

【0127】
実施例15:(7S,22S,26S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((3−(カルボキシメチル)−3H−ピロル−2−イル)メチル)−9,16,24−トリオキソ−2,8,17,23,25−ペンタアザオクタコサン−7,22,26,28−テトラカルボン酸
【化55】

【0128】
実施例16:(19S,23S)−1−(1−(カルボキシメチル)−1H−イミダゾール−2−イル)−2−((1−(カルボキシメチル)−1H−イミダゾール−2−イル)メチル)−13,21−ジオキソ−2,14,20,22−テトラアザペンタコサン−19,23,25−トリカルボン酸
【化56】

【0129】
実施例17:(7S,11S,26S)−26−(4−(ビス((1−メチル−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−2,2−ジメチル−4,9,17,24−テトラオキソ−3−オキサ−8,10,16,25−テトラアザヘプタコサン−27−オイック酸
【化57】

【0130】
1,4,7,10−テトラアザシクロドデカン−1,4,7,10−テトラ酢酸(DOTA)に基づいたキレーターを組み込んで他の化合物を調製することができる。このようなDOTA系のキレーターは、イットリウム、ルテチウム、ガリウム及びインジウムを含むが、これらに限定されない撮像金属をキレート化するために使用することができる。DOTA系のキレーターは、以上で概略したように、DOTAの酸基のうち1つを利用し、他のR基に結合して調製することができる。例示的なDOTA系の化合物は下式を含むが、これらに限定されず、式中、MはY、Lu、Ga又はInであり、nは0〜20である。
【化58】

【0131】
実施例18.(7S,22S,26S)−1−(1−メチル−1H−イミダゾール−2−イル)−2−((1−メチル−1H−イミダゾール−2−イル)メチル)−9,16,24−トリオキソ−2,8,17,23,25−ペンタアザオクタコサン−7,22,26,28−テトラカルボン酸のRe(CO)3錯体。
【化59】

【0132】
DMF(5.0mL)中に(S)−ジ−tert−ブチル2−(3−((S)−1−tert−ブトキシ−6−(8−(2,5−ジオキソピロリジン−1−イルオキシ)−8−オキソオクタンアミド)−1−オキソヘキサン−2−イル)ウレイド)ペンタンジオアート(0.356g、0.48mmol)、化合物13の化合物(0.16g、0.48mmol)及びDIPEA(1.0mL)を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて残留物を生成し、これをDCM/MeOHでBiotageで溶出することによって精製し、(7S,11S,26S)−26−(4−(ビス((1−メチル−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−2,2−ジメチル−4,9,17,24−テトラオキソ−3−オキサ−8,10,16,25−テトラアザヘプタコサン−27−オイック酸(81mg、18%)を生成した。MS (ESI), 481 (M/2+H)+.
【0133】
MeOH(4mL)中に(7S,11S,26S)−26−(4−(ビス((1−メチル−1H−イミダゾール−2−イル)メチル)アミノ)ブチル)−7,11−ビス(tert−ブトキシカルボニル)−2,2−ジメチル−4,9,17,24−テトラオキソ−3−オキサ−8,10,16,25−テトラアザヘプタコサン−27−オイック酸(72mg、0.075mmol)及び[NEt4]2[Re(CO)3Br3](72mg、0.094mmol)を含む溶液を圧力管にて95℃で4時間攪拌した。溶媒を蒸発させて残留物を生成し、これは次のステップで直接使用した。TFA/DCM中に以上の生成物を含む溶液を室温で一晩攪拌した。溶媒を蒸発させて精製されていない生成物が得られ、これをHPLCによって精製し、白い固体として[Re(CO)3][(7S,22S,26S)−1−(1−メチル−1H−イミダゾール−2−イル)−2−((1−メチル−1H−イミダゾール−2−イル)メチル)−9,16,24−トリオキソ−2,8,17,23,25−ペンタアザオクタコサン−7,22,26,28−テトラカルボン酸](4.0mg)を生成した。1H NMR (400 MHz, DMSO-d6) 8.08 (d, J = 8.0 Hz, 1 H), 7.72 (t, J = 5.4 Hz, 1 H), 7.24 (d, J = 1.2 Hz, 2 H), 7.05 (d, J = 1.2 Hz, 2 H), 6.31 (d, J = 8.4 Hz, 1 H), 6.28 (d, J = 8.0 Hz, 1 H), 4.69 (d, J = 16.8 Hz, 2 H), 4.54 (d, J = 16.8 Hz, 2 H), 4.28-4.23 (m, 1 H), 4.11-4.03 (m, 2 H), 3.78 (s, 6 H), 2.97-2.92 (m, 2 H), 2.26-2.20 (m, 2 H), 2.11 (t, J = 7.2 Hz, 2 H), 1.99 (t, J = 7.6 Hz, 2 H), 1.90-1.20 (m, 24 H); MS (ESI), 531.8 (M/2+H)+.
【0134】
レニウム、テクネチウム、又は他の金属キレート化錯体を有する式Iの化合物の他の錯体は、以上で例示された方法で調製することができる。ランタニド収縮により、レニウム及びテクネチウムは同様のサイズ及び反応性を有する。したがって、レニウムは放射性ではない安定した同位元素を幾つか有するので、レニウム錯体は、対応する放射性テクネチウム錯体の挙動について、合成し、試験する良好なモデルになる。このようにレニウム錯体が例示によって提供されているが、テクネチウム錯体も調製することができ、その逆もあり得る。
【0135】
表1に示す下記の例は、保護基について単離するか、上述したようにin situで、上述の方法によって調製された、又は調製される。
【表1−1】

【表1−2】

【表1−3】

【表1−4】

【表1−5】

【表1−6】

【0136】
基本的な生物学的性質
PSMA陽性(+)のLnCap細胞を使用し、一般構造5の新たに調製した類似体を、ヒト前立腺癌細胞結合測定法にて3nMの濃度でスクリーニングした。このスクリーニングの結果は、化合物がPSMA(+)細胞に特異な結合を示すかどうかを実証した。PSMA(+)細胞に特異的な結合を示した化合物を、PSMAの既知の阻害剤である、N−[N−[(S)−1,3−ジカルボキシプロピル]カルバモイル]−S−3−ヨード−L−チロシン(DCIT)との競合結合測定法でさらに評価し、IC50値を計算した。
【0137】
In vitro予備スクリーニング
LNCaP及びPC3ヒト前立腺癌細胞は、メリーランド州RockvilleのAmerican Type Culture Collectionから入手した。LNCaP細胞を、10%のウシ胎児血清(FBS)で補ったRPMI−1640培地中に維持した。LNCaP細胞に対する放射性標識付き化合物の結合、及び低温誘導体との競合は、適切な修正をして、既知の手順に従って実行された。細胞を、12ウェルプレートに約4×105個/ウェルとし、37℃/5%二酸化炭素の加湿したインキュベータ内で48時間インキュベートしてから化合物を加えた。Glu−尿素−X誘導体をそれぞれ調製し、3nMの123I−DCIT(既知の阻害剤)と組み合わせた0.5%のウシ血清アルブミン(BSA)を含有する無血清細胞培養培地で希釈した。全結合量は、試験化合物がない状態で123I−DCITをインキュベートすることによって測定した。プレートを室温で1時間インキュベートした。細胞をプレートから取り出し、エッペンドルフ管に移した。サンプルを15秒間、10K×gでマイクロ遠心分離器にかけた。培地を吸引し、新しいアッセイ培地中に分散させることによってペレットを2回洗浄し、その後にマイクロ遠心分離した。123I−DCITの細胞結合量は、自動ガンマカウンタで細胞ペレットを数えることによって求めた。非特異的結合量は、2uMの放射性標識なし化合物又は2ホスホノメチル−ペンタンジオン酸(PMPA)でインキュベートした後に、細胞に関連するカウントとして測定された。重要な対照標準化合物を下図に示す。
【化60】

【0138】
バイオアッセイ
組織の生体内分布結果はin vitroデータと一致し、LNCaP(PSMA陽性)腫瘍内の有意の取り込みを実証した。この結果は、またPC3(PSMA陰性)腫瘍における高度の特異性及び非常に小さい活性も示した。
【0139】
「低温」錯体に対してN−[N−[(S)−1,3−ジカルボキシプロピル]カルバモイル]−S−3−ヨード−L−チロシン(I−131−DCIT)を使用した生物学的評価は、迅速な第1のスクリーニングであり、そして投与量曲線からIC50値を正確に求められることが判明した。一連のリード化合物は50nM未満のIC50値を示した。一連のリード化合物のin vivoデータは、LNCaP腫瘍内で3%ID/g蓄積という高い親和性、及びLNCaP対PC3の比率が15:1を超えるという高い特異性を実証した。
【0140】
NAALADaseのアッセイ
以下のようにNAAGの結合を測定し、PSMAを測定する。(a)反応混合物の調製:反応混合物は、LNCaP細胞溶解物(200μg)を600uLの反応緩衝液(反応緩衝液:50mMのTris−HCl、pH7.4、20mMのCoCl2、32mMのNaCl)と組み合わせることによって調製する。混合物は、使用前に37℃で3分間プレインキュベートさせる。(b)放射性標識付きNAAG溶液の調製:放射性標識付きNAAG溶液原料は、反応緩衝液(1mM)を使用して1μlの100mMの原料を100μlに希釈することによって調製する。(c)アッセイ:アッセイは、(1mMの最終濃度のために)1,000,000CPMの3H−NAAG(100μLの1mMのNAAG+10μLの3H−NAAG(10μCi))を加えた6μLの1mMのNAAGを反応混合物に添加することによって実行する。競合結合の研究のために、PMPA[濃度]を添加し、その結果の溶液を30分間37℃でインキュベートする。100uLの反応混合物を移し、等量の氷温の0.25MのKH2PO4(pH4.3)を添加することによって、特定の時点で反応を停止する。緩衝した混合物の約1/2を250mgAGの50W−X4陽イオン交換カラム(200〜400メッシュ、H+型、使用前にDI H2Oで膨張した樹脂)に注入する。注入したカラムを500μLの1:1のRxn緩衝液/0.25MのKH2PO4で洗浄し、3MのKCl(1.5mL)で溶出する。カラムに結合した放射性標識の濃度は、消光効果を最小化するためにシンチレーションカウンタ及び100μLの溶出剤(1:6で希釈)を使用して測定する。
【0141】
治療処置
本発明の化合物を使用して、治療処置のためにNAALADaseを阻害することができる。NAALADase処置を受けいれ得る疾患には、疼痛性及び感覚性の糖尿病性神経障害、神経障害損傷及び前立腺癌、統合失調症、結腸直腸癌、炎症、筋萎縮性側索硬化症、糖尿病性神経障害を含む。本発明の化合物は鎮痛剤としても使用することができる。このような治療処置をモデリングするための案内は、Goodman & Gilman’s The Pharmacological Basis of Therapeutics(McGraw Hill、第10版、2001)、Pharmaceutical Preformulation and Formulation:A Practical Guide from Candidate Drug Selection to Commercial Dosage Form(CRC、2001)、及びHandbook of Pharmaceutical Excipients(AphA Publications、第5版、2005)に見ることができる。
【0142】
図では、比較のために幾つかの化合物を参照している。これらの比較用の化合物及びその構造を以下に示す。
【表2−1】

【表2−2】

【0143】
例示的放射性医薬品の組織分布
本明細書で調製した幾つかの化合物及び錯体の組織分布について、また場合によっては比較用の化合物と比較して評価した。図1、図3、図4及び図5は、このデータの幾つかをグラフで提示する。図6は、実施例6の化合物の99mTc錯体の組織生体内分布を示す放射線画像である。
【0144】
均等物
特定の実施形態を図示し、説明してきたが、添付の特許請求の範囲で定義されるようなより広義の態様における技術から逸脱することなく、当技術分野の通常の技術に従って、変更及び修正をできることを理解されたい。
【0145】
本開示は、本出願で述べた特定の実施形態によって制限されるものではない。当業者には明白なように、その精神及び範囲から逸脱することなく、多くの変更及び変形が可能である。本明細書で列挙されているものに加えて、開示の範囲内にある機能的に同等の方法及び組成物が、以上の説明から当業者には明白になる。このような修正及び変形は、特許請求の範囲に入るものとする。本開示は、特許請求の範囲、及びこのような請求項によって資格を与えられた均等物の全範囲によってのみ限定される。本開示は、特定の方法、試薬、化合物、組成物又は生物学的構造に限定されず、これが言うまでもなく変化できることを理解されたい。本明細書で使用される用語は、特定の実施形態を説明することのみを目的とし、限定するものではないことも理解されたい。
【0146】
また、マーカッシュグループに関して開示の特徴又は態様を述べる場合、その開示はマーカッシュグループの個々のメンバ又はメンバのサブグループに関しても述べられることが、当業者には認識される。
【0147】
当業者には理解されるように、いかなる意味でも、特に書面による説明の提供に関して、本明細書で開示された範囲はすべて、任意かつすべての可能な部分範囲及びその部分範囲の組合せも含む。列挙されたいかなる範囲も、同じ範囲を少なくとも均等の2分の1、3分の1、4分の1、5分の1、10分の1などに分割することを十分に説明し、それを可能にすると容易に認識することができる。非限定的な例として、本明細書で検討した各範囲は、下位3分の1、中位3分の1及び上位3分の1などに容易に分割することができる。も当業者に理解されるように、「最大」、「少なくとも」、「より大きい」、「未満」などの言語はすべて、列挙された数を含み、以上で検討したように後で部分範囲に分割することができる範囲を指す。最後に、当業者に理解されるように、ある範囲は個々の数をそれぞれ含み、範囲を示す最初と最後の数字を含む。
【0148】
本明細書で言及されたすべての出版物、特許出願、発行された特許、又は他の文書は、個々の各出版物、特許出願、発行された特許、又は他の文書が参照により全体が特に個別に組み込まれたかのように、参照により本明細書に組み込まれる。参照により組み込まれた文章に含まれる定義は、本開示の定義と矛盾する場合は除外される。
【0149】
他の実施形態は、添付の特許請求の範囲に記載されている。
【特許請求の範囲】
【請求項1】
式Iの化合物、その薬学的に許容可能な塩、又は溶媒和化合物。
【化1】

(式中、
Rは、H、アンモニウムイオン、アルキルアンモニウムイオン、アルカリ土類金属イオン、希土類金属イオン、又はアルキル基であり、
Wは、結合、−NHC(O)−、−CH(NH2)−、−NH−C(O)−NH−、−C(O)−NH−、−C(O)−NH−CH(COOH)−、−O−(CH2)n−O−(CH2)n−、−(CH2)nO(CH2)nO(CH2)n−、−CH(NHFmoc)−であり、
Zは、結合、−CO(O)−、−NH−、−NHC(O)−、−NH−C(O)−NH−、−NH−C(O)(CH2)n−、−NH−C(O)−CH(NH2)−、−C(O)−NH−CH(COOH)−、又は−NH−C(O)−C6H4−(CH2)n−NH−であり、
NRaRbは、下式のいずれかのキレート基であり、
【化2】

Rtは、H、C1−C8アルキル基、アンモニウムイオン、アルキルアンモニウムイオン、又はアルカリ若しくはアルカリ土類金属イオンであり、
Rvは、アルキルであり、
eは、0から15の整数であり、
fは、0から15の整数であり、
gは、0から15の整数であり、
nは、0から10の整数であり、
ただし、NRaRbが下式のいずれかであり、
【化3】

Wが結合である場合、Zは結合、−C(O)−NH−、又は−NHC(O)−以外であり、Zが結合である場合、Wは結合、−C(O)−NH−、又は−NHC(O)−以外である。)
【請求項2】
Rvが、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、又はtert−ブチルである、請求項1に記載の化合物。
【請求項3】
Rvがメチルである、請求項2に記載の化合物。
【請求項4】
Rtがそれぞれ独立に、H又はtert−ブチルである、請求項1に記載の化合物。
【請求項5】
RtがHである、請求項4に記載の化合物。
【請求項6】
eが0から4の整数であり、fが0から12の整数であり、gが0から6の整数である、請求項1に記載の化合物。
【請求項7】
Wが−C(O)−NH−である、請求項1に記載の化合物。
【請求項8】
下式のいずれか、
【化4】

【化5】

又はその薬学的に許容可能な塩若しくは溶媒和化合物であり、
eが0から10の整数であり、
fが0から12の整数であり、
gが0から12の整数であり、
nが0から10の整数である、
請求項1に記載の化合物。
【請求項9】
Zが−NH−C(O)−である、請求項1に記載の化合物。
【請求項10】
Zが−C(O)−NH−CH(COOH)−である、請求項1に記載の化合物。
【請求項11】
Zが−NH−C(O)−CH(NH2)−である、請求項1に記載の化合物。
【請求項12】
金属及び請求項1の前記化合物を含む錯体。
【請求項13】
前記金属が、Re、Tc、Y、Lu、Ga、In又はCuである、請求項12に記載の錯体。
【請求項14】
前記金属が放射性核種である、請求項12に記載の錯体。
【請求項15】
前記金属が、テクネチウム−99m、レニウム−186、又はレニウム−188である、請求項14に記載の錯体。
【請求項16】
NRaRbが下式であり、
【化6】

前記金属が、Y、Ga、Lu、In及びCuからなる群から選択される、請求項12に記載の錯体。
【請求項17】
下式のいずれか、
【化7】

【化8】

【化9】

又はその薬学的に許容可能な塩若しくは溶媒和化合物であり、
Mが、Re、Tc、Y、Lu、Ga、In又はCuであり、
eが0から10の整数であり、
fが0から12の整数であり、
gが0から12の整数であり、
nが0から10の整数である、
請求項12に記載の錯体。
【請求項18】
請求項1〜17のいずれか1項に記載の化合物、その薬学的に許容可能な塩又は溶媒和化合物、及び薬学的に許容可能な補形剤を含む医薬組成物。
【請求項19】
患者内の部位を撮像する方法であって、
診断上有効な量の請求項1〜18のいずれか1項に記載の化合物、その薬学的に許容可能な塩又は溶媒和化合物を患者に投与するステップと、
前記患者の前記部位の像を入手するステップと
を含む方法。
【請求項20】
脾臓組織、腎臓組織、及びPSMA発現腫瘍組織から選択される組織を撮像する方法であって、
放射性金属及び下式のいずれかの基を含む化合物、
【化10】

又はその薬学的に許容可能な塩若しくは溶媒和化合物を含む錯体に前記組織を接触させるステップを含む方法。
【請求項21】
前記組織が、PSMA発現腫瘍組織である、請求項20に記載の方法。
【請求項1】
式Iの化合物、その薬学的に許容可能な塩、又は溶媒和化合物。
【化1】

(式中、
Rは、H、アンモニウムイオン、アルキルアンモニウムイオン、アルカリ土類金属イオン、希土類金属イオン、又はアルキル基であり、
Wは、結合、−NHC(O)−、−CH(NH2)−、−NH−C(O)−NH−、−C(O)−NH−、−C(O)−NH−CH(COOH)−、−O−(CH2)n−O−(CH2)n−、−(CH2)nO(CH2)nO(CH2)n−、−CH(NHFmoc)−であり、
Zは、結合、−CO(O)−、−NH−、−NHC(O)−、−NH−C(O)−NH−、−NH−C(O)(CH2)n−、−NH−C(O)−CH(NH2)−、−C(O)−NH−CH(COOH)−、又は−NH−C(O)−C6H4−(CH2)n−NH−であり、
NRaRbは、下式のいずれかのキレート基であり、
【化2】

Rtは、H、C1−C8アルキル基、アンモニウムイオン、アルキルアンモニウムイオン、又はアルカリ若しくはアルカリ土類金属イオンであり、
Rvは、アルキルであり、
eは、0から15の整数であり、
fは、0から15の整数であり、
gは、0から15の整数であり、
nは、0から10の整数であり、
ただし、NRaRbが下式のいずれかであり、
【化3】

Wが結合である場合、Zは結合、−C(O)−NH−、又は−NHC(O)−以外であり、Zが結合である場合、Wは結合、−C(O)−NH−、又は−NHC(O)−以外である。)
【請求項2】
Rvが、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、イソブチル、又はtert−ブチルである、請求項1に記載の化合物。
【請求項3】
Rvがメチルである、請求項2に記載の化合物。
【請求項4】
Rtがそれぞれ独立に、H又はtert−ブチルである、請求項1に記載の化合物。
【請求項5】
RtがHである、請求項4に記載の化合物。
【請求項6】
eが0から4の整数であり、fが0から12の整数であり、gが0から6の整数である、請求項1に記載の化合物。
【請求項7】
Wが−C(O)−NH−である、請求項1に記載の化合物。
【請求項8】
下式のいずれか、
【化4】

【化5】

又はその薬学的に許容可能な塩若しくは溶媒和化合物であり、
eが0から10の整数であり、
fが0から12の整数であり、
gが0から12の整数であり、
nが0から10の整数である、
請求項1に記載の化合物。
【請求項9】
Zが−NH−C(O)−である、請求項1に記載の化合物。
【請求項10】
Zが−C(O)−NH−CH(COOH)−である、請求項1に記載の化合物。
【請求項11】
Zが−NH−C(O)−CH(NH2)−である、請求項1に記載の化合物。
【請求項12】
金属及び請求項1の前記化合物を含む錯体。
【請求項13】
前記金属が、Re、Tc、Y、Lu、Ga、In又はCuである、請求項12に記載の錯体。
【請求項14】
前記金属が放射性核種である、請求項12に記載の錯体。
【請求項15】
前記金属が、テクネチウム−99m、レニウム−186、又はレニウム−188である、請求項14に記載の錯体。
【請求項16】
NRaRbが下式であり、
【化6】

前記金属が、Y、Ga、Lu、In及びCuからなる群から選択される、請求項12に記載の錯体。
【請求項17】
下式のいずれか、
【化7】

【化8】

【化9】

又はその薬学的に許容可能な塩若しくは溶媒和化合物であり、
Mが、Re、Tc、Y、Lu、Ga、In又はCuであり、
eが0から10の整数であり、
fが0から12の整数であり、
gが0から12の整数であり、
nが0から10の整数である、
請求項12に記載の錯体。
【請求項18】
請求項1〜17のいずれか1項に記載の化合物、その薬学的に許容可能な塩又は溶媒和化合物、及び薬学的に許容可能な補形剤を含む医薬組成物。
【請求項19】
患者内の部位を撮像する方法であって、
診断上有効な量の請求項1〜18のいずれか1項に記載の化合物、その薬学的に許容可能な塩又は溶媒和化合物を患者に投与するステップと、
前記患者の前記部位の像を入手するステップと
を含む方法。
【請求項20】
脾臓組織、腎臓組織、及びPSMA発現腫瘍組織から選択される組織を撮像する方法であって、
放射性金属及び下式のいずれかの基を含む化合物、
【化10】

又はその薬学的に許容可能な塩若しくは溶媒和化合物を含む錯体に前記組織を接触させるステップを含む方法。
【請求項21】
前記組織が、PSMA発現腫瘍組織である、請求項20に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2012−511023(P2012−511023A)
【公表日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願番号】特願2011−539755(P2011−539755)
【出願日】平成21年12月4日(2009.12.4)
【国際出願番号】PCT/US2009/066836
【国際公開番号】WO2010/065902
【国際公開日】平成22年6月10日(2010.6.10)
【出願人】(507412863)モレキュラ インサイト ファーマシューティカルズ インコーポレイテッド (11)
【Fターム(参考)】
【公表日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願日】平成21年12月4日(2009.12.4)
【国際出願番号】PCT/US2009/066836
【国際公開番号】WO2010/065902
【国際公開日】平成22年6月10日(2010.6.10)
【出願人】(507412863)モレキュラ インサイト ファーマシューティカルズ インコーポレイテッド (11)
【Fターム(参考)】
[ Back to top ]

