新規メタスチン同族体およびその用途
【課題】新規メタスチン同族体とその用途を提供する。
【解決手段】本発明は配列番号3又は4に列挙されるアミノ酸配列からなるペプチドを提供する。本発明のペプチドはC末端がアミド化されている場合がある。本発明は、本発明のペプチドをエンコードするポリヌクレオチドと、該ポリヌクレオチドを含み、本発明のペプチドを産生する発現コンストラクトと、該発現コンストラクトを含み、本発明のペプチドを産生する宿主細胞と、これらのうち少なくとも1つを含む、疾患を予防又は治療するための医薬品組成物とを提供する。本発明は、本発明のペプチドと特異的に結合する抗体と、該抗体を含む疾患の診断用キットと、ヒト又はヒト以外の動物の疾患の予防又は治療方法であって、本発明の医薬品組成物と、本発明の抗体とのうち少なくとも1つを投与するステップを含む、予防又は治療方法とを提供する。
【解決手段】本発明は配列番号3又は4に列挙されるアミノ酸配列からなるペプチドを提供する。本発明のペプチドはC末端がアミド化されている場合がある。本発明は、本発明のペプチドをエンコードするポリヌクレオチドと、該ポリヌクレオチドを含み、本発明のペプチドを産生する発現コンストラクトと、該発現コンストラクトを含み、本発明のペプチドを産生する宿主細胞と、これらのうち少なくとも1つを含む、疾患を予防又は治療するための医薬品組成物とを提供する。本発明は、本発明のペプチドと特異的に結合する抗体と、該抗体を含む疾患の診断用キットと、ヒト又はヒト以外の動物の疾患の予防又は治療方法であって、本発明の医薬品組成物と、本発明の抗体とのうち少なくとも1つを投与するステップを含む、予防又は治療方法とを提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規メタスチン同族体に関し、具体的には、KiSS−2ペプチドと、該ペプチドをエンコードするポリヌクレオチドと、該ポリヌクレオチドを含む発現コンストラクトと、これらを含む、疾患を治療するための組成物と、該組成物を投与するステップを含む疾患の治療方法と、前記ペプチドに対する抗体と、該抗体を含む疾患の診断用キットとに関する。
【背景技術】
【0002】
キスペプチンはオーファンレセプターのGPR54の内因性リガンドとして発見された(非特許文献1、2及び3)。KiSS−1遺伝子には癌転移(metastasis)抑制作用があることから、当該遺伝子の産物であるキスペプチンは癌治療に役立つと当初考えられ、生体内から分離精製されたアミノ酸54個からなるKiSS−1遺伝子産物の部分断片でC末端がアミド化されたペプチドはメタスチンと命名された。しかし、GPR54レセプターの異常が低ゴナドトロピン・性腺機能低下症と密接に結びついていることが報告され、メタスチンは性成熟に重要なペプチドであることが示された(非特許文献4)。その後、メタスチンは中枢神経系、特に視床下部で強く発現しており、生殖腺刺激ホルモン放出ホルモン(GnRH)のニューロンに直接働いてGnRHの発現・分泌を促進する作用があることが判明した(非特許文献5)。このようにメタスチンは視床下部−下垂体−性腺軸の生殖神経内分泌系において重要な働きを持つペプチドである。
【非特許文献1】Welch, D. R.ら、(1994) Oncogene 9: 255-262.
【非特許文献2】Lee, J.-H.ら、(1996) J. Nat. Cancer Inst. 88: 1731-1737, 1996.
【非特許文献3】Ohtaki, T.ら、(2001) Nature 411: 613-617.
【非特許文献4】Seminara, S. B.ら、(2003) New Eng. J. Med. 349: 1614-1627.
【非特許文献5】Kinoshita, M.ら、(2005) Endocrinology 146: 4431-4436, 2005. ヒトのKiSS−1遺伝子は、145個のアミノ酸からなるタンパク質をコードしており、このうちN末端の19個のアミノ酸はシグナルペプチドで、第68番目から第121番目までの54個のアミノ酸からなるタンパク質が切り出されたものがメタスチンである。以下では、KiSS遺伝子産物のタンパク質を「キスペプチン」といい、キスペプチンの第68番目から第121番目までの54個のアミノ酸からなるキスペプチン断片を「キスペプチン68−121」と表す。同様にメタスチンについても第45番目のアミノ酸から第54番目のアミノ酸までの10個のアミノ酸からなるペプチドを「メタスチン45−54」と表す(非特許文献6及び7)。キスペプチン68−121はメタスチン1−54と同一のペプチドであり、メタスチン45−54はキスペプチン112−121と同一のペプチドである。メタスチンのC末端がアミド化されない場合にはGPR54レセプターへのアゴニスト活性は非常に減弱するが、C末端がアミド化されていればN末端アミノ酸が除去されていてもGPR54レセプターへのアゴニスト活性を有する。実際、メタスチン40−54や、メタスチン45−54でもGPR54レセプターへのアゴニスト活性はメタスチンよりも3倍ないし10倍アゴニスト活性が高い(非特許文献3)。GPR54レセプターへのアゴニスト活性を有する最短のキスペプチン断片であるキスペプチン112−121又はメタスチン45−54をそれぞれキスペプチン−10又はメタスチン−10と表す。キスペプチン68−121又はメタスチン1−54をキスペプチン−54又はメタスチン−54と表す。
【非特許文献6】Seminara, S. B.(2005)J. Clin. Endocr. Metab. 90: 6738-6740.
【非特許文献7】Dhillo, W. S.ら、(2005)J. Clin. Endocr. Metab. 90: 6609-6615. メタスチン−10又はメタスチン−54はともにC末端がアルギニン−フェニルアラニン−NH2であるが、これと同一のC末端構造を有するペプチドのファミリーが存在する。アルギニン及びフェニルアラニンの1文字表記であるR及びFと末端アミド基を有することからRFアミドペプチドと総称される。RFアミドペプチドには、鳥類の脳ペプチド(gonadotropin-inhibitory hormone)のように生殖腺刺激ホルモンの放出を抑制する作用を有するものがある(非特許文献8)が、摂食行動に関与するRFアミドペプチドも知られている(非特許文献9)。KiSS遺伝子及びGPR54遺伝子はともに膵臓で強く発現する(非特許文献3)が、GPR54遺伝子のノックアウトマウスは生殖機能以外には異常がみられない(非特許文献4)。そこで、メタスチンとそのレセプターであるGPR54遺伝子産物とが関与する経路には代替的な経路が存在し、未知の機能を担っている可能性がある。かかる代替的経路にはメタスチンと類似のアミノ酸配列を有するC末端がアミド化されたペプチドホルモン、すなわちメタスチンと同じファミリーに属する同族体が関与すると考えられる。
【非特許文献8】Tsutsui, K.ら、(2000)Biochem. Biophys. Res. Commun. 275: 661-667.
【非特許文献9】Dockray, G.J.(2004)Exp. Physiol. 89: 229-235.
【発明の開示】
【発明が解決しようとする課題】
【0003】
そこで、発明者らは新規メタスチン同族体を探索し、KiSS−1のサブファミリーであるKiSS−1a及びKiSS−1bと、KiSS−1とは異なる別のファミリーメンバーであるKiSS−2の遺伝子及びその産物であるペプチドを発見した。本発明はこの発見に基づいて新規メタスチン同族体とその用途を提供することを課題とする。
【課題を解決するための手段】
【0004】
本発明は配列番号3又は4に列挙されるアミノ酸配列からなるペプチドを提供する。
【0005】
本発明のペプチドはC末端がアミド化されている場合がある。
【0006】
本発明は、本発明のペプチドをエンコードするポリヌクレオチドを提供する。
【0007】
本発明は、本発明のポリヌクレオチドを含み、本発明のペプチドを産生する発現コンストラクトを提供する。
【0008】
本発明は、本発明の発現コンストラクトを含み、本発明のペプチドを産生する宿主細胞を提供する。
【0009】
本発明は、本発明のペプチドと、該ペプチドの塩と、前記ペプチド又はその塩のプロドラッグと、本発明のポリヌクレオチドと、本発明の発現コンストラクトと、本発明の宿主細胞とからなるグループから選択される少なくとも1つを含む、疾患を予防又は治療するための医薬品組成物を提供する。
【0010】
本発明の医薬品組成物において、前記疾患は生殖機能障害の場合がある。
【0011】
本発明の医薬品組成物において、前記疾患は癌又は腫瘍の場合がある。
【0012】
本発明は、本発明のペプチドと特異的に結合する抗体を提供する。
【0013】
本発明の抗体は、モノクローナル抗体の場合がある。
【0014】
本発明は、本発明の抗体を含む疾患の診断用キットを提供する。
【0015】
本発明の診断用キットにおいて、前記疾患は生殖機能障害の場合がある。
【0016】
本発明の診断用キットにおいて、前記疾患は癌又は腫瘍の場合がある。
【0017】
本発明は、ヒト又はヒト以外の動物の疾患の予防又は治療方法であって、本発明の医薬品組成物と、本発明の抗体とのうち少なくとも1つを投与するステップを含む、予防又は治療方法を提供する。
【0018】
本発明の予防又は治療方法において、前記疾患は生殖機能障害の場合がある。
【0019】
本発明の予防又は治療方法において、前記疾患は癌又は腫瘍の場合がある。
【0020】
本明細書において「タンパク質」、「ペプチド」、「オリゴペプチド」又は「ポリペプチド」とは、2個以上のアミノ酸がペプチド結合で連結した化合物である。「タンパク質」、「ペプチド」、「オリゴペプチド」又は「ポリペプチド」は、メチル基を含むアルキル基、リン酸基、糖鎖、及び/又は、エステル結合その他の共有結合による修飾を含む場合がある。また、「タンパク質」、「ペプチド」、「オリゴペプチド」又は「ポリペプチド」は、金属イオン、補酵素、アロステリックリガンドその他の原子、イオン、原子団か、他の「タンパク質」、「ペプチド」、「オリゴペプチド」又は「ポリペプチド」か、糖、脂質、核酸等の生体高分子か、ポリスチレン、ポリエチレン、ポリビニル、ポリエステルその他の合成高分子かを共有結合又は非共有結合により結合又は会合している場合がある。
【0021】
本明細書でアミノ酸を表す場合、L−アスパラギン、L−グルタミン等の化合物名で表す場合と、Asn、Gln等の慣用の3文字表記で表す場合とがある。化合物名で表す場合には、アミノ酸のα炭素に関する立体配置を示す接頭辞(L−又はD−)を用いて表す。慣用の3文字表記で表す場合には、該3文字表記は特に断りのない限りL体のアミノ酸を表す。本明細書において、アミノ酸は、アミノ基とカルボキシル基とが少なくとも1個の炭素原子を介して結合した化合物であって、ペプチド結合により重合することが可能ないずれかの化合物を指す。本明細書におけるアミノ酸は、生体内でメッセンジャーRNAからリボゾームで合成されるタンパク質の翻訳に用いられる20種類のL−アミノ酸とこれらの立体異性体であるD−アミノ酸とを含むがこれらに限定されない、いずれかの天然又は非天然のアミノ酸を含む場合がある。
【0022】
また、本明細書でペプチドを表す場合、ペプチドを構成するアミノ酸残基は、慣用の3文字表記で示され、ハイフンで結んで表される。例えば2個のアミノ酸の3文字表記がハイフンで結ばれて表される場合には、左側のアミノ酸のカルボキシル基と右側のアミノ酸のアミノ基とがペプチド結合したジペプチドであることを表す。したがってAsn−Alaは、L−アスパラギンのカルボキシル基とL−アラニンのアミノ基とがペプチド結合したジペプチドであって、L−アスパラギンのアミノ基とL−アラニンのカルボキシル基は修飾されていないことを意味する。本明細書において、C末端がアミド化されたペプチドは「Arg−Phe−NH2」のように表記する。アミノ酸配列を配列番号を示して引用するアミノ酸配列からなるペプチドは、C末端がアミド化されている場合と、アミド化されていない場合とを含む。
【0023】
本発明のペプチドは、動物の組織から精製して調製される場合がある。代替的には、本発明のペプチドのアミノ酸配列をエンコードするヌクレオチド配列からなるポリヌクレオチドを、無生物発現系か、宿主生物及び発現ベクターを使用する発現系で発現させることにより産生される。前記宿主生物は、大腸菌、枯草菌等のような原核生物と、酵母、菌類、植物、動物等のような真核生物とを含む。本発明の宿主生物及び発現ベクターを使用する発現系は、細胞や組織のような生物の一部か、生物の個体全体かの場合がある。本発明のペプチドは、GPR54レセプターへのアゴニスト活性を有することを条件として、無生物発現系又は宿主生物及び発現ベクターを使用する発現系の他の成分が混在する状態で本発明の医薬品組成物に使用されてもよく、あるいは、精製された状態で本発明の医薬品組成物に使用されてもよい。
【0024】
本発明の医薬品組成物と、診断用キットと、治療方法との対象となる疾患は、生殖機能障害と、マトリックスメタロプロテイナーゼ活性の調節異常と、走化性その他の細胞遊走の異常と、細胞外マトリクスの分解その他細胞の行動異常と、癌又は腫瘍と、糖尿病その他の糖代謝異常と、高脂血症その他の脂質代謝異常と、急性もしくは慢性膵炎と、高血圧症、脳梗塞、心筋梗塞、動脈硬化その他の心臓循環器系疾患と、肥満、食欲減退、食欲亢進その他の摂食行動の異常とを含む。生殖機能障害には、1次性徴及び/又は2次性徴の異常を含む生殖腺の発生及び/又は分化の異常と、性行動の異常と、月経異常その他の排卵異常と、受精又は卵割の異常と、着床の異常を含む妊娠異常と、乳腺の絨毛癌、胞状奇胎、胎児の発育不全と、侵入奇胎その他の胎盤の形成及び/又は機能の異常と、切迫流産その他分娩誘発の異常とを含むがこれらに限られない。前記癌又は腫瘍は、絨毛癌、胞状奇胎、トロホブラストーマ、前立腺癌、精巣腫瘍、卵巣腫瘍、乳癌、子宮内膜症、子宮筋腫、膵癌、胆嚢癌、胆管癌、大腸癌、食道癌、胃癌、肝癌、悪性メラノーマ、骨肉腫、甲状腺乳頭癌を含むがこれらに限られない。
【0025】
本発明の抗体は、ポリクローナル抗体又はモノクローナル抗体と、該抗体の抗原結合断片と、該抗原結合断片を含むキメラ抗体又は組換え抗体とからなるグループから選択される場合がある。抗体の抗原結合断片は、抗原結合に参加する抗体の部分を指す。前記抗原結合部位は、重(H)鎖及び軽(L)鎖のN末端の可変(V)領域のアミノ酸残基によって形成される。
【0026】
抗体は、当業者に知られたさまざまな技術によって調製される場合がある。例えば、Harlow及びLane、Antibodies: A Laboratory Manual、Cold Spring Harbor Laboratory、1988を参照せよ。
【0027】
本発明で用いられるポリクローナル抗体は、本発明のペプチドを免疫原として、ほ乳類(例えば、マウス、ラット、ウサギ、ヒツジ又はヤギ)又は鳥類(例えばニワトリ)のいずれかの動物宿主に注射される。ウシ血清アルブミン又はスカシ貝ヘモシアニン(keyhole limpet hemocyanine)のような担体タンパク質と連結される場合に優れた免疫応答が誘発される場合がある。前記免疫原は、1回又は2回以上のブースター免疫を取り込んだ予め定められたスケジュールに従って、前記動物宿主に注射されることが好ましい。前記免疫原は、完全又は不完全フロイントアジュバントその他の免疫増強剤に混合して前記動物宿主に注射される場合がある。本発明のポリクローナル抗体は、かかる抗血清から、例えば適当な固体支持体に結合された本発明のペプチドを用いるアフィニティクロマトグラフィーによって精製される場合がある。
【0028】
本発明で用いられるモノクローナル抗体は、Kohler及びMilstein、Eur.J.Immunol.6:511-519、1976の技術と、その改良技術を用いて調製される場合がある。これらの方法は、所望の特異性を有する抗体を産生できる不死性細胞株の調製を伴う。かかる細胞株は上記のとおり免疫された動物宿主由来の脾臓細胞から作成される場合がある。前記脾臓細胞は、さまざまな方法で不死化され、抗体産生能を有する不死化細胞株が調製される。前記脾臓細胞は、例えば、前記免疫された動物と同種かあるいは異種の動物由来のミエローマ細胞との融合によって不死化される。当業者に周知のさまざまな融合技術を用いる場合がある。例えば、前記脾臓細胞とミエローマ細胞とは非イオン性界面活性剤と数分間混合され、それからハイブリッド細胞の増殖は支持するがミエローマ細胞の増殖は支持しない選択培地に低濃度でプレートされる。好ましい選択技術はHAT(ヒポキサンチン、アミノプテリン、チミジン)選択を用いる。通常約1ないし2週間の十分な時間の後、ハイブリッドのコロニーが観察される。シングルコロニーが選択され、その培養上清が前記ポリペプチドに対する結合活性についてテストされる。反応性及び特異性が高いハイブリドーマが好ましい。限界希釈法によるクローニングを繰り返すことにより、反応性及び特異性が高い抗体を安定的に大量に産生するハイブリドーマのクローンが選択される。モノクローナル抗体は増殖中の選択されたハイブリドーマクローン由来の細胞株のコロニーの上清から単離される場合がある。さらに、マウスのような適当な脊椎動物宿主の腹腔内に前記ハイブリドーマ細胞株を注射するような、収率を向上させるためのさまざまな技術が用いられる場合がある。モノクローナル抗体は前記ハイブリドーマ細胞腹水又は血液から回収される場合がある。汚染物は、クロマトグラフィー、ゲルろ過、沈殿及び抽出のような従来技術によって前記抗体から除去される場合がある。
【0029】
本発明で用いられる抗体の抗原結合断片は、それぞれタンパク質分解酵素パパイン又はペプシンでインタクトなポリクローナル抗体又はモノクローナル抗体を分解して得られるFab断片又はF(ab’)2断片の他、天然抗体分子の抗原認識能及び結合能の多くを保持する抗原結合部位を含む非共有結合的なVH及びVL領域のヘテロ2量体を含むFv断片を含む。
【0030】
本発明で用いられる組換え抗体は、適当な細菌宿主への形質転換か、適当なほ乳類細胞宿主へのトランスフェクションかを含む抗体遺伝子の発現クローニングによって調製される場合がある。本発明で用いられるキメラ抗体は、前記本発明の組換え抗体の抗原結合部位が本発明のペプチドと特異的に結合できるように同種又は異種の抗体の定常ドメインによって支持された融合タンパク質である。本発明で用いられるキメラ抗体には、抗体軽鎖可変領域(VL)に操作可能に連結された抗体重鎖可変領域(VH)を含む短鎖可変部抗体(scFv)と、ラクダ科(Camelidae、ラクダ、ヒトコブラクダ、ラマを含む)の動物が産生する軽鎖がないIgGのクラスであるラクダ重鎖抗体(HCAb)又はその重鎖可変部ドメイン(VHH)とを含む。本発明の組換え抗体は原核生物及び真核生物由来の遺伝子発現システムを用いて大量に調製することができる。
【0031】
本発明のペプチドの塩としては、例えば金属塩、アンモニウム塩、有機塩基との塩、無機酸との塩、有機酸との塩、塩基性または酸性アミノ酸との塩等が挙げられる。金属塩の好適な例としては、例えばナトリウム塩、カリウム塩等のアルカリ金属塩;カルシウム塩、マグネシウム塩、バリウム塩等のアルカリ土類金属塩;アルミニウム塩等が挙げられる。有機塩基との塩の好適な例としては、例えばトリメチルアミン、トリエチルアミン、ピリジン、ピコリン、2,6−ルチジン、エタノールアミン、ジエタノールアミン、トリエタノールアミン、シクロヘキシルアミン、ジシクロヘキシルアミン、N,N'−ジベンジルエチレンジアミン等との塩が挙げられる。無機酸との塩の好適な例としては、例えば塩酸、臭化水素酸、硝酸、硫酸、リン酸等との塩が挙げられる。有機酸との塩の好適な例としては、例えばギ酸、酢酸、トリフルオロ酢酸、フタル酸、フマル酸、シュウ酸、酒石酸、マレイン酸、クエン酸、コハク酸、リンゴ酸、メタンスルホン酸、ベンゼンスルホン酸、p−トルエンスルホン酸等との塩が挙げられる。塩基性アミノ酸との塩の好適な例としては、例えばアルギニン、リジン、オルニチン等との塩が挙げられ、酸性アミノ酸との塩の好適な例としては、例えばアスパラギン酸、グルタミン酸等との塩が挙げられる。このうち、薬学的に許容し得る塩が好ましい。例えば、化合物内に酸性官能基を有する場合にはアルカリ金属塩(例、ナトリウム塩、カリウム塩等)、アルカリ土類金属塩(例、カルシウム塩、マグネシウム塩、バリウム塩等)等の無機塩、アンモニウム塩等が、また、化合物内に塩基性官能基を有する場合には、例えば塩酸、臭化水素酸、硝酸、硫酸、リン酸等無機酸との塩、または酢酸、フタル酸、フマル酸、シュウ酸、酒石酸、マレイン酸、クエン酸、コハク酸、メタンスルホン酸、p−トルエンスルホン酸等の有機酸との塩が好ましい。
【0032】
本発明のペプチド又はその塩のプロドラッグは、生体内における生理条件下で酵素や胃酸等による反応により本発明のペプチドに変換するペプチド又はその誘導体、すなわち酵素的に酸化、還元、加水分解等を起こして本発明のペプチドに変化するペプチド又はその誘導体、例えば、胃酸等により加水分解等を起こして本発明のペプチド又はその塩に変化するペプチド又はその誘導体をいう。本発明のペプチド又はその塩のプロドラッグは、本発明のペプチドのアミノ基がアシル化、アルキル化、リン酸化されたペプチド又はその誘導体(例えば、本発明のペプチドのアミノ基がエイコサノイル化、アラニル化、ペンチルアミノカルボニル化、(5−メチル−2−オキソ−1,3−ジオキソレン−4−イル)メトキシカルボニル化、テトラヒドロフラニル化、ピロリジルメチル化、ピバロイルオキシメチル化、tert−ブチル化されたペプチド誘導体等)と、本発明のペプチドの水酸基がアシル化、アルキル化、リン酸化、ホウ酸化されたペプチド誘導体(例えば、本発明ペプチドの水酸基がアセチル化、パルミトイル化、プロパノイル化、ピバロイル化、スクシニル化、フマリル化、アラニル化、ジメチルアミノメチルカルボニル化されたペプチド誘導体等)と、本発明のペプチドのカルボキシル基がエステル化、アミド化されたペプチド誘導体(例えば、本発明のペプチドのカルボキシル基がエチルエステル化、フェニルエステル化、カルボキシメチルエステル化、ジメチルアミノメチルエステル化、ピバロイルオキシメチルエステル化、エトキシカルボニルオキシエチルエステル化、フタリジルエステル化、(5−メチル−2−オキソ−1,3−ジオキソレン−4−イル)メチルエステル化、シクロヘキシルオキシカルボニルエチルエステル化、メチルアミド化されたペプチド誘導体等)とを含むが、これらに限られない。これらのペプチド誘導体は公知の方法によって本発明のペプチドから製造することができる。本発明のプロドラッグは、広川書店1990年刊「医薬品の開発」第7巻分子設計163頁から198頁に記載されているような生理的条件で本発明のペプチドに変化するものであってもよい。
【0033】
本発明の医薬品組成物は、毒性が低く、医薬製剤の製造法で一般的に用いられている自体公知の手段に従って、本発明の化合物をそのままあるいは薬理学的に許容される担体と混合して、例えば、錠剤(糖衣錠、フィルムコーティング錠を含む)、散剤、顆粒剤、カプセル剤、(ソフトカプセルを含む)、液剤、注射剤、坐剤、徐放剤等の医薬製剤として、経口的または非経口的(例、局所、直腸、静脈投与等)に安全に投与することができる。本発明の化合物の本発明製剤中の含有量は、製剤全体の約0.01ないし約100重量%である。本発明の化合物の投与量は、投与対象、対象臓器、症状、投与方法などにより差異はあるが、経口投与の場合、一般的に、癌患者(体重60kgとして)に対して、一日につき約0.1〜100mg、好ましくは約1.0〜50mg、より好ましくは約1.0〜20mgである。非経口的に投与する場合は、その1回投与量は投与対象、対象臓器、症状、投与方法などによっても異なるが、例えば、注射剤の形では通常、癌患者(体重60kgとして)に対して、一日につき約0.01〜30mg程度、好ましくは約0.1〜20mg程度、より好ましくは約0.1〜10mg程度を静脈注射により投与するのが好都合である。他の動物の場合も、体重60kg当たりに換算した量を投与することができる。
【0034】
本発明の医薬品組成物の製造に用いられてもよい薬理学的に許容される担体は、製剤素材として慣用の各種有機あるいは無機担体物質を含み、例えば固形製剤における賦形剤、滑沢剤、結合剤及び崩壊剤、あるいは液状製剤における溶剤、溶解補助剤、懸濁化剤、等張化剤、緩衝剤及び無痛化剤等を含む。更に必要に応じ、通常の防腐剤、抗酸化剤、着色剤、甘味剤、吸着剤、湿潤剤等の添加物を適宜、適量用いることもできる。賦形剤は、例えば乳糖、白糖、D−マンニトール、デンプン、コーンスターチ、結晶セルロース、軽質無水ケイ酸等が挙げられる。滑沢剤としては、例えばステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、コロイドシリカ等を含む。結合剤は、例えば結晶セルロース、白糖、D−マンニトール、デキストリン、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、デンプン、ショ糖、ゼラチン、メチルセルロース、カルボキシメチルセルロースナトリウム等を含む。崩壊剤は、例えばデンプン、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、カルボキシメチルスターチナトリウム、L−ヒドロキシプロピルセルロース等を含む。溶剤は、例えば注射用水、アルコール、プロピレングリコール、マクロゴール、ゴマ油、トウモロコシ油、オリーブ油等を含む。溶解補助剤は、例えばポリエチレングリコール、プロピレングリコール、D−マンニトール、安息香酸ベンジル、エタノール、トリスアミノメタン、コレステロール、トリエタノールアミン、炭酸ナトリウム、クエン酸ナトリウム等を含む。懸濁化剤は、例えばステアリルトリエタノールアミン、ラウリル硫酸ナトリウム、ラウリルアミノプロピオン酸、レシチン、塩化ベンザルコニウム、塩化ベンゼトニウム、モノステアリン酸グリセリン、等の界面活性剤;例えばポリビニルアルコール、ポリビニルピロリドン、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース等の親水性高分子等を含む。等張化剤は、例えばブドウ糖、 D−ソルビトール、塩化ナトリウム、グリセリン、D−マンニトール等を含む。緩衝剤は、例えばリン酸塩、酢酸塩、炭酸塩、クエン酸塩等の緩衝液等を含む。無痛化剤は、例えばベンジルアルコール等を含む。防腐剤は、例えばパラヒドロキシ安息香酸エステル類、クロロブタノール、ベンジルアルコール、フェネチルアルコール、デヒドロ酢酸、ソルビン酸等を含む。抗酸化剤は、例えば亜硫酸塩、アスコルビン酸、α−トコフェロール等を含む。
【0035】
さらに、本発明の医薬品組成物は、本発明の医薬品組成物以外の薬物と併用して使用することができる。本発明の医薬品組成物と併用し得る薬物(以下、併用薬物と略記する場合がある)としては、例えば、癌治療のための化学療法剤、ホルモン療法剤、免疫療法剤等の薬剤(以下、併用薬剤と略記する)と組み合わせて用いることができる。前記「化学療法剤」は、例えばアルキル化剤、代謝拮抗剤、抗癌性抗生物質、植物由来抗癌剤等を含む。「アルキル化剤」は、例えば、ナイトロジェンマスタード、塩酸ナイトロジェンマスタード−N−オキシド、クロラムブチル、シクロフォスファミド、イホスファミド、チオテパ、カルボコン、トシル酸インプロスルファン、ブスルファン、塩酸ニムスチン、ミトブロニトール、メルファラン、ダカルバジン、ラニムスチン、リン酸エストラムスチンナトリウム、トリエチレンメラミン、カルムスチン、ロムスチン、ストレプトゾシン、ピポブロマン、エトグルシド、カルボプラチン、シスプラチン、ミボプラチン、ネダプラチン、オキサリプラチン、アルトレタミン、アンバムスチン、塩酸ジブロスピジウム、フォテムスチン、プレドニムスチン、プミテパ、リボムスチン、テモゾロミド、トレオスルファン、トロフォスファミド、ジノスタチンスチマラマー、カルボコン、アドゼレシン、システムスチン、ビゼレシン等を含む。「代謝拮抗剤」は、例えば、メルカプトプリン、6−メルカプトプリンリボシド、チオイノシン、メトトレキサート、エノシタビン、シタラビン、シタラビンオクフォスファート、塩酸アンシタビン、5−FU系薬剤(例、フルオロウラシル、テガフール、UFT、ドキシフルリジン、カルモフール、ガロシタビン、エミテフールなど)、アミノプテリン、ロイコボリンカルシウム、タブロイド、ブトシン、フォリネイトカルシウム、レボフォリネイトカルシウム、クラドリビン、エミテフール、フルダラビン、ゲムシタビン、ヒドロキシカルバミド、ペントスタチン、ピリトレキシム、イドキシウリジン、ミトグアゾン、チアゾフリン、アンバムスチン等を含む。「抗癌性抗生物質」は、例えば、アクチノマイシンD、アクチノマイシンC、マイトマイシンC、クロモマイシンA3、塩酸ブレオマイシン、硫酸ブレオマイシン、硫酸ペプロマイシン、塩酸ダウノルビシン、塩酸ドキソルビシン、塩酸アクラルビシン、塩酸ピラルビシン、塩酸エピルビシン、ネオカルチノスタチン、ミスラマイシン、ザルコマイシン、カルチノフィリン、ミトタン、塩酸ゾルビシン、塩酸ミトキサントロン、塩酸イダルビシン等を含む。「植物由来抗癌剤」は、例えば、エトポシド、リン酸エトポシド、硫酸ビンブラスチン、硫酸ビンクリスチン、硫酸ビンデシン、テニポシド、パクリタキセル、ドセタクセル、ビノレルビン等を含む。前記「ホルモン療法剤」は、例えば、ホスフェストロール、ジエチルスチルベストロール、クロロトリアニセリン、酢酸メドロキシプロゲステロン、酢酸メゲストロール、酢酸クロルマジノン、酢酸シプロテロン、ダナゾール、アリルエストレノール、ゲストリノン、メパルトリシン、ラロキシフェン、オルメロキフェン、レボルメロキシフェン、抗エストロゲン(例、クエン酸タモキシフェン、クエン酸トレミフェンなど)、ピル製剤、メピチオスタン、テストロラクトン、アミノグルテチイミド、LH−RHアゴニスト(例、酢酸ゴセレリン、ブセレリン、リュープロレリンなど)、ドロロキシフェン、エピチオスタノール、スルホン酸エチニルエストラジオール、アロマターゼ阻害薬(例、塩酸ファドロゾール、アナストロゾール、レトロゾール、エキセメスタン、ボロゾール、フォルメスタンなど)、抗アンドロゲン(例、フルタミド、ビカルタミド、ニルタミドなど)、5α-レダクターゼ阻害薬(例、フィナステリド、エプリステリドなど)、副腎皮質ホルモン系薬剤(例、デキサメタゾン、プレドニゾロン、ベタメタゾン、トリアムシノロンなど)、アンドロゲン合成阻害薬(例、アビラテロンなど)、レチノイドおよびレチノイドの代謝を遅らせる薬剤(例、リアロゾールなど)等を含み、なかでもLH−RHアゴニスト(例、酢酸ゴセレリン、ブセレリン、リュープロレリンなど)が好ましい。前記「免疫療法剤(BRM)」としては、例えば、ピシバニール、クレスチン、シゾフィラン、レンチナン、ウベニメクス、インターフェロン、インターロイキン、マクロファージコロニー刺激因子、顆粒球コロニー刺激因子、エリスロポイエチン、リンホトキシン、BCGワクチン、コリネバクテリウムパルブム、レバミゾール、ポリサッカライドK、プロコダゾール等を含む。
【0036】
本発明の医薬品組成物と併用薬物とを組み合わせることにより、
(1)本発明の医薬品組成物又は併用薬物を単独で投与する場合に比べて、その投与量を軽減することができる、
(2)患者の症状(軽症、重症など)に応じて、本発明の医薬品組成物と併用する薬物を選択することができる、
(3)本発明の医薬品組成物と作用機序が異なる併用薬物を選択することにより、治療期間を長く設定することができる、
(4)本発明の医薬品組成物と作用機序が異なる併用薬物を選択することにより、治療効果の持続を図ることができる、
(5)本発明の医薬品組成物と併用薬物とを併用することにより、相乗効果が得られる、などの優れた効果を得ることができる。
【0037】
以下、本発明の医薬品組成物と併用薬物を併用して使用することを「本発明の併用剤」と称する。本発明の併用剤の使用に際しては、本発明の化合物と併用薬物の投与時期は限定されず、本発明の化合物またはその医薬組成物と併用薬物またはその医薬組成物とを、投与対象に対し、同時に投与してもよいし、時間差をおいて投与してもよい。併用薬物の投与量は、臨床上用いられている投与量に準ずればよく、投与対象、投与ルート、疾患、組み合わせ等により適宜選択することができる。本発明の併用剤の投与形態は、特に限定されず、投与時に、本発明の医薬品組成物と併用薬物とが組み合わされていればよい。このような投与形態は、例えば、(1)本発明の医薬品組成物と併用薬物とを同時に製剤化して得られる単一の製剤の投与、(2)本発明の医薬品組成物とを別々に製剤化して得られる2種2種の製剤の投与の製剤の同一投与経路での同時投与、(3)本発明の医薬品組成物と併用薬物とを別々に製剤化して得られる2種の製剤の同一投与経路での時間差をおいての投与、(4)本発明の医薬品組成物と併用薬物とを別々に製剤化して得られる2種の製剤の異なる投与経路での同時投与、(5)本発明の医薬品組成物と併用薬物とを別々に製剤化して得られる2種の製剤の異なる投与経路での時間差をおいての投与(例えば、本発明の医薬品組成物;併用薬物の順序での投与、あるいは逆の順序での投与)等を含む。
【0038】
本発明の医薬品組成物又は併用薬物は、固形製剤(例、散剤、顆粒剤、錠剤、カプセル剤)などの経口投与用製剤か、坐剤などの直腸投与用製剤か、注射用製剤かの剤形で製造される場合がある。本発明の医薬品組成物又は併用薬物は、徐放性マイクロカプセル剤等の徐放性製剤として製造される場合がある。あるいは、ポリエチレングリコール付加その他の薬物送達技術を適用した製剤として製造される場合がある。
【0039】
本発明の疾患の治療方法は、ヒトに施される場合がある。あるいは、ヒト以外の動物に施される場合がある。
【発明を実施するための最良の形態】
【0040】
以下の実施例によって本発明について詳細な説明を行なうが、本発明はこれらの実施例により何ら制限されるものではない。
【0041】
材料及び方法
(使用したペプチド)
ヒト(Homo sapiens)のKiSS−10(H−10;配列番号1のアミノ酸配列を有しC末端がアミド化されたペプチド)と、齧歯類のKiSS−10Y(R−10;配列番号2のアミノ酸配列を有しC末端がアミド化されたペプチド)と、アフリカツメガエル(Xenopus laevis)のKiSS−10F(X2−10;配列番号3のアミノ酸配列を有しC末端がアミド化されたペプチド)と、アフリカツメガエルのKiSS−12F(X2−12F;配列番号4のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ゼブラフィッシュ(Danio rerio)のZ1−10(配列番号5のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ゼブラフィッシュのZ1−15(配列番号6のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ゼブラフィッシュのZ1−p15(配列番号7のアミノ酸配列を有し、N末端がピログルタミン酸化され、C末端がアミド化されたペプチド)と、ゼブラフィッシュのZ2−10(配列番号8のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ゼブラフィッシュのZ2−12(配列番号9のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ネッタイツメガエル(Xenopus tropicalis)のX1a−14(配列番号10のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ネッタイツメガエルのX1b−p15(配列番号11のアミノ酸配列を有し、N末端がピログルタミン酸化され、C末端がアミド化されたペプチド)とを、Anygen(韓国)から購入した。
【0042】
(使用したプラスミド)
pcDNA3発現ベクターを、Invitrogenから購入した。pCMVβ−Galベクターを、Clontechから取得した。シグナル伝達特異的レポーターベクターCRE−luc及びSRE−lucを、Stratageneから購入した。Institut de Recherche Interdisciplinare(ベルギー、ブリュッセル)のMarc Parmentier博士から分譲されたhGPR54のcDNAをpcDNA3発現ベクターにリクローニングした。
【0043】
(動物及び組織の調製)
ネッタイツメガエルの成体と、アフリカツメガエルの成体とは、それぞれ、Xenopusone(米国)と、ゼノパス養殖教材(茨城県古河市)とから入手した。メダカ(Oryzias latipes)及びゼブラフィッシュの成魚は業者から購入した。ニホンカナヘビ(Takydromus tachydromoides)の成体は2007年に東京郊外で採集した。前記動物は、水槽で飼育した。Korea University College of Medicine(高麗大学校医学部、韓国、ソウル市)及び早稲田大学で、実験動物管理規則に従って実施した。
【0044】
(ゲノムデータベース解析)
ゼブラフィッシュ、アフリカツメガエル及びヒトのキスペプチンのアミノ酸配列をクエリー配列としてネッタイツメガエルのゲノムデータベースをTBLASTNアルゴリズム(Ensembl Genome Browser;http://www.ensembl.org/)により検索した。さまざまな脊椎動物種におけるGPR54遺伝子を特定するために、ヒト及びウシガエルのGPR54のアミノ酸配列についてゼブラフィッシュ、メダカ、カモノハシ(Ornithorhynchus anatinus)及びネッタイツメガエルのゲノムデータベースをTBLASTNアルゴリズムにより検索した。クエリー配列とヒットしたゲノム配列との間のアミノ酸配列のアライメントはBlast View(http://www.ensembl.org/)を用いて行い、また、CBS Prediction Serviceにより提供されるHMMgene(v.1.1)プログラム(http://www.cbs.dtu.dk/services/HMMgene/)を用いてエクソン及びイントロンの配列を予想した。ヒト、ネッタイツメガエル、ゼブラフィッシュ、メダカ及びカモノハシの、GPR54遺伝子座を含むゲノム領域のコンティグ図の比較を行なった後、ゲノムシンテニー解析を実施した。
【0045】
(KiSSペプチド及びそのレセプターcDNAのクローニング)
アフリカツメガエルのKiSS−1及びKiSS−2ペプチドをエンコードするcDNAのクローニングは以下のとおり行なった。ネッタイツメガエルのKiSS−1ペプチドのcDNA配列に基づき、2種類の順方向プライマーと、3種類の逆方向プライマーとを合成した(オペロンバイオテクノロジー株式会社)。前記2種類の順方向プライマーを配列番号12及び13に、前記3種類の逆方向プライマーを配列番号14〜16に、それぞれ示す。また、ゲノムデータベースからネッタイツメガエルのKiSS−2ペプチドのcDNA配列を推定し、2種類の順方向プライマーと、3種類の逆方向プライマーとを合成した。前記2種類の順方向プライマーを配列番号17及び18に、前記3種類の逆方向プライマーを配列番号19〜21に、それぞれ示す。sepasol抽出法により単離したアフリカツメガエルの脳の全RNAと、前記プライマーとを用いてRT−PCR法により合成されたPCR産物を、ゲル電気泳動とMicroSpin Column(GEヘルスケアバイオサイエンス株式会社)とを用いて精製し、pGEM−T Easy vector(Promega)にサブクローニングした。PCR断片のDNA配列は、universal M13 primerより増幅したDNAをABI 3730XL DNA analyzer(Applied Biosystems)でサイクルシーケンシング反応により決定した。
ゼブラフィッシュ及びネッタイツメガエルのGPR54及びそのファミリー遺伝子をエンコードするcDNAのクローニングは以下のとおり行なった。ゼブラフィッシュ及びネッタイツメガエルのGPR54のcDNA配列に基づき、3種類の順方向プライマーと、3種類の逆方向プライマーとを合成した。前記3種類の順方向プライマーを配列番号22〜24に、前記3種類の逆方向プライマーを配列番号25〜27に、それぞれ示す。sepasol抽出法により単離した脳の全RNAと、前記プライマーとを用いてRT−PCR法により合成されたPCR産物を、ゲル電気泳動とMicroSpin Columnとを用いて精製し、pGEM−T Easy vectorにサブクローニングした。cDNAの構造を配列決定により確認した後、cDNAをpcDNA3発現ベクターにリクローニングした。
【0046】
(抗体の調製)
Azumaya,Y.、Kominami,S.及びTsutsui,K.(1998)J.Exp.Zool.281:90−96に記載の方法に従い、m−マレイミドベンゾイル−N−ヒドロキシサクシンイミドエステル(MBS)を用いてスカシ貝ヘモシアニン(KLH)に結合した合成ペプチドを抗原として使用して、抗血清を作成した。推定KiSS−2ペプチドのC末端部分とN末端部分とに対する抗血清は、それぞれ、SKFNFNPFGLRF(配列番号28)というアミノ酸配列のC末端のフェニルアラニンにシステインを付加したペプチド(配列番号29)をKLHに結合したものと、配列番号28のアミノ酸配列のN末端のセリンにシステインを付加したペプチド(配列番号30)をKLHを結合したものとを抗原として作成された。1mg/mLの抗原溶液をフロイント完全アジュバント(Difco)と混合し、マウスに注射した。50μgのブースター注射の後、各々のマウスから血液を回収し、適切に希釈した抗血清を、ELISA法により分析した。推定KiSS−2ペプチドのC末端部分に対する抗血清と、N末端部分に対する抗血清とは、それぞれ免疫組織化学的検査と、KiSS−2ペプチドのアフィニティー精製とに用いられた。
【0047】
(ペプチドの抽出及びアフィニティー精製)
アフリカツメガエルの成体(500匹)から回収した脳組織をドライアイスで凍結させ、使用するまで−80°Cで保存した。Tsutsui Kら、(2000)Biochem Biophys Res Commun 275:661−667、Koda Aら、(2002)Endocrinology 143:411−419、及び、Ukena Kら、(2003)Endocrinology 144:3879−3884に記載の方法に従い、脳組織を5%酢酸中で煮沸及びホモジナイズした。ホモジネートを10,000g、4°Cで30分間遠心分離し、得られた沈殿を再度ホモジナイズ及び遠心分離した。回収した遠心上清を、ロータリーエバポレーターを45°Cで使用することにより濃縮した後、ディスポーサブルのC−18カートリッジカラム(Mega Bond−Elut;Varian)に適用した。Ukena Kら、(2003)、Ukena Kら、(2002)FEBS Lett 512:255−258、及び、Bonnard Eら、(2001)Peptides 22:1085−1092に記載の方法に従い、前記カラムに保持された物質を60%メタノールで溶出し、イムノアフィニティー精製に供した。イムノアフィニティーカラムは、推定KiSS−2ペプチドのC末端側のアミノ酸配列に対する抗血清を臭化シアンで活性化してSepharose 4B(Amersham)に結合して調製された。60%メタノールで溶出した前記脳抽出物を前記イムノアフィニティーカラムに4°Cで適用し、0.1%の2−メルカプトエタノールを含む0.3M酢酸で溶出した。Koda Aら(2002)、及び、Ukena Kら、(2003)に記載の方法に従い、1mLの分画を、前記推定KiSS−2ペプチドに対する抗血清を用いて、ドットイムノブロットアッセイにより分析した。
【0048】
(HPLC分析及び構造決定)
前記ドットイムノブロットアッセイ陽性分画をHPLCカラム(ODS−80TM、東ソー株式会社)に適用し、100分間で0.1%のトリフルオロ酢酸を含む10%アセトニトリルから0.1%のトリフルオロ酢酸を含む50%アセトニトリルまで溶離液組成を変化させる線形グラジエント、0.5mL/分の流速の設定で100分間の溶出を行なった。溶出画分を2分ごとに回収した後、イムノブロッティングで陽性の画分を、逆相HPLCカラム(ODS−80TM、東ソー株式会社)にさらに適用し、0.1%のトリフルオロ酢酸を含む31.4%のアセトニトリルを使用するイソクラティック条件下、流速0.5mL/分で25分間溶出を行なった。単離した物質を、マトリックス支援レーザー脱離イオン化飛行時間型質量分析(MALDI−TOF MS)装置(
AXIMA−CFR plus、株式会社島津製作所)によるアミノ酸配列解析に供した。
【0049】
(In Situハイブリダイゼーション)
アフリカツメガエルの脳におけるKiSS−2ペプチドのmRNAの発現の局在はin situハイブリダイゼーション法により解析した。簡潔には、アフリカツメガエルの成体の脳下垂体を含む脳組織を、冷却した4%のパラホルムアルデヒドを含む0.1Mリン酸緩衝液に24時間浸漬し、冷却したスクロース溶液(30%のスクロースを含むNaCl/Pi)中に浸漬した。前記脳組織をOCTコンパウンド(Miles Inc.)包埋後、−20°Cでクライオスタットを用いて10μmの厚さに切断し、3−アミノプロピルトリエトキシシランでコーティングしたスライドの上に戴置した。Sawadaら、(2002)Eur J Biochem 269:6000−6008、
Ukena Kら、(1999)Endocrinology 40:805−813、及び、Sawada Kら、(2002)J Endocrinol 174:395−402に記載の方法に従い、ジゴキシゲニン(DIG)標識アンチセンスRNAプローブを使用して、in situハイブリダイゼーションを行った。前記DIG標識アンチセンスRNAプローブは、RNA標識キット(Roche Diagnostics)を用いて、ペプチド前駆体cDNAの一部から作り出した。KiSS−2ペプチドmRNAのin situハイブリダイゼーションの特異性についての対照実験は、DIG標識アンチセンスRNAプローブの共通配列に相補的なDIG標識センスRNAプローブを使用することにより行った。
【0050】
(免疫組織化学的検査)
アフリカツメガエルの脳組織を、ブアン液で固定し、−20°Cで20μmの厚さの前頭断又は矢状断面を調製した。非特異的結合成分をブロッキングした後、前記切片を1:1,000に希釈したKiSS−2ペプチドのN末端側のペプチドに対する抗血清と4°Cで終夜反応させた後、アルカリフォスファターゼ標識ヤギ抗マウスIgGと反応させた。染色の特異性を評価するための対照実験には、飽和濃度(1mL当たり10μgのKiSS−2ペプチド)の抗原と予め終夜インキュベーションして中和させた前記抗体(希釈比1:1,000)を使用した。
【0051】
(ルシフェラーゼアッセイ)
アフリカミドリザル腎臓線維芽細胞由来CV−1細胞は10%ウシ胎児血清を含むダルベッコ改変イーグル培地(DMEM)中で培養した。ルシフェラーゼアッセイの際は、トランスフェクションの1日前に、細胞を24ウェルプレートに播種した。トランスフェクションは、100ngの内部標準プラスミドpCMVb−Galとともに、100ngの各受容体cDNAと、SRE−lucベクター又はCRE−lucベクターの100ngをSuperFect reagent(QIAGEN)とともに使用して実施した。トランスフェクションの1日後、細胞を24時間血清が欠乏した状態におき、その後、キスペプチンを6時間負荷した。細胞を回収し、細胞抽出液中のルシフェラーゼ活性を、Lumat LB9501(EG & G Berthold,Bad Wildbad,Germany)を用いる標準的な方法に従い決定した。ルシフェラーゼ活性は、β−Gal値を使用して正規化した。
【0052】
(データ解析)
全てのアッセイは、1回の実験では同一実験条件のサンプルを3個用意して並列して測定し、かつ、同じ実験を3回繰り返し行った。データ解析は、S字状用量応答曲線での非線形回帰を用いて行った。最大応答値の50%の刺激を誘発させるアゴニスト濃度(EC50)と、最大応答値を誘発させるアゴニスト濃度(Emax)とを、GraphPad PRISM2 software(GraphPad、米国、カリフォルニア州、サンジエゴ)を使用して算出した。全てのデータを、少なくとも2回の独立した実験結果の平均値±SEMとして表示した。
【0053】
結果
メタスチンのアミノ酸配列をさまざまな動物種のゲノムデータベースを用いて解析したところ、従来推定されていた10個のアミノ酸残基からなるKiSS−1ペプチドとは別に、12個のアミノ酸残基からなる新規メタスチン誘導体ペプチド(KiSS−2)をエンコードするDNA配列を発見した。次に、新規メタスチン同族体ペプチドKiSS−2ペプチドが脳内の特定ニューロンで発現し、GPR54遺伝子ファミリーの内因性リガンドとして機能することが確かめた。また、KiSS−2ペプチドが実際にアフリカツメガエルの脳組織に存在すること、KiSS−2ペプチドに対する抗血清が脳の特定の領域と反応すること、及び、KiSS−2ペプチドがKiSS−1ペプチドのレセプターとして知られているGPR54に対してアゴニスト活性を示すことを確かめた。以下にその実験結果を説明する。
【実施例1】
【0054】
KiSS相同ペプチドのゲノムデータベース解析の結果
図1−Aは、従来GRP54レセプターの内因性リガンドとして知られていたヒトKiSS−1ペプチド(キスペプチン−10)との相同性が高い他の脊椎動物の相同ペプチドの推定アミノ酸配列のアライメント結果を示す。全ゲノム配列情報が得られる脊椎動物のうち、硬骨魚類のゼブラフィッシュではヒトKiSS−1ペプチドと相同性のあるアミノ酸配列が2個見つかった。このうち一方はヒトKiSS−1ペプチドと10個のうち2個のアミノ酸が異なり、他方は3個のアミノ酸が異なる。そこで前者をゼブラフィッシュのKiSS−1ペプチド、後者をKiSS−2ペプチドと分類した。また、ネッタイツメガエルではヒトKiSS−1ペプチドと相同性のあるアミノ酸配列が3個見つかったが、これらのうち1個はゼブラフィッシュKiSS−2ペプチドと同一のアミノ酸配列であるのでこれをネッタイツメガエルのKiSS−2ペプチドと分類し、残る2個の相同ペプチドのうちヒトKiSS−1ペプチドとの相同性の高い方をKiSS−1a、ゼブラフィッシュKiSS−1と相同性の高い方をKiSS−1bと分類した。これらの分類をもとに無顎類のヤツメウナギ(lamprey)、軟骨魚類のゾウザメ(Callorhinchus milii)、硬骨魚類のメダカ、両生類のアフリカツメガエル、カモノハシ及びヒトのメタスタチン相同ペプチド、すなわち、KiSS−1ペプチド、KiSS−1aペプチド、KiSS−1bペプチド及びKiSS−2ペプチドのアミノ酸配列のアライメントを行った。図1−AではヒトKiSS−1ペプチドに対応するアミノ酸配列と、アフリカツメガエルKiSS−2ペプチドに対応するアミノ酸配列とをそれぞれ四角で囲んだ。ネッタイツメガエルの相同ペプチドのうちの一方はゼブラフィッシュの相同ペプチドと相同性を最大化するためにギャップを挿入し、該ギャップはハイフンで示した。保存アミノ酸残基には影をつけた。アミノ酸配列は、GenBankにより提供されるヒトKiSS−1(NP_002247)、ゼブラフィッシュKiSS−1(EF690279)、ヤツメウナギKiSS−1(EB722290及びEB722291)のcDNA配列から推定した。アフリカツメガエルKiSS−1、ネッタイツメガエルKiSS−1a、ネッタイツメガエルKiSS−1b、ニホンカナヘビKiSS−2(AB435432)、アフリカツメガエルKiSS−2(AB435389)、ネッタイツメガエルKiSS−2、ゼブラフィッシュKiSS−2、メダカKiSS−2(AB435386)のcDNAをクローニングされた。他の推定cDNA配列は、Ensemble Genome Browser又はGenBankにより提供されるメダカKiSS−1(BAAF04056457、1−5915)、カモノハシKiSS−1(AAPN01239752,1688−1735)、カモノハシKiSS−2(AAPN01043280、1−5154)、ゾウサメKiSS−1(AAVX01162971、1−922)、ゾウサメKiSS−2(AAVX01172388、1−2587)、ヤツメウナギKiSS−2のゲノム配列に基づいて取得した。クローニングしたcDNA配列はアスタリスク(*)で、部分的なcDNA配列はシャープ(#)で示した。推定シグナルペプチド(下線部)は、SignalP 3.0(http://www.cbs.dtu.dk/services/SignalP/)を使用して推定した。
【0055】
我々は、Blast検索により、EnsembleゲノムデータベースとNCBIデータベースとからカモノハシ、ゾウサメ及びヤツメウナギにおいて類似のcDNAも見出した(図1−A)。我々は、キスペプチンcDNAの3種類の形態をKiSS−1、KiSS−1b及びKiSS−2に分類した。KiSS−1のcDNAは、10番目のチロシン残基又はフェニルアラニン残基がアミド化されている場合がある10個のアミノ酸残基からなる推定ペプチド(キスペプチン−10)をエンコードした。キスペプチン−10のアミノ酸配列は、脊椎動物において高度に保存される(図1−Aのボックス内のキスペプチン−10の配列を参照せよ。)。
【0056】
図1−Bは、ヒトKiSS−1ペプチドと相同性のある遺伝子の分子進化についての模式図である。KiSS−1遺伝子及びKiSS−2遺伝子は、遺伝子/染色体の重複と遺伝子の修復及び欠損とのような進化のメカニズムを通じて、共通の祖先遺伝子から分化したと予想される。両生類は2種類のKiSS−1遺伝子を有する。アミノ酸配列の同一性を基準として、ネッタイツメガエルKiSS−1aは哺乳類のKiSS−1(mKiSS−1)と類似し、ネッタイツメガエルKiSS−1bは魚類のKiSS−1(fKiSS−1)と類似する。
【実施例2】
【0057】
KiSS−1及びKiSS−2ペプチドをエンコードするcDNAのクローニング及び特徴づけ
アフリカツメガエル、ネッタイツメガエル及びゼブラフィッシュのメタスチン相同ペプチドと推定されるペプチドをエンコードするcDNAのクローニングを行なった。アフリカツメガエルのKiSS−1のcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号31及び32と、図5−Aとにそれぞれ示す。アフリカツメガエルのKiSS−2のcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号33及び34と、図5−Bとにそれぞれ示す。ネッタイツメガエルのKiSS−1aのcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号35及び36と、図6−Aとにそれぞれ示す。ネッタイツメガエルのKiSS−1bのcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号37及び38と、図6−Bとにそれぞれ示す。ネッタイツメガエルのKiSS−2のcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号39及び40と、図6−Cとにそれぞれ示す。ゼブラフィッシュのKiSS−2のcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号41及び42と、図7とにそれぞれ示す。
【0058】
Blast検索により、EnsembleゲノムデータベースとNCBIデータベースとからカモノハシ、ゾウサメ及びヤツメウナギにおいて類似のcDNAが見いだされた(図1−A)。キスペプチンcDNAをKiSS−1、KiSS−1a、KiSS−1b及びKiSS−2に分類した。KiSS−1又はKiSS−1aのcDNAは、10番目のチロシン残基又はフェニルアラニン残基がアミド化されている場合がある10個のアミノ酸残基からなる推定ペプチド(キスペプチン−10)をエンコードした。キスペプチン−10のアミノ酸配列は、脊椎動物において高度に保存される。(図1−Aの四角で囲んだキスペプチン−10の配列を参照せよ。)KiSS−1のcDNAに加えて、ネッタイツメガエルにおいて、キスペプチン−10と類似する推定デカペプチドをエンコードする別のcDNA(KiSS−1b)がクローニングされた(図1−A)。推定KiSS−1bペプチド(YNVNSFGLRF(配列番号43))のアミノ酸配列とキスペプチン−10のアミノ酸配列との間には1個のアミノ酸残基の違いしかない(図1−A)。そこで、X.tropicalisのようにキスペプチン−10と類似する推定デカペプチドをエンコードするcDNAが2種類存在する場合には、1種類しか存在しない生物におけるKiSS−1と同じものをKiSS−1aとする。
【0059】
一方でKiSS−2のcDNAは12個のアミノ酸残基からなる新規な推定ペプチドをエンコードし、該推定ペプチドにおいて12番目のフェニルアラニン残基はアミド化されている場合がある。KiSS−2ペプチドの推定配列とキスペプチン−10の推定配列との間には60%の相同性があった。(図1−Aの四角で囲んだKiSS−2ペプチド及びキスペプチン−10の配列を参照せよ。)前記KiSS−2ペプチドのアミノ酸配列は、各々の末端に、細胞内タンパク質分解部位としてのグリシンC末端アミド化シグナル(glycine C−terminal amidation signal)及び塩基性アミノ酸と隣接している。この12個のアミノ酸残基からなるペプチドの配列と、シグナルペプチドの配列とは、脊椎動物において高度に保存されている。
【実施例3】
【0060】
両生類KiSS−2ペプチドの単離及び同定
KiSS−2推定ペプチドは内在の成熟リガンドとして働くことを確認する必要がある。そこで、脳からの成熟ペプチド単離と、その同定とを行った。アフリカツメガエルの脳における成熟KiSS−2ペプチドを特定するために、前記推定KiSS−2ペプチドのC末端のアミノ酸配列に対する特異的な抗血清を使用するイムノアフィニティー精製を行った。図2−Aは、逆相HPLCカラム(ODS−80TM)に保持された物質のHPLCプロファイルである。前記逆相カラムに適用され保持された物質を、100分間で0.1%のトリフルオロ酢酸を含む10%アセトニトリルから0.1%のトリフルオロ酢酸を含む50%アセトニトリルまで溶離液組成を変化させる線形グラジエントと、0.5mL/分の流速との設定で100分間溶出させ、1画分当たり1mLの50個の画分に分画した。各々の画分について一定分量(1/100量)を蒸発乾固し、蒸留水に溶解し、ニトロセルロース膜上にスポットした。アフリカツメガエルのKiSS−2推定ペプチドへの抗血清に対する免疫陽性の画分が、溶離液中のアセトニトリル含量が34−36%のとき、すなわち、溶出時間70−74分に対応する画分に溶出された。(水平のバーで示した。)これらの免疫陽性の画分は、31.4%のアセトニトリルを使用するイソクラティック条件下で逆相HPLC精製を使用して再度クロマト分離された。
【0061】
図2−Bは、図2−Aに示したHPLCでの分画により得られた免疫陽性の画分を、逆相HPLCカラム(ODS−80TM)によりさらに精製したときのHPLCプロファイルである。0.1%のトリフルオロ酢酸を含む31.4%のアセトニトリルを使用するイソクラティック条件下、流速0.2mL/分で30分間溶出を行なった。免疫陽性の物質は保持時間14分で溶出し、そのピークを矢印で示した。図2−Bに示されるように、精製した物質は単一のピークとして溶出された。前記精製した物質のアミノ酸配列を決定したところ、SKFNFNPFGLRF(配列番号28)という配列であった。
【0062】
単離したペプチドのC末端の構造を明らかにするために、MALDI−TOF MSを使用した。図2−Cは、イムノアフィニティ精製されたKiSS−2ペプチドのMALDI−TOF MSによる検出を示す図である。タンデムMS分析により、1472.78m/z([M+H]+)という観測質量数を有する精製物質のフラグメンテーションパターンが得られた。観察されたスペクトルは、推定KiSS−2ペプチドのフラグメントイオンの典型的な質量値を示した。この結果から、アフリカツメガエルKiSS−2ペプチドは、12個のアミノ酸からなる配列番号4に列挙されるアミノ酸配列を有し、C末端がアミド化されたペプチドであると同定された。このペプチドのスペクトルにおける分子イオンピークは、1472.84m/z([M+H]+)であった。この値は、推定アミド化ペプチドについて算出した質量数1478.78m/z([M+H]+)に近い値であった。得られたMS/MSフラグメンテーションパターンにより、KiSS−2ペプチドは、アミノ酸配列がSKFNFNPFGLRF(配列番号28)であり、かつ、C末端のフェニルアラニンがアミド化された構造であると特定することができた。以上より、単離した天然ペプチドは、12個のアミノ酸残基からなり、C末端のアミノ酸配列がRFであり、かつ、C末端のフェニルアラニンがアミド化された構造を有することが確認された。
【実施例4】
【0063】
KiSS−1及びKiSS−2のペプチド及びmRNAの局在
図3−Aは、アフリカツメガエルの脳組織におけるKiSS−1及びKiSS−2のmRNAの局在をin situハイブリダイゼーションにより解析した結果の顕微鏡写真である。図3−A(1)は、アフリカツメガエルの脳の前頭断切片をジゴキシン標識したKiSS−1アンチセンスRNAプローブと反応させた後、酵素標識された抗ジゴキシン抗体を用いて発色反応により検出した結果である。図3−A(3)及び(5)は、アフリカツメガエルの脳の前頭断切片をジゴキシン標識したKiSS−2アンチセンスRNAプローブと反応させた後、酵素標識された抗ジゴキシン抗体を用いて発色反応により検出した結果である。図3−A(2)、(4)及び(6)は、対照実験としてセンスRNAプローブを使用した結果である。スケールバーは100μmを表す。KiSS−1ペプチドのアンチセンスRNAプローブは腹側視床下部(VH)で強く反応した(図3−A(1))。KiSS−2ペプチドのアンチセンスRNAプローブは、腹側視床下部(VH)に加えて、視索前野(POA)とも強く反応した(図3−A(3)及び(5))。対照実験では発色はみられなかった。したがって、KiSS−1及びKiSS−2ペプチドのアンチセンスRNAプローブの反応はこれらのmRNAに特異的であると結論された。
【0064】
図3−Bは、アフリカツメガエルの脳におけるKiSS−2ペプチドの細胞局在を示す顕微鏡写真である。図3−B(1)及び(3)は脳の前頭断切片を、X.laevisのKiSS−2ペプチドに対する抗血清と反応させ、その後、標識された2次抗体を用いて発色反応により検出した結果である。図3−B(2)及び(4)は、対照実験として、飽和濃度の合成KiSS−2ペプチドといっしょにプレインキュベーションした抗血清と反応させ、その後、標識された2次抗体を用いて発色反応により検出した結果である。スケールバーは100μmを表す。アフリカツメガエルのKiSS−2ペプチドに対する抗血清はPOAの細胞体に反応した。また、前記抗血清は前記POA及びVHから投射してその終末が正中隆起(ME)に達する神経繊維とも反応した。対照実験では発色はみられなかった。したがって、アフリカツメガエルのKiSS−2ペプチドに対する抗血清の反応はKiSS−2ペプチドに特異的であると結論された。
【0065】
図3−Cは、背側からアフリカツメガエルの中枢神経系組織における前頭断切片の位置を示す模式図と、各切片でのKiSS−2ペプチドに対する抗血清との反応がみられる部位を示した模式図とを示す。黒塗りの丸(●)は免疫陽性の細胞体を表し、黒塗りの星(★)は免疫陽性の線維を表す。Accは側坐核を、BNSTは分界条床核を、DBはブローカー対角帯核を、dpは背側外套を、iglは内部顆粒細胞層を、Isは峡部核を、MEは正中隆起を、MeAは内側扁桃核を、NPvは室傍核を、Pdは末端部を、Piは中間部を、Pnは後葉を、POAは視索前野を、SCは視交叉上核を、TPは後側結節を、VHは腹側視床下部核を、VMは視床腹内側核をそれぞれ表す。図3−Cの各切片に示すとおり、免疫陽性の線維は、視床下部のいくつかの領域と、脳の他の領域とにも多数存在した。
【0066】
KiSS−2ペプチド免疫陽性の神経軸索は正中隆起に観察された。POAの巨細胞性のニューロンはその軸索を正中隆起の下垂体門脈に投射していることが知られているので、POAに存在するKiSS−2ペプチドニューロンが正中隆起の下垂体門脈を介して主要な下垂体前葉ホルモンを調節している可能性がある。
【0067】
KiSS−2ペプチドはPOAとVHのニューロンの他に、前脳の神経軸索で観察された。両生類のPOAとVHに電気的な刺激を与える実験により、これらの神経核がゴナドトロピンと性ステロイドの分泌を調節していること、POAを電気刺激することでカエルの交尾期の鳴き声を喚起すること、その中でも特に腹側のPOAは交尾期の鳴き声ジェネレーターを活性化することが知られているため、KiSS−2ペプチドは、視床下部・下垂体の生殖内分泌系を制御するというKiSS−1と類似の機能の他に、動物の繁殖行動を制御する神経ペプチドとしての機能も有すると考えられる。
【実施例5】
【0068】
GPR54相同遺伝子のゲノムデータベース解析の結果
図4は、さまざまな脊椎動物種から同定されたGPR54のアミノ酸配列のアライメントと、GPR54のcDNAの構造とを示す図である。図4−Aは、さまざまな脊椎動物種から同定されたGPR54のアミノ酸配列のアライメントを示す図である。相同性を最大化するためにギャップを挿入し、該ギャップはハイフンで示した。保存アミノ酸残基には影をつけた。右側の数字は、アミノ酸残基の位置を示す。推定7回膜貫通ヘリックス(TMH)を、整列させた配列の上側に示す。黒塗りの三角(▲)はスプライシングジャンクションを示す。シャープ(#)はEnsembl Genome Browserにより提供されるゲノムデータベースから推定された推定アミノ酸配列を示す。Human;Chromosome 19:868203:873745:1、Zeburafish−2;Chromosome 2:28224113:28274250:1、Zebrafish−1:Chromosome 5:62011059:62019702:−1、medaka−2;Chromosome 17:29839761:29855706:−1、medaka−1;Chromosome 9:4480521:4500733:−1、XT−1a;scaffold_289:1010897:1051639:−1、XT−1b;scaffold_122:1203307:1243558:−1、XT−2;scaffold_2567:37018:33176:1及びscaffold_4:511186−518389:1、Ornithorhynchus anatinus−1(Orn−1);Ultra_266:390150:395924:1、Ornithorhynchus anatinus−2(Orn−2);Contig_15629:1100:6789:1。GPR54遺伝子のオープンリーディングフレームは、ゼブラフィッシュのGPR54−1では364個のアミノ酸からなるタンパク質を、ネッタイツメガエルGPR54−1aでは366個のアミノ酸からなるタンパク質を、ネッタイツメガエルGPR54−1bでは367個のアミノ酸からなるタンパク質を、ネッタイツメガエルGPR54−2では369個のアミノ酸からなるタンパク質を、それぞれエンコードする。
【0069】
図4−Bは、GPR54のcDNAの構造を示す図である。GPR54のcDNAは5個のエクソンからなる。影付きのボックスの中のローマ数字は膜貫通ヘリックスドメインの番号を表す。ゼブラフィッシュ及びネッタイツメガエル由来の推定GPR54の配列をEnsemblゲノムデータベースにおいて見出した。ゼブラフィッシュ(z)についてはGPR54−1はChromosome 5 location 62,011,059−62,019,702に見出された。ネッタイツメガエル(xt)についてはGPR54−1a(XT−1a)はscaffold_289 location 1,010,897−1,051,639に、XT−1bはscaffold_122 location 1,203,307−1,243,558に、XT−2はscaffold_2567 location 37,018−33,176とscaffold_4 location 511,186−518,389とに、それぞれ見出された。bfFPR54のハイドロパシー分析により、Gタンパク質共役型受容体(GPCR)に典型的な疎水性アミノ酸残基からなる7種類の配列の存在が明らかとなった。ゲノム分析及びcDNA分析により、全てのGPR54が5個のエクソンを有し、かつ、スプライシングジャンクションの位置が保存されていることが明らかになった。
【0070】
図4−Cは、GPR54遺伝子の分子進化についての仮説を示す模式図である。GPR54は、遺伝子/染色体の重複と遺伝子の修復及び欠損とのような進化のメカニズムを通じて、共通の祖先遺伝子から分化したと予想される。両生類は3種類の形態のGPR54遺伝子を有する。ネッタイツメガエルのGPR54−1aはヒト及びカモノハシのGPR54−1のホモログであり、ネッタイツメガエルのGPR54−1bは魚類のGPR54−1の同族体である。アミノ酸配列の同一性を基準として、ネッタイツメガエルGPR54−2は魚類のGPR54−2の同族体であると考えられる。
【0071】
図12は、ヒトと、ツメガエルと、ゼブラフィッシュとの間でのKiSS−1遺伝子座のシンテニーを示す図である。ヒト、ネッタイツメガエル及びゼブラフィッシュのゲノム構成は、Ensembl Genome Browserから取得した。PLEKHA6はプレクストリン相同ドメイン含有ファミリーAメンバー6であり、RENはレニン前駆体である。
【0072】
図13は、カモノハシGPR54−1と、ヒトGPR54と、ネッタイツメガエルGPR54−1aとの間でのシンテニーを示す図である。前記GPR54の遺伝子座のヌクレオチド配列データは、Ensembl Genome Browserから取得した。C19orf21は未特定タンパク質C19orf21であり、MED16はRNAポリメラーゼII転写サブユニット16のメディエーターであり、PALMはパラレミンであり、PSAT1はホスホセリンアミノトランスフェラーゼ1アイソフォームであり、PTBP1はポリピリミジントラクト結合タンパク質1(PTB)であり、WDR18はWD反復タンパク質18であり、ZCCH6はジンクフィンガーCCHCドメイン含有タンパク質6である
ゲノムシンテニー解析(図13)及び相同性解析(表1)に基づき、ネッタイツメガエル及び魚類のGPR54を分類した。ゲノムシンテニー解析により、ネッタイツメガエルGPR54−1aと、ヒトGPR54と、カモノハシGPR54−1とが、未特定タンパク質C19orf21(C19orf21)、RNAポリメラーゼII転写サブユニット16のメディエーター(MED16)、パラレミン(paralemmin、PALM)、ポリピリミジントラクト結合タンパク質1(PTBP1)、WD反復タンパク質(WDR18)を含む、共通の遺伝子座を含むゲノム領域に局在することが明らかとなった。したがってネッタイツメガエルGPR54−1aは、ヒトGPR54のホモログであるようである。ヒトGPR54と、いずれかの魚類のGRP54との間ではシンテニーは観察されなかった。ネッタイツメガエルGPR54−1bと、メダカのGPR54−1とが、共通の遺伝子座のジンクフィンガーCCHCドメイン含有タンパク質6(ZCCH6)を有するゲノム領域に局在した。zGPR54−1を含むゲノム領域はZCCH6を有しないが、ホスホセリンアミノトランスフェラーゼ1アイソフォーム(PSAT1)遺伝子座をメダカのゲノム領域と共有する。このシンテニー解析を支持して、魚類のGPR54は、3種類のネッタイツメガエルGPR中でネッタイツメガエルGPR54−1bと最も高い(58〜63%)アミノ酸配列の同一性を有する。したがってネッタイツメガエルGPR54−1bは、魚類のGPR54−1のホモログだと考えられる。ネッタイツメガエルGPR54−2と、魚類のGRP54−2との間では、非常に高いアミノ酸配列の同一性(69〜74%)を有していたが、シンテニーは観察されなかった。ネッタイツメガエルGPR54−1aは、ネッタイツメガエルGPR54(60%)よりもネッタイツメガエルGPR54−1b(70%)と高いアミノ酸配列同一性を有するので、ネッタイツメガエルGPR54−1a及びネッタイツメガエルGPR54−1bは遺伝子の重複により生成されたと考えられる。したがってGPR54遺伝子の進化の過程は、下で述べるようなものだと考えられる。全てのGPR54遺伝子において、5個のエクソンが存在し、かつ、スプライシングジャンクションが保存されており、類似の遺伝子構造を有する。したがってこれらは、共通の祖先遺伝子の遺伝子/染色体の重複により発生し、GPR54−1及びGPR54−2という2系列のGPR54を生成したと考えられる。両生類ではGPR54−1は、さらにもう1回の遺伝子/染色体の重複を受け、GPR54−1a及びGPR54−1bを生成した。哺乳類では単孔類は2種類のGPR54遺伝子を有する場合があるが、ヒトは、おそらく遺伝子欠損のために1種類のGPR54のみを有する(図4−C)。
【0073】
【表1】

【実施例6】
【0074】
GPR54レセプター相同タンパク質をエンコードするcDNAのクローニング
ゼブラフィッシュ及びネッタイツメガエルのGPR54cDNAクローニング
ネッタイツメガエル及びゼブラフィッシュのGPR54レセプター相同タンパク質と推定されるタンパク質をエンコードするcDNAのクローニングを行なった。Ensembl Genome Browserにより提供されるゲノム配列に基づき、ネッタイツメガエルのGPR54−1(XT−1a)、GPR54−2(XT−1b)及びGPR54−3(XT−2)と、ゼブラフィッシュのGPR54−1(Zebra−1)とのcDNAをPCR法により増幅させた。ネッタイツメガエルのGPR54−1aのcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号44及び45と、図8とにそれぞれ示す。ネッタイツメガエルのGPR54−1bのcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号46及び47と、図9とにそれぞれ示す。ネッタイツメガエルのGPR54−2のcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号48及び49と、図10とにそれぞれ示す。ゼブラフィッシュのGPR54−1cDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号50及び51と、図11とにそれぞれ示す。
【実施例7】
【0075】
KiSS−2ペプチドのGPR54レセプターに対するアゴニスト活性
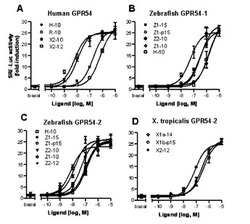
ヒトGPR54、ゼブラフィッシュGPR54−1、ゼブラフィッシュGPR54−2又はネッタイツメガエルGPR54−2のレセプターcDNAの発現コンストラクトと、SRE−lucベクターとをCV−1細胞に導入するトランスフェクションを行った。48時間後、トランスフェクションされた細胞に、10−10モル(0.1nM)から10−5モル(10μM)の濃度のヒトKiSS−1(H−10)、齧歯類KiSS−1(R−10)、ツメガエルのKiSS−1a(X1a−14)、KiSS−1b(X1b−p15)及びKiSS−2(X2−10、X2−12)、ゼブラフィッシュのKiSS−1(Z1−10、Z1−15、Z1−p15)及びKiSS−2(Z2−10、Z2−12)ペプチドを添加し、これらのKiSSペプチドによって誘導されたルシフェラーゼ活性を測定した。前記ルシフェラーゼ活性をレセプターのアゴニスト活性として各KiSSペプチドごとにプロットした結果を図14A−Dにそれぞれ示す。各KiSSペプチド濃度でのアゴニスト活性のプロットは、立ち上がりのKiSSペプチド濃度より1桁高い濃度でEC50に達し、さらに1桁高い濃度でプラトーに達するシグモイド曲線を示した。以下、EC50の値で比較・検討を行なった。
【0076】
ヒトGPR54に対するEC50は、ヒト及び齧歯類KiSS−1ペプチドではともに10−8モル、ネッタイツメガエルKiSS−2ペプチドでは10−7モル、ネッタイツメガエルKiSS−2ペプチドでは10−6モルであった(図14−A)。ヒト及び齧歯類のペプチドのヒトGPR54レセプターに対するアゴニスト活性はほぼ同じ強さであるが、ネッタイツメガエルKiSS−2ペプチドはヒト及び齧歯類よりも1桁低いアゴニスト活性を示し、ネッタイツメガエルKiSS−2ペプチドは、さらに約1桁低いアゴニスト活性を示した。以上の結果から、ネッタイツメガエルKiSS−2ペプチドはヒトでも薬理作用を示す可能性が明らかになった。
【0077】
ゼブラフィッシュGPR54−1に対するEC50は、ゼブラフィッシュKiSS−1ペプチドは10−7モル、ゼブラフィッシュKiSS−2ペプチド及びヒトKiSS−1ペプチドは10−6モルであった(図14−B)。KiSS−1ペプチドもKiSS−2ペプチドもゼブラフィッシュGPR54−1レセプターに対するアゴニスト活性を示した。しかし、ヒトKiSS−1及びゼブラフィッシュKiSS−2ペプチドのアゴニスト活性は、ゼブラフィッシュKiSS−1ペプチドのアゴニスト活性より1桁低かった。
【0078】
ゼブラフィッシュGPR54−2に対するEC50は、ゼブラフィッシュKiSS−1ペプチドは10−8モル、ヒトKiSS−1ペプチド及びゼブラフィッシュKiSS−2ペプチドは10−7モルであった(図14−C)。KiSS−1ペプチドもKiSS−2ペプチドもゼブラフィッシュGPR54−2レセプターに対するアゴニスト活性を示した。ゼブラフィッシュGPR54−1レセプターと同様に、ゼブラフィッシュGPR54−2レセプターに対するヒトKiSS−1及びゼブラフィッシュKiSS−2ペプチドのアゴニスト活性は、ゼブラフィッシュKiSS−1ペプチドのアゴニスト活性より1桁低かった。しかし、ゼブラフィッシュGPR54−2レセプターに対するアゴニスト活性は、ゼブラフィッシュGPR54−1レセプターに対するアゴニスト活性より1桁高かった。本実験の結果から、ゼブラフィッシュKiSS−1ペプチドとKiSS−2ペプチドが共に、ゼブラフィッシュ等の魚類において、GPR54−2レセプターに対して薬理作用を示すアゴニストとして使用できる可能性が明らかになった。
【0079】
ネッタイツメガエルGPR54−2に対するEC50は、ネッタイツメガエルKiSS−1及びKiSS−2ペプチドは10−7モルであった(図14−D)。ツメガエルのKiSS−1aペプチド、KiSS−1bペプチド及びKiSS−2ペプチドのネッタイツメガエルGPR54−2レセプターに対するアゴニスト活性は、ほぼ同程度であった。ネッタイツメガエルのGPR54−2レセプターに対するアゴニスト活性は、ゼブラフィッシュGPR54−1(図14−B)と同程度であり、ヒトGPR54レセプター(図14−A)及びゼブラフィッシュGPR54−2レセプター(図14−C)よりも1桁低かった。本実験の結果から、ネッタイツメガエルKiSS−1a、KiSS−1bペプチド及びKiSS−2ペプチドがともに、ネッタイツメガエル等の両生類において、GPR54−2レセプターに対して薬理作用を示すアゴニストとして使用できる可能性が明らかになった。
【図面の簡単な説明】
【0080】
【図1−A】脊椎動物におけるKiSS−1ペプチド、KiSS−1bペプチド及びKiSS−2ペプチドの推定アミノ酸配列のアライメントを示す図。
【図1−B】KiSS−1遺伝子の分子進化についての仮想的な模式図。
【図2−A】逆相HPLCカラム(ODS−80TM)に保持された物質のHPLCプロファイル。
【図2−B】図2−Aに示したHPLCでの分画により得られた免疫陽性の画分を、逆相HPLCカラム(ODS−80TM)によりさらに精製したときのHPLCプロファイル。
【図2−C】イムノアフィニティ精製されたKiSS−2ペプチドのMALDI−TOF MSによる検出を示す図。
【図3−A】アフリカツメガエルの脳におけるKiSS−1 mRNA及びKiSS−2 mRNAの細胞局在を示す顕微鏡写真。
【図3−B】アフリカツメガエルの脳におけるKiSS−2ペプチドの細胞局在を示す顕微鏡写真。
【図3−C】アフリカツメガエルの脳におけるKiSS−2ペプチドに対する免疫陽性部位を示した前頭断の模式図。
【図4−A】さまざまな脊椎動物種から同定されたGPR54のアミノ酸配列のアライメントを示す図。
【図4−B】GPR54のcDNAの構造を示す図。
【図4−C】GPR54遺伝子の分子進化についての仮想的な模式図。
【図5−A】アフリカツメガエルのKiSS−1のcDNA及び推定アミノ酸配列を示す図。
【図5−B】アフリカツメガエルのKiSS−2のcDNA及び推定アミノ酸配列を示す図。
【図6−A】ネッタイツメガエルのKiSS−1aのcDNA及び推定アミノ酸配列を示す図。
【図6−B】ネッタイツメガエルのKiSS−1bのcDNA及び推定アミノ酸配列を示す図。
【図6−C】ネッタイツメガエルのKiSS−2のcDNA及び推定アミノ酸配列を示す図。
【図7】ゼブラフィッシュのKiSS−2のcDNA及び推定アミノ酸配列を示す図。
【図8】ネッタイツメガエルのGPR54−1aのcDNA及び推定アミノ酸配列を示す図。
【図9】ネッタイツメガエルのGPR54−1bのcDNA及び推定アミノ酸配列を示す図。
【図10】ネッタイツメガエルのGPR54−2のcDNA及び推定アミノ酸配列を示す図。
【図11】ゼブラフィッシュのGPR54−1のcDNA及び推定アミノ酸配列を示す図。
【図12】ヒトと、ネッタイツメガエルと、ゼブラフィッシュとの間でのKiSS−1アレルのシンテニーを示す図。
【図13】カモノハシGPR54−1と、ヒトGPR54と、ネッタイツメガエルGPR54−1aとのアレルのシンテニーを示す図。
【図14】GPR54のリガンド選択性を示すグラフ。
【技術分野】
【0001】
本発明は、新規メタスチン同族体に関し、具体的には、KiSS−2ペプチドと、該ペプチドをエンコードするポリヌクレオチドと、該ポリヌクレオチドを含む発現コンストラクトと、これらを含む、疾患を治療するための組成物と、該組成物を投与するステップを含む疾患の治療方法と、前記ペプチドに対する抗体と、該抗体を含む疾患の診断用キットとに関する。
【背景技術】
【0002】
キスペプチンはオーファンレセプターのGPR54の内因性リガンドとして発見された(非特許文献1、2及び3)。KiSS−1遺伝子には癌転移(metastasis)抑制作用があることから、当該遺伝子の産物であるキスペプチンは癌治療に役立つと当初考えられ、生体内から分離精製されたアミノ酸54個からなるKiSS−1遺伝子産物の部分断片でC末端がアミド化されたペプチドはメタスチンと命名された。しかし、GPR54レセプターの異常が低ゴナドトロピン・性腺機能低下症と密接に結びついていることが報告され、メタスチンは性成熟に重要なペプチドであることが示された(非特許文献4)。その後、メタスチンは中枢神経系、特に視床下部で強く発現しており、生殖腺刺激ホルモン放出ホルモン(GnRH)のニューロンに直接働いてGnRHの発現・分泌を促進する作用があることが判明した(非特許文献5)。このようにメタスチンは視床下部−下垂体−性腺軸の生殖神経内分泌系において重要な働きを持つペプチドである。
【非特許文献1】Welch, D. R.ら、(1994) Oncogene 9: 255-262.
【非特許文献2】Lee, J.-H.ら、(1996) J. Nat. Cancer Inst. 88: 1731-1737, 1996.
【非特許文献3】Ohtaki, T.ら、(2001) Nature 411: 613-617.
【非特許文献4】Seminara, S. B.ら、(2003) New Eng. J. Med. 349: 1614-1627.
【非特許文献5】Kinoshita, M.ら、(2005) Endocrinology 146: 4431-4436, 2005. ヒトのKiSS−1遺伝子は、145個のアミノ酸からなるタンパク質をコードしており、このうちN末端の19個のアミノ酸はシグナルペプチドで、第68番目から第121番目までの54個のアミノ酸からなるタンパク質が切り出されたものがメタスチンである。以下では、KiSS遺伝子産物のタンパク質を「キスペプチン」といい、キスペプチンの第68番目から第121番目までの54個のアミノ酸からなるキスペプチン断片を「キスペプチン68−121」と表す。同様にメタスチンについても第45番目のアミノ酸から第54番目のアミノ酸までの10個のアミノ酸からなるペプチドを「メタスチン45−54」と表す(非特許文献6及び7)。キスペプチン68−121はメタスチン1−54と同一のペプチドであり、メタスチン45−54はキスペプチン112−121と同一のペプチドである。メタスチンのC末端がアミド化されない場合にはGPR54レセプターへのアゴニスト活性は非常に減弱するが、C末端がアミド化されていればN末端アミノ酸が除去されていてもGPR54レセプターへのアゴニスト活性を有する。実際、メタスチン40−54や、メタスチン45−54でもGPR54レセプターへのアゴニスト活性はメタスチンよりも3倍ないし10倍アゴニスト活性が高い(非特許文献3)。GPR54レセプターへのアゴニスト活性を有する最短のキスペプチン断片であるキスペプチン112−121又はメタスチン45−54をそれぞれキスペプチン−10又はメタスチン−10と表す。キスペプチン68−121又はメタスチン1−54をキスペプチン−54又はメタスチン−54と表す。
【非特許文献6】Seminara, S. B.(2005)J. Clin. Endocr. Metab. 90: 6738-6740.
【非特許文献7】Dhillo, W. S.ら、(2005)J. Clin. Endocr. Metab. 90: 6609-6615. メタスチン−10又はメタスチン−54はともにC末端がアルギニン−フェニルアラニン−NH2であるが、これと同一のC末端構造を有するペプチドのファミリーが存在する。アルギニン及びフェニルアラニンの1文字表記であるR及びFと末端アミド基を有することからRFアミドペプチドと総称される。RFアミドペプチドには、鳥類の脳ペプチド(gonadotropin-inhibitory hormone)のように生殖腺刺激ホルモンの放出を抑制する作用を有するものがある(非特許文献8)が、摂食行動に関与するRFアミドペプチドも知られている(非特許文献9)。KiSS遺伝子及びGPR54遺伝子はともに膵臓で強く発現する(非特許文献3)が、GPR54遺伝子のノックアウトマウスは生殖機能以外には異常がみられない(非特許文献4)。そこで、メタスチンとそのレセプターであるGPR54遺伝子産物とが関与する経路には代替的な経路が存在し、未知の機能を担っている可能性がある。かかる代替的経路にはメタスチンと類似のアミノ酸配列を有するC末端がアミド化されたペプチドホルモン、すなわちメタスチンと同じファミリーに属する同族体が関与すると考えられる。
【非特許文献8】Tsutsui, K.ら、(2000)Biochem. Biophys. Res. Commun. 275: 661-667.
【非特許文献9】Dockray, G.J.(2004)Exp. Physiol. 89: 229-235.
【発明の開示】
【発明が解決しようとする課題】
【0003】
そこで、発明者らは新規メタスチン同族体を探索し、KiSS−1のサブファミリーであるKiSS−1a及びKiSS−1bと、KiSS−1とは異なる別のファミリーメンバーであるKiSS−2の遺伝子及びその産物であるペプチドを発見した。本発明はこの発見に基づいて新規メタスチン同族体とその用途を提供することを課題とする。
【課題を解決するための手段】
【0004】
本発明は配列番号3又は4に列挙されるアミノ酸配列からなるペプチドを提供する。
【0005】
本発明のペプチドはC末端がアミド化されている場合がある。
【0006】
本発明は、本発明のペプチドをエンコードするポリヌクレオチドを提供する。
【0007】
本発明は、本発明のポリヌクレオチドを含み、本発明のペプチドを産生する発現コンストラクトを提供する。
【0008】
本発明は、本発明の発現コンストラクトを含み、本発明のペプチドを産生する宿主細胞を提供する。
【0009】
本発明は、本発明のペプチドと、該ペプチドの塩と、前記ペプチド又はその塩のプロドラッグと、本発明のポリヌクレオチドと、本発明の発現コンストラクトと、本発明の宿主細胞とからなるグループから選択される少なくとも1つを含む、疾患を予防又は治療するための医薬品組成物を提供する。
【0010】
本発明の医薬品組成物において、前記疾患は生殖機能障害の場合がある。
【0011】
本発明の医薬品組成物において、前記疾患は癌又は腫瘍の場合がある。
【0012】
本発明は、本発明のペプチドと特異的に結合する抗体を提供する。
【0013】
本発明の抗体は、モノクローナル抗体の場合がある。
【0014】
本発明は、本発明の抗体を含む疾患の診断用キットを提供する。
【0015】
本発明の診断用キットにおいて、前記疾患は生殖機能障害の場合がある。
【0016】
本発明の診断用キットにおいて、前記疾患は癌又は腫瘍の場合がある。
【0017】
本発明は、ヒト又はヒト以外の動物の疾患の予防又は治療方法であって、本発明の医薬品組成物と、本発明の抗体とのうち少なくとも1つを投与するステップを含む、予防又は治療方法を提供する。
【0018】
本発明の予防又は治療方法において、前記疾患は生殖機能障害の場合がある。
【0019】
本発明の予防又は治療方法において、前記疾患は癌又は腫瘍の場合がある。
【0020】
本明細書において「タンパク質」、「ペプチド」、「オリゴペプチド」又は「ポリペプチド」とは、2個以上のアミノ酸がペプチド結合で連結した化合物である。「タンパク質」、「ペプチド」、「オリゴペプチド」又は「ポリペプチド」は、メチル基を含むアルキル基、リン酸基、糖鎖、及び/又は、エステル結合その他の共有結合による修飾を含む場合がある。また、「タンパク質」、「ペプチド」、「オリゴペプチド」又は「ポリペプチド」は、金属イオン、補酵素、アロステリックリガンドその他の原子、イオン、原子団か、他の「タンパク質」、「ペプチド」、「オリゴペプチド」又は「ポリペプチド」か、糖、脂質、核酸等の生体高分子か、ポリスチレン、ポリエチレン、ポリビニル、ポリエステルその他の合成高分子かを共有結合又は非共有結合により結合又は会合している場合がある。
【0021】
本明細書でアミノ酸を表す場合、L−アスパラギン、L−グルタミン等の化合物名で表す場合と、Asn、Gln等の慣用の3文字表記で表す場合とがある。化合物名で表す場合には、アミノ酸のα炭素に関する立体配置を示す接頭辞(L−又はD−)を用いて表す。慣用の3文字表記で表す場合には、該3文字表記は特に断りのない限りL体のアミノ酸を表す。本明細書において、アミノ酸は、アミノ基とカルボキシル基とが少なくとも1個の炭素原子を介して結合した化合物であって、ペプチド結合により重合することが可能ないずれかの化合物を指す。本明細書におけるアミノ酸は、生体内でメッセンジャーRNAからリボゾームで合成されるタンパク質の翻訳に用いられる20種類のL−アミノ酸とこれらの立体異性体であるD−アミノ酸とを含むがこれらに限定されない、いずれかの天然又は非天然のアミノ酸を含む場合がある。
【0022】
また、本明細書でペプチドを表す場合、ペプチドを構成するアミノ酸残基は、慣用の3文字表記で示され、ハイフンで結んで表される。例えば2個のアミノ酸の3文字表記がハイフンで結ばれて表される場合には、左側のアミノ酸のカルボキシル基と右側のアミノ酸のアミノ基とがペプチド結合したジペプチドであることを表す。したがってAsn−Alaは、L−アスパラギンのカルボキシル基とL−アラニンのアミノ基とがペプチド結合したジペプチドであって、L−アスパラギンのアミノ基とL−アラニンのカルボキシル基は修飾されていないことを意味する。本明細書において、C末端がアミド化されたペプチドは「Arg−Phe−NH2」のように表記する。アミノ酸配列を配列番号を示して引用するアミノ酸配列からなるペプチドは、C末端がアミド化されている場合と、アミド化されていない場合とを含む。
【0023】
本発明のペプチドは、動物の組織から精製して調製される場合がある。代替的には、本発明のペプチドのアミノ酸配列をエンコードするヌクレオチド配列からなるポリヌクレオチドを、無生物発現系か、宿主生物及び発現ベクターを使用する発現系で発現させることにより産生される。前記宿主生物は、大腸菌、枯草菌等のような原核生物と、酵母、菌類、植物、動物等のような真核生物とを含む。本発明の宿主生物及び発現ベクターを使用する発現系は、細胞や組織のような生物の一部か、生物の個体全体かの場合がある。本発明のペプチドは、GPR54レセプターへのアゴニスト活性を有することを条件として、無生物発現系又は宿主生物及び発現ベクターを使用する発現系の他の成分が混在する状態で本発明の医薬品組成物に使用されてもよく、あるいは、精製された状態で本発明の医薬品組成物に使用されてもよい。
【0024】
本発明の医薬品組成物と、診断用キットと、治療方法との対象となる疾患は、生殖機能障害と、マトリックスメタロプロテイナーゼ活性の調節異常と、走化性その他の細胞遊走の異常と、細胞外マトリクスの分解その他細胞の行動異常と、癌又は腫瘍と、糖尿病その他の糖代謝異常と、高脂血症その他の脂質代謝異常と、急性もしくは慢性膵炎と、高血圧症、脳梗塞、心筋梗塞、動脈硬化その他の心臓循環器系疾患と、肥満、食欲減退、食欲亢進その他の摂食行動の異常とを含む。生殖機能障害には、1次性徴及び/又は2次性徴の異常を含む生殖腺の発生及び/又は分化の異常と、性行動の異常と、月経異常その他の排卵異常と、受精又は卵割の異常と、着床の異常を含む妊娠異常と、乳腺の絨毛癌、胞状奇胎、胎児の発育不全と、侵入奇胎その他の胎盤の形成及び/又は機能の異常と、切迫流産その他分娩誘発の異常とを含むがこれらに限られない。前記癌又は腫瘍は、絨毛癌、胞状奇胎、トロホブラストーマ、前立腺癌、精巣腫瘍、卵巣腫瘍、乳癌、子宮内膜症、子宮筋腫、膵癌、胆嚢癌、胆管癌、大腸癌、食道癌、胃癌、肝癌、悪性メラノーマ、骨肉腫、甲状腺乳頭癌を含むがこれらに限られない。
【0025】
本発明の抗体は、ポリクローナル抗体又はモノクローナル抗体と、該抗体の抗原結合断片と、該抗原結合断片を含むキメラ抗体又は組換え抗体とからなるグループから選択される場合がある。抗体の抗原結合断片は、抗原結合に参加する抗体の部分を指す。前記抗原結合部位は、重(H)鎖及び軽(L)鎖のN末端の可変(V)領域のアミノ酸残基によって形成される。
【0026】
抗体は、当業者に知られたさまざまな技術によって調製される場合がある。例えば、Harlow及びLane、Antibodies: A Laboratory Manual、Cold Spring Harbor Laboratory、1988を参照せよ。
【0027】
本発明で用いられるポリクローナル抗体は、本発明のペプチドを免疫原として、ほ乳類(例えば、マウス、ラット、ウサギ、ヒツジ又はヤギ)又は鳥類(例えばニワトリ)のいずれかの動物宿主に注射される。ウシ血清アルブミン又はスカシ貝ヘモシアニン(keyhole limpet hemocyanine)のような担体タンパク質と連結される場合に優れた免疫応答が誘発される場合がある。前記免疫原は、1回又は2回以上のブースター免疫を取り込んだ予め定められたスケジュールに従って、前記動物宿主に注射されることが好ましい。前記免疫原は、完全又は不完全フロイントアジュバントその他の免疫増強剤に混合して前記動物宿主に注射される場合がある。本発明のポリクローナル抗体は、かかる抗血清から、例えば適当な固体支持体に結合された本発明のペプチドを用いるアフィニティクロマトグラフィーによって精製される場合がある。
【0028】
本発明で用いられるモノクローナル抗体は、Kohler及びMilstein、Eur.J.Immunol.6:511-519、1976の技術と、その改良技術を用いて調製される場合がある。これらの方法は、所望の特異性を有する抗体を産生できる不死性細胞株の調製を伴う。かかる細胞株は上記のとおり免疫された動物宿主由来の脾臓細胞から作成される場合がある。前記脾臓細胞は、さまざまな方法で不死化され、抗体産生能を有する不死化細胞株が調製される。前記脾臓細胞は、例えば、前記免疫された動物と同種かあるいは異種の動物由来のミエローマ細胞との融合によって不死化される。当業者に周知のさまざまな融合技術を用いる場合がある。例えば、前記脾臓細胞とミエローマ細胞とは非イオン性界面活性剤と数分間混合され、それからハイブリッド細胞の増殖は支持するがミエローマ細胞の増殖は支持しない選択培地に低濃度でプレートされる。好ましい選択技術はHAT(ヒポキサンチン、アミノプテリン、チミジン)選択を用いる。通常約1ないし2週間の十分な時間の後、ハイブリッドのコロニーが観察される。シングルコロニーが選択され、その培養上清が前記ポリペプチドに対する結合活性についてテストされる。反応性及び特異性が高いハイブリドーマが好ましい。限界希釈法によるクローニングを繰り返すことにより、反応性及び特異性が高い抗体を安定的に大量に産生するハイブリドーマのクローンが選択される。モノクローナル抗体は増殖中の選択されたハイブリドーマクローン由来の細胞株のコロニーの上清から単離される場合がある。さらに、マウスのような適当な脊椎動物宿主の腹腔内に前記ハイブリドーマ細胞株を注射するような、収率を向上させるためのさまざまな技術が用いられる場合がある。モノクローナル抗体は前記ハイブリドーマ細胞腹水又は血液から回収される場合がある。汚染物は、クロマトグラフィー、ゲルろ過、沈殿及び抽出のような従来技術によって前記抗体から除去される場合がある。
【0029】
本発明で用いられる抗体の抗原結合断片は、それぞれタンパク質分解酵素パパイン又はペプシンでインタクトなポリクローナル抗体又はモノクローナル抗体を分解して得られるFab断片又はF(ab’)2断片の他、天然抗体分子の抗原認識能及び結合能の多くを保持する抗原結合部位を含む非共有結合的なVH及びVL領域のヘテロ2量体を含むFv断片を含む。
【0030】
本発明で用いられる組換え抗体は、適当な細菌宿主への形質転換か、適当なほ乳類細胞宿主へのトランスフェクションかを含む抗体遺伝子の発現クローニングによって調製される場合がある。本発明で用いられるキメラ抗体は、前記本発明の組換え抗体の抗原結合部位が本発明のペプチドと特異的に結合できるように同種又は異種の抗体の定常ドメインによって支持された融合タンパク質である。本発明で用いられるキメラ抗体には、抗体軽鎖可変領域(VL)に操作可能に連結された抗体重鎖可変領域(VH)を含む短鎖可変部抗体(scFv)と、ラクダ科(Camelidae、ラクダ、ヒトコブラクダ、ラマを含む)の動物が産生する軽鎖がないIgGのクラスであるラクダ重鎖抗体(HCAb)又はその重鎖可変部ドメイン(VHH)とを含む。本発明の組換え抗体は原核生物及び真核生物由来の遺伝子発現システムを用いて大量に調製することができる。
【0031】
本発明のペプチドの塩としては、例えば金属塩、アンモニウム塩、有機塩基との塩、無機酸との塩、有機酸との塩、塩基性または酸性アミノ酸との塩等が挙げられる。金属塩の好適な例としては、例えばナトリウム塩、カリウム塩等のアルカリ金属塩;カルシウム塩、マグネシウム塩、バリウム塩等のアルカリ土類金属塩;アルミニウム塩等が挙げられる。有機塩基との塩の好適な例としては、例えばトリメチルアミン、トリエチルアミン、ピリジン、ピコリン、2,6−ルチジン、エタノールアミン、ジエタノールアミン、トリエタノールアミン、シクロヘキシルアミン、ジシクロヘキシルアミン、N,N'−ジベンジルエチレンジアミン等との塩が挙げられる。無機酸との塩の好適な例としては、例えば塩酸、臭化水素酸、硝酸、硫酸、リン酸等との塩が挙げられる。有機酸との塩の好適な例としては、例えばギ酸、酢酸、トリフルオロ酢酸、フタル酸、フマル酸、シュウ酸、酒石酸、マレイン酸、クエン酸、コハク酸、リンゴ酸、メタンスルホン酸、ベンゼンスルホン酸、p−トルエンスルホン酸等との塩が挙げられる。塩基性アミノ酸との塩の好適な例としては、例えばアルギニン、リジン、オルニチン等との塩が挙げられ、酸性アミノ酸との塩の好適な例としては、例えばアスパラギン酸、グルタミン酸等との塩が挙げられる。このうち、薬学的に許容し得る塩が好ましい。例えば、化合物内に酸性官能基を有する場合にはアルカリ金属塩(例、ナトリウム塩、カリウム塩等)、アルカリ土類金属塩(例、カルシウム塩、マグネシウム塩、バリウム塩等)等の無機塩、アンモニウム塩等が、また、化合物内に塩基性官能基を有する場合には、例えば塩酸、臭化水素酸、硝酸、硫酸、リン酸等無機酸との塩、または酢酸、フタル酸、フマル酸、シュウ酸、酒石酸、マレイン酸、クエン酸、コハク酸、メタンスルホン酸、p−トルエンスルホン酸等の有機酸との塩が好ましい。
【0032】
本発明のペプチド又はその塩のプロドラッグは、生体内における生理条件下で酵素や胃酸等による反応により本発明のペプチドに変換するペプチド又はその誘導体、すなわち酵素的に酸化、還元、加水分解等を起こして本発明のペプチドに変化するペプチド又はその誘導体、例えば、胃酸等により加水分解等を起こして本発明のペプチド又はその塩に変化するペプチド又はその誘導体をいう。本発明のペプチド又はその塩のプロドラッグは、本発明のペプチドのアミノ基がアシル化、アルキル化、リン酸化されたペプチド又はその誘導体(例えば、本発明のペプチドのアミノ基がエイコサノイル化、アラニル化、ペンチルアミノカルボニル化、(5−メチル−2−オキソ−1,3−ジオキソレン−4−イル)メトキシカルボニル化、テトラヒドロフラニル化、ピロリジルメチル化、ピバロイルオキシメチル化、tert−ブチル化されたペプチド誘導体等)と、本発明のペプチドの水酸基がアシル化、アルキル化、リン酸化、ホウ酸化されたペプチド誘導体(例えば、本発明ペプチドの水酸基がアセチル化、パルミトイル化、プロパノイル化、ピバロイル化、スクシニル化、フマリル化、アラニル化、ジメチルアミノメチルカルボニル化されたペプチド誘導体等)と、本発明のペプチドのカルボキシル基がエステル化、アミド化されたペプチド誘導体(例えば、本発明のペプチドのカルボキシル基がエチルエステル化、フェニルエステル化、カルボキシメチルエステル化、ジメチルアミノメチルエステル化、ピバロイルオキシメチルエステル化、エトキシカルボニルオキシエチルエステル化、フタリジルエステル化、(5−メチル−2−オキソ−1,3−ジオキソレン−4−イル)メチルエステル化、シクロヘキシルオキシカルボニルエチルエステル化、メチルアミド化されたペプチド誘導体等)とを含むが、これらに限られない。これらのペプチド誘導体は公知の方法によって本発明のペプチドから製造することができる。本発明のプロドラッグは、広川書店1990年刊「医薬品の開発」第7巻分子設計163頁から198頁に記載されているような生理的条件で本発明のペプチドに変化するものであってもよい。
【0033】
本発明の医薬品組成物は、毒性が低く、医薬製剤の製造法で一般的に用いられている自体公知の手段に従って、本発明の化合物をそのままあるいは薬理学的に許容される担体と混合して、例えば、錠剤(糖衣錠、フィルムコーティング錠を含む)、散剤、顆粒剤、カプセル剤、(ソフトカプセルを含む)、液剤、注射剤、坐剤、徐放剤等の医薬製剤として、経口的または非経口的(例、局所、直腸、静脈投与等)に安全に投与することができる。本発明の化合物の本発明製剤中の含有量は、製剤全体の約0.01ないし約100重量%である。本発明の化合物の投与量は、投与対象、対象臓器、症状、投与方法などにより差異はあるが、経口投与の場合、一般的に、癌患者(体重60kgとして)に対して、一日につき約0.1〜100mg、好ましくは約1.0〜50mg、より好ましくは約1.0〜20mgである。非経口的に投与する場合は、その1回投与量は投与対象、対象臓器、症状、投与方法などによっても異なるが、例えば、注射剤の形では通常、癌患者(体重60kgとして)に対して、一日につき約0.01〜30mg程度、好ましくは約0.1〜20mg程度、より好ましくは約0.1〜10mg程度を静脈注射により投与するのが好都合である。他の動物の場合も、体重60kg当たりに換算した量を投与することができる。
【0034】
本発明の医薬品組成物の製造に用いられてもよい薬理学的に許容される担体は、製剤素材として慣用の各種有機あるいは無機担体物質を含み、例えば固形製剤における賦形剤、滑沢剤、結合剤及び崩壊剤、あるいは液状製剤における溶剤、溶解補助剤、懸濁化剤、等張化剤、緩衝剤及び無痛化剤等を含む。更に必要に応じ、通常の防腐剤、抗酸化剤、着色剤、甘味剤、吸着剤、湿潤剤等の添加物を適宜、適量用いることもできる。賦形剤は、例えば乳糖、白糖、D−マンニトール、デンプン、コーンスターチ、結晶セルロース、軽質無水ケイ酸等が挙げられる。滑沢剤としては、例えばステアリン酸マグネシウム、ステアリン酸カルシウム、タルク、コロイドシリカ等を含む。結合剤は、例えば結晶セルロース、白糖、D−マンニトール、デキストリン、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、デンプン、ショ糖、ゼラチン、メチルセルロース、カルボキシメチルセルロースナトリウム等を含む。崩壊剤は、例えばデンプン、カルボキシメチルセルロース、カルボキシメチルセルロースカルシウム、カルボキシメチルスターチナトリウム、L−ヒドロキシプロピルセルロース等を含む。溶剤は、例えば注射用水、アルコール、プロピレングリコール、マクロゴール、ゴマ油、トウモロコシ油、オリーブ油等を含む。溶解補助剤は、例えばポリエチレングリコール、プロピレングリコール、D−マンニトール、安息香酸ベンジル、エタノール、トリスアミノメタン、コレステロール、トリエタノールアミン、炭酸ナトリウム、クエン酸ナトリウム等を含む。懸濁化剤は、例えばステアリルトリエタノールアミン、ラウリル硫酸ナトリウム、ラウリルアミノプロピオン酸、レシチン、塩化ベンザルコニウム、塩化ベンゼトニウム、モノステアリン酸グリセリン、等の界面活性剤;例えばポリビニルアルコール、ポリビニルピロリドン、カルボキシメチルセルロースナトリウム、メチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース等の親水性高分子等を含む。等張化剤は、例えばブドウ糖、 D−ソルビトール、塩化ナトリウム、グリセリン、D−マンニトール等を含む。緩衝剤は、例えばリン酸塩、酢酸塩、炭酸塩、クエン酸塩等の緩衝液等を含む。無痛化剤は、例えばベンジルアルコール等を含む。防腐剤は、例えばパラヒドロキシ安息香酸エステル類、クロロブタノール、ベンジルアルコール、フェネチルアルコール、デヒドロ酢酸、ソルビン酸等を含む。抗酸化剤は、例えば亜硫酸塩、アスコルビン酸、α−トコフェロール等を含む。
【0035】
さらに、本発明の医薬品組成物は、本発明の医薬品組成物以外の薬物と併用して使用することができる。本発明の医薬品組成物と併用し得る薬物(以下、併用薬物と略記する場合がある)としては、例えば、癌治療のための化学療法剤、ホルモン療法剤、免疫療法剤等の薬剤(以下、併用薬剤と略記する)と組み合わせて用いることができる。前記「化学療法剤」は、例えばアルキル化剤、代謝拮抗剤、抗癌性抗生物質、植物由来抗癌剤等を含む。「アルキル化剤」は、例えば、ナイトロジェンマスタード、塩酸ナイトロジェンマスタード−N−オキシド、クロラムブチル、シクロフォスファミド、イホスファミド、チオテパ、カルボコン、トシル酸インプロスルファン、ブスルファン、塩酸ニムスチン、ミトブロニトール、メルファラン、ダカルバジン、ラニムスチン、リン酸エストラムスチンナトリウム、トリエチレンメラミン、カルムスチン、ロムスチン、ストレプトゾシン、ピポブロマン、エトグルシド、カルボプラチン、シスプラチン、ミボプラチン、ネダプラチン、オキサリプラチン、アルトレタミン、アンバムスチン、塩酸ジブロスピジウム、フォテムスチン、プレドニムスチン、プミテパ、リボムスチン、テモゾロミド、トレオスルファン、トロフォスファミド、ジノスタチンスチマラマー、カルボコン、アドゼレシン、システムスチン、ビゼレシン等を含む。「代謝拮抗剤」は、例えば、メルカプトプリン、6−メルカプトプリンリボシド、チオイノシン、メトトレキサート、エノシタビン、シタラビン、シタラビンオクフォスファート、塩酸アンシタビン、5−FU系薬剤(例、フルオロウラシル、テガフール、UFT、ドキシフルリジン、カルモフール、ガロシタビン、エミテフールなど)、アミノプテリン、ロイコボリンカルシウム、タブロイド、ブトシン、フォリネイトカルシウム、レボフォリネイトカルシウム、クラドリビン、エミテフール、フルダラビン、ゲムシタビン、ヒドロキシカルバミド、ペントスタチン、ピリトレキシム、イドキシウリジン、ミトグアゾン、チアゾフリン、アンバムスチン等を含む。「抗癌性抗生物質」は、例えば、アクチノマイシンD、アクチノマイシンC、マイトマイシンC、クロモマイシンA3、塩酸ブレオマイシン、硫酸ブレオマイシン、硫酸ペプロマイシン、塩酸ダウノルビシン、塩酸ドキソルビシン、塩酸アクラルビシン、塩酸ピラルビシン、塩酸エピルビシン、ネオカルチノスタチン、ミスラマイシン、ザルコマイシン、カルチノフィリン、ミトタン、塩酸ゾルビシン、塩酸ミトキサントロン、塩酸イダルビシン等を含む。「植物由来抗癌剤」は、例えば、エトポシド、リン酸エトポシド、硫酸ビンブラスチン、硫酸ビンクリスチン、硫酸ビンデシン、テニポシド、パクリタキセル、ドセタクセル、ビノレルビン等を含む。前記「ホルモン療法剤」は、例えば、ホスフェストロール、ジエチルスチルベストロール、クロロトリアニセリン、酢酸メドロキシプロゲステロン、酢酸メゲストロール、酢酸クロルマジノン、酢酸シプロテロン、ダナゾール、アリルエストレノール、ゲストリノン、メパルトリシン、ラロキシフェン、オルメロキフェン、レボルメロキシフェン、抗エストロゲン(例、クエン酸タモキシフェン、クエン酸トレミフェンなど)、ピル製剤、メピチオスタン、テストロラクトン、アミノグルテチイミド、LH−RHアゴニスト(例、酢酸ゴセレリン、ブセレリン、リュープロレリンなど)、ドロロキシフェン、エピチオスタノール、スルホン酸エチニルエストラジオール、アロマターゼ阻害薬(例、塩酸ファドロゾール、アナストロゾール、レトロゾール、エキセメスタン、ボロゾール、フォルメスタンなど)、抗アンドロゲン(例、フルタミド、ビカルタミド、ニルタミドなど)、5α-レダクターゼ阻害薬(例、フィナステリド、エプリステリドなど)、副腎皮質ホルモン系薬剤(例、デキサメタゾン、プレドニゾロン、ベタメタゾン、トリアムシノロンなど)、アンドロゲン合成阻害薬(例、アビラテロンなど)、レチノイドおよびレチノイドの代謝を遅らせる薬剤(例、リアロゾールなど)等を含み、なかでもLH−RHアゴニスト(例、酢酸ゴセレリン、ブセレリン、リュープロレリンなど)が好ましい。前記「免疫療法剤(BRM)」としては、例えば、ピシバニール、クレスチン、シゾフィラン、レンチナン、ウベニメクス、インターフェロン、インターロイキン、マクロファージコロニー刺激因子、顆粒球コロニー刺激因子、エリスロポイエチン、リンホトキシン、BCGワクチン、コリネバクテリウムパルブム、レバミゾール、ポリサッカライドK、プロコダゾール等を含む。
【0036】
本発明の医薬品組成物と併用薬物とを組み合わせることにより、
(1)本発明の医薬品組成物又は併用薬物を単独で投与する場合に比べて、その投与量を軽減することができる、
(2)患者の症状(軽症、重症など)に応じて、本発明の医薬品組成物と併用する薬物を選択することができる、
(3)本発明の医薬品組成物と作用機序が異なる併用薬物を選択することにより、治療期間を長く設定することができる、
(4)本発明の医薬品組成物と作用機序が異なる併用薬物を選択することにより、治療効果の持続を図ることができる、
(5)本発明の医薬品組成物と併用薬物とを併用することにより、相乗効果が得られる、などの優れた効果を得ることができる。
【0037】
以下、本発明の医薬品組成物と併用薬物を併用して使用することを「本発明の併用剤」と称する。本発明の併用剤の使用に際しては、本発明の化合物と併用薬物の投与時期は限定されず、本発明の化合物またはその医薬組成物と併用薬物またはその医薬組成物とを、投与対象に対し、同時に投与してもよいし、時間差をおいて投与してもよい。併用薬物の投与量は、臨床上用いられている投与量に準ずればよく、投与対象、投与ルート、疾患、組み合わせ等により適宜選択することができる。本発明の併用剤の投与形態は、特に限定されず、投与時に、本発明の医薬品組成物と併用薬物とが組み合わされていればよい。このような投与形態は、例えば、(1)本発明の医薬品組成物と併用薬物とを同時に製剤化して得られる単一の製剤の投与、(2)本発明の医薬品組成物とを別々に製剤化して得られる2種2種の製剤の投与の製剤の同一投与経路での同時投与、(3)本発明の医薬品組成物と併用薬物とを別々に製剤化して得られる2種の製剤の同一投与経路での時間差をおいての投与、(4)本発明の医薬品組成物と併用薬物とを別々に製剤化して得られる2種の製剤の異なる投与経路での同時投与、(5)本発明の医薬品組成物と併用薬物とを別々に製剤化して得られる2種の製剤の異なる投与経路での時間差をおいての投与(例えば、本発明の医薬品組成物;併用薬物の順序での投与、あるいは逆の順序での投与)等を含む。
【0038】
本発明の医薬品組成物又は併用薬物は、固形製剤(例、散剤、顆粒剤、錠剤、カプセル剤)などの経口投与用製剤か、坐剤などの直腸投与用製剤か、注射用製剤かの剤形で製造される場合がある。本発明の医薬品組成物又は併用薬物は、徐放性マイクロカプセル剤等の徐放性製剤として製造される場合がある。あるいは、ポリエチレングリコール付加その他の薬物送達技術を適用した製剤として製造される場合がある。
【0039】
本発明の疾患の治療方法は、ヒトに施される場合がある。あるいは、ヒト以外の動物に施される場合がある。
【発明を実施するための最良の形態】
【0040】
以下の実施例によって本発明について詳細な説明を行なうが、本発明はこれらの実施例により何ら制限されるものではない。
【0041】
材料及び方法
(使用したペプチド)
ヒト(Homo sapiens)のKiSS−10(H−10;配列番号1のアミノ酸配列を有しC末端がアミド化されたペプチド)と、齧歯類のKiSS−10Y(R−10;配列番号2のアミノ酸配列を有しC末端がアミド化されたペプチド)と、アフリカツメガエル(Xenopus laevis)のKiSS−10F(X2−10;配列番号3のアミノ酸配列を有しC末端がアミド化されたペプチド)と、アフリカツメガエルのKiSS−12F(X2−12F;配列番号4のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ゼブラフィッシュ(Danio rerio)のZ1−10(配列番号5のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ゼブラフィッシュのZ1−15(配列番号6のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ゼブラフィッシュのZ1−p15(配列番号7のアミノ酸配列を有し、N末端がピログルタミン酸化され、C末端がアミド化されたペプチド)と、ゼブラフィッシュのZ2−10(配列番号8のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ゼブラフィッシュのZ2−12(配列番号9のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ネッタイツメガエル(Xenopus tropicalis)のX1a−14(配列番号10のアミノ酸配列を有しC末端がアミド化されたペプチド)と、ネッタイツメガエルのX1b−p15(配列番号11のアミノ酸配列を有し、N末端がピログルタミン酸化され、C末端がアミド化されたペプチド)とを、Anygen(韓国)から購入した。
【0042】
(使用したプラスミド)
pcDNA3発現ベクターを、Invitrogenから購入した。pCMVβ−Galベクターを、Clontechから取得した。シグナル伝達特異的レポーターベクターCRE−luc及びSRE−lucを、Stratageneから購入した。Institut de Recherche Interdisciplinare(ベルギー、ブリュッセル)のMarc Parmentier博士から分譲されたhGPR54のcDNAをpcDNA3発現ベクターにリクローニングした。
【0043】
(動物及び組織の調製)
ネッタイツメガエルの成体と、アフリカツメガエルの成体とは、それぞれ、Xenopusone(米国)と、ゼノパス養殖教材(茨城県古河市)とから入手した。メダカ(Oryzias latipes)及びゼブラフィッシュの成魚は業者から購入した。ニホンカナヘビ(Takydromus tachydromoides)の成体は2007年に東京郊外で採集した。前記動物は、水槽で飼育した。Korea University College of Medicine(高麗大学校医学部、韓国、ソウル市)及び早稲田大学で、実験動物管理規則に従って実施した。
【0044】
(ゲノムデータベース解析)
ゼブラフィッシュ、アフリカツメガエル及びヒトのキスペプチンのアミノ酸配列をクエリー配列としてネッタイツメガエルのゲノムデータベースをTBLASTNアルゴリズム(Ensembl Genome Browser;http://www.ensembl.org/)により検索した。さまざまな脊椎動物種におけるGPR54遺伝子を特定するために、ヒト及びウシガエルのGPR54のアミノ酸配列についてゼブラフィッシュ、メダカ、カモノハシ(Ornithorhynchus anatinus)及びネッタイツメガエルのゲノムデータベースをTBLASTNアルゴリズムにより検索した。クエリー配列とヒットしたゲノム配列との間のアミノ酸配列のアライメントはBlast View(http://www.ensembl.org/)を用いて行い、また、CBS Prediction Serviceにより提供されるHMMgene(v.1.1)プログラム(http://www.cbs.dtu.dk/services/HMMgene/)を用いてエクソン及びイントロンの配列を予想した。ヒト、ネッタイツメガエル、ゼブラフィッシュ、メダカ及びカモノハシの、GPR54遺伝子座を含むゲノム領域のコンティグ図の比較を行なった後、ゲノムシンテニー解析を実施した。
【0045】
(KiSSペプチド及びそのレセプターcDNAのクローニング)
アフリカツメガエルのKiSS−1及びKiSS−2ペプチドをエンコードするcDNAのクローニングは以下のとおり行なった。ネッタイツメガエルのKiSS−1ペプチドのcDNA配列に基づき、2種類の順方向プライマーと、3種類の逆方向プライマーとを合成した(オペロンバイオテクノロジー株式会社)。前記2種類の順方向プライマーを配列番号12及び13に、前記3種類の逆方向プライマーを配列番号14〜16に、それぞれ示す。また、ゲノムデータベースからネッタイツメガエルのKiSS−2ペプチドのcDNA配列を推定し、2種類の順方向プライマーと、3種類の逆方向プライマーとを合成した。前記2種類の順方向プライマーを配列番号17及び18に、前記3種類の逆方向プライマーを配列番号19〜21に、それぞれ示す。sepasol抽出法により単離したアフリカツメガエルの脳の全RNAと、前記プライマーとを用いてRT−PCR法により合成されたPCR産物を、ゲル電気泳動とMicroSpin Column(GEヘルスケアバイオサイエンス株式会社)とを用いて精製し、pGEM−T Easy vector(Promega)にサブクローニングした。PCR断片のDNA配列は、universal M13 primerより増幅したDNAをABI 3730XL DNA analyzer(Applied Biosystems)でサイクルシーケンシング反応により決定した。
ゼブラフィッシュ及びネッタイツメガエルのGPR54及びそのファミリー遺伝子をエンコードするcDNAのクローニングは以下のとおり行なった。ゼブラフィッシュ及びネッタイツメガエルのGPR54のcDNA配列に基づき、3種類の順方向プライマーと、3種類の逆方向プライマーとを合成した。前記3種類の順方向プライマーを配列番号22〜24に、前記3種類の逆方向プライマーを配列番号25〜27に、それぞれ示す。sepasol抽出法により単離した脳の全RNAと、前記プライマーとを用いてRT−PCR法により合成されたPCR産物を、ゲル電気泳動とMicroSpin Columnとを用いて精製し、pGEM−T Easy vectorにサブクローニングした。cDNAの構造を配列決定により確認した後、cDNAをpcDNA3発現ベクターにリクローニングした。
【0046】
(抗体の調製)
Azumaya,Y.、Kominami,S.及びTsutsui,K.(1998)J.Exp.Zool.281:90−96に記載の方法に従い、m−マレイミドベンゾイル−N−ヒドロキシサクシンイミドエステル(MBS)を用いてスカシ貝ヘモシアニン(KLH)に結合した合成ペプチドを抗原として使用して、抗血清を作成した。推定KiSS−2ペプチドのC末端部分とN末端部分とに対する抗血清は、それぞれ、SKFNFNPFGLRF(配列番号28)というアミノ酸配列のC末端のフェニルアラニンにシステインを付加したペプチド(配列番号29)をKLHに結合したものと、配列番号28のアミノ酸配列のN末端のセリンにシステインを付加したペプチド(配列番号30)をKLHを結合したものとを抗原として作成された。1mg/mLの抗原溶液をフロイント完全アジュバント(Difco)と混合し、マウスに注射した。50μgのブースター注射の後、各々のマウスから血液を回収し、適切に希釈した抗血清を、ELISA法により分析した。推定KiSS−2ペプチドのC末端部分に対する抗血清と、N末端部分に対する抗血清とは、それぞれ免疫組織化学的検査と、KiSS−2ペプチドのアフィニティー精製とに用いられた。
【0047】
(ペプチドの抽出及びアフィニティー精製)
アフリカツメガエルの成体(500匹)から回収した脳組織をドライアイスで凍結させ、使用するまで−80°Cで保存した。Tsutsui Kら、(2000)Biochem Biophys Res Commun 275:661−667、Koda Aら、(2002)Endocrinology 143:411−419、及び、Ukena Kら、(2003)Endocrinology 144:3879−3884に記載の方法に従い、脳組織を5%酢酸中で煮沸及びホモジナイズした。ホモジネートを10,000g、4°Cで30分間遠心分離し、得られた沈殿を再度ホモジナイズ及び遠心分離した。回収した遠心上清を、ロータリーエバポレーターを45°Cで使用することにより濃縮した後、ディスポーサブルのC−18カートリッジカラム(Mega Bond−Elut;Varian)に適用した。Ukena Kら、(2003)、Ukena Kら、(2002)FEBS Lett 512:255−258、及び、Bonnard Eら、(2001)Peptides 22:1085−1092に記載の方法に従い、前記カラムに保持された物質を60%メタノールで溶出し、イムノアフィニティー精製に供した。イムノアフィニティーカラムは、推定KiSS−2ペプチドのC末端側のアミノ酸配列に対する抗血清を臭化シアンで活性化してSepharose 4B(Amersham)に結合して調製された。60%メタノールで溶出した前記脳抽出物を前記イムノアフィニティーカラムに4°Cで適用し、0.1%の2−メルカプトエタノールを含む0.3M酢酸で溶出した。Koda Aら(2002)、及び、Ukena Kら、(2003)に記載の方法に従い、1mLの分画を、前記推定KiSS−2ペプチドに対する抗血清を用いて、ドットイムノブロットアッセイにより分析した。
【0048】
(HPLC分析及び構造決定)
前記ドットイムノブロットアッセイ陽性分画をHPLCカラム(ODS−80TM、東ソー株式会社)に適用し、100分間で0.1%のトリフルオロ酢酸を含む10%アセトニトリルから0.1%のトリフルオロ酢酸を含む50%アセトニトリルまで溶離液組成を変化させる線形グラジエント、0.5mL/分の流速の設定で100分間の溶出を行なった。溶出画分を2分ごとに回収した後、イムノブロッティングで陽性の画分を、逆相HPLCカラム(ODS−80TM、東ソー株式会社)にさらに適用し、0.1%のトリフルオロ酢酸を含む31.4%のアセトニトリルを使用するイソクラティック条件下、流速0.5mL/分で25分間溶出を行なった。単離した物質を、マトリックス支援レーザー脱離イオン化飛行時間型質量分析(MALDI−TOF MS)装置(
AXIMA−CFR plus、株式会社島津製作所)によるアミノ酸配列解析に供した。
【0049】
(In Situハイブリダイゼーション)
アフリカツメガエルの脳におけるKiSS−2ペプチドのmRNAの発現の局在はin situハイブリダイゼーション法により解析した。簡潔には、アフリカツメガエルの成体の脳下垂体を含む脳組織を、冷却した4%のパラホルムアルデヒドを含む0.1Mリン酸緩衝液に24時間浸漬し、冷却したスクロース溶液(30%のスクロースを含むNaCl/Pi)中に浸漬した。前記脳組織をOCTコンパウンド(Miles Inc.)包埋後、−20°Cでクライオスタットを用いて10μmの厚さに切断し、3−アミノプロピルトリエトキシシランでコーティングしたスライドの上に戴置した。Sawadaら、(2002)Eur J Biochem 269:6000−6008、
Ukena Kら、(1999)Endocrinology 40:805−813、及び、Sawada Kら、(2002)J Endocrinol 174:395−402に記載の方法に従い、ジゴキシゲニン(DIG)標識アンチセンスRNAプローブを使用して、in situハイブリダイゼーションを行った。前記DIG標識アンチセンスRNAプローブは、RNA標識キット(Roche Diagnostics)を用いて、ペプチド前駆体cDNAの一部から作り出した。KiSS−2ペプチドmRNAのin situハイブリダイゼーションの特異性についての対照実験は、DIG標識アンチセンスRNAプローブの共通配列に相補的なDIG標識センスRNAプローブを使用することにより行った。
【0050】
(免疫組織化学的検査)
アフリカツメガエルの脳組織を、ブアン液で固定し、−20°Cで20μmの厚さの前頭断又は矢状断面を調製した。非特異的結合成分をブロッキングした後、前記切片を1:1,000に希釈したKiSS−2ペプチドのN末端側のペプチドに対する抗血清と4°Cで終夜反応させた後、アルカリフォスファターゼ標識ヤギ抗マウスIgGと反応させた。染色の特異性を評価するための対照実験には、飽和濃度(1mL当たり10μgのKiSS−2ペプチド)の抗原と予め終夜インキュベーションして中和させた前記抗体(希釈比1:1,000)を使用した。
【0051】
(ルシフェラーゼアッセイ)
アフリカミドリザル腎臓線維芽細胞由来CV−1細胞は10%ウシ胎児血清を含むダルベッコ改変イーグル培地(DMEM)中で培養した。ルシフェラーゼアッセイの際は、トランスフェクションの1日前に、細胞を24ウェルプレートに播種した。トランスフェクションは、100ngの内部標準プラスミドpCMVb−Galとともに、100ngの各受容体cDNAと、SRE−lucベクター又はCRE−lucベクターの100ngをSuperFect reagent(QIAGEN)とともに使用して実施した。トランスフェクションの1日後、細胞を24時間血清が欠乏した状態におき、その後、キスペプチンを6時間負荷した。細胞を回収し、細胞抽出液中のルシフェラーゼ活性を、Lumat LB9501(EG & G Berthold,Bad Wildbad,Germany)を用いる標準的な方法に従い決定した。ルシフェラーゼ活性は、β−Gal値を使用して正規化した。
【0052】
(データ解析)
全てのアッセイは、1回の実験では同一実験条件のサンプルを3個用意して並列して測定し、かつ、同じ実験を3回繰り返し行った。データ解析は、S字状用量応答曲線での非線形回帰を用いて行った。最大応答値の50%の刺激を誘発させるアゴニスト濃度(EC50)と、最大応答値を誘発させるアゴニスト濃度(Emax)とを、GraphPad PRISM2 software(GraphPad、米国、カリフォルニア州、サンジエゴ)を使用して算出した。全てのデータを、少なくとも2回の独立した実験結果の平均値±SEMとして表示した。
【0053】
結果
メタスチンのアミノ酸配列をさまざまな動物種のゲノムデータベースを用いて解析したところ、従来推定されていた10個のアミノ酸残基からなるKiSS−1ペプチドとは別に、12個のアミノ酸残基からなる新規メタスチン誘導体ペプチド(KiSS−2)をエンコードするDNA配列を発見した。次に、新規メタスチン同族体ペプチドKiSS−2ペプチドが脳内の特定ニューロンで発現し、GPR54遺伝子ファミリーの内因性リガンドとして機能することが確かめた。また、KiSS−2ペプチドが実際にアフリカツメガエルの脳組織に存在すること、KiSS−2ペプチドに対する抗血清が脳の特定の領域と反応すること、及び、KiSS−2ペプチドがKiSS−1ペプチドのレセプターとして知られているGPR54に対してアゴニスト活性を示すことを確かめた。以下にその実験結果を説明する。
【実施例1】
【0054】
KiSS相同ペプチドのゲノムデータベース解析の結果
図1−Aは、従来GRP54レセプターの内因性リガンドとして知られていたヒトKiSS−1ペプチド(キスペプチン−10)との相同性が高い他の脊椎動物の相同ペプチドの推定アミノ酸配列のアライメント結果を示す。全ゲノム配列情報が得られる脊椎動物のうち、硬骨魚類のゼブラフィッシュではヒトKiSS−1ペプチドと相同性のあるアミノ酸配列が2個見つかった。このうち一方はヒトKiSS−1ペプチドと10個のうち2個のアミノ酸が異なり、他方は3個のアミノ酸が異なる。そこで前者をゼブラフィッシュのKiSS−1ペプチド、後者をKiSS−2ペプチドと分類した。また、ネッタイツメガエルではヒトKiSS−1ペプチドと相同性のあるアミノ酸配列が3個見つかったが、これらのうち1個はゼブラフィッシュKiSS−2ペプチドと同一のアミノ酸配列であるのでこれをネッタイツメガエルのKiSS−2ペプチドと分類し、残る2個の相同ペプチドのうちヒトKiSS−1ペプチドとの相同性の高い方をKiSS−1a、ゼブラフィッシュKiSS−1と相同性の高い方をKiSS−1bと分類した。これらの分類をもとに無顎類のヤツメウナギ(lamprey)、軟骨魚類のゾウザメ(Callorhinchus milii)、硬骨魚類のメダカ、両生類のアフリカツメガエル、カモノハシ及びヒトのメタスタチン相同ペプチド、すなわち、KiSS−1ペプチド、KiSS−1aペプチド、KiSS−1bペプチド及びKiSS−2ペプチドのアミノ酸配列のアライメントを行った。図1−AではヒトKiSS−1ペプチドに対応するアミノ酸配列と、アフリカツメガエルKiSS−2ペプチドに対応するアミノ酸配列とをそれぞれ四角で囲んだ。ネッタイツメガエルの相同ペプチドのうちの一方はゼブラフィッシュの相同ペプチドと相同性を最大化するためにギャップを挿入し、該ギャップはハイフンで示した。保存アミノ酸残基には影をつけた。アミノ酸配列は、GenBankにより提供されるヒトKiSS−1(NP_002247)、ゼブラフィッシュKiSS−1(EF690279)、ヤツメウナギKiSS−1(EB722290及びEB722291)のcDNA配列から推定した。アフリカツメガエルKiSS−1、ネッタイツメガエルKiSS−1a、ネッタイツメガエルKiSS−1b、ニホンカナヘビKiSS−2(AB435432)、アフリカツメガエルKiSS−2(AB435389)、ネッタイツメガエルKiSS−2、ゼブラフィッシュKiSS−2、メダカKiSS−2(AB435386)のcDNAをクローニングされた。他の推定cDNA配列は、Ensemble Genome Browser又はGenBankにより提供されるメダカKiSS−1(BAAF04056457、1−5915)、カモノハシKiSS−1(AAPN01239752,1688−1735)、カモノハシKiSS−2(AAPN01043280、1−5154)、ゾウサメKiSS−1(AAVX01162971、1−922)、ゾウサメKiSS−2(AAVX01172388、1−2587)、ヤツメウナギKiSS−2のゲノム配列に基づいて取得した。クローニングしたcDNA配列はアスタリスク(*)で、部分的なcDNA配列はシャープ(#)で示した。推定シグナルペプチド(下線部)は、SignalP 3.0(http://www.cbs.dtu.dk/services/SignalP/)を使用して推定した。
【0055】
我々は、Blast検索により、EnsembleゲノムデータベースとNCBIデータベースとからカモノハシ、ゾウサメ及びヤツメウナギにおいて類似のcDNAも見出した(図1−A)。我々は、キスペプチンcDNAの3種類の形態をKiSS−1、KiSS−1b及びKiSS−2に分類した。KiSS−1のcDNAは、10番目のチロシン残基又はフェニルアラニン残基がアミド化されている場合がある10個のアミノ酸残基からなる推定ペプチド(キスペプチン−10)をエンコードした。キスペプチン−10のアミノ酸配列は、脊椎動物において高度に保存される(図1−Aのボックス内のキスペプチン−10の配列を参照せよ。)。
【0056】
図1−Bは、ヒトKiSS−1ペプチドと相同性のある遺伝子の分子進化についての模式図である。KiSS−1遺伝子及びKiSS−2遺伝子は、遺伝子/染色体の重複と遺伝子の修復及び欠損とのような進化のメカニズムを通じて、共通の祖先遺伝子から分化したと予想される。両生類は2種類のKiSS−1遺伝子を有する。アミノ酸配列の同一性を基準として、ネッタイツメガエルKiSS−1aは哺乳類のKiSS−1(mKiSS−1)と類似し、ネッタイツメガエルKiSS−1bは魚類のKiSS−1(fKiSS−1)と類似する。
【実施例2】
【0057】
KiSS−1及びKiSS−2ペプチドをエンコードするcDNAのクローニング及び特徴づけ
アフリカツメガエル、ネッタイツメガエル及びゼブラフィッシュのメタスチン相同ペプチドと推定されるペプチドをエンコードするcDNAのクローニングを行なった。アフリカツメガエルのKiSS−1のcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号31及び32と、図5−Aとにそれぞれ示す。アフリカツメガエルのKiSS−2のcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号33及び34と、図5−Bとにそれぞれ示す。ネッタイツメガエルのKiSS−1aのcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号35及び36と、図6−Aとにそれぞれ示す。ネッタイツメガエルのKiSS−1bのcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号37及び38と、図6−Bとにそれぞれ示す。ネッタイツメガエルのKiSS−2のcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号39及び40と、図6−Cとにそれぞれ示す。ゼブラフィッシュのKiSS−2のcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号41及び42と、図7とにそれぞれ示す。
【0058】
Blast検索により、EnsembleゲノムデータベースとNCBIデータベースとからカモノハシ、ゾウサメ及びヤツメウナギにおいて類似のcDNAが見いだされた(図1−A)。キスペプチンcDNAをKiSS−1、KiSS−1a、KiSS−1b及びKiSS−2に分類した。KiSS−1又はKiSS−1aのcDNAは、10番目のチロシン残基又はフェニルアラニン残基がアミド化されている場合がある10個のアミノ酸残基からなる推定ペプチド(キスペプチン−10)をエンコードした。キスペプチン−10のアミノ酸配列は、脊椎動物において高度に保存される。(図1−Aの四角で囲んだキスペプチン−10の配列を参照せよ。)KiSS−1のcDNAに加えて、ネッタイツメガエルにおいて、キスペプチン−10と類似する推定デカペプチドをエンコードする別のcDNA(KiSS−1b)がクローニングされた(図1−A)。推定KiSS−1bペプチド(YNVNSFGLRF(配列番号43))のアミノ酸配列とキスペプチン−10のアミノ酸配列との間には1個のアミノ酸残基の違いしかない(図1−A)。そこで、X.tropicalisのようにキスペプチン−10と類似する推定デカペプチドをエンコードするcDNAが2種類存在する場合には、1種類しか存在しない生物におけるKiSS−1と同じものをKiSS−1aとする。
【0059】
一方でKiSS−2のcDNAは12個のアミノ酸残基からなる新規な推定ペプチドをエンコードし、該推定ペプチドにおいて12番目のフェニルアラニン残基はアミド化されている場合がある。KiSS−2ペプチドの推定配列とキスペプチン−10の推定配列との間には60%の相同性があった。(図1−Aの四角で囲んだKiSS−2ペプチド及びキスペプチン−10の配列を参照せよ。)前記KiSS−2ペプチドのアミノ酸配列は、各々の末端に、細胞内タンパク質分解部位としてのグリシンC末端アミド化シグナル(glycine C−terminal amidation signal)及び塩基性アミノ酸と隣接している。この12個のアミノ酸残基からなるペプチドの配列と、シグナルペプチドの配列とは、脊椎動物において高度に保存されている。
【実施例3】
【0060】
両生類KiSS−2ペプチドの単離及び同定
KiSS−2推定ペプチドは内在の成熟リガンドとして働くことを確認する必要がある。そこで、脳からの成熟ペプチド単離と、その同定とを行った。アフリカツメガエルの脳における成熟KiSS−2ペプチドを特定するために、前記推定KiSS−2ペプチドのC末端のアミノ酸配列に対する特異的な抗血清を使用するイムノアフィニティー精製を行った。図2−Aは、逆相HPLCカラム(ODS−80TM)に保持された物質のHPLCプロファイルである。前記逆相カラムに適用され保持された物質を、100分間で0.1%のトリフルオロ酢酸を含む10%アセトニトリルから0.1%のトリフルオロ酢酸を含む50%アセトニトリルまで溶離液組成を変化させる線形グラジエントと、0.5mL/分の流速との設定で100分間溶出させ、1画分当たり1mLの50個の画分に分画した。各々の画分について一定分量(1/100量)を蒸発乾固し、蒸留水に溶解し、ニトロセルロース膜上にスポットした。アフリカツメガエルのKiSS−2推定ペプチドへの抗血清に対する免疫陽性の画分が、溶離液中のアセトニトリル含量が34−36%のとき、すなわち、溶出時間70−74分に対応する画分に溶出された。(水平のバーで示した。)これらの免疫陽性の画分は、31.4%のアセトニトリルを使用するイソクラティック条件下で逆相HPLC精製を使用して再度クロマト分離された。
【0061】
図2−Bは、図2−Aに示したHPLCでの分画により得られた免疫陽性の画分を、逆相HPLCカラム(ODS−80TM)によりさらに精製したときのHPLCプロファイルである。0.1%のトリフルオロ酢酸を含む31.4%のアセトニトリルを使用するイソクラティック条件下、流速0.2mL/分で30分間溶出を行なった。免疫陽性の物質は保持時間14分で溶出し、そのピークを矢印で示した。図2−Bに示されるように、精製した物質は単一のピークとして溶出された。前記精製した物質のアミノ酸配列を決定したところ、SKFNFNPFGLRF(配列番号28)という配列であった。
【0062】
単離したペプチドのC末端の構造を明らかにするために、MALDI−TOF MSを使用した。図2−Cは、イムノアフィニティ精製されたKiSS−2ペプチドのMALDI−TOF MSによる検出を示す図である。タンデムMS分析により、1472.78m/z([M+H]+)という観測質量数を有する精製物質のフラグメンテーションパターンが得られた。観察されたスペクトルは、推定KiSS−2ペプチドのフラグメントイオンの典型的な質量値を示した。この結果から、アフリカツメガエルKiSS−2ペプチドは、12個のアミノ酸からなる配列番号4に列挙されるアミノ酸配列を有し、C末端がアミド化されたペプチドであると同定された。このペプチドのスペクトルにおける分子イオンピークは、1472.84m/z([M+H]+)であった。この値は、推定アミド化ペプチドについて算出した質量数1478.78m/z([M+H]+)に近い値であった。得られたMS/MSフラグメンテーションパターンにより、KiSS−2ペプチドは、アミノ酸配列がSKFNFNPFGLRF(配列番号28)であり、かつ、C末端のフェニルアラニンがアミド化された構造であると特定することができた。以上より、単離した天然ペプチドは、12個のアミノ酸残基からなり、C末端のアミノ酸配列がRFであり、かつ、C末端のフェニルアラニンがアミド化された構造を有することが確認された。
【実施例4】
【0063】
KiSS−1及びKiSS−2のペプチド及びmRNAの局在
図3−Aは、アフリカツメガエルの脳組織におけるKiSS−1及びKiSS−2のmRNAの局在をin situハイブリダイゼーションにより解析した結果の顕微鏡写真である。図3−A(1)は、アフリカツメガエルの脳の前頭断切片をジゴキシン標識したKiSS−1アンチセンスRNAプローブと反応させた後、酵素標識された抗ジゴキシン抗体を用いて発色反応により検出した結果である。図3−A(3)及び(5)は、アフリカツメガエルの脳の前頭断切片をジゴキシン標識したKiSS−2アンチセンスRNAプローブと反応させた後、酵素標識された抗ジゴキシン抗体を用いて発色反応により検出した結果である。図3−A(2)、(4)及び(6)は、対照実験としてセンスRNAプローブを使用した結果である。スケールバーは100μmを表す。KiSS−1ペプチドのアンチセンスRNAプローブは腹側視床下部(VH)で強く反応した(図3−A(1))。KiSS−2ペプチドのアンチセンスRNAプローブは、腹側視床下部(VH)に加えて、視索前野(POA)とも強く反応した(図3−A(3)及び(5))。対照実験では発色はみられなかった。したがって、KiSS−1及びKiSS−2ペプチドのアンチセンスRNAプローブの反応はこれらのmRNAに特異的であると結論された。
【0064】
図3−Bは、アフリカツメガエルの脳におけるKiSS−2ペプチドの細胞局在を示す顕微鏡写真である。図3−B(1)及び(3)は脳の前頭断切片を、X.laevisのKiSS−2ペプチドに対する抗血清と反応させ、その後、標識された2次抗体を用いて発色反応により検出した結果である。図3−B(2)及び(4)は、対照実験として、飽和濃度の合成KiSS−2ペプチドといっしょにプレインキュベーションした抗血清と反応させ、その後、標識された2次抗体を用いて発色反応により検出した結果である。スケールバーは100μmを表す。アフリカツメガエルのKiSS−2ペプチドに対する抗血清はPOAの細胞体に反応した。また、前記抗血清は前記POA及びVHから投射してその終末が正中隆起(ME)に達する神経繊維とも反応した。対照実験では発色はみられなかった。したがって、アフリカツメガエルのKiSS−2ペプチドに対する抗血清の反応はKiSS−2ペプチドに特異的であると結論された。
【0065】
図3−Cは、背側からアフリカツメガエルの中枢神経系組織における前頭断切片の位置を示す模式図と、各切片でのKiSS−2ペプチドに対する抗血清との反応がみられる部位を示した模式図とを示す。黒塗りの丸(●)は免疫陽性の細胞体を表し、黒塗りの星(★)は免疫陽性の線維を表す。Accは側坐核を、BNSTは分界条床核を、DBはブローカー対角帯核を、dpは背側外套を、iglは内部顆粒細胞層を、Isは峡部核を、MEは正中隆起を、MeAは内側扁桃核を、NPvは室傍核を、Pdは末端部を、Piは中間部を、Pnは後葉を、POAは視索前野を、SCは視交叉上核を、TPは後側結節を、VHは腹側視床下部核を、VMは視床腹内側核をそれぞれ表す。図3−Cの各切片に示すとおり、免疫陽性の線維は、視床下部のいくつかの領域と、脳の他の領域とにも多数存在した。
【0066】
KiSS−2ペプチド免疫陽性の神経軸索は正中隆起に観察された。POAの巨細胞性のニューロンはその軸索を正中隆起の下垂体門脈に投射していることが知られているので、POAに存在するKiSS−2ペプチドニューロンが正中隆起の下垂体門脈を介して主要な下垂体前葉ホルモンを調節している可能性がある。
【0067】
KiSS−2ペプチドはPOAとVHのニューロンの他に、前脳の神経軸索で観察された。両生類のPOAとVHに電気的な刺激を与える実験により、これらの神経核がゴナドトロピンと性ステロイドの分泌を調節していること、POAを電気刺激することでカエルの交尾期の鳴き声を喚起すること、その中でも特に腹側のPOAは交尾期の鳴き声ジェネレーターを活性化することが知られているため、KiSS−2ペプチドは、視床下部・下垂体の生殖内分泌系を制御するというKiSS−1と類似の機能の他に、動物の繁殖行動を制御する神経ペプチドとしての機能も有すると考えられる。
【実施例5】
【0068】
GPR54相同遺伝子のゲノムデータベース解析の結果
図4は、さまざまな脊椎動物種から同定されたGPR54のアミノ酸配列のアライメントと、GPR54のcDNAの構造とを示す図である。図4−Aは、さまざまな脊椎動物種から同定されたGPR54のアミノ酸配列のアライメントを示す図である。相同性を最大化するためにギャップを挿入し、該ギャップはハイフンで示した。保存アミノ酸残基には影をつけた。右側の数字は、アミノ酸残基の位置を示す。推定7回膜貫通ヘリックス(TMH)を、整列させた配列の上側に示す。黒塗りの三角(▲)はスプライシングジャンクションを示す。シャープ(#)はEnsembl Genome Browserにより提供されるゲノムデータベースから推定された推定アミノ酸配列を示す。Human;Chromosome 19:868203:873745:1、Zeburafish−2;Chromosome 2:28224113:28274250:1、Zebrafish−1:Chromosome 5:62011059:62019702:−1、medaka−2;Chromosome 17:29839761:29855706:−1、medaka−1;Chromosome 9:4480521:4500733:−1、XT−1a;scaffold_289:1010897:1051639:−1、XT−1b;scaffold_122:1203307:1243558:−1、XT−2;scaffold_2567:37018:33176:1及びscaffold_4:511186−518389:1、Ornithorhynchus anatinus−1(Orn−1);Ultra_266:390150:395924:1、Ornithorhynchus anatinus−2(Orn−2);Contig_15629:1100:6789:1。GPR54遺伝子のオープンリーディングフレームは、ゼブラフィッシュのGPR54−1では364個のアミノ酸からなるタンパク質を、ネッタイツメガエルGPR54−1aでは366個のアミノ酸からなるタンパク質を、ネッタイツメガエルGPR54−1bでは367個のアミノ酸からなるタンパク質を、ネッタイツメガエルGPR54−2では369個のアミノ酸からなるタンパク質を、それぞれエンコードする。
【0069】
図4−Bは、GPR54のcDNAの構造を示す図である。GPR54のcDNAは5個のエクソンからなる。影付きのボックスの中のローマ数字は膜貫通ヘリックスドメインの番号を表す。ゼブラフィッシュ及びネッタイツメガエル由来の推定GPR54の配列をEnsemblゲノムデータベースにおいて見出した。ゼブラフィッシュ(z)についてはGPR54−1はChromosome 5 location 62,011,059−62,019,702に見出された。ネッタイツメガエル(xt)についてはGPR54−1a(XT−1a)はscaffold_289 location 1,010,897−1,051,639に、XT−1bはscaffold_122 location 1,203,307−1,243,558に、XT−2はscaffold_2567 location 37,018−33,176とscaffold_4 location 511,186−518,389とに、それぞれ見出された。bfFPR54のハイドロパシー分析により、Gタンパク質共役型受容体(GPCR)に典型的な疎水性アミノ酸残基からなる7種類の配列の存在が明らかとなった。ゲノム分析及びcDNA分析により、全てのGPR54が5個のエクソンを有し、かつ、スプライシングジャンクションの位置が保存されていることが明らかになった。
【0070】
図4−Cは、GPR54遺伝子の分子進化についての仮説を示す模式図である。GPR54は、遺伝子/染色体の重複と遺伝子の修復及び欠損とのような進化のメカニズムを通じて、共通の祖先遺伝子から分化したと予想される。両生類は3種類の形態のGPR54遺伝子を有する。ネッタイツメガエルのGPR54−1aはヒト及びカモノハシのGPR54−1のホモログであり、ネッタイツメガエルのGPR54−1bは魚類のGPR54−1の同族体である。アミノ酸配列の同一性を基準として、ネッタイツメガエルGPR54−2は魚類のGPR54−2の同族体であると考えられる。
【0071】
図12は、ヒトと、ツメガエルと、ゼブラフィッシュとの間でのKiSS−1遺伝子座のシンテニーを示す図である。ヒト、ネッタイツメガエル及びゼブラフィッシュのゲノム構成は、Ensembl Genome Browserから取得した。PLEKHA6はプレクストリン相同ドメイン含有ファミリーAメンバー6であり、RENはレニン前駆体である。
【0072】
図13は、カモノハシGPR54−1と、ヒトGPR54と、ネッタイツメガエルGPR54−1aとの間でのシンテニーを示す図である。前記GPR54の遺伝子座のヌクレオチド配列データは、Ensembl Genome Browserから取得した。C19orf21は未特定タンパク質C19orf21であり、MED16はRNAポリメラーゼII転写サブユニット16のメディエーターであり、PALMはパラレミンであり、PSAT1はホスホセリンアミノトランスフェラーゼ1アイソフォームであり、PTBP1はポリピリミジントラクト結合タンパク質1(PTB)であり、WDR18はWD反復タンパク質18であり、ZCCH6はジンクフィンガーCCHCドメイン含有タンパク質6である
ゲノムシンテニー解析(図13)及び相同性解析(表1)に基づき、ネッタイツメガエル及び魚類のGPR54を分類した。ゲノムシンテニー解析により、ネッタイツメガエルGPR54−1aと、ヒトGPR54と、カモノハシGPR54−1とが、未特定タンパク質C19orf21(C19orf21)、RNAポリメラーゼII転写サブユニット16のメディエーター(MED16)、パラレミン(paralemmin、PALM)、ポリピリミジントラクト結合タンパク質1(PTBP1)、WD反復タンパク質(WDR18)を含む、共通の遺伝子座を含むゲノム領域に局在することが明らかとなった。したがってネッタイツメガエルGPR54−1aは、ヒトGPR54のホモログであるようである。ヒトGPR54と、いずれかの魚類のGRP54との間ではシンテニーは観察されなかった。ネッタイツメガエルGPR54−1bと、メダカのGPR54−1とが、共通の遺伝子座のジンクフィンガーCCHCドメイン含有タンパク質6(ZCCH6)を有するゲノム領域に局在した。zGPR54−1を含むゲノム領域はZCCH6を有しないが、ホスホセリンアミノトランスフェラーゼ1アイソフォーム(PSAT1)遺伝子座をメダカのゲノム領域と共有する。このシンテニー解析を支持して、魚類のGPR54は、3種類のネッタイツメガエルGPR中でネッタイツメガエルGPR54−1bと最も高い(58〜63%)アミノ酸配列の同一性を有する。したがってネッタイツメガエルGPR54−1bは、魚類のGPR54−1のホモログだと考えられる。ネッタイツメガエルGPR54−2と、魚類のGRP54−2との間では、非常に高いアミノ酸配列の同一性(69〜74%)を有していたが、シンテニーは観察されなかった。ネッタイツメガエルGPR54−1aは、ネッタイツメガエルGPR54(60%)よりもネッタイツメガエルGPR54−1b(70%)と高いアミノ酸配列同一性を有するので、ネッタイツメガエルGPR54−1a及びネッタイツメガエルGPR54−1bは遺伝子の重複により生成されたと考えられる。したがってGPR54遺伝子の進化の過程は、下で述べるようなものだと考えられる。全てのGPR54遺伝子において、5個のエクソンが存在し、かつ、スプライシングジャンクションが保存されており、類似の遺伝子構造を有する。したがってこれらは、共通の祖先遺伝子の遺伝子/染色体の重複により発生し、GPR54−1及びGPR54−2という2系列のGPR54を生成したと考えられる。両生類ではGPR54−1は、さらにもう1回の遺伝子/染色体の重複を受け、GPR54−1a及びGPR54−1bを生成した。哺乳類では単孔類は2種類のGPR54遺伝子を有する場合があるが、ヒトは、おそらく遺伝子欠損のために1種類のGPR54のみを有する(図4−C)。
【0073】
【表1】

【実施例6】
【0074】
GPR54レセプター相同タンパク質をエンコードするcDNAのクローニング
ゼブラフィッシュ及びネッタイツメガエルのGPR54cDNAクローニング
ネッタイツメガエル及びゼブラフィッシュのGPR54レセプター相同タンパク質と推定されるタンパク質をエンコードするcDNAのクローニングを行なった。Ensembl Genome Browserにより提供されるゲノム配列に基づき、ネッタイツメガエルのGPR54−1(XT−1a)、GPR54−2(XT−1b)及びGPR54−3(XT−2)と、ゼブラフィッシュのGPR54−1(Zebra−1)とのcDNAをPCR法により増幅させた。ネッタイツメガエルのGPR54−1aのcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号44及び45と、図8とにそれぞれ示す。ネッタイツメガエルのGPR54−1bのcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号46及び47と、図9とにそれぞれ示す。ネッタイツメガエルのGPR54−2のcDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号48及び49と、図10とにそれぞれ示す。ゼブラフィッシュのGPR54−1cDNAのヌクレオチド配列及び推定アミノ酸配列を、配列番号50及び51と、図11とにそれぞれ示す。
【実施例7】
【0075】
KiSS−2ペプチドのGPR54レセプターに対するアゴニスト活性
ヒトGPR54、ゼブラフィッシュGPR54−1、ゼブラフィッシュGPR54−2又はネッタイツメガエルGPR54−2のレセプターcDNAの発現コンストラクトと、SRE−lucベクターとをCV−1細胞に導入するトランスフェクションを行った。48時間後、トランスフェクションされた細胞に、10−10モル(0.1nM)から10−5モル(10μM)の濃度のヒトKiSS−1(H−10)、齧歯類KiSS−1(R−10)、ツメガエルのKiSS−1a(X1a−14)、KiSS−1b(X1b−p15)及びKiSS−2(X2−10、X2−12)、ゼブラフィッシュのKiSS−1(Z1−10、Z1−15、Z1−p15)及びKiSS−2(Z2−10、Z2−12)ペプチドを添加し、これらのKiSSペプチドによって誘導されたルシフェラーゼ活性を測定した。前記ルシフェラーゼ活性をレセプターのアゴニスト活性として各KiSSペプチドごとにプロットした結果を図14A−Dにそれぞれ示す。各KiSSペプチド濃度でのアゴニスト活性のプロットは、立ち上がりのKiSSペプチド濃度より1桁高い濃度でEC50に達し、さらに1桁高い濃度でプラトーに達するシグモイド曲線を示した。以下、EC50の値で比較・検討を行なった。
【0076】
ヒトGPR54に対するEC50は、ヒト及び齧歯類KiSS−1ペプチドではともに10−8モル、ネッタイツメガエルKiSS−2ペプチドでは10−7モル、ネッタイツメガエルKiSS−2ペプチドでは10−6モルであった(図14−A)。ヒト及び齧歯類のペプチドのヒトGPR54レセプターに対するアゴニスト活性はほぼ同じ強さであるが、ネッタイツメガエルKiSS−2ペプチドはヒト及び齧歯類よりも1桁低いアゴニスト活性を示し、ネッタイツメガエルKiSS−2ペプチドは、さらに約1桁低いアゴニスト活性を示した。以上の結果から、ネッタイツメガエルKiSS−2ペプチドはヒトでも薬理作用を示す可能性が明らかになった。
【0077】
ゼブラフィッシュGPR54−1に対するEC50は、ゼブラフィッシュKiSS−1ペプチドは10−7モル、ゼブラフィッシュKiSS−2ペプチド及びヒトKiSS−1ペプチドは10−6モルであった(図14−B)。KiSS−1ペプチドもKiSS−2ペプチドもゼブラフィッシュGPR54−1レセプターに対するアゴニスト活性を示した。しかし、ヒトKiSS−1及びゼブラフィッシュKiSS−2ペプチドのアゴニスト活性は、ゼブラフィッシュKiSS−1ペプチドのアゴニスト活性より1桁低かった。
【0078】
ゼブラフィッシュGPR54−2に対するEC50は、ゼブラフィッシュKiSS−1ペプチドは10−8モル、ヒトKiSS−1ペプチド及びゼブラフィッシュKiSS−2ペプチドは10−7モルであった(図14−C)。KiSS−1ペプチドもKiSS−2ペプチドもゼブラフィッシュGPR54−2レセプターに対するアゴニスト活性を示した。ゼブラフィッシュGPR54−1レセプターと同様に、ゼブラフィッシュGPR54−2レセプターに対するヒトKiSS−1及びゼブラフィッシュKiSS−2ペプチドのアゴニスト活性は、ゼブラフィッシュKiSS−1ペプチドのアゴニスト活性より1桁低かった。しかし、ゼブラフィッシュGPR54−2レセプターに対するアゴニスト活性は、ゼブラフィッシュGPR54−1レセプターに対するアゴニスト活性より1桁高かった。本実験の結果から、ゼブラフィッシュKiSS−1ペプチドとKiSS−2ペプチドが共に、ゼブラフィッシュ等の魚類において、GPR54−2レセプターに対して薬理作用を示すアゴニストとして使用できる可能性が明らかになった。
【0079】
ネッタイツメガエルGPR54−2に対するEC50は、ネッタイツメガエルKiSS−1及びKiSS−2ペプチドは10−7モルであった(図14−D)。ツメガエルのKiSS−1aペプチド、KiSS−1bペプチド及びKiSS−2ペプチドのネッタイツメガエルGPR54−2レセプターに対するアゴニスト活性は、ほぼ同程度であった。ネッタイツメガエルのGPR54−2レセプターに対するアゴニスト活性は、ゼブラフィッシュGPR54−1(図14−B)と同程度であり、ヒトGPR54レセプター(図14−A)及びゼブラフィッシュGPR54−2レセプター(図14−C)よりも1桁低かった。本実験の結果から、ネッタイツメガエルKiSS−1a、KiSS−1bペプチド及びKiSS−2ペプチドがともに、ネッタイツメガエル等の両生類において、GPR54−2レセプターに対して薬理作用を示すアゴニストとして使用できる可能性が明らかになった。
【図面の簡単な説明】
【0080】
【図1−A】脊椎動物におけるKiSS−1ペプチド、KiSS−1bペプチド及びKiSS−2ペプチドの推定アミノ酸配列のアライメントを示す図。
【図1−B】KiSS−1遺伝子の分子進化についての仮想的な模式図。
【図2−A】逆相HPLCカラム(ODS−80TM)に保持された物質のHPLCプロファイル。
【図2−B】図2−Aに示したHPLCでの分画により得られた免疫陽性の画分を、逆相HPLCカラム(ODS−80TM)によりさらに精製したときのHPLCプロファイル。
【図2−C】イムノアフィニティ精製されたKiSS−2ペプチドのMALDI−TOF MSによる検出を示す図。
【図3−A】アフリカツメガエルの脳におけるKiSS−1 mRNA及びKiSS−2 mRNAの細胞局在を示す顕微鏡写真。
【図3−B】アフリカツメガエルの脳におけるKiSS−2ペプチドの細胞局在を示す顕微鏡写真。
【図3−C】アフリカツメガエルの脳におけるKiSS−2ペプチドに対する免疫陽性部位を示した前頭断の模式図。
【図4−A】さまざまな脊椎動物種から同定されたGPR54のアミノ酸配列のアライメントを示す図。
【図4−B】GPR54のcDNAの構造を示す図。
【図4−C】GPR54遺伝子の分子進化についての仮想的な模式図。
【図5−A】アフリカツメガエルのKiSS−1のcDNA及び推定アミノ酸配列を示す図。
【図5−B】アフリカツメガエルのKiSS−2のcDNA及び推定アミノ酸配列を示す図。
【図6−A】ネッタイツメガエルのKiSS−1aのcDNA及び推定アミノ酸配列を示す図。
【図6−B】ネッタイツメガエルのKiSS−1bのcDNA及び推定アミノ酸配列を示す図。
【図6−C】ネッタイツメガエルのKiSS−2のcDNA及び推定アミノ酸配列を示す図。
【図7】ゼブラフィッシュのKiSS−2のcDNA及び推定アミノ酸配列を示す図。
【図8】ネッタイツメガエルのGPR54−1aのcDNA及び推定アミノ酸配列を示す図。
【図9】ネッタイツメガエルのGPR54−1bのcDNA及び推定アミノ酸配列を示す図。
【図10】ネッタイツメガエルのGPR54−2のcDNA及び推定アミノ酸配列を示す図。
【図11】ゼブラフィッシュのGPR54−1のcDNA及び推定アミノ酸配列を示す図。
【図12】ヒトと、ネッタイツメガエルと、ゼブラフィッシュとの間でのKiSS−1アレルのシンテニーを示す図。
【図13】カモノハシGPR54−1と、ヒトGPR54と、ネッタイツメガエルGPR54−1aとのアレルのシンテニーを示す図。
【図14】GPR54のリガンド選択性を示すグラフ。
【特許請求の範囲】
【請求項1】
配列番号3又は4に列挙されるアミノ酸配列からなることを特徴とするペプチド。
【請求項2】
C末端がアミド化されたことを特徴とする請求項1に記載のペプチド。
【請求項3】
請求項1に記載のペプチドをエンコードすることを特徴とするポリヌクレオチド。
【請求項4】
請求項3に記載のポリヌクレオチドを含み、請求項1又は2に記載のペプチドを産生することを特徴とする発現コンストラクト。
【請求項5】
請求項4に記載の発現コンストラクトを含み、請求項1又は2に記載のペプチドを産生することを特徴とする宿主細胞。
【請求項6】
請求項1又は2に記載のペプチドと、該ペプチドの塩と、前記ペプチド又はその塩のプロドラッグと、請求項3に記載のポリヌクレオチドと、請求項4に記載の発現コンストラクトと、請求項5に記載の宿主細胞とからなるグループから選択される少なくとも1つを含むことを特徴とする、疾患を予防又は治療するための医薬品組成物。
【請求項7】
前記疾患は生殖機能障害であることを特徴とする、請求項6に記載の医薬品組成物。
【請求項8】
前記疾患は癌又は腫瘍であることを特徴とする、請求項6に記載の医薬品組成物。
【請求項9】
請求項1又は2に記載のペプチドと特異的に結合することを特徴とする抗体。
【請求項10】
モノクローナル抗体であることを特徴とする請求項9に記載の抗体。
【請求項11】
請求項9又は10に記載の抗体を含むことを特徴とする、疾患の診断用キット。
【請求項12】
前記疾患は生殖機能障害であることを特徴とする、請求項11に記載の診断用キット。
【請求項13】
前記疾患は癌又は腫瘍であることを特徴とする、請求項11に記載の診断用キット。
【請求項1】
配列番号3又は4に列挙されるアミノ酸配列からなることを特徴とするペプチド。
【請求項2】
C末端がアミド化されたことを特徴とする請求項1に記載のペプチド。
【請求項3】
請求項1に記載のペプチドをエンコードすることを特徴とするポリヌクレオチド。
【請求項4】
請求項3に記載のポリヌクレオチドを含み、請求項1又は2に記載のペプチドを産生することを特徴とする発現コンストラクト。
【請求項5】
請求項4に記載の発現コンストラクトを含み、請求項1又は2に記載のペプチドを産生することを特徴とする宿主細胞。
【請求項6】
請求項1又は2に記載のペプチドと、該ペプチドの塩と、前記ペプチド又はその塩のプロドラッグと、請求項3に記載のポリヌクレオチドと、請求項4に記載の発現コンストラクトと、請求項5に記載の宿主細胞とからなるグループから選択される少なくとも1つを含むことを特徴とする、疾患を予防又は治療するための医薬品組成物。
【請求項7】
前記疾患は生殖機能障害であることを特徴とする、請求項6に記載の医薬品組成物。
【請求項8】
前記疾患は癌又は腫瘍であることを特徴とする、請求項6に記載の医薬品組成物。
【請求項9】
請求項1又は2に記載のペプチドと特異的に結合することを特徴とする抗体。
【請求項10】
モノクローナル抗体であることを特徴とする請求項9に記載の抗体。
【請求項11】
請求項9又は10に記載の抗体を含むことを特徴とする、疾患の診断用キット。
【請求項12】
前記疾患は生殖機能障害であることを特徴とする、請求項11に記載の診断用キット。
【請求項13】
前記疾患は癌又は腫瘍であることを特徴とする、請求項11に記載の診断用キット。
【図3−C】


【図14】


【図1−A】


【図1−B】


【図2−A】


【図2−B】


【図2−C】


【図3−A】


【図3−B】


【図4−A】


【図4−B】


【図4−C】


【図5−A】


【図5−B】


【図6−A】


【図6−B】


【図6−C】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図14】


【図1−A】


【図1−B】


【図2−A】


【図2−B】


【図2−C】


【図3−A】


【図3−B】


【図4−A】


【図4−B】


【図4−C】


【図5−A】


【図5−B】


【図6−A】


【図6−B】


【図6−C】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2010−83793(P2010−83793A)
【公開日】平成22年4月15日(2010.4.15)
【国際特許分類】
【出願番号】特願2008−253859(P2008−253859)
【出願日】平成20年9月30日(2008.9.30)
【出願人】(899000068)学校法人早稲田大学 (602)
【Fターム(参考)】
【公開日】平成22年4月15日(2010.4.15)
【国際特許分類】
【出願日】平成20年9月30日(2008.9.30)
【出願人】(899000068)学校法人早稲田大学 (602)
【Fターム(参考)】
[ Back to top ]

