神経栄養因子介在疾患の治療
A/B−cisフロスタン、フロステン、スピロスタン及びスピロステンステロイド性サポゲニン及びそのエステル、エーテル、ケトン及びグリコシル化型から選択された薬剤を、例えばBDNF及び/又はGDNFなどの神経栄養因子(NFs)の自己制御恒常性を、恒常性を制御した状態で非毒性態様で対象の天然NFsを調整することによって、制限された対処可能な副作用で、誘発する。有効量の少なくとも一の薬剤は、ある範囲のNF介在疾患、特に、神経性、精神性、炎症性、アレルギー性、免疫性、及び腫瘍性疾患の治療又は予防に、及び、組織(例えば皮膚、骨、眼及び筋肉)の治癒、及び通常の皮膚、骨、眼、及び筋肉の健康を支援する場合を含む、ダメージを受けたあるいは異常な組織における又はこれに関連するニューロン又はその他の機能の回復又は正常化において、対象に投与される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、神経栄養因子介在疾患の治療及び予防に関するものであり、特に、神経疾患、精神疾患、炎症性疾患、アレルギー性疾患、免疫疾患、及び腫瘍性疾患、及び、損傷を受けたあるいは異常な組織内のあるいはこれに関連するニューロン機能及びその他の機能の回復あるいは正常化に関し、組織(例えば、皮膚、骨、目、及び筋肉)治癒と、通常の皮膚、骨、目及び筋肉の健康を支援する場合を含み、非治療的方法、及び、この方法に使用する化合物及び組成物に関する。
【背景技術】
【0002】
天然の神経栄養因子(NFs)には、ニューロトロフィン、形質転換増殖因子βスーパーファミリー、NFs及びニューロカインがあり、例えば、神経成長因子(NGF)、脳由来神経栄養因子(BDNF)、毛様神経栄養因子(CNTF)、ニューロトロフィン3(NT−3)、ニューロトロフィン4(NT−4)、及び神経膠細胞由来神経栄養因子(GDNF)がある。神経栄養因子は、神経栄養因子受容体(NFrs)として知られている細胞受容体に結合する。NFr TrkAは、NGFの効果を介在する。NFr TrkBは、BDNF、NT−3、及びNT−4によって活性化される。NFr TrkCは、NT−3によって活性化される。NFr低親和性NGF受容体(LNGFR又はp57)は、ニューロトロフィンファミリーのすべての員に結合する。GDNF用のNFrは、GDNF結合ドメイン(GDNF受容体α1(GRFα1))と、その受容体チロシン成分Ret.の二つの成分からなる。GDNFのGFRα1への結合は、Ret.を活性化する。
【0003】
天然のNFsの異常発現は、様々な疾患に関連しており、小分子非ペプチド治療薬の想定されるNF様活性あるいはNF活性化活動に基づいて、治療が考案されている。原理的には、小分子非ペプチド治療薬(非ポリペプチド及び非たんぱく質を含む)治療薬は、ペプチドに比較して、一般的に低コストであること、比較的製造が容易であること、取扱いと保存が容易であること、固有の毒性が低いこと、患者、特に脳への送達が比較的容易であること、研究開発段階における最適化が比較的容易であること、を含めてペプチド薬剤を超える様々な利点がある。ペプチドNFs、NF模倣体、及びNFエンハンサに潜在的な薬剤として相当の関心があるにもかかわらず、これらの固有の開発上の困難性、潜在的な毒性、及びその他の問題が見つかり、これらの可能性を大きく制限している。
【0004】
数々の低分子非ペプチドが、ある種の神経疾患や精神疾患の治療用に提案されている。以下の段落は、いくつかの公開された文献に注目している。しかしながら、これらの従来の提案はすべて、その薬剤の実質的な副作用によって特徴づけられており、この副作用が有効投与量の投与を妨げているため、すべてのケースにおいて、この化合物を開発して、神経疾患及び精神疾患の治療あるいは予防する市販薬を提供することができない。
【0005】
例えば、キサリプロデン(サノフィ・アベンティス社)(1−(2−naphthalen−2−ylethyl)−4−[3−(trifluoromethyl)pheny1]−3,6−dihydro−2H−pyridine hydrochloride;塩のMW:417.5;遊離塩基のMW:381))、セロトニン5−HT1A受容体アゴニストが後に発見され、これもある程度NGFを活性化する。キサリプロデンは、筋萎縮性側索硬化症(ALS)の潜在的な治療として段階IIIの治験を完了したと報告されており(Drugs RD.2003,4(6),pp.386−388)、最近では、アルツハイマー病への可能性があるとして段階IIIで評価を受けている。しかしながら、5−HT1Aアゴニスト活性が、投与量依存型副作用を生じさせ、これがキサリプロデンの医薬としての使用を制限している。
【0006】
4−メチルカテコール(MW124)は、ニューロトロフィン合成を刺激し、従って、理論的には、神経変性の治療へのアプローチを提供する旨が報告されている。(Fukukawa et al,Advances in Behavioral Biology,2002,53,pp.233−236)。しかしながら、この薬剤は、おそらく神経成長因子(NGF)の発現を過剰に刺激することにより、毒性のある副作用を生じることがわかっている。
【0007】
レチノイン酸は、NGFの血清と神経レベルを上げて糖尿病マウスの神経疾患を防止することがわかっており(Arrieta et al.,European Journal of Clinical Investigation,2005,35.Pp.201−207)、及び、神経変性疾患において可能性のある治療的役割を有することが提言されている(Mey and McCaffery,The Neuroscientist,2004,10,pp.409−420)。しかしながら、この薬剤は、深刻な容量制限毒性副作用があることが知られている。
【0008】
AMPA受容体増強剤(AMPAkines)は、グルタミン酸受容体修飾因子であり、インビボでBDNF発現を強化することを示している(Mackowiak et al.,Neuropharmacology,2002,43,pp.1−10)。更に、二つのAMPAkines(CX614とCX546)は、AMPAkinesの連続的露出にも関わらず、BDNF mRNAレベルを、投与後6−12時間まで最大限に上げて、次いで、投与後48時間まではほぼ対照レベルに下がることを示している(Lauterborn et al.,Journal of Pharmacology and Experimental Therapeutics,2003,307,pp.297−305)。いくつかのAMPAkinesは神経性疾患のために、開発された、あるいは、現在開発されている(Price et a.,Pharmacology and Therapeutics,2007,115,pp.292−306)。しかしながら、これらの薬剤の少なくともいくつかは毒性副作用がある。
【0009】
セロトニン選択的再取り込み阻害薬(SSRIs)やモノアミン酸化酵素阻害薬(MAOIs)としての一次作用を有するものを含む、ある種の抗鬱剤も、インビボでBDNF mRNAレベルを上げることが示されている(Malberg and blendy,Trends in Pharmacological Sciences,2005,26,pp.631−638;Martinez−Turrillas et al.,Neuropharmacology,2005,49,pp.1178−1188)。また、“Neurotrophic effects of antidepressant drugs”by,Castren,Current Opinion in Pharmacology,2004,4,pp.58−64も参照されたい。しかしながら、これらの薬剤はすべて、多くの望ましくない副作用を有することが良く知られている。
【0010】
イムノフィリンは、あるクラスの免疫抑制剤であり、神経栄養因子の活性を高めることが示されている(Price et al.,Pharmacology and Therapeutics,2007,115,pp.292−306)。FK506(タクロリムス)は、インビボで、BDNF mRNAレベルを高めること(Zawadzka and Kaminska,Molecular and Cellular Neuroscience,2003,22,pp.202−209)、及び、BDNFとGDNFたんぱく質レベルを高めること(Tanaka et al.,Brain Research,2003,970,pp.250−253)が示されている。しかしながら、このクラス全体が、重大な容量制限毒性副作用があることが知られている。
【0011】
GFR*−1受容体アゴニストであるN4−(7−クロロ−2−[(E)−2−クロロ−フェニル−ビニル)]−キノリン−4−イル)−N,N’−ジエチル−ペンタン−1,4−ジオン(XIP4035)は、濃度依存態様で神経突起伸長を促進すると報告されている(Tokugawa et al.Neurochemistry International,42,1,January 2003,pp.81−86)。しかしながら、この分子は、容量制限毒性副作用が多すぎる。
【0012】
従って、これらの公知の小分子薬剤は、NF様効果あるいはNF活性化効果をいくらか有しているが、前臨床モデル、あるいは臨床モデルにおいて、容量依存性副作用を有する。この副作用は、通常、明らかな毒性が自体に現れる。このことが、治療におけるこの薬剤の潜在的な利用を大きく制限している。
【0013】
神経疾患及び精神疾患のための、改良された、特に非毒性の、小分子非ペプチド生物活性薬剤の開発が一般的に必要とされている。
【0014】
WO−A−99/16786、WO−A−99/48482、WO−A−99/48507、WO−A−01/23407、WO−A−01/23408、WO−A−02/079221、WO−A−03/082893、WO−A−2005/105108、WO−A−2005/105825、及びWO−A−2006/048665は、その開示がここに引用によって組み込まれており、認知機能障害及びある種のその他の神経疾患及び精神疾患の治療におけるある種の小分子ステロイドの使用に関する。一般的に、これらの活性薬剤は、A/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型である。「サポゲニン」の表現は、例えば、前記サポゲニンの疑似サポゲニン型とジヒドロ疑似サポゲニンといった、E及びF開環誘導体をすべて含むと解される。この化合物の不飽和型では、一又はそれ以上の二重結合が、A/B−cisモチーフに影響しない位置に存在する。
【0015】
WO−A−03/082893、第25頁、第5行乃至18行には、少なくともいくつかの化合物が、有害な細胞体の変化と神経突起の委縮を逆転させる、神経栄養因子、TGF−β−スーパーファミリーNFs及び、ニューロカインなどのNFsの放出を低減する、及び、神経毒性と神経細胞アポトーシスを低減することを含む、ある種の神経変性を遅らせる又は逆転させることが分かっていると、報告されている。この記載は、また、神経防護作用と受容体喪失効果の逆転が能動的に調整された効果であり、過去の劣化が、連続的な劣化に対して防護することで正常な状態あるいは若い状態に戻ることが報告されている。
【0016】
同じ文献の第26頁、第8乃至15行には、更に、活性剤の一生理作用が、NFs又はその受容体の合成又は放出を増やす能力、あるいは、劣化率を低減する能力であると考えられると、報告されている。成長因子についてのこれらの効果は、「細胞質受容体あるいは核内受容体上の化合物の効果、あるいは成長因子のmRNA生成率についての直接的な当然の効果を用いて化合物を促進剤領域に結合させる効果、あるいは別の重要な要素の生成を増やすことによって生じた結果としての効果によるかもしれない」と、理論づけている。
【0017】
同じ文献の第20頁、第4行以降は、自閉症症候群、鬱病、及び統合失調症の精神疾患を治療するこの活性薬剤の使用について述べている。
【0018】
Zhang Y,et al,FEBS Letters,19 March 2008,582,Issue 6,pp.956−960は、ここに引用により組み込まれているが、スミラゲニンは、1−メチル−4−フェニルピリジニウム(MPP+)によって損傷したラットの中脳ドーパミン神経細胞中のGDNF mRNA発現を、培地におけるGDNFの容量と同様に増加させるように見えると報告している。また、スミラゲニンは、これらのニューロン中のMPP+が誘発する神経損傷及び委縮を防止するように見えるとも報告している。この刊行物は、本発明者のものであり、指定国すべてにおいて従来技術ではない。
【0019】
免疫システムの恒常性におけるNFsの役割は、近年の多くの研究主題であった(例えば、Vega,J A et al,J.Anat.2003,203,pp.1−19、及びここにあげた引用例を参照。これらはすべて引用によりここに組み込まれている)。Vega et alの刊行物により詳細に説明されており、第8頁の表2に要約されているように、NFsは免疫システム、特に、B−リンパ球、T−リンパ球、単核白血球/マクロファージ、好中球、好酸球、好塩基球、マスト細胞及び造血細胞、並びに血小板及び脈管組織に関係している様々な細胞に関連する様々な活性を有することが示されている。NFsの恒常性調整は、免疫システム疾患治療あるいは予防に関する価値のある技術を提供する。
【0020】
炎症や炎症性疾患、及びアレルギィにおけるNFsの役割も、多くの注目を集めている。炎症やアレルギィ反応の間、並びに免疫システムに疾患がある場合は、NFGレベルが上がることが知られている(Stanisz,AM & Stanisz,JA,Ann.N.Y Acad.Sci.,2000,917,pp.268−272;Oten,U et al,Ann.N.Y Acad.Sci.,2000,917,pp.322−330;Vega et alの第10頁、第2欄、及び第11頁、第1欄と第2欄に挙げられた引例も参照)。NFsの恒常性調整は、炎症や炎症性疾患及びアレルギィ反応の治療あるいは予防に関する価値のある技術を提供する。
【0021】
良く知られているように、炎症反応、アレルギィ反応、及び免疫反応は、例えば、自己免疫疾患や、毒性、パラサイト、及びその他の感染体による課題に応答して、同時に、相関して生じることがある。NFsの恒常性調整は、これらの症状の治療あるいは予防に関する価値のある技術を提供する。
【0022】
NGFは、血管炎誘発性関節リュウマチに有益な効果を有することが示されており(Tuveri,M.et al,Lancet,2000 Nov.18,356,pages 1739−1740;Aloe,L.,arch.Physiol.Biochem.,2001,109,pages 354−356)、アレルギィ性又は炎症性プロセスにおけるNF過剰発現の阻害における新しい治療的戦略と考えられていることが報告されている(上述のVega et al publication,page 12,column 1)。神経疾患に関する上記に説明した理由によって、NGFたんぱく質の使用は、小分子の使用より要望が少ない。NF過剰発現調整用小分子薬剤は、非常に望ましいであろう。
【0023】
WO−A−01/64247は、その開示がここに引用によって組み込まれており、癌細胞表面、特にtrk+癌細胞におけるNF受容体の発現によって特徴づけられる腫瘍性疾患(癌)の治療あるいは予防方法を記載している。この方法は、例えば、抗NF抗体、抗NFアンチセンスポリヌクレオチド、あるいは抗NFtrk突然変異体など、有効量の抗NF薬剤(この文献では、抗神経栄養因子、あるいは、抗NT薬剤と呼ばれている)を投与するステップを含む。胸、甲状腺、大腸、肺、子宮、皮膚、筋肉、膵臓、前立腺、腎臓、生殖器官、血液、免疫システム組織(例えば、脾臓、胸線、骨髄)、脳及び末端神経系組織、を含む様々な癌をこの方法で治療あるいは予防できることが記載されている。この薬剤のNFsへの非常に特別な結合を介する動作モードが記載されており、活性化NF配位子を中性化することによるtrk受容体の抑制につながっている(第5頁、第8乃至10行)。
【0024】
Innominato,P F et al,J.Pathol.,2001,194,pages 95−100は、その内容がここに引用によって組み込まれており、メラノーマ細胞表面上のNFsとNF受容体の発現について述べている。従って、皮膚癌細胞、特にメラノーマ細胞は、NF受容体陽性癌細胞の上記リストに含まれる。
【0025】
神経疾患に関する上記に説明した理由で、抗体、ポリヌクレオチド及び抗NF受容体突然変異たんぱく質の使用は、小分子の使用より望ましくない(LeSauteur et al,Nature Biotech.,1996,14,page 1120参照)。受容体、すなわち、NFたんぱく質の作用形態に類似するものの結合パートナーの制御を通じて、NFsの恒常性制御に小分子薬剤を使用して癌細胞のtrk受容体を抑制することは、非常に望ましい。
【0026】
本発明は、上述のA/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型が、以下に述べるように、非毒性態様でのNFsの修飾につながり、対象の恒常性制御プロセスを正常なままにしておくという我々の新規発見に基づいている。このように、この薬剤は、わずかな副作用でNFsの恒常性自己制御を誘発する。副作用がある場合は、それに対処することができ、有効量の投与を妨げない。自己制御恒常性を誘発する、本質的に非毒性、非ペプチドである小分子を発見し、使用することにより、不健康状態において、一又はそれ以上のNFsが、副作用を起こすことなく健康な状態に向けて修復(高レベルあるいは低レベルで)されることは、予期しないことで、驚くべきことであり、以下に詳細に説明するように有意な利益を提供する。
【0027】
更に、我々は、この薬剤が、副作用を起こすことなく一以上のNF、例えば、BDNFとGDNFの自己制御恒常性を誘発することを発見した。一の活性薬剤による、副作用を伴うことのない一以上のNFの自己制御恒常性の達成は驚くべきことであり、我々の知識では、あらゆる小分子薬剤において唯一のことである。ニューロンは、最適な神経防護作用と神経修復作用のためには、通常、一以上のNFを必要とすることがわかっているので、本発明によるこの発見は、NF介在疾患とこれに関連する症状の実質的に改善された治療と予防を提供する。
【0028】
NFsが、皮膚、角膜組織、骨及び筋肉を含む組織を治癒する役割を果たしており、一般的に、皮膚、骨、及び筋肉の健康に有益であることも知られている。例えば、Albers,K.M.et al,Neuroscientist 2007,13,pages 317−382;Asaumi,K.,et al.,Bone,26(6),June 2000,pages 625−633;You,L et al.,Investigative Opthalmology &Visual Science,October 2001,42(11),pages 2496−2504;Cruise,B.A.et al.,Developmental Biology,271,(2004),pages 1−10;Jurjus,A.et al.,Burns 33(2007),892−907;Matsuda,H.,etal.,J.Exp.Med.,187(3),2 February 1998,pages 297−306;Menetrey,J et al.,J.Bone Joint Surg Br),82−B(1),January 2000,pages 131−137;Micera,A.,et al.,Cytokine & Growth Factor reviews,18,(2007),pages 245−256;Nithya,M.,et al.,Biochim.Biophys,Acta,1620,(2003),pages 25−31; Matsuda,H et al.,J.Exp.Med.1998,187,pages 297−306;Lambiase et al,Invest.Ophthalmol.Vision Sci.,2000,41,pages 1063−1069参照。これらの刊行物の内容は、ここに引用により組み込まれている。
【0029】
本発明の基本的な発見は、従って、皮膚、骨、筋肉、及び角膜組織などの眼組織を含む組織の治癒と健康に適用することもできる。従って、本発明は、また、損傷を受けたあるいは異常な組織の、あるいはこれに関連する神経機能の修復又は正常化に関するものであり、組織(例えば、皮膚、骨、眼、及び筋肉)治癒の支援及び、運動、労働あるいは消耗からの筋肉や組織の回復、日光への露出、風への露出、雨への露出、寒さへの露出、老化、しわからの皮膚の回復、持久力の改善、疲労感の低減を含む、一般的な皮膚、骨及び筋肉の健康に関する。限定することなく、本発明が支援する組織治癒には、以下により詳細に述べるように、創傷や火傷の治癒が含まれる。
【発明の概要】
【0030】
本発明の第1の態様によれば、対象の天然NFsを恒常性を制御した非毒性態様で制御することによって、対象の神経栄養因子(NFs)の自己制御恒常性を誘発する方法が提供されており、この方法は、対象に、A/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型から選択した一又はそれ以上の有効量の薬剤投与するステップを具える。対象の天然NFsは、BDNFとGDNFの一方あるいは両方であっても良い。
【0031】
本発明の第1の態様の方法は、NFsの自己制御恒常性の誘発が、制限された、対処可能な副作用を伴って行われる。
【0032】
本発明の第1の態様の特に好ましい一実施例では、誘発された恒常性が、例えば、BDNFとGDNFなど、対象の二又はそれ以上の天然NFsを共に制御する。
【0033】
本発明の第2の態様によれば、対象の天然NFsを、恒常性を制御した非毒性態様で制御することによって対象のNFsの自己制御恒常性を誘発する、A/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型から選択した薬剤が提供されている。
【0034】
本発明の第2の態様による使用のための薬剤は、NFsの自己制御恒常性の誘発が、制限された対処可能な副作用を伴って生じる薬剤である。
【0035】
本発明の第3の態様によれば、対象の天然NFsを、恒常性を制御した非毒性態様で制御することによって対象のNFsの自己制御恒常性を誘発する、A/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型から選択した薬剤を含む組成物が提供されている。
【0036】
本発明の第3の態様による使用のための組成物は、NFsの自己制御恒常性の誘発が、制限された対処可能な副作用を伴って生じる。
【0037】
本発明の第4の態様によれば、対象の天然NFsを、恒常性を制御した非毒性態様で制御することによって対象のNFsの自己制御恒常性を誘発する薬剤の製造における、A/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型から選択した薬剤の使用が提供されている。
【0038】
本発明の第4の態様による使用は、NFsの自己制御恒常性の誘発が、制限された対処可能な副作用又は有害な副作用を伴って生じる。
【0039】
本発明は、有害な副作用、特に、例えば、NGFなどのNFsの過剰誘発、過剰刺激あるいは過剰増強に関連する副作用、受容体アゴニスト(アンタゴニスト)作用に関連する副作用、及び酵素結合作用に関連する副作用を制限する。
【0040】
本発明は、NFs介在疾患、特に、神経性疾患、精神性疾患、炎症性疾患、アレルギィ性疾患、免疫疾患、及び腫瘍性疾患の治療方法と共に使用され、ヒト及び非ヒト動物の対象における、組織(例えば、皮膚、骨、眼、及び筋肉)治癒の支援及び、一般的な皮膚、骨、眼及び筋肉の健康、及び非治療的方法に関連する場合を含めて、損傷を受けたあるいは異常な組織中の、あるいはこの組織に関連する神経作用及びその他の作用の修復又は正常化に使用することができる。
【0041】
ここで用いられている用語「NF介在」とは、一般的な意味に解するべきであり、神経栄養因子が、疾患あるいは症状の進展、進行、あるいは効果に寄与する役割を果たしていると理解される場合の疾患及び症状を含む。従って、例えば、現在の兆候がNF受容体、そのアゴニスト(アンタゴニスト)、あるいはNFsのその他の活性化因子又は抑制因子に関係している疾患あるいは症状は、本発明の「NF介在」疾患又は症状であると解するべきである。このような疾患及び症状は、本発明によるヒト又は非ヒト動物対象の天然NFsの恒常性制御に応答することが予期される。
【0042】
このように、本発明は、例えば、けがによって、血液不足によって、老化によって、あるいは(皮膚の場合は)しわによって、あるいは日光、風、雨、冷気にさらすことによって、あるいはその他の障害媒体によって損傷を受けた組織(脳組織、あるいは、皮膚、骨、眼、及び筋肉などのその他の組織にかかわらず)内の、あらゆる損傷を受けた組織あるいは異常組織の、神経機能及びその他の機能回復と併用して用いることができる。本発明による正常な神経機能の回復は、通常、神経再生と、血流の改善、並びに、中枢神経系(CNS)又は末梢神経系(PNS)における炎症などの神経疾患の症状の正常化あるいはニューロンの異常、につながるNFsの自己制御恒常性の誘発によって達成される。
【0043】
このように、本発明は、創傷治癒の支援と共に使用することができ、特に、ヒト及びその他の哺乳動物の皮膚創傷治癒の速度と質を向上させることができる。このコンテキストにおいて、「創傷」は、例えば、切り傷、擦り傷、ナイフによる傷、外科的外傷、あざ、やけど、潰瘍、痛みなどの損傷といった、あらゆる器官のすべての損傷を含む。慢性及び急性の両創傷を本発明によって治療することができる。
【0044】
本発明は、胎児細胞、幹細胞あるいはその他の細胞治療や、組織移植と共に、特に、移植した材料の生存、あるいは治療の効果、あるいはこの両方を改善するために使用することができる。例には、脳又は身体のその他の器官の機能を改善する細胞治療が含まれる。
【0045】
更に、本発明は、皮膚、骨、眼、及び筋肉などの組織の健康状態を促進するあるいは支援する非治療的方法に使用することができ、このような組織におけるNFsの自己制御恒常性の利益によって、運動、労働あるいは消耗からの筋肉と組織の回復を促進し、老化現象、しわ、あるいは日光、風、雨、冷気、あるいはその他の損傷を与える媒体への露出からの皮膚の回復を促進し、持久力と筋肉の耐久性(例えば、競技スポーツ又は非競技スポーツにおいて)を改善し、疲労感を低減する。
【0046】
本発明によれば、薬剤を作用部位に送達することが一般的に良いことが分かっているので、薬剤を全身あるいは局所的に投与することができる。特に、以下により詳細に述べるように、限定することなく、経口及び非経口(例えば、局所)投与ルートが適していることがわかっている。
【0047】
ここで用いている「サポゲニン」の表現は、例えば、上述のサポゲニンの疑似サポゲニン及びジヒドロ疑似サポゲニン型といった、E及び/又はF開環誘導体をすべて含み、この型はこのような誘導体の支配を受ける。この化合物の不飽和型では、一又はそれ以上の二重結合が、A/Bcisモチーフに影響しない位置に存在する。サポゲニンのグリコシル化型は、通常、サポニンと呼ばれている。
【0048】
発明の詳細な説明
序論
本明細書に提示されている証拠は、この薬剤が様々な受容体と酵素に結合していないことを示している(実施例1参照)。
【0049】
NFs又はNF受容体の導入に関する活性薬剤の効果を立証する証拠が、本出願に提示されている。この証拠は(以下の実施例2及び3を参照)、その活性が、NFsとNF受容体の強化型遺伝子発現を伴うことを示す。ニューロンが比較的健康である(基本培地)例2に見られるように、強化型遺伝子発現は一次的なものであり、その時間スケールは、自己制御機構を伴うことを強く示している。
【0050】
より罹患が進んでいる実施例3では、データが、より長期間の強化型遺伝子発現を示しており、制御機構が無傷で残り、遺伝子発現の強化の度合いがシステムの必要性に依存していることを示す。
【0051】
本出願で提示されている証拠はまた、活性薬剤が、例えば特にBDNFやGDNFといったNFsの自己制御恒常性を提供することを示している(下記の実施例4乃至7及び18参照)。非ペプチド薬剤による、例えばBDNF又はGDNFといった、一のNFの自己制御ノーマライゼーションが非常に優れているのみならず、例えば、非ペプチド薬剤によるBDNFとGDNF両方といった二つのNFsの自己制御ノーマライゼーションも独自である。両NFsを互いにノーマライゼーションすることは、BDNFとGDNFの相乗的ノーマライゼーションに結び付くように見え、これは特に有益である。
【0052】
本出願に提示されている証拠は、活性薬剤が様々なCNS及びPNSニューロンの神経突起生成を増やすことが示されている(実施例8を参照)。重要なことは、この神経突起生成効果は、外因性NFsの存在に依存していないことである。このことは、本発明の薬剤の効果が、NFの強化というよりは、むしろ導入であることを示している。
【0053】
本出願に提示されている証拠は、更に、活性薬剤が、NFsと同じ細胞間形質導入を活性化することを示している(実施例9を参照)。これは、薬剤のNF調節活性の証拠を支持している。
【0054】
本出願に提示されている証拠はまた、様々なA/B−cis活性薬剤が、皮質ニューロンへのグルタミン酸塩で誘発された損傷と、ドーパミン作用性ニューロンのアポトーシスを低減するが、一方で、ほぼ同じ化学構造ではあるが、A/B−cisモチーフを持たないサポゲニン(ジオスゲニン)は、不活性である(実施例10及び11を参照)ことを示している。
【0055】
本出願に提示されている証拠はまた、この薬剤が様々なニューロンの損傷を回復に向かわせる、すなわち、この薬剤は、神経再生薬剤(neurorestorative or neuroregenerative)である(実施例12を参照)。
【0056】
本出願に提示されている証拠はまた、この薬剤が経口投与可能であることを示している(実施例13及び14を参照)。この例は、この薬剤の経口投与が、運動ニューロン疾患あるいは外傷後の神経損傷があるマウスモデルの神経機能の回復を改善することを示している。
【0057】
本出願に提示されている証拠はまた、この薬剤が老化したラットの不安を取り除き、認知を回復することを示している(実施例15を参照)。
【0058】
本出願に提示されている証拠はまた、経口投与した薬剤が、ある範囲の身体組織に送達され(実施例16を参照)、有効投与量において非毒性である(実施例17を参照)ことを示している。
【0059】
本出願に提示されている証拠はまた、この薬剤がマカクのパーキンソン症候群を低減することを示している(実施例18を参照)。
【0060】
本出願に提示されている証拠は、この薬剤のNF又はNF受容体(NFr)を介在する活性が、ある範囲の受容体と酵素との直接結合相互作用を含まないことを示している。例えば、この活性は、エストロゲン、プロステロン、テストステロン、及びセロトニン受容体などのホルモン受容体、ニコチン受容体、ムスカリン性受容体、アドレナリン性受容体、カンナビノイドやアヘン受容体などの麻薬受容体、NMDA、AMPA及びカイナイト受容体などのグルタミン酸受容体、及び、レチノイドX受容体などのレチノイン酸受容体といった、様々な重要な受容体における直接結合アゴニスム、アンタゴニスト、非アゴニスト(非アンタゴニスト)直接結合に関連していない。この結果、この活性薬剤の生理学的効果は、従来の神経疾患や神経障害の治療に見られる多くの受容体介在及び酵素介在副作用と無関係である。例えば、従来の神経疾患及び精神疾患の治療の多くに見られる問題は、中毒と依存性、中毒になりやすい性格型、受容体又は酵素の副作用を持つ従来の治療、及び、中毒又は依存性を発生する現在の治療のいずれもが、神経疾患あるいは精神疾患の治療に禁忌を示すことがあるが、この薬剤によって実質的に低減される。
【0061】
精神疾患の従来の治療は、その生化学モードの作用を即座に発揮するにもかかわらず、より長い時間規模で有益な精神的効果を示している。本発明の効果は、より一層即座にみられ、恒常性制御の下、非毒性態様でNFsを調整する証拠を提供している。従って、本発明は、公知の精神及び神経疾患の小分子(非ペプチド)治療から区別される。
【0062】
これらの実施例の試験におけるこの薬剤の容量反応プロファイルは、自己調整機構の特徴である後に安定状態が続く最大値を示している(図1を参照)。
【0063】
本発明で使用する一又はそれ以上の活性薬剤は、GDNFやBDNFなどの外因性投与神経栄養因子なしで使用することができる。
【0064】
本発明に関連する新規使用
本発明は、従って、例えば(i)治療するべき疾患、(ii)治療する個体のクラス、(iii)使用する治療の組み合わせ、及び(iv)安全な使用状況、という意味で、同定するべき活性薬剤を新規使用することができる。
【0065】
(i)に関する限り、例えば、ある範囲の神経性、精神性、炎症性、アレルギー性、免疫性、及び腫瘍性疾患及び症状、並びに性格特性と行動特性を治療するためのこの活性薬剤の使用、及び、薬剤と機能性食品の双方を介した、ニューロンの再生あるいは正常化、ニューロンへの血流、損傷を受けた組織(例えば、皮膚、骨、眼あるいは筋肉組織)の再成長及び治癒、脳内及び脳外(例えば、皮膚、骨、眼及び筋肉組織)両方の組織の全体的な健康と良好な状態、運動、労働あるいは消耗からの筋肉や組織の回復、持久力の改善、疲労感の低減、正常な神経機能及び正常な神経ネットワークの再生の達成が、以下に詳細に述べるように、現在認識できる。この使用には、集団の正常範囲内にある個体の神経的あるいは精神的機能、あるいは個体の全体的な健康及び満足感を改善するための非治療的使用、例えば老化現象、しわ、あるいは日光への露出、風への露出、雨への露出、寒さへの露出、あるいはその他の損傷を与える媒体への露出からの皮膚の回復を促進する、皮膚、骨、眼、筋肉及びその他の組織の健康を促進するための非治療的使用、及び、運動、労働、あるいは消耗からの筋肉及び組織の回復を含む、健康と良好な状態のその他の態様を提供するための非治療的使用が含まれる。用語「障害」「症状」「特徴」は、これに従って理解される。
【0066】
(ii)に関する限り、多くの受容体又は酵素の調整あるいは結合ではなく、NFs自己制御恒常性を介した本発明の薬剤の作用によって、薬剤又は受容体アゴニスト薬を抑制するある種の酵素からの副作用に敏感な患者が治療を受けることができる。例えば、ある認知症(アルツハイマー)患者は、コリンエステラーゼ抑制剤への耐性がない。あるパーキンソン病患者は、L−ドーパへの耐性がなく、危険負担といった運動障害や神経異常の問題を含む副作用に苦しむ。
【0067】
(iii)に関する限り、例えば、特定の障害、症状、特徴、あるいは特定のクラスの個体の治療に、この薬剤をその他の補助薬剤と組み合わせて使用することは、以下に詳細に述べるとおり、現在は確認可能である。このような多くの組み合わせの認識は、従来はせいぜい推論に過ぎなかった。この使用には、集団の正常範囲内にある個体の神経的あるいは精神的機能、あるいは個体の全体的な健康及び満足感を改善するための非治療的使用、例えば老化現象、しわ、あるいは日光への露出、風への露出、雨への露出、寒さへの露出、あるいはその他の損傷を与える媒体への露出からの皮膚の回復を促進する、皮膚、骨、眼、筋肉及びその他の組織の健康を促進するための非治療的使用、及び、運動、労働、あるいは消耗からの筋肉及び組織の回復を含む、健康と良好な状態のその他の態様を提供するための非治療的使用が含まれる。用語「障害」「症状」「特徴」は、これに従って理解される。
【0068】
(iv)に関する限り、例えば、臨床及び薬学的環境外での新しい範囲の使用状況は、以下により詳細に述べるように、現在認識可能である。
【0069】
新規使用(i)−新しい治療
本発明は、必要に応じて、ヒト又は非ヒト哺乳動物における(a)神経性、精神性、炎症性、アレルギー性、及び腫瘍性疾患の治療及び予防、(b)ニューロン機能又はニューロンネットワークの再生を含む、ニューロン及びニューロンへの血流の再生及び/又は正常化、(c)損傷を受けた組織の再成長及び治癒、(d)運動、労働、あるいは消耗からの筋肉及び組織の回復、(e)持久力の改善と疲労感の低減、(f)異常な行動又は個体的な特徴を治療又は防止する方法に使用することができる。この神経性、精神性、炎症性、アレルギー性、免疫性及び腫瘍性疾患は、上述した従来技術に開示されたものであっても良く、これらの障害と異なるものでも良い。例えば、精神性疾患は、自閉症症候群、鬱病、及び統合失調症であっても良く、あるいは、これら以外の疾患であっても良い。ニューロン及びニューロンへの血流の再生あるいは正常化、ダメージを受けた組織、神経機能、あるいは神経ネットワークの再成長と治癒のための方法には、例えば、神経の外傷後再生、移植組織片、及び神経の術後再生(例えば、四肢や指の再付着)、脳卒中、一過性脳虚血性発作(TIAs)、あるいはその他の虚血組織の回復支援、例えば、神経機能や、虚血組織への血流の回復支援、創傷、骨、及び筋肉の治癒支援、及び、CNS又はPNSに関する神経疾患及び炎症性症状の治療支援が含まれる。
【0070】
本発明は、この活性薬剤の神経防護効作用と神経回復(神経再生)作用の点で、例えば、神経及び精神疾患用、あるいはダメージを受けたあるいは異常な組織又は機能の回復又は正常化のための、胎児細胞、幹細胞、あるいはその他の細胞治療と共に使用することができる。実施例には、脳障害を治療する細胞治療が含まれている。本発明に係る活性薬剤の使用により、例えば、移植した細胞の生存率を上げることによって、この治療における生存細胞の効率を改善することによって、あるいはこれらの組み合わせによって、細胞治療の効果を改善することができる。
【0071】
本発明を、一又はそれ以上のNF又はNFrの異常発現に関連する疾患を患っている、あるいはこの影響を受けているヒト又は非ヒト動物における、このような疾患の治療法に使用することができる。この疾患は、上述した従来技術に開示されている疾患であっても良く、これらの疾患と異なる疾患であっても良い。例えば、神経性疾患は、自閉症、鬱病、及び統合失調症であっても良く、あるいは、これらの障害以外の障害であっても良い。神経あるいは精神疾患、異常行動、あるいは個人の特性以外のこのような障害には、例えば、睡眠不足とストレスの影響、炎症性障害、アレルギー、免疫障害、及び、NF介在の癌が含まれる。
【0072】
上述したように、この出願の証拠は、本発明に使用されている活性薬剤が、脳内のBDNFとGDNFのレベルを同時に正常化あるいは強化することができることを示している。本発明は、従って、これらのNFsの一方あるいは両方の異常なあるいは低下した脳レベルを患っているヒト又は非ヒト動物の脳内のBDNFとGDNFレベルの一方あるいは両方を同時に正常化する方法に使用することができる。
【0073】
本発明は、BDNFやGDNFなどのNFsの自己制御恒常性を誘発する方法を提供する。この方法では、NFsの自己制御恒常性の誘発が、制限され対処可能な副作用を伴って生じる。この出願は、この誘発が、ペプチドNFsやNFrsの存在を必要としないことの証拠を具えている。従って、本発明は、公知の薬剤と対照的に、ペプチドNFsやNFrsを本発明の非ペプチド活性薬剤と同時投与する必要性を排除している。
【0074】
上述の各新規使用は、本発明の各態様と共に使用することができる。
【0075】
本発明を実行する方法は、以下に詳細に述べるように、治療的方法でも、非治療的方法でも良く、この組成物は、薬学的組成物又は非薬学的組成物であっても良い。この活性薬剤は、以下に詳細に説明するように、その他の投与ルートが提供されているが、好ましくは経口投与される。
【0076】
新規使用(ii)−治療可能な個体の新しいクラス
本発明による新しい発見は、少なくとも所定の回数、例えば、睡眠不足又はストレスを受けた人など、一又はそれ以上のNFsあるいはNFrs(例えば、BDNF及び/GDNF)を天然に過剰発現、又は異常発現する人の治療に活性薬剤を使用できることを明らかにしているが、以前はNF様又はNF刺激薬剤によるこのような人の治療は禁忌であった。
【0077】
本発明は、低減した又は異常なNF又はNFrレベルに伴う疾患又は症状に罹っている又は罹りやすくなっている、一又はそれ以上のNFs又はNFrsの天然な過剰発現、又は異常発現に敏感なヒト又は非ヒト動物における、このような障害又は症状を治療又は予防する方法に使用することができる。
【0078】
本発明の新しい発見はまた、この活性薬剤を用いて、NF様又はNF刺激薬剤の精神的副作用に敏感な人を治療することができることを明らかにしており、これらの副作用は、典型的には、精神的、気分、不安、あるいはその他の個性、あるいは行動上の症状であり、以前は、これらの人に対してNF様又は刺激薬剤による治療は禁忌であった。
【0079】
本発明の薬剤が多くの受容体又は酵素への調整あるいは結合ではなく、NFsの自己制御恒常性を介して作用することの発見によって、薬剤あるいは受容体アゴニスト薬剤を抑制するある種の酵素からくる副作用に敏感な患者を治療することが可能となる。例えば、ある認知症(アルツハイマー)患者は、コリンエステラーゼ抑制剤への耐性がない。あるパーキンソン病患者は、L−ドーパに耐性がなく、危険負担といった、運動障害あるいは神経精神病の問題を含む副作用に苦しむであろう。
【0080】
本発明は、低減した又は異常なNF又はNFrレベルに伴う障害又は症状に罹っている又は罹りやすくなっているヒト又は非ヒト動物におけるこのような障害又は症状を治療する又は予防する方法に使用することができ、このヒト又は動物は、NF様又は刺激薬剤の精神医学的あるいはその他の副作用に敏感な人である。
【0081】
低減した又は異常なNF又はNFrレベルに伴う障害又は症状には、例えば、神経性、精神性、炎症性、アレルギー性、免疫性、及び腫瘍性疾患、又は、以下に詳細に説明する、異常行動又は個体的特徴が含まれる。更に、この障害及び症状には、以下に述べる皮膚、筋肉、眼及び骨の障害及び症状が含まれ、これには、組織の良好な状態と健康に関連する症状や、筋肉やその他の組織の疲労の症状が含まれる。
【0082】
本発明の新しい発見によれば、また、ある範囲のホルモン受容体やその他の受容体に対するアゴニスト(アンタゴニスト)能力あるいは結合能力を有さず、ある範囲の酵素に対する酵素結合能力を有さないこの活性薬剤を用いて、薬剤の受容体介在又は酵素介在副作用に敏感な人を治療することができる。このような人には、例えば、中毒あるいは依存性を有し、この中毒あるいは依存性に影響される受容体におけるアゴニスト(アンタゴニスト)効果によって悪化することがある人;中毒又は依存症から引き離す治療あるいは自己治療を行っている人であり、同じ理由で、中毒あるいは依存性に影響される受容体におけるアゴニスト(アンタゴニスト)効果によって引き離すプロセスが後退してしまうことがある人;例えば受容体又は酵素結合におけるアゴニスト(アンタゴニスト)又は結合に特に敏感なある種の受容体又は代謝プロセスを有する、中毒性又は依存性のある性格型を有する人;が含まれる。更に、受容体介在又は酵素介在副作用に対するぜい弱性は、例えば、ホルモン治療(例えば、治療におけるホルモン治療、成長ホルモン治療、甲状腺ホルモン治療、女性ホルモン補充治療(HRT)、あるいは性別適合治療)を行っている人など、受容体介在又は酵素介在副作用によって干渉されるその他の臨床症状の治療を受けている人に生じる。
【0083】
従って、本発明は、低減したNF又はNFrレベルに伴う疾患又は症状に罹っている又は罹りやすくなっているヒト又は非ヒト動物におけるこのような疾患又は症状を治療する又は予防する方法に使用することができ、このヒト又は動物は、薬剤の受容体介在又は酵素介在副作用に敏感な人である。
【0084】
受容体(又は結合部位)介在副作用に対する人の感受性に関連する受容体又は結合部位は、以下の受容体の一又はそれ以上を含む:アデンソニン(adensonine)A1受容体;アデンソニンA2A受容体;アデンソニンA3受容体;アドレナリン性α1A受容体、アドレナリン性α1B受容体、又はアドレナリン性α1D受容体を含む非選択的アドレナリン性α1受容体;アドレナリン性α2A受容体、アドレナリン性α2C受容体、又はアドレナリン性α2D受容体を含む非選択的アドレナリン性α2受容体;アドレナリン性β1受容体、アドレナリン性β2受容体、又はアドレナリン性β3受容体を含む非選択的アドレナリン性β受容体;アドレノメズリンAM1受容体;アドレノメズリンAM2受容体;アルドステロン受容体;アナフィラトキシンC5a受容体;アンドロゲン(テストステロン)受容体AR;アンジオテンシンAT1受容体、アンジオテンシンAT2受容体;アペリン(APJ)受容体;心房性ナトリウム利尿因子受容体;ボンベシンBB1受容体;ボンベシンBB2受容体;ボンベシンBB3受容体;ブラジキニンB1受容体;ブラジキニンB2受容体;カルシトニン受容体;カルシトニン遺伝子関連ペプチド(CGRP1)受容体;ベンゾチアゼピンL−型カルシウムチャネル;ジヒドロピリジンL−型カルシウムチャネル;フェニルアルキルアミンL−型チャネル;カルシウムチャネルN−型;カンナビノイドCB1受容体;カンナビノイドCB2受容体;ケモキンCCR1受容体;ケモキンCCR2B受容体;ケモキンCCR4受容体;ケモキンCCR5受容体;ケモキンCXCR1受容体;ケモキンCXCR1(IL−8RB)受容体;コレシストキニンCCK1(CCKA)受容体;コレシストキニンCCK2(CCKB)受容体;コルチシン受容体;コルチコトロピン放出因子(CRF1)受容体;ドーパミンD1受容体;ドーパミンD2S受容体;ドーパミンD3受容体;ドーパミンD4.2受容体;ドーパミンD5受容体;エンドセリンETA受容体;エンドセリンETB受容体;上皮成長因子(EGF)受容体;エリスロポエチンEPOR受容体;エストロゲン受容体;エストロゲン(ERα)受容体;エストロゲン(ERβ)受容体;Gタンパク結合受容体GPR103;Gタンパク結合受容体GPR8;GABAA受容体;TBOB塩素チャネルGABAA受容体;中央フルニトラゼパムGABAA受容体;中央ムシモールGABAA受容体;GABAB1A受容体;GABAB1B受容体;ガバペンチン受容体;ガラニンGAL1受容体;ガラニンGAL2受容体;グルココルチコイド受容体;グルタミン酸受容体;AMPAグルタミン酸受容体;カイニン酸グルタミン酸受容体;アゴニスムNMDAグルタミン酸受容体;グリシンNMDAグルタミン酸受容体;フェンシクリジンNMDAグルタミン酸受容体;ポリアミンNMDAグルタミン酸受容体;成長ホルモン分泌促進物(GHS、グレリン)受容体;ヒスタミンH1受容体;ヒスタミンH2受容体;ヒスタミンH3受容体、ヒスタミンH4受容体;中央イミダゾリンI2受容体;イノシトール三リン酸IP3受容体;インスリン受容体;インターロイキンIL−1受容体;インターロイキンIL−2受容体;インターロイキンIL−6受容体;レプチン受容体;BLTロイコトリエン(LTB4)受容体;システイニルロイコトリエンCysLT1受容体;システイニルロイコトリエンCysLT2受容体;メラノコルチンMC1受容体;メラノコルチンMC3受容体;メラノコルチンMC4受容体;メラノコルチンMC5受容体;メラトニンMT1受容体;メラトニンMT2受容体;モトリン受容体;ムスカリン性M1受容体;ムスカリン性M2受容体;ムスカリン性M3受容体;ムスカリン性M4受容体;ムスカリン性M5受容体;N−ホルミルペプチド受容体FPR1;N−ホルミルペプチド受容体様FPR1受容体;ノイロメジンU MNU1受容体;ノイロメジンU MNU2受容体;神経ペプチドY Y1受容体;神経ペプチドY Y2受容体;ニューロテンシンNT1受容体;ニコチン性アセチルコリン受容体;ニコチン性アセチルコリンα1、ブンガロトキシン受容体;ニコチン性アセチルコリンα7、ブンガロトキシン受容体;アヘンδ(OP1,DOP)受容体;アヘンκ(OP2,KOP)受容体;アヘンμ(OP3,MOP)受容体;オルファニンORL1受容体;ホルボールエステル受容体;血小板活性化因子(PAF)受容体;血小板由来成長因子(PDGF)受容体;カリウムチャネル[KA];カリウムチャネル[KATP];カリウムチャネル[SKCA];カリウムチャネルHERG;プロゲステロン受容体;プロゲステロンPR−B受容体;プロスタノイドCRTH2受容体;プロスタノイドDP受容体;プロスタノイドEP2受容体;プロスタノイドEP4受容体;プロスタノイドトロンボキサンA2(TP)受容体;プリン作動性P2X受容体;プリン作動性P2Y受容体;レタノイドX受容体RXRα;ロリプラム受容体;リアノジンRyR3受容体;セロトニン5−ヒドロキシトリプタミン5−HT1受容体;5−ヒドロキシトリプタミン5−HT1A受容体;5−ヒドロキシトリプタミン5−HT1B受容体;5−ヒドロキシトリプタミン5−HT2B受容体;5−ヒドロキシトリプタミン5−HT2C受容体;5−ヒドロキシトリプタミン5−HT3受容体;5−ヒドロキシトリプタミン5−HT4受容体;5−ヒドロキシトリプタミン5−HT5A受容体;5−ヒドロキシトリプタミン5−HT6受容体;シグマσ1受容体;シグマσ2受容体;部位2ナトリウムチャネル受容体;ソマトスタチンsst1受容体;ソマトスタチンsst2受容体;ソマトスタチンsst3受容体;ソマトスタチンsst4受容体;ソマトスタチンsst5受容体;タキキニンNK1受容体;タキキニンNK2受容体;タキキニンNK3受容体;テストステロン受容体;甲状腺ホルモン受容体;チロトロピン遊離ホルモン(TRH)受容体;形質転換成長因子−β(TGF−β)受容体;アデノシン輸送体;コリン輸送体;ドーパミン輸送体(DAT);GABA輸送体;モノアミン輸送体;ノルエピネフィリン輸送体(NET);5−ヒドロキシトリプタミン輸送体(SERT);非選択的腫瘍壊死因子(TNF)受容体;ノイロテンシンII受容体;バニロイド受容体;血管内皮成長因子(VEGF)受容体;血管活性腸管ペプチドVIP1受容体;バソプレッシンV1A受容体;バソプレッシンV1B受容体;バソプレッシンV2受容体;及びビタミンD3受容体。
【0085】
副作用に対する人の感受性に関連する酵素には、以下の酵素の一又はそれ以上が含まれる:アセチルコリンステラーゼ;アセチルCoA合成酵素;コリン・アセチルトランスフェラーゼ;たんぱく質・セリン/スレオニン・キナーゼAKT1(PRKBA);たんぱく質・セリン/スレオニン・キナーゼAKT3(PRKBG);たんぱく質・セリン/スレオニン・キナーゼCAMK2D(KCC2D);たんぱく質・セリン/スレオニン・キナーゼMAP2K1(MEK1);たんぱく質・セリン/スレオニン・キナーゼMAPK1(ERK1);たんぱく質・セリン/スレオニン・キナーゼMAPK11(p38β);たんぱく質・セリン/スレオニン・キナーゼMAPK12(p38γ);たんぱく質・セリン/スレオニン・キナーゼMAPK13(p38δ);たんぱく質・セリン/スレオニン・キナーゼMAPK3(ERK1);たんぱく質・セリン/スレオニン・キナーゼMAPK8(JNK1);非選択的たんぱく質・セリン/スレオニン・キナーゼPKC;たんぱく質・セリン・キナーゼNTRK1(trkA);たんぱく質・セリン・キナーゼNTRK2(trkB);たんぱく質・セリン・キナーゼSRC;アルドースレアクターゼ;ABTSラジカルフリー・ラジカルスカベンジャー酵素;DPPHラジカルフリー・ラジカルスカベンジャー酵素;SOD模倣薬フリー・ラジカルスカベンジャー酵素;及びUDPグルクノシルトランスフェラーゼUGT1A1。
【0086】
従って、本発明は、この薬剤の受容体介在及び酵素介在活性から生じる副作用を起こすことなく、あるいは、少なくともこのような副作用が生じるリスクを実質的に低減して、初めてこのような個体に小分子治療薬を使用可能にする。
【0087】
エストロゲン、アンドロゲン、プロゲステロン、グルココルチコイド、及びテストステロン受容体におけるある種のA/B−cisスピロスタンサポゲニンとサポニンの不活性は、これまでに、WO−A−99/48507、WO−A−99/48482、WO−A−01/23406、WO−A−01/23407、WO−A−01/23408、WO−A−01/49703において公開されている。ムスカリン性受容体における同じ薬剤の不活性/非結合性は、数が増えたムスカリン性受容体の合成の証拠が提示されているにもかかわらず、示されていなかった。ムスカリン性及びアドレナリン性β2受容体の数の正常化の証拠は、容量依存性あるいは活性/結合性に関連する証拠なしで、WO−A−02/079221及びWO−A−03/082893に提示されている。
【0088】
ある種のA/B−cisフルスタンサポニン、ティモサポニンBIIによるニコチン性受容体の数の容量依存性強化の証拠は、以前に、WO−A−99/16786(EP−A−1024146;US−A−6593301)に公開されている。これらの受容体におけるこの薬剤の活性/結合性の程度は明らかに測定されていない。ここに提示されている更なる証拠は、従来技術に報告されている効果は、NFs及び/又はその受容体の合成あるいは放出の定期的な増加、及び/又は分解速度の減少から生じたものであることを示している。
【0089】
本発明は、上述の一又はそれ以上の受容体と酵素に関連する受容体介在又は酵素介在の副作用を誘発することなく、必要に応じてヒト又は非ヒトにおける神経変性を治療又は予防する方法に使用することができる。
【0090】
以下により詳細に説明するように、この方法は、治療的あるいは非治療的なものであっても良く、この組成物は、薬学的あるいは非薬学的組成物であっても良い。例えば、非治療的使用は、集団の正常範囲にある個体の神経的あるいは精神的機能を改善するものであっても良い。用語「疾患」「症状」「特徴」は、これに従って理解される。以下に詳細に説明するように、他の投与ルートが提供されてはいるが、この活性薬剤は経口投与することが好ましい。
【0091】
新規使用(iii)−薬剤の新規組み合わせ
本発明の活性薬剤は、対象に異常レベルのNF又はNFrを引き起こすことが公知の、あるいはその疑いがあるとされている(すなわち、異常に低い又は異常に高いレベル)その他の活性薬剤と組み合わせて使用することができ、あるいは、このような異常レベルを引き起こす可能性が知られていない、あるいは疑われていない、又はいまだ試験されていない一又はそれ以上のその他の生物学的活性薬剤を用いた予防ベースで使用することができる。このようなその他の生物学的活性薬剤には、薬剤、タンパク質又はポリ核酸(例えば、抗体、F(ab)又はF(ab)2フラグメントなどの抗体フラグメント、siRNA、あるいはアンチセンスDNA)を抑制する特定の結合材、及び幹細胞などの活性組織といった、活性化学物質が含まれる。
【0092】
このように、本発明による薬剤は、その他の生物学的活性薬剤の起こり得る副作用に対抗するように使用することができる。
【0093】
本発明は、ある種の患者の疾患又は症状を治療するあるいは予防するために、ヒト又は非ヒト動物の対象に投与する組成物又は組成物のセット(配列群)に使用することができ、この組成物又は組成物セットは、この疾患又は症状を治療又は予防し、この対象に異常レベルのNF又はNFrを引き起こす可能性を有する第1の生物活性剤を具えており、対象に誘発されたこのような異常NF又はNFrレベルに自己調整態様で対抗する本発明の活性薬剤は、これによって対象において前記異常NF又はNFrレベルに対抗し、好ましくは、正常なNF又はNFrレベルに向ける傾向にある。
【0094】
新規使用(iv)−新規使用状況
本発明は、投与プロトコルの綿密な臨床制御が得られない又は実行できない状況において使用することができる。
【0095】
過剰投与に対する自己制御治療の抵抗及びその応答の時間延長特性は例えば、自己投与又は非治療的投与といった、比較的制御されていない状況の活性薬剤の好ましい投与に結び付く。本発明による自己調整治療方法のプロトコルは、対応する従来技術の治療に比べてより広い範囲で有効である。
【0096】
本発明を使用するいずれの方法も、従って、特に、自己投与又は非治療的投与の状況における投与プロトコルの臨床制御がなされていない状況に適用することができる。
【0097】
本発明のいずれの態様も、本発明の一又はそれ以上の他の態様と同時に実行あるいは使用することができ、本発明の一態様について述べたいずれの例あるいは好ましい例も、本発明のその他の態様と同様に適用するべきである。
【0098】
「治療と予防」
ここで用いられている「治療又は予防」の表現及び類似の用語は、予防医学及び精神科診療によって入手可能な何らかの試験に従って判断した時に、予防手段、治療法、苦痛緩和治療を含めて、障害を取り除くあるいは防ぐあるいは症状を取り除くことを意図したヘルスケアのすべての形を意味する。妥当な見込みを持って特定の結果を達成することを目的とするが、常に達成するとは限らない介在は、「治療又は予防」の表現に含まれる。障害の進行を遅らせるあるいは止めることに成功する介在は、「治療又は予防」の表現に含まれる。
【0099】
ある種の神経性、精神性、炎症性、アレルギー性、及び免疫性疾患は、「スペクトル」状態と考えられ、この場合、個体はある範囲のあり得る症状のいくつかあるいはすべてを示しているか、軽症型の疾患のみを示している。更に、神経性、精神性、炎症性、アレルギー性、及び免疫性及び腫瘍性疾患の多くは進行性であり、比較的軽症の異常な症状で始まって、より重症の異常な症状へ進行する。本発明は、タイプと段階がどのようなものであれ、NF介在型の神経性、精神性、炎症性、アレルギー性、及び免疫性及び腫瘍性のすべての症状の治療と予防を含む。
【0100】
「罹患しやすい」
ここで用いられている「罹患しやすい」の表現及び類似の用語は、個体あるいは疾患についての公知のリスク因子を用いて評価した時に、医学的、健康上の良好な状態、あるいは精神的異常、あるいは個体的な変化について、正常なリスクよりリスクが高い個体を特に意味する。このような個体は、例えば、薬剤の処方、及び/又は、特別な食事療法、ライフスタイル又は同様の推奨がその個体になされる程度に、一又はそれ以上の特定の疾患あるいは個体的な変化が進展する実質的なリスクを有するものとして分類される。
【0101】
毒性と副作用
本発明の薬剤は、制限された、対処可能な副作用を有しており、使用に際して非毒性あるいは基本的に非毒性である。
【0102】
薬学的(獣医学的使用を含む)使用のコンテキストにおいては、これは、薬剤の生理学的受容性という意味を含んでおり、音響医学及び獣医学的判断の範囲内において、この薬剤は、ヒト、哺乳動物及びその他の動物の細胞に接触させて有効投与量で、不適切な毒性、刺激、アレルギー性反応、好ましくない副作用を生じることなく使用するのに適しており、また、このような生じることがある有害事象は、過度なものであると考えられるか、あるいは副次的治療によって対処することができず、妥当なリスク/ベネフィット比につり合ったものと考えられる。
【0103】
機能性食品、特に、食材、サプリメント食品(健康補助食品を含む)、飲料及びサプリメント飲料、並びに、機能性化粧品や、皮膚科及びその他の皮膚に接触する又は眼に接触する調製品といった、局所用製剤のコンテキストにおいては、これはリスク/ベネフィット及び副作用に関する相当の評価を意味しており、供給されるものの特定の成分又は調製品、及び、特定の使用についての安全性と、毒性の基準に適合している。
【0104】
「非治療的方法」
非治療的使用は、一般的に、医学的監督を行うことなく、ある組成物中の生理的活性薬剤のヒト対象の選択的自己投与、典型的には経口投与によって特徴付けられる。典型的には、これから意図される利点は、症状あるいは認識された症状に関連して、良好な状態、あるいは一般的な健康に良い状態になることであり、これは、(i)形式的に診断未確定、(ii)臨床診療に従って診断未確定、あるいは(iii)正常な範囲の健康な集団内にあり、従って、疾患があると考えられない状態である。
【0105】
非治療的使用は、また、医学的介入の欠如、あるいは対象の組成物購入又は入手の段階における介助によって特徴付けられる。
【0106】
更に、非治療的使用は、供給者による組成物の医学的要求の欠如によっても特徴付けられ、従って、自己投与は診断を受けた疾患を治療する特定の意図によって行われない。
【0107】
例えば、非治療的に好適な影響を受けることがある神経機能には、例えば、認知(思考、理由づけ、記憶、思い出す、想像、学習を含む)、集中及び留意、特にそのスケールの症状のより穏やかな終局に対する留意、及び穏やかな異常行動、あるいは性格特性が含まれる。非治療的に好適に治療できる神経機能には、例えば、ヒトの行動、気分、人格、及び、例えば、性的行動、性的機能障害、苦悩、不安、鬱、むら気、不機嫌、ティーンエイジのむら気、睡眠パターンの乱れ、鮮明な夢、悪夢、及び夢中歩行、などの社会機能が含まれる。
【0108】
本発明の非治療的方法によって治療可能な上述の神経的及び精神的機能の例に加えて、関連する行動又は思考が個体に有意な苦痛を生じないため、あるいは個体の日常の機能を破壊しないため、臨床診療によって診断不可能な、穏やかな神経疾患及び精神疾患も、本発明によって非治療的に治療可能な症状と考えられる。
【0109】
穏やかな炎症性、アレルギー性及び免疫性疾患、又は、原因不明のあるいは形式的な診断を受けないその他の理由による、炎症性、アレルギー性、及び免疫性疾患も、本発明によって非治療的に治療可能な症状と考えられる。
【0110】
良性の腫瘍性疾患、又は、原因不明のあるいは形式的な診断を受けないその他の理由による腫瘍性疾患も、本発明によって非治療的に治療可能な症状と考えられる。
【0111】
「正常化」
ここで用いられている「正常化」及び類似の用語(「恒常性」など)の表現は、一般的に正常な健康状態の症状特性に対する生理学的調整を特に意味する。最適な正常状態は、健康な若年の成人あるいは非ヒト動物の状態によって例示できる。
【0112】
従って、「正常化」とは、正常であると特徴づけられる状態に実際に達したか否かにかかわらず、正常な状態に向けた調整過程を含む。
【0113】
神経性疾患
ここで用いられている「神経性疾患」及び類似の用語の表現は、例えば、神経変性(認知障害の症状を伴う神経変性と、認知障害の症状を伴わない神経変性を含む)、神経筋変性、及び運動感覚神経変性を含む。
【0114】
本発明に関連する神経性疾患の例には、限定することなく、以下のものが含まれる:痴呆症、加齢に関連した認識機能障害、アルツハイマー病、アルツハイマー型老年性認知症(SDAT)、レヴィー小体認知症、血管性認知症、パーキンソン病、脳炎後のパーキンソン病、脳炎後及びその他のパーキンソン病以外の理由によるパーキンソン症候群、顔面肩甲上腕型筋ジストロフィーを含む筋ジストロフィー(FSH)、デュシェンヌ型筋ジストロフィー、ベッカー型筋ジストロフィー及びブルース型筋ジストロフィー(Bruce’s muscular dystrophy)、フックスジストロフィー(Fuchs’dystrophy)、筋緊張性ジストロフィー、角膜ジストロフィー、反射性交感神経性ジストロフィー症候群(RSDSA)、神経血管ジストロフィー(neurovascular dystrophy)、重症筋無力症、ランバート・イートン病、ハンチントン病、筋萎縮性側索硬化症(ALS)を含む運動ニューロン疾患、乳児脊髄性筋萎縮症(infantile spinal atrophy)、多発性硬化症、起立性低血圧、疼痛、神経痛、下記のような発作及び事故のような外傷性神経変性(例えば、外傷性の頭部又は脳の損傷、又は脊髄の損傷)、バトン病、コケーン症候群、ダウン症候群、大脳皮質基底核神経節変性症、多系統萎縮症、脳萎縮症、オリーブ橋小脳萎縮症、歯状核赤核萎縮症(dentatorubral atrophy)、淡蒼球ルイ体萎縮症(pallidoluysian atrophy)、球脊髄性萎縮症(spinobulbar atrophy)、視神経炎、硬化性全脳炎(SSPE)、注意欠陥障害、ポストウイルス性脳炎(post−viral encephalitis)、ポリオ後症候群、ファール症候群、ジュベール症候群、ギラン・バレー症候群、無脳回症、もやもや病、神経細胞移動障害、自閉性症候群(autistic syndrome)、ポリグルタミン病、ニーマン・ピック病、進行性多巣性白質脳症、偽脳腫瘍、レフサム病、ツェルヴェーガー症候群、核上性麻痺、フリードライヒ失調症、脊髄小脳失調症2型(spinocerebellar ataxia type 2)、レット症候群、シャイ・ドレーガー症候群、結節性硬化症、ピック病、慢性疲労症候群、遺伝性ニューロパシーを含む神経障害、糖尿病性神経障害及び有糸分裂性神経障害、クロイツフェルト・ヤコブ病(CJD)、変異型CJD、新変異型CJDを含むプリオンベースの神経変性、牛海綿状脳症(狂牛病)(BSE)、GSS、FFI、クールー病及びアルパーズ症候群、ジョセフ病、急性散在性脳脊髄炎、くも膜炎、中枢神経系の血管障害、四肢神経機能の喪失、シャルコー・マリー・トゥース病、クラッベ病、白質萎縮症、心不全への罹患性、喘息、てんかん、聴覚神経変性(auditory neurodegeneration)、黄斑変性症、色素性網膜症(pigmentary retinitis)、及び緑内障に起因する視神経変性。
【0115】
精神疾患
「精神疾患」の表現は、個性と行動に影響する、特に、人間の思考、感覚、気分、及びその他のことに関連する能力に影響する、ヒトの精神的疾患をすべて含む。従って、「神経性」疾患と「精神性」疾患はいくらか重なっており、特に、本発明においては、本発明によって治療あるいは予防する「精神疾患」は、NFs又はNFrsによって直接あるいは間接的に影響を受ける基本的な神経性欠陥に、直接あるいは間接的に関連する。
【0116】
一般的に言って、精神疾患は、関連する行動あるいは思考が、個体に有意な苦痛を生じないかぎり、あるいは個体の日常の機能を壊さない限り、「精神異常」と診断されない。従って、診断可能な疾患と、同様ではあるが、治療が非治療的である(下記を参照)と考えられるあまり重症でない、あるいは破壊的でない精神機能との間にはボーダーラインがある。
【0117】
本発明に関連する精神疾患の例には、限定することなく、以下のものが含まれる:不安障害(例えば、急性ストレス障害、パニック障害、広場恐怖症、社会恐怖症、特定恐怖症、強迫性障害、心的外傷後ストレス障害、身体醜形障害及び全般性不安障害)、性的不安障害(例えば、膣痙、男性の勃起不全、男性のオルガズム障害、女性のオルガズム障害)、小児期障害(例えば、注意欠陥・多動性障害(ADHD)、アスペルガー症候群、自閉性障害、行為障害、反抗的行為障害、分離不安障害及びトゥレット障害)、摂食障害(例えば、拒食症及び過食症)、気分障害(例えば、鬱病、大鬱病性障害、双極性障害(躁鬱病)、季節性情動障害(SAD)、気分循環性障害及び気分変調性障害)、睡眠障害、認知精神障害(cognitive psychiatric disorders)(例えば、せん妄、健忘障害)、人格障害(例えば、妄想性人格障害、分裂病質人格障害、統合失調症性人格障害、反社会的人格障害、境界性型人格障害、演技性人格障害、自己愛性人格障害、回避性人格障害、依存性人格障害、強迫性人格障害)、精神病性障害(例えば、統合失調症、妄想性障害、短期的精神障害(brief psychotic disorder)、統合失調症様障害、分裂情動性障害及び共有精神病性障害)、及び物質関連障害(例えば、アルコール依存症、覚醒剤依存症、大麻依存症、コカイン依存症、幻覚剤依存症、吸入依存症、ニコチン依存症、オピオイド依存症、フェンシクリジン依存症及び鎮静剤依存症)。
【0118】
炎症性及びアレルギー性疾患
本発明によって治療可能な炎症性及びアレルギー性疾患の例には、咳、掻痒症(Johansson,O et al,Arch.Dermatol.Res.,2002,293,pages 614−619)、食物不耐性、乾癬、クループ、過敏性腸症候群、耳鳴り、メニエール病、ストレスによる潰瘍又はアセチルサリチル酸による潰瘍、アレルギー性鼻炎、アレルギー性皮膚炎、結膜炎、炎症、炎症性大腸炎、回腸炎、膵炎、胆嚢炎、非アレルギー性鼻炎、食道炎、変形性関節炎、関節リウマチ、花粉症、家ダニアレルギー、ペットアレルギー、ハンチントン病、急性炎症性痛覚、内臓痛、歯痛及び頭痛、炎症性痛覚過敏、触知性痛覚過敏(tactile hyperalgesia)(例えば、Ma,QP et al,Neuroreport 1997,8,pages 807−810参照)、アレルギー性皮膚反応、目のアレルギー反応、喘息(Bonini,S et al,Proc.Natl.Acad.Sci.USA,1996,93,pages 10955−10960;Braun,A et al,Am.J.Respiratory Cell Mol.Biol.,1999,21,pages 537−546)、アテローム性動脈硬化症、関節炎、慢性潰瘍(例えば、関節リウマチに関連する慢性の血管炎性潰瘍(chronic vasculitic ulcer))及び湿疹が含まれる。
【0119】
本発明による関連する非治療的処置には、正常な呼吸の維持、痛むのどと咳の鎮静、正常な消化を維持する目的での胃の痛みの緩和、鼻詰まりなどの風邪やインフルエンザからの回復を目的とする頭痛の鎮静、筋肉痛の軽減、軽度の痛みの緩和、歯痛の軽減、口腔内潰瘍又は胃潰瘍の軽減、及び健康な関節の維持が含まれる。
【0120】
免疫性疾患
本発明によって治療可能なNF介在免疫性疾患の例には、上述のVega et alの文献の表2(第8頁)に挙げられている免疫細胞機能に対するNFsの影響の正常化によって治療可能な症状を含む。これらの疾患には、AIDS(この場合、NFsの正常化が対象の免疫能力を上げるであろう)、免疫活動過剰症状(この場合、NFsの正常化が対象の免疫システムを下方制御するであろう)、及び、例えば、全身性エリトマトーシス(SLE)などの自己免疫疾患といった、低下した免疫特性の症状(この場合、NFsの正常化が外部薬剤により特異的になるよう免疫システムを支援するであろう)などの免疫不全状態が含まれる。
【0121】
腫瘍性疾患
本発明によって治療可能なNF介在悪性腫瘍性疾患の例には、乳、甲状腺、大腸、肺、卵巣、皮膚、筋肉、膵臓、前立腺、腎臓、生殖器、血液、免疫システム(例えば、脾臓、胸腺及び骨髄)、脳、末梢神経系及び皮膚(例えば、メラノーマ及びカポジ肉腫)の癌が含まれる。
【0122】
損傷を受けたあるいは異常な組織における、あるいはこれに関連する神経機能の回復又は正常化
本発明は、一態様において、損傷を受けたあるいは異常な組織における、あるいはこれに関連する神経機能の回復又は正常化を提供する。この組織は、脳組織であっても良く、皮膚、骨、眼、あるは筋肉組織など、脳外組織であっても良い。
【0123】
本発明のこの態様は、例えば、外科手術、切断、創傷、事故、痣、擦り傷、火傷、凍傷、骨折後の神経の回復に関連して使用できる。
【0124】
創傷の治癒
本発明は、一態様において、創傷の治癒の支援を提供する。この創傷は、あらゆる皮膚の損傷であっても良く、慢性(例えば、潰瘍性)皮膚損傷と、急性皮膚損傷を含む。このような損傷の原因は数多く、多様である。一般的に、すべての皮膚の損傷を、本発明を用いて有益に治療することができる。
【0125】
皮膚の治癒の質を評価するのに測定される創傷治癒の態様には、創傷の閉合の度合い、創傷の上の皮膚組織の再生速度、周辺の皮膚色素に対する治癒した創傷の色、周辺の皮膚強度に対する治癒した創傷の機械的強度、最大に治癒した後に創傷に残る異常な触感又は凹凸に関する組織あるいはその他の皮膚組織を損傷している度合い、創傷の滲出が止まる、又は滲出の流れが弱まるまでにかかる時間、創傷又は滲出液の物理的外観と匂い、及び、治癒過程における様々な時点での痛み、かゆみ、あるいはその他の不快感の度合い、が含まれる。
【0126】
これらのすべての基準に対して、本発明は従来技術の治療に比べて利点を提供する。対象の天然NFsの自己制御恒常性は、外因性NFsを加える必要なしに、使用したすべての基準下で、ヒト及び非ヒト哺乳類の皮膚損傷に有利に影響することが期待される。
【0127】
本発明による薬剤は、創傷治療のために、局所的にあるいは全身に投与することができる。局所的に投与する場合は、例えば、創傷用ドレッシング、クリーム、又は創傷に塗布するその他の調剤など、何らかの好適な組成又は構造から送達することができる。送達システムの更なる詳細は、以下に述べられている。
【0128】
組織の良好な状態及び一般的な健康の促進又は支援
本発明は、別の態様において、運動、労働あるいは消耗からの筋肉や組織の回復、持久力と筋肉スタミナの回復(例えば、競技スポーツにおける、あるいは非競技スポーツにおける)、及び疲労感の低減を提供する。
【0129】
より一般的には、脳内及び脳外の両方において、組織の良好な状態及び一般的な健康を、本発明によって支援することができる。
【0130】
一例では、皮膚に対する、本発明による薬剤の化粧品、眼、あるいは皮膚科学的アプリケーションは、新しい皮膚細胞の補充を改善し、従って、皮膚又は眼の健康感と良好な状態を支援する。例えば、Alber,K.M.et al,Neuroscientist 2007,13,pages 371−382を参照。本発明による方法は、皮膚NFsの自己制御恒常性を含んでおり、身体への毒性薬剤の投与を防ぎ、代わりに、処置に対して対象自身の天然なNFsを調整する。
【0131】
これらの使用は、一般的に、限定するものではないが、非治療的であり、健康な人々を主に対象としている。
【0132】
哺乳動物
ヒトの治療に有益である他に、本発明は、やはり栄養学的及び心理学/精神的症状によって影響を受けることがある様々な哺乳動物においても有益である。このような動物には、例えば動物園の非ヒト霊長類(例えば、類人猿、猿、及びキツネザル)、猫や犬などのペット、犬、馬、仔馬などの労働及びスポーツ動物、例えばブタ、羊、山羊、鹿、牛、及び畜牛などの家畜、及び、ウサギや齧歯動物(例えば、ラット、マウス、ハムスター、スナネズミ、テンジクネズミ)などの実験動物が含まれる。
【0133】
治療するべき疾患、症状、特性あるいは機能がヒトに限定されている場合、治療を受ける哺乳類はヒトであると解される。治療するべき疾患、症状、特性あるいは機能がヒト以外の哺乳類の種に限定されている場合、同じことがそれぞれの種に言える。
【0134】
薬剤
ここで使用されている活性薬剤は一般的に、本質的なことではないが、約800より少ない、例えば約700より少ない、例えば約600より少ない、例えば約500より少ない、例えば約450より少ない分子量を有する。
【0135】
ステロイド化学からの正式名称を受けて、左側の6員環は、A−リングと呼ばれ、A−リングに隣接するリングはB−リングと呼ばれる。また、ステロイド化学からの正式名称を受けて、炭素原子は以下に示すように数値が付されており、環の間の融合線が、5位及び10位の炭素原子の間に生じる。
【0136】
A/B−cisステロイド性フロスタン/エン又はスピロスタン/エン・サポゲニンでは、5位及び10位の炭素原子における置換基又は水素原子が、その分子の面に対して(上方に)βだけ方向づけられている。
【0137】
このことは、分子の面をねじって、立体図面において以下のように見える活性基を作る効果を有する。10位の炭素原子における置換又は水素原子は、図面において、「a」の符号が付けられており、5位の炭素原子における置換又は水素原子には「b」の符号が付けられている。C環は、部分的にのみ示されている。

これは、A/B−cisモチーフである。
【0138】
WO−A−99/48482、WO−A−99/48507、WO−A−01/23407、WO−A−01/23408、WO−A−02/079221、WO−A−03/082893、WO−A−2005/105108及びWO−A−2006/048665に開示されているA/B−cisステロイド性フロスタン/エン又はスピロスタン/エン・サポゲニンの例及びこれらの誘導体の形状は、本発明に用いる活性薬剤として特に記載されている。これらの公報に開示された特定の化合物セット及び個々の化合物、A/B−cisステロイド性フロスタン/エン又はスピロスタン/エン・サポゲニンである化合物の代表的なクラス、及び、これらのエステル、エーテル、ケトン、及びグリコシル化型は、ここに引用によって組み込まれている。
【0139】
A/B−cisステロイド性フロスタン/エン又はスピロスタン/エン・サポゲニンのエステル、エーテル、ケトン、及びグリコシル化型は、一又はそれ以上のエステル、エーテル、ケトン、及びグリコシル化基が分子に存在するものでも良い。一般的にエステル、エーテル、ケトン、及びグリコシル化基は、従来の化学合成法を用いて、A/B−cisスピロスタン/エン・サポゲニンの一又はそれ以上の任意のOH部分に形成される。
【0140】
本発明の活性薬剤の例は、WO−A−01/23406(公開PCT出願の第6頁)の式I、WO−A−01/23406(公開PCT出願の第7頁)にある式II、WO−A−01/23407(公開PCT出願の第6頁)にある式I、WO−A−01/23407(公開PCT出願の第6頁)にある式II、WO−A−01/23408(公開PCT出願の第6頁)にある式I、WO−A−01/49703(公開PCT出願の第7頁)にある式I、WO−A−02/79221(公開PCT出願の第6頁)にある式II、WO−A−03/082893(公開PCT出願の第4頁)にある式I、WO−A−03/082893(公開PCT出願の第4頁)にある式II、WO−A−03/082893(公開PCT出願の第5頁)にある式III、EP−A−1024146(公開EP出願の第4頁)にある式I、及びEP−A−1024146(公開EP出願の第8頁)にある式II、で表されるA/B−cis化合物である。
【0141】
例えば、サルササポゲニンとスミラゲニンの分子、及び、その対応するエステル、エーテル、ケトン、及びサポニン(グリコシル化)誘導体は、本発明の有用な活性薬剤である。A/B−cisフロスタンサポニンである、化合物ティモサポニンBIIは、本発明の有用な活性薬剤である。
【0142】
本発明のその他の有用な活性薬剤には、エピサルササポゲニン、エピスミラゲニン、メタゲニン、サーモゲニン(samogenin)、ジオチゲニン、イソジオチゲニン、テキソゲニン(texogenin)、ヨノゲニン、メキソゲニン(mexogenin)、マルコゲニン及びそれらに対応するエステル、エーテル、ケトン及びサポニン誘導体が含まれる。
【0143】
この活性薬剤は、好適な結晶あるいは非晶質の形で、及び好適な無水、水和あるいは溶媒和の形で使用することができる。サルササポゲニンとスミラゲニン及びこれらの誘導体のこのような形状の更なる詳細は、WO−A−2005/105825及びWO−A−2006/048665に記載されており、これらの文献に特定の符号が付されている。
【0144】
エステルには、特に、カルボン酸塩(例えば、カシレート(cathylate)(エゾキシカルボニロキシ)、アセテート、コハク酸、桂皮酸、フェルラ酸、プロピオナート、ブチレート、イソブチレート、吉草酸、イソ吉草酸、カプロン酸、イソカプロン酸、ジエチルアセテート、オクタノン酸、デカン酸、ラウレート、ミリステート、パルミテート、ステアレート、ベンゾアート、フェニルアセテート、フェニルプロピオナート、桂皮酸、p−ニトロベンゾイルオキシ、3,5−ジニトロベンゾイルオキシ、p−クロロベンゾイルオキシ、2,4−ジクロロベンゾイルオキシ、p−ブロモベンゾイルオキシ、m−ブロモベンゾイルオキシ、p−メトキシベンゾイルオキシ、フタリル、グリシナート、アラニナート、バリナート(valinate)、フェニルアラニナト、イソロシナート(isoleucinate)、メチオニナト、アルギナート(argininate)、アスパラギナート、アスパラギン酸、システイナート、グルタマート、ヒスチジナート、リジナート(lysinate)、プロリナート(prolinate)、セリナート(serinate)、トレオニナート、トリプトファナート、チロシナート、フマル酸、マレイン酸、リン酸塩、及び、スルホン酸塩エステルなど、3−位エステルが含まれる。
【0145】
エーテルには、特に、アルコキシ誘導体(例えば、メトキシ、エトキシ、n−プロポキシ、s−プロポキシ、n−ブトキシ、s−ブトキシ、t−ブトキシ)などの3−位エーテルが含まれる。
【0146】
ケトン(サポゲノン)は、典型的には対応するサポゲニンの3−ケト誘導体であり、環システムの様々なOH−ベアリング炭素原子に形成されたケト誘導体も可能である。3−ケトサポゲノンの例には、サルササポゲノン、スミラゲノン、エピサルササポゲノン、及びエピスミラゲノンが含まれる。
【0147】
好適なサポニン化合物の例には、3−位の炭素原子(すなわち、R3が付着している炭素)がR3の適所にO−糖成分を担持している化合物、例えば、モノ−、ジ−、トリ−サッカライド又は高次のポリサッカライド、又はこれらのアシル化型が含まれる。これらの糖類の例には、グルコース、マンノース、フラクトース、ガラクトース、マルトース、セロビオース、スクロース、ラムノース、キシロース、アラビノース、フコース、キノボース、アピオース、ラクトース、ガラクトース−グルコース、グルコース−アラビノース、フコース−グルコース、ラムノース−グルコース、グルコース−グルコース−グルコース、グルコース−ラムノース、マンノース−グルコース、グルコース−(ラムノース)−グルコース、グルコース−(ラムノース)−ラムノース、グルコース−(グルコース)−グルコース、ガラクトース−(ラムノース)−ガラクトース、から選択された糖類、及びそのアシル化(例えば、アセチル化)誘導体が含まれる。
【0148】
疑似サポ(ゲ)ニンは、それぞれスピロスタン/エン・サポゲニン又はサポニンの開環誘導体であり、F環が開閉する。疑似サポ(ゲ)ニンは、C20−C22結合において、飽和あるいは不飽和である。飽和型は、ときに、「ジハイドロ疑似サポ(ゲ)ニン」と呼ばれる。
【0149】
本発明の活性薬剤は、単体で使用しても良く、所望の組み合わせで使用しても良い。
【0150】
その他の補助薬剤又は補助成分
本発明に使用されている組成物は、組成物と投与ルートに関連して以下により詳細に記載するように、所望の場合、一又はそれ以上の補助薬剤及び/又は補助成分を含むものでも良い。
【0151】
特に、代謝補助剤、ケトンのボディレベルを上げる化合物(ケト原生化合物)、トリカルボン酸(TCA)回路中間体、インビボでTCA中間体に変換する化合物、エネルギィ強化化合物、あるいはこれらの混合物を使用することができる。
【0152】
代謝補助剤には、ビタミン剤、(例えばビタミンE)、ミネラル、抗酸化剤及びその他の関連する化合物(例えば、アルコルビン酸、ビオチン、カルシトリオール、コバラミン、葉酸、ナイアシン、パントテン酸、ピリドキシン、レチノール、レチナール(レチナールデヒド)、レチノイン酸、リボフラビン、チアミン、α−トコフェロール、フィチルメナキノン、マルチプレニルメナキノン、カルシウム、マグネシウム、ナトリウム、アルミニウム、亜鉛、カリウム、クロム、バナジウム、セレン、リン、マンガン、鉄、フッ素、銅、コバルト、モリブデン、ヨウ素、あるいはこれらの組み合わせが含まれる。
【0153】
ケト原生化合物は、一般的に、レシピエントによって外因性脂肪代謝(酸化)を高め、これによって、血中のケトンレベルを上げる。これには、例えば、アセトンといったC3−8ケトン、D−β−ヒドロキシブチレート、D−β−ヒドロキシブチレートの代謝前駆体(例えば、アセトアセチル1−1,3−ブタンジオール、アセトアセチル−D−β−ヒドロキシブチレート及びアセトアセチルグリセロールといったアセトアセチル前駆体;一価、二価又は三価アルコールを伴うD−β−ヒドロキシブチレートのエステルといったエステル;ポリ−D−β−ヒドロキシブチレート、又は約2乃至約100のリピート、例えば約3乃至約10のリピートを有する、最終的に酸素と結合するポリ−D−β−ヒドロキシブチレートといったD−β−ヒドロキシブチレートのポリエステル)、アセトアセテートの前駆体、あるいはこれらの組み合わせが含まれる。
【0154】
TCA中間体には、クエン酸、アコニット酸、イソクエン酸、α−ケトグルタル酸、コハク酸、フマル酸、マレイン酸、オキソ酢酸、あるいはこれらの組み合わせを含まれる。
【0155】
インビボでTCA中間体に変換する化合物には、2−ケト−ヒドロキシプロパノル、2,4−ジヒドロキシブタノール、2−ケト−4−ヒドロキシブタノール、2,4−ジヒドロキシブチル酸、2−ケト−4−ヒドロキシブチル酸、アスパラギン酸、モノ−及びジ−アルキル−オキサロ酢酸、ピルビン酸、グルコース−6−リン酸、あるいはこれらの組み合わせが含まれる。
【0156】
エネルギィ強化化合物には、例えば、コエンザイムCoQ−10、クレアチン、クレアチン誘導体、L−カルニチン、n−アセチル−カルニチン、L−カルニチン誘導体、あるいはこれらの組み合わせが含まれる。これらの化合物は、いろいろな意味でエネルギィ製品を強化する。カルニチンは、脂肪酸の代謝を高める。CoQ−10は、ミトコンドリア内での電子の移動の際に電子キャリアとして作用する。従って、中鎖脂肪酸トリグリセリド(MCTs)などの活性薬剤を有するこれらの化合物の添加によって、特に、栄養的に貧しい人における、代謝効率を高める。
【0157】
補助薬剤が存在する場合、治療あるいは栄養的使用には、一又はそれ以上のカチオンとの錯体として、あるいは塩として代謝前駆体の形で提供することができる。カチオンと典型的な生理学的塩の例には、ナトリウム、カリウム、マグネシウム、カルシウム塩が含まれ、それぞれ、カチオンが生理学的カウンターイオンによってバランスされており、L−リシン、L−アルギニン、メチルグルカミン又はこの分野で知られているその他の塩錯体を形成している。これらの代謝前駆体の調整及び使用は、WO−A−98/41201及びWO−A−00/15216に記載されており、この開示はここに引用によって組み込まれている。
【0158】
組成及び投与ルート
活性薬剤は、活性薬剤と好適な追加成分を含む組成物の形で投与することができる。この組成物は、例えば、薬学的組成物(医薬)、食材、フードサプリメント又は飲料であっても良い。このような組成物は、特定の化合物、及び/又は生理学的に受容できるエステル、アミド、塩、溶媒和物、類似体、あるいはその他の好適な誘導体の混合物を含んでいても良い。一般的に、ある組成物の一の活性薬剤及び/又はその他の成分の存在への言及は、その範囲内で、このような薬剤及び/又は成分の2又はそれ以上の混合物を示す。
【0159】
薬学的組成物は、限定するものではないが、経口、経鼻胃、直腸、経皮、非経口(皮下、筋肉内、静脈内、髄内、及び皮内注射又は点滴)、鼻腔内、経粘膜、インプラント、膣、局所、頬内、舌下を含む適宜のルートで投与することができる。
【0160】
多くの薬物と同様に、投与部位が治療を受ける哺乳類の脳から遠隔で良いことは、小分子でいくらか親油性の薬物使用の典型的な特徴であり、この薬剤は、血流を介して及び血液−脳及び/又は血液−神経バリヤに亘って移動する。
【0161】
本発明のコンテキストにおける「薬学的組成物」の用語は、投与モードの特性と投与形態に応じて、活性薬剤を含む組成物、及び、更に薬学的に許容可能な担体、希釈剤、補助薬、賦形剤、保存剤などのビークル、充填剤、崩壊剤、緩衝材、保存剤、浸透促進剤、湿潤剤、乳化剤、懸濁化剤、甘味剤、香味剤、香料、抗菌材、抗カビ剤、潤滑剤、及び助剤を含む組成物を意味する。適当な投与形態には、例えば、タブレット、糖衣錠、粉、エリキシル剤、シロップ、懸濁液を含む液体薬剤、スプレィ、吸入抗原、タブレット、トローチ、乳化剤、溶液、流体、カプセル、座薬、並びにリポソーム調剤を含む点滴用液体薬剤、が含まれる。技術と製剤は一般的に、Remington,Pharmaceutical sciences,Mack Publishing co.,Easton,PA,latest editionに見ることができる。
【0162】
ここで用いられている「食材」、「フードサプリメント」、「飲料」、及び「飲料サプリメント」の用語は、これらの用語の一般的な意味であり、薬学的調剤に限定されない。これらの組成物は、経口摂取に適している。サプリメントの組成物(例えば、フードサプリメントあるいは飲料サプリメント)は、食料及び飲料に添加して、これらと共に摂取するように構成されている。食物は、典型的には、脂肪、オイル、及び炭水化物などのカロリー材料、並びにタンパク質や、ミネラル源、繊維を含む。組成物の例には、乳製品、シリアル、野菜、肉、魚、鶏肉、あるいは果物ベースの食物が含まれる。飲料の例には、炭酸入り又は炭酸なしの飲料、フルーツジュース、コーヒーあるいは、ハーブティ、フルーツティ、緑茶、あるいは紅茶ィ又は中国茶などのお茶、といった浸出液の飲み物が含まれる。組成物は、牛乳、あるいは、粉ミルク及び/又はラクトース及び/又はカゼインなどの牛乳由来の成分を含んでいても良い。牛乳又は牛乳由来の成分は、好ましくは、牛又はヤギからのものが良い。豆乳などの植物由来のミルクも使用できる。食用成分は、一又はそれ以上の発酵成分を含むものでも良い。この成分は、ヨーグルトを含む。フードサプリメントは、例えば、ビタミン、ミネラル、カフェイン、エフェドリンアルカロイドを含むものでも良い。
【0163】
経口組成物
好適な摂取形態の例には、限定するものではないが、液体、粉あるいは固体のコアを有する投与形態;かみ砕くことができるあるいは経口で崩壊するタブレット;薄いストリップ;グミタブレット;フォームタブレット:被覆材及び/又は粒状マトリックス中に薬剤を含む唾液分泌材で被覆した粒子が含まれる。一の実施例では、投与形態は、特定の所定量(すなわち、投与量)のある種成分、例えば、以下に規定するような活性成分を含むように設計した、固体、半固体、あるいは液体組成物である。好適な投与形態は、経口投与、頬内投与、粘膜投与用のもの、あるいはミネラル、ビタミン及びその他の栄養補給食品、口内ケア薬剤、香料、その他を送達する組成物を含む、薬剤送達システムであっても良い。一の実施例では、本発明の投与形態は、固体であると考えられるが、液体又は半固体成分を含んでいても良い。別の実施例では、投与形態は、ヒトの胃腸管へ薬学的活性成分を送達する経口投与システムである。この組成物の好適な補助薬剤は、鎮痛剤、抗炎症剤、抗関節炎薬、麻酔薬、抗ヒスタミン剤、鎮咳薬、抗生物質、抗ガン剤、抗アレルギー剤、抗感染症薬、抗ウイルス剤、抗凝血剤、抗鬱剤、抗糖尿病薬、制吐薬、整腸剤、抗真菌剤、食欲抑制剤、気管支拡張剤、心血管治療薬、中枢神経系刺激薬、免疫系刺激薬、鼻充血除去薬、利尿剤、去痰薬、胃腸薬、偏頭痛予防薬(migraine preparations)、ポリジメチルシロキサン、呼吸器官の薬、スリープエイド(睡眠導入剤)、尿路系の薬、及びその混合物を含んでも良い。好適な口内ケア薬剤には、例えば、息の清涼剤、歯の漂白剤、抗菌剤、歯の鉱化剤、虫歯防止剤、表面麻酔薬、粘膜保護剤(mucoprotectants)などがある。好適な香料には、メントール、ペパーミント、ミント風味、フルーツ風味、チョコレート、バニラ、風船ガム風味、コーヒー風味、お酒の風味及びこれらの組合せなどが含まれる。存在する好適な胃腸薬には、炭酸カルシウム、水酸化マグネシウム、酸化マグネシウム、炭酸マグネシウム、水酸化アルミニウム、重炭酸ナトリウム、ジヒドロキシアルミニウム炭酸ナトリウム;ビサコジル、カスカラサグラダ、ダントロン、センナ、フェノールフタレイン、アロエ、ヒマシ油、リシノール酸、デヒドロコール酸といった刺激性下剤;ファモチジン、ラニチジン、シメチジン(cimetadine)、ニザチジンといったH2受容体アンタゴニスト、オメプラゾール又はランソプラゾールなどのプロトンポンプ阻害薬、スクラフラート及びミソプロストールのような胃腸の細胞保護薬;プルカロプライド(prucalopride) のような胃腸の消化管運動改善薬、クラリスロマイシン、アモキシシリン、テトラサイクリン及びメトロニダゾールといったピロリ菌に対する抗生物質;ジフェノキシラート及びロぺラミドのような止瀉薬;グリコピロラート;オンダンセトロンのような制吐薬;メサラミンのような鎮痛薬が含まれる。薬剤はまた、例えば、プロピオン酸誘導体を含む非ステロイド性抗炎症剤(NSAIDs)など、イブプロフェン、ナプロキセン、ケトプロフェンなどの鎮痛薬、抗炎症薬、及び解熱剤;例えば、インドメタシン、ジクロフェナク、スリンダク、トルメチンなどの酢酸誘導体;例えば、メフェナム酸、メクロフェナム酸、フルフェナム酸などのフェナム酸誘導体;例えば、ジフルニサール、フルフェニサールなどの2−フェニル安息香酸誘導体;例えばピロキシカム、スドキシカム、イソキシカム、メロキシカムなどのオキシカム(oxicams)、から選択されても良い。一の実施例では、補助活性成分は、例えば、イブプロフェン、ナプロキセン、フルルビプロフェン、フェンブフェン、フェノプロフェン、インドプロフェン、ケトプロフェン、フルプロフェン、ピルプロフェン、カルプロフェン、オキサプロジン、プラノプロフェン、スプロフェン、及び薬学的に許容される塩、誘導体及びそれらの混合物などのプロピオン酸誘導体NSAIDから選択されても良い。本発明の別の実施例では、活性成分は、アセトアミノフェン、アセチルサリチル酸、イブプロフェン、ナプロキセン、ケトプロフェン、フルルビプロフェン、ジクロフェナク、シクロベンザプリン、メロキシカム、ロフェコキシブ、セレコキシブ、及び薬学的に許容される塩、エステル、異性体及びそれらの混合物から選択されても良い。
【0164】
別の実施例では、補助薬剤は、プソイドエフェドリン、フェニレフリン、フェニルプロパノールアミン、クロルフェニラミン、デキストロメトルファン、ジフェンヒドラミン、グアイフェネシン、アステミゾール、テルフェナジン、フェソフェナジン(fexofenadine)、ロラタジン、デスロラタジン、ノラステミゾール(norastemizole)、セチリジン、ベンゾカイン、それらの混合物及び薬学的に許容される塩、エステル、異性体及びそれらの混合物から選択されても良い。別の実施例では、補助活性成分は、メチルフェニデート、モダフィニル、及び、注意欠陥過活動性障害又は注意欠陥障害に適したその他の活性薬剤;オキシブチニン;シデネフィル;シクロベンザプリンであっても良い。この活性成分又は成分は、本発明の投与形態で治療的に有効量で存在する。この量は、経口投与をした際に所望の治療的応答が生じる量であり、当業者は容易に決定することができる。この分野で公知の通り、このような量を決定するに当たり、投与する特定の活性成分、この活性成分のバイオアベイラビリティ特性、投与計画、患者の年齢及び体重、及びその他の要因を考慮するべきである。一の実施例では、この投与形態は、活性成分の少なくとも約85重量パーセントを含む。この活性成分又は成分は、どのような形態の投与形態にも存在する。例えば、活性成分は、投与形態において例えば、溶けるあるいは分解するといった、分子レベルで分散できる、あるいは、粒子の形であっても良く、これは、被覆されていてもされていなくとも良い。活性成分が粒子形状である場合、その粒子(被覆されている、いないにかかわらず)は、典型的に、約1ミクロン乃至約2000ミクロンの平均粒径を有する。一の実施例では、このような粒子は、平均粒径約1ミクロン乃至約300ミクロンの結晶である。更に別の実施例では、この粒子は、平均粒径約50ミクロン乃至約2000ミクロン、例えば、約50ミクロン乃至約1000ミクロン、又は約100ミクロン乃至約800ミクロンの顆粒又はペレットである。
【0165】
一の実施例では、本発明の経口組成物は、ヒト又はペットの食物といった、フード組成物である。ある実施例では、この組成物がフード組成物であり、活性成分に加えて更に、それぞれ乾燥重量で、約15−50%のタンパク質、約5−40%の脂肪、約15−60%の炭水化物、5−10%の灰分、及び5−20%の含水量を具える。ある実施例では、食物は、完全に必要な食餌療法の要件で供給するように意図されている。また、スナック、ペットトリート(例えば、ビスケット)、栄養物バー、及び、食品あるいは、タブレット、カプセル、ゲル、ペースト、乳剤、カプレット、及び以下に述べる同様のものを含む栄養補助食品用のその他の形といった有用な組成物が提供されている。選択的に、このフード組成物は、乾燥組成物(例えば、ペットフード用食物)、半湿性組成物、湿潤組成物、あるいはこれらの混合物であっても良い。
【0166】
本発明の組成物は、特にヒトの消費用に調整された食品である。これらは、ヒトの必要な食餌療法の条件で供給するように意図された食物及び栄養物、並びにその他のヒトの食餌療法サプリメントを含む。一の実施例では、ヒトが消費するように調整された食品は、完全であり、栄養的にバランスをが取れているが、その他の実施例では、良好にバランスが取れたあるいは調整された食事に関連して使用する食事療法サプリメントを意図している。
【0167】
この組成物は、グレイビー、飲料水、飲料、濃縮液、ジェル、ヨーグルト、粉体、流体、ペースト、懸濁液、チューズ、チョコレートチップ、おやつ、スナック、ペレット、ピル、カプセル、タブレット、あるいはその他の送達形式といった、フードサプリメントであっても良い。「フードサプリメント」の用語は、食事療法サプリメントを含む。食事療法サプリメントは、特に、特定の種、あるいはペットなどの個体の動物やヒトによって消費するように調整することができる。一の実施例では、食事療法サプリメントは、比較的濃縮された投与量の活性薬剤を具えており、このサプリメントを少量で動物に投与できるようにするか、あるいは動物へ投与する前に希釈できるようにしても良い。いくつかの実施例では、食事療法サプリメント又はその他の活性薬剤含有組成物は、例えば、投与量を調整するために、よりおいしくなるように、あるいはより少量の投与量でより頻繁な投与を行えるように、動物へ投与する前に水又は水のようなものと混合する必要がある。
【0168】
本発明の組成物は、冷蔵あるいは冷凍することができる。活性薬剤は、当該組成物のその他の成分と予めブレンドしておいて、必要な有益量を乳化させる、あるいはペットフード組成物、食事療法サプリメント、あるいはヒトが消費するように調整した食物の上に被覆するようにしても良く、あるいは、それを消費する前にあるいは動物に提供する前に、例えば、粉あるいはミックスを用いて、組成物に加えるようにしても良い。
【0169】
一の実施例では、この組成物は、有効量の活性薬剤を含んでおり、組成物を投与した動物又はヒトの生理学的又は精神的又は行動学的所望の効果を得る。ペットフード及びヒトの消費用に調整した食物については、組成物のパーセンテージとしての活性薬剤の量は、乾燥材料ベースで組成物の約1%乃至約30%の範囲にあるが、より少ない又はより多いパーセンテージを供給することもできる。様々な実施例では、この量は、乾燥重量ベースで組成物の、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%、5.0%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%、10%、10.5%、11%、11.5%、12%、12.5%、13%、13.5%、14%、14.5%、15%、15.5%、16%、16.5%、17%、17.5%、18%、18.5%、19%、19.5%、20%、20.5%、21%、21.5%、22%、22.5%、23%、23.5%、24%、24.5%、25%、25.5%、26%、26.5%、27%、27.5%、28%、28.5%、29%、29.5%、30%、あるいはそれ以上である。食事療法サプリメントは、数倍濃度が高い活性薬剤を含有するように調整して、タブレット、カプセル、濃縮液の形態、あるいはその他の同様の投与形態で動物又はヒトに投与するようにでき、あるいは、水で希釈する、ペット又はヒトの食物の上にスプレイするあるいは膜、及びその他の同様の投与モードで押予の前に希釈するようにしても良い。食事療法サプリメント用に、活性薬剤を単体で、動物又はヒトに直接投与しても良く、あるいは動物又はヒトの通常の食物に直接適用しても良い。
【0170】
この組成物は、選択的に、ミネラル、ビタミン、塩、香辛料、着色料、及び保存料といった補助物質を含んでいても良い。補助ミネラルの非限定的な例には、カルシウム、リン、カリウム、ナトリウム、鉄、塩化物、硼素、銅、亜鉛、マグネシウム、マンガン、ヨウ素、セレン、などが含まれる。補助ビタミンの非限定的な例には、ビタミンA、ビタミンB、ビタミンC、ビタミンD、ビタミンE、及びビタミンKが含まれ、これらの様々な塩、エステル、あるいは前述の誘導体を含む。また、更なる食事療法サプリメントには、例えば、いずれかの形のナイアシン、パントテン酸、イヌリン、葉酸、ビオチン、アミノ酸、及び同様のもの、並びにこれらの塩及び誘導体が含まれる。更に、この組成物は、(n−3)及び/又は(n−6)脂肪酸、アラキドン酸、ドコサペンタエン酸、及びドコサヘキサエン酸、並びにこれらの全ての組み合わせといった、有益な長鎖ポリ不飽和脂肪酸を含んでいても良い。
【0171】
ここに提供された組成物は、選択的に、通常の神経性健康を促進又は維持する、あるいは認知機能をさらに強化する、一又はそれ以上の補助物質を含む。このような物質には、例えば、コリン、ホスファチジルセリン、α−脂肪酸、CoQ10、アセチル−L−カルニチン、及び、例えばGinko biloba,bacopa monniera,convolvulus pluricaulis,及び/又は、Leucojum aestivumといった植物からの一又はそれ以上の成分を含有する薬草成分又はエキスを含む。
【0172】
様々な実施例において、ここに提供されている食材又はフード/食事療法サプリメントの組成物は、好ましくは、乾燥重量ベースで、約15%乃至約50%の粗タンパク質を含む。粗タンパク質材料は、動物、植物、あるいはその他にかかわらずいずれかの源からの一又はそれ以上のタンパク質を含む。例えば、大豆、綿実、及びピーナッツなどの植物性タンパク質をここで好適に使用することができる。カゼイン、アルブミン、及び、豚、ラム、馬、鳥、魚あるいはこれらの混合物を含む食肉タンパク質などの動物性及び乳性タンパク質が有益である。
【0173】
この組成物は更に、乾燥重量ベースで約5%乃至約40%の脂肪を含んでいても良い。この組成物は、更に、炭水化物の源を含んでいても良い。この組成物は、通常、乾燥重量ベースで約15%乃至約60%の炭水化物を含む。このような炭水化物の例には、米、コーン、ソルガム、アルファルファ、大豆、カノーラ、大麦、小麦、あるはこれらの混合物などの穀類又はシリアルを含む。この組成物は、また、選択的に、乾燥乳清及びその他の乳製品、又は副産物といった、炭水化物を含むその他の成分を含む。
【0174】
この組成物は、また、少なくとも一の繊維源を含む。食物あるいは餌用に適した様々な溶解性あるいは非溶解性の繊維を使用することができ、このような繊維は当業者に知られている。好適な繊維源には、ビートパルプ(甜菜から)、アラビアゴム、タルハゴム、サイリウム、米ぬか、イナゴマメガム、シトラスパルプ、ペクチン、短連鎖オリゴ糖付加フラクトオリゴ糖、マンナンオリゴフルクトース、大豆繊維、アラビノガラクタン、ガラクトオリゴ糖、アラビノキシラン、又はそれらの混合物が含まれる。代替的に、繊維源は、発酵性繊維であっても良い。発酵性繊維については、ペットの免疫システムに利点を提供するものとしてすでに述べられている。前生物的な組成物を提供して腸内のプロバイオティック微生物の成長を強化する、当業者に知られている発酵性繊維又はその他の組成物も、動物の免疫システムに対する本発明が提供する利点を強化する目的で組成物に組み入れることができる。更に、例えば、Lactobacillus又はBifidobacterium種などのプロバイオティック微生物を、この組成物に加えることができる。
【0175】
本発明の経口組成物の別の実施例は、その濃縮物を含む炭酸飲料組成物である。このような組成物は、この分野でよく知られている方法によって調整することができる。
【0176】
この実施例では、二酸化炭素(水中でカルボン酸を作る)によって、飲料が通常酸性である。しかしながら、このような飲料が「酸性になる」、すなわち、「舌にぴりっとする」飲料に見られるこのタイプの追加の酸を含むように調整することができる。この例には、リン酸、及びクエン酸、マレイン酸、フマル酸、及び酒石酸などの食用酸(時に、「健全な酸」と呼ばれる)を含む。果物、果汁、果物エキスは食用酸を含んでおり、これらの成分を含む飲料は酸性になると考えられる。
【0177】
この飲料はノンアルコールであっても良い。例には、コーラ飲料、オレンジ飲料、レモン飲料、レモネード、トニックウオータ、ルートビール、ジンジャーエール、及び、ジンジャービールが含まれる。
【0178】
この飲料は、アルコール飲料であっても良く、典型的には3−9%wt/wtのエタノールを含む。例には、サイダーや、ウオッカやその他のスピリッツと果実風味の炭酸入りブレンドである、いわゆる「アルコポップ」が含まれる。この飲料は軽いアルコール飲料であっても良く、典型的には、0.1−3%wt/wtのエタノールを含む。例には、シャンディや、ある種の発酵型ルートビール、ジンジャービール、及びレモネードが含まれる。
【0179】
炭酸入り飲料は、例えば牛乳又はヨーグルトが入っていない非乳製品である。炭酸入り飲料は、ほとんど脂肪が含まれていない。
【0180】
この飲料はフレーバーウオータベースの飲料であっても良い。
【0181】
炭酸入り飲料は、透明なものでも濁ったものでもよく、不透明なものでも良い。
【0182】
炭酸入り飲料は、例えば、ビタミンA、B、C、D、E及びK群の一又はそれ以上といった、ビタミンを含有していても良い。ビタミンは、フルーツジュースなどその他の成分に存在するビタミンに、更に加えることができる。水溶性ビタミンB及びCは、非常に好適な飲料の成分である。脂溶性ビタミンA、D、E及びKは、若干低いが好適である。好ましいビタミンE、又はその誘導体は、飲料には存在しない。好ましいビタミンA及びK、又はその誘導体は、飲料には存在しない。
【0183】
炭酸入り飲料は、甘味料を含有していても良い。甘味料は、例えば、砂糖、コーンシロップ、糖アルコール(例えば、ソルビトール、キシリトール、マンニトール、マルチトール又はイソマルト)、あるいは、強い甘味料(例えば、サッカリン、スクラロース、ネオターム、アセスルファム、ポタジウム、アスパルテーム)、あるいはこれらの組み合わせなど、天然又は合成甘味料であっても良い。
【0184】
局所組成物
別の実施例では、本発明の組成物は、例えば、化粧品、眼あるいは皮膚の組成物など、局所組成物である。
【0185】
活性薬剤を送達する局所組成物は、好適な方法で調整される。局所組成物は、創傷ドレッシング内あるいはその他の機械的アプリケーション内に、従来の方法で調整することができる。
【0186】
ここに述べた活性薬剤化合物は、一又はそれ以上の化粧品及び/又は皮膚に受容可能なキャリアと共に、及び選択的にその他の治療成分と共に調整し、送達することができる。キャリアは、この組成物のその他の成分と相溶性があり、レシピアントを傷つけないように受け入れ可能でなくてはならない。キャリアはまた、薬剤の望ましくない副作用を低減することもある。このようなキャリア又はビークル成分は、この分野では知られている。Handbook of Cosmetic Science and Technology Taylor & Francis Group,2006を参照。これは、全体として引用により組み込まれている。
【0187】
本発明による局所投与用組成物は、その中に提供されている活性成分と投与領域及び回数に応じて、局部的に及び/又は全身的に投与しても良い。従って、局所製剤に関する以下の説明は、ある程度全身製剤について述べているものとみられ、局所投与と全身投与が可能な活性薬剤が含まれている。
【0188】
本発明の組み合わせに使用されている局所投与用組成物は、通常使用されている薬剤、化粧品、眼、あるいは皮膚の調整に組み入れることができ、様々な形態で存在している。例えば、局所投与用のこの組成物は、溶液、油中水滴型エマルション、水中油滴型エマルジョン、又は水中油中水型乳剤、又は油中水中油中乳剤といった多重エマルジョン、水分散体又は油性分散液、ゲル、クリーム、固体スティック、あるいはエアロゾールであっても良い。本発明によるエマルジョンは、例えば、クリーム、ローション、あるは化粧用ミルクの形で有益であり、例えば、油脂、油、ワックス、及び/又はその他の脂質を含み、並びに、水及び一又はそれ以上の乳化剤を含む。なぜなら、エマルジョンは通常、このような形の剤形で使用されるためである。
【0189】
いくつかの実施例では、本発明による局所投与用組成物は、組成に応じて、例えば、保護皮膚クリーム、クレンジングミルク、日焼け止めローション、栄養クリーム、デイクリーム、あるいはナイトクリーム、などとして使用することができる。
【0190】
局所投与用組成物は、このような調整に従来使用されている化粧品用活性成分、化粧用補助成分、及び/又は化粧品用添加物を含んでいても良い。これらは、例えば、抗酸化剤、防腐剤、殺菌剤、増粘剤、充填剤、消泡剤、香料、エッセンシャルオイル、顔料(例えば、フュームシリカ、酸化剤及びオプションで被覆酸化物、酸化チタン、窒化ホウ素、及び硫酸バリウムを含むケイ酸塩のような超微粒シリカ)、セラミド(天然セラミド又は天然セラミドの機能的疑態の何れか)、界面活性剤、乳化剤、リン脂質、コレステロール、フィトスフィンゴシン、ビタミン又はタンパク質(例えば、レチニル・パルミテート又はアセテート、パンテノール及びその誘導体のようなビタミンB、酢酸トコフェロールのようなビタミンE、ガンマリノレン酸エステルのような多価不飽和脂肪酸のようなビタミンF)といった追加的な有効成分、日焼け止め(化学的な日焼け止め及び分散した物理的な日焼け止めを含む)、安定剤、虫除け、アルコール、可塑剤、ポリオール、重合体、気泡安定剤、電解質、有機溶媒、シリコーン誘導体、保湿剤及び/又は保湿剤、油脂、油、ワックス、水、塩、タンパク質分解性又は角質溶解性活性物質など、を含む。このような添加物は、局所投与用の皮膚又は化粧品用成分に存在する。
【0191】
上述したように、局所送達用活性成分に加えて、本発明の局所組成物は、有益な効果をもたらす一又はそれ以上の追加の活性成分又は物質を含んでいても良い。例えば、特定の実施例では、局所組成物は、日焼け止め製品を含んでいても良い。これらは、好ましくは、本発明に用いる活性成分に加えて、少なくとも一の追加UVAフィルタ及び/又は少なくとも一のUVBフィルタ及び/又は少なくとも一の無機顔料を含む。
【0192】
UVBフィルタは油中あるいは水中に溶けるものでも良い。油中に溶ける物質の例は、例えば、3−ベンジリデンカンファー及びその誘導体、例えば3−(4−メチルベンジリデン)カンファー、4−アミノ安息香酸誘導体、好ましくは2−エチルヘキシル4−ジメチルアミノ安息香酸、アミル4−ジメチルアミノ安息香酸、桂皮酸エステル、好ましくは2−エチルヘキシル4−メトキシケイ皮酸、イソペンチル4−メトキシケイ皮酸、サリチル酸エステル、好ましくは2−エチルヘキシルサリチル酸塩、4−イソプロピルベンジルサリチル酸塩、ホモメチルサリチル酸塩;ベンゾフェノン誘導体、好ましくは2−ヒドロキシ−4−メトキシベンゾフェノン、2−ヒドロキシ−4−メトキシ−4’−メチルベンゾフェノン、2−2’−ジヒドロキシ−4−メトキシベンゾフェノン;ベンザルマロン酸エステル、好ましくはジ(2−エチルヘキシル)4−メトキシベンザルマロン酸、2,4,6−トリアニリノ−(p−カルボ−2’−エチル−1’−ヘキシルオキシ)−1,3,5−トリザン(trizane)、である。
【0193】
水中に溶ける有利な物質は、2−フェニルベンゾイミダゾール−5−スルホン酸及びその塩、例えば、ナトリウム、カリウム又はトリエタノールアンモニウム塩、ベンゾフェノンのスルホン酸誘導体、好ましくは2−ヒドロキシ−4−メトキシベンゾフェノン−5−スルホン酸及びその塩;例えば、4−(2−オキソ−3−ボルニリデンメチル)ベンゾスルホン酸、2−メチル−5−(2−オキソ−3−ボルニリデンメチル)スルホン酸及びそれらの塩のような3-ベンジリデンカンファーのスルホン酸誘導体、である。当然ながら、本発明によって使用できる上述のUVBフィルタのリストは、限定を意図するものではない。
【0194】
本発明によって使用できるUVAフィルタの例には、ジベンゾイルメタン誘導体、特に1−(4’−tert−ブチルフェニル)−3−(4’−メトキシフェニル) プロパン−1,3−ジエン及び1−フェニル−3−(4’−イソプロピルフェニル)プロパン−1,3−ジエンが含まれる。
【0195】
本発明によって使用できる無機顔料の例には、チタン、鉛、鉄、ジルコニウム、ケイ素、マンガン、アルミニウム、セリウムの酸化物及びこれらの混合物、及び当該酸化物が活性薬剤である修飾を含む。酸化チタンに基づく含量が最も好ましい。
【0196】
本発明によって使用することができる有益な抗酸化剤は、化粧品、及び/又は眼、及び/又は、皮膚への適用に適している又は通常使用しているすべての抗酸化剤である。抗酸化剤は、アミノ酸(例えば、グリシン、ヒスチジン、チロシン、トリプトファン)及びそれらの誘導体、イミダゾール(例えば、ウロカニン酸)及びそれらの誘導体、D,L0−カルノシン、D−カルノシン、L−カルノシン及びそれらの誘導体(例えば、アンセリン)などのペプチド、カロチノイド、カロチン(例えば、α−カロチン、β−カロチン、リコピン)及びそれらの誘導体、オーロチオグルコース、プロピルチオウラシル及びそれらのチオール(例えば、チオレドキシン、グルタチオン、システイン、シスチン、シスタミン及びそれらのグリコシル、N−アセチル、メチル、エチル、プロピル、アミル、ブチル及びラウリル、パルミトイル、オレイル、γ‐リノレニル、コレステリル及びグリセリルエステル)及びそれらの塩、チオジプロピオン酸ジラウリル、チオジプロピオン酸ジステアリル、チオジプロパン酸及びその誘導体(例えば、エステル、エーテル、ペプチド、脂質、ヌクレオチド、ヌクレオチド及び塩)及び、低耐性量の(例えば、pmol−μmol/kg)スルホキシミン化合物(例えば、ブチオニンスルホキシミン、ホモシステインスルホキシミン、ブチオニンスルホン、ペンタ−、ヘキサ−、ヘプタチオニンスルホキシミン)、さらに(金属)キレート剤(例えば、α‐ヒドロキシ脂肪酸、パルミチン酸、フィチン酸、ラクトフェリン)、α‐ヒドロキシ酸(例えば、クエン酸、乳酸、リンゴ酸)、フミン酸、胆汁酸、胆汁抽出物、ビリルビン、胆緑素、EDTA、EGTA及びそれらの誘導体、不胞和脂肪酸及びそれらの誘導体(例えば、γ−リノレン酸、リノレン酸、オレイン酸)、葉酸及びその誘導体、アラニン二酢酸、フラボノイド、ポリフェノール、カテコール、ユビキノン、ユビキノール及びそれらの誘導体、ビタミンC及び誘導体(例えば、アスコルビン酸パルミテート、リン酸アスコルビルMg、酢酸アスコルビル)、トコフェロール及び誘導体(例えば、酢酸ビタミンE)、及び安息香の安息香酸コニフェリル、ルチン酸及びその誘導体、フェルラ酸及びその誘導体、ブチルヒドロキシトルエン、ブチルヒドロキシアニソール、ノルジヒドログアイヤチク酸、ノルジヒドログアイヤレチン酸、トリヒドロキシブチロフェノン、尿酸及びその誘導体、マンノース及びその誘導体、亜鉛及びその誘導体(例えば、ZnO、ZnSO4)、セレン及びその誘導体(例えば、セレニウムメチオニン)、スチルベン及びその誘導体(例えば、スチルベンオキシド、トランススチルベンオキシド)及び本発明による好適な上述の有効成分のそれらの誘導体(例えば、塩、エステル、エーテル、糖類、ヌクレオチド、ヌクレオシド、ペプチド及び脂質)からなる群から有益に選択される。
【0197】
溶液、エマルジョン、あるいは分散液として提供されている場合、局所投与用組成物は、以下のように例示される溶材を含んでいても良い。水又は水溶液;カプリン酸又はカプリル酸のトリグリセリドのような、好ましくはヒマシ油といった油;油脂、ワックス及び他の天然及び合成脂質、好ましくは低炭素数のアルコール、例えば、イソプロパノール、プロピレングリコール又はグリセロールを有する脂肪酸のエステル、又は低炭素数のアルカン酸又は脂肪アコード(accord)を有する脂肪アルコールのエステル;アルコール、ジオール又は低炭素数のポリオール及びそれらの誘導体、好ましくは、エタノール、イソプロパノール、プロピレングリコール、グリセロール、エチレングリコール、エチレングリコールモノエチルエーテル又はエチレングリコールモノブチルエーテル、プロピレングリコールモノメチルエーテル、プロピレングリコールモノエチルエーテル又はプロピレングリコールモノブチルエーテル、ジエチレングリコールモノメチルエーテル又はジエチレングリコールモノエチルエーテル、及び類似物。更に、上述した溶材の混合物を使用することができる。特に、アルコール溶材について言えば、水が更なる要素である。
【0198】
本発明によるエマルジョン、アエロゲル、あるいは水分散体又は油性分散液の油相は、鎖長3乃至30炭素原子の飽和及び/又は不飽和型分枝及び/又は非分枝アルカンカルボン酸、及び、鎖長3乃至30炭素原子の飽和及び/又は不飽和型鎖長3乃至30炭素原子の分枝及び/又は非分枝アルコールのエステル群から、又は、芳香族カルボン酸と、鎖長3乃至30炭素原子の分枝及び/又は非分枝アルコールのエステル群から有益に選択される。この場合、このようなエステル油は、ミリスチン酸イソプロピル、パルミチン酸イソプロピル、イソプロピルステアラート、オレイン酸イソプロピル、ステアリン酸n−ブチル、ラウリン酸n−ブチル、オレイン酸n−デシル、ステアリン酸イソオクチル(isoctyl stearate)、ステアリン酸イソノニル、イソノナン酸イソノニル、パルミチン酸2−エチルヘキシル、ラウリン酸2−エチルヘキシル、ステアリン酸2−ヘキシルデシル、パルミチン酸2−オクチルドデシル、オレイン酸オレイル、エルカ酸オレイル、オレイン酸エルシル、エルカ酸エルシル、及びこのようなエステルの合成、半合成及び天然の混合物、例えばホホバオイルからなる群から有益に選択することができる。
【0199】
更に、この油相は、分枝及び/又は非分枝炭化水素及び炭化水素ワックス、シリコーン油、ジアルキルエーテルからなる群、飽和及び/又は不飽和型分枝及び/又は非分枝アルコールと、脂肪酸トリグリセリド、すなわち、鎖長8乃至24、特に12乃至18炭素原子の飽和及び/又は不飽和型分枝及び/又は非分枝アルカンカルボン酸のトリグリセロールエステルとからなる群から有益に選択される。例えば、脂肪酸トリグリセリドは、例えば、オリーブオイル、ひまわり油、大豆油、ピーナッツ油、菜種油、アーモンドオイル、ヤシ油、ココナツオイル、パーム核油等の合成、半合成及び天然オイルのグループからなる群から有益に選択される。これらのオイルとワックス成分の任意の混合物も本発明によって有益に使用される。適当であれば、例えば、パルミチン酸セチルなどのワックスは、唯一の油相脂質であるので、有益に使用することができる。
【0200】
油相は、例えば、2−エチルヘキシルイソステアラート、オクチルドデカノール、イソノナン酸イソトリデシル、イソエイコサン(isoeicosan)、2−エチルヘキシルココエート、C12−15−安息香酸アルキル、カプリル/カプリン酸トリグリセリド、ジカプリリルエーテルからなる群から有益に選択される。特に有利な混合物は、C12−15−安息香酸アルキル及び2−エチルヘキシルイソステアラートの混合物、C12−15−安息香酸アルキル及びイソノナン酸イソトリデシルの混合物、及びC12−15−安息香酸アルキル、及び2−エチルヘキシルイソステアラート及びイソノナン酸イソトリデシルの混合物である。炭化水素に関しては、液体パラフィン、スクワラン、及びスクワレンを本発明によって有益に使用することができる。油相は、環状又は線状シリコーンオイルを含み、あるいは、全体的にこのオイルでなるが、シリコーンオイルとは別に、その他の追加の油相成分を含むことがより有益である。シクロメチコーン(オクタメチルシクロテトラシロキサン)は、本発明によって使用するシリコーンオイルとして有益に用いられる。しかしながら、例えば、ヘキサメチルシクロトリシロキサン、ポリジメチルシロキサン、ポリ(メチルフェニルシロキサン)といったその他のシリコーンオイルも本発明によって有益に用いることができる。特に有益な混合物は更に、シクロメチコーン及びイソノナン酸イソトリデシルの混合物、及びシクロメチコーン及び2−エチルヘキシルイソステアラートの混合物である。
【0201】
適当である場合は、本発明による調剤の水相は、アルコール、ジオール又は低炭素数のポリオール、及びそれらのエステル類、好ましくは、エタノール、イソプロパノール、プロピレングリコール、グリセロール、エチレングリコール、エチレングリコールモノエチルエーテル又はエチレングリコールモノブチルエーテル、ポリエチレングリコールモノメチルエーテル、ポリエチレングリコールモノエチルエーテル又はポリエチレングリコールモノブチルエーテル、ジエチレングリコールモノメチルエーテル又はジエチレングリコールモノエチルエーテル及び類似物、更に、例えばエタノール、イソプロパノール、1,2−プロパンジオール、グリセロールといった低炭素数のアルコール、及び、特に、例えば、ヒアルロン酸、キサンタンゴム、ヒドロキシプロピルメチルセルロースなどの、二酸化シリコン、ケイ酸アルミニウム、多糖及びそれらの誘導体からなるグループから選択された一又はそれ以上の増粘剤を有益に含み、ポリアクリル酸塩からなる群、好ましくはカーボポールと呼ばれる群、例えば型番980、981、1382、2984及び5984のカーボポールからなるポリアクリル酸塩が、単独で又は組み合わせて特に有益である。
【0202】
本発明によって使用するゲルは、通常、低炭素数のアルコール、例えば、エタノール、イソプロパノール、1,2−プロパンジオール、グリセロールと水、あるいは、増粘剤が存在する上述のオイルを含む。この増粘剤は、油性アルコールゲルの場合は、二酸化シリコン又はケイ化アルミニウムであることが好ましく、水性アルコールゲルの場合は、ポリアクリレートが好ましい。
【0203】
固体スティックは、例えば、天然又は合成ワックス、脂肪アルコール又は脂肪酸エステルを含む。本発明による化粧用スティックとしての使用に適した普通の基礎材料は、液状オイル(例えば、液体パラフィン、ヒマシ油、ミリスチン酸イソプロピル)、半固体成分(例えば、ワセリン、ラノリン)、固体成分(例えば、蜜蝋、セレシン、微晶ワックス、あるはオゾケライト)、及び、高融点ワックス(例えば、カルナバワックス、カンデリラワックス)である。
【0204】
本発明による化粧品及び/又は皮膚用調剤に適した、アエロゾール容器からスプレイできる高圧ガスは、通常知られている揮発性の液化高圧ガスであり、例えば、単体で、あるいは互いの混合物として使用できる炭化水素(プロパン、ブタン、イソブテン)である。加圧空気も有益に使用することができる。当業者には、もちろん、アエロゾール調剤の形で原理的に本発明の実施に適する非毒性の高圧ガスがあることは自明である。しかし、特に、フッ化炭化水素とフルオロクロロ炭化水素(FCHCs)中の高圧ガスは、環境あるいはその他の付属する周囲に受け入れられない作用があるため、このガスを用いることなく対処することが推奨される。
【0205】
本発明による局所投与用組成物は、有効量の本発明の活性成分と通常使用される溶材のみならず、有機増粘剤も含むゲルの形状であっても良い。このような増粘剤には、アラビアゴム、キサンタンゴム、アルギン酸ナトリウム、セルロース誘導体、好ましくはメチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、又は例えばベントナイトのようなケイ酸アルミニウムといった無機増粘剤、又はポリエチレングリコール及びステアリン酸塩ポリエチレングリコール又はジステアリン酸ポリエチレングリコールの混合物が含まれる。
【0206】
上述の活性成分を含有する許容できる化粧品/皮膚用キャリア剤形の一例は、以下の成分:キサンタンゴム;グリセリン99.7%;四ナトリウムEDTA;ステアリン酸グリセリル及びPEG−100ステアリン酸塩(ARLACEL(登録商標)165);セチルアルコール;パルミチン酸イソプロピル;ブチル化ヒドロキシトルエン(BHT);メチルパラベン;プロピルパラベン及び純水を含むものでも良い。上述の活性成分を含有する許容できる化粧品/皮膚用キャリア剤形の別の例は、以下の成分:ステアリン酸;セチルアルコール;ラウレス4;CARSONOL(登録商標)Sles;プロピルパラベン;パルミチン酸アスコルビル;プロピレングリコール;CARBOPOL(登録商標)974P;メチルパラベン;KOH(10%);及び水を含むものでも良い。
【0207】
上述の組成物は、例えば、以下の工程によって調整することができる:
1.ステアリン酸、セチルアルコール、ラウレス4、プロピルパラベン、及び、パルミチン酸アスコルビルを合わせて、油相を溶かす;
2.ガラスビーカで、プロピレングリコールと水を合わせて、高速プロペラ攪拌でメチルパラベンとCARBOPOL(登録商標)を分散させる;
3.CARSONOL(登録商標)Slesをステップ(2)の製品に加える;
4.ステップ(3)の製品を65−70℃に温める;
5.混合して、ステップ(1)の製品をステップ(4)の製品に加え、良くかき混ぜる;
6.混合物を40℃に冷却する;
7.溶媒部分を加えて、手でよくかき混ぜる;
8.KOH溶液を加えて中和する;
9.光から防護する。
【0208】
概論
各ケースにおいて、組成物は一又はそれ以上の活性成分を好適に含み、この成分は、A/B−cisスピロスタン又はスピロステンステロイドサポゲニン及びこれらのエステル、エーテル、ケトン、及びこれらのグリコシル化型、その他の非サポ(ゲ)ニン活性薬剤、あるいは任意の組み合わせである。この組み合わせは、一又はそれ以上の生物学的不活性成分、例えば、希釈剤、キャリア、賦形材、を含んでいても良く、この成分が生理活性成分の提示、投与又は送達に関連する目的で作用する、あるいは、活性成分の生理学的効果とは別に対象に関連する利点を提供する。キャリアは、大豆たんぱく質などの植物材料を含んでいても良い。この組成物は、投与モードの特性と投与形態に応じて、保存剤、充填剤、崩壊剤、湿潤剤、乳化剤、懸濁化剤、甘味料、香味料、香料、抗菌材、抗カビ剤、潤滑剤、及び分散剤を含んでいても良い。
【0209】
本発明に使用する組成物、特に、薬学的組成物は、単位量投与形でもよく、ここでは、ある数のこのような投与形を、治療又は予防する症状に応じて、所定の時間内に対象に投与する。代替的に、この組成物は、バルク形であっても良く、この場合、所定の重量又は容量のバルク組成物を測って、治療又は予防する症状に応じて、所定の時間内に対象に投与する。
【0210】
しかしながら、高い投与量であっても、毒性はこれらの活性薬剤に付随する問題であるとは考えられない。適当な投与量の選択は、従って、過度の負担をかけることなく当業者の能力で行うことができる。約0.3mg/kg体重を超える活性薬剤の投与量は、好ましくは、1日1回投与される。より典型的には、投与量は約0.1乃至約25mg/kg、例えば約1乃至約10mg/kgであり、好ましくは1日2回投与される。成人に使用する場合は、投与量は、1日当たり約10乃至約700mgであるのが好ましい。
【0211】
本発明に使用する組成物は、上述したように、その他の治療及び/又は非治療生物活性薬剤を好適に含んでいても良い。
【0212】
本発明に使用する組成物は、単位量投与形であっても良く、ある数のこのような投与形を、治療又は予防する症状に応じて、所定の時間内に対象に投与する。代替的に、この組成物は、バルク形であっても良く、この場合、所定の重量又は容量のバルク組成物を測って、治療又は予防する症状に応じて、所定の時間内に対象に投与する。
【0213】
活性薬剤の必要な投与量は、治療あるいは予防する症状の重篤度に応じて広く変化する。例えば、約1fMないし約5μMといった、フェムトモルからミクロモル範囲の濃度が有効である。実施例12に報告されている実験は、培地中の神経の損傷に対して、インビトロでEC5013.4fMのスミラゲニンを示している。一般的に、ピコモルからミクロモルの範囲のインビボでの血漿濃度(例えばナノモルからミクロモル範囲)は、例えば約1mP以上、例えば約1mP乃至約5μM、例えば、約1pM乃至約3μM、例えば約10pM乃至約700nM、例えば、約0.1nM乃至約500nM、が好ましい。ピコモル以下では、活性薬剤のインビボでの活動が減る傾向にある。ミクロモル以上では、対象の過投与に対する自己制御及び関連する抵抗は、単に、活性薬物が排出されることを意味する。しかしながら、本出願の例では、投与量が高い場合でも、毒性がこれらの活性薬剤の問題であるとは考えられない。従って、適宜の投与量の選択は、過剰な負荷をかけることなく当業者の能力の範囲で行うことができる。活性薬剤を投与した量は、例えば、約0.1mg/kg体重より大きくても、約0.3mg/kg体重より大きくてもよく、好ましくは1日1回投与される。より典型的には、この投与量は、約1.0乃至約25mg/kgであり、例えば、約1乃至約10mg/kgであり、好ましくは1日1回投与される。成人に使用する場合は、投与量は、1日当たり約10乃至約700mgであるのが好ましい。
【0214】
好適な組成物の形及び投与量の更なる詳細、及び、本発明によって治療可能な症状及び疾病の例については、WO−A−99/48482、WO−A−99/48507、WO−A−01/23407、WO−A−01/23408、WO−A−02/079221、WO−A−03/082893、WO−A−2005/105825、WO−A−2006/048665を参照されたい。
【0215】
この活性薬剤は、組成物中の一又はそれ以上のキャリア、賦形剤、及び/又は希釈剤と共に調整することが好ましい。一般的には、薬学的組成物、食材、フードサプリメント、及び飲料など経口組成物、あるいは化粧品、眼あるいは皮膚の調整材など局所的組成物に使用される従来のキャリア、賦形剤及び/又は希釈剤を使用することができる。
【0216】
多くの活性薬剤が比較的脂溶性であり、この場合、可溶化剤、懸濁化剤、及び/又は分散剤を好適に用いて、活性薬剤を組成物中の溶液、懸濁液あるいは分散液中に維持することができる。
【0217】
特に挙げることができる二群の可溶化剤、懸濁化剤、及び/又は分散剤は、MCTsと、中鎖脂肪酸(MCFAs)である。これらは、鎖長が約4乃至12炭素原子の脂肪酸を有する脂溶性化合物である。
【0218】
MCTsの好ましい例は、以下の一般式(I)で表わされる。

ここで、Ra、Rb、及びRcは、互いに独立して、炭素骨格に4乃至12炭素原子を有する飽和又は不飽和脂肪酸残渣から選択される。
【0219】
MCFAsの好ましい例は、以下の一般式(II)で表わされる。

ここで、Rdは、炭素骨格に4乃至12炭素原子を有する飽和又は不飽和脂肪酸残渣である。
【0220】
Ra、Rb、Rc及びRdの例には、カプロン酸(C6:0)、カプリル酸(C8:0)、カプリン酸(C10:0)、ラウリン酸(C12:0)の残渣が含まれる。標準的な命名システムでは、Cの文字の直後の数は、炭素鎖長を表わし、コロンの直後の数字は不飽和結合を示す。このようなMCTsや、MCFAsは、ココナッツ油、ヤシカーネル油、及びカンファー石果(果実)といった天然源から公知の方法で得られる。一又はそれ以上の脂肪酸の残渣は、商業的なMCTs又はMCFAs製品の中に存在する。
【0221】
本発明で使用するMCTsは、例えば、トリ−C6:0MCT、トリ−C8:0MCT、及び、トリ−C10:0MCTから選択することができる。
【0222】
産業上の利用可能性と有用性
本発明は、ヒト及び非ヒト哺乳動物における、最初の、NFs介在の障害と機能の治療的及び非治療的治療の自己制御方法を可能とするものであり、生理学的応答が容量依存的でないが、活性薬剤の比較的広範囲にわたる容量で自己制御が行われる一方、副作用や毒性なしに、予測可能で有益な生理学的効果という点では、比較的狭い「治療窓」を提供している。従って、治療は、比較的広い制限内で過投与に耐える。この性質は、自己投与あるいは臨床設定外のその他の状況と、これまではわからなかった神経及びその他の治療の特徴を好適なものにする。薬剤が小分子であって、ペプチドではない(例えば、タンパク質)との事実は、さらに、脳あるいはCNS内へペプチド活性薬剤を直接投与する複雑な送達装置が入手できない臨床設定外で、本発明の潜在的有用性を支持している。
【0223】
神経性、精神性、炎症性、アレルギー性、免疫性、あるいは腫瘍性疾患を患っている多くの患者は比較的年をとっている、あるいは健康状態があまり良くないので、これらの患者は、これらのカテゴリィ以外の病気にかかりやすいことがある。しばしば、どの範囲のその他の病気又は症状が生じるのかは、確実に予測することができない。本発明以前には、このようなその他の疾患又は症状、あるいはこれらへの個々の感染しやすさは、このような患者のこのような他の疾患又は症状を促進する実質的リスクを治療が運ぶことが非常に多いため、主疾患の治療と矛盾するものであった。従って、以前より簡単で単純な方法であり、より広い患者群にこの方法で適用可能な、疾患及び症状を治療する本発明の有用性は、ヒト及び動物の健康のこれらの重要な領域における医学及びヘルスケア実施を実質的に前進させる。
【図面の簡単な説明】
【0224】
更なる説明のために、本発明を支持するデータを、純粋に例示により、限定することなく以下に述べる。
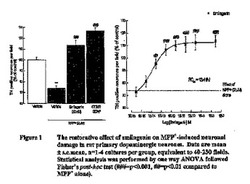
【図1】図1は、MMP+誘発損傷に対するニューロンの保護に関する、ニューロンのスミラゲニン予治療の効果を示す。
【図2】図2は、(a)複合筋活動電位(CMAP)の振幅、(b)グリッド試験、(c)進行性運動ニューロン疾患(pmm)マウスの生存率、に関するサルササポゲニンの効果を示す。
【図3】図3は、CMAPの(a)振幅、(b)待ち時間、(c)時間の経過につれて神経が損傷したマウスの期間、に関するサルササポゲニン、スミラゲニン、及び4−メチルカテコールの効果を示す。
【0225】
実施例と図面の詳細な説明
以下の実施例と図面の説明において、以下の略語を用いる。h=時間;min=分;s=秒;s.c.=皮下;p.o=経口。固体内固体、液体内固体、あるいは固体内液体である組成物の成分のパーセンテージは、重量パーセンテージである。液体内液体である組成物の成分のパーセンテージは、体積パーセンテージである
【0226】
実施例1
いくつかの酵素及び受容体に結合しないサルササポゲニン及びスミラゲニン
以下の表1に挙げた酵素の活性に関するサルササポゲニンの効果及び、以下の表1に挙げた受容体へのサルササポゲニンの結合を調査した。
【0227】
酵素の活性調節を以下の方法を用いて調査した。サルササポゲニンを各酵素と、各酵素用の特別な基体を用いてインキュベートした。インキュベーション期間経過後、反応が止まり、サルササポゲニンの欠如下及び存在下での特別な基体の減少あるいは特別な生成物の増加を測定し、サルササポゲニンの存在下における反応抑制のパーセンテージを計算した。使用した酵素の量、インキュベーション条件、使用した物質及び定量方法は、特定の各アッセイによって変わる。
【0228】
以下の方法を用いて、受容体の結合を調査した。サルササポゲニンを、対象の受容体を発現する組織又は細胞均等質と、既知の濃度の、対象の受容体に対して親和性のある放射性標識化合物と共にインキュベートした。インキュベーションの後、非結合放射性標識化合物を除去し、特定の結合量を定量した。サルササポゲニンの欠如及び存在下での特定の結合量を比較して、サルササポゲニンによる放射性標識化合物の結合抑制のパーセンテージを計算した。受容体源、インキュベーション条件、使用する放射性標識化合物は、各特定のアッセイによって変わる。
【0229】
結果を表1に示す。
表1 酵素及び受容体結合アッセイのサルササポゲニンの効果

【0230】
上述したものと同じ方法を用いて、以下の表2に挙げた受容体に対するスミラゲニン(1μM)の結合、及び、以下の表2に挙げた酵素の活性についてのスミラゲニンの効果を調査した。
【0231】
表2 受容体結合アッセイと酵素のスミラゲニンの効果






【0232】
サルササポゲニンとスミラゲニンは、ある範囲の受容体には結合せず、ある範囲の酵素の活性は変化しない。これらの受容体と酵素は、神経経路、感覚経路、及び運動経路に含まれることが分かっているので、これらの実験で得られた知識の制限内において、神経、感覚及び運動に源をもつ症状及び疾患に対するサルササポゲニンとスミラゲニンの活性は、受容体の結合あるいは酵素の変化を通じて生じるものではない、と推定される。
【0233】
実施例2
サルササポゲニンとスミラゲニンは、インビトロでの基本条件下で培養したニューロンにおける神経栄養因子mRNAを一次的に増やす
特殊化した媒体と条件を用いて、新鮮な単離したニューロンをインビトロで培養することができる。このインビトロ環境は、生理学的なものとは異なり、ニューロンがより大きなストレスを受けて、神経損傷が生じる。神経損傷のレベルは、使用する詳細な条件に応じて、培地によって異なる。従って、神経損傷のレベルは、病理学的物質(例えば、β−アミロイド又はMPP+)を加えることによって有意に増加する。
【0234】
ラットの皮質ニューロンを、上述した方法(Singer,et al.,Neuroscience Letters,1996,212,pp.13−16)の変形によって培養した。培養開始後12日目に、サルササポゲニン(30nM)、スミラゲニン(30nM)、4−メチルカテコール(0.5mM)、NFG及びBDNFの誘導物質放出(Saporito et al.,Experimental Neurology.,1993,123,pp.295−302;Nitta et al.,Journal of Pharmacology and Experimental Therapeutics,1999,291,1276−1283)又はビークル(ジメチル・スルホキシド、DMSO、0.25%)を加えて、1時間、3時間、あるいは6時間おいた。インキュベーション後、全ての伝令リボ核酸(mRNA)を、リアルタイムで逆転写ポリメラーゼ連鎖反応法(rtRT−PCR)を用いて定量した。
【0235】
この結果を以下の表3に示す。
表3 インキュベーションの1、3及び6時間後の、ラット皮質ニューロンにおけるBDNF及びtrkB mRNA発現についての、サルササポゲニン、スミラゲニン、及び4−メチルカテコールの効果

【0236】
サルササポゲニンとスミラゲニンの両方とも、新鮮な単離した皮質ニューロンにおいて、BDNFとBDNF受容体trk−B(チロシン受容体キナーゼニューロトロフィン受容体)のmRNAのレベルを一時的に上げた(3時間後)。
【0237】
別の実験において、ラットの皮質ニューロンを、上述の方法を変形して培養した(Eckenstein and Sofroniew,Journal of Neuroscience,1983,3,pp.22826−2291)。8日目に、培地を、ビークル(DMSO、0.5%)又はスミラゲニン(10μM)を含む媒体に48時間交換して、皮質ニューロンのBDNF mRNAのレベルを、rtRT−PCRで評価した。
【0238】
その結果を以下の表4に示す。
【0239】
表4 ラットの皮質ニューロンにおけるBDNF mRNAのサルササポゲニンを用いた48時間インキュベーションの効果

【0240】
スミラゲニン(10μM)を用いた48時間インキュベーションは、新鮮な遊離皮質ニューロン中のBDNF mRNAレベルを上げなかった。これは、スミラゲニンとサルササポゲニンが6時間ではなく、3時間でBDNF mRNAを上げたことを示す表3のデータと一致している。更に、スミラゲニンの一時的効果(表3)は高濃度のスミラゲニン(表4)によっては克服されなかった。
【0241】
実施例3
スミラゲニンはインビトロで病原体に露出させた培養ニューロンにおいて神経栄養因子mRNAを有意に増加させる
スミラゲニンは予めβ−アミロイドに露出させた皮質ニューロン中のBDNF mRNAを増加させる。
【0242】
ラットの皮質ニューロンを、上述の方法(Eckenstein and Sofroniew,Journal of Neuroscience,1983,3,pp.2286−2291)の変形によって培養した。8日目に、培地をビークル(DMSO、0.5%)あるいはスミラゲニン(10μM)を含む培地に交換した。10日目に、ラットの主な皮質ニューロンをβ−アミロイド(10μg/ml)に、最大48時間37℃で露出させ、続く48時間中、皮質ニューロン中のBDNF mRNAを、rt RT−PCRによって評価した。
【0243】
その結果を表5に示す。
【0244】
表5 β−アミロイドへ露出した後48時間スミラゲニンでの予インキュベーションがラットの皮質ニューロン中のBDNF mRNAを増加させる

【0245】
β−アミロイドへの露出に続く48時間のスミラゲニンによる予処理によって、ラットの皮質ニューロンにおけるBDNF mRNAの発現が有意かつ持続的に増えた。
スミラゲニンは、MPP+に予め露出させたドーパミン作動性ニューロン中のBDNF mRNAを増加させる。
【0246】
ラットのドーパミン作動性ニューロンは、上述の方法(Brouard et al.,Journal of Neuroscience,1992,12,pp.1409−1415)を若干変形させて調整した。培地MPP+(2μM)中で、5日後に、特定のドーパミン作動性神経毒、あるいはビークル(食塩水)を加えて48時間置いた。次いで、培地を、スミラゲニン(10μM)又はビークル(DMSO、0.25%)を含有する新鮮な培地と交換して、10分後、2時間後、24時間後、48時間後、及び72時間後に、rt RT−PCRによってドーパミン作動性ニューロン中のGDNF mRNAを評価した。
【0247】
この結果を以下の表6に示す。
【0248】
表6 スミラゲニンは、MPP+に露出させた後に、ラットドーパミン作動性ニューロン中のGDNF mRNAの発現を増加させる

【0249】
MPP+に露出させた後48時間スミラゲニンで処理を行うことによって、ラットのドーパミン作動性ニューロン中のGDNF mRNAが有意に増加した。この増加は、24時間で最大であり、次いで48時間、72時間後は減少した。
【0250】
実施例2及び3は、スミラゲニンとサルササポゲニンが、神経栄養因子mRNAの発現を増加させることを示している。更に、神経栄養因子mRNA発現に対するスミラゲニンとサルササポゲニンの効果は、ニューロンの状況に応じてある程度(期間と大きさ)変化する。基本条件下で培養した神経では、スミラゲニンとサルササポゲニンが、神経栄養因子mRNAレベルを一次的に増加(最大で、コントロールの140%)させ、これは、6時間(表3)又は48時間(表4)ではなく、3時間(表3)で観察された。反対に、病原体(例えばβ−アミロイドあるいはMPP+)に露出させた培養したニューロンでは、スミラゲニンが、神経栄養因子mRNAの発現をより明確に(最大でコントロールの3319%)かつより長い期間(最大72時間)増加させた(表5及び6)。この結果は、サルササポゲニンとスミラゲニンの神経栄養誘導因子効果が、システムの損傷の度合いに基づいて、自己制御すること、すなわち、サルササポゲニンとスミラゲニンは、神経栄養因子の自己制御メカニズムを壊すあるいはこれに優先することがない、ことを示している。
【0251】
実施例4
スミラゲニンは、インビトロでの基本条件下で培養したニューロン中の神経栄養因子の発現を変えない
ラットの皮質ニューロンを、上述の方法(Eckenstein and Sofroniew,Journal of Neuroscience,1983,3,pp.2286−2291)の変形によって培養した。8日目に、培地をビークル(DMSO、0.5%)あるいはスミラゲニン(10μM)を含む培地に交換した。12日目に、培地中のBDNF濃度を測定した。
【0252】
この結果を以下の表7に示す。
【0253】
表7 スミラゲニンを用いたインキュベーションは、インビトロでの基本条件下で培養したニューロン中のBDNFたんぱく質レベルを変えない

【0254】
スミラゲニンは、インビトロでの基本条件下で培養したニューロン中のBDNFレベルを増加させない。
【0255】
実施例5
サルササポゲニンとスミラゲニンは、インビトロで病原体に発現した、培養したニューロン中の神経栄養因子タンパク質発現を増加させる
サルササポゲニンとスミラゲニンは、BDNFたんぱく質を増やし、β−アミロイドに予め露出させた皮質ニューロンにおけるニューロンの生存と神経突起伸長を増加させる。
【0256】
ラットの皮質ニューロンを、上述の方法(Eckenstein and Sofroniew,Journal of Neuroscience,1983,3,pp.2286−2291)の変形によって培養した。8日目に、培地をビークル(DMSO、0.5%)あるいはスミラゲニン(10μM)を含む培地に交換した。10日目に、ラットの主な皮質ニューロンをβ−アミロイド(10μg/ml)に、最大48時間37℃で露出させ、培地中のBDNF濃度、コリンアセチルトランスフェラーゼ(ChAT)が溶性の細胞の数、及び、神経突起成長を測定した(スミラゲニンのみ)。
【0257】
この結果を以下の表8に示す。
【0258】
表8 スミラゲニン又はサルササポゲニンで48時間予インキュベーションした後β−アミロイドに露出させることで、BDNFたんぱく質レベルがあがり、インビボでニューロン損傷とニューロン委縮が防止される

【0259】
サルササポゲニンとスミラゲニンは、BDNFレベルをコントロールのレベルより上げて、皮質ニューロンにおけるβ−アミロイド誘発ニューロン損傷を防止する。
【0260】
スミラゲニンは、GDNFたんぱく質を上げて、予めMPP+に露出させたドーパミン作動性ニューロンにおけるニューロンの生存と神経突起伸長を増やす。
【0261】
ラットのドーパミン作動性ニューロンは、上述の方法(Brouard et al.,Journal of Neuroscience,1992,12,pp.1409−1415)を若干変形させて調整した。6日後に培地を、スミラゲニン(10μM)又はビークル(DMSO、0.25%)を含有する新鮮な培地と交換した。8日目にMPP+(2μM)あるいはビークル(食塩水)を加えて、48時間後にドーパミン作動性ニューロン中を染色して、培地中のGDNF濃度、ニューロン損傷、及び神経突起伸長を評価した。
【0262】
この結果を以下の表9に示す。
【0263】
表9 スミラゲニンは、培地中のGDNFの量を増やし、MPP+に露出させた後のラットのドーパミン作動性ニューロンにおけるニューロン損傷とニューロン委縮を防止する

【0264】
スミラゲニンは、GDNFの量を増やし、ドーパミン作動性ニューロン中のMPP+誘発性のニューロン損傷を防止する。
【0265】
実施例4に示すデータは、インビトロで基本条件下では培養したニューロンにおける神経栄養因子タンパク質発現を増やさないことを示す。反対に、実施例5は、サルササポゲニンとスミラゲニンが、インビトロで病原体に露出させた培養したニューロン中の神経栄養因子タンパク質発現を増やすことを示している。従って、神経栄養因子タンパク質についてのサルササポゲニンとスミラゲニンの効果は、神経栄養因子mRNAについての効果と同じである。すなわち、サルササポゲニンとスミラゲニンは、神経栄養因子の自己制御メカニズムを壊すあるいはこれに優先することがないが、実際は、ニューロンの必要性に応じて、その影響を受ける。
【0266】
BDNF、trk−B及びGDNFは、神経経路、感覚経路及び運動経路に関係することが知られているので、これらの実験から得られた知識の制限内で、神経源、感覚源及び運動源に対するサルササポゲニンとスミラゲニンの活性が、神経栄養因子とその受容体の強化された遺伝的発現を具えると推定される。
【0267】
実施例6
サルササポゲニンとスミラゲニンは、老化した動物中のBDNF濃度を回復させる
老齢のスプラーグドーリー(SD)ラット(20月令)に、サルササポゲニンとスミラゲニン(18mg/kg/日)を3ヶ月間経口で投与した。若いラットの脳に比べて、年取ったラットの脳においてBDNFが有意に低減した。若いSDラット(4月令)を健康な陽性対象として使用した。処理の終盤において、脳を除去してELISAを用いてBDNFの定量した。
【0268】
その結果を以下の表11に示す。
【0269】
表11 サルササポゲニンとスミラゲニンは、老齢のラットにおけるBDNFレベルの低下を反転させ、BDNFレベルを若い状態に戻す

【0270】
サルササポゲニンとスミラゲニンを、3ヶ月間老齢のラットに経口投与し、老齢の動物のBDNFの低下を、若く健康なラットに観察されるレベルに戻した。すなわち、この薬剤は、老齢のコントロールラットに比べてBDNFレベルを有意に上げる。
【0271】
このデータは、BDNF発現に関するこの薬剤の効果が、長期投与における正常化効果であることを示している。すなわち、ほぼ正常な状態に戻ることを制限することによって、処置を行った動物を薬剤への過剰露出に対して保護する長期の調節作用がある。
【0272】
この実施例は、ここで引用により組み込まれているPCT特許出願第WO−A−03/082893号の実施例9の実験に合致している。この実験は、加齢に関連するBDNF、ドーパミン受容体、及びムスカリン性アセチルコリン受容体のラットにおける低下が、スミラゲニン又はサルササポゲニンによって有意に低減する、あるいは回復することを示した。
【0273】
実施例7
スミラゲニンは、MPTP−障害マウスの線条体におけるBDNFとGDNF濃度を上げる
7週令のオスC57bl/マウス(C57マウス)に毎日、1−メチル−4−フェニル−1,2,3,6−テトラヒドロピリジン(MPTP、25mg/kg/日、腹腔内、連続5日間)を注射し、スミラゲニン(10mg/kg/日)又はビークル(ヒドロキシプロピルメチルセルロース、ツイーン80 0.2% v/vを含有するHPMC 0.5% w/v)を60日間経口投与し、その後、脳を切り取って、ELISAを用いて、GDNFとBDNFの線条体レベル、及び、[I125]−RTI結合を用いてドーパミン輸送体(DAT)レベルの定量化を行った。DATはドーパミン作用性ニューロンに対するニューロン損傷のマーカーである。
【0274】
神経毒MPP+によって生じた損傷、すなわちMPTPの代謝産物は、パーキンソン病などの神経変性疾患に観察される黒質線条体ドーパミン作用性ニューロンの変性に似ている(Mytinlineou et al,Science,225,529−531(1984))。この毒性によって誘発される最も顕著な生化学的変化には、ドーパミンレベルの上昇、及び中脳黒質緻密部と尾状核におけるこの代謝物質(Burns et al,Proc.Natl.Acad.Sci.USA,80,4546−4550(1983))と、黒質線条体シナプトソーム生成におけるドーパミン摂取の低減(Heikkila et al,J.Neurochem.,44,310−313(1985))が含まれる。
【0275】
このように、この実験で用いたMPTPで処理したマウスは、パーキンソン病と同様の運動感覚神経変性症状の受容モデルを提供している。
【0276】
この結果を以下の表12と13に示す。
【0277】
表12 スミラゲニンは、MPTP障害マウスにおける線条体GDNFとBDNFを増やす

【0278】
表13 スミラゲニンは、MPTP障害マウスにおける線条体DATレベルを増やす

【0279】
MPTP障害マウスへ60日間経口投与したスミラゲニンは、線条体GDNF及びBDNFレベルを大幅に上げて、MPTPが誘発したDAT結合のロスを有意に防止する。
【0280】
この実施例は、ここで引用により組み込まれているPCT特許出願第WO−A−03/082893号の実施例6及び7の実験に合致している。これらの実験は、スミラゲニン又はサルササポゲニンで、中脳ドーパミン作用性ニューロンをラットに予め処理することで、インビトロでMPP+誘発神経変性を有意に防止あるいは回復させることを示した。
【0281】
同様の実験で、10週令のオスC57マウスに毎日、MPTP(25mg/kg/日、腹腔内)を連続5日間(1−5日)注射し、スミラゲニン(10mg/kg/日)又はビークル(ツイーン80 0.2% v/vを含有するPMC 0.5% w/v)を61日間(12−72日)、又は71日間(2−72日)経口投与し、その後、脳を切り取って、DATの線条体レベルの定量化を行った。DATはドーパミン作用性ニューロンに対するニューロン損傷の範囲のマーカーである。
【0282】
その結果を以下の表14に示す。
【0283】
表14 スミラゲニンは、マウスの線条体DATレベルにおけるMPTP誘発の低下を回復させる

【0284】
コントロールマウスに71日間経口投与したスミラゲニンは、ビークルのみを投与されたコントロールマウスに比べて、線条体DATレベルを変えない。MPTP障害マウスに61日又は71日間経口投与したスミラゲニンは、MPP誘発線条体DATレベルの低下を有意に回復させる。
【0285】
実施例8
サルササポゲニンとスミラゲニンは、皮質ニューロン、脊髄運動ニューロン、及び感覚ニューロンにおける神経突起生成を増やす
【0286】
皮質ニューロン
ラットの皮質ニューロンを、上述の方法(Singer,et al.,Neuroscience letters,1996,212,pp.13−16)の変形によって培養する。細胞を、サルササポゲニン、スミラゲニン、ビークル(DMSO 0.25%)、GDNF、BDNF、あるいはNGFで24時間培養した。各群について、神経突起を示しているニューロンを示す15枚の写真を各フィールドで任意に選択して、各ニューロンについて最も長い神経突起を測定した。神経突起を示しているニューロンの数と、神経突起を示していないニューロンの数と、各フィールドにおける総ニューロン数を計数することで神経突起の数を測定した。各ウエルにつき6つのフィールドを調べた。
【0287】
この結果を以下の表15に示す。フィールドごとの線条体があるニューロンの数は、フィールドごとの総ニューロン数のパーセンテージで表わしている。
【0288】
表15 サルササポゲニンとスミラゲニンは、皮質ニューロン中の神経突起生成を増やす

【0289】
サルササポゲニンとスミラゲニンは、ラットの主な皮質ニューロンにおいて、存在する神経突起の長さと、神経突起を表わすニューロンのパーセンテージを有意に増やす。サルササポゲニンとスミラゲニンへの露出に続く神経突起の伸長の効果は、陽性コントロール、GDNF、BDNF及びNGFに観察される効果と比較できる。
【0290】
この実施例は、ここで引用により組み込まれているPCT特許出願第WO−A−03/082893号の実施例5の実験に合致している。この実験は、ラットの主な皮質ニューロンをサルササポゲニン又はスミラゲニンで処理することが、存在する神経突起の長さと、神経突起を表わすニューロンのパーセンテージを有意に増やすことを示した。
【0291】
サルササポゲニンとスミラゲニンの神経栄養活性、神経保護活性、及び神経回復活性が、BDNFやGDNFといった神経栄養因子の存在に依存するかどうかを試験するために、以下の実験を行った。
【0292】
以下に示す方法に従って、ラットの皮質ニューロンを培養した。
【0293】
上述した考察とは異なり、ウシ胎児血清(FBS)又はウシ胎仔血清(FCS)を培地に加えておらず、これは培地中に神経栄養因子が存在しないことを意味する。試験化合物を24時間加えた。
【0294】
ラットの皮質ニューロンをFBSあるいはFCSの入っていない、サルササポゲニン、スミラゲニン(30nM)又はビークル(DMSO、0.25%)に、一日露出させた。皮質ニューロンを、希釈したモノクロナール抗体抗β−チューブリンと、希釈した抗マウス免疫グロブリンGを用いて染色した。これらの抗体が、ニューロン細胞本体(神経保護効果を定量する)と神経突起(神経栄養効果を定量する)とを染色した。カメラ付落射蛍光顕微鏡(倍率×20)で、ウエルごとに2枚写真を撮った(各症状につき10枚)。抗β−チューブリンで標識化した細胞の数と、細胞総数の分析を、LUCIA6.0ソフトウエアを用いて行った。
【0295】
この結果を以下の表16に示す。
【0296】
表16 血清がなく、追加の神経栄養因子がない状態で培養した皮質ニューロンのニューロン生存及び神経突起伸長に対するサルササポゲニンとスミラゲニンの効果

【0297】
サルササポゲニンとスミラゲニンは、その神経栄養、神経保護、及び神経回復活性を発揮するために、追加の神経栄養因子を必要としない。
【0298】
脊髄運動ニューロン
キサリプロデン(1−[2−(naphtha−2−yl)ethyl]−4−(3−trifluoromethylphenyl)−1,2,5,6−tetra−hydropyridine hydrochloride)は、SR57746Aとしても知られており、サノフィ・アベンティス社によって、神経変性障害の治療用に開発された、経口活性の、合成、非ペプチド化合物である。キサリプロデンは、血液脳関門を貫通して、インビトロで神経栄養活性を有し、ここで、PC12細胞における神経突起の伸長に関するNGFの効果を促進し(Fournier et al.,Neuroscience,1993,55,pp.629−641;Pradines et al.,Journal of Neurochemistry,1995,64,pp.1954−1964)、マウスの脊髄運動ニューロンの生存を高める(Duong et al.,British Journal of Pharmacology,1999,128,pp.1385−1392)。更に、キサリプロデンは、進行性運動ニューロン疾患マウスの平均生存時間と運動能力を上げる(Duong et al.,British Journal of Pharmacology,1998,124,pp.811−817)。キサリプロデンの行動モードは、不明のところが多い。しかしながら、キサリプロデンの神経保護効果は、5−ヒドロキシトリプタミン1A受容体におけるアゴニスト行動から独立しているように見える(Labie et al.,British Journal of Pharmacology,1999,127,pp.139−144)。
【0299】
以下の実験は、サルササポゲニン又はスミラゲニンの、キサリプロデンに対する、神経及び神経突起の効果を比較している。
【0300】
ラットの脊髄運動ニューロンを、上述の方法に従って調整した(Martinou et al,Neuron,8,737−744,1992)。サルササポゲニン、スミラゲニン、ビークル(DMSO、0.25%)、キサリプロデン、又はBDNFで培養した3日後に、脊髄運動ニューロンをPBSで2回洗浄して、冷たいアルコール溶液(95%)と酢酸(5%)中で5分間固定し、PBSで3回すすいだ。モノクロナール抗体抗β−チューブリンと、抗マウス免疫グロブリンGを用いて、ニューロンを染色した。これらの抗体は、染色ニューロン細胞本体(神経保護効果を定量する)と神経突起(神経栄養効果を定量する)を染色した。細胞の核は、蛍光マーカーによって染色された。培養の1時間後に、細胞をPBSで3回洗浄した。倍率20倍の落射蛍光顕微鏡で培養体を観察した。コンピュータソフトウエアで制御されたカメラを用いて、一連の写真を撮った。すべての画像は、同じ条件下で撮影された。抗β−チューブリンで標識化した細胞の数と、細胞総数(染色された細胞核の数)の分析を、LUCIA6.0ソフトウエアを用いて行った。
【0301】
この結果を以下の表17に示す。
【0302】
表17 サルササポゲニンとスミラゲニンは、脊髄運動ニューロンの神経新生と神経突起生成を増やす

【0303】
このデータは、キサリプロデンへの露出が、コントロールに比べてニューロンの生存と神経突起伸長を有意に増やしたことを示している。サルササポゲニンとスミラゲニンも、ラットの主な脊髄運動ニューロンにおけるニューロンの生存と神経突起伸長を有意に増やした。神経突起生成を増やす効果は、陽性コントロールBDNFで観察される効果と比較できる。
【0304】
サルササポゲニンとスミラゲニンの神経新生を促進する効果は、キサリプロデンの効果より若干顕著であるように見える。ただし、サルササポゲニンとスミラゲニンの効果は、従来の研究に比較すると、この研究では低減しているように見える。
【0305】
キサリプロデン(1及び2mg/日)の効力と安全性は、筋萎縮性側索硬化症(ALS)患者を用いて、2つの段階III臨床試験において評価した(Meininger et al.,Amyotrophic Lateral Aclerosis and Other Motor Neuron Disorders,2004,5,pp.107−117)。更に、近年、キサリプロデンを、アルツハイマー病の可能性として段階III試験において、評価した。そのキサリプロデンについての表示は、現在はもはや進行していない。投与量に依存する副作用は、キサリプロデンの5−ヒドロキシトリプタミン(5−HT)アゴニスト特性に大きくかかわっている。
【0306】
この実施例では、サルササポゲニンとスミラゲニンは、キサリプロデンに比較して、改善したあるいは同様の活性プロファイルを示した。重要なことは、サルササポゲニンとスミラゲニンは、5−HTアゴニストではなく、キサリプロデンに対応する副作用を示していないことである。
【0307】
この実施例は、ここで引用により組み込まれているPCT特許出願第WO−A−03/082893号の実施例8のインビトロでの実験に合致している。この実験は、インビトロでラットの主な脊髄運動ニューロンのグルタミン酸誘発神経変性が、サルササポゲニン又はスミラゲニンによって有意に低減した、あるいは戻ったことを示した。
【0308】
感覚ニューロン
妊娠15日目のWistarラットの胚からラットの感覚ニューロンを得た。5%CO2/95%空気の雰囲気中で37℃にて細胞を培養した。サルササポゲニン、スミラゲニン、ビークル(DMSO、0.25%)、又はNGFで培養した2日後に、感覚ニューロンをPBSで2回洗浄して、PBS中のパラホルムアルデヒド(4%)に4℃で30分間固定した。細胞をTriton X−100(0.1%)で透過性にし、非特定部位をウシ胎仔血清を用いて飽和させた。染色する前に、一次抗体の混合物である、抗ニューロフィラメント68及び200との混合物を用いて、ウシ胎仔血清5%を含むPBS中で、室温で2時間インキュベートした。洗浄する前に、スライドをはずして、細胞をPBSで5分間、2回洗浄し、暗室に1時間置いて、二次抗体であるシアニン3と結合した抗マウス抗体(Cy3;1/1600)とふっ化イソチアン酸スズ(fluoroisothiocyanate)とインキュベートした結合した抗ウサギ抗体を用いて、ウシ胎仔血清5%を含むPBS中でインキュベートした。スライドをPBSで5分間、2回洗浄し、Tris/HCl(0.2mM;pH8.5)で緩衝化したグリセロール(22%)中の抗酸化性溶液(9% w/v)であるMowiolを用いてカバースリップ上に装填した。スライドを室温で一晩置いて、固め、遮光状態で保存した。a×20対物レンズ付DAPI/FITC/Cy3トリプルフィルタ顕微鏡を用いて、スライドを見た。デジタルカメラを用いて、ウエルごとの一連の写真をランダムに撮影した。
【0309】
この結果を以下の表18に示す。
【0310】
表18 サルササポゲニンとスミラゲニンは、感覚ニューロンのニューロン生存を増やす

【0311】
サルササポゲニンとスミラゲニンは、ラットの主な感覚ニューロンのニューロン生存を増やす。
【0312】
実施例9
サルササポゲニンとスミラゲニンは、神経栄養因子と同じ細胞間変換経路を活性化する
サルササポゲニンとスミラゲニン誘発神経突起生成は、trk抑制剤であるK252aによって抑制され、サルササポゲニンとスミラゲニンの神経栄養効果がtrk受容体によって直接的にあるいは間接的に介在されていることを提言している。この抑制実験を以下に説明し、結果を以下の表19に示す。
【0313】
皮質ニューロンを上述の詳細に従って培養した。ニューロンをビークル(DMSO、0.25%)又はK252a(100nM)に1時間露出させた。1時間後、ビークル、サルササポゲニン、スミラゲニン(30nM)又はBDNF(1.85nM)を、K252aの存在を維持した状態で、媒体に加えた。サルササポゲニン又はスミラゲニン(30nM)、ビークル(DMSO、0.25%)又はBDNF(1.85nM)へ24時間露出させた後、ニューロンをリン酸緩衝食塩水(PBS)を用いて洗浄し、PBS中のグルタルアルデヒド(2.5%)に固定した。神経突起を表わしている40−60のニューロンの写真を、顕微鏡に固定したカメラ(対物レンズ ×20、ニコン)で撮像した。写真を分析して神経突起長を測定した。
【0314】
この結果を以下の表19に示す。
【0315】
表19 ラットの主な皮質ニューロンのサルササポゲニンとスミラゲニン誘発神経突起伸長の抑制

【0316】
皮質及び中脳ニューロンにおけるK252a、抗BDNF又は抗GDNF抗体を用いた個別実験で、同様の結果が得られた。
【0317】
trk受容体の活性化を行った後、ニューロンの生存を導く特定の信号変換経路を活性化させ、この経路にMEK1/2が含まれることが示された(Finkbeiner,Neuron,2000,25,pp.11−14)。スミラゲニン誘発神経突起生成は、MEK1/2抑制剤である、PD98059によって部分的に抑制され、スミラゲニンの神経栄養効果がMEK1/2を介して部分的に介在されることを示唆している。この抑制実験について以下に述べ、結果を以下の表20に示す。
【0318】
皮質ニューロンを上述の詳細に従って培養した。ニューロンをビークル(DMSO、0.25%)又はPD98059(10μM)に1時間露出させた。1時間後、ビークル、スミラゲニン(30nM)又はBDNF(1.85nM)を、PD98059の存在を維持した状態で、媒体に加えた。スミラゲニン(30nM)、ビークル(DMSO、0.25%)又はBDNF(1.85nM)へ24時間露出させた後、ニューロンをPBSを用いて洗浄し、PBS中のグルタルアルデヒド(2.5%)に固定した。神経突起を表わしている40−60のニューロンの写真を、顕微鏡に固定したカメラ(対物レンズ ×20、ニコン)で撮像した。写真を分析して神経突起長を測定した。
【0319】
この結果を以下の表20に示す。
【0320】
表20 ラットの主な皮質ニューロンのスミラゲニン誘発神経突起伸長の抑制

【0321】
サルササポゲニンを用いて同様の実験を行って、同様の結果となった。
【0322】
環状アデノシン一リン酸応答要素結合蛋白(CREB)は、転写因子族に属し、ニューロン生存の調整に重要である。更に、trk受容体活性化を行った後、CREBを上方制御した(Finkbeiner,Neuron,2000,25,pp1−14)。サルササポゲニンは、チャイニーズハムスターの卵巣(CHO)細胞中のリン酸化CREB(pCREB、CREBの活性型)の量を有意に増やした。この実験について以下に述べ、結果を以下の表21に示す。
【0323】
CHOをDMSO(0.5%)又はサルササポゲニン(10μM)で24時間インキュベートした。次いで、細胞を冷たいPBSで洗浄し、ドデシル硫酸ナトリウム(SDS)緩衝液中に溶解させ、5分間ボイルして、ブラッドフォールド法によってたんぱく質の含有量を測定した。次いで、サンプルをSDSポリアクリルアミドゲルの上で分離して、PVDF(Bio−Rad)膜に移した。5%のスキムミルク粉に1時間露出させた後、膜を一晩、4℃で、一次抗体である、pCREB(Upsdate: 1:1000)とマウスβ−アクチン(Santa Cruz,1:1000)中でインキュベートした。次いで、膜をぺルオキシダーゼ接合二次抗体(Wuhan Boster biology Tchnology,China.1:2000)で1時間室温でインキュベートして、ECL試薬(Pierce)を用いて発現させた。2−メルカプトエタノール(100mM)、SDS(2%)、Tris HCl(62.5mM)中で、pH6.8、50℃で30分間インキュベートさせることで、膜をストリップさせた。画像分析器(Gel Doc 2000.,Bio−Rad)付のImage J分析システムを用いて、免疫染色の濃度測定定量化を行った。pCREBの各帯域の免疫染色の相対量を、同じ実験のβ−アクチンバンドランに正規化して、任意の単位で表わした。
【0324】
表21 CHO細胞中のあるサルサポゲニンに24時間露出させた後のリン酸化CREBの発現

【0325】
実施例10
サルササポゲニン、スミラゲニン、エピサルササポゲニン、及びエピスミラゲニンでの予処理が、皮質ニューロンへのグルタミン酸誘発損傷を低減する
ラットの主な皮質ニューロンのグルタミン酸への露出は、グルタミン酸の露出後24時間で測定した乳酸脱水素酵素(LDH)活性を増加させ、ニューロンの有意な損傷を示している。ラットの皮質ニューロンを、上述した方法(Singer,et al.,Neuroscience Letters,1996,212,pp.13−16)の変形によって培養した。培養後10目に、媒体を血清を含まない既知の媒体に交換した。12日目に、培地を洗浄して、24時間テスト化合物又はビークル(DMSO、0.25%)を含む新鮮な媒体においた。13日目にニューロンをグルタミン酸(100μM;10分)に、37℃で露出させた。次いで、培地を、テスト化合物又はビークルを補充した新鮮な媒体で洗浄して、LDHを測定する前にその中に更に24時間おいた。グルタミン酸に露出させた後24時間で、この媒体中のLDH活性を測定することで、ニューロンの損傷を評価した。
【0326】
この結果を以下の表22乃至26に示す。
【0327】
表22 サルササポゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を低減する

【0328】
表23 スミラゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を低減する

【0329】
表24 エピサルササポゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を低減する

【0330】
表25 エピスミラゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を低減する

【0331】
表26 ジオスゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を低減しない

【0332】
ラットの主な皮質ニューロンにおいて、グルタミン酸に露出させる24時間前にサルササポゲニン、スミラゲニン、エピサルササポゲニン(1−100nM)、及びエピスミラゲニン(3−300nM)で予処理を行うことで、グルタミン酸のみに露出させたニューロンに比べてグルタミン酸誘発LDHの放出が有意に少なくなる。
【0333】
反対に、グルタミン酸に露出させる24時間前にジオスゲニン(3−300nM)で予処理を行うことは、ニューロンの損傷を防止しなかった。
【0334】
サルササポゲニン、スミラゲニン、エピサルササポゲニン、及びエピスミラゲニンの活性は、毒性を生じさせることなく、ナノモル濃度で安定域に達した。これらの実験条件におけるマイクロモル濃度のテスト化合物は、溶液から凝固する。
【0335】
この実施例は、ここで引用により組み込まれているPCT特許出願第WO−A−03/082893号の実施例2乃至4のインビトロでの実験に合致している。これらの実験は、サルササポゲニン、エピサルササポゲニン、スミラゲニン、エピスミラゲニン、又はこれらの3−ケトン又は3−エステルでラットの主な皮質ニューロンを予処理することが、グルタミン酸誘発神経変性を有意に防止あるいは回復する一方、ジオスゲニンはこのような活性がないことを示した。
【0336】
実施例11
ドーパミン作用性ニューロンにおけるサルササポゲニン、スミラゲニン、エピサルササポゲニン、及びエピスミラゲニンの抗アポトーシス作用
ラットのドーパミン作用性ニューロンを上述のように培養した(Schinelli et al.,Journal of Neurochemistry,1988,50,pp.1900−1907)。5日目に、培養体を洗浄して、テスト化合物(30nM)、ビークル(DMSO、0.25%)又はBDNF(1.85nM)とGDNF(0.17nM)の組み合わせを含む新鮮な媒体に24時間置いた。
【0337】
ラットの主なドーパミン作用性ニューロンをMPP+(2μM、24時間)に露出させることで、コントロールに比べて、ドーパミン作用性ニューロンの数が有意に減少した。6日目に、テスト化合物、ビークル、あるいはBDNFとGDNFの組み合わせの存在下で、MPP+(2μM)を培養体に加えて、更に48時間置いた。MPP+は、ミトコンドリア中の錯体Iの抑制と続くATPの欠乏を介して神経細胞の死を誘発し、その結果フリーラジカルが生じて、アポトーシスを誘発する。インキュベーション期間後に、培養体をPBS(4%)中のパラフォルムアルデヒドに固定した。固定後、Triton×100(0.05%)で30分間透過性にした。次いでニューロンを、抗−チロシン水酸化酵素(TH)で、37℃で2時間インキュベートした。ニューロンをPBSで3回洗浄し、次いで、ヤギ抗マウス/Cy3で、37℃で2時間インキュベートした。ニューロンを経口顕微鏡に装填して、検査した。
【0338】
この結果を以下の表27に示す。
【0339】
表27 サルササポゲニン、スミラゲニン、エピサルササポゲニン、及びエピスミラゲニンは、MPP+誘発の中脳ドーパミン作用性ニューロンの喪失を低減する

【0340】
サルササポゲニン、スミラゲニン、エピサルササポゲニン、及びエピスミラゲニンは、MPP+誘発ドーパミン作用性ニューロンの低減を有意に防止する。神経栄養因子、BDNF及びGDNFの組み合わせに露出させることも、MPP+誘発ドーパミン作用性ニューロンの低減を有意に防止する。
【0341】
実施例12
サルササポゲニンとスミラゲニンは、グルタミン酸又はMPP+誘発損傷後に神経を再生する
【0342】
皮質ニューロン
神経変性疾患の治療の重要なゴールは、進行を防ぐことのみならず、患者に生じるニューロンの喪失を回復することである。ラットの主な皮質ニューロンをグルタミン酸(100μM;10分)に露出させた後、サルササポゲニンとスミラゲニン(30nM)が、治療後24時間でグルタミン酸誘発損傷を有意に回復させた。この実施例は、PCT特許出願第WO−A−03/082893号の実施例2乃至4に報告されている研究の発展形である。
【0343】
ラットの皮質ニューロンを上述した詳細に従って調整した。13日目に、培養体をグルタミン酸(100μM)に、10分間、37℃で、5%CO2/95%空気の雰囲気中で、既知の媒体において露出させた。インキュベーション期間後、培養体を洗浄して、サルササポゲニン、スミラゲニン、又はビークルを含む新鮮な媒体中に維持した。グルタミン酸に露出させた後、細胞を更に24時間培養して、上述した詳細に従って、ニューロン損傷を評価した。
【0344】
その結果を以下の表28に示す。
【0345】
表28 サルササポゲニンとスミラゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を回復させる

【0346】
脊髄運動ニューロン
ラットの脊髄運動ニューロンを上述した詳細に従って調整した。10日目に、媒体を除去して、培養体をグルタミン酸(4μM)に、10分間、37℃で、5%CO2/95%空気の雰囲気中で、既知の媒体において露出させた。グルタミン酸に露出させた後、培養体をDMEMで37℃で洗浄して、サルササポゲニン、スミラゲニン、ビークル、又はBDNFを含む新鮮な培養媒体中に置いた。48時間後、運動ニューロンの障害の程度を上述の詳細に従って測定した。この実施例は、PCT特許出願第WO−A−03/082893号の実施例8に報告されている研究の発展形である。
【0347】
その結果を以下の表29に示す。
【0348】
表29 サルササポゲニンとスミラゲニンは、脊髄運動ニューロンにおけるグルタミン酸誘発損傷を回復させる

【0349】
ラットの主な脊髄運動ニューロンのグルタミン酸(4μM;10分)への露出は、グルタミン酸への露出後48時間で測定したLDH活性を増加させ、有意なニューロン損傷を示している。サルササポゲニンとスミラゲニン(0.03−300μM)は、治療後48時間のグルタミン酸誘発損傷を有意に回復させた。
【0350】
しかしながら、最も濃度の低いサルササポゲニンとスミラゲニンによって提供された障害の回復は、培地間で異なり、このモデルにおける活性の最も低いリミットでは0.03μMであることを示唆している。脳由来の神経栄養因子(3nM)を陽性コントロールとして用いて、グルタミン酸のみに露出させた脊髄運動ニューロンに比べた場合に、グルタミン酸誘発LDH活性を有意に回復させた。
【0351】
ドーパミン作用性ニューロン
ラットの主なドーパミン作用性ニューロンを上述した詳細に従って調整した。5日目に、培養体にMPP+(2μM)を加えて、24時間、37℃で、5%CO2/95%空気の雰囲気中に置いた。ラットの主なドーパミン作用性ニューロンをMPP+(2μM、24時間)露出させることで、コントロールに比較してドーパミン作用性ニューロンの数を有意に低減させた。6日目に、媒体を除去して、ビークル(DMSO、0.25%)、サルササポゲニン、スミラゲニン、又はBDNFとGDNFの組み合わせを含む新鮮な媒体を加えた。48時間後、ドーパミン作用性障害の程度を上述の詳細に従って測定した。
【0352】
その結果を以下の表30に示す。
【0353】
表30 サルササポゲニンとスミラゲニンは、ドーパミン作用性ニューロンにおけるMPP+誘発損傷を回復させる

【0354】
このデータは、サルササポゲニンとスミラゲニン(30nM)がドーパミン作用性ニューロンにおけるMPP+誘発損傷を有意に回復させたことを示す。神経栄養因子、BDNF(1.85nM)とGDNF(0.17nM)の組み合わせに露出させることも、ドーパミン作用性ニューロンにおけるMPP+誘発損傷を有意に回復させた。
【0355】
同様の実験では、結果を図1に示すが、ラットの主なドーパミン作用性ニューロンにおけるMPP+(2μM、24時間)誘発ニューロン損傷を回復させる様々な濃度のスミラゲニンの効果を調べた。BDNF、GDNF、及びビークルの濃度は上述した通りである。ドーパミン作用性培養体を、スミラゲニン(0.3fM乃至30nM)、BDNF(1.85nM)とGDNF(0.17nM)の組み合わせ、又はビークル(DMSO、0.25%)を含む媒体中で24時間インキュベートした。次いで、MPP+(2μM)又はビークルを媒体に加えて、培養体を更に48時間インキュベートした。フィールドあたりのドーパミン作用性(TH−陽性)ニューロンの数を、免疫組織化学と蛍光顕微鏡によって定量化し、次いで、データを組み合わせるようにするべく自体のコントロールに正規化した。MPP+に24時間露出させた後のスミラゲニン(3fM−30nM)を用いた48時間の処理は、13.4fMのEC50を用いたMPP+誘発ニューロン損傷を有意に回復させた。
【0356】
実施例13
サルササポゲニンとスミラゲニンの経口投与は、神経を損傷したマウスモデル(pmnマウス)における神経機能の回復を改善する
進行性の運動神経疾患(pmn)マウスは、変性運動ニューロン障害の遺伝モデルであり、遠位軸索変性と、近位軸索と細胞体の相対保護を伴う後退性プロセスを含む(Schmalbruch et al.,Journal of Neuropathology and Experimental Neurology,1991,50,pp.192−204)。pmn/pmnホモ接合性は、運動軸索のcaudio−cranial変性を患い、おそらく呼吸筋の脱神経によって生後数週間で死にいたる(Schmalbruch et al.,Journal of Neuropathology and Experimental Neurology,1992,358,pp.502−504)。pmnマウスは、特別なヒト運動ニューロン疾患と同等の正しい動物モデルと考えることはできない(Kennel et al.,Neurobiology of Disease,1996,3,pp.137−147)が、神経変性疾患の新しい薬剤候補の可能性を評価する有益なモデルに相当する。このマウスモデルは、ALS、進行性筋委縮症、脊髄性筋委縮症、進行性球まひ、仮性球まひ、原発性側索硬化症、などの運動ニューロン変性の原因となっている病理学的機構を決定するために(Sagot et al,Journal of Neuroscience,1995,15,pp.7727−7733)、及び、運動ニューロン障害の治療のための潜在的な治療戦略を評価するために(Haase et al,Nature medicine,1997,3,pp.429−436;Sendtner et al.,Nature,1992,358,pp.502−504;Sagot et al.,Journal of Neuroscience,1995,15,pp.7727−7733;Sagot et al.,Journal of Neuroscience,1996,16,pp.2335−2341)既に使用されている。この実施例は、PCT特許出願第WO−A−03/082893号の実施例11に報告されている研究の発展形である。
【0357】
罹患したホモ接合性+/+pmn(「pmnマウス」)マウスを、Neurofit(Illkirch,France)に維持されているエキストラトウ遺伝子座(Xt)+/+pmn二重ホモ接合性マウスの繁殖コロニーから得た。生後10日目から、疾患の最初の症状が現れる直後まで、pmnマウスに経口強制飼養を行った。サルササポゲニン(0.03、0.3、及び3μg/kg/日)を、油中懸濁液(10ml/kg)としてpmnマウスに投与した。米国電気診断医学協会のガイドラインに従って、標準形Neuromatic2000M筋電図装置を用いて筋電図(EMB)の記録を取った。8日目から標準行動試験(グリッド、ロータロッド、ハンギングテスト)を行って、pmnマウスの運動能力を評価した。
【0358】
運動機能に関するサルササポゲニンの効果を、腓腹筋誘発運動反応の大きさを記録することによって評価した(CMAP、機能性運動ニューロン数の関節測定)。
【0359】
この結果を図2に示す。
【0360】
pmnコントロール群は、12日令で、CMAPの大きさの急激な減少を示した。pmnマウスへサルササポゲニン(0.3μg/kg/日)を毎日経口投与することが、運動機能の劣化を遅らせた(p<0.001)。コントロールマウスのつまずきの回数は、12日令から急激に多くなった。pmnマウスへサルササポゲニン(0.3μg/kg/日)を毎日経口投与することが、pmnコントロール群と比較して、ロータロッド及びグリッドテストパフォーマンスにおける劣化を有意に遅らせた(p=0.02 多変量分散(MANOVA)分析)。サルササポゲニン(0.3μg/kg/日)の毎日の経口投与によって、pmnコントロール群に比較して、pmnマウスの生存率を有意に増やした(コントロールに比べて最大62%、log rank,χ2=7.36,P=0.006)。
【0361】
反対に、臨床症状が発症した後に、最も低いテスト投与量(0.03μg/kg/日)でサルササポゲニンを毎日経口投与することでは、この遺伝子モデルにおける運動ニューロン変性の進行を遅らせることはない。
【0362】
これらの結果は、経口活性、非ペプチド神経栄養因子誘発体であるサルササポゲニンが、この遺伝子モデルにける運動ニューロン変性の進行を遅らせることができることを示唆している。神経栄養因子(毛様体神経栄養因子;CNTF;Sagot et al,Journal of Neuroscience,1995,15,pp.7727−7733)及びGDNF(Sagot et al,Journal of Neuroscience,1996,16,pp.2335−2341)は、pmnマウスモデルで試験を行った。これらの研究は、CNTF(腹腔内、CNTF−分泌細胞の投与)が生存時間を40%伸ばし、運動機能を改善する一方、GDNF派運動ニューロン生存を改善したが、疾病を遅らせることはなかったことを示した(Sagot et al,Journal of Neuroscience,1996,16,pp.2335−2341)。神経栄養因子は、運動ニューロン疾患の有望な治療として考えられてきたが、タンパク質として広く知られた臨床使用は非常に問題である。非ペプチド神経栄養組成物SR57746A(キサリプロデン)を、pmnマウスに生後から経口投与することは、運動神経変性の進行を遅らせて、マウスの運動能力を改善し生存期間を改善した(〜50%;Duong et al.,British Jounal of Pharmacology,1998,124,pp.811−817)。更に、疾病開始時点におけるCGP3466B(抗アポトーシス剤)の経口投与は、その疾病の進行を遅らせ、pnmマウスの生存期間を57%改善した(Sagot et al.,British Jounal of Pharmacology,2000,131,pp.721−728);分子BN80933(抑制剤ニューロン酸化窒素シンターゼ及び脂質過酸化反応)は、pmnマウスの生存期間を40%改善した(Sagot et al.,British Jounal of Pharmacology,2000,131,pp.721−728)。
【0363】
重要なことは、サルササポゲニンは、疾患の症状が現れた後に経口投与した場合、その疾患の進行を遅らせて、このモデルにおいてpmnマウスの生存期間をインビボで最大62%改善したことである。同様の結果がスミラゲニンでも得られた。
【0364】
実施例14
サルササポゲニンとスミラゲニンの経口投与は、神経疾患のある別のマウスモデル(神経挫滅モデル)における神経機能の回復を改善する
坐骨神経挫滅モデルは、運動ニューロン障害及び外傷後の神経損傷の良く特徴づけられた可逆モデルである(McMahon and Priestley,Current Opinion in Neurobiology,1995,5,pp.616−624)。この神経損傷は、止血鉗子を用いて、マウスの右の坐骨神経が3つにわかれる部分近傍5mmに機械的圧力を2回かけて作る。この結果、2週間に亘って神経変性が生じ、続いて神経の局所的炎症が最大4週間続く。神経機能の喪失は、機械的損傷後4−5週間に亘って徐々に回復する。
【0365】
坐骨神経損傷後、C57マウスへの6週間に亘るサルササポゲニン(3mg/kg/日、油中経口強制飼養)とスミラゲニン(0.3及び3mg/kg/日、油中経口強制飼養)の経口投与は、腓腹筋のCMAPパラメータ(振幅、待ち時間及び期間、活性運動ファイバの間接マーカ、運動神経伝導速度、及び神経繊維の機能性)と、坐骨神経の形態学的分析(変性した神経線維の比率)で測定した場合の神経機能の回復を有意に改善した。4−メチルカテコール(10μg/kg/日、腹腔)を陽性コントロールとして用いた(Kaechi et al.,Journal of Phamacology and Experimental Therapeutics,1995,272,pp.1300−1304)。
【0366】
この結果を図3に示す。
【0367】
C57bl/6 RJマウスに塩酸ケタミン(60mg/kg、腹腔)で麻酔をかけた。大腿つけねの皺と膝の中間レベルで座骨神経を外科的に露出させて、坐骨神経が3つにわかれる部分近傍5mmをつぶした。この神経は、止血鉗子を用いて、それぞれの間で90度回転させて、30秒間2回つぶした。この結果、二週間に亘って、神経変性が生じ、次いで神経の局所的炎症が機械的損傷の後4週間続いた。神経機能の喪失は、機械的損傷後4−5週間に亘って徐々に回復した。筋電図の記録を上述したように評価した。
【0368】
この結果を以下の表31に示す。
【0369】
表31 サルササポゲニンとスミラゲニンは、神経を損傷したマウスモデルにおける変性した神経繊維の数を減らす

【0370】
サルササポゲニンとスミラゲニンは、経口活性であり、神経機能の回復を改善し、座骨神経損傷モデルにおける神経再生を刺激する。
【0371】
実施例15
サルササポゲニンとスミラゲニンは、老化した動物の不安を低減し、認知能力とBDNFの減少を回復する
老齢のSDラット(20月令)に3ヶ月間サルササポゲニン又はスミラゲニン(18mg/kg/日)を経口投与した。若いSDラット(4月令)を健康な陽性コントロールとして用い、老齢のSDラット(20月令)を神経変性コントロールとして用いた。Y字迷路を用いて、学習と記憶を評価し、動物を疲れさせるテストの特徴を考慮して不安モデルとした。Y字迷路の各アームの床は、銅性ロッドでできたアレイであり(2mm×140mm)、これに調整可能な電圧で、必要に応じて電流を流した。各アームは450mmの長さであり、端部に15ワットのランプが付いている。2カ月の処置の後、各ラットを、1日1回、連続7日間訓練した。各訓練期間中、ラットをY字迷路の一方のアームにおいて、2分後に反時計回り方向のアームの銅製ロッドに電流を流し、時計回り方向のアームのランプを点灯させ、電流の通ってない領域を表示した。ラットがランプが点灯しているアームへ行った場合に、正しい反応を記録して、そうでない場合は誤った反応を記録した。この刺激−応答試験を、各試験の間に5秒の休止を入れて、一日20回繰り返した。正しい応答数と、20回の試験のトータル時間を記録した。トータル応答時間で割った正しい応答回数の割合を計算して学習能力の指標として用い、この割合が高いほど学習能力が良好であった。学習テストの1カ月後(3か月の処置)、Y字迷路試験を再度行って、得られた割合を記憶能力の指標として用いた。処置の最後に、ラットを殺して、脳を取り出して、ELISAを用いてBDNFの定量化を行った(上述の実施例3に提示されているBDNFのデータ)。
【0372】
Y字迷路実験の結果を以下の表32に示す。
【0373】
表32 サルササポゲニンとスミラゲニンは、老齢ラットの認知能力(学習及び記憶)とBDNFレベルの減少を回復させる

【0374】
老齢のラットに最大3カ月間経口投与したサルササポゲニンとスミラゲニン(18mg/kg/日)は、認知能力(学習及び記憶能力)を若いラットに見られる能力に回復させる。
【0375】
実施例16
経口投与したサルササポゲニンとスミラゲニンは、様々な身体組織に送達される
サルササポゲニンとスミラゲニンは、経口的に活性であることが示されており、齧歯動物及び非齧歯動物における経口投与後に血漿、脳、脊髄(及びその他の組織)の濃度を測定した。
【0376】
この結果を以下の表33に示す。
【0377】
表33 サルササポゲニンとスミラゲニンは、単回の経口投与後に血漿、脳、及び脊髄に分配される

【0378】
経口投与したサルササポゲニンとスミラゲニンは、身体のニューロン部位及び血漿へ移動する。
【0379】
実施例17
経口投与したサルササポゲニンとスミラゲニンは、有効投与量において非毒性である
サルササポゲニンとスミラゲニンは、インビトロではナノ分子濃度で活性であるが、より低い濃度では不活性であるか、あるいはニューロンにおいて可変活性を示す。より高い濃度では、サルササポゲニンとスミラゲニンは、インビトロでより高い濃度の神経栄養因子で観察される毒性を示さない。
【0380】
高い投与量で経口投与した後の長期に亘る毒性の研究をサルササポゲニン(ラットで最大26週間、非齧歯動物で39週間)とスミラゲニン(マウスと非齧歯{げっし}動物で最大52週間)について行ったが、高レベルの神経栄養因子が到達したときに見られた毒性あるいは副作用の兆候は示さなかった。
【0381】
実施例18
スミラゲニンは、MPTP障害のあるマカクのパーキンソン病を低減し、被殻中のGDNFとBDNF濃度を調整する
19匹のカニクイザル(Macaca fascicularis,3.0−4.5kg、4−6歳)を3ヶ月間実験環境と工程に慣れさせて、すべての動物の基準行動を評価した。14匹のメスのマカクに、著しく、安定的なパーキンソン症状が発現するまで、MPTP(0.2mg/kg/日、皮下注射)を与えた。動物(n=7/群)をランダムに2群に振り分けて、スミラゲニン(20mg/kg/日、経口)投与群又はビークルコントロール(HPMC、0.5%w/v、ツイーン800.2%v/v含有)とした。MPTPを与えられなかった5匹のマカクは、ビークルを投与して、コントロール群とした。
【0382】
スミラゲニン又はビークルを18週間投与した後、MPTP投与後にパーキンソン性障害の評価を行った。パーキンソン性障害を、この処置に正しい判断ができない神経学者によって、DVD記録の事後分析によって評価した。研究の最後に、脳を取り出して、被殻中の非結合GDNFとBDNFのレベルを、Multiplex ELISA/Aushonアッセイを用いて測定した。このように、この実験で用いたMPTPで処置したマカクは、パーキンソン病及び同様の運動−感覚神経変性症状の受け入れモデルを提供している。
【0383】
この結果を以下の表34に示す。
【0384】
表34 スミラゲニンは、MPTP障害マカクにおける行動を改善し、被殻のGDNFとBDNFのレベルを調整する

【0385】
MPTP障害マカクに18週間経口投与したスミラゲニンは、MPTP障害マカクのパーキンソン性レベルを有意に低減する。スミラゲニンはまた、ビークルを投与したマカクに比べて、MPTP障害マカクの被殻におけるGDNFとBDNFのレベルを、コントロールの障害がないマカクのものとほぼ変わらないレベルにまで、有意に低減させる。
【0386】
このデータは、GDNFとBDNFの発現に関するスミラゲニンの効果が、長期投与の下での正常化効果である、すなわち、このレベルをほぼ正常レベルに戻すことによって、GDNFとBDNFへの過剰投与に対して動物を保護する、長期に亘る定期的な効果がある。この変化は、重要であり、マカクのパーキンソン性レベルの有意な低減に関連する。
【0387】
考察
上述の実施例は、A/B−cisスピロスタンステロイド性サポゲニンである、サルササポゲニンとスミラゲニンは、インビトロ及びエクスビトロのデータで示すように、神経栄養因子誘発剤である。これらは、経口投与後にインビトロであるいはインビボで神経保護及び神経回復可能である。これらは、誘発材としての神経栄養因子の存在を必要とせず、NF強化剤ではなくむしろ、真のNF誘発剤であるように見える。
【0388】
神経栄養因子(例えば、BDNFやGDNF)の投与は、鬱病、統合失調症、パーキンソン病及びその他の疾病における疾病調整の戦略であり、この戦略は、強力な科学的論拠を有していた。しかしながら、この科学的根拠を臨床に持ち込むことが困難であるとされてきた。これは、神経栄養因子のたんぱく質特性と、外科的、ウイルスベクタによる、及び細胞ベースの遺伝子/たんぱく質送達アプローチに固有の困難性に起因する。ニューロンの栄養に関する複雑な条件が、単一因子によって達成される効果を制限しており、臨床的利益を達成するための神経栄養因子の量及び必要な期間も、現在のところわかっていない。
【0389】
経口活性神経栄養因子誘発剤であるサルササポゲニンとスミラゲニンと、この出願で規定されている関連する分子は、これらの困難の多くを克服する。ここで、サルササポゲニンとスミラゲニンが、インビトロで、ピコ分子及びナノ分子濃度で活性であることを示した。これらは、インビトロでの高濃度神経栄養因子に見られる毒性を示していない。
【0390】
本出願の証拠は、ここで引用されている引用例にすでに公開されている証拠と共に、例えばBDNF及び/又はGDNFなどのNFsの自己制御恒常性の誘発が、制限された対処できる副作用で、A/B−cisフロスタン、フロステン、スピロスタンとスピロステンステロイド性サポゲニン及びこのエステル、エーテル、ケトン及びグリコシル化型から選択された、有効量の少なくとも一の薬剤を対象に投与して達成されること、及び、神経症状、精神症状、炎症、アレルギー症状、免疫症状、腫瘍症状、及び関連する症状などのNF介在障害及び症状を治療及び予防する様々な治療及び非治療方法において、新規な予期しない利点を提供すること、を示している。
【0391】
上記は、限定することなく本発明の広く述べている。この分野の当業者に明らかなように、変形例や変更例は、特許請求の範囲に規定されている発明の範囲に含まれることを意図している。
【技術分野】
【0001】
本発明は、神経栄養因子介在疾患の治療及び予防に関するものであり、特に、神経疾患、精神疾患、炎症性疾患、アレルギー性疾患、免疫疾患、及び腫瘍性疾患、及び、損傷を受けたあるいは異常な組織内のあるいはこれに関連するニューロン機能及びその他の機能の回復あるいは正常化に関し、組織(例えば、皮膚、骨、目、及び筋肉)治癒と、通常の皮膚、骨、目及び筋肉の健康を支援する場合を含み、非治療的方法、及び、この方法に使用する化合物及び組成物に関する。
【背景技術】
【0002】
天然の神経栄養因子(NFs)には、ニューロトロフィン、形質転換増殖因子βスーパーファミリー、NFs及びニューロカインがあり、例えば、神経成長因子(NGF)、脳由来神経栄養因子(BDNF)、毛様神経栄養因子(CNTF)、ニューロトロフィン3(NT−3)、ニューロトロフィン4(NT−4)、及び神経膠細胞由来神経栄養因子(GDNF)がある。神経栄養因子は、神経栄養因子受容体(NFrs)として知られている細胞受容体に結合する。NFr TrkAは、NGFの効果を介在する。NFr TrkBは、BDNF、NT−3、及びNT−4によって活性化される。NFr TrkCは、NT−3によって活性化される。NFr低親和性NGF受容体(LNGFR又はp57)は、ニューロトロフィンファミリーのすべての員に結合する。GDNF用のNFrは、GDNF結合ドメイン(GDNF受容体α1(GRFα1))と、その受容体チロシン成分Ret.の二つの成分からなる。GDNFのGFRα1への結合は、Ret.を活性化する。
【0003】
天然のNFsの異常発現は、様々な疾患に関連しており、小分子非ペプチド治療薬の想定されるNF様活性あるいはNF活性化活動に基づいて、治療が考案されている。原理的には、小分子非ペプチド治療薬(非ポリペプチド及び非たんぱく質を含む)治療薬は、ペプチドに比較して、一般的に低コストであること、比較的製造が容易であること、取扱いと保存が容易であること、固有の毒性が低いこと、患者、特に脳への送達が比較的容易であること、研究開発段階における最適化が比較的容易であること、を含めてペプチド薬剤を超える様々な利点がある。ペプチドNFs、NF模倣体、及びNFエンハンサに潜在的な薬剤として相当の関心があるにもかかわらず、これらの固有の開発上の困難性、潜在的な毒性、及びその他の問題が見つかり、これらの可能性を大きく制限している。
【0004】
数々の低分子非ペプチドが、ある種の神経疾患や精神疾患の治療用に提案されている。以下の段落は、いくつかの公開された文献に注目している。しかしながら、これらの従来の提案はすべて、その薬剤の実質的な副作用によって特徴づけられており、この副作用が有効投与量の投与を妨げているため、すべてのケースにおいて、この化合物を開発して、神経疾患及び精神疾患の治療あるいは予防する市販薬を提供することができない。
【0005】
例えば、キサリプロデン(サノフィ・アベンティス社)(1−(2−naphthalen−2−ylethyl)−4−[3−(trifluoromethyl)pheny1]−3,6−dihydro−2H−pyridine hydrochloride;塩のMW:417.5;遊離塩基のMW:381))、セロトニン5−HT1A受容体アゴニストが後に発見され、これもある程度NGFを活性化する。キサリプロデンは、筋萎縮性側索硬化症(ALS)の潜在的な治療として段階IIIの治験を完了したと報告されており(Drugs RD.2003,4(6),pp.386−388)、最近では、アルツハイマー病への可能性があるとして段階IIIで評価を受けている。しかしながら、5−HT1Aアゴニスト活性が、投与量依存型副作用を生じさせ、これがキサリプロデンの医薬としての使用を制限している。
【0006】
4−メチルカテコール(MW124)は、ニューロトロフィン合成を刺激し、従って、理論的には、神経変性の治療へのアプローチを提供する旨が報告されている。(Fukukawa et al,Advances in Behavioral Biology,2002,53,pp.233−236)。しかしながら、この薬剤は、おそらく神経成長因子(NGF)の発現を過剰に刺激することにより、毒性のある副作用を生じることがわかっている。
【0007】
レチノイン酸は、NGFの血清と神経レベルを上げて糖尿病マウスの神経疾患を防止することがわかっており(Arrieta et al.,European Journal of Clinical Investigation,2005,35.Pp.201−207)、及び、神経変性疾患において可能性のある治療的役割を有することが提言されている(Mey and McCaffery,The Neuroscientist,2004,10,pp.409−420)。しかしながら、この薬剤は、深刻な容量制限毒性副作用があることが知られている。
【0008】
AMPA受容体増強剤(AMPAkines)は、グルタミン酸受容体修飾因子であり、インビボでBDNF発現を強化することを示している(Mackowiak et al.,Neuropharmacology,2002,43,pp.1−10)。更に、二つのAMPAkines(CX614とCX546)は、AMPAkinesの連続的露出にも関わらず、BDNF mRNAレベルを、投与後6−12時間まで最大限に上げて、次いで、投与後48時間まではほぼ対照レベルに下がることを示している(Lauterborn et al.,Journal of Pharmacology and Experimental Therapeutics,2003,307,pp.297−305)。いくつかのAMPAkinesは神経性疾患のために、開発された、あるいは、現在開発されている(Price et a.,Pharmacology and Therapeutics,2007,115,pp.292−306)。しかしながら、これらの薬剤の少なくともいくつかは毒性副作用がある。
【0009】
セロトニン選択的再取り込み阻害薬(SSRIs)やモノアミン酸化酵素阻害薬(MAOIs)としての一次作用を有するものを含む、ある種の抗鬱剤も、インビボでBDNF mRNAレベルを上げることが示されている(Malberg and blendy,Trends in Pharmacological Sciences,2005,26,pp.631−638;Martinez−Turrillas et al.,Neuropharmacology,2005,49,pp.1178−1188)。また、“Neurotrophic effects of antidepressant drugs”by,Castren,Current Opinion in Pharmacology,2004,4,pp.58−64も参照されたい。しかしながら、これらの薬剤はすべて、多くの望ましくない副作用を有することが良く知られている。
【0010】
イムノフィリンは、あるクラスの免疫抑制剤であり、神経栄養因子の活性を高めることが示されている(Price et al.,Pharmacology and Therapeutics,2007,115,pp.292−306)。FK506(タクロリムス)は、インビボで、BDNF mRNAレベルを高めること(Zawadzka and Kaminska,Molecular and Cellular Neuroscience,2003,22,pp.202−209)、及び、BDNFとGDNFたんぱく質レベルを高めること(Tanaka et al.,Brain Research,2003,970,pp.250−253)が示されている。しかしながら、このクラス全体が、重大な容量制限毒性副作用があることが知られている。
【0011】
GFR*−1受容体アゴニストであるN4−(7−クロロ−2−[(E)−2−クロロ−フェニル−ビニル)]−キノリン−4−イル)−N,N’−ジエチル−ペンタン−1,4−ジオン(XIP4035)は、濃度依存態様で神経突起伸長を促進すると報告されている(Tokugawa et al.Neurochemistry International,42,1,January 2003,pp.81−86)。しかしながら、この分子は、容量制限毒性副作用が多すぎる。
【0012】
従って、これらの公知の小分子薬剤は、NF様効果あるいはNF活性化効果をいくらか有しているが、前臨床モデル、あるいは臨床モデルにおいて、容量依存性副作用を有する。この副作用は、通常、明らかな毒性が自体に現れる。このことが、治療におけるこの薬剤の潜在的な利用を大きく制限している。
【0013】
神経疾患及び精神疾患のための、改良された、特に非毒性の、小分子非ペプチド生物活性薬剤の開発が一般的に必要とされている。
【0014】
WO−A−99/16786、WO−A−99/48482、WO−A−99/48507、WO−A−01/23407、WO−A−01/23408、WO−A−02/079221、WO−A−03/082893、WO−A−2005/105108、WO−A−2005/105825、及びWO−A−2006/048665は、その開示がここに引用によって組み込まれており、認知機能障害及びある種のその他の神経疾患及び精神疾患の治療におけるある種の小分子ステロイドの使用に関する。一般的に、これらの活性薬剤は、A/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型である。「サポゲニン」の表現は、例えば、前記サポゲニンの疑似サポゲニン型とジヒドロ疑似サポゲニンといった、E及びF開環誘導体をすべて含むと解される。この化合物の不飽和型では、一又はそれ以上の二重結合が、A/B−cisモチーフに影響しない位置に存在する。
【0015】
WO−A−03/082893、第25頁、第5行乃至18行には、少なくともいくつかの化合物が、有害な細胞体の変化と神経突起の委縮を逆転させる、神経栄養因子、TGF−β−スーパーファミリーNFs及び、ニューロカインなどのNFsの放出を低減する、及び、神経毒性と神経細胞アポトーシスを低減することを含む、ある種の神経変性を遅らせる又は逆転させることが分かっていると、報告されている。この記載は、また、神経防護作用と受容体喪失効果の逆転が能動的に調整された効果であり、過去の劣化が、連続的な劣化に対して防護することで正常な状態あるいは若い状態に戻ることが報告されている。
【0016】
同じ文献の第26頁、第8乃至15行には、更に、活性剤の一生理作用が、NFs又はその受容体の合成又は放出を増やす能力、あるいは、劣化率を低減する能力であると考えられると、報告されている。成長因子についてのこれらの効果は、「細胞質受容体あるいは核内受容体上の化合物の効果、あるいは成長因子のmRNA生成率についての直接的な当然の効果を用いて化合物を促進剤領域に結合させる効果、あるいは別の重要な要素の生成を増やすことによって生じた結果としての効果によるかもしれない」と、理論づけている。
【0017】
同じ文献の第20頁、第4行以降は、自閉症症候群、鬱病、及び統合失調症の精神疾患を治療するこの活性薬剤の使用について述べている。
【0018】
Zhang Y,et al,FEBS Letters,19 March 2008,582,Issue 6,pp.956−960は、ここに引用により組み込まれているが、スミラゲニンは、1−メチル−4−フェニルピリジニウム(MPP+)によって損傷したラットの中脳ドーパミン神経細胞中のGDNF mRNA発現を、培地におけるGDNFの容量と同様に増加させるように見えると報告している。また、スミラゲニンは、これらのニューロン中のMPP+が誘発する神経損傷及び委縮を防止するように見えるとも報告している。この刊行物は、本発明者のものであり、指定国すべてにおいて従来技術ではない。
【0019】
免疫システムの恒常性におけるNFsの役割は、近年の多くの研究主題であった(例えば、Vega,J A et al,J.Anat.2003,203,pp.1−19、及びここにあげた引用例を参照。これらはすべて引用によりここに組み込まれている)。Vega et alの刊行物により詳細に説明されており、第8頁の表2に要約されているように、NFsは免疫システム、特に、B−リンパ球、T−リンパ球、単核白血球/マクロファージ、好中球、好酸球、好塩基球、マスト細胞及び造血細胞、並びに血小板及び脈管組織に関係している様々な細胞に関連する様々な活性を有することが示されている。NFsの恒常性調整は、免疫システム疾患治療あるいは予防に関する価値のある技術を提供する。
【0020】
炎症や炎症性疾患、及びアレルギィにおけるNFsの役割も、多くの注目を集めている。炎症やアレルギィ反応の間、並びに免疫システムに疾患がある場合は、NFGレベルが上がることが知られている(Stanisz,AM & Stanisz,JA,Ann.N.Y Acad.Sci.,2000,917,pp.268−272;Oten,U et al,Ann.N.Y Acad.Sci.,2000,917,pp.322−330;Vega et alの第10頁、第2欄、及び第11頁、第1欄と第2欄に挙げられた引例も参照)。NFsの恒常性調整は、炎症や炎症性疾患及びアレルギィ反応の治療あるいは予防に関する価値のある技術を提供する。
【0021】
良く知られているように、炎症反応、アレルギィ反応、及び免疫反応は、例えば、自己免疫疾患や、毒性、パラサイト、及びその他の感染体による課題に応答して、同時に、相関して生じることがある。NFsの恒常性調整は、これらの症状の治療あるいは予防に関する価値のある技術を提供する。
【0022】
NGFは、血管炎誘発性関節リュウマチに有益な効果を有することが示されており(Tuveri,M.et al,Lancet,2000 Nov.18,356,pages 1739−1740;Aloe,L.,arch.Physiol.Biochem.,2001,109,pages 354−356)、アレルギィ性又は炎症性プロセスにおけるNF過剰発現の阻害における新しい治療的戦略と考えられていることが報告されている(上述のVega et al publication,page 12,column 1)。神経疾患に関する上記に説明した理由によって、NGFたんぱく質の使用は、小分子の使用より要望が少ない。NF過剰発現調整用小分子薬剤は、非常に望ましいであろう。
【0023】
WO−A−01/64247は、その開示がここに引用によって組み込まれており、癌細胞表面、特にtrk+癌細胞におけるNF受容体の発現によって特徴づけられる腫瘍性疾患(癌)の治療あるいは予防方法を記載している。この方法は、例えば、抗NF抗体、抗NFアンチセンスポリヌクレオチド、あるいは抗NFtrk突然変異体など、有効量の抗NF薬剤(この文献では、抗神経栄養因子、あるいは、抗NT薬剤と呼ばれている)を投与するステップを含む。胸、甲状腺、大腸、肺、子宮、皮膚、筋肉、膵臓、前立腺、腎臓、生殖器官、血液、免疫システム組織(例えば、脾臓、胸線、骨髄)、脳及び末端神経系組織、を含む様々な癌をこの方法で治療あるいは予防できることが記載されている。この薬剤のNFsへの非常に特別な結合を介する動作モードが記載されており、活性化NF配位子を中性化することによるtrk受容体の抑制につながっている(第5頁、第8乃至10行)。
【0024】
Innominato,P F et al,J.Pathol.,2001,194,pages 95−100は、その内容がここに引用によって組み込まれており、メラノーマ細胞表面上のNFsとNF受容体の発現について述べている。従って、皮膚癌細胞、特にメラノーマ細胞は、NF受容体陽性癌細胞の上記リストに含まれる。
【0025】
神経疾患に関する上記に説明した理由で、抗体、ポリヌクレオチド及び抗NF受容体突然変異たんぱく質の使用は、小分子の使用より望ましくない(LeSauteur et al,Nature Biotech.,1996,14,page 1120参照)。受容体、すなわち、NFたんぱく質の作用形態に類似するものの結合パートナーの制御を通じて、NFsの恒常性制御に小分子薬剤を使用して癌細胞のtrk受容体を抑制することは、非常に望ましい。
【0026】
本発明は、上述のA/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型が、以下に述べるように、非毒性態様でのNFsの修飾につながり、対象の恒常性制御プロセスを正常なままにしておくという我々の新規発見に基づいている。このように、この薬剤は、わずかな副作用でNFsの恒常性自己制御を誘発する。副作用がある場合は、それに対処することができ、有効量の投与を妨げない。自己制御恒常性を誘発する、本質的に非毒性、非ペプチドである小分子を発見し、使用することにより、不健康状態において、一又はそれ以上のNFsが、副作用を起こすことなく健康な状態に向けて修復(高レベルあるいは低レベルで)されることは、予期しないことで、驚くべきことであり、以下に詳細に説明するように有意な利益を提供する。
【0027】
更に、我々は、この薬剤が、副作用を起こすことなく一以上のNF、例えば、BDNFとGDNFの自己制御恒常性を誘発することを発見した。一の活性薬剤による、副作用を伴うことのない一以上のNFの自己制御恒常性の達成は驚くべきことであり、我々の知識では、あらゆる小分子薬剤において唯一のことである。ニューロンは、最適な神経防護作用と神経修復作用のためには、通常、一以上のNFを必要とすることがわかっているので、本発明によるこの発見は、NF介在疾患とこれに関連する症状の実質的に改善された治療と予防を提供する。
【0028】
NFsが、皮膚、角膜組織、骨及び筋肉を含む組織を治癒する役割を果たしており、一般的に、皮膚、骨、及び筋肉の健康に有益であることも知られている。例えば、Albers,K.M.et al,Neuroscientist 2007,13,pages 317−382;Asaumi,K.,et al.,Bone,26(6),June 2000,pages 625−633;You,L et al.,Investigative Opthalmology &Visual Science,October 2001,42(11),pages 2496−2504;Cruise,B.A.et al.,Developmental Biology,271,(2004),pages 1−10;Jurjus,A.et al.,Burns 33(2007),892−907;Matsuda,H.,etal.,J.Exp.Med.,187(3),2 February 1998,pages 297−306;Menetrey,J et al.,J.Bone Joint Surg Br),82−B(1),January 2000,pages 131−137;Micera,A.,et al.,Cytokine & Growth Factor reviews,18,(2007),pages 245−256;Nithya,M.,et al.,Biochim.Biophys,Acta,1620,(2003),pages 25−31; Matsuda,H et al.,J.Exp.Med.1998,187,pages 297−306;Lambiase et al,Invest.Ophthalmol.Vision Sci.,2000,41,pages 1063−1069参照。これらの刊行物の内容は、ここに引用により組み込まれている。
【0029】
本発明の基本的な発見は、従って、皮膚、骨、筋肉、及び角膜組織などの眼組織を含む組織の治癒と健康に適用することもできる。従って、本発明は、また、損傷を受けたあるいは異常な組織の、あるいはこれに関連する神経機能の修復又は正常化に関するものであり、組織(例えば、皮膚、骨、眼、及び筋肉)治癒の支援及び、運動、労働あるいは消耗からの筋肉や組織の回復、日光への露出、風への露出、雨への露出、寒さへの露出、老化、しわからの皮膚の回復、持久力の改善、疲労感の低減を含む、一般的な皮膚、骨及び筋肉の健康に関する。限定することなく、本発明が支援する組織治癒には、以下により詳細に述べるように、創傷や火傷の治癒が含まれる。
【発明の概要】
【0030】
本発明の第1の態様によれば、対象の天然NFsを恒常性を制御した非毒性態様で制御することによって、対象の神経栄養因子(NFs)の自己制御恒常性を誘発する方法が提供されており、この方法は、対象に、A/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型から選択した一又はそれ以上の有効量の薬剤投与するステップを具える。対象の天然NFsは、BDNFとGDNFの一方あるいは両方であっても良い。
【0031】
本発明の第1の態様の方法は、NFsの自己制御恒常性の誘発が、制限された、対処可能な副作用を伴って行われる。
【0032】
本発明の第1の態様の特に好ましい一実施例では、誘発された恒常性が、例えば、BDNFとGDNFなど、対象の二又はそれ以上の天然NFsを共に制御する。
【0033】
本発明の第2の態様によれば、対象の天然NFsを、恒常性を制御した非毒性態様で制御することによって対象のNFsの自己制御恒常性を誘発する、A/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型から選択した薬剤が提供されている。
【0034】
本発明の第2の態様による使用のための薬剤は、NFsの自己制御恒常性の誘発が、制限された対処可能な副作用を伴って生じる薬剤である。
【0035】
本発明の第3の態様によれば、対象の天然NFsを、恒常性を制御した非毒性態様で制御することによって対象のNFsの自己制御恒常性を誘発する、A/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型から選択した薬剤を含む組成物が提供されている。
【0036】
本発明の第3の態様による使用のための組成物は、NFsの自己制御恒常性の誘発が、制限された対処可能な副作用を伴って生じる。
【0037】
本発明の第4の態様によれば、対象の天然NFsを、恒常性を制御した非毒性態様で制御することによって対象のNFsの自己制御恒常性を誘発する薬剤の製造における、A/B−cisフロスタン、フロステン、スピロスタン又はスピロステンステロイドサポゲニン及びエステル、エーテル、ケトン、及びこれらのグリコシル化型から選択した薬剤の使用が提供されている。
【0038】
本発明の第4の態様による使用は、NFsの自己制御恒常性の誘発が、制限された対処可能な副作用又は有害な副作用を伴って生じる。
【0039】
本発明は、有害な副作用、特に、例えば、NGFなどのNFsの過剰誘発、過剰刺激あるいは過剰増強に関連する副作用、受容体アゴニスト(アンタゴニスト)作用に関連する副作用、及び酵素結合作用に関連する副作用を制限する。
【0040】
本発明は、NFs介在疾患、特に、神経性疾患、精神性疾患、炎症性疾患、アレルギィ性疾患、免疫疾患、及び腫瘍性疾患の治療方法と共に使用され、ヒト及び非ヒト動物の対象における、組織(例えば、皮膚、骨、眼、及び筋肉)治癒の支援及び、一般的な皮膚、骨、眼及び筋肉の健康、及び非治療的方法に関連する場合を含めて、損傷を受けたあるいは異常な組織中の、あるいはこの組織に関連する神経作用及びその他の作用の修復又は正常化に使用することができる。
【0041】
ここで用いられている用語「NF介在」とは、一般的な意味に解するべきであり、神経栄養因子が、疾患あるいは症状の進展、進行、あるいは効果に寄与する役割を果たしていると理解される場合の疾患及び症状を含む。従って、例えば、現在の兆候がNF受容体、そのアゴニスト(アンタゴニスト)、あるいはNFsのその他の活性化因子又は抑制因子に関係している疾患あるいは症状は、本発明の「NF介在」疾患又は症状であると解するべきである。このような疾患及び症状は、本発明によるヒト又は非ヒト動物対象の天然NFsの恒常性制御に応答することが予期される。
【0042】
このように、本発明は、例えば、けがによって、血液不足によって、老化によって、あるいは(皮膚の場合は)しわによって、あるいは日光、風、雨、冷気にさらすことによって、あるいはその他の障害媒体によって損傷を受けた組織(脳組織、あるいは、皮膚、骨、眼、及び筋肉などのその他の組織にかかわらず)内の、あらゆる損傷を受けた組織あるいは異常組織の、神経機能及びその他の機能回復と併用して用いることができる。本発明による正常な神経機能の回復は、通常、神経再生と、血流の改善、並びに、中枢神経系(CNS)又は末梢神経系(PNS)における炎症などの神経疾患の症状の正常化あるいはニューロンの異常、につながるNFsの自己制御恒常性の誘発によって達成される。
【0043】
このように、本発明は、創傷治癒の支援と共に使用することができ、特に、ヒト及びその他の哺乳動物の皮膚創傷治癒の速度と質を向上させることができる。このコンテキストにおいて、「創傷」は、例えば、切り傷、擦り傷、ナイフによる傷、外科的外傷、あざ、やけど、潰瘍、痛みなどの損傷といった、あらゆる器官のすべての損傷を含む。慢性及び急性の両創傷を本発明によって治療することができる。
【0044】
本発明は、胎児細胞、幹細胞あるいはその他の細胞治療や、組織移植と共に、特に、移植した材料の生存、あるいは治療の効果、あるいはこの両方を改善するために使用することができる。例には、脳又は身体のその他の器官の機能を改善する細胞治療が含まれる。
【0045】
更に、本発明は、皮膚、骨、眼、及び筋肉などの組織の健康状態を促進するあるいは支援する非治療的方法に使用することができ、このような組織におけるNFsの自己制御恒常性の利益によって、運動、労働あるいは消耗からの筋肉と組織の回復を促進し、老化現象、しわ、あるいは日光、風、雨、冷気、あるいはその他の損傷を与える媒体への露出からの皮膚の回復を促進し、持久力と筋肉の耐久性(例えば、競技スポーツ又は非競技スポーツにおいて)を改善し、疲労感を低減する。
【0046】
本発明によれば、薬剤を作用部位に送達することが一般的に良いことが分かっているので、薬剤を全身あるいは局所的に投与することができる。特に、以下により詳細に述べるように、限定することなく、経口及び非経口(例えば、局所)投与ルートが適していることがわかっている。
【0047】
ここで用いている「サポゲニン」の表現は、例えば、上述のサポゲニンの疑似サポゲニン及びジヒドロ疑似サポゲニン型といった、E及び/又はF開環誘導体をすべて含み、この型はこのような誘導体の支配を受ける。この化合物の不飽和型では、一又はそれ以上の二重結合が、A/Bcisモチーフに影響しない位置に存在する。サポゲニンのグリコシル化型は、通常、サポニンと呼ばれている。
【0048】
発明の詳細な説明
序論
本明細書に提示されている証拠は、この薬剤が様々な受容体と酵素に結合していないことを示している(実施例1参照)。
【0049】
NFs又はNF受容体の導入に関する活性薬剤の効果を立証する証拠が、本出願に提示されている。この証拠は(以下の実施例2及び3を参照)、その活性が、NFsとNF受容体の強化型遺伝子発現を伴うことを示す。ニューロンが比較的健康である(基本培地)例2に見られるように、強化型遺伝子発現は一次的なものであり、その時間スケールは、自己制御機構を伴うことを強く示している。
【0050】
より罹患が進んでいる実施例3では、データが、より長期間の強化型遺伝子発現を示しており、制御機構が無傷で残り、遺伝子発現の強化の度合いがシステムの必要性に依存していることを示す。
【0051】
本出願で提示されている証拠はまた、活性薬剤が、例えば特にBDNFやGDNFといったNFsの自己制御恒常性を提供することを示している(下記の実施例4乃至7及び18参照)。非ペプチド薬剤による、例えばBDNF又はGDNFといった、一のNFの自己制御ノーマライゼーションが非常に優れているのみならず、例えば、非ペプチド薬剤によるBDNFとGDNF両方といった二つのNFsの自己制御ノーマライゼーションも独自である。両NFsを互いにノーマライゼーションすることは、BDNFとGDNFの相乗的ノーマライゼーションに結び付くように見え、これは特に有益である。
【0052】
本出願に提示されている証拠は、活性薬剤が様々なCNS及びPNSニューロンの神経突起生成を増やすことが示されている(実施例8を参照)。重要なことは、この神経突起生成効果は、外因性NFsの存在に依存していないことである。このことは、本発明の薬剤の効果が、NFの強化というよりは、むしろ導入であることを示している。
【0053】
本出願に提示されている証拠は、更に、活性薬剤が、NFsと同じ細胞間形質導入を活性化することを示している(実施例9を参照)。これは、薬剤のNF調節活性の証拠を支持している。
【0054】
本出願に提示されている証拠はまた、様々なA/B−cis活性薬剤が、皮質ニューロンへのグルタミン酸塩で誘発された損傷と、ドーパミン作用性ニューロンのアポトーシスを低減するが、一方で、ほぼ同じ化学構造ではあるが、A/B−cisモチーフを持たないサポゲニン(ジオスゲニン)は、不活性である(実施例10及び11を参照)ことを示している。
【0055】
本出願に提示されている証拠はまた、この薬剤が様々なニューロンの損傷を回復に向かわせる、すなわち、この薬剤は、神経再生薬剤(neurorestorative or neuroregenerative)である(実施例12を参照)。
【0056】
本出願に提示されている証拠はまた、この薬剤が経口投与可能であることを示している(実施例13及び14を参照)。この例は、この薬剤の経口投与が、運動ニューロン疾患あるいは外傷後の神経損傷があるマウスモデルの神経機能の回復を改善することを示している。
【0057】
本出願に提示されている証拠はまた、この薬剤が老化したラットの不安を取り除き、認知を回復することを示している(実施例15を参照)。
【0058】
本出願に提示されている証拠はまた、経口投与した薬剤が、ある範囲の身体組織に送達され(実施例16を参照)、有効投与量において非毒性である(実施例17を参照)ことを示している。
【0059】
本出願に提示されている証拠はまた、この薬剤がマカクのパーキンソン症候群を低減することを示している(実施例18を参照)。
【0060】
本出願に提示されている証拠は、この薬剤のNF又はNF受容体(NFr)を介在する活性が、ある範囲の受容体と酵素との直接結合相互作用を含まないことを示している。例えば、この活性は、エストロゲン、プロステロン、テストステロン、及びセロトニン受容体などのホルモン受容体、ニコチン受容体、ムスカリン性受容体、アドレナリン性受容体、カンナビノイドやアヘン受容体などの麻薬受容体、NMDA、AMPA及びカイナイト受容体などのグルタミン酸受容体、及び、レチノイドX受容体などのレチノイン酸受容体といった、様々な重要な受容体における直接結合アゴニスム、アンタゴニスト、非アゴニスト(非アンタゴニスト)直接結合に関連していない。この結果、この活性薬剤の生理学的効果は、従来の神経疾患や神経障害の治療に見られる多くの受容体介在及び酵素介在副作用と無関係である。例えば、従来の神経疾患及び精神疾患の治療の多くに見られる問題は、中毒と依存性、中毒になりやすい性格型、受容体又は酵素の副作用を持つ従来の治療、及び、中毒又は依存性を発生する現在の治療のいずれもが、神経疾患あるいは精神疾患の治療に禁忌を示すことがあるが、この薬剤によって実質的に低減される。
【0061】
精神疾患の従来の治療は、その生化学モードの作用を即座に発揮するにもかかわらず、より長い時間規模で有益な精神的効果を示している。本発明の効果は、より一層即座にみられ、恒常性制御の下、非毒性態様でNFsを調整する証拠を提供している。従って、本発明は、公知の精神及び神経疾患の小分子(非ペプチド)治療から区別される。
【0062】
これらの実施例の試験におけるこの薬剤の容量反応プロファイルは、自己調整機構の特徴である後に安定状態が続く最大値を示している(図1を参照)。
【0063】
本発明で使用する一又はそれ以上の活性薬剤は、GDNFやBDNFなどの外因性投与神経栄養因子なしで使用することができる。
【0064】
本発明に関連する新規使用
本発明は、従って、例えば(i)治療するべき疾患、(ii)治療する個体のクラス、(iii)使用する治療の組み合わせ、及び(iv)安全な使用状況、という意味で、同定するべき活性薬剤を新規使用することができる。
【0065】
(i)に関する限り、例えば、ある範囲の神経性、精神性、炎症性、アレルギー性、免疫性、及び腫瘍性疾患及び症状、並びに性格特性と行動特性を治療するためのこの活性薬剤の使用、及び、薬剤と機能性食品の双方を介した、ニューロンの再生あるいは正常化、ニューロンへの血流、損傷を受けた組織(例えば、皮膚、骨、眼あるいは筋肉組織)の再成長及び治癒、脳内及び脳外(例えば、皮膚、骨、眼及び筋肉組織)両方の組織の全体的な健康と良好な状態、運動、労働あるいは消耗からの筋肉や組織の回復、持久力の改善、疲労感の低減、正常な神経機能及び正常な神経ネットワークの再生の達成が、以下に詳細に述べるように、現在認識できる。この使用には、集団の正常範囲内にある個体の神経的あるいは精神的機能、あるいは個体の全体的な健康及び満足感を改善するための非治療的使用、例えば老化現象、しわ、あるいは日光への露出、風への露出、雨への露出、寒さへの露出、あるいはその他の損傷を与える媒体への露出からの皮膚の回復を促進する、皮膚、骨、眼、筋肉及びその他の組織の健康を促進するための非治療的使用、及び、運動、労働、あるいは消耗からの筋肉及び組織の回復を含む、健康と良好な状態のその他の態様を提供するための非治療的使用が含まれる。用語「障害」「症状」「特徴」は、これに従って理解される。
【0066】
(ii)に関する限り、多くの受容体又は酵素の調整あるいは結合ではなく、NFs自己制御恒常性を介した本発明の薬剤の作用によって、薬剤又は受容体アゴニスト薬を抑制するある種の酵素からの副作用に敏感な患者が治療を受けることができる。例えば、ある認知症(アルツハイマー)患者は、コリンエステラーゼ抑制剤への耐性がない。あるパーキンソン病患者は、L−ドーパへの耐性がなく、危険負担といった運動障害や神経異常の問題を含む副作用に苦しむ。
【0067】
(iii)に関する限り、例えば、特定の障害、症状、特徴、あるいは特定のクラスの個体の治療に、この薬剤をその他の補助薬剤と組み合わせて使用することは、以下に詳細に述べるとおり、現在は確認可能である。このような多くの組み合わせの認識は、従来はせいぜい推論に過ぎなかった。この使用には、集団の正常範囲内にある個体の神経的あるいは精神的機能、あるいは個体の全体的な健康及び満足感を改善するための非治療的使用、例えば老化現象、しわ、あるいは日光への露出、風への露出、雨への露出、寒さへの露出、あるいはその他の損傷を与える媒体への露出からの皮膚の回復を促進する、皮膚、骨、眼、筋肉及びその他の組織の健康を促進するための非治療的使用、及び、運動、労働、あるいは消耗からの筋肉及び組織の回復を含む、健康と良好な状態のその他の態様を提供するための非治療的使用が含まれる。用語「障害」「症状」「特徴」は、これに従って理解される。
【0068】
(iv)に関する限り、例えば、臨床及び薬学的環境外での新しい範囲の使用状況は、以下により詳細に述べるように、現在認識可能である。
【0069】
新規使用(i)−新しい治療
本発明は、必要に応じて、ヒト又は非ヒト哺乳動物における(a)神経性、精神性、炎症性、アレルギー性、及び腫瘍性疾患の治療及び予防、(b)ニューロン機能又はニューロンネットワークの再生を含む、ニューロン及びニューロンへの血流の再生及び/又は正常化、(c)損傷を受けた組織の再成長及び治癒、(d)運動、労働、あるいは消耗からの筋肉及び組織の回復、(e)持久力の改善と疲労感の低減、(f)異常な行動又は個体的な特徴を治療又は防止する方法に使用することができる。この神経性、精神性、炎症性、アレルギー性、免疫性及び腫瘍性疾患は、上述した従来技術に開示されたものであっても良く、これらの障害と異なるものでも良い。例えば、精神性疾患は、自閉症症候群、鬱病、及び統合失調症であっても良く、あるいは、これら以外の疾患であっても良い。ニューロン及びニューロンへの血流の再生あるいは正常化、ダメージを受けた組織、神経機能、あるいは神経ネットワークの再成長と治癒のための方法には、例えば、神経の外傷後再生、移植組織片、及び神経の術後再生(例えば、四肢や指の再付着)、脳卒中、一過性脳虚血性発作(TIAs)、あるいはその他の虚血組織の回復支援、例えば、神経機能や、虚血組織への血流の回復支援、創傷、骨、及び筋肉の治癒支援、及び、CNS又はPNSに関する神経疾患及び炎症性症状の治療支援が含まれる。
【0070】
本発明は、この活性薬剤の神経防護効作用と神経回復(神経再生)作用の点で、例えば、神経及び精神疾患用、あるいはダメージを受けたあるいは異常な組織又は機能の回復又は正常化のための、胎児細胞、幹細胞、あるいはその他の細胞治療と共に使用することができる。実施例には、脳障害を治療する細胞治療が含まれている。本発明に係る活性薬剤の使用により、例えば、移植した細胞の生存率を上げることによって、この治療における生存細胞の効率を改善することによって、あるいはこれらの組み合わせによって、細胞治療の効果を改善することができる。
【0071】
本発明を、一又はそれ以上のNF又はNFrの異常発現に関連する疾患を患っている、あるいはこの影響を受けているヒト又は非ヒト動物における、このような疾患の治療法に使用することができる。この疾患は、上述した従来技術に開示されている疾患であっても良く、これらの疾患と異なる疾患であっても良い。例えば、神経性疾患は、自閉症、鬱病、及び統合失調症であっても良く、あるいは、これらの障害以外の障害であっても良い。神経あるいは精神疾患、異常行動、あるいは個人の特性以外のこのような障害には、例えば、睡眠不足とストレスの影響、炎症性障害、アレルギー、免疫障害、及び、NF介在の癌が含まれる。
【0072】
上述したように、この出願の証拠は、本発明に使用されている活性薬剤が、脳内のBDNFとGDNFのレベルを同時に正常化あるいは強化することができることを示している。本発明は、従って、これらのNFsの一方あるいは両方の異常なあるいは低下した脳レベルを患っているヒト又は非ヒト動物の脳内のBDNFとGDNFレベルの一方あるいは両方を同時に正常化する方法に使用することができる。
【0073】
本発明は、BDNFやGDNFなどのNFsの自己制御恒常性を誘発する方法を提供する。この方法では、NFsの自己制御恒常性の誘発が、制限され対処可能な副作用を伴って生じる。この出願は、この誘発が、ペプチドNFsやNFrsの存在を必要としないことの証拠を具えている。従って、本発明は、公知の薬剤と対照的に、ペプチドNFsやNFrsを本発明の非ペプチド活性薬剤と同時投与する必要性を排除している。
【0074】
上述の各新規使用は、本発明の各態様と共に使用することができる。
【0075】
本発明を実行する方法は、以下に詳細に述べるように、治療的方法でも、非治療的方法でも良く、この組成物は、薬学的組成物又は非薬学的組成物であっても良い。この活性薬剤は、以下に詳細に説明するように、その他の投与ルートが提供されているが、好ましくは経口投与される。
【0076】
新規使用(ii)−治療可能な個体の新しいクラス
本発明による新しい発見は、少なくとも所定の回数、例えば、睡眠不足又はストレスを受けた人など、一又はそれ以上のNFsあるいはNFrs(例えば、BDNF及び/GDNF)を天然に過剰発現、又は異常発現する人の治療に活性薬剤を使用できることを明らかにしているが、以前はNF様又はNF刺激薬剤によるこのような人の治療は禁忌であった。
【0077】
本発明は、低減した又は異常なNF又はNFrレベルに伴う疾患又は症状に罹っている又は罹りやすくなっている、一又はそれ以上のNFs又はNFrsの天然な過剰発現、又は異常発現に敏感なヒト又は非ヒト動物における、このような障害又は症状を治療又は予防する方法に使用することができる。
【0078】
本発明の新しい発見はまた、この活性薬剤を用いて、NF様又はNF刺激薬剤の精神的副作用に敏感な人を治療することができることを明らかにしており、これらの副作用は、典型的には、精神的、気分、不安、あるいはその他の個性、あるいは行動上の症状であり、以前は、これらの人に対してNF様又は刺激薬剤による治療は禁忌であった。
【0079】
本発明の薬剤が多くの受容体又は酵素への調整あるいは結合ではなく、NFsの自己制御恒常性を介して作用することの発見によって、薬剤あるいは受容体アゴニスト薬剤を抑制するある種の酵素からくる副作用に敏感な患者を治療することが可能となる。例えば、ある認知症(アルツハイマー)患者は、コリンエステラーゼ抑制剤への耐性がない。あるパーキンソン病患者は、L−ドーパに耐性がなく、危険負担といった、運動障害あるいは神経精神病の問題を含む副作用に苦しむであろう。
【0080】
本発明は、低減した又は異常なNF又はNFrレベルに伴う障害又は症状に罹っている又は罹りやすくなっているヒト又は非ヒト動物におけるこのような障害又は症状を治療する又は予防する方法に使用することができ、このヒト又は動物は、NF様又は刺激薬剤の精神医学的あるいはその他の副作用に敏感な人である。
【0081】
低減した又は異常なNF又はNFrレベルに伴う障害又は症状には、例えば、神経性、精神性、炎症性、アレルギー性、免疫性、及び腫瘍性疾患、又は、以下に詳細に説明する、異常行動又は個体的特徴が含まれる。更に、この障害及び症状には、以下に述べる皮膚、筋肉、眼及び骨の障害及び症状が含まれ、これには、組織の良好な状態と健康に関連する症状や、筋肉やその他の組織の疲労の症状が含まれる。
【0082】
本発明の新しい発見によれば、また、ある範囲のホルモン受容体やその他の受容体に対するアゴニスト(アンタゴニスト)能力あるいは結合能力を有さず、ある範囲の酵素に対する酵素結合能力を有さないこの活性薬剤を用いて、薬剤の受容体介在又は酵素介在副作用に敏感な人を治療することができる。このような人には、例えば、中毒あるいは依存性を有し、この中毒あるいは依存性に影響される受容体におけるアゴニスト(アンタゴニスト)効果によって悪化することがある人;中毒又は依存症から引き離す治療あるいは自己治療を行っている人であり、同じ理由で、中毒あるいは依存性に影響される受容体におけるアゴニスト(アンタゴニスト)効果によって引き離すプロセスが後退してしまうことがある人;例えば受容体又は酵素結合におけるアゴニスト(アンタゴニスト)又は結合に特に敏感なある種の受容体又は代謝プロセスを有する、中毒性又は依存性のある性格型を有する人;が含まれる。更に、受容体介在又は酵素介在副作用に対するぜい弱性は、例えば、ホルモン治療(例えば、治療におけるホルモン治療、成長ホルモン治療、甲状腺ホルモン治療、女性ホルモン補充治療(HRT)、あるいは性別適合治療)を行っている人など、受容体介在又は酵素介在副作用によって干渉されるその他の臨床症状の治療を受けている人に生じる。
【0083】
従って、本発明は、低減したNF又はNFrレベルに伴う疾患又は症状に罹っている又は罹りやすくなっているヒト又は非ヒト動物におけるこのような疾患又は症状を治療する又は予防する方法に使用することができ、このヒト又は動物は、薬剤の受容体介在又は酵素介在副作用に敏感な人である。
【0084】
受容体(又は結合部位)介在副作用に対する人の感受性に関連する受容体又は結合部位は、以下の受容体の一又はそれ以上を含む:アデンソニン(adensonine)A1受容体;アデンソニンA2A受容体;アデンソニンA3受容体;アドレナリン性α1A受容体、アドレナリン性α1B受容体、又はアドレナリン性α1D受容体を含む非選択的アドレナリン性α1受容体;アドレナリン性α2A受容体、アドレナリン性α2C受容体、又はアドレナリン性α2D受容体を含む非選択的アドレナリン性α2受容体;アドレナリン性β1受容体、アドレナリン性β2受容体、又はアドレナリン性β3受容体を含む非選択的アドレナリン性β受容体;アドレノメズリンAM1受容体;アドレノメズリンAM2受容体;アルドステロン受容体;アナフィラトキシンC5a受容体;アンドロゲン(テストステロン)受容体AR;アンジオテンシンAT1受容体、アンジオテンシンAT2受容体;アペリン(APJ)受容体;心房性ナトリウム利尿因子受容体;ボンベシンBB1受容体;ボンベシンBB2受容体;ボンベシンBB3受容体;ブラジキニンB1受容体;ブラジキニンB2受容体;カルシトニン受容体;カルシトニン遺伝子関連ペプチド(CGRP1)受容体;ベンゾチアゼピンL−型カルシウムチャネル;ジヒドロピリジンL−型カルシウムチャネル;フェニルアルキルアミンL−型チャネル;カルシウムチャネルN−型;カンナビノイドCB1受容体;カンナビノイドCB2受容体;ケモキンCCR1受容体;ケモキンCCR2B受容体;ケモキンCCR4受容体;ケモキンCCR5受容体;ケモキンCXCR1受容体;ケモキンCXCR1(IL−8RB)受容体;コレシストキニンCCK1(CCKA)受容体;コレシストキニンCCK2(CCKB)受容体;コルチシン受容体;コルチコトロピン放出因子(CRF1)受容体;ドーパミンD1受容体;ドーパミンD2S受容体;ドーパミンD3受容体;ドーパミンD4.2受容体;ドーパミンD5受容体;エンドセリンETA受容体;エンドセリンETB受容体;上皮成長因子(EGF)受容体;エリスロポエチンEPOR受容体;エストロゲン受容体;エストロゲン(ERα)受容体;エストロゲン(ERβ)受容体;Gタンパク結合受容体GPR103;Gタンパク結合受容体GPR8;GABAA受容体;TBOB塩素チャネルGABAA受容体;中央フルニトラゼパムGABAA受容体;中央ムシモールGABAA受容体;GABAB1A受容体;GABAB1B受容体;ガバペンチン受容体;ガラニンGAL1受容体;ガラニンGAL2受容体;グルココルチコイド受容体;グルタミン酸受容体;AMPAグルタミン酸受容体;カイニン酸グルタミン酸受容体;アゴニスムNMDAグルタミン酸受容体;グリシンNMDAグルタミン酸受容体;フェンシクリジンNMDAグルタミン酸受容体;ポリアミンNMDAグルタミン酸受容体;成長ホルモン分泌促進物(GHS、グレリン)受容体;ヒスタミンH1受容体;ヒスタミンH2受容体;ヒスタミンH3受容体、ヒスタミンH4受容体;中央イミダゾリンI2受容体;イノシトール三リン酸IP3受容体;インスリン受容体;インターロイキンIL−1受容体;インターロイキンIL−2受容体;インターロイキンIL−6受容体;レプチン受容体;BLTロイコトリエン(LTB4)受容体;システイニルロイコトリエンCysLT1受容体;システイニルロイコトリエンCysLT2受容体;メラノコルチンMC1受容体;メラノコルチンMC3受容体;メラノコルチンMC4受容体;メラノコルチンMC5受容体;メラトニンMT1受容体;メラトニンMT2受容体;モトリン受容体;ムスカリン性M1受容体;ムスカリン性M2受容体;ムスカリン性M3受容体;ムスカリン性M4受容体;ムスカリン性M5受容体;N−ホルミルペプチド受容体FPR1;N−ホルミルペプチド受容体様FPR1受容体;ノイロメジンU MNU1受容体;ノイロメジンU MNU2受容体;神経ペプチドY Y1受容体;神経ペプチドY Y2受容体;ニューロテンシンNT1受容体;ニコチン性アセチルコリン受容体;ニコチン性アセチルコリンα1、ブンガロトキシン受容体;ニコチン性アセチルコリンα7、ブンガロトキシン受容体;アヘンδ(OP1,DOP)受容体;アヘンκ(OP2,KOP)受容体;アヘンμ(OP3,MOP)受容体;オルファニンORL1受容体;ホルボールエステル受容体;血小板活性化因子(PAF)受容体;血小板由来成長因子(PDGF)受容体;カリウムチャネル[KA];カリウムチャネル[KATP];カリウムチャネル[SKCA];カリウムチャネルHERG;プロゲステロン受容体;プロゲステロンPR−B受容体;プロスタノイドCRTH2受容体;プロスタノイドDP受容体;プロスタノイドEP2受容体;プロスタノイドEP4受容体;プロスタノイドトロンボキサンA2(TP)受容体;プリン作動性P2X受容体;プリン作動性P2Y受容体;レタノイドX受容体RXRα;ロリプラム受容体;リアノジンRyR3受容体;セロトニン5−ヒドロキシトリプタミン5−HT1受容体;5−ヒドロキシトリプタミン5−HT1A受容体;5−ヒドロキシトリプタミン5−HT1B受容体;5−ヒドロキシトリプタミン5−HT2B受容体;5−ヒドロキシトリプタミン5−HT2C受容体;5−ヒドロキシトリプタミン5−HT3受容体;5−ヒドロキシトリプタミン5−HT4受容体;5−ヒドロキシトリプタミン5−HT5A受容体;5−ヒドロキシトリプタミン5−HT6受容体;シグマσ1受容体;シグマσ2受容体;部位2ナトリウムチャネル受容体;ソマトスタチンsst1受容体;ソマトスタチンsst2受容体;ソマトスタチンsst3受容体;ソマトスタチンsst4受容体;ソマトスタチンsst5受容体;タキキニンNK1受容体;タキキニンNK2受容体;タキキニンNK3受容体;テストステロン受容体;甲状腺ホルモン受容体;チロトロピン遊離ホルモン(TRH)受容体;形質転換成長因子−β(TGF−β)受容体;アデノシン輸送体;コリン輸送体;ドーパミン輸送体(DAT);GABA輸送体;モノアミン輸送体;ノルエピネフィリン輸送体(NET);5−ヒドロキシトリプタミン輸送体(SERT);非選択的腫瘍壊死因子(TNF)受容体;ノイロテンシンII受容体;バニロイド受容体;血管内皮成長因子(VEGF)受容体;血管活性腸管ペプチドVIP1受容体;バソプレッシンV1A受容体;バソプレッシンV1B受容体;バソプレッシンV2受容体;及びビタミンD3受容体。
【0085】
副作用に対する人の感受性に関連する酵素には、以下の酵素の一又はそれ以上が含まれる:アセチルコリンステラーゼ;アセチルCoA合成酵素;コリン・アセチルトランスフェラーゼ;たんぱく質・セリン/スレオニン・キナーゼAKT1(PRKBA);たんぱく質・セリン/スレオニン・キナーゼAKT3(PRKBG);たんぱく質・セリン/スレオニン・キナーゼCAMK2D(KCC2D);たんぱく質・セリン/スレオニン・キナーゼMAP2K1(MEK1);たんぱく質・セリン/スレオニン・キナーゼMAPK1(ERK1);たんぱく質・セリン/スレオニン・キナーゼMAPK11(p38β);たんぱく質・セリン/スレオニン・キナーゼMAPK12(p38γ);たんぱく質・セリン/スレオニン・キナーゼMAPK13(p38δ);たんぱく質・セリン/スレオニン・キナーゼMAPK3(ERK1);たんぱく質・セリン/スレオニン・キナーゼMAPK8(JNK1);非選択的たんぱく質・セリン/スレオニン・キナーゼPKC;たんぱく質・セリン・キナーゼNTRK1(trkA);たんぱく質・セリン・キナーゼNTRK2(trkB);たんぱく質・セリン・キナーゼSRC;アルドースレアクターゼ;ABTSラジカルフリー・ラジカルスカベンジャー酵素;DPPHラジカルフリー・ラジカルスカベンジャー酵素;SOD模倣薬フリー・ラジカルスカベンジャー酵素;及びUDPグルクノシルトランスフェラーゼUGT1A1。
【0086】
従って、本発明は、この薬剤の受容体介在及び酵素介在活性から生じる副作用を起こすことなく、あるいは、少なくともこのような副作用が生じるリスクを実質的に低減して、初めてこのような個体に小分子治療薬を使用可能にする。
【0087】
エストロゲン、アンドロゲン、プロゲステロン、グルココルチコイド、及びテストステロン受容体におけるある種のA/B−cisスピロスタンサポゲニンとサポニンの不活性は、これまでに、WO−A−99/48507、WO−A−99/48482、WO−A−01/23406、WO−A−01/23407、WO−A−01/23408、WO−A−01/49703において公開されている。ムスカリン性受容体における同じ薬剤の不活性/非結合性は、数が増えたムスカリン性受容体の合成の証拠が提示されているにもかかわらず、示されていなかった。ムスカリン性及びアドレナリン性β2受容体の数の正常化の証拠は、容量依存性あるいは活性/結合性に関連する証拠なしで、WO−A−02/079221及びWO−A−03/082893に提示されている。
【0088】
ある種のA/B−cisフルスタンサポニン、ティモサポニンBIIによるニコチン性受容体の数の容量依存性強化の証拠は、以前に、WO−A−99/16786(EP−A−1024146;US−A−6593301)に公開されている。これらの受容体におけるこの薬剤の活性/結合性の程度は明らかに測定されていない。ここに提示されている更なる証拠は、従来技術に報告されている効果は、NFs及び/又はその受容体の合成あるいは放出の定期的な増加、及び/又は分解速度の減少から生じたものであることを示している。
【0089】
本発明は、上述の一又はそれ以上の受容体と酵素に関連する受容体介在又は酵素介在の副作用を誘発することなく、必要に応じてヒト又は非ヒトにおける神経変性を治療又は予防する方法に使用することができる。
【0090】
以下により詳細に説明するように、この方法は、治療的あるいは非治療的なものであっても良く、この組成物は、薬学的あるいは非薬学的組成物であっても良い。例えば、非治療的使用は、集団の正常範囲にある個体の神経的あるいは精神的機能を改善するものであっても良い。用語「疾患」「症状」「特徴」は、これに従って理解される。以下に詳細に説明するように、他の投与ルートが提供されてはいるが、この活性薬剤は経口投与することが好ましい。
【0091】
新規使用(iii)−薬剤の新規組み合わせ
本発明の活性薬剤は、対象に異常レベルのNF又はNFrを引き起こすことが公知の、あるいはその疑いがあるとされている(すなわち、異常に低い又は異常に高いレベル)その他の活性薬剤と組み合わせて使用することができ、あるいは、このような異常レベルを引き起こす可能性が知られていない、あるいは疑われていない、又はいまだ試験されていない一又はそれ以上のその他の生物学的活性薬剤を用いた予防ベースで使用することができる。このようなその他の生物学的活性薬剤には、薬剤、タンパク質又はポリ核酸(例えば、抗体、F(ab)又はF(ab)2フラグメントなどの抗体フラグメント、siRNA、あるいはアンチセンスDNA)を抑制する特定の結合材、及び幹細胞などの活性組織といった、活性化学物質が含まれる。
【0092】
このように、本発明による薬剤は、その他の生物学的活性薬剤の起こり得る副作用に対抗するように使用することができる。
【0093】
本発明は、ある種の患者の疾患又は症状を治療するあるいは予防するために、ヒト又は非ヒト動物の対象に投与する組成物又は組成物のセット(配列群)に使用することができ、この組成物又は組成物セットは、この疾患又は症状を治療又は予防し、この対象に異常レベルのNF又はNFrを引き起こす可能性を有する第1の生物活性剤を具えており、対象に誘発されたこのような異常NF又はNFrレベルに自己調整態様で対抗する本発明の活性薬剤は、これによって対象において前記異常NF又はNFrレベルに対抗し、好ましくは、正常なNF又はNFrレベルに向ける傾向にある。
【0094】
新規使用(iv)−新規使用状況
本発明は、投与プロトコルの綿密な臨床制御が得られない又は実行できない状況において使用することができる。
【0095】
過剰投与に対する自己制御治療の抵抗及びその応答の時間延長特性は例えば、自己投与又は非治療的投与といった、比較的制御されていない状況の活性薬剤の好ましい投与に結び付く。本発明による自己調整治療方法のプロトコルは、対応する従来技術の治療に比べてより広い範囲で有効である。
【0096】
本発明を使用するいずれの方法も、従って、特に、自己投与又は非治療的投与の状況における投与プロトコルの臨床制御がなされていない状況に適用することができる。
【0097】
本発明のいずれの態様も、本発明の一又はそれ以上の他の態様と同時に実行あるいは使用することができ、本発明の一態様について述べたいずれの例あるいは好ましい例も、本発明のその他の態様と同様に適用するべきである。
【0098】
「治療と予防」
ここで用いられている「治療又は予防」の表現及び類似の用語は、予防医学及び精神科診療によって入手可能な何らかの試験に従って判断した時に、予防手段、治療法、苦痛緩和治療を含めて、障害を取り除くあるいは防ぐあるいは症状を取り除くことを意図したヘルスケアのすべての形を意味する。妥当な見込みを持って特定の結果を達成することを目的とするが、常に達成するとは限らない介在は、「治療又は予防」の表現に含まれる。障害の進行を遅らせるあるいは止めることに成功する介在は、「治療又は予防」の表現に含まれる。
【0099】
ある種の神経性、精神性、炎症性、アレルギー性、及び免疫性疾患は、「スペクトル」状態と考えられ、この場合、個体はある範囲のあり得る症状のいくつかあるいはすべてを示しているか、軽症型の疾患のみを示している。更に、神経性、精神性、炎症性、アレルギー性、及び免疫性及び腫瘍性疾患の多くは進行性であり、比較的軽症の異常な症状で始まって、より重症の異常な症状へ進行する。本発明は、タイプと段階がどのようなものであれ、NF介在型の神経性、精神性、炎症性、アレルギー性、及び免疫性及び腫瘍性のすべての症状の治療と予防を含む。
【0100】
「罹患しやすい」
ここで用いられている「罹患しやすい」の表現及び類似の用語は、個体あるいは疾患についての公知のリスク因子を用いて評価した時に、医学的、健康上の良好な状態、あるいは精神的異常、あるいは個体的な変化について、正常なリスクよりリスクが高い個体を特に意味する。このような個体は、例えば、薬剤の処方、及び/又は、特別な食事療法、ライフスタイル又は同様の推奨がその個体になされる程度に、一又はそれ以上の特定の疾患あるいは個体的な変化が進展する実質的なリスクを有するものとして分類される。
【0101】
毒性と副作用
本発明の薬剤は、制限された、対処可能な副作用を有しており、使用に際して非毒性あるいは基本的に非毒性である。
【0102】
薬学的(獣医学的使用を含む)使用のコンテキストにおいては、これは、薬剤の生理学的受容性という意味を含んでおり、音響医学及び獣医学的判断の範囲内において、この薬剤は、ヒト、哺乳動物及びその他の動物の細胞に接触させて有効投与量で、不適切な毒性、刺激、アレルギー性反応、好ましくない副作用を生じることなく使用するのに適しており、また、このような生じることがある有害事象は、過度なものであると考えられるか、あるいは副次的治療によって対処することができず、妥当なリスク/ベネフィット比につり合ったものと考えられる。
【0103】
機能性食品、特に、食材、サプリメント食品(健康補助食品を含む)、飲料及びサプリメント飲料、並びに、機能性化粧品や、皮膚科及びその他の皮膚に接触する又は眼に接触する調製品といった、局所用製剤のコンテキストにおいては、これはリスク/ベネフィット及び副作用に関する相当の評価を意味しており、供給されるものの特定の成分又は調製品、及び、特定の使用についての安全性と、毒性の基準に適合している。
【0104】
「非治療的方法」
非治療的使用は、一般的に、医学的監督を行うことなく、ある組成物中の生理的活性薬剤のヒト対象の選択的自己投与、典型的には経口投与によって特徴付けられる。典型的には、これから意図される利点は、症状あるいは認識された症状に関連して、良好な状態、あるいは一般的な健康に良い状態になることであり、これは、(i)形式的に診断未確定、(ii)臨床診療に従って診断未確定、あるいは(iii)正常な範囲の健康な集団内にあり、従って、疾患があると考えられない状態である。
【0105】
非治療的使用は、また、医学的介入の欠如、あるいは対象の組成物購入又は入手の段階における介助によって特徴付けられる。
【0106】
更に、非治療的使用は、供給者による組成物の医学的要求の欠如によっても特徴付けられ、従って、自己投与は診断を受けた疾患を治療する特定の意図によって行われない。
【0107】
例えば、非治療的に好適な影響を受けることがある神経機能には、例えば、認知(思考、理由づけ、記憶、思い出す、想像、学習を含む)、集中及び留意、特にそのスケールの症状のより穏やかな終局に対する留意、及び穏やかな異常行動、あるいは性格特性が含まれる。非治療的に好適に治療できる神経機能には、例えば、ヒトの行動、気分、人格、及び、例えば、性的行動、性的機能障害、苦悩、不安、鬱、むら気、不機嫌、ティーンエイジのむら気、睡眠パターンの乱れ、鮮明な夢、悪夢、及び夢中歩行、などの社会機能が含まれる。
【0108】
本発明の非治療的方法によって治療可能な上述の神経的及び精神的機能の例に加えて、関連する行動又は思考が個体に有意な苦痛を生じないため、あるいは個体の日常の機能を破壊しないため、臨床診療によって診断不可能な、穏やかな神経疾患及び精神疾患も、本発明によって非治療的に治療可能な症状と考えられる。
【0109】
穏やかな炎症性、アレルギー性及び免疫性疾患、又は、原因不明のあるいは形式的な診断を受けないその他の理由による、炎症性、アレルギー性、及び免疫性疾患も、本発明によって非治療的に治療可能な症状と考えられる。
【0110】
良性の腫瘍性疾患、又は、原因不明のあるいは形式的な診断を受けないその他の理由による腫瘍性疾患も、本発明によって非治療的に治療可能な症状と考えられる。
【0111】
「正常化」
ここで用いられている「正常化」及び類似の用語(「恒常性」など)の表現は、一般的に正常な健康状態の症状特性に対する生理学的調整を特に意味する。最適な正常状態は、健康な若年の成人あるいは非ヒト動物の状態によって例示できる。
【0112】
従って、「正常化」とは、正常であると特徴づけられる状態に実際に達したか否かにかかわらず、正常な状態に向けた調整過程を含む。
【0113】
神経性疾患
ここで用いられている「神経性疾患」及び類似の用語の表現は、例えば、神経変性(認知障害の症状を伴う神経変性と、認知障害の症状を伴わない神経変性を含む)、神経筋変性、及び運動感覚神経変性を含む。
【0114】
本発明に関連する神経性疾患の例には、限定することなく、以下のものが含まれる:痴呆症、加齢に関連した認識機能障害、アルツハイマー病、アルツハイマー型老年性認知症(SDAT)、レヴィー小体認知症、血管性認知症、パーキンソン病、脳炎後のパーキンソン病、脳炎後及びその他のパーキンソン病以外の理由によるパーキンソン症候群、顔面肩甲上腕型筋ジストロフィーを含む筋ジストロフィー(FSH)、デュシェンヌ型筋ジストロフィー、ベッカー型筋ジストロフィー及びブルース型筋ジストロフィー(Bruce’s muscular dystrophy)、フックスジストロフィー(Fuchs’dystrophy)、筋緊張性ジストロフィー、角膜ジストロフィー、反射性交感神経性ジストロフィー症候群(RSDSA)、神経血管ジストロフィー(neurovascular dystrophy)、重症筋無力症、ランバート・イートン病、ハンチントン病、筋萎縮性側索硬化症(ALS)を含む運動ニューロン疾患、乳児脊髄性筋萎縮症(infantile spinal atrophy)、多発性硬化症、起立性低血圧、疼痛、神経痛、下記のような発作及び事故のような外傷性神経変性(例えば、外傷性の頭部又は脳の損傷、又は脊髄の損傷)、バトン病、コケーン症候群、ダウン症候群、大脳皮質基底核神経節変性症、多系統萎縮症、脳萎縮症、オリーブ橋小脳萎縮症、歯状核赤核萎縮症(dentatorubral atrophy)、淡蒼球ルイ体萎縮症(pallidoluysian atrophy)、球脊髄性萎縮症(spinobulbar atrophy)、視神経炎、硬化性全脳炎(SSPE)、注意欠陥障害、ポストウイルス性脳炎(post−viral encephalitis)、ポリオ後症候群、ファール症候群、ジュベール症候群、ギラン・バレー症候群、無脳回症、もやもや病、神経細胞移動障害、自閉性症候群(autistic syndrome)、ポリグルタミン病、ニーマン・ピック病、進行性多巣性白質脳症、偽脳腫瘍、レフサム病、ツェルヴェーガー症候群、核上性麻痺、フリードライヒ失調症、脊髄小脳失調症2型(spinocerebellar ataxia type 2)、レット症候群、シャイ・ドレーガー症候群、結節性硬化症、ピック病、慢性疲労症候群、遺伝性ニューロパシーを含む神経障害、糖尿病性神経障害及び有糸分裂性神経障害、クロイツフェルト・ヤコブ病(CJD)、変異型CJD、新変異型CJDを含むプリオンベースの神経変性、牛海綿状脳症(狂牛病)(BSE)、GSS、FFI、クールー病及びアルパーズ症候群、ジョセフ病、急性散在性脳脊髄炎、くも膜炎、中枢神経系の血管障害、四肢神経機能の喪失、シャルコー・マリー・トゥース病、クラッベ病、白質萎縮症、心不全への罹患性、喘息、てんかん、聴覚神経変性(auditory neurodegeneration)、黄斑変性症、色素性網膜症(pigmentary retinitis)、及び緑内障に起因する視神経変性。
【0115】
精神疾患
「精神疾患」の表現は、個性と行動に影響する、特に、人間の思考、感覚、気分、及びその他のことに関連する能力に影響する、ヒトの精神的疾患をすべて含む。従って、「神経性」疾患と「精神性」疾患はいくらか重なっており、特に、本発明においては、本発明によって治療あるいは予防する「精神疾患」は、NFs又はNFrsによって直接あるいは間接的に影響を受ける基本的な神経性欠陥に、直接あるいは間接的に関連する。
【0116】
一般的に言って、精神疾患は、関連する行動あるいは思考が、個体に有意な苦痛を生じないかぎり、あるいは個体の日常の機能を壊さない限り、「精神異常」と診断されない。従って、診断可能な疾患と、同様ではあるが、治療が非治療的である(下記を参照)と考えられるあまり重症でない、あるいは破壊的でない精神機能との間にはボーダーラインがある。
【0117】
本発明に関連する精神疾患の例には、限定することなく、以下のものが含まれる:不安障害(例えば、急性ストレス障害、パニック障害、広場恐怖症、社会恐怖症、特定恐怖症、強迫性障害、心的外傷後ストレス障害、身体醜形障害及び全般性不安障害)、性的不安障害(例えば、膣痙、男性の勃起不全、男性のオルガズム障害、女性のオルガズム障害)、小児期障害(例えば、注意欠陥・多動性障害(ADHD)、アスペルガー症候群、自閉性障害、行為障害、反抗的行為障害、分離不安障害及びトゥレット障害)、摂食障害(例えば、拒食症及び過食症)、気分障害(例えば、鬱病、大鬱病性障害、双極性障害(躁鬱病)、季節性情動障害(SAD)、気分循環性障害及び気分変調性障害)、睡眠障害、認知精神障害(cognitive psychiatric disorders)(例えば、せん妄、健忘障害)、人格障害(例えば、妄想性人格障害、分裂病質人格障害、統合失調症性人格障害、反社会的人格障害、境界性型人格障害、演技性人格障害、自己愛性人格障害、回避性人格障害、依存性人格障害、強迫性人格障害)、精神病性障害(例えば、統合失調症、妄想性障害、短期的精神障害(brief psychotic disorder)、統合失調症様障害、分裂情動性障害及び共有精神病性障害)、及び物質関連障害(例えば、アルコール依存症、覚醒剤依存症、大麻依存症、コカイン依存症、幻覚剤依存症、吸入依存症、ニコチン依存症、オピオイド依存症、フェンシクリジン依存症及び鎮静剤依存症)。
【0118】
炎症性及びアレルギー性疾患
本発明によって治療可能な炎症性及びアレルギー性疾患の例には、咳、掻痒症(Johansson,O et al,Arch.Dermatol.Res.,2002,293,pages 614−619)、食物不耐性、乾癬、クループ、過敏性腸症候群、耳鳴り、メニエール病、ストレスによる潰瘍又はアセチルサリチル酸による潰瘍、アレルギー性鼻炎、アレルギー性皮膚炎、結膜炎、炎症、炎症性大腸炎、回腸炎、膵炎、胆嚢炎、非アレルギー性鼻炎、食道炎、変形性関節炎、関節リウマチ、花粉症、家ダニアレルギー、ペットアレルギー、ハンチントン病、急性炎症性痛覚、内臓痛、歯痛及び頭痛、炎症性痛覚過敏、触知性痛覚過敏(tactile hyperalgesia)(例えば、Ma,QP et al,Neuroreport 1997,8,pages 807−810参照)、アレルギー性皮膚反応、目のアレルギー反応、喘息(Bonini,S et al,Proc.Natl.Acad.Sci.USA,1996,93,pages 10955−10960;Braun,A et al,Am.J.Respiratory Cell Mol.Biol.,1999,21,pages 537−546)、アテローム性動脈硬化症、関節炎、慢性潰瘍(例えば、関節リウマチに関連する慢性の血管炎性潰瘍(chronic vasculitic ulcer))及び湿疹が含まれる。
【0119】
本発明による関連する非治療的処置には、正常な呼吸の維持、痛むのどと咳の鎮静、正常な消化を維持する目的での胃の痛みの緩和、鼻詰まりなどの風邪やインフルエンザからの回復を目的とする頭痛の鎮静、筋肉痛の軽減、軽度の痛みの緩和、歯痛の軽減、口腔内潰瘍又は胃潰瘍の軽減、及び健康な関節の維持が含まれる。
【0120】
免疫性疾患
本発明によって治療可能なNF介在免疫性疾患の例には、上述のVega et alの文献の表2(第8頁)に挙げられている免疫細胞機能に対するNFsの影響の正常化によって治療可能な症状を含む。これらの疾患には、AIDS(この場合、NFsの正常化が対象の免疫能力を上げるであろう)、免疫活動過剰症状(この場合、NFsの正常化が対象の免疫システムを下方制御するであろう)、及び、例えば、全身性エリトマトーシス(SLE)などの自己免疫疾患といった、低下した免疫特性の症状(この場合、NFsの正常化が外部薬剤により特異的になるよう免疫システムを支援するであろう)などの免疫不全状態が含まれる。
【0121】
腫瘍性疾患
本発明によって治療可能なNF介在悪性腫瘍性疾患の例には、乳、甲状腺、大腸、肺、卵巣、皮膚、筋肉、膵臓、前立腺、腎臓、生殖器、血液、免疫システム(例えば、脾臓、胸腺及び骨髄)、脳、末梢神経系及び皮膚(例えば、メラノーマ及びカポジ肉腫)の癌が含まれる。
【0122】
損傷を受けたあるいは異常な組織における、あるいはこれに関連する神経機能の回復又は正常化
本発明は、一態様において、損傷を受けたあるいは異常な組織における、あるいはこれに関連する神経機能の回復又は正常化を提供する。この組織は、脳組織であっても良く、皮膚、骨、眼、あるは筋肉組織など、脳外組織であっても良い。
【0123】
本発明のこの態様は、例えば、外科手術、切断、創傷、事故、痣、擦り傷、火傷、凍傷、骨折後の神経の回復に関連して使用できる。
【0124】
創傷の治癒
本発明は、一態様において、創傷の治癒の支援を提供する。この創傷は、あらゆる皮膚の損傷であっても良く、慢性(例えば、潰瘍性)皮膚損傷と、急性皮膚損傷を含む。このような損傷の原因は数多く、多様である。一般的に、すべての皮膚の損傷を、本発明を用いて有益に治療することができる。
【0125】
皮膚の治癒の質を評価するのに測定される創傷治癒の態様には、創傷の閉合の度合い、創傷の上の皮膚組織の再生速度、周辺の皮膚色素に対する治癒した創傷の色、周辺の皮膚強度に対する治癒した創傷の機械的強度、最大に治癒した後に創傷に残る異常な触感又は凹凸に関する組織あるいはその他の皮膚組織を損傷している度合い、創傷の滲出が止まる、又は滲出の流れが弱まるまでにかかる時間、創傷又は滲出液の物理的外観と匂い、及び、治癒過程における様々な時点での痛み、かゆみ、あるいはその他の不快感の度合い、が含まれる。
【0126】
これらのすべての基準に対して、本発明は従来技術の治療に比べて利点を提供する。対象の天然NFsの自己制御恒常性は、外因性NFsを加える必要なしに、使用したすべての基準下で、ヒト及び非ヒト哺乳類の皮膚損傷に有利に影響することが期待される。
【0127】
本発明による薬剤は、創傷治療のために、局所的にあるいは全身に投与することができる。局所的に投与する場合は、例えば、創傷用ドレッシング、クリーム、又は創傷に塗布するその他の調剤など、何らかの好適な組成又は構造から送達することができる。送達システムの更なる詳細は、以下に述べられている。
【0128】
組織の良好な状態及び一般的な健康の促進又は支援
本発明は、別の態様において、運動、労働あるいは消耗からの筋肉や組織の回復、持久力と筋肉スタミナの回復(例えば、競技スポーツにおける、あるいは非競技スポーツにおける)、及び疲労感の低減を提供する。
【0129】
より一般的には、脳内及び脳外の両方において、組織の良好な状態及び一般的な健康を、本発明によって支援することができる。
【0130】
一例では、皮膚に対する、本発明による薬剤の化粧品、眼、あるいは皮膚科学的アプリケーションは、新しい皮膚細胞の補充を改善し、従って、皮膚又は眼の健康感と良好な状態を支援する。例えば、Alber,K.M.et al,Neuroscientist 2007,13,pages 371−382を参照。本発明による方法は、皮膚NFsの自己制御恒常性を含んでおり、身体への毒性薬剤の投与を防ぎ、代わりに、処置に対して対象自身の天然なNFsを調整する。
【0131】
これらの使用は、一般的に、限定するものではないが、非治療的であり、健康な人々を主に対象としている。
【0132】
哺乳動物
ヒトの治療に有益である他に、本発明は、やはり栄養学的及び心理学/精神的症状によって影響を受けることがある様々な哺乳動物においても有益である。このような動物には、例えば動物園の非ヒト霊長類(例えば、類人猿、猿、及びキツネザル)、猫や犬などのペット、犬、馬、仔馬などの労働及びスポーツ動物、例えばブタ、羊、山羊、鹿、牛、及び畜牛などの家畜、及び、ウサギや齧歯動物(例えば、ラット、マウス、ハムスター、スナネズミ、テンジクネズミ)などの実験動物が含まれる。
【0133】
治療するべき疾患、症状、特性あるいは機能がヒトに限定されている場合、治療を受ける哺乳類はヒトであると解される。治療するべき疾患、症状、特性あるいは機能がヒト以外の哺乳類の種に限定されている場合、同じことがそれぞれの種に言える。
【0134】
薬剤
ここで使用されている活性薬剤は一般的に、本質的なことではないが、約800より少ない、例えば約700より少ない、例えば約600より少ない、例えば約500より少ない、例えば約450より少ない分子量を有する。
【0135】
ステロイド化学からの正式名称を受けて、左側の6員環は、A−リングと呼ばれ、A−リングに隣接するリングはB−リングと呼ばれる。また、ステロイド化学からの正式名称を受けて、炭素原子は以下に示すように数値が付されており、環の間の融合線が、5位及び10位の炭素原子の間に生じる。
【0136】
A/B−cisステロイド性フロスタン/エン又はスピロスタン/エン・サポゲニンでは、5位及び10位の炭素原子における置換基又は水素原子が、その分子の面に対して(上方に)βだけ方向づけられている。
【0137】
このことは、分子の面をねじって、立体図面において以下のように見える活性基を作る効果を有する。10位の炭素原子における置換又は水素原子は、図面において、「a」の符号が付けられており、5位の炭素原子における置換又は水素原子には「b」の符号が付けられている。C環は、部分的にのみ示されている。

これは、A/B−cisモチーフである。
【0138】
WO−A−99/48482、WO−A−99/48507、WO−A−01/23407、WO−A−01/23408、WO−A−02/079221、WO−A−03/082893、WO−A−2005/105108及びWO−A−2006/048665に開示されているA/B−cisステロイド性フロスタン/エン又はスピロスタン/エン・サポゲニンの例及びこれらの誘導体の形状は、本発明に用いる活性薬剤として特に記載されている。これらの公報に開示された特定の化合物セット及び個々の化合物、A/B−cisステロイド性フロスタン/エン又はスピロスタン/エン・サポゲニンである化合物の代表的なクラス、及び、これらのエステル、エーテル、ケトン、及びグリコシル化型は、ここに引用によって組み込まれている。
【0139】
A/B−cisステロイド性フロスタン/エン又はスピロスタン/エン・サポゲニンのエステル、エーテル、ケトン、及びグリコシル化型は、一又はそれ以上のエステル、エーテル、ケトン、及びグリコシル化基が分子に存在するものでも良い。一般的にエステル、エーテル、ケトン、及びグリコシル化基は、従来の化学合成法を用いて、A/B−cisスピロスタン/エン・サポゲニンの一又はそれ以上の任意のOH部分に形成される。
【0140】
本発明の活性薬剤の例は、WO−A−01/23406(公開PCT出願の第6頁)の式I、WO−A−01/23406(公開PCT出願の第7頁)にある式II、WO−A−01/23407(公開PCT出願の第6頁)にある式I、WO−A−01/23407(公開PCT出願の第6頁)にある式II、WO−A−01/23408(公開PCT出願の第6頁)にある式I、WO−A−01/49703(公開PCT出願の第7頁)にある式I、WO−A−02/79221(公開PCT出願の第6頁)にある式II、WO−A−03/082893(公開PCT出願の第4頁)にある式I、WO−A−03/082893(公開PCT出願の第4頁)にある式II、WO−A−03/082893(公開PCT出願の第5頁)にある式III、EP−A−1024146(公開EP出願の第4頁)にある式I、及びEP−A−1024146(公開EP出願の第8頁)にある式II、で表されるA/B−cis化合物である。
【0141】
例えば、サルササポゲニンとスミラゲニンの分子、及び、その対応するエステル、エーテル、ケトン、及びサポニン(グリコシル化)誘導体は、本発明の有用な活性薬剤である。A/B−cisフロスタンサポニンである、化合物ティモサポニンBIIは、本発明の有用な活性薬剤である。
【0142】
本発明のその他の有用な活性薬剤には、エピサルササポゲニン、エピスミラゲニン、メタゲニン、サーモゲニン(samogenin)、ジオチゲニン、イソジオチゲニン、テキソゲニン(texogenin)、ヨノゲニン、メキソゲニン(mexogenin)、マルコゲニン及びそれらに対応するエステル、エーテル、ケトン及びサポニン誘導体が含まれる。
【0143】
この活性薬剤は、好適な結晶あるいは非晶質の形で、及び好適な無水、水和あるいは溶媒和の形で使用することができる。サルササポゲニンとスミラゲニン及びこれらの誘導体のこのような形状の更なる詳細は、WO−A−2005/105825及びWO−A−2006/048665に記載されており、これらの文献に特定の符号が付されている。
【0144】
エステルには、特に、カルボン酸塩(例えば、カシレート(cathylate)(エゾキシカルボニロキシ)、アセテート、コハク酸、桂皮酸、フェルラ酸、プロピオナート、ブチレート、イソブチレート、吉草酸、イソ吉草酸、カプロン酸、イソカプロン酸、ジエチルアセテート、オクタノン酸、デカン酸、ラウレート、ミリステート、パルミテート、ステアレート、ベンゾアート、フェニルアセテート、フェニルプロピオナート、桂皮酸、p−ニトロベンゾイルオキシ、3,5−ジニトロベンゾイルオキシ、p−クロロベンゾイルオキシ、2,4−ジクロロベンゾイルオキシ、p−ブロモベンゾイルオキシ、m−ブロモベンゾイルオキシ、p−メトキシベンゾイルオキシ、フタリル、グリシナート、アラニナート、バリナート(valinate)、フェニルアラニナト、イソロシナート(isoleucinate)、メチオニナト、アルギナート(argininate)、アスパラギナート、アスパラギン酸、システイナート、グルタマート、ヒスチジナート、リジナート(lysinate)、プロリナート(prolinate)、セリナート(serinate)、トレオニナート、トリプトファナート、チロシナート、フマル酸、マレイン酸、リン酸塩、及び、スルホン酸塩エステルなど、3−位エステルが含まれる。
【0145】
エーテルには、特に、アルコキシ誘導体(例えば、メトキシ、エトキシ、n−プロポキシ、s−プロポキシ、n−ブトキシ、s−ブトキシ、t−ブトキシ)などの3−位エーテルが含まれる。
【0146】
ケトン(サポゲノン)は、典型的には対応するサポゲニンの3−ケト誘導体であり、環システムの様々なOH−ベアリング炭素原子に形成されたケト誘導体も可能である。3−ケトサポゲノンの例には、サルササポゲノン、スミラゲノン、エピサルササポゲノン、及びエピスミラゲノンが含まれる。
【0147】
好適なサポニン化合物の例には、3−位の炭素原子(すなわち、R3が付着している炭素)がR3の適所にO−糖成分を担持している化合物、例えば、モノ−、ジ−、トリ−サッカライド又は高次のポリサッカライド、又はこれらのアシル化型が含まれる。これらの糖類の例には、グルコース、マンノース、フラクトース、ガラクトース、マルトース、セロビオース、スクロース、ラムノース、キシロース、アラビノース、フコース、キノボース、アピオース、ラクトース、ガラクトース−グルコース、グルコース−アラビノース、フコース−グルコース、ラムノース−グルコース、グルコース−グルコース−グルコース、グルコース−ラムノース、マンノース−グルコース、グルコース−(ラムノース)−グルコース、グルコース−(ラムノース)−ラムノース、グルコース−(グルコース)−グルコース、ガラクトース−(ラムノース)−ガラクトース、から選択された糖類、及びそのアシル化(例えば、アセチル化)誘導体が含まれる。
【0148】
疑似サポ(ゲ)ニンは、それぞれスピロスタン/エン・サポゲニン又はサポニンの開環誘導体であり、F環が開閉する。疑似サポ(ゲ)ニンは、C20−C22結合において、飽和あるいは不飽和である。飽和型は、ときに、「ジハイドロ疑似サポ(ゲ)ニン」と呼ばれる。
【0149】
本発明の活性薬剤は、単体で使用しても良く、所望の組み合わせで使用しても良い。
【0150】
その他の補助薬剤又は補助成分
本発明に使用されている組成物は、組成物と投与ルートに関連して以下により詳細に記載するように、所望の場合、一又はそれ以上の補助薬剤及び/又は補助成分を含むものでも良い。
【0151】
特に、代謝補助剤、ケトンのボディレベルを上げる化合物(ケト原生化合物)、トリカルボン酸(TCA)回路中間体、インビボでTCA中間体に変換する化合物、エネルギィ強化化合物、あるいはこれらの混合物を使用することができる。
【0152】
代謝補助剤には、ビタミン剤、(例えばビタミンE)、ミネラル、抗酸化剤及びその他の関連する化合物(例えば、アルコルビン酸、ビオチン、カルシトリオール、コバラミン、葉酸、ナイアシン、パントテン酸、ピリドキシン、レチノール、レチナール(レチナールデヒド)、レチノイン酸、リボフラビン、チアミン、α−トコフェロール、フィチルメナキノン、マルチプレニルメナキノン、カルシウム、マグネシウム、ナトリウム、アルミニウム、亜鉛、カリウム、クロム、バナジウム、セレン、リン、マンガン、鉄、フッ素、銅、コバルト、モリブデン、ヨウ素、あるいはこれらの組み合わせが含まれる。
【0153】
ケト原生化合物は、一般的に、レシピエントによって外因性脂肪代謝(酸化)を高め、これによって、血中のケトンレベルを上げる。これには、例えば、アセトンといったC3−8ケトン、D−β−ヒドロキシブチレート、D−β−ヒドロキシブチレートの代謝前駆体(例えば、アセトアセチル1−1,3−ブタンジオール、アセトアセチル−D−β−ヒドロキシブチレート及びアセトアセチルグリセロールといったアセトアセチル前駆体;一価、二価又は三価アルコールを伴うD−β−ヒドロキシブチレートのエステルといったエステル;ポリ−D−β−ヒドロキシブチレート、又は約2乃至約100のリピート、例えば約3乃至約10のリピートを有する、最終的に酸素と結合するポリ−D−β−ヒドロキシブチレートといったD−β−ヒドロキシブチレートのポリエステル)、アセトアセテートの前駆体、あるいはこれらの組み合わせが含まれる。
【0154】
TCA中間体には、クエン酸、アコニット酸、イソクエン酸、α−ケトグルタル酸、コハク酸、フマル酸、マレイン酸、オキソ酢酸、あるいはこれらの組み合わせを含まれる。
【0155】
インビボでTCA中間体に変換する化合物には、2−ケト−ヒドロキシプロパノル、2,4−ジヒドロキシブタノール、2−ケト−4−ヒドロキシブタノール、2,4−ジヒドロキシブチル酸、2−ケト−4−ヒドロキシブチル酸、アスパラギン酸、モノ−及びジ−アルキル−オキサロ酢酸、ピルビン酸、グルコース−6−リン酸、あるいはこれらの組み合わせが含まれる。
【0156】
エネルギィ強化化合物には、例えば、コエンザイムCoQ−10、クレアチン、クレアチン誘導体、L−カルニチン、n−アセチル−カルニチン、L−カルニチン誘導体、あるいはこれらの組み合わせが含まれる。これらの化合物は、いろいろな意味でエネルギィ製品を強化する。カルニチンは、脂肪酸の代謝を高める。CoQ−10は、ミトコンドリア内での電子の移動の際に電子キャリアとして作用する。従って、中鎖脂肪酸トリグリセリド(MCTs)などの活性薬剤を有するこれらの化合物の添加によって、特に、栄養的に貧しい人における、代謝効率を高める。
【0157】
補助薬剤が存在する場合、治療あるいは栄養的使用には、一又はそれ以上のカチオンとの錯体として、あるいは塩として代謝前駆体の形で提供することができる。カチオンと典型的な生理学的塩の例には、ナトリウム、カリウム、マグネシウム、カルシウム塩が含まれ、それぞれ、カチオンが生理学的カウンターイオンによってバランスされており、L−リシン、L−アルギニン、メチルグルカミン又はこの分野で知られているその他の塩錯体を形成している。これらの代謝前駆体の調整及び使用は、WO−A−98/41201及びWO−A−00/15216に記載されており、この開示はここに引用によって組み込まれている。
【0158】
組成及び投与ルート
活性薬剤は、活性薬剤と好適な追加成分を含む組成物の形で投与することができる。この組成物は、例えば、薬学的組成物(医薬)、食材、フードサプリメント又は飲料であっても良い。このような組成物は、特定の化合物、及び/又は生理学的に受容できるエステル、アミド、塩、溶媒和物、類似体、あるいはその他の好適な誘導体の混合物を含んでいても良い。一般的に、ある組成物の一の活性薬剤及び/又はその他の成分の存在への言及は、その範囲内で、このような薬剤及び/又は成分の2又はそれ以上の混合物を示す。
【0159】
薬学的組成物は、限定するものではないが、経口、経鼻胃、直腸、経皮、非経口(皮下、筋肉内、静脈内、髄内、及び皮内注射又は点滴)、鼻腔内、経粘膜、インプラント、膣、局所、頬内、舌下を含む適宜のルートで投与することができる。
【0160】
多くの薬物と同様に、投与部位が治療を受ける哺乳類の脳から遠隔で良いことは、小分子でいくらか親油性の薬物使用の典型的な特徴であり、この薬剤は、血流を介して及び血液−脳及び/又は血液−神経バリヤに亘って移動する。
【0161】
本発明のコンテキストにおける「薬学的組成物」の用語は、投与モードの特性と投与形態に応じて、活性薬剤を含む組成物、及び、更に薬学的に許容可能な担体、希釈剤、補助薬、賦形剤、保存剤などのビークル、充填剤、崩壊剤、緩衝材、保存剤、浸透促進剤、湿潤剤、乳化剤、懸濁化剤、甘味剤、香味剤、香料、抗菌材、抗カビ剤、潤滑剤、及び助剤を含む組成物を意味する。適当な投与形態には、例えば、タブレット、糖衣錠、粉、エリキシル剤、シロップ、懸濁液を含む液体薬剤、スプレィ、吸入抗原、タブレット、トローチ、乳化剤、溶液、流体、カプセル、座薬、並びにリポソーム調剤を含む点滴用液体薬剤、が含まれる。技術と製剤は一般的に、Remington,Pharmaceutical sciences,Mack Publishing co.,Easton,PA,latest editionに見ることができる。
【0162】
ここで用いられている「食材」、「フードサプリメント」、「飲料」、及び「飲料サプリメント」の用語は、これらの用語の一般的な意味であり、薬学的調剤に限定されない。これらの組成物は、経口摂取に適している。サプリメントの組成物(例えば、フードサプリメントあるいは飲料サプリメント)は、食料及び飲料に添加して、これらと共に摂取するように構成されている。食物は、典型的には、脂肪、オイル、及び炭水化物などのカロリー材料、並びにタンパク質や、ミネラル源、繊維を含む。組成物の例には、乳製品、シリアル、野菜、肉、魚、鶏肉、あるいは果物ベースの食物が含まれる。飲料の例には、炭酸入り又は炭酸なしの飲料、フルーツジュース、コーヒーあるいは、ハーブティ、フルーツティ、緑茶、あるいは紅茶ィ又は中国茶などのお茶、といった浸出液の飲み物が含まれる。組成物は、牛乳、あるいは、粉ミルク及び/又はラクトース及び/又はカゼインなどの牛乳由来の成分を含んでいても良い。牛乳又は牛乳由来の成分は、好ましくは、牛又はヤギからのものが良い。豆乳などの植物由来のミルクも使用できる。食用成分は、一又はそれ以上の発酵成分を含むものでも良い。この成分は、ヨーグルトを含む。フードサプリメントは、例えば、ビタミン、ミネラル、カフェイン、エフェドリンアルカロイドを含むものでも良い。
【0163】
経口組成物
好適な摂取形態の例には、限定するものではないが、液体、粉あるいは固体のコアを有する投与形態;かみ砕くことができるあるいは経口で崩壊するタブレット;薄いストリップ;グミタブレット;フォームタブレット:被覆材及び/又は粒状マトリックス中に薬剤を含む唾液分泌材で被覆した粒子が含まれる。一の実施例では、投与形態は、特定の所定量(すなわち、投与量)のある種成分、例えば、以下に規定するような活性成分を含むように設計した、固体、半固体、あるいは液体組成物である。好適な投与形態は、経口投与、頬内投与、粘膜投与用のもの、あるいはミネラル、ビタミン及びその他の栄養補給食品、口内ケア薬剤、香料、その他を送達する組成物を含む、薬剤送達システムであっても良い。一の実施例では、本発明の投与形態は、固体であると考えられるが、液体又は半固体成分を含んでいても良い。別の実施例では、投与形態は、ヒトの胃腸管へ薬学的活性成分を送達する経口投与システムである。この組成物の好適な補助薬剤は、鎮痛剤、抗炎症剤、抗関節炎薬、麻酔薬、抗ヒスタミン剤、鎮咳薬、抗生物質、抗ガン剤、抗アレルギー剤、抗感染症薬、抗ウイルス剤、抗凝血剤、抗鬱剤、抗糖尿病薬、制吐薬、整腸剤、抗真菌剤、食欲抑制剤、気管支拡張剤、心血管治療薬、中枢神経系刺激薬、免疫系刺激薬、鼻充血除去薬、利尿剤、去痰薬、胃腸薬、偏頭痛予防薬(migraine preparations)、ポリジメチルシロキサン、呼吸器官の薬、スリープエイド(睡眠導入剤)、尿路系の薬、及びその混合物を含んでも良い。好適な口内ケア薬剤には、例えば、息の清涼剤、歯の漂白剤、抗菌剤、歯の鉱化剤、虫歯防止剤、表面麻酔薬、粘膜保護剤(mucoprotectants)などがある。好適な香料には、メントール、ペパーミント、ミント風味、フルーツ風味、チョコレート、バニラ、風船ガム風味、コーヒー風味、お酒の風味及びこれらの組合せなどが含まれる。存在する好適な胃腸薬には、炭酸カルシウム、水酸化マグネシウム、酸化マグネシウム、炭酸マグネシウム、水酸化アルミニウム、重炭酸ナトリウム、ジヒドロキシアルミニウム炭酸ナトリウム;ビサコジル、カスカラサグラダ、ダントロン、センナ、フェノールフタレイン、アロエ、ヒマシ油、リシノール酸、デヒドロコール酸といった刺激性下剤;ファモチジン、ラニチジン、シメチジン(cimetadine)、ニザチジンといったH2受容体アンタゴニスト、オメプラゾール又はランソプラゾールなどのプロトンポンプ阻害薬、スクラフラート及びミソプロストールのような胃腸の細胞保護薬;プルカロプライド(prucalopride) のような胃腸の消化管運動改善薬、クラリスロマイシン、アモキシシリン、テトラサイクリン及びメトロニダゾールといったピロリ菌に対する抗生物質;ジフェノキシラート及びロぺラミドのような止瀉薬;グリコピロラート;オンダンセトロンのような制吐薬;メサラミンのような鎮痛薬が含まれる。薬剤はまた、例えば、プロピオン酸誘導体を含む非ステロイド性抗炎症剤(NSAIDs)など、イブプロフェン、ナプロキセン、ケトプロフェンなどの鎮痛薬、抗炎症薬、及び解熱剤;例えば、インドメタシン、ジクロフェナク、スリンダク、トルメチンなどの酢酸誘導体;例えば、メフェナム酸、メクロフェナム酸、フルフェナム酸などのフェナム酸誘導体;例えば、ジフルニサール、フルフェニサールなどの2−フェニル安息香酸誘導体;例えばピロキシカム、スドキシカム、イソキシカム、メロキシカムなどのオキシカム(oxicams)、から選択されても良い。一の実施例では、補助活性成分は、例えば、イブプロフェン、ナプロキセン、フルルビプロフェン、フェンブフェン、フェノプロフェン、インドプロフェン、ケトプロフェン、フルプロフェン、ピルプロフェン、カルプロフェン、オキサプロジン、プラノプロフェン、スプロフェン、及び薬学的に許容される塩、誘導体及びそれらの混合物などのプロピオン酸誘導体NSAIDから選択されても良い。本発明の別の実施例では、活性成分は、アセトアミノフェン、アセチルサリチル酸、イブプロフェン、ナプロキセン、ケトプロフェン、フルルビプロフェン、ジクロフェナク、シクロベンザプリン、メロキシカム、ロフェコキシブ、セレコキシブ、及び薬学的に許容される塩、エステル、異性体及びそれらの混合物から選択されても良い。
【0164】
別の実施例では、補助薬剤は、プソイドエフェドリン、フェニレフリン、フェニルプロパノールアミン、クロルフェニラミン、デキストロメトルファン、ジフェンヒドラミン、グアイフェネシン、アステミゾール、テルフェナジン、フェソフェナジン(fexofenadine)、ロラタジン、デスロラタジン、ノラステミゾール(norastemizole)、セチリジン、ベンゾカイン、それらの混合物及び薬学的に許容される塩、エステル、異性体及びそれらの混合物から選択されても良い。別の実施例では、補助活性成分は、メチルフェニデート、モダフィニル、及び、注意欠陥過活動性障害又は注意欠陥障害に適したその他の活性薬剤;オキシブチニン;シデネフィル;シクロベンザプリンであっても良い。この活性成分又は成分は、本発明の投与形態で治療的に有効量で存在する。この量は、経口投与をした際に所望の治療的応答が生じる量であり、当業者は容易に決定することができる。この分野で公知の通り、このような量を決定するに当たり、投与する特定の活性成分、この活性成分のバイオアベイラビリティ特性、投与計画、患者の年齢及び体重、及びその他の要因を考慮するべきである。一の実施例では、この投与形態は、活性成分の少なくとも約85重量パーセントを含む。この活性成分又は成分は、どのような形態の投与形態にも存在する。例えば、活性成分は、投与形態において例えば、溶けるあるいは分解するといった、分子レベルで分散できる、あるいは、粒子の形であっても良く、これは、被覆されていてもされていなくとも良い。活性成分が粒子形状である場合、その粒子(被覆されている、いないにかかわらず)は、典型的に、約1ミクロン乃至約2000ミクロンの平均粒径を有する。一の実施例では、このような粒子は、平均粒径約1ミクロン乃至約300ミクロンの結晶である。更に別の実施例では、この粒子は、平均粒径約50ミクロン乃至約2000ミクロン、例えば、約50ミクロン乃至約1000ミクロン、又は約100ミクロン乃至約800ミクロンの顆粒又はペレットである。
【0165】
一の実施例では、本発明の経口組成物は、ヒト又はペットの食物といった、フード組成物である。ある実施例では、この組成物がフード組成物であり、活性成分に加えて更に、それぞれ乾燥重量で、約15−50%のタンパク質、約5−40%の脂肪、約15−60%の炭水化物、5−10%の灰分、及び5−20%の含水量を具える。ある実施例では、食物は、完全に必要な食餌療法の要件で供給するように意図されている。また、スナック、ペットトリート(例えば、ビスケット)、栄養物バー、及び、食品あるいは、タブレット、カプセル、ゲル、ペースト、乳剤、カプレット、及び以下に述べる同様のものを含む栄養補助食品用のその他の形といった有用な組成物が提供されている。選択的に、このフード組成物は、乾燥組成物(例えば、ペットフード用食物)、半湿性組成物、湿潤組成物、あるいはこれらの混合物であっても良い。
【0166】
本発明の組成物は、特にヒトの消費用に調整された食品である。これらは、ヒトの必要な食餌療法の条件で供給するように意図された食物及び栄養物、並びにその他のヒトの食餌療法サプリメントを含む。一の実施例では、ヒトが消費するように調整された食品は、完全であり、栄養的にバランスをが取れているが、その他の実施例では、良好にバランスが取れたあるいは調整された食事に関連して使用する食事療法サプリメントを意図している。
【0167】
この組成物は、グレイビー、飲料水、飲料、濃縮液、ジェル、ヨーグルト、粉体、流体、ペースト、懸濁液、チューズ、チョコレートチップ、おやつ、スナック、ペレット、ピル、カプセル、タブレット、あるいはその他の送達形式といった、フードサプリメントであっても良い。「フードサプリメント」の用語は、食事療法サプリメントを含む。食事療法サプリメントは、特に、特定の種、あるいはペットなどの個体の動物やヒトによって消費するように調整することができる。一の実施例では、食事療法サプリメントは、比較的濃縮された投与量の活性薬剤を具えており、このサプリメントを少量で動物に投与できるようにするか、あるいは動物へ投与する前に希釈できるようにしても良い。いくつかの実施例では、食事療法サプリメント又はその他の活性薬剤含有組成物は、例えば、投与量を調整するために、よりおいしくなるように、あるいはより少量の投与量でより頻繁な投与を行えるように、動物へ投与する前に水又は水のようなものと混合する必要がある。
【0168】
本発明の組成物は、冷蔵あるいは冷凍することができる。活性薬剤は、当該組成物のその他の成分と予めブレンドしておいて、必要な有益量を乳化させる、あるいはペットフード組成物、食事療法サプリメント、あるいはヒトが消費するように調整した食物の上に被覆するようにしても良く、あるいは、それを消費する前にあるいは動物に提供する前に、例えば、粉あるいはミックスを用いて、組成物に加えるようにしても良い。
【0169】
一の実施例では、この組成物は、有効量の活性薬剤を含んでおり、組成物を投与した動物又はヒトの生理学的又は精神的又は行動学的所望の効果を得る。ペットフード及びヒトの消費用に調整した食物については、組成物のパーセンテージとしての活性薬剤の量は、乾燥材料ベースで組成物の約1%乃至約30%の範囲にあるが、より少ない又はより多いパーセンテージを供給することもできる。様々な実施例では、この量は、乾燥重量ベースで組成物の、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%、5.0%、5.5%、6%、6.5%、7%、7.5%、8%、8.5%、9%、9.5%、10%、10.5%、11%、11.5%、12%、12.5%、13%、13.5%、14%、14.5%、15%、15.5%、16%、16.5%、17%、17.5%、18%、18.5%、19%、19.5%、20%、20.5%、21%、21.5%、22%、22.5%、23%、23.5%、24%、24.5%、25%、25.5%、26%、26.5%、27%、27.5%、28%、28.5%、29%、29.5%、30%、あるいはそれ以上である。食事療法サプリメントは、数倍濃度が高い活性薬剤を含有するように調整して、タブレット、カプセル、濃縮液の形態、あるいはその他の同様の投与形態で動物又はヒトに投与するようにでき、あるいは、水で希釈する、ペット又はヒトの食物の上にスプレイするあるいは膜、及びその他の同様の投与モードで押予の前に希釈するようにしても良い。食事療法サプリメント用に、活性薬剤を単体で、動物又はヒトに直接投与しても良く、あるいは動物又はヒトの通常の食物に直接適用しても良い。
【0170】
この組成物は、選択的に、ミネラル、ビタミン、塩、香辛料、着色料、及び保存料といった補助物質を含んでいても良い。補助ミネラルの非限定的な例には、カルシウム、リン、カリウム、ナトリウム、鉄、塩化物、硼素、銅、亜鉛、マグネシウム、マンガン、ヨウ素、セレン、などが含まれる。補助ビタミンの非限定的な例には、ビタミンA、ビタミンB、ビタミンC、ビタミンD、ビタミンE、及びビタミンKが含まれ、これらの様々な塩、エステル、あるいは前述の誘導体を含む。また、更なる食事療法サプリメントには、例えば、いずれかの形のナイアシン、パントテン酸、イヌリン、葉酸、ビオチン、アミノ酸、及び同様のもの、並びにこれらの塩及び誘導体が含まれる。更に、この組成物は、(n−3)及び/又は(n−6)脂肪酸、アラキドン酸、ドコサペンタエン酸、及びドコサヘキサエン酸、並びにこれらの全ての組み合わせといった、有益な長鎖ポリ不飽和脂肪酸を含んでいても良い。
【0171】
ここに提供された組成物は、選択的に、通常の神経性健康を促進又は維持する、あるいは認知機能をさらに強化する、一又はそれ以上の補助物質を含む。このような物質には、例えば、コリン、ホスファチジルセリン、α−脂肪酸、CoQ10、アセチル−L−カルニチン、及び、例えばGinko biloba,bacopa monniera,convolvulus pluricaulis,及び/又は、Leucojum aestivumといった植物からの一又はそれ以上の成分を含有する薬草成分又はエキスを含む。
【0172】
様々な実施例において、ここに提供されている食材又はフード/食事療法サプリメントの組成物は、好ましくは、乾燥重量ベースで、約15%乃至約50%の粗タンパク質を含む。粗タンパク質材料は、動物、植物、あるいはその他にかかわらずいずれかの源からの一又はそれ以上のタンパク質を含む。例えば、大豆、綿実、及びピーナッツなどの植物性タンパク質をここで好適に使用することができる。カゼイン、アルブミン、及び、豚、ラム、馬、鳥、魚あるいはこれらの混合物を含む食肉タンパク質などの動物性及び乳性タンパク質が有益である。
【0173】
この組成物は更に、乾燥重量ベースで約5%乃至約40%の脂肪を含んでいても良い。この組成物は、更に、炭水化物の源を含んでいても良い。この組成物は、通常、乾燥重量ベースで約15%乃至約60%の炭水化物を含む。このような炭水化物の例には、米、コーン、ソルガム、アルファルファ、大豆、カノーラ、大麦、小麦、あるはこれらの混合物などの穀類又はシリアルを含む。この組成物は、また、選択的に、乾燥乳清及びその他の乳製品、又は副産物といった、炭水化物を含むその他の成分を含む。
【0174】
この組成物は、また、少なくとも一の繊維源を含む。食物あるいは餌用に適した様々な溶解性あるいは非溶解性の繊維を使用することができ、このような繊維は当業者に知られている。好適な繊維源には、ビートパルプ(甜菜から)、アラビアゴム、タルハゴム、サイリウム、米ぬか、イナゴマメガム、シトラスパルプ、ペクチン、短連鎖オリゴ糖付加フラクトオリゴ糖、マンナンオリゴフルクトース、大豆繊維、アラビノガラクタン、ガラクトオリゴ糖、アラビノキシラン、又はそれらの混合物が含まれる。代替的に、繊維源は、発酵性繊維であっても良い。発酵性繊維については、ペットの免疫システムに利点を提供するものとしてすでに述べられている。前生物的な組成物を提供して腸内のプロバイオティック微生物の成長を強化する、当業者に知られている発酵性繊維又はその他の組成物も、動物の免疫システムに対する本発明が提供する利点を強化する目的で組成物に組み入れることができる。更に、例えば、Lactobacillus又はBifidobacterium種などのプロバイオティック微生物を、この組成物に加えることができる。
【0175】
本発明の経口組成物の別の実施例は、その濃縮物を含む炭酸飲料組成物である。このような組成物は、この分野でよく知られている方法によって調整することができる。
【0176】
この実施例では、二酸化炭素(水中でカルボン酸を作る)によって、飲料が通常酸性である。しかしながら、このような飲料が「酸性になる」、すなわち、「舌にぴりっとする」飲料に見られるこのタイプの追加の酸を含むように調整することができる。この例には、リン酸、及びクエン酸、マレイン酸、フマル酸、及び酒石酸などの食用酸(時に、「健全な酸」と呼ばれる)を含む。果物、果汁、果物エキスは食用酸を含んでおり、これらの成分を含む飲料は酸性になると考えられる。
【0177】
この飲料はノンアルコールであっても良い。例には、コーラ飲料、オレンジ飲料、レモン飲料、レモネード、トニックウオータ、ルートビール、ジンジャーエール、及び、ジンジャービールが含まれる。
【0178】
この飲料は、アルコール飲料であっても良く、典型的には3−9%wt/wtのエタノールを含む。例には、サイダーや、ウオッカやその他のスピリッツと果実風味の炭酸入りブレンドである、いわゆる「アルコポップ」が含まれる。この飲料は軽いアルコール飲料であっても良く、典型的には、0.1−3%wt/wtのエタノールを含む。例には、シャンディや、ある種の発酵型ルートビール、ジンジャービール、及びレモネードが含まれる。
【0179】
炭酸入り飲料は、例えば牛乳又はヨーグルトが入っていない非乳製品である。炭酸入り飲料は、ほとんど脂肪が含まれていない。
【0180】
この飲料はフレーバーウオータベースの飲料であっても良い。
【0181】
炭酸入り飲料は、透明なものでも濁ったものでもよく、不透明なものでも良い。
【0182】
炭酸入り飲料は、例えば、ビタミンA、B、C、D、E及びK群の一又はそれ以上といった、ビタミンを含有していても良い。ビタミンは、フルーツジュースなどその他の成分に存在するビタミンに、更に加えることができる。水溶性ビタミンB及びCは、非常に好適な飲料の成分である。脂溶性ビタミンA、D、E及びKは、若干低いが好適である。好ましいビタミンE、又はその誘導体は、飲料には存在しない。好ましいビタミンA及びK、又はその誘導体は、飲料には存在しない。
【0183】
炭酸入り飲料は、甘味料を含有していても良い。甘味料は、例えば、砂糖、コーンシロップ、糖アルコール(例えば、ソルビトール、キシリトール、マンニトール、マルチトール又はイソマルト)、あるいは、強い甘味料(例えば、サッカリン、スクラロース、ネオターム、アセスルファム、ポタジウム、アスパルテーム)、あるいはこれらの組み合わせなど、天然又は合成甘味料であっても良い。
【0184】
局所組成物
別の実施例では、本発明の組成物は、例えば、化粧品、眼あるいは皮膚の組成物など、局所組成物である。
【0185】
活性薬剤を送達する局所組成物は、好適な方法で調整される。局所組成物は、創傷ドレッシング内あるいはその他の機械的アプリケーション内に、従来の方法で調整することができる。
【0186】
ここに述べた活性薬剤化合物は、一又はそれ以上の化粧品及び/又は皮膚に受容可能なキャリアと共に、及び選択的にその他の治療成分と共に調整し、送達することができる。キャリアは、この組成物のその他の成分と相溶性があり、レシピアントを傷つけないように受け入れ可能でなくてはならない。キャリアはまた、薬剤の望ましくない副作用を低減することもある。このようなキャリア又はビークル成分は、この分野では知られている。Handbook of Cosmetic Science and Technology Taylor & Francis Group,2006を参照。これは、全体として引用により組み込まれている。
【0187】
本発明による局所投与用組成物は、その中に提供されている活性成分と投与領域及び回数に応じて、局部的に及び/又は全身的に投与しても良い。従って、局所製剤に関する以下の説明は、ある程度全身製剤について述べているものとみられ、局所投与と全身投与が可能な活性薬剤が含まれている。
【0188】
本発明の組み合わせに使用されている局所投与用組成物は、通常使用されている薬剤、化粧品、眼、あるいは皮膚の調整に組み入れることができ、様々な形態で存在している。例えば、局所投与用のこの組成物は、溶液、油中水滴型エマルション、水中油滴型エマルジョン、又は水中油中水型乳剤、又は油中水中油中乳剤といった多重エマルジョン、水分散体又は油性分散液、ゲル、クリーム、固体スティック、あるいはエアロゾールであっても良い。本発明によるエマルジョンは、例えば、クリーム、ローション、あるは化粧用ミルクの形で有益であり、例えば、油脂、油、ワックス、及び/又はその他の脂質を含み、並びに、水及び一又はそれ以上の乳化剤を含む。なぜなら、エマルジョンは通常、このような形の剤形で使用されるためである。
【0189】
いくつかの実施例では、本発明による局所投与用組成物は、組成に応じて、例えば、保護皮膚クリーム、クレンジングミルク、日焼け止めローション、栄養クリーム、デイクリーム、あるいはナイトクリーム、などとして使用することができる。
【0190】
局所投与用組成物は、このような調整に従来使用されている化粧品用活性成分、化粧用補助成分、及び/又は化粧品用添加物を含んでいても良い。これらは、例えば、抗酸化剤、防腐剤、殺菌剤、増粘剤、充填剤、消泡剤、香料、エッセンシャルオイル、顔料(例えば、フュームシリカ、酸化剤及びオプションで被覆酸化物、酸化チタン、窒化ホウ素、及び硫酸バリウムを含むケイ酸塩のような超微粒シリカ)、セラミド(天然セラミド又は天然セラミドの機能的疑態の何れか)、界面活性剤、乳化剤、リン脂質、コレステロール、フィトスフィンゴシン、ビタミン又はタンパク質(例えば、レチニル・パルミテート又はアセテート、パンテノール及びその誘導体のようなビタミンB、酢酸トコフェロールのようなビタミンE、ガンマリノレン酸エステルのような多価不飽和脂肪酸のようなビタミンF)といった追加的な有効成分、日焼け止め(化学的な日焼け止め及び分散した物理的な日焼け止めを含む)、安定剤、虫除け、アルコール、可塑剤、ポリオール、重合体、気泡安定剤、電解質、有機溶媒、シリコーン誘導体、保湿剤及び/又は保湿剤、油脂、油、ワックス、水、塩、タンパク質分解性又は角質溶解性活性物質など、を含む。このような添加物は、局所投与用の皮膚又は化粧品用成分に存在する。
【0191】
上述したように、局所送達用活性成分に加えて、本発明の局所組成物は、有益な効果をもたらす一又はそれ以上の追加の活性成分又は物質を含んでいても良い。例えば、特定の実施例では、局所組成物は、日焼け止め製品を含んでいても良い。これらは、好ましくは、本発明に用いる活性成分に加えて、少なくとも一の追加UVAフィルタ及び/又は少なくとも一のUVBフィルタ及び/又は少なくとも一の無機顔料を含む。
【0192】
UVBフィルタは油中あるいは水中に溶けるものでも良い。油中に溶ける物質の例は、例えば、3−ベンジリデンカンファー及びその誘導体、例えば3−(4−メチルベンジリデン)カンファー、4−アミノ安息香酸誘導体、好ましくは2−エチルヘキシル4−ジメチルアミノ安息香酸、アミル4−ジメチルアミノ安息香酸、桂皮酸エステル、好ましくは2−エチルヘキシル4−メトキシケイ皮酸、イソペンチル4−メトキシケイ皮酸、サリチル酸エステル、好ましくは2−エチルヘキシルサリチル酸塩、4−イソプロピルベンジルサリチル酸塩、ホモメチルサリチル酸塩;ベンゾフェノン誘導体、好ましくは2−ヒドロキシ−4−メトキシベンゾフェノン、2−ヒドロキシ−4−メトキシ−4’−メチルベンゾフェノン、2−2’−ジヒドロキシ−4−メトキシベンゾフェノン;ベンザルマロン酸エステル、好ましくはジ(2−エチルヘキシル)4−メトキシベンザルマロン酸、2,4,6−トリアニリノ−(p−カルボ−2’−エチル−1’−ヘキシルオキシ)−1,3,5−トリザン(trizane)、である。
【0193】
水中に溶ける有利な物質は、2−フェニルベンゾイミダゾール−5−スルホン酸及びその塩、例えば、ナトリウム、カリウム又はトリエタノールアンモニウム塩、ベンゾフェノンのスルホン酸誘導体、好ましくは2−ヒドロキシ−4−メトキシベンゾフェノン−5−スルホン酸及びその塩;例えば、4−(2−オキソ−3−ボルニリデンメチル)ベンゾスルホン酸、2−メチル−5−(2−オキソ−3−ボルニリデンメチル)スルホン酸及びそれらの塩のような3-ベンジリデンカンファーのスルホン酸誘導体、である。当然ながら、本発明によって使用できる上述のUVBフィルタのリストは、限定を意図するものではない。
【0194】
本発明によって使用できるUVAフィルタの例には、ジベンゾイルメタン誘導体、特に1−(4’−tert−ブチルフェニル)−3−(4’−メトキシフェニル) プロパン−1,3−ジエン及び1−フェニル−3−(4’−イソプロピルフェニル)プロパン−1,3−ジエンが含まれる。
【0195】
本発明によって使用できる無機顔料の例には、チタン、鉛、鉄、ジルコニウム、ケイ素、マンガン、アルミニウム、セリウムの酸化物及びこれらの混合物、及び当該酸化物が活性薬剤である修飾を含む。酸化チタンに基づく含量が最も好ましい。
【0196】
本発明によって使用することができる有益な抗酸化剤は、化粧品、及び/又は眼、及び/又は、皮膚への適用に適している又は通常使用しているすべての抗酸化剤である。抗酸化剤は、アミノ酸(例えば、グリシン、ヒスチジン、チロシン、トリプトファン)及びそれらの誘導体、イミダゾール(例えば、ウロカニン酸)及びそれらの誘導体、D,L0−カルノシン、D−カルノシン、L−カルノシン及びそれらの誘導体(例えば、アンセリン)などのペプチド、カロチノイド、カロチン(例えば、α−カロチン、β−カロチン、リコピン)及びそれらの誘導体、オーロチオグルコース、プロピルチオウラシル及びそれらのチオール(例えば、チオレドキシン、グルタチオン、システイン、シスチン、シスタミン及びそれらのグリコシル、N−アセチル、メチル、エチル、プロピル、アミル、ブチル及びラウリル、パルミトイル、オレイル、γ‐リノレニル、コレステリル及びグリセリルエステル)及びそれらの塩、チオジプロピオン酸ジラウリル、チオジプロピオン酸ジステアリル、チオジプロパン酸及びその誘導体(例えば、エステル、エーテル、ペプチド、脂質、ヌクレオチド、ヌクレオチド及び塩)及び、低耐性量の(例えば、pmol−μmol/kg)スルホキシミン化合物(例えば、ブチオニンスルホキシミン、ホモシステインスルホキシミン、ブチオニンスルホン、ペンタ−、ヘキサ−、ヘプタチオニンスルホキシミン)、さらに(金属)キレート剤(例えば、α‐ヒドロキシ脂肪酸、パルミチン酸、フィチン酸、ラクトフェリン)、α‐ヒドロキシ酸(例えば、クエン酸、乳酸、リンゴ酸)、フミン酸、胆汁酸、胆汁抽出物、ビリルビン、胆緑素、EDTA、EGTA及びそれらの誘導体、不胞和脂肪酸及びそれらの誘導体(例えば、γ−リノレン酸、リノレン酸、オレイン酸)、葉酸及びその誘導体、アラニン二酢酸、フラボノイド、ポリフェノール、カテコール、ユビキノン、ユビキノール及びそれらの誘導体、ビタミンC及び誘導体(例えば、アスコルビン酸パルミテート、リン酸アスコルビルMg、酢酸アスコルビル)、トコフェロール及び誘導体(例えば、酢酸ビタミンE)、及び安息香の安息香酸コニフェリル、ルチン酸及びその誘導体、フェルラ酸及びその誘導体、ブチルヒドロキシトルエン、ブチルヒドロキシアニソール、ノルジヒドログアイヤチク酸、ノルジヒドログアイヤレチン酸、トリヒドロキシブチロフェノン、尿酸及びその誘導体、マンノース及びその誘導体、亜鉛及びその誘導体(例えば、ZnO、ZnSO4)、セレン及びその誘導体(例えば、セレニウムメチオニン)、スチルベン及びその誘導体(例えば、スチルベンオキシド、トランススチルベンオキシド)及び本発明による好適な上述の有効成分のそれらの誘導体(例えば、塩、エステル、エーテル、糖類、ヌクレオチド、ヌクレオシド、ペプチド及び脂質)からなる群から有益に選択される。
【0197】
溶液、エマルジョン、あるいは分散液として提供されている場合、局所投与用組成物は、以下のように例示される溶材を含んでいても良い。水又は水溶液;カプリン酸又はカプリル酸のトリグリセリドのような、好ましくはヒマシ油といった油;油脂、ワックス及び他の天然及び合成脂質、好ましくは低炭素数のアルコール、例えば、イソプロパノール、プロピレングリコール又はグリセロールを有する脂肪酸のエステル、又は低炭素数のアルカン酸又は脂肪アコード(accord)を有する脂肪アルコールのエステル;アルコール、ジオール又は低炭素数のポリオール及びそれらの誘導体、好ましくは、エタノール、イソプロパノール、プロピレングリコール、グリセロール、エチレングリコール、エチレングリコールモノエチルエーテル又はエチレングリコールモノブチルエーテル、プロピレングリコールモノメチルエーテル、プロピレングリコールモノエチルエーテル又はプロピレングリコールモノブチルエーテル、ジエチレングリコールモノメチルエーテル又はジエチレングリコールモノエチルエーテル、及び類似物。更に、上述した溶材の混合物を使用することができる。特に、アルコール溶材について言えば、水が更なる要素である。
【0198】
本発明によるエマルジョン、アエロゲル、あるいは水分散体又は油性分散液の油相は、鎖長3乃至30炭素原子の飽和及び/又は不飽和型分枝及び/又は非分枝アルカンカルボン酸、及び、鎖長3乃至30炭素原子の飽和及び/又は不飽和型鎖長3乃至30炭素原子の分枝及び/又は非分枝アルコールのエステル群から、又は、芳香族カルボン酸と、鎖長3乃至30炭素原子の分枝及び/又は非分枝アルコールのエステル群から有益に選択される。この場合、このようなエステル油は、ミリスチン酸イソプロピル、パルミチン酸イソプロピル、イソプロピルステアラート、オレイン酸イソプロピル、ステアリン酸n−ブチル、ラウリン酸n−ブチル、オレイン酸n−デシル、ステアリン酸イソオクチル(isoctyl stearate)、ステアリン酸イソノニル、イソノナン酸イソノニル、パルミチン酸2−エチルヘキシル、ラウリン酸2−エチルヘキシル、ステアリン酸2−ヘキシルデシル、パルミチン酸2−オクチルドデシル、オレイン酸オレイル、エルカ酸オレイル、オレイン酸エルシル、エルカ酸エルシル、及びこのようなエステルの合成、半合成及び天然の混合物、例えばホホバオイルからなる群から有益に選択することができる。
【0199】
更に、この油相は、分枝及び/又は非分枝炭化水素及び炭化水素ワックス、シリコーン油、ジアルキルエーテルからなる群、飽和及び/又は不飽和型分枝及び/又は非分枝アルコールと、脂肪酸トリグリセリド、すなわち、鎖長8乃至24、特に12乃至18炭素原子の飽和及び/又は不飽和型分枝及び/又は非分枝アルカンカルボン酸のトリグリセロールエステルとからなる群から有益に選択される。例えば、脂肪酸トリグリセリドは、例えば、オリーブオイル、ひまわり油、大豆油、ピーナッツ油、菜種油、アーモンドオイル、ヤシ油、ココナツオイル、パーム核油等の合成、半合成及び天然オイルのグループからなる群から有益に選択される。これらのオイルとワックス成分の任意の混合物も本発明によって有益に使用される。適当であれば、例えば、パルミチン酸セチルなどのワックスは、唯一の油相脂質であるので、有益に使用することができる。
【0200】
油相は、例えば、2−エチルヘキシルイソステアラート、オクチルドデカノール、イソノナン酸イソトリデシル、イソエイコサン(isoeicosan)、2−エチルヘキシルココエート、C12−15−安息香酸アルキル、カプリル/カプリン酸トリグリセリド、ジカプリリルエーテルからなる群から有益に選択される。特に有利な混合物は、C12−15−安息香酸アルキル及び2−エチルヘキシルイソステアラートの混合物、C12−15−安息香酸アルキル及びイソノナン酸イソトリデシルの混合物、及びC12−15−安息香酸アルキル、及び2−エチルヘキシルイソステアラート及びイソノナン酸イソトリデシルの混合物である。炭化水素に関しては、液体パラフィン、スクワラン、及びスクワレンを本発明によって有益に使用することができる。油相は、環状又は線状シリコーンオイルを含み、あるいは、全体的にこのオイルでなるが、シリコーンオイルとは別に、その他の追加の油相成分を含むことがより有益である。シクロメチコーン(オクタメチルシクロテトラシロキサン)は、本発明によって使用するシリコーンオイルとして有益に用いられる。しかしながら、例えば、ヘキサメチルシクロトリシロキサン、ポリジメチルシロキサン、ポリ(メチルフェニルシロキサン)といったその他のシリコーンオイルも本発明によって有益に用いることができる。特に有益な混合物は更に、シクロメチコーン及びイソノナン酸イソトリデシルの混合物、及びシクロメチコーン及び2−エチルヘキシルイソステアラートの混合物である。
【0201】
適当である場合は、本発明による調剤の水相は、アルコール、ジオール又は低炭素数のポリオール、及びそれらのエステル類、好ましくは、エタノール、イソプロパノール、プロピレングリコール、グリセロール、エチレングリコール、エチレングリコールモノエチルエーテル又はエチレングリコールモノブチルエーテル、ポリエチレングリコールモノメチルエーテル、ポリエチレングリコールモノエチルエーテル又はポリエチレングリコールモノブチルエーテル、ジエチレングリコールモノメチルエーテル又はジエチレングリコールモノエチルエーテル及び類似物、更に、例えばエタノール、イソプロパノール、1,2−プロパンジオール、グリセロールといった低炭素数のアルコール、及び、特に、例えば、ヒアルロン酸、キサンタンゴム、ヒドロキシプロピルメチルセルロースなどの、二酸化シリコン、ケイ酸アルミニウム、多糖及びそれらの誘導体からなるグループから選択された一又はそれ以上の増粘剤を有益に含み、ポリアクリル酸塩からなる群、好ましくはカーボポールと呼ばれる群、例えば型番980、981、1382、2984及び5984のカーボポールからなるポリアクリル酸塩が、単独で又は組み合わせて特に有益である。
【0202】
本発明によって使用するゲルは、通常、低炭素数のアルコール、例えば、エタノール、イソプロパノール、1,2−プロパンジオール、グリセロールと水、あるいは、増粘剤が存在する上述のオイルを含む。この増粘剤は、油性アルコールゲルの場合は、二酸化シリコン又はケイ化アルミニウムであることが好ましく、水性アルコールゲルの場合は、ポリアクリレートが好ましい。
【0203】
固体スティックは、例えば、天然又は合成ワックス、脂肪アルコール又は脂肪酸エステルを含む。本発明による化粧用スティックとしての使用に適した普通の基礎材料は、液状オイル(例えば、液体パラフィン、ヒマシ油、ミリスチン酸イソプロピル)、半固体成分(例えば、ワセリン、ラノリン)、固体成分(例えば、蜜蝋、セレシン、微晶ワックス、あるはオゾケライト)、及び、高融点ワックス(例えば、カルナバワックス、カンデリラワックス)である。
【0204】
本発明による化粧品及び/又は皮膚用調剤に適した、アエロゾール容器からスプレイできる高圧ガスは、通常知られている揮発性の液化高圧ガスであり、例えば、単体で、あるいは互いの混合物として使用できる炭化水素(プロパン、ブタン、イソブテン)である。加圧空気も有益に使用することができる。当業者には、もちろん、アエロゾール調剤の形で原理的に本発明の実施に適する非毒性の高圧ガスがあることは自明である。しかし、特に、フッ化炭化水素とフルオロクロロ炭化水素(FCHCs)中の高圧ガスは、環境あるいはその他の付属する周囲に受け入れられない作用があるため、このガスを用いることなく対処することが推奨される。
【0205】
本発明による局所投与用組成物は、有効量の本発明の活性成分と通常使用される溶材のみならず、有機増粘剤も含むゲルの形状であっても良い。このような増粘剤には、アラビアゴム、キサンタンゴム、アルギン酸ナトリウム、セルロース誘導体、好ましくはメチルセルロース、ヒドロキシメチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、又は例えばベントナイトのようなケイ酸アルミニウムといった無機増粘剤、又はポリエチレングリコール及びステアリン酸塩ポリエチレングリコール又はジステアリン酸ポリエチレングリコールの混合物が含まれる。
【0206】
上述の活性成分を含有する許容できる化粧品/皮膚用キャリア剤形の一例は、以下の成分:キサンタンゴム;グリセリン99.7%;四ナトリウムEDTA;ステアリン酸グリセリル及びPEG−100ステアリン酸塩(ARLACEL(登録商標)165);セチルアルコール;パルミチン酸イソプロピル;ブチル化ヒドロキシトルエン(BHT);メチルパラベン;プロピルパラベン及び純水を含むものでも良い。上述の活性成分を含有する許容できる化粧品/皮膚用キャリア剤形の別の例は、以下の成分:ステアリン酸;セチルアルコール;ラウレス4;CARSONOL(登録商標)Sles;プロピルパラベン;パルミチン酸アスコルビル;プロピレングリコール;CARBOPOL(登録商標)974P;メチルパラベン;KOH(10%);及び水を含むものでも良い。
【0207】
上述の組成物は、例えば、以下の工程によって調整することができる:
1.ステアリン酸、セチルアルコール、ラウレス4、プロピルパラベン、及び、パルミチン酸アスコルビルを合わせて、油相を溶かす;
2.ガラスビーカで、プロピレングリコールと水を合わせて、高速プロペラ攪拌でメチルパラベンとCARBOPOL(登録商標)を分散させる;
3.CARSONOL(登録商標)Slesをステップ(2)の製品に加える;
4.ステップ(3)の製品を65−70℃に温める;
5.混合して、ステップ(1)の製品をステップ(4)の製品に加え、良くかき混ぜる;
6.混合物を40℃に冷却する;
7.溶媒部分を加えて、手でよくかき混ぜる;
8.KOH溶液を加えて中和する;
9.光から防護する。
【0208】
概論
各ケースにおいて、組成物は一又はそれ以上の活性成分を好適に含み、この成分は、A/B−cisスピロスタン又はスピロステンステロイドサポゲニン及びこれらのエステル、エーテル、ケトン、及びこれらのグリコシル化型、その他の非サポ(ゲ)ニン活性薬剤、あるいは任意の組み合わせである。この組み合わせは、一又はそれ以上の生物学的不活性成分、例えば、希釈剤、キャリア、賦形材、を含んでいても良く、この成分が生理活性成分の提示、投与又は送達に関連する目的で作用する、あるいは、活性成分の生理学的効果とは別に対象に関連する利点を提供する。キャリアは、大豆たんぱく質などの植物材料を含んでいても良い。この組成物は、投与モードの特性と投与形態に応じて、保存剤、充填剤、崩壊剤、湿潤剤、乳化剤、懸濁化剤、甘味料、香味料、香料、抗菌材、抗カビ剤、潤滑剤、及び分散剤を含んでいても良い。
【0209】
本発明に使用する組成物、特に、薬学的組成物は、単位量投与形でもよく、ここでは、ある数のこのような投与形を、治療又は予防する症状に応じて、所定の時間内に対象に投与する。代替的に、この組成物は、バルク形であっても良く、この場合、所定の重量又は容量のバルク組成物を測って、治療又は予防する症状に応じて、所定の時間内に対象に投与する。
【0210】
しかしながら、高い投与量であっても、毒性はこれらの活性薬剤に付随する問題であるとは考えられない。適当な投与量の選択は、従って、過度の負担をかけることなく当業者の能力で行うことができる。約0.3mg/kg体重を超える活性薬剤の投与量は、好ましくは、1日1回投与される。より典型的には、投与量は約0.1乃至約25mg/kg、例えば約1乃至約10mg/kgであり、好ましくは1日2回投与される。成人に使用する場合は、投与量は、1日当たり約10乃至約700mgであるのが好ましい。
【0211】
本発明に使用する組成物は、上述したように、その他の治療及び/又は非治療生物活性薬剤を好適に含んでいても良い。
【0212】
本発明に使用する組成物は、単位量投与形であっても良く、ある数のこのような投与形を、治療又は予防する症状に応じて、所定の時間内に対象に投与する。代替的に、この組成物は、バルク形であっても良く、この場合、所定の重量又は容量のバルク組成物を測って、治療又は予防する症状に応じて、所定の時間内に対象に投与する。
【0213】
活性薬剤の必要な投与量は、治療あるいは予防する症状の重篤度に応じて広く変化する。例えば、約1fMないし約5μMといった、フェムトモルからミクロモル範囲の濃度が有効である。実施例12に報告されている実験は、培地中の神経の損傷に対して、インビトロでEC5013.4fMのスミラゲニンを示している。一般的に、ピコモルからミクロモルの範囲のインビボでの血漿濃度(例えばナノモルからミクロモル範囲)は、例えば約1mP以上、例えば約1mP乃至約5μM、例えば、約1pM乃至約3μM、例えば約10pM乃至約700nM、例えば、約0.1nM乃至約500nM、が好ましい。ピコモル以下では、活性薬剤のインビボでの活動が減る傾向にある。ミクロモル以上では、対象の過投与に対する自己制御及び関連する抵抗は、単に、活性薬物が排出されることを意味する。しかしながら、本出願の例では、投与量が高い場合でも、毒性がこれらの活性薬剤の問題であるとは考えられない。従って、適宜の投与量の選択は、過剰な負荷をかけることなく当業者の能力の範囲で行うことができる。活性薬剤を投与した量は、例えば、約0.1mg/kg体重より大きくても、約0.3mg/kg体重より大きくてもよく、好ましくは1日1回投与される。より典型的には、この投与量は、約1.0乃至約25mg/kgであり、例えば、約1乃至約10mg/kgであり、好ましくは1日1回投与される。成人に使用する場合は、投与量は、1日当たり約10乃至約700mgであるのが好ましい。
【0214】
好適な組成物の形及び投与量の更なる詳細、及び、本発明によって治療可能な症状及び疾病の例については、WO−A−99/48482、WO−A−99/48507、WO−A−01/23407、WO−A−01/23408、WO−A−02/079221、WO−A−03/082893、WO−A−2005/105825、WO−A−2006/048665を参照されたい。
【0215】
この活性薬剤は、組成物中の一又はそれ以上のキャリア、賦形剤、及び/又は希釈剤と共に調整することが好ましい。一般的には、薬学的組成物、食材、フードサプリメント、及び飲料など経口組成物、あるいは化粧品、眼あるいは皮膚の調整材など局所的組成物に使用される従来のキャリア、賦形剤及び/又は希釈剤を使用することができる。
【0216】
多くの活性薬剤が比較的脂溶性であり、この場合、可溶化剤、懸濁化剤、及び/又は分散剤を好適に用いて、活性薬剤を組成物中の溶液、懸濁液あるいは分散液中に維持することができる。
【0217】
特に挙げることができる二群の可溶化剤、懸濁化剤、及び/又は分散剤は、MCTsと、中鎖脂肪酸(MCFAs)である。これらは、鎖長が約4乃至12炭素原子の脂肪酸を有する脂溶性化合物である。
【0218】
MCTsの好ましい例は、以下の一般式(I)で表わされる。

ここで、Ra、Rb、及びRcは、互いに独立して、炭素骨格に4乃至12炭素原子を有する飽和又は不飽和脂肪酸残渣から選択される。
【0219】
MCFAsの好ましい例は、以下の一般式(II)で表わされる。

ここで、Rdは、炭素骨格に4乃至12炭素原子を有する飽和又は不飽和脂肪酸残渣である。
【0220】
Ra、Rb、Rc及びRdの例には、カプロン酸(C6:0)、カプリル酸(C8:0)、カプリン酸(C10:0)、ラウリン酸(C12:0)の残渣が含まれる。標準的な命名システムでは、Cの文字の直後の数は、炭素鎖長を表わし、コロンの直後の数字は不飽和結合を示す。このようなMCTsや、MCFAsは、ココナッツ油、ヤシカーネル油、及びカンファー石果(果実)といった天然源から公知の方法で得られる。一又はそれ以上の脂肪酸の残渣は、商業的なMCTs又はMCFAs製品の中に存在する。
【0221】
本発明で使用するMCTsは、例えば、トリ−C6:0MCT、トリ−C8:0MCT、及び、トリ−C10:0MCTから選択することができる。
【0222】
産業上の利用可能性と有用性
本発明は、ヒト及び非ヒト哺乳動物における、最初の、NFs介在の障害と機能の治療的及び非治療的治療の自己制御方法を可能とするものであり、生理学的応答が容量依存的でないが、活性薬剤の比較的広範囲にわたる容量で自己制御が行われる一方、副作用や毒性なしに、予測可能で有益な生理学的効果という点では、比較的狭い「治療窓」を提供している。従って、治療は、比較的広い制限内で過投与に耐える。この性質は、自己投与あるいは臨床設定外のその他の状況と、これまではわからなかった神経及びその他の治療の特徴を好適なものにする。薬剤が小分子であって、ペプチドではない(例えば、タンパク質)との事実は、さらに、脳あるいはCNS内へペプチド活性薬剤を直接投与する複雑な送達装置が入手できない臨床設定外で、本発明の潜在的有用性を支持している。
【0223】
神経性、精神性、炎症性、アレルギー性、免疫性、あるいは腫瘍性疾患を患っている多くの患者は比較的年をとっている、あるいは健康状態があまり良くないので、これらの患者は、これらのカテゴリィ以外の病気にかかりやすいことがある。しばしば、どの範囲のその他の病気又は症状が生じるのかは、確実に予測することができない。本発明以前には、このようなその他の疾患又は症状、あるいはこれらへの個々の感染しやすさは、このような患者のこのような他の疾患又は症状を促進する実質的リスクを治療が運ぶことが非常に多いため、主疾患の治療と矛盾するものであった。従って、以前より簡単で単純な方法であり、より広い患者群にこの方法で適用可能な、疾患及び症状を治療する本発明の有用性は、ヒト及び動物の健康のこれらの重要な領域における医学及びヘルスケア実施を実質的に前進させる。
【図面の簡単な説明】
【0224】
更なる説明のために、本発明を支持するデータを、純粋に例示により、限定することなく以下に述べる。
【図1】図1は、MMP+誘発損傷に対するニューロンの保護に関する、ニューロンのスミラゲニン予治療の効果を示す。
【図2】図2は、(a)複合筋活動電位(CMAP)の振幅、(b)グリッド試験、(c)進行性運動ニューロン疾患(pmm)マウスの生存率、に関するサルササポゲニンの効果を示す。
【図3】図3は、CMAPの(a)振幅、(b)待ち時間、(c)時間の経過につれて神経が損傷したマウスの期間、に関するサルササポゲニン、スミラゲニン、及び4−メチルカテコールの効果を示す。
【0225】
実施例と図面の詳細な説明
以下の実施例と図面の説明において、以下の略語を用いる。h=時間;min=分;s=秒;s.c.=皮下;p.o=経口。固体内固体、液体内固体、あるいは固体内液体である組成物の成分のパーセンテージは、重量パーセンテージである。液体内液体である組成物の成分のパーセンテージは、体積パーセンテージである
【0226】
実施例1
いくつかの酵素及び受容体に結合しないサルササポゲニン及びスミラゲニン
以下の表1に挙げた酵素の活性に関するサルササポゲニンの効果及び、以下の表1に挙げた受容体へのサルササポゲニンの結合を調査した。
【0227】
酵素の活性調節を以下の方法を用いて調査した。サルササポゲニンを各酵素と、各酵素用の特別な基体を用いてインキュベートした。インキュベーション期間経過後、反応が止まり、サルササポゲニンの欠如下及び存在下での特別な基体の減少あるいは特別な生成物の増加を測定し、サルササポゲニンの存在下における反応抑制のパーセンテージを計算した。使用した酵素の量、インキュベーション条件、使用した物質及び定量方法は、特定の各アッセイによって変わる。
【0228】
以下の方法を用いて、受容体の結合を調査した。サルササポゲニンを、対象の受容体を発現する組織又は細胞均等質と、既知の濃度の、対象の受容体に対して親和性のある放射性標識化合物と共にインキュベートした。インキュベーションの後、非結合放射性標識化合物を除去し、特定の結合量を定量した。サルササポゲニンの欠如及び存在下での特定の結合量を比較して、サルササポゲニンによる放射性標識化合物の結合抑制のパーセンテージを計算した。受容体源、インキュベーション条件、使用する放射性標識化合物は、各特定のアッセイによって変わる。
【0229】
結果を表1に示す。
表1 酵素及び受容体結合アッセイのサルササポゲニンの効果

【0230】
上述したものと同じ方法を用いて、以下の表2に挙げた受容体に対するスミラゲニン(1μM)の結合、及び、以下の表2に挙げた酵素の活性についてのスミラゲニンの効果を調査した。
【0231】
表2 受容体結合アッセイと酵素のスミラゲニンの効果






【0232】
サルササポゲニンとスミラゲニンは、ある範囲の受容体には結合せず、ある範囲の酵素の活性は変化しない。これらの受容体と酵素は、神経経路、感覚経路、及び運動経路に含まれることが分かっているので、これらの実験で得られた知識の制限内において、神経、感覚及び運動に源をもつ症状及び疾患に対するサルササポゲニンとスミラゲニンの活性は、受容体の結合あるいは酵素の変化を通じて生じるものではない、と推定される。
【0233】
実施例2
サルササポゲニンとスミラゲニンは、インビトロでの基本条件下で培養したニューロンにおける神経栄養因子mRNAを一次的に増やす
特殊化した媒体と条件を用いて、新鮮な単離したニューロンをインビトロで培養することができる。このインビトロ環境は、生理学的なものとは異なり、ニューロンがより大きなストレスを受けて、神経損傷が生じる。神経損傷のレベルは、使用する詳細な条件に応じて、培地によって異なる。従って、神経損傷のレベルは、病理学的物質(例えば、β−アミロイド又はMPP+)を加えることによって有意に増加する。
【0234】
ラットの皮質ニューロンを、上述した方法(Singer,et al.,Neuroscience Letters,1996,212,pp.13−16)の変形によって培養した。培養開始後12日目に、サルササポゲニン(30nM)、スミラゲニン(30nM)、4−メチルカテコール(0.5mM)、NFG及びBDNFの誘導物質放出(Saporito et al.,Experimental Neurology.,1993,123,pp.295−302;Nitta et al.,Journal of Pharmacology and Experimental Therapeutics,1999,291,1276−1283)又はビークル(ジメチル・スルホキシド、DMSO、0.25%)を加えて、1時間、3時間、あるいは6時間おいた。インキュベーション後、全ての伝令リボ核酸(mRNA)を、リアルタイムで逆転写ポリメラーゼ連鎖反応法(rtRT−PCR)を用いて定量した。
【0235】
この結果を以下の表3に示す。
表3 インキュベーションの1、3及び6時間後の、ラット皮質ニューロンにおけるBDNF及びtrkB mRNA発現についての、サルササポゲニン、スミラゲニン、及び4−メチルカテコールの効果

【0236】
サルササポゲニンとスミラゲニンの両方とも、新鮮な単離した皮質ニューロンにおいて、BDNFとBDNF受容体trk−B(チロシン受容体キナーゼニューロトロフィン受容体)のmRNAのレベルを一時的に上げた(3時間後)。
【0237】
別の実験において、ラットの皮質ニューロンを、上述の方法を変形して培養した(Eckenstein and Sofroniew,Journal of Neuroscience,1983,3,pp.22826−2291)。8日目に、培地を、ビークル(DMSO、0.5%)又はスミラゲニン(10μM)を含む媒体に48時間交換して、皮質ニューロンのBDNF mRNAのレベルを、rtRT−PCRで評価した。
【0238】
その結果を以下の表4に示す。
【0239】
表4 ラットの皮質ニューロンにおけるBDNF mRNAのサルササポゲニンを用いた48時間インキュベーションの効果

【0240】
スミラゲニン(10μM)を用いた48時間インキュベーションは、新鮮な遊離皮質ニューロン中のBDNF mRNAレベルを上げなかった。これは、スミラゲニンとサルササポゲニンが6時間ではなく、3時間でBDNF mRNAを上げたことを示す表3のデータと一致している。更に、スミラゲニンの一時的効果(表3)は高濃度のスミラゲニン(表4)によっては克服されなかった。
【0241】
実施例3
スミラゲニンはインビトロで病原体に露出させた培養ニューロンにおいて神経栄養因子mRNAを有意に増加させる
スミラゲニンは予めβ−アミロイドに露出させた皮質ニューロン中のBDNF mRNAを増加させる。
【0242】
ラットの皮質ニューロンを、上述の方法(Eckenstein and Sofroniew,Journal of Neuroscience,1983,3,pp.2286−2291)の変形によって培養した。8日目に、培地をビークル(DMSO、0.5%)あるいはスミラゲニン(10μM)を含む培地に交換した。10日目に、ラットの主な皮質ニューロンをβ−アミロイド(10μg/ml)に、最大48時間37℃で露出させ、続く48時間中、皮質ニューロン中のBDNF mRNAを、rt RT−PCRによって評価した。
【0243】
その結果を表5に示す。
【0244】
表5 β−アミロイドへ露出した後48時間スミラゲニンでの予インキュベーションがラットの皮質ニューロン中のBDNF mRNAを増加させる

【0245】
β−アミロイドへの露出に続く48時間のスミラゲニンによる予処理によって、ラットの皮質ニューロンにおけるBDNF mRNAの発現が有意かつ持続的に増えた。
スミラゲニンは、MPP+に予め露出させたドーパミン作動性ニューロン中のBDNF mRNAを増加させる。
【0246】
ラットのドーパミン作動性ニューロンは、上述の方法(Brouard et al.,Journal of Neuroscience,1992,12,pp.1409−1415)を若干変形させて調整した。培地MPP+(2μM)中で、5日後に、特定のドーパミン作動性神経毒、あるいはビークル(食塩水)を加えて48時間置いた。次いで、培地を、スミラゲニン(10μM)又はビークル(DMSO、0.25%)を含有する新鮮な培地と交換して、10分後、2時間後、24時間後、48時間後、及び72時間後に、rt RT−PCRによってドーパミン作動性ニューロン中のGDNF mRNAを評価した。
【0247】
この結果を以下の表6に示す。
【0248】
表6 スミラゲニンは、MPP+に露出させた後に、ラットドーパミン作動性ニューロン中のGDNF mRNAの発現を増加させる

【0249】
MPP+に露出させた後48時間スミラゲニンで処理を行うことによって、ラットのドーパミン作動性ニューロン中のGDNF mRNAが有意に増加した。この増加は、24時間で最大であり、次いで48時間、72時間後は減少した。
【0250】
実施例2及び3は、スミラゲニンとサルササポゲニンが、神経栄養因子mRNAの発現を増加させることを示している。更に、神経栄養因子mRNA発現に対するスミラゲニンとサルササポゲニンの効果は、ニューロンの状況に応じてある程度(期間と大きさ)変化する。基本条件下で培養した神経では、スミラゲニンとサルササポゲニンが、神経栄養因子mRNAレベルを一次的に増加(最大で、コントロールの140%)させ、これは、6時間(表3)又は48時間(表4)ではなく、3時間(表3)で観察された。反対に、病原体(例えばβ−アミロイドあるいはMPP+)に露出させた培養したニューロンでは、スミラゲニンが、神経栄養因子mRNAの発現をより明確に(最大でコントロールの3319%)かつより長い期間(最大72時間)増加させた(表5及び6)。この結果は、サルササポゲニンとスミラゲニンの神経栄養誘導因子効果が、システムの損傷の度合いに基づいて、自己制御すること、すなわち、サルササポゲニンとスミラゲニンは、神経栄養因子の自己制御メカニズムを壊すあるいはこれに優先することがない、ことを示している。
【0251】
実施例4
スミラゲニンは、インビトロでの基本条件下で培養したニューロン中の神経栄養因子の発現を変えない
ラットの皮質ニューロンを、上述の方法(Eckenstein and Sofroniew,Journal of Neuroscience,1983,3,pp.2286−2291)の変形によって培養した。8日目に、培地をビークル(DMSO、0.5%)あるいはスミラゲニン(10μM)を含む培地に交換した。12日目に、培地中のBDNF濃度を測定した。
【0252】
この結果を以下の表7に示す。
【0253】
表7 スミラゲニンを用いたインキュベーションは、インビトロでの基本条件下で培養したニューロン中のBDNFたんぱく質レベルを変えない

【0254】
スミラゲニンは、インビトロでの基本条件下で培養したニューロン中のBDNFレベルを増加させない。
【0255】
実施例5
サルササポゲニンとスミラゲニンは、インビトロで病原体に発現した、培養したニューロン中の神経栄養因子タンパク質発現を増加させる
サルササポゲニンとスミラゲニンは、BDNFたんぱく質を増やし、β−アミロイドに予め露出させた皮質ニューロンにおけるニューロンの生存と神経突起伸長を増加させる。
【0256】
ラットの皮質ニューロンを、上述の方法(Eckenstein and Sofroniew,Journal of Neuroscience,1983,3,pp.2286−2291)の変形によって培養した。8日目に、培地をビークル(DMSO、0.5%)あるいはスミラゲニン(10μM)を含む培地に交換した。10日目に、ラットの主な皮質ニューロンをβ−アミロイド(10μg/ml)に、最大48時間37℃で露出させ、培地中のBDNF濃度、コリンアセチルトランスフェラーゼ(ChAT)が溶性の細胞の数、及び、神経突起成長を測定した(スミラゲニンのみ)。
【0257】
この結果を以下の表8に示す。
【0258】
表8 スミラゲニン又はサルササポゲニンで48時間予インキュベーションした後β−アミロイドに露出させることで、BDNFたんぱく質レベルがあがり、インビボでニューロン損傷とニューロン委縮が防止される

【0259】
サルササポゲニンとスミラゲニンは、BDNFレベルをコントロールのレベルより上げて、皮質ニューロンにおけるβ−アミロイド誘発ニューロン損傷を防止する。
【0260】
スミラゲニンは、GDNFたんぱく質を上げて、予めMPP+に露出させたドーパミン作動性ニューロンにおけるニューロンの生存と神経突起伸長を増やす。
【0261】
ラットのドーパミン作動性ニューロンは、上述の方法(Brouard et al.,Journal of Neuroscience,1992,12,pp.1409−1415)を若干変形させて調整した。6日後に培地を、スミラゲニン(10μM)又はビークル(DMSO、0.25%)を含有する新鮮な培地と交換した。8日目にMPP+(2μM)あるいはビークル(食塩水)を加えて、48時間後にドーパミン作動性ニューロン中を染色して、培地中のGDNF濃度、ニューロン損傷、及び神経突起伸長を評価した。
【0262】
この結果を以下の表9に示す。
【0263】
表9 スミラゲニンは、培地中のGDNFの量を増やし、MPP+に露出させた後のラットのドーパミン作動性ニューロンにおけるニューロン損傷とニューロン委縮を防止する

【0264】
スミラゲニンは、GDNFの量を増やし、ドーパミン作動性ニューロン中のMPP+誘発性のニューロン損傷を防止する。
【0265】
実施例4に示すデータは、インビトロで基本条件下では培養したニューロンにおける神経栄養因子タンパク質発現を増やさないことを示す。反対に、実施例5は、サルササポゲニンとスミラゲニンが、インビトロで病原体に露出させた培養したニューロン中の神経栄養因子タンパク質発現を増やすことを示している。従って、神経栄養因子タンパク質についてのサルササポゲニンとスミラゲニンの効果は、神経栄養因子mRNAについての効果と同じである。すなわち、サルササポゲニンとスミラゲニンは、神経栄養因子の自己制御メカニズムを壊すあるいはこれに優先することがないが、実際は、ニューロンの必要性に応じて、その影響を受ける。
【0266】
BDNF、trk−B及びGDNFは、神経経路、感覚経路及び運動経路に関係することが知られているので、これらの実験から得られた知識の制限内で、神経源、感覚源及び運動源に対するサルササポゲニンとスミラゲニンの活性が、神経栄養因子とその受容体の強化された遺伝的発現を具えると推定される。
【0267】
実施例6
サルササポゲニンとスミラゲニンは、老化した動物中のBDNF濃度を回復させる
老齢のスプラーグドーリー(SD)ラット(20月令)に、サルササポゲニンとスミラゲニン(18mg/kg/日)を3ヶ月間経口で投与した。若いラットの脳に比べて、年取ったラットの脳においてBDNFが有意に低減した。若いSDラット(4月令)を健康な陽性対象として使用した。処理の終盤において、脳を除去してELISAを用いてBDNFの定量した。
【0268】
その結果を以下の表11に示す。
【0269】
表11 サルササポゲニンとスミラゲニンは、老齢のラットにおけるBDNFレベルの低下を反転させ、BDNFレベルを若い状態に戻す

【0270】
サルササポゲニンとスミラゲニンを、3ヶ月間老齢のラットに経口投与し、老齢の動物のBDNFの低下を、若く健康なラットに観察されるレベルに戻した。すなわち、この薬剤は、老齢のコントロールラットに比べてBDNFレベルを有意に上げる。
【0271】
このデータは、BDNF発現に関するこの薬剤の効果が、長期投与における正常化効果であることを示している。すなわち、ほぼ正常な状態に戻ることを制限することによって、処置を行った動物を薬剤への過剰露出に対して保護する長期の調節作用がある。
【0272】
この実施例は、ここで引用により組み込まれているPCT特許出願第WO−A−03/082893号の実施例9の実験に合致している。この実験は、加齢に関連するBDNF、ドーパミン受容体、及びムスカリン性アセチルコリン受容体のラットにおける低下が、スミラゲニン又はサルササポゲニンによって有意に低減する、あるいは回復することを示した。
【0273】
実施例7
スミラゲニンは、MPTP−障害マウスの線条体におけるBDNFとGDNF濃度を上げる
7週令のオスC57bl/マウス(C57マウス)に毎日、1−メチル−4−フェニル−1,2,3,6−テトラヒドロピリジン(MPTP、25mg/kg/日、腹腔内、連続5日間)を注射し、スミラゲニン(10mg/kg/日)又はビークル(ヒドロキシプロピルメチルセルロース、ツイーン80 0.2% v/vを含有するHPMC 0.5% w/v)を60日間経口投与し、その後、脳を切り取って、ELISAを用いて、GDNFとBDNFの線条体レベル、及び、[I125]−RTI結合を用いてドーパミン輸送体(DAT)レベルの定量化を行った。DATはドーパミン作用性ニューロンに対するニューロン損傷のマーカーである。
【0274】
神経毒MPP+によって生じた損傷、すなわちMPTPの代謝産物は、パーキンソン病などの神経変性疾患に観察される黒質線条体ドーパミン作用性ニューロンの変性に似ている(Mytinlineou et al,Science,225,529−531(1984))。この毒性によって誘発される最も顕著な生化学的変化には、ドーパミンレベルの上昇、及び中脳黒質緻密部と尾状核におけるこの代謝物質(Burns et al,Proc.Natl.Acad.Sci.USA,80,4546−4550(1983))と、黒質線条体シナプトソーム生成におけるドーパミン摂取の低減(Heikkila et al,J.Neurochem.,44,310−313(1985))が含まれる。
【0275】
このように、この実験で用いたMPTPで処理したマウスは、パーキンソン病と同様の運動感覚神経変性症状の受容モデルを提供している。
【0276】
この結果を以下の表12と13に示す。
【0277】
表12 スミラゲニンは、MPTP障害マウスにおける線条体GDNFとBDNFを増やす

【0278】
表13 スミラゲニンは、MPTP障害マウスにおける線条体DATレベルを増やす

【0279】
MPTP障害マウスへ60日間経口投与したスミラゲニンは、線条体GDNF及びBDNFレベルを大幅に上げて、MPTPが誘発したDAT結合のロスを有意に防止する。
【0280】
この実施例は、ここで引用により組み込まれているPCT特許出願第WO−A−03/082893号の実施例6及び7の実験に合致している。これらの実験は、スミラゲニン又はサルササポゲニンで、中脳ドーパミン作用性ニューロンをラットに予め処理することで、インビトロでMPP+誘発神経変性を有意に防止あるいは回復させることを示した。
【0281】
同様の実験で、10週令のオスC57マウスに毎日、MPTP(25mg/kg/日、腹腔内)を連続5日間(1−5日)注射し、スミラゲニン(10mg/kg/日)又はビークル(ツイーン80 0.2% v/vを含有するPMC 0.5% w/v)を61日間(12−72日)、又は71日間(2−72日)経口投与し、その後、脳を切り取って、DATの線条体レベルの定量化を行った。DATはドーパミン作用性ニューロンに対するニューロン損傷の範囲のマーカーである。
【0282】
その結果を以下の表14に示す。
【0283】
表14 スミラゲニンは、マウスの線条体DATレベルにおけるMPTP誘発の低下を回復させる

【0284】
コントロールマウスに71日間経口投与したスミラゲニンは、ビークルのみを投与されたコントロールマウスに比べて、線条体DATレベルを変えない。MPTP障害マウスに61日又は71日間経口投与したスミラゲニンは、MPP誘発線条体DATレベルの低下を有意に回復させる。
【0285】
実施例8
サルササポゲニンとスミラゲニンは、皮質ニューロン、脊髄運動ニューロン、及び感覚ニューロンにおける神経突起生成を増やす
【0286】
皮質ニューロン
ラットの皮質ニューロンを、上述の方法(Singer,et al.,Neuroscience letters,1996,212,pp.13−16)の変形によって培養する。細胞を、サルササポゲニン、スミラゲニン、ビークル(DMSO 0.25%)、GDNF、BDNF、あるいはNGFで24時間培養した。各群について、神経突起を示しているニューロンを示す15枚の写真を各フィールドで任意に選択して、各ニューロンについて最も長い神経突起を測定した。神経突起を示しているニューロンの数と、神経突起を示していないニューロンの数と、各フィールドにおける総ニューロン数を計数することで神経突起の数を測定した。各ウエルにつき6つのフィールドを調べた。
【0287】
この結果を以下の表15に示す。フィールドごとの線条体があるニューロンの数は、フィールドごとの総ニューロン数のパーセンテージで表わしている。
【0288】
表15 サルササポゲニンとスミラゲニンは、皮質ニューロン中の神経突起生成を増やす

【0289】
サルササポゲニンとスミラゲニンは、ラットの主な皮質ニューロンにおいて、存在する神経突起の長さと、神経突起を表わすニューロンのパーセンテージを有意に増やす。サルササポゲニンとスミラゲニンへの露出に続く神経突起の伸長の効果は、陽性コントロール、GDNF、BDNF及びNGFに観察される効果と比較できる。
【0290】
この実施例は、ここで引用により組み込まれているPCT特許出願第WO−A−03/082893号の実施例5の実験に合致している。この実験は、ラットの主な皮質ニューロンをサルササポゲニン又はスミラゲニンで処理することが、存在する神経突起の長さと、神経突起を表わすニューロンのパーセンテージを有意に増やすことを示した。
【0291】
サルササポゲニンとスミラゲニンの神経栄養活性、神経保護活性、及び神経回復活性が、BDNFやGDNFといった神経栄養因子の存在に依存するかどうかを試験するために、以下の実験を行った。
【0292】
以下に示す方法に従って、ラットの皮質ニューロンを培養した。
【0293】
上述した考察とは異なり、ウシ胎児血清(FBS)又はウシ胎仔血清(FCS)を培地に加えておらず、これは培地中に神経栄養因子が存在しないことを意味する。試験化合物を24時間加えた。
【0294】
ラットの皮質ニューロンをFBSあるいはFCSの入っていない、サルササポゲニン、スミラゲニン(30nM)又はビークル(DMSO、0.25%)に、一日露出させた。皮質ニューロンを、希釈したモノクロナール抗体抗β−チューブリンと、希釈した抗マウス免疫グロブリンGを用いて染色した。これらの抗体が、ニューロン細胞本体(神経保護効果を定量する)と神経突起(神経栄養効果を定量する)とを染色した。カメラ付落射蛍光顕微鏡(倍率×20)で、ウエルごとに2枚写真を撮った(各症状につき10枚)。抗β−チューブリンで標識化した細胞の数と、細胞総数の分析を、LUCIA6.0ソフトウエアを用いて行った。
【0295】
この結果を以下の表16に示す。
【0296】
表16 血清がなく、追加の神経栄養因子がない状態で培養した皮質ニューロンのニューロン生存及び神経突起伸長に対するサルササポゲニンとスミラゲニンの効果

【0297】
サルササポゲニンとスミラゲニンは、その神経栄養、神経保護、及び神経回復活性を発揮するために、追加の神経栄養因子を必要としない。
【0298】
脊髄運動ニューロン
キサリプロデン(1−[2−(naphtha−2−yl)ethyl]−4−(3−trifluoromethylphenyl)−1,2,5,6−tetra−hydropyridine hydrochloride)は、SR57746Aとしても知られており、サノフィ・アベンティス社によって、神経変性障害の治療用に開発された、経口活性の、合成、非ペプチド化合物である。キサリプロデンは、血液脳関門を貫通して、インビトロで神経栄養活性を有し、ここで、PC12細胞における神経突起の伸長に関するNGFの効果を促進し(Fournier et al.,Neuroscience,1993,55,pp.629−641;Pradines et al.,Journal of Neurochemistry,1995,64,pp.1954−1964)、マウスの脊髄運動ニューロンの生存を高める(Duong et al.,British Journal of Pharmacology,1999,128,pp.1385−1392)。更に、キサリプロデンは、進行性運動ニューロン疾患マウスの平均生存時間と運動能力を上げる(Duong et al.,British Journal of Pharmacology,1998,124,pp.811−817)。キサリプロデンの行動モードは、不明のところが多い。しかしながら、キサリプロデンの神経保護効果は、5−ヒドロキシトリプタミン1A受容体におけるアゴニスト行動から独立しているように見える(Labie et al.,British Journal of Pharmacology,1999,127,pp.139−144)。
【0299】
以下の実験は、サルササポゲニン又はスミラゲニンの、キサリプロデンに対する、神経及び神経突起の効果を比較している。
【0300】
ラットの脊髄運動ニューロンを、上述の方法に従って調整した(Martinou et al,Neuron,8,737−744,1992)。サルササポゲニン、スミラゲニン、ビークル(DMSO、0.25%)、キサリプロデン、又はBDNFで培養した3日後に、脊髄運動ニューロンをPBSで2回洗浄して、冷たいアルコール溶液(95%)と酢酸(5%)中で5分間固定し、PBSで3回すすいだ。モノクロナール抗体抗β−チューブリンと、抗マウス免疫グロブリンGを用いて、ニューロンを染色した。これらの抗体は、染色ニューロン細胞本体(神経保護効果を定量する)と神経突起(神経栄養効果を定量する)を染色した。細胞の核は、蛍光マーカーによって染色された。培養の1時間後に、細胞をPBSで3回洗浄した。倍率20倍の落射蛍光顕微鏡で培養体を観察した。コンピュータソフトウエアで制御されたカメラを用いて、一連の写真を撮った。すべての画像は、同じ条件下で撮影された。抗β−チューブリンで標識化した細胞の数と、細胞総数(染色された細胞核の数)の分析を、LUCIA6.0ソフトウエアを用いて行った。
【0301】
この結果を以下の表17に示す。
【0302】
表17 サルササポゲニンとスミラゲニンは、脊髄運動ニューロンの神経新生と神経突起生成を増やす

【0303】
このデータは、キサリプロデンへの露出が、コントロールに比べてニューロンの生存と神経突起伸長を有意に増やしたことを示している。サルササポゲニンとスミラゲニンも、ラットの主な脊髄運動ニューロンにおけるニューロンの生存と神経突起伸長を有意に増やした。神経突起生成を増やす効果は、陽性コントロールBDNFで観察される効果と比較できる。
【0304】
サルササポゲニンとスミラゲニンの神経新生を促進する効果は、キサリプロデンの効果より若干顕著であるように見える。ただし、サルササポゲニンとスミラゲニンの効果は、従来の研究に比較すると、この研究では低減しているように見える。
【0305】
キサリプロデン(1及び2mg/日)の効力と安全性は、筋萎縮性側索硬化症(ALS)患者を用いて、2つの段階III臨床試験において評価した(Meininger et al.,Amyotrophic Lateral Aclerosis and Other Motor Neuron Disorders,2004,5,pp.107−117)。更に、近年、キサリプロデンを、アルツハイマー病の可能性として段階III試験において、評価した。そのキサリプロデンについての表示は、現在はもはや進行していない。投与量に依存する副作用は、キサリプロデンの5−ヒドロキシトリプタミン(5−HT)アゴニスト特性に大きくかかわっている。
【0306】
この実施例では、サルササポゲニンとスミラゲニンは、キサリプロデンに比較して、改善したあるいは同様の活性プロファイルを示した。重要なことは、サルササポゲニンとスミラゲニンは、5−HTアゴニストではなく、キサリプロデンに対応する副作用を示していないことである。
【0307】
この実施例は、ここで引用により組み込まれているPCT特許出願第WO−A−03/082893号の実施例8のインビトロでの実験に合致している。この実験は、インビトロでラットの主な脊髄運動ニューロンのグルタミン酸誘発神経変性が、サルササポゲニン又はスミラゲニンによって有意に低減した、あるいは戻ったことを示した。
【0308】
感覚ニューロン
妊娠15日目のWistarラットの胚からラットの感覚ニューロンを得た。5%CO2/95%空気の雰囲気中で37℃にて細胞を培養した。サルササポゲニン、スミラゲニン、ビークル(DMSO、0.25%)、又はNGFで培養した2日後に、感覚ニューロンをPBSで2回洗浄して、PBS中のパラホルムアルデヒド(4%)に4℃で30分間固定した。細胞をTriton X−100(0.1%)で透過性にし、非特定部位をウシ胎仔血清を用いて飽和させた。染色する前に、一次抗体の混合物である、抗ニューロフィラメント68及び200との混合物を用いて、ウシ胎仔血清5%を含むPBS中で、室温で2時間インキュベートした。洗浄する前に、スライドをはずして、細胞をPBSで5分間、2回洗浄し、暗室に1時間置いて、二次抗体であるシアニン3と結合した抗マウス抗体(Cy3;1/1600)とふっ化イソチアン酸スズ(fluoroisothiocyanate)とインキュベートした結合した抗ウサギ抗体を用いて、ウシ胎仔血清5%を含むPBS中でインキュベートした。スライドをPBSで5分間、2回洗浄し、Tris/HCl(0.2mM;pH8.5)で緩衝化したグリセロール(22%)中の抗酸化性溶液(9% w/v)であるMowiolを用いてカバースリップ上に装填した。スライドを室温で一晩置いて、固め、遮光状態で保存した。a×20対物レンズ付DAPI/FITC/Cy3トリプルフィルタ顕微鏡を用いて、スライドを見た。デジタルカメラを用いて、ウエルごとの一連の写真をランダムに撮影した。
【0309】
この結果を以下の表18に示す。
【0310】
表18 サルササポゲニンとスミラゲニンは、感覚ニューロンのニューロン生存を増やす

【0311】
サルササポゲニンとスミラゲニンは、ラットの主な感覚ニューロンのニューロン生存を増やす。
【0312】
実施例9
サルササポゲニンとスミラゲニンは、神経栄養因子と同じ細胞間変換経路を活性化する
サルササポゲニンとスミラゲニン誘発神経突起生成は、trk抑制剤であるK252aによって抑制され、サルササポゲニンとスミラゲニンの神経栄養効果がtrk受容体によって直接的にあるいは間接的に介在されていることを提言している。この抑制実験を以下に説明し、結果を以下の表19に示す。
【0313】
皮質ニューロンを上述の詳細に従って培養した。ニューロンをビークル(DMSO、0.25%)又はK252a(100nM)に1時間露出させた。1時間後、ビークル、サルササポゲニン、スミラゲニン(30nM)又はBDNF(1.85nM)を、K252aの存在を維持した状態で、媒体に加えた。サルササポゲニン又はスミラゲニン(30nM)、ビークル(DMSO、0.25%)又はBDNF(1.85nM)へ24時間露出させた後、ニューロンをリン酸緩衝食塩水(PBS)を用いて洗浄し、PBS中のグルタルアルデヒド(2.5%)に固定した。神経突起を表わしている40−60のニューロンの写真を、顕微鏡に固定したカメラ(対物レンズ ×20、ニコン)で撮像した。写真を分析して神経突起長を測定した。
【0314】
この結果を以下の表19に示す。
【0315】
表19 ラットの主な皮質ニューロンのサルササポゲニンとスミラゲニン誘発神経突起伸長の抑制

【0316】
皮質及び中脳ニューロンにおけるK252a、抗BDNF又は抗GDNF抗体を用いた個別実験で、同様の結果が得られた。
【0317】
trk受容体の活性化を行った後、ニューロンの生存を導く特定の信号変換経路を活性化させ、この経路にMEK1/2が含まれることが示された(Finkbeiner,Neuron,2000,25,pp.11−14)。スミラゲニン誘発神経突起生成は、MEK1/2抑制剤である、PD98059によって部分的に抑制され、スミラゲニンの神経栄養効果がMEK1/2を介して部分的に介在されることを示唆している。この抑制実験について以下に述べ、結果を以下の表20に示す。
【0318】
皮質ニューロンを上述の詳細に従って培養した。ニューロンをビークル(DMSO、0.25%)又はPD98059(10μM)に1時間露出させた。1時間後、ビークル、スミラゲニン(30nM)又はBDNF(1.85nM)を、PD98059の存在を維持した状態で、媒体に加えた。スミラゲニン(30nM)、ビークル(DMSO、0.25%)又はBDNF(1.85nM)へ24時間露出させた後、ニューロンをPBSを用いて洗浄し、PBS中のグルタルアルデヒド(2.5%)に固定した。神経突起を表わしている40−60のニューロンの写真を、顕微鏡に固定したカメラ(対物レンズ ×20、ニコン)で撮像した。写真を分析して神経突起長を測定した。
【0319】
この結果を以下の表20に示す。
【0320】
表20 ラットの主な皮質ニューロンのスミラゲニン誘発神経突起伸長の抑制

【0321】
サルササポゲニンを用いて同様の実験を行って、同様の結果となった。
【0322】
環状アデノシン一リン酸応答要素結合蛋白(CREB)は、転写因子族に属し、ニューロン生存の調整に重要である。更に、trk受容体活性化を行った後、CREBを上方制御した(Finkbeiner,Neuron,2000,25,pp1−14)。サルササポゲニンは、チャイニーズハムスターの卵巣(CHO)細胞中のリン酸化CREB(pCREB、CREBの活性型)の量を有意に増やした。この実験について以下に述べ、結果を以下の表21に示す。
【0323】
CHOをDMSO(0.5%)又はサルササポゲニン(10μM)で24時間インキュベートした。次いで、細胞を冷たいPBSで洗浄し、ドデシル硫酸ナトリウム(SDS)緩衝液中に溶解させ、5分間ボイルして、ブラッドフォールド法によってたんぱく質の含有量を測定した。次いで、サンプルをSDSポリアクリルアミドゲルの上で分離して、PVDF(Bio−Rad)膜に移した。5%のスキムミルク粉に1時間露出させた後、膜を一晩、4℃で、一次抗体である、pCREB(Upsdate: 1:1000)とマウスβ−アクチン(Santa Cruz,1:1000)中でインキュベートした。次いで、膜をぺルオキシダーゼ接合二次抗体(Wuhan Boster biology Tchnology,China.1:2000)で1時間室温でインキュベートして、ECL試薬(Pierce)を用いて発現させた。2−メルカプトエタノール(100mM)、SDS(2%)、Tris HCl(62.5mM)中で、pH6.8、50℃で30分間インキュベートさせることで、膜をストリップさせた。画像分析器(Gel Doc 2000.,Bio−Rad)付のImage J分析システムを用いて、免疫染色の濃度測定定量化を行った。pCREBの各帯域の免疫染色の相対量を、同じ実験のβ−アクチンバンドランに正規化して、任意の単位で表わした。
【0324】
表21 CHO細胞中のあるサルサポゲニンに24時間露出させた後のリン酸化CREBの発現

【0325】
実施例10
サルササポゲニン、スミラゲニン、エピサルササポゲニン、及びエピスミラゲニンでの予処理が、皮質ニューロンへのグルタミン酸誘発損傷を低減する
ラットの主な皮質ニューロンのグルタミン酸への露出は、グルタミン酸の露出後24時間で測定した乳酸脱水素酵素(LDH)活性を増加させ、ニューロンの有意な損傷を示している。ラットの皮質ニューロンを、上述した方法(Singer,et al.,Neuroscience Letters,1996,212,pp.13−16)の変形によって培養した。培養後10目に、媒体を血清を含まない既知の媒体に交換した。12日目に、培地を洗浄して、24時間テスト化合物又はビークル(DMSO、0.25%)を含む新鮮な媒体においた。13日目にニューロンをグルタミン酸(100μM;10分)に、37℃で露出させた。次いで、培地を、テスト化合物又はビークルを補充した新鮮な媒体で洗浄して、LDHを測定する前にその中に更に24時間おいた。グルタミン酸に露出させた後24時間で、この媒体中のLDH活性を測定することで、ニューロンの損傷を評価した。
【0326】
この結果を以下の表22乃至26に示す。
【0327】
表22 サルササポゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を低減する

【0328】
表23 スミラゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を低減する

【0329】
表24 エピサルササポゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を低減する

【0330】
表25 エピスミラゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を低減する

【0331】
表26 ジオスゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を低減しない

【0332】
ラットの主な皮質ニューロンにおいて、グルタミン酸に露出させる24時間前にサルササポゲニン、スミラゲニン、エピサルササポゲニン(1−100nM)、及びエピスミラゲニン(3−300nM)で予処理を行うことで、グルタミン酸のみに露出させたニューロンに比べてグルタミン酸誘発LDHの放出が有意に少なくなる。
【0333】
反対に、グルタミン酸に露出させる24時間前にジオスゲニン(3−300nM)で予処理を行うことは、ニューロンの損傷を防止しなかった。
【0334】
サルササポゲニン、スミラゲニン、エピサルササポゲニン、及びエピスミラゲニンの活性は、毒性を生じさせることなく、ナノモル濃度で安定域に達した。これらの実験条件におけるマイクロモル濃度のテスト化合物は、溶液から凝固する。
【0335】
この実施例は、ここで引用により組み込まれているPCT特許出願第WO−A−03/082893号の実施例2乃至4のインビトロでの実験に合致している。これらの実験は、サルササポゲニン、エピサルササポゲニン、スミラゲニン、エピスミラゲニン、又はこれらの3−ケトン又は3−エステルでラットの主な皮質ニューロンを予処理することが、グルタミン酸誘発神経変性を有意に防止あるいは回復する一方、ジオスゲニンはこのような活性がないことを示した。
【0336】
実施例11
ドーパミン作用性ニューロンにおけるサルササポゲニン、スミラゲニン、エピサルササポゲニン、及びエピスミラゲニンの抗アポトーシス作用
ラットのドーパミン作用性ニューロンを上述のように培養した(Schinelli et al.,Journal of Neurochemistry,1988,50,pp.1900−1907)。5日目に、培養体を洗浄して、テスト化合物(30nM)、ビークル(DMSO、0.25%)又はBDNF(1.85nM)とGDNF(0.17nM)の組み合わせを含む新鮮な媒体に24時間置いた。
【0337】
ラットの主なドーパミン作用性ニューロンをMPP+(2μM、24時間)に露出させることで、コントロールに比べて、ドーパミン作用性ニューロンの数が有意に減少した。6日目に、テスト化合物、ビークル、あるいはBDNFとGDNFの組み合わせの存在下で、MPP+(2μM)を培養体に加えて、更に48時間置いた。MPP+は、ミトコンドリア中の錯体Iの抑制と続くATPの欠乏を介して神経細胞の死を誘発し、その結果フリーラジカルが生じて、アポトーシスを誘発する。インキュベーション期間後に、培養体をPBS(4%)中のパラフォルムアルデヒドに固定した。固定後、Triton×100(0.05%)で30分間透過性にした。次いでニューロンを、抗−チロシン水酸化酵素(TH)で、37℃で2時間インキュベートした。ニューロンをPBSで3回洗浄し、次いで、ヤギ抗マウス/Cy3で、37℃で2時間インキュベートした。ニューロンを経口顕微鏡に装填して、検査した。
【0338】
この結果を以下の表27に示す。
【0339】
表27 サルササポゲニン、スミラゲニン、エピサルササポゲニン、及びエピスミラゲニンは、MPP+誘発の中脳ドーパミン作用性ニューロンの喪失を低減する

【0340】
サルササポゲニン、スミラゲニン、エピサルササポゲニン、及びエピスミラゲニンは、MPP+誘発ドーパミン作用性ニューロンの低減を有意に防止する。神経栄養因子、BDNF及びGDNFの組み合わせに露出させることも、MPP+誘発ドーパミン作用性ニューロンの低減を有意に防止する。
【0341】
実施例12
サルササポゲニンとスミラゲニンは、グルタミン酸又はMPP+誘発損傷後に神経を再生する
【0342】
皮質ニューロン
神経変性疾患の治療の重要なゴールは、進行を防ぐことのみならず、患者に生じるニューロンの喪失を回復することである。ラットの主な皮質ニューロンをグルタミン酸(100μM;10分)に露出させた後、サルササポゲニンとスミラゲニン(30nM)が、治療後24時間でグルタミン酸誘発損傷を有意に回復させた。この実施例は、PCT特許出願第WO−A−03/082893号の実施例2乃至4に報告されている研究の発展形である。
【0343】
ラットの皮質ニューロンを上述した詳細に従って調整した。13日目に、培養体をグルタミン酸(100μM)に、10分間、37℃で、5%CO2/95%空気の雰囲気中で、既知の媒体において露出させた。インキュベーション期間後、培養体を洗浄して、サルササポゲニン、スミラゲニン、又はビークルを含む新鮮な媒体中に維持した。グルタミン酸に露出させた後、細胞を更に24時間培養して、上述した詳細に従って、ニューロン損傷を評価した。
【0344】
その結果を以下の表28に示す。
【0345】
表28 サルササポゲニンとスミラゲニンは、皮質ニューロンにおけるグルタミン酸誘発損傷を回復させる

【0346】
脊髄運動ニューロン
ラットの脊髄運動ニューロンを上述した詳細に従って調整した。10日目に、媒体を除去して、培養体をグルタミン酸(4μM)に、10分間、37℃で、5%CO2/95%空気の雰囲気中で、既知の媒体において露出させた。グルタミン酸に露出させた後、培養体をDMEMで37℃で洗浄して、サルササポゲニン、スミラゲニン、ビークル、又はBDNFを含む新鮮な培養媒体中に置いた。48時間後、運動ニューロンの障害の程度を上述の詳細に従って測定した。この実施例は、PCT特許出願第WO−A−03/082893号の実施例8に報告されている研究の発展形である。
【0347】
その結果を以下の表29に示す。
【0348】
表29 サルササポゲニンとスミラゲニンは、脊髄運動ニューロンにおけるグルタミン酸誘発損傷を回復させる

【0349】
ラットの主な脊髄運動ニューロンのグルタミン酸(4μM;10分)への露出は、グルタミン酸への露出後48時間で測定したLDH活性を増加させ、有意なニューロン損傷を示している。サルササポゲニンとスミラゲニン(0.03−300μM)は、治療後48時間のグルタミン酸誘発損傷を有意に回復させた。
【0350】
しかしながら、最も濃度の低いサルササポゲニンとスミラゲニンによって提供された障害の回復は、培地間で異なり、このモデルにおける活性の最も低いリミットでは0.03μMであることを示唆している。脳由来の神経栄養因子(3nM)を陽性コントロールとして用いて、グルタミン酸のみに露出させた脊髄運動ニューロンに比べた場合に、グルタミン酸誘発LDH活性を有意に回復させた。
【0351】
ドーパミン作用性ニューロン
ラットの主なドーパミン作用性ニューロンを上述した詳細に従って調整した。5日目に、培養体にMPP+(2μM)を加えて、24時間、37℃で、5%CO2/95%空気の雰囲気中に置いた。ラットの主なドーパミン作用性ニューロンをMPP+(2μM、24時間)露出させることで、コントロールに比較してドーパミン作用性ニューロンの数を有意に低減させた。6日目に、媒体を除去して、ビークル(DMSO、0.25%)、サルササポゲニン、スミラゲニン、又はBDNFとGDNFの組み合わせを含む新鮮な媒体を加えた。48時間後、ドーパミン作用性障害の程度を上述の詳細に従って測定した。
【0352】
その結果を以下の表30に示す。
【0353】
表30 サルササポゲニンとスミラゲニンは、ドーパミン作用性ニューロンにおけるMPP+誘発損傷を回復させる

【0354】
このデータは、サルササポゲニンとスミラゲニン(30nM)がドーパミン作用性ニューロンにおけるMPP+誘発損傷を有意に回復させたことを示す。神経栄養因子、BDNF(1.85nM)とGDNF(0.17nM)の組み合わせに露出させることも、ドーパミン作用性ニューロンにおけるMPP+誘発損傷を有意に回復させた。
【0355】
同様の実験では、結果を図1に示すが、ラットの主なドーパミン作用性ニューロンにおけるMPP+(2μM、24時間)誘発ニューロン損傷を回復させる様々な濃度のスミラゲニンの効果を調べた。BDNF、GDNF、及びビークルの濃度は上述した通りである。ドーパミン作用性培養体を、スミラゲニン(0.3fM乃至30nM)、BDNF(1.85nM)とGDNF(0.17nM)の組み合わせ、又はビークル(DMSO、0.25%)を含む媒体中で24時間インキュベートした。次いで、MPP+(2μM)又はビークルを媒体に加えて、培養体を更に48時間インキュベートした。フィールドあたりのドーパミン作用性(TH−陽性)ニューロンの数を、免疫組織化学と蛍光顕微鏡によって定量化し、次いで、データを組み合わせるようにするべく自体のコントロールに正規化した。MPP+に24時間露出させた後のスミラゲニン(3fM−30nM)を用いた48時間の処理は、13.4fMのEC50を用いたMPP+誘発ニューロン損傷を有意に回復させた。
【0356】
実施例13
サルササポゲニンとスミラゲニンの経口投与は、神経を損傷したマウスモデル(pmnマウス)における神経機能の回復を改善する
進行性の運動神経疾患(pmn)マウスは、変性運動ニューロン障害の遺伝モデルであり、遠位軸索変性と、近位軸索と細胞体の相対保護を伴う後退性プロセスを含む(Schmalbruch et al.,Journal of Neuropathology and Experimental Neurology,1991,50,pp.192−204)。pmn/pmnホモ接合性は、運動軸索のcaudio−cranial変性を患い、おそらく呼吸筋の脱神経によって生後数週間で死にいたる(Schmalbruch et al.,Journal of Neuropathology and Experimental Neurology,1992,358,pp.502−504)。pmnマウスは、特別なヒト運動ニューロン疾患と同等の正しい動物モデルと考えることはできない(Kennel et al.,Neurobiology of Disease,1996,3,pp.137−147)が、神経変性疾患の新しい薬剤候補の可能性を評価する有益なモデルに相当する。このマウスモデルは、ALS、進行性筋委縮症、脊髄性筋委縮症、進行性球まひ、仮性球まひ、原発性側索硬化症、などの運動ニューロン変性の原因となっている病理学的機構を決定するために(Sagot et al,Journal of Neuroscience,1995,15,pp.7727−7733)、及び、運動ニューロン障害の治療のための潜在的な治療戦略を評価するために(Haase et al,Nature medicine,1997,3,pp.429−436;Sendtner et al.,Nature,1992,358,pp.502−504;Sagot et al.,Journal of Neuroscience,1995,15,pp.7727−7733;Sagot et al.,Journal of Neuroscience,1996,16,pp.2335−2341)既に使用されている。この実施例は、PCT特許出願第WO−A−03/082893号の実施例11に報告されている研究の発展形である。
【0357】
罹患したホモ接合性+/+pmn(「pmnマウス」)マウスを、Neurofit(Illkirch,France)に維持されているエキストラトウ遺伝子座(Xt)+/+pmn二重ホモ接合性マウスの繁殖コロニーから得た。生後10日目から、疾患の最初の症状が現れる直後まで、pmnマウスに経口強制飼養を行った。サルササポゲニン(0.03、0.3、及び3μg/kg/日)を、油中懸濁液(10ml/kg)としてpmnマウスに投与した。米国電気診断医学協会のガイドラインに従って、標準形Neuromatic2000M筋電図装置を用いて筋電図(EMB)の記録を取った。8日目から標準行動試験(グリッド、ロータロッド、ハンギングテスト)を行って、pmnマウスの運動能力を評価した。
【0358】
運動機能に関するサルササポゲニンの効果を、腓腹筋誘発運動反応の大きさを記録することによって評価した(CMAP、機能性運動ニューロン数の関節測定)。
【0359】
この結果を図2に示す。
【0360】
pmnコントロール群は、12日令で、CMAPの大きさの急激な減少を示した。pmnマウスへサルササポゲニン(0.3μg/kg/日)を毎日経口投与することが、運動機能の劣化を遅らせた(p<0.001)。コントロールマウスのつまずきの回数は、12日令から急激に多くなった。pmnマウスへサルササポゲニン(0.3μg/kg/日)を毎日経口投与することが、pmnコントロール群と比較して、ロータロッド及びグリッドテストパフォーマンスにおける劣化を有意に遅らせた(p=0.02 多変量分散(MANOVA)分析)。サルササポゲニン(0.3μg/kg/日)の毎日の経口投与によって、pmnコントロール群に比較して、pmnマウスの生存率を有意に増やした(コントロールに比べて最大62%、log rank,χ2=7.36,P=0.006)。
【0361】
反対に、臨床症状が発症した後に、最も低いテスト投与量(0.03μg/kg/日)でサルササポゲニンを毎日経口投与することでは、この遺伝子モデルにおける運動ニューロン変性の進行を遅らせることはない。
【0362】
これらの結果は、経口活性、非ペプチド神経栄養因子誘発体であるサルササポゲニンが、この遺伝子モデルにける運動ニューロン変性の進行を遅らせることができることを示唆している。神経栄養因子(毛様体神経栄養因子;CNTF;Sagot et al,Journal of Neuroscience,1995,15,pp.7727−7733)及びGDNF(Sagot et al,Journal of Neuroscience,1996,16,pp.2335−2341)は、pmnマウスモデルで試験を行った。これらの研究は、CNTF(腹腔内、CNTF−分泌細胞の投与)が生存時間を40%伸ばし、運動機能を改善する一方、GDNF派運動ニューロン生存を改善したが、疾病を遅らせることはなかったことを示した(Sagot et al,Journal of Neuroscience,1996,16,pp.2335−2341)。神経栄養因子は、運動ニューロン疾患の有望な治療として考えられてきたが、タンパク質として広く知られた臨床使用は非常に問題である。非ペプチド神経栄養組成物SR57746A(キサリプロデン)を、pmnマウスに生後から経口投与することは、運動神経変性の進行を遅らせて、マウスの運動能力を改善し生存期間を改善した(〜50%;Duong et al.,British Jounal of Pharmacology,1998,124,pp.811−817)。更に、疾病開始時点におけるCGP3466B(抗アポトーシス剤)の経口投与は、その疾病の進行を遅らせ、pnmマウスの生存期間を57%改善した(Sagot et al.,British Jounal of Pharmacology,2000,131,pp.721−728);分子BN80933(抑制剤ニューロン酸化窒素シンターゼ及び脂質過酸化反応)は、pmnマウスの生存期間を40%改善した(Sagot et al.,British Jounal of Pharmacology,2000,131,pp.721−728)。
【0363】
重要なことは、サルササポゲニンは、疾患の症状が現れた後に経口投与した場合、その疾患の進行を遅らせて、このモデルにおいてpmnマウスの生存期間をインビボで最大62%改善したことである。同様の結果がスミラゲニンでも得られた。
【0364】
実施例14
サルササポゲニンとスミラゲニンの経口投与は、神経疾患のある別のマウスモデル(神経挫滅モデル)における神経機能の回復を改善する
坐骨神経挫滅モデルは、運動ニューロン障害及び外傷後の神経損傷の良く特徴づけられた可逆モデルである(McMahon and Priestley,Current Opinion in Neurobiology,1995,5,pp.616−624)。この神経損傷は、止血鉗子を用いて、マウスの右の坐骨神経が3つにわかれる部分近傍5mmに機械的圧力を2回かけて作る。この結果、2週間に亘って神経変性が生じ、続いて神経の局所的炎症が最大4週間続く。神経機能の喪失は、機械的損傷後4−5週間に亘って徐々に回復する。
【0365】
坐骨神経損傷後、C57マウスへの6週間に亘るサルササポゲニン(3mg/kg/日、油中経口強制飼養)とスミラゲニン(0.3及び3mg/kg/日、油中経口強制飼養)の経口投与は、腓腹筋のCMAPパラメータ(振幅、待ち時間及び期間、活性運動ファイバの間接マーカ、運動神経伝導速度、及び神経繊維の機能性)と、坐骨神経の形態学的分析(変性した神経線維の比率)で測定した場合の神経機能の回復を有意に改善した。4−メチルカテコール(10μg/kg/日、腹腔)を陽性コントロールとして用いた(Kaechi et al.,Journal of Phamacology and Experimental Therapeutics,1995,272,pp.1300−1304)。
【0366】
この結果を図3に示す。
【0367】
C57bl/6 RJマウスに塩酸ケタミン(60mg/kg、腹腔)で麻酔をかけた。大腿つけねの皺と膝の中間レベルで座骨神経を外科的に露出させて、坐骨神経が3つにわかれる部分近傍5mmをつぶした。この神経は、止血鉗子を用いて、それぞれの間で90度回転させて、30秒間2回つぶした。この結果、二週間に亘って、神経変性が生じ、次いで神経の局所的炎症が機械的損傷の後4週間続いた。神経機能の喪失は、機械的損傷後4−5週間に亘って徐々に回復した。筋電図の記録を上述したように評価した。
【0368】
この結果を以下の表31に示す。
【0369】
表31 サルササポゲニンとスミラゲニンは、神経を損傷したマウスモデルにおける変性した神経繊維の数を減らす

【0370】
サルササポゲニンとスミラゲニンは、経口活性であり、神経機能の回復を改善し、座骨神経損傷モデルにおける神経再生を刺激する。
【0371】
実施例15
サルササポゲニンとスミラゲニンは、老化した動物の不安を低減し、認知能力とBDNFの減少を回復する
老齢のSDラット(20月令)に3ヶ月間サルササポゲニン又はスミラゲニン(18mg/kg/日)を経口投与した。若いSDラット(4月令)を健康な陽性コントロールとして用い、老齢のSDラット(20月令)を神経変性コントロールとして用いた。Y字迷路を用いて、学習と記憶を評価し、動物を疲れさせるテストの特徴を考慮して不安モデルとした。Y字迷路の各アームの床は、銅性ロッドでできたアレイであり(2mm×140mm)、これに調整可能な電圧で、必要に応じて電流を流した。各アームは450mmの長さであり、端部に15ワットのランプが付いている。2カ月の処置の後、各ラットを、1日1回、連続7日間訓練した。各訓練期間中、ラットをY字迷路の一方のアームにおいて、2分後に反時計回り方向のアームの銅製ロッドに電流を流し、時計回り方向のアームのランプを点灯させ、電流の通ってない領域を表示した。ラットがランプが点灯しているアームへ行った場合に、正しい反応を記録して、そうでない場合は誤った反応を記録した。この刺激−応答試験を、各試験の間に5秒の休止を入れて、一日20回繰り返した。正しい応答数と、20回の試験のトータル時間を記録した。トータル応答時間で割った正しい応答回数の割合を計算して学習能力の指標として用い、この割合が高いほど学習能力が良好であった。学習テストの1カ月後(3か月の処置)、Y字迷路試験を再度行って、得られた割合を記憶能力の指標として用いた。処置の最後に、ラットを殺して、脳を取り出して、ELISAを用いてBDNFの定量化を行った(上述の実施例3に提示されているBDNFのデータ)。
【0372】
Y字迷路実験の結果を以下の表32に示す。
【0373】
表32 サルササポゲニンとスミラゲニンは、老齢ラットの認知能力(学習及び記憶)とBDNFレベルの減少を回復させる

【0374】
老齢のラットに最大3カ月間経口投与したサルササポゲニンとスミラゲニン(18mg/kg/日)は、認知能力(学習及び記憶能力)を若いラットに見られる能力に回復させる。
【0375】
実施例16
経口投与したサルササポゲニンとスミラゲニンは、様々な身体組織に送達される
サルササポゲニンとスミラゲニンは、経口的に活性であることが示されており、齧歯動物及び非齧歯動物における経口投与後に血漿、脳、脊髄(及びその他の組織)の濃度を測定した。
【0376】
この結果を以下の表33に示す。
【0377】
表33 サルササポゲニンとスミラゲニンは、単回の経口投与後に血漿、脳、及び脊髄に分配される

【0378】
経口投与したサルササポゲニンとスミラゲニンは、身体のニューロン部位及び血漿へ移動する。
【0379】
実施例17
経口投与したサルササポゲニンとスミラゲニンは、有効投与量において非毒性である
サルササポゲニンとスミラゲニンは、インビトロではナノ分子濃度で活性であるが、より低い濃度では不活性であるか、あるいはニューロンにおいて可変活性を示す。より高い濃度では、サルササポゲニンとスミラゲニンは、インビトロでより高い濃度の神経栄養因子で観察される毒性を示さない。
【0380】
高い投与量で経口投与した後の長期に亘る毒性の研究をサルササポゲニン(ラットで最大26週間、非齧歯動物で39週間)とスミラゲニン(マウスと非齧歯{げっし}動物で最大52週間)について行ったが、高レベルの神経栄養因子が到達したときに見られた毒性あるいは副作用の兆候は示さなかった。
【0381】
実施例18
スミラゲニンは、MPTP障害のあるマカクのパーキンソン病を低減し、被殻中のGDNFとBDNF濃度を調整する
19匹のカニクイザル(Macaca fascicularis,3.0−4.5kg、4−6歳)を3ヶ月間実験環境と工程に慣れさせて、すべての動物の基準行動を評価した。14匹のメスのマカクに、著しく、安定的なパーキンソン症状が発現するまで、MPTP(0.2mg/kg/日、皮下注射)を与えた。動物(n=7/群)をランダムに2群に振り分けて、スミラゲニン(20mg/kg/日、経口)投与群又はビークルコントロール(HPMC、0.5%w/v、ツイーン800.2%v/v含有)とした。MPTPを与えられなかった5匹のマカクは、ビークルを投与して、コントロール群とした。
【0382】
スミラゲニン又はビークルを18週間投与した後、MPTP投与後にパーキンソン性障害の評価を行った。パーキンソン性障害を、この処置に正しい判断ができない神経学者によって、DVD記録の事後分析によって評価した。研究の最後に、脳を取り出して、被殻中の非結合GDNFとBDNFのレベルを、Multiplex ELISA/Aushonアッセイを用いて測定した。このように、この実験で用いたMPTPで処置したマカクは、パーキンソン病及び同様の運動−感覚神経変性症状の受け入れモデルを提供している。
【0383】
この結果を以下の表34に示す。
【0384】
表34 スミラゲニンは、MPTP障害マカクにおける行動を改善し、被殻のGDNFとBDNFのレベルを調整する

【0385】
MPTP障害マカクに18週間経口投与したスミラゲニンは、MPTP障害マカクのパーキンソン性レベルを有意に低減する。スミラゲニンはまた、ビークルを投与したマカクに比べて、MPTP障害マカクの被殻におけるGDNFとBDNFのレベルを、コントロールの障害がないマカクのものとほぼ変わらないレベルにまで、有意に低減させる。
【0386】
このデータは、GDNFとBDNFの発現に関するスミラゲニンの効果が、長期投与の下での正常化効果である、すなわち、このレベルをほぼ正常レベルに戻すことによって、GDNFとBDNFへの過剰投与に対して動物を保護する、長期に亘る定期的な効果がある。この変化は、重要であり、マカクのパーキンソン性レベルの有意な低減に関連する。
【0387】
考察
上述の実施例は、A/B−cisスピロスタンステロイド性サポゲニンである、サルササポゲニンとスミラゲニンは、インビトロ及びエクスビトロのデータで示すように、神経栄養因子誘発剤である。これらは、経口投与後にインビトロであるいはインビボで神経保護及び神経回復可能である。これらは、誘発材としての神経栄養因子の存在を必要とせず、NF強化剤ではなくむしろ、真のNF誘発剤であるように見える。
【0388】
神経栄養因子(例えば、BDNFやGDNF)の投与は、鬱病、統合失調症、パーキンソン病及びその他の疾病における疾病調整の戦略であり、この戦略は、強力な科学的論拠を有していた。しかしながら、この科学的根拠を臨床に持ち込むことが困難であるとされてきた。これは、神経栄養因子のたんぱく質特性と、外科的、ウイルスベクタによる、及び細胞ベースの遺伝子/たんぱく質送達アプローチに固有の困難性に起因する。ニューロンの栄養に関する複雑な条件が、単一因子によって達成される効果を制限しており、臨床的利益を達成するための神経栄養因子の量及び必要な期間も、現在のところわかっていない。
【0389】
経口活性神経栄養因子誘発剤であるサルササポゲニンとスミラゲニンと、この出願で規定されている関連する分子は、これらの困難の多くを克服する。ここで、サルササポゲニンとスミラゲニンが、インビトロで、ピコ分子及びナノ分子濃度で活性であることを示した。これらは、インビトロでの高濃度神経栄養因子に見られる毒性を示していない。
【0390】
本出願の証拠は、ここで引用されている引用例にすでに公開されている証拠と共に、例えばBDNF及び/又はGDNFなどのNFsの自己制御恒常性の誘発が、制限された対処できる副作用で、A/B−cisフロスタン、フロステン、スピロスタンとスピロステンステロイド性サポゲニン及びこのエステル、エーテル、ケトン及びグリコシル化型から選択された、有効量の少なくとも一の薬剤を対象に投与して達成されること、及び、神経症状、精神症状、炎症、アレルギー症状、免疫症状、腫瘍症状、及び関連する症状などのNF介在障害及び症状を治療及び予防する様々な治療及び非治療方法において、新規な予期しない利点を提供すること、を示している。
【0391】
上記は、限定することなく本発明の広く述べている。この分野の当業者に明らかなように、変形例や変更例は、特許請求の範囲に規定されている発明の範囲に含まれることを意図している。
【特許請求の範囲】
【請求項1】
対象における例えばBDNF及び/又はGDNFなどの神経栄養因子(NFs)の自己制御恒常性を、恒常性を制御した状態で、非毒性態様で対象の天然NFsを調整することによって誘発する方法において、当該方法が、前記対象に、A/B−cisフロスタン、フロステン、スピロスタンとスピロステンステロイド性サポゲニン及びこのエステル、エーテル、ケトン及びグリコシル化型から選択された、有効量の一又はそれ以上の薬剤を投与するステップを具えることを特徴とする方法。
【請求項2】
請求項1に記載の方法において、前記NFsの自己制御恒常性の誘発が、例えばNGFなどのNFsの過剰誘発、過剰刺激、又は過剰増強に関連する、及び、受容体のアンタゴニスト又はアゴニスト作用に関連する、及び酵素結合作用に関連する、制限された対処可能な副作用で生じることを特徴とする方法。
【請求項3】
請求項1に記載の方法において、当該方法が、例えば:
(a)例えば、痴呆症、加齢に関連した認識機能障害、アルツハイマー病、アルツハイマー型老年性認知症(SDAT)、レヴィー小体認知症、血管性認知症、パーキンソン病、脳炎後のパーキンソン病、脳炎後及びその他のパーキンソン病以外の理由によるパーキンソン症候群、顔面肩甲上腕型筋ジストロフィーを含む筋ジストロフィー(FSH)、デュシェンヌ型筋ジストロフィー、ベッカー型筋ジストロフィー及びブルース型筋ジストロフィー(Bruce’s muscular dystrophy)、フックスジストロフィー(Fuchs’dystrophy)、筋緊張性ジストロフィー、角膜ジストロフィー、反射性交感神経性ジストロフィー症候群(RSDSA)、神経血管ジストロフィー(neurovascular dystrophy)、重症筋無力症、ランバート・イートン病、ハンチントン病、筋萎縮性側索硬化症(ALS)を含む運動ニューロン疾患、乳児脊髄性筋萎縮症(infantile spinal atrophy)、多発性硬化症、起立性低血圧、疼痛、神経痛、下記のような発作及び事故のような外傷性神経変性(例えば、外傷性の頭部又は脳の損傷、又は脊髄の損傷)、バトン病、コケーン症候群、ダウン症候群、大脳皮質基底核神経節変性症、多系統萎縮症、脳萎縮症、オリーブ橋小脳萎縮症、歯状核赤核萎縮症(dentatorubral atrophy)、淡蒼球ルイ体萎縮症(pallidoluysian atrophy)、球脊髄性萎縮症(spinobulbar atrophy)、視神経炎、硬化性全脳炎(SSPE)、注意欠陥障害、ポストウイルス性脳炎(post−viral encephalitis)、ポリオ後症候群、ファール症候群、ジュベール症候群、ギラン・バレー症候群、無脳回症、もやもや病、神経細胞移動障害、自閉性症候群(autistic syndrome)、ポリグルタミン病、ニーマン・ピック病、進行性多巣性白質脳症、偽脳腫瘍、レフサム病、ツェルヴェーガー症候群、核上性麻痺、フリードライヒ失調症、脊髄小脳失調症2型(spinocerebellar ataxia type 2)、レット症候群、シャイ・ドレーガー症候群、結節性硬化症、ピック病、慢性疲労症候群、遺伝性ニューロパシーを含む神経障害、糖尿病性神経障害及び有糸分裂性神経障害、クロイツフェルト・ヤコブ病(CJD)、変異型CJD、新変異型CJDを含むプリオンベースの神経変性、牛海綿状脳症(狂牛病)(BSE)、GSS、FFI、クールー病及びアルパーズ症候群、ジョセフ病、急性散在性脳脊髄炎、くも膜炎、中枢神経系の血管障害、四肢神経機能の喪失、シャルコー・マリー・トゥース病、クラッベ病、白質萎縮症、心不全への罹患性、喘息、てんかん、聴覚神経変性(auditory neurodegeneration)、黄斑変性症、色素性網膜症(pigmentary retinitis)、及び緑内障に起因する視神経変性から選択される、神経性疾患の治療又は予防;
(b)例えば、不安障害(例えば、急性ストレス障害、パニック障害、広場恐怖症、社会恐怖症、特定恐怖症、強迫性障害、心的外傷後ストレス障害、身体醜形障害及び全般性不安障害)、性的不安障害(例えば、膣痙、男性の勃起不全、男性のオルガズム障害、女性のオルガズム障害)、小児期障害(例えば、注意欠陥・多動性障害(ADHD)、アスペルガー症候群、自閉性障害、行為障害、反抗的行為障害、分離不安障害及びトゥレット障害)、摂食障害(例えば、拒食症及び過食症)、気分障害(例えば、鬱病、大鬱病性障害、双極性障害(躁鬱病)、季節性情動障害(SAD)、気分循環性障害及び気分変調性障害)、睡眠障害、認知精神障害(cognitive psychiatric disorders)(例えば、せん妄、健忘障害)、人格障害(例えば、妄想性人格障害、分裂病質人格障害、統合失調症性人格障害、反社会的人格障害、境界性型人格障害、演技性人格障害、自己愛性人格障害、回避性人格障害、依存性人格障害及び強迫性人格障害)、精神病性障害(例えば、統合失調症、妄想性障害、短期的精神障害(brief psychotic disorder)、統合失調症様障害、分裂情動性障害及び共有精神病性障害)、及び物質関連障害(例えば、アルコール依存症、覚醒剤依存症、大麻依存症、コカイン依存症、幻覚剤依存症、吸入依存症、ニコチン依存症、オピオイド依存症、フェンシクリジン依存症及び鎮静剤依存症)から選択される、精神疾患の治療又は予防;
(c)例えば、咳、掻痒症、食物不耐性、乾癬、クループ、過敏性腸症候群、耳鳴り、メニエール病、ストレスによる潰瘍又はアセチルサリチル酸による潰瘍、アレルギー性鼻炎、アレルギー性皮膚炎、結膜炎、炎症、炎症性大腸炎、回腸炎、膵炎、胆嚢炎、非アレルギー性鼻炎、食道炎、変形性関節炎、関節リウマチ、花粉症、家ダニアレルギー、ペットアレルギー、ハンチントン病、急性炎症性痛覚、内臓痛、歯痛及び頭痛、炎症性痛覚過敏、触知性痛覚過敏、アレルギー性皮膚反応、目のアレルギー反応、喘息、アテローム性動脈硬化症、関節炎、慢性潰瘍(例えば、関節リウマチに関連する慢性の血管炎性潰瘍(chronic vasculitic ulcer))、湿疹、正常な呼吸の維持、喉痛及び咳の軽減、正常な消化の維持の補助、胃のむかつきの緩和、鼻炎薬としての風邪及びインフルエンザからの回復の補助、頭痛の軽減、筋肉痛の緩和、軽い痛みの緩和、歯痛からの回復の提供、口内炎又は胃潰瘍からの回復の提供、及び健康な関節の維持から選択される、炎症性又はアレルギー性疾患の治療及び予防;
(d)例えば、AIDSなどの免疫不全状態、免疫活動過剰症状、及び、例えば、全身性エリトマトーシス(SLE)などの自己免疫疾患といった、低下した免疫特性の症状から選択される、免疫性疾患の治療及び予防;及び
(e)例えば、乳、甲状腺、大腸、肺、卵巣、皮膚、筋肉、膵臓、前立腺、腎臓、生殖器、血液、免疫システム(例えば、脾臓、胸腺及び骨髄)、脳、末梢神経系及び皮膚(例えば、メラノーマ及びカポジ肉腫)の癌から選択される、ヒト及び必要に応じて非ヒト哺乳動物における、腫瘍性疾患の治療及び予防;
から選択された、NF介在疾患の治療又は予防方法と共に使用されることを特徴とする方法。
【請求項4】
請求項1に記載の方法において、当該方法が、ニューロン、ニューロン機能又はニューロンネットワークの回復又は再生法、ニューロンへの血流の再生又は正常化を行う方法、例えば外傷後の神経の再構築、組織移植、術後の神経の再構築など、障害を受けた組織の再生及び治癒方法、心臓発作、TIAsあるいはその他の虚血からの回復を支援する方法、創傷、骨及び筋肉の治癒を支援する方法、神経病症状あるいはニューロンの異常を正常化する方法、あるいは、移植した細胞の生存率を上げて、生存細胞効率を改善するための胎児細胞、幹細胞、又はその他の細胞治療方法、又はこれらの組み合わせ、と共に使用されることを特徴とする方法。
【請求項5】
請求項1に記載の方法において、前記方法が異常行動あるは個体的特徴を治療又は予防する方法と共に使用されることを特徴とする方法。
【請求項6】
請求項1に記載の方法において、前記方法が創傷治癒の支援と共に使用されることを特徴とする方法。
【請求項7】
請求項1に記載の方法において、前記方法が、例えば老化、しわ、あるいは日光、風、雨、冷気又はその他のダメージを与える媒体に露出させる効果から皮膚の回復を促進する、といった皮膚、骨、眼、筋肉及びその他の組織の健康を改善する非治療的方法と共に、あるいは、運動、労働あるいは消耗からの筋肉と組織の回復を含み、持久力を改善し、疲労感を低減する、健康で良好な状態に関するその他の態様を提供する非治療的使用と共に、使用されることを特徴とする方法。
【請求項8】
請求項1に記載の方法において、当該方法が、人口の正常範囲内にあり、診断可能でない疾患である、神経症状及び精神症状の治療及び予防のための非治療的方法と共に使用されることを特徴とする方法。
【請求項9】
請求項1乃至8のいずれか1項に記載の方法において、前記方法が、天然にBDNF又はGDNFを過剰発現している、あるいは、NF様あるいは刺激の精神的副作用にかかりやすい、又は、受容体アンタゴニスト、受容体アゴニスト又は酵素相互作用薬剤の受容体介在又は酵素介在副作用にかかりやすい個体である、ヒト又は動物に使用されることを特徴とする方法。
【請求項10】
請求項1乃至9のいずれか1項に記載の方法において、前記活性薬剤が外部から投与された神経栄養因子を伴うことなく使用されることを特徴とする方法。
【請求項11】
請求項1乃至10のいずれか1項に記載の方法において、前記方法が、対象への投与プロトコルの臨床制御を伴わない状況で使用されることを特徴とする方法。
【請求項12】
請求項1乃至11のいずれか1項に記載の方法において、前記活性薬剤が、サルササポゲニン、スミラゲニン、エピサルササポゲニン、エピスミラゲニン、チモサポニンBII、メタゲニン、サモゲニン、ジオチゲニン、イソジオチゲニン、テクソゲニン、ヨノゲニン、メクソゲニン、及びマルコゲニン、及びこれらの対応するエステル、エーテル、ケトン、及びサポニン(グリコシル化)誘導体から選択されることを特徴とする方法。
【請求項13】
請求項1乃至12のいずれか1項に記載の方法において、前記活性薬剤が、サルササポゲニン、スミラゲニン、及びこれらの対応するエステル、エーテル、ケトン、及びサポニン(グリコシル化)誘導体から選択されることを特徴とする方法。
【請求項14】
請求項1乃至13のいずれか1項に記載の方法において、前記一又はそれ以上の活性薬剤が、代謝アジュバント、ケトンの本体レベルを上げる化合物(ケト原生化合物)、トリカルボキシル酸(TCA)サイクル中間体、インビボでTCA中間体に変換可能な化合物、エネルギィ強化化合物、及びこれらの混合物から選択された一又はそれ以上の補助薬剤と共に使用されることを特徴とする方法。
【請求項15】
請求項1乃至14のいずれか1項に記載の方法において、前記一又はそれ以上の活性薬剤が、当該活性薬剤と、例えば医薬組成物(薬剤)、フードスタッフ、フードサプリメント、又は飲料(例えば、炭酸入り飲料)、又は、化粧品、眼又は皮膚(皮膚科)組成物などの局所組成物といった、適宜の好適な追加成分を含む組成物において投与されることを特徴とする方法。
【請求項16】
請求項13に記載の方法において、前記一又はそれ以上の活性薬剤が、一又はそれ以上の可溶化剤及び/又は懸濁化剤及び/又は分散化剤を伴う組成物中に存在しており、前記活性薬剤が前記組成物中の、例えば、中鎖トリグリセリド(MCTs)又は中鎖脂肪酸(MCFAs)などの、溶液、又は、懸濁液、又は分散液中に維持されていることを特徴とする方法。
【請求項17】
A/B−cisフロスタン、フロステン、スピロスタン及びスピロステンステロイド性サポゲニン及びそのエステル、エーテル、ケトン及びグリコシル化型から選択され、恒常性を制御した状態で非毒性態様の対象の天然NFsを調整し、一又はそれ以上の前記薬剤の有効量を対象に投与することによって、対象のNFsの自己制御恒常性を誘発する方法に使用する薬剤。
【請求項18】
請求項2乃至16のいずれか1項に記載の方法に使用する、請求項17に記載の薬剤。
【請求項19】
A/B−cisフロスタン、フロステン、スピロスタン及びスピロステンステロイド性サポゲニン及びそのエステル、エーテル、ケトン及びグリコシル化型から選択された一又はそれ以上の活性薬剤を含み、恒常性を制御した状態で非毒性態様の対象の天然NFsを調整し、一又はそれ以上の前記薬剤の有効量を対象に投与することによって、対象のNFsの自己制御恒常性を誘発する方法に使用する組成物。
【請求項20】
請求項2乃至16のいずれか1項に記載の方法に使用する、請求項15に記載の組成物。
【請求項21】
A/B−cisフロスタン、フロステン、スピロスタン及びスピロステンステロイド性サポゲニン及びそのエステル、エーテル、ケトン及びグリコシル化型から選択された一又はそれ以上の薬剤の、恒常性を制御した状態で非毒性態様の対象の天然NFsを調整することによって、対象におけるNFsの自己制御恒常性を誘発する薬物の製造における使用。
【請求項22】
請求項21に記載の使用において、前記薬物が請求項2乃至16のいずれか1項に記載の方法に使用されることを特徴とする使用。
【請求項1】
対象における例えばBDNF及び/又はGDNFなどの神経栄養因子(NFs)の自己制御恒常性を、恒常性を制御した状態で、非毒性態様で対象の天然NFsを調整することによって誘発する方法において、当該方法が、前記対象に、A/B−cisフロスタン、フロステン、スピロスタンとスピロステンステロイド性サポゲニン及びこのエステル、エーテル、ケトン及びグリコシル化型から選択された、有効量の一又はそれ以上の薬剤を投与するステップを具えることを特徴とする方法。
【請求項2】
請求項1に記載の方法において、前記NFsの自己制御恒常性の誘発が、例えばNGFなどのNFsの過剰誘発、過剰刺激、又は過剰増強に関連する、及び、受容体のアンタゴニスト又はアゴニスト作用に関連する、及び酵素結合作用に関連する、制限された対処可能な副作用で生じることを特徴とする方法。
【請求項3】
請求項1に記載の方法において、当該方法が、例えば:
(a)例えば、痴呆症、加齢に関連した認識機能障害、アルツハイマー病、アルツハイマー型老年性認知症(SDAT)、レヴィー小体認知症、血管性認知症、パーキンソン病、脳炎後のパーキンソン病、脳炎後及びその他のパーキンソン病以外の理由によるパーキンソン症候群、顔面肩甲上腕型筋ジストロフィーを含む筋ジストロフィー(FSH)、デュシェンヌ型筋ジストロフィー、ベッカー型筋ジストロフィー及びブルース型筋ジストロフィー(Bruce’s muscular dystrophy)、フックスジストロフィー(Fuchs’dystrophy)、筋緊張性ジストロフィー、角膜ジストロフィー、反射性交感神経性ジストロフィー症候群(RSDSA)、神経血管ジストロフィー(neurovascular dystrophy)、重症筋無力症、ランバート・イートン病、ハンチントン病、筋萎縮性側索硬化症(ALS)を含む運動ニューロン疾患、乳児脊髄性筋萎縮症(infantile spinal atrophy)、多発性硬化症、起立性低血圧、疼痛、神経痛、下記のような発作及び事故のような外傷性神経変性(例えば、外傷性の頭部又は脳の損傷、又は脊髄の損傷)、バトン病、コケーン症候群、ダウン症候群、大脳皮質基底核神経節変性症、多系統萎縮症、脳萎縮症、オリーブ橋小脳萎縮症、歯状核赤核萎縮症(dentatorubral atrophy)、淡蒼球ルイ体萎縮症(pallidoluysian atrophy)、球脊髄性萎縮症(spinobulbar atrophy)、視神経炎、硬化性全脳炎(SSPE)、注意欠陥障害、ポストウイルス性脳炎(post−viral encephalitis)、ポリオ後症候群、ファール症候群、ジュベール症候群、ギラン・バレー症候群、無脳回症、もやもや病、神経細胞移動障害、自閉性症候群(autistic syndrome)、ポリグルタミン病、ニーマン・ピック病、進行性多巣性白質脳症、偽脳腫瘍、レフサム病、ツェルヴェーガー症候群、核上性麻痺、フリードライヒ失調症、脊髄小脳失調症2型(spinocerebellar ataxia type 2)、レット症候群、シャイ・ドレーガー症候群、結節性硬化症、ピック病、慢性疲労症候群、遺伝性ニューロパシーを含む神経障害、糖尿病性神経障害及び有糸分裂性神経障害、クロイツフェルト・ヤコブ病(CJD)、変異型CJD、新変異型CJDを含むプリオンベースの神経変性、牛海綿状脳症(狂牛病)(BSE)、GSS、FFI、クールー病及びアルパーズ症候群、ジョセフ病、急性散在性脳脊髄炎、くも膜炎、中枢神経系の血管障害、四肢神経機能の喪失、シャルコー・マリー・トゥース病、クラッベ病、白質萎縮症、心不全への罹患性、喘息、てんかん、聴覚神経変性(auditory neurodegeneration)、黄斑変性症、色素性網膜症(pigmentary retinitis)、及び緑内障に起因する視神経変性から選択される、神経性疾患の治療又は予防;
(b)例えば、不安障害(例えば、急性ストレス障害、パニック障害、広場恐怖症、社会恐怖症、特定恐怖症、強迫性障害、心的外傷後ストレス障害、身体醜形障害及び全般性不安障害)、性的不安障害(例えば、膣痙、男性の勃起不全、男性のオルガズム障害、女性のオルガズム障害)、小児期障害(例えば、注意欠陥・多動性障害(ADHD)、アスペルガー症候群、自閉性障害、行為障害、反抗的行為障害、分離不安障害及びトゥレット障害)、摂食障害(例えば、拒食症及び過食症)、気分障害(例えば、鬱病、大鬱病性障害、双極性障害(躁鬱病)、季節性情動障害(SAD)、気分循環性障害及び気分変調性障害)、睡眠障害、認知精神障害(cognitive psychiatric disorders)(例えば、せん妄、健忘障害)、人格障害(例えば、妄想性人格障害、分裂病質人格障害、統合失調症性人格障害、反社会的人格障害、境界性型人格障害、演技性人格障害、自己愛性人格障害、回避性人格障害、依存性人格障害及び強迫性人格障害)、精神病性障害(例えば、統合失調症、妄想性障害、短期的精神障害(brief psychotic disorder)、統合失調症様障害、分裂情動性障害及び共有精神病性障害)、及び物質関連障害(例えば、アルコール依存症、覚醒剤依存症、大麻依存症、コカイン依存症、幻覚剤依存症、吸入依存症、ニコチン依存症、オピオイド依存症、フェンシクリジン依存症及び鎮静剤依存症)から選択される、精神疾患の治療又は予防;
(c)例えば、咳、掻痒症、食物不耐性、乾癬、クループ、過敏性腸症候群、耳鳴り、メニエール病、ストレスによる潰瘍又はアセチルサリチル酸による潰瘍、アレルギー性鼻炎、アレルギー性皮膚炎、結膜炎、炎症、炎症性大腸炎、回腸炎、膵炎、胆嚢炎、非アレルギー性鼻炎、食道炎、変形性関節炎、関節リウマチ、花粉症、家ダニアレルギー、ペットアレルギー、ハンチントン病、急性炎症性痛覚、内臓痛、歯痛及び頭痛、炎症性痛覚過敏、触知性痛覚過敏、アレルギー性皮膚反応、目のアレルギー反応、喘息、アテローム性動脈硬化症、関節炎、慢性潰瘍(例えば、関節リウマチに関連する慢性の血管炎性潰瘍(chronic vasculitic ulcer))、湿疹、正常な呼吸の維持、喉痛及び咳の軽減、正常な消化の維持の補助、胃のむかつきの緩和、鼻炎薬としての風邪及びインフルエンザからの回復の補助、頭痛の軽減、筋肉痛の緩和、軽い痛みの緩和、歯痛からの回復の提供、口内炎又は胃潰瘍からの回復の提供、及び健康な関節の維持から選択される、炎症性又はアレルギー性疾患の治療及び予防;
(d)例えば、AIDSなどの免疫不全状態、免疫活動過剰症状、及び、例えば、全身性エリトマトーシス(SLE)などの自己免疫疾患といった、低下した免疫特性の症状から選択される、免疫性疾患の治療及び予防;及び
(e)例えば、乳、甲状腺、大腸、肺、卵巣、皮膚、筋肉、膵臓、前立腺、腎臓、生殖器、血液、免疫システム(例えば、脾臓、胸腺及び骨髄)、脳、末梢神経系及び皮膚(例えば、メラノーマ及びカポジ肉腫)の癌から選択される、ヒト及び必要に応じて非ヒト哺乳動物における、腫瘍性疾患の治療及び予防;
から選択された、NF介在疾患の治療又は予防方法と共に使用されることを特徴とする方法。
【請求項4】
請求項1に記載の方法において、当該方法が、ニューロン、ニューロン機能又はニューロンネットワークの回復又は再生法、ニューロンへの血流の再生又は正常化を行う方法、例えば外傷後の神経の再構築、組織移植、術後の神経の再構築など、障害を受けた組織の再生及び治癒方法、心臓発作、TIAsあるいはその他の虚血からの回復を支援する方法、創傷、骨及び筋肉の治癒を支援する方法、神経病症状あるいはニューロンの異常を正常化する方法、あるいは、移植した細胞の生存率を上げて、生存細胞効率を改善するための胎児細胞、幹細胞、又はその他の細胞治療方法、又はこれらの組み合わせ、と共に使用されることを特徴とする方法。
【請求項5】
請求項1に記載の方法において、前記方法が異常行動あるは個体的特徴を治療又は予防する方法と共に使用されることを特徴とする方法。
【請求項6】
請求項1に記載の方法において、前記方法が創傷治癒の支援と共に使用されることを特徴とする方法。
【請求項7】
請求項1に記載の方法において、前記方法が、例えば老化、しわ、あるいは日光、風、雨、冷気又はその他のダメージを与える媒体に露出させる効果から皮膚の回復を促進する、といった皮膚、骨、眼、筋肉及びその他の組織の健康を改善する非治療的方法と共に、あるいは、運動、労働あるいは消耗からの筋肉と組織の回復を含み、持久力を改善し、疲労感を低減する、健康で良好な状態に関するその他の態様を提供する非治療的使用と共に、使用されることを特徴とする方法。
【請求項8】
請求項1に記載の方法において、当該方法が、人口の正常範囲内にあり、診断可能でない疾患である、神経症状及び精神症状の治療及び予防のための非治療的方法と共に使用されることを特徴とする方法。
【請求項9】
請求項1乃至8のいずれか1項に記載の方法において、前記方法が、天然にBDNF又はGDNFを過剰発現している、あるいは、NF様あるいは刺激の精神的副作用にかかりやすい、又は、受容体アンタゴニスト、受容体アゴニスト又は酵素相互作用薬剤の受容体介在又は酵素介在副作用にかかりやすい個体である、ヒト又は動物に使用されることを特徴とする方法。
【請求項10】
請求項1乃至9のいずれか1項に記載の方法において、前記活性薬剤が外部から投与された神経栄養因子を伴うことなく使用されることを特徴とする方法。
【請求項11】
請求項1乃至10のいずれか1項に記載の方法において、前記方法が、対象への投与プロトコルの臨床制御を伴わない状況で使用されることを特徴とする方法。
【請求項12】
請求項1乃至11のいずれか1項に記載の方法において、前記活性薬剤が、サルササポゲニン、スミラゲニン、エピサルササポゲニン、エピスミラゲニン、チモサポニンBII、メタゲニン、サモゲニン、ジオチゲニン、イソジオチゲニン、テクソゲニン、ヨノゲニン、メクソゲニン、及びマルコゲニン、及びこれらの対応するエステル、エーテル、ケトン、及びサポニン(グリコシル化)誘導体から選択されることを特徴とする方法。
【請求項13】
請求項1乃至12のいずれか1項に記載の方法において、前記活性薬剤が、サルササポゲニン、スミラゲニン、及びこれらの対応するエステル、エーテル、ケトン、及びサポニン(グリコシル化)誘導体から選択されることを特徴とする方法。
【請求項14】
請求項1乃至13のいずれか1項に記載の方法において、前記一又はそれ以上の活性薬剤が、代謝アジュバント、ケトンの本体レベルを上げる化合物(ケト原生化合物)、トリカルボキシル酸(TCA)サイクル中間体、インビボでTCA中間体に変換可能な化合物、エネルギィ強化化合物、及びこれらの混合物から選択された一又はそれ以上の補助薬剤と共に使用されることを特徴とする方法。
【請求項15】
請求項1乃至14のいずれか1項に記載の方法において、前記一又はそれ以上の活性薬剤が、当該活性薬剤と、例えば医薬組成物(薬剤)、フードスタッフ、フードサプリメント、又は飲料(例えば、炭酸入り飲料)、又は、化粧品、眼又は皮膚(皮膚科)組成物などの局所組成物といった、適宜の好適な追加成分を含む組成物において投与されることを特徴とする方法。
【請求項16】
請求項13に記載の方法において、前記一又はそれ以上の活性薬剤が、一又はそれ以上の可溶化剤及び/又は懸濁化剤及び/又は分散化剤を伴う組成物中に存在しており、前記活性薬剤が前記組成物中の、例えば、中鎖トリグリセリド(MCTs)又は中鎖脂肪酸(MCFAs)などの、溶液、又は、懸濁液、又は分散液中に維持されていることを特徴とする方法。
【請求項17】
A/B−cisフロスタン、フロステン、スピロスタン及びスピロステンステロイド性サポゲニン及びそのエステル、エーテル、ケトン及びグリコシル化型から選択され、恒常性を制御した状態で非毒性態様の対象の天然NFsを調整し、一又はそれ以上の前記薬剤の有効量を対象に投与することによって、対象のNFsの自己制御恒常性を誘発する方法に使用する薬剤。
【請求項18】
請求項2乃至16のいずれか1項に記載の方法に使用する、請求項17に記載の薬剤。
【請求項19】
A/B−cisフロスタン、フロステン、スピロスタン及びスピロステンステロイド性サポゲニン及びそのエステル、エーテル、ケトン及びグリコシル化型から選択された一又はそれ以上の活性薬剤を含み、恒常性を制御した状態で非毒性態様の対象の天然NFsを調整し、一又はそれ以上の前記薬剤の有効量を対象に投与することによって、対象のNFsの自己制御恒常性を誘発する方法に使用する組成物。
【請求項20】
請求項2乃至16のいずれか1項に記載の方法に使用する、請求項15に記載の組成物。
【請求項21】
A/B−cisフロスタン、フロステン、スピロスタン及びスピロステンステロイド性サポゲニン及びそのエステル、エーテル、ケトン及びグリコシル化型から選択された一又はそれ以上の薬剤の、恒常性を制御した状態で非毒性態様の対象の天然NFsを調整することによって、対象におけるNFsの自己制御恒常性を誘発する薬物の製造における使用。
【請求項22】
請求項21に記載の使用において、前記薬物が請求項2乃至16のいずれか1項に記載の方法に使用されることを特徴とする使用。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2012−515754(P2012−515754A)
【公表日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願番号】特願2011−546964(P2011−546964)
【出願日】平成22年1月22日(2010.1.22)
【国際出願番号】PCT/GB2010/050098
【国際公開番号】WO2010/084356
【国際公開日】平成22年7月29日(2010.7.29)
【出願人】(511178522)ファイトファーム ピーエルシー (1)
【氏名又は名称原語表記】PHYTOPHARM PLC
【Fターム(参考)】
【公表日】平成24年7月12日(2012.7.12)
【国際特許分類】
【出願日】平成22年1月22日(2010.1.22)
【国際出願番号】PCT/GB2010/050098
【国際公開番号】WO2010/084356
【国際公開日】平成22年7月29日(2010.7.29)
【出願人】(511178522)ファイトファーム ピーエルシー (1)
【氏名又は名称原語表記】PHYTOPHARM PLC
【Fターム(参考)】
[ Back to top ]

