AZD2171およびAZD6244またはMEK阻害剤IIを含む併用療法
本発明は、ヒトのような温血動物(任意に電離放射線で治療されていてもよい)において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法、具体的には、AZD6244またはMEK阻害剤II;AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含む医薬組成物を併用したAZD2171の投与を含む、癌の治療方法、具体的には充実性腫瘍に関連する癌の治療方法;ヒトまたは動物の体を療法によって治療する方法で使用するための、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含む組み合わせ製品;AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含むキット;ヒトのような温血動物(任意に電離放射線で治療されていてもよい)において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用する医薬品の製造における、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIの使用に関する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ヒトのような温血動物(任意に電離放射線で治療されていてもよい)において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法、具体的には、AZD6244またはMEK阻害剤II;AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含む医薬組成物を併用したAZD2171の投与を含む、癌の治療方法、具体的には充実性腫瘍に関連する癌の治療方法;ヒトまたは動物の体を療法によって治療する方法で使用するための、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含む組み合わせ製品;AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含むキット;ヒトのような温血動物(任意に電離放射線で治療されていてもよい)において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用する医薬品の製造における、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIの使用に関する。
【背景技術】
【0002】
正常な血管新生は、胚発生、創傷治癒、および、雌の生殖機能の数々の要素などの様々なプロセスにおいて重要な役割を果たす。望ましくない、または、病的な血管新生は、糖尿病性網膜症、乾癬、癌、リウマチ様関節炎、アテローム、カポジ肉腫、および、血管腫などの病状に関連している(Fan et al, 1995, Trends Pharmacol. Sci. 16: 57-66; Folkman, 1995, Nature Medicine 1: 27-31)。血管透過性を変化させることは、正常な生理学的プロセスと病的な生理学的プロセスとの両方において役割を果たすと考えられる(Cullinan-Bove et al, 1993, Endocrinology 133: 829-837; Senger et al, 1993, Cancer and Metastasis Reviews, 12: 303-324)。インビトロにおける内皮細胞増殖を促進する活性を有する数種のポリペプチドが同定されており、例えば酸性および塩基性線維芽細胞増殖因子(aFGFおよびbFGF)、および、血管内皮増殖因子(VEGF)などが挙げられる。VEGFの増殖因子活性は、受容体の発現が制限されているために、FGFの増殖因子活性と比べて内皮細胞に対して特異的である。近年の証拠によれば、VEGFは、正常な、および、病的な血管新生(Jakeman et al, 1993, Endocrinology, 133: 848-859; Kolch et al, 1995, Breast Cancer Research and Treatment, 36:139-155)ならびに血管透過性(Connolly et al, 1989, J. Biol. Chem. 264: 20017-20024)の両方にとって重要な刺激因子であることが示されている。抗体がVEGFを捕獲することによるVEGF作用の拮抗作用のために、腫瘍増殖の阻害が生じる可能性がある(Kim et al, 1993, Nature 362: 841-844)。
【0003】
受容体チロシンキナーゼ(RTK)は、細胞の細胞質膜を通過する生化学シグナルの伝達において重要である。これらの膜貫通分子は、細胞質膜中のセグメントを介して細胞内のチロシンキナーゼドメインへ連結される細胞外のリガンド結合ドメインからなることを特徴とする。リガンドが受容体へ結合すると、受容体に関するチロシンキナーゼ活性の刺激が生じ、それにより、受容体およびその他の細胞内分子の両方においてチロシン残基のリン酸化が起こる。これらのチロシンリン酸化の変化は、様々な細胞の応答をもたらすシグナル伝達カスケードを開始させる。これまで、少なくとも19種の別個のRTKサブファミリーがアミノ酸配列相同性によって認識され、同定されている。現在のところ、これらのサブファミリーのうち1種は、fms様チロシンキナーゼ受容体、Flt−1(また、VEGFR−1とも称される)、キナーゼインサートドメイン含有受容体、KDR(また、VEGFR−2またはFlk−1とも称される)、および、その他のfms様チロシンキナーゼ受容体、Flt−4(また、VEGFR−3とも称される)で構成されている。これらの関連RTKのうち2種、すなわちFlt−1およびKDRは、VEGFと高親和性で結合することが示されている(De Vries et al, 1992, Science 255: 989-991; Terman et al, 1992, Biochem. Biophys. Res. Comm. 1992, 187: 1579-1586)。VEGFの異種細胞で発現されたそれらの受容体への結合は、細胞タンパク質のチロシンリン酸化状態の変化、および、カルシウム流出との関連を示す。
【0004】
VEGFは、脈管形成および血管新生に関する主要な刺激因子である。このサイトカインは、内皮細胞増殖、プロテアーゼ発現および移動、ならびにそれに続く毛細管を形成するための細胞の組織化を誘導することによって、血管を形成する表現型を誘導する(Keck, P.J., Hauser, S.D., Krivi, G., Sanzo, K., Warren, T., Feder, J., and Connolly, D.T., Science (Washington DC), 246: 1309-1312, 1989; Lamoreaux, W.J., Fitzgerald, M.E., Reiner, A., Hasty, K.A., and Charles, S.T., Microvasc. Res., 55: 29-42, 1998; Pepper, M.S., Montesano, R., Mandroita, S.J., Orci, L. and Vassalli, J.D., Enzyme Protein, 49: 138-162, 1996)。加えてVEGFは、有意な血管透過性(Dvorak, H.F., Detmar, M., Claffey, K.P., Nagy, J.A., van de Water, L., and Senger, D.R., (Int. Arch. Allergy Immunol., 107: 233-235, 1995; Bates, D.O., Heald, R.I., Curry, F.E. and Williams, B. J. Physiol. (Lond.), 533: 263-272, 2001)、病的な血管新生に特徴的な超透過性の未成熟な血管ネットワークの促進形成を誘導する。
【0005】
VEGFに対する全ての主要な表現型応答、例えば内皮細胞増殖、移動および生存、ならびに血管透過性の誘導を促進するには、KDR単独の活性化で十分であることが示されている(Meyer, M., Clauss, M., Lepple-Wienhues, A., Waltenberger, J., Augustin, H.G., Ziche, M., Lanz, C., Buttner, M., Rziha, H-J., and Dehio, C., EMBO J., 18: 363-374, 1999; Zeng, H., Sanyal, S. and Mukhopadhyay, D., J. Biol. Chem., 276: 32714-32719, 2001; Gille, H., Kowalski, J., Li, B., LeCouter, J., Moffat, B, Zioncheck, T.F., Pelletier, N. and Ferrara, N., J. Biol. Chem., 276: 3222-3230, 2001)。
【0006】
国際特許出願公報番号WO00/47212で、VEGF 受容体チロシンキナーゼの阻害剤であるキナゾリン誘導体が説明されている。WO00/47212において、AZD2171が説明されており、これは、そこでは実施例240である。AZD2171は、4−(4−フルオロ−2−メチル−1H−インドール−5−イルオキシ)−6−メトキシ−7−(3−(ピロリジン−1−イル)プロポキシ)キナゾリンである:
【0007】
【化1】

【0008】
WO00/47212(80〜83頁)で説明されているように、AZD2171は、インビトロでの(a)酵素および(b)HUVEC分析において優れた活性を示す。酵素分析において、単離したKDR(VEGFR−2)、Flt−1(VEGFR−1)、および、Flt−4(VEGFR−3)チロシンキナーゼ活性の阻害に関するAZD2171のIC50値は、それぞれ≦2nM、5±2nM、および、≦3nMであった。AZD2171は、VEGFによって刺激された内皮細胞増殖を強く阻害するが(HUVEC分析において、IC50値は0.4±0.2nM)、1250倍より高い濃度では基底の内皮細胞増殖をそれほど阻害しない(IC50値は、>500nMである)。WO00/47212(83頁)で説明されているインビボでの充実性腫瘍モデルにおけるCalu−6腫瘍の異種移植片の増殖は、それぞれ1.5、3および6mg/kg/日のAZD2171(P**≦0.01、P***≦0.0001;片側t検定)で1日1回経口治療してから28日後に、49%**、69%***、および、91%***阻害された。AZD2171は、1日1回経口投与した後の様々なモデルにおいて広範な抗腫瘍活性を惹起することが示されている(Wedge et al., 2005, Cancer Research 65: 4389-4440)。
【0009】
AZD2171、それに加えて、KDRを阻害することによって血管新生抑制作用および/または血管透過性抑制作用を生じさせることは、幹細胞因子受容体チロシンキナーゼ(SCF RTK、一般的にはc−Kitとしてよく知られている)の阻害を介して腫瘍細胞に追加の直接的な増殖抑制効果を有する可能性がある。我々は、AZD2171はc−Kitを阻害することを見出したことから、AZD2171が突然変異型および野生型c−Kitを阻害することが期待される。c−KitおよびそのリガンドSCFは、多数の充実性腫瘍および血液悪性疾患で見出されており、例えば、消化管間質腫瘍、原発性脳腫瘍、例えばグリア芽腫、神経膠腫、および、髄芽細胞腫、小細胞肺癌(SCLC)、悪性中皮腫、精巣腫瘍、例えば精上皮腫、および、精巣の奇形癌、卵巣腫瘍、例えば未分化胚細胞腫、および、性腺芽細胞腫、慢性骨髄性白血病(CML)、急性骨髄性白血病(AML)、ならびに、肥満細胞症などで見出されている(例えば、Jnl. Clin. Oncol., 2004, 22, 4514-4522を参照)。さらにc−Kitは、肝細胞癌(Am J Clin Pathol. 2005 Jul;124(1):31-6)、および、結腸直腸癌腫(Case Reports Tumour Biol. 1993;14(5):295-302)にも見出されている。c−Kitは、消化器系の腫瘍(GIST)(Bumming et al, 2003 Br J Cancer 89, 460-464)、小細胞肺癌(SCLC)(Pott et. al., 2003, Annals of Oncology 14: 894-879)、および、慢性骨髄性白血病(CML)、(Goselink et al.1992, Blood 80, 750-757 and Muroi et al, 1995, Leuk Lymphoma 16, 297-305)のような所定の癌における重要なシグナル伝達阻害剤である。またc−Kitは、平滑筋肉腫のような軟部組織肉腫においても重要なシグナル伝達阻害剤でもある。
【0010】
WO00/47212において、本発明の化合物は:
「単独療法として適用してもよいし、または、本発明の化合物に加えて、1種またはそれ以上のその他の物質および/または治療を併用してもよい。このような併用治療は、治療の個々の構成要素を同時に、連続的に、または、別々に投与することによって達成することもできる」
ということが述べられている。
【0011】
さらにWO00/47212では、このような併用治療の例、例えば外科手術、放射線治療、および、様々なタイプの化学療法剤などの説明が続く。
【0012】
WO00/47212に、本発明の化合物とMEK阻害剤との組み合わせを示唆する記載はどこにもない。
【0013】
WO00/47212に、癌などの何らかの病状を治療するための、本発明の化合物と、AZD6244またはMEK阻害剤IIとの組み合わせを示唆する記載はどこにもない。
【0014】
WO00/47212に、AZD2171およびAZD6244の特定の組み合わせを示唆する記載はどこにもない。
【0015】
WO00/47212に、AZD2171およびMEK阻害剤IIの特定の組み合わせを示唆する記載はどこにもない。
【0016】
WO05/061488において、AZD2171のマレイン酸塩が説明されている。WO05/061488において、「AZD2171のマレイン酸塩は、血管新生抑制剤および/または血管透過性抑制剤であり、単独療法として適用してもよいし、または、AZD2171のマレイン酸塩に加えて、1種またはそれ以上のその他の物質および/または治療を併用してもよい。このような併用治療は、治療の個々の構成要素を同時に、連続的に、または、別々に投与することによって達成することもできる」ということが述べられている。
【0017】
さらにWO05/016488は、続いて、このような併用治療の例、例えば外科手術、放射線治療、および、様々なタイプの化学療法剤などの説明が続く。
【0018】
WO05/061488に、本発明の化合物とMEK阻害剤との組み合わせを示唆する記載はどこにもない。
【0019】
WO05/061488に、癌などの何らかの病状を治療するための、本発明の化合物と、AZD6244またはMEK阻害剤IIとの組み合わせを示唆する記載はどこにもない。
【0020】
WO05/061488に、AZD2171およびAZD6244の特定の組み合わせを示唆する記載はどこにもない。
【0021】
WO05/061488に、AZD2171およびMEK阻害剤IIの特定の組み合わせを示唆する記載はどこにもない。
【0022】
WO00/47212およびWO05/061488に、本発明のいずれかの化合物とその他の治療との併用によって、驚くべき有益な作用を生じると予想されるということはどこにも述べられていない。
【先行技術文献】
【特許文献】
【0023】
【特許文献1】WO00/47212
【特許文献2】WO05/061488
【特許文献3】WO03/077914
【非特許文献】
【0024】
【非特許文献1】Fanet al, 1995, Trends Pharmacol. Sci. 16: 57-66
【非特許文献2】Folkman, 1995, Nature Medicine 1: 27-31)
【非特許文献3】Cullinan-Bove et al, 1993, Endocrinology 133: 829-837
【非特許文献4】Senger et al, 1993, Cancer and Metastasis Reviews, 12: 303-324
【非特許文献5】Jakeman et al, 1993, Endocrinology, 133: 848-859
【非特許文献6】Kolch et al, 1995, Breast Cancer Research and Treatment, 36:139-155
【非特許文献7】Connolly et al, 1989, J. Biol. Chem. 264: 20017-20024
【非特許文献8】Kim et al, 1993, Nature 362: 841-844
【非特許文献9】De Vrieset al, 1992, Science 255: 989-991
【非特許文献10】Termanet al, 1992, Biochem. Biophys. Res. Comm. 1992, 187: 1579-1586
【非特許文献11】Keck, P.J., Hauser, S.D., Krivi, G., Sanzo, K., Warren, T., Feder, J., and Connolly, D.T., Science (Washington DC)
【非特許文献12】Lamoreaux, W.J., Fitzgerald, M.E., Reiner, A., Hasty, K.A., and Charles, S.T., Microvasc. Res., 55: 29-42, 1998
【非特許文献13】Pepper, M.S., Montesano, R., Mandroita, S.J., Orci, L. and Vassalli, J.D., Enzyme Protein, 49: 138-162, 1996.
【非特許文献14】Dvorak, H.F., Detmar, M., Claffey, K.P., Nagy, J.A., van de Water, L., and Senger, D.R.,(Int. Arch. Allergy Immunol., 107: 233-235, 1995)
【非特許文献15】Bates, D.O., Heald, R.I., Curry, F.E. and Williams, B. J. Physiol.(Lond.), 533: 263-272, 2001
【非特許文献16】Meyer, M., Clauss, M., Lepple-Wienhues, A., Waltenberger, J., Augustin, H.G., Ziche, M., Lanz, C., Buttner, M., Rziha, H-J., and Dehio, C., EMBO J., 18: 363-374, 1999
【非特許文献17】Zeng, H., Sanyal, S. and Mukhopadhyay, D., J. Biol. Chem., 276: 32714-32719, 2001
【非特許文献18】Gille, H., Kowalski, J., Li, B., LeCouter, J., Moffat, B, Zioncheck, T.F., Pelletier, N. and Ferrara, N., J. Biol. Chem., 276: 3222-3230, 2001
【非特許文献19】Wedge et al., 2005, Cancer Research 65: 4389-4440
【非特許文献20】Jnl. Clin. Oncol., 2004, 22, 4514-4522
【非特許文献21】Am J Clin Pathol. 2005 Jul;124(1):31-6
【非特許文献22】Case Reports Tumour Biol. 1993;14(5):295-302
【非特許文献23】Bumming et al, 2003 Br J Cancer 89, 460-464
【非特許文献24】Pott et. al., 2003, Annals of Oncology 14: 894-879
【非特許文献25】Goselinket al.1992, Blood 80, 750-757
【非特許文献26】Muroiet al, 1995, Leuk Lymphoma 16, 297-305
【発明の概要】
【0025】
ここで我々は、意外なことに、および、驚くべきことに、特定の化合物AZD2171をMEK阻害剤であるAZD6244と組み合わせて使用すると、AZD2171およびAZD6244のいずれか一方を単独で使用した場合よりも有意に優れた作用を生じることを見出した。具体的には、AZD2171をAZD6244と組み合わせて使用すると、充実性腫瘍に対して、AZD2171およびAZD6244のいずれか一方を単独で使用した場合よりも有意に優れた作用を生じる。
【0026】
ここで我々は、意外なことに、および、驚くべきことに、特定の化合物AZD2171を、MEK阻害剤であるMEK阻害剤IIと組み合わせて使用すると、AZD2171およびMEK阻害剤IIのいずれか一方を単独で使用した場合よりも有意に優れた作用を生じることを見出した。具体的には、AZD2171をMEK阻害剤IIと組み合わせて使用すると、充実性腫瘍に対して、AZD2171およびMEK阻害剤IIのいずれか一方を単独で使用した場合よりも有意に優れた作用を生じる。
【図面の簡単な説明】
【0027】
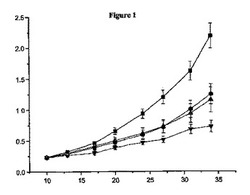
【図1】無胸腺マウスにおけるCalu−6腫瘍増殖に対するAZD2171、AZD6244または併用療法の作用を示す。
【発明を実施するための形態】
【0028】
近年、細胞のDNAの一部が、腫瘍遺伝子、すなわち活性化されると悪性腫瘍細胞の形成を引き起こす遺伝子に形質転換されることによって、その細胞が癌化する可能性があることが発見された(Bradshaw, Mutagenesis, 1986, 1, 91)。悪性細胞の主要な特性の1つは、移動および侵入して、周囲の組織に移動して、宿主の組織破壊および二次的な転移性病巣の形成を引き起こす能力である。これを達成するために、腫瘍細胞は、様々なシグナル伝達経路の構成要素が腫瘍形成性を活性化した結果として、運動性および浸潤性の表現型を獲得しなければならない。腫瘍遺伝子は、増殖因子の受容体であるペプチドの生産を引き起こす。増殖因子と受容体との複合体が活性化されると、それに続いて細胞の増殖、運動性および浸潤の増加が起こる。腫瘍遺伝子は、受容体チロシンキナーゼ、セリン−スレオニンキナーゼ、または、下流シグナル伝達分子(例えばras遺伝子)のようなシグナル経路の構成要素の異常型をコードすることが多い。ras遺伝子は、結合したグアノシン三リン酸(GTP)をグアノシン二リン酸塩(GDP)に加水分解する、密接に関連した小さいグアニンヌクレオチド結合タンパク質をコードする。rasタンパク質は、それらがGTPに結合した場合に、細胞増殖、形質転換および浸潤の促進において活性であり、それらがGDPに結合した場合に不活性である。p21rasの形質転換による突然変異体は、それらのGTPアーゼ活性が不完全であるため、活性なGTPと結合した状態のままである。ras腫瘍遺伝子は、所定の癌において不可欠な役割を果たすことがわかっており、ヒトの癌の全ケースのうち20%を超えるケースにおいて形成に寄与することが見出された。
【0029】
増殖因子のようなリガンドによって活性化されると、分裂促進性の応答と共役する細胞表面受容体は、連鎖反応を開始させることができ、それにより、rasタンパク質においてグアニンヌクレオチド交換活性の活性化を起こすことができる。rasタンパク質がその活性なGTPに結合した状態の場合、細胞質膜で多数のその他のタンパクがrasと直接的に相互作用し、それにより、数種の別個の経路を介してシグナル伝達が起こる。最も特徴的なエフェクタータンパク質は、raf癌原遺伝子産物である。細胞増殖の制御において、rafとrasとの相互作用は主要な調節工程である。rafセリン−スレオニンキナーゼのras介在活性化は、順に、マイトジェン活性化プロテインキナーゼ(細胞外シグナルで調節されたプロテインキナーゼとして知られているMAPK、または、ERK1およびERK2)のすぐ上流の活性化因子である二重特異性を有するキナーゼMEK(MEK1およびMEK2)を活性化する。これまでMAPK以外にMEKの基質は同定されておらず、近年の報告によれば、MEKは、その他の上流シグナルタンパク質、例えばMEKK1およびCot/Tpl−2によって活性化される可能性もあることが示されている。活性化されたMAPKは移動して細胞核中に蓄積するが、ここでMAPKは、Elk−1およびSap1aのような転写因子をリン酸化して、活性化することができ、それにより、c−fosのような遺伝子の強化された発現が起こる。加えて、活性化されたMAPKはまた、その他のキナーゼ、例えばp90RSK、および、細胞骨格のタンパク質もリン酸化する。
【0030】
ras−依存性raf−MEK−MAPKカスケードは、細胞表面からの分裂促進、生存および浸潤シグナルそれぞれを細胞核に運搬して、遺伝子発現および細胞運命に変化をもたらすことに関与する主要なシグナル伝達経路の1つである。p21rasの形質転換による突然変異体は、構成的に活性であり、raf、MEKおよびMAPK活性、ならびに細胞の形質転換を引き起こす。構成的で高いキナーゼ活性を生じるBRAFの形質転換による突然変異体は、ヒトの癌のうち約7%に見出されており、MEKおよびMAPKの活性化を引き起こす。アンチセンスraf、ドミナントネガティブMEK突然変異体、または、選択的な阻害剤であるPD098059のいずれかを用いたMEK活性の阻害は、ras−形質転換線維芽細胞の増殖および形態学的な形質転換、細胞運動性および浸潤をブロックすることが示されている。
【0031】
raf、MEKおよびMAPKの活性化メカニズムは、特定のセリン、スレオニンまたはチロシン残基におけるリン酸化を介してなされる。活性化されたrafおよびその他のキナーゼは、S218およびS222においてMEK1をリン酸化し、S222およびS226においてMEK2をリン酸化する。それによりMEKの活性化が起こり、続いて、二重特異性を有するキナーゼMEK1およびMEK2により、T190およびY192においてERK1のリン酸化および活性化、ならびにT183およびY185においてERK2のリン酸化および活性化が起こる。MEKは多数のプロテインキナーゼによって活性化が可能であるが、活性なMAPKは、転写因子、その他のプロテインキナーゼおよび細胞質のタンパク質などの多数の基質タンパク質(そのうちいくつかは浸潤プロセスに関与する)をリン酸化して活性化し、MEKは、MAPKの特異的で唯一の活性化因子のようであり、いくつかのカスケードにまたがって調節するための中心として作用する可能性がある。MEK1およびMEK2アイソフォームは異常な特異性を示し、さらに、他の既知のMEKファミリーのどれにも存在しない触媒サブドメインIXとXとの間にプロリン豊富なインサートも含む。このようなMEKとその他のプロテインキナーゼとの差は、血管増殖性および浸潤性のシグナル伝達におけるMEK(MEK1、MEK2)および、最近ではMEK5の既知の役割と共に、増殖性疾患および浸潤性疾患に使用するための治療剤として、選択的なMEK阻害剤を発見して、それらを使用することは可能であることを示唆している。
【0032】
従って、MAPKキナーゼ経路の阻害剤は、充実性腫瘍関連の疾患の封じ込めおよび/または治療に使用するための増殖抑制剤および抗浸潤剤の両方として有用であろうということが認識されている。
【0033】
国際特許出願公報番号WO03/077914で、MEK阻害剤が説明されている。WO03/077914において、AZD6244が説明されており、これは、そこでは実施例10である。AZD6244は、6−(4−ブロモ−2−クロロ−フェニルアミノ)−7−フルオロ−3−メチル−3H−ベンゾイミダゾール−5−カルボン酸(2−ヒドロキシ−エトキシ)−アミドである:
【0034】
【化2】

【0035】
MEK阻害剤IIは、2−(2−フルオロ−4−ヨードフェニルアミノ)−N−(2−ヒドロキシエトキシ)−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキサミドである:
【0036】
【化3】

【0037】
本発明の治療方法の抗癌作用としては、これらに限定されないが、抗腫瘍作用、反応速度、無増悪期間、および、生存率が挙げられる。本発明の治療方法の抗腫瘍作用としては、これらに限定されないが、腫瘍増殖の阻害、腫瘍増殖の遅延、腫瘍の縮小、腫瘍の減少、治療中断中に腫瘍が再増殖するまでの時間を延長させること、病気の進行を減速させることが挙げられる。本発明の治療方法が癌治療が必要な温血動物(例えばヒト)に施される場合、前記治療方法は、例えば以下のうち1種またはそれ以上:抗腫瘍作用の程度、反応速度、無増悪期間および生存率によって測定した場合に、作用を生じると予想されることが期待される。抗癌作用は予防的治療を含み、加えてすでに罹っている病気の治療も含む。
【0038】
本発明によれば、温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0039】
本発明のさらなる形態によれば、温血動物(例えばヒト)における癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0040】
本発明のさらなる形態によれば、温血動物(例えばヒト)における充実性腫瘍に関連する癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0041】
本発明のさらなる形態によれば、温血動物(例えばヒト)における非小細胞肺癌(NSCLC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0042】
本発明のさらなる形態によれば、温血動物(例えばヒト)における結腸直腸癌(CRC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0043】
本発明のさらなる形態によれば、温血動物(例えばヒト)における膵臓癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0044】
本発明のさらなる形態によれば、温血動物(例えばヒト)における悪性黒色腫の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0045】
本発明のさらなる形態によれば、温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0046】
本発明のさらなる形態によれば、温血動物(例えばヒト)における癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0047】
本発明のさらなる形態によれば、温血動物(例えばヒト)における充実性腫瘍に関連する癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0048】
本発明のさらなる形態によれば、温血動物(例えばヒト)における非小細胞肺癌(NSCLC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0049】
本発明のさらなる形態によれば、温血動物(例えばヒト)における結腸直腸癌(CRC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0050】
本発明のさらなる形態によれば、温血動物(例えばヒト)における膵臓癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0051】
本発明のさらなる形態によれば、温血動物(例えばヒト)における悪性黒色腫の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0052】
本発明のさらなる形態によれば、製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩を含む医薬組成物が提供される。
【0053】
本発明のさらなる形態によれば、製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩を含む医薬組成物が提供される。
【0054】
本発明のさらなる形態によれば、ヒトまたは動物の体を療法によって治療する方法で使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩を含む組み合わせ製品が提供される。
【0055】
本発明のさらなる形態によれば、ヒトまたは動物の体を療法によって治療する方法で使用するための、AZD2171またはそれらの製薬上許容できる塩、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩を含む組み合わせ製品が提供される。
【0056】
本発明のさらなる形態によれば、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩を含むキットが提供される。
【0057】
本発明のさらなる形態によれば:
a)第一の1回投与量中に、AZD2171またはそれらの製薬上許容できる塩;
b)第二の1回投与量中に、AZD6244またはそれらの製薬上許容できる塩;および、
c)前記第一および第二の剤形を包含させるための容器手段、
含むキットが提供される。
【0058】
本発明のさらなる形態によれば:
a)第一の1回投与量中に、製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩;
b)第二の1回投与量中に、製薬上許容できる賦形剤またはキャリアーと共に、AZD6244またはそれらの製薬上許容できる塩;および、
c)前記第一および第二の剤形を包含させるための容器手段、
含むキットが提供される。
【0059】
本発明のさらなる形態によれば、AZD2171またはそれらの製薬上許容できる塩、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩を含むキットが提供される。
【0060】
本発明のさらなる形態によれば:
a)第一の1回投与量中に、AZD2171またはそれらの製薬上許容できる塩;
b)第二の1回投与量中に、MEK阻害剤IIまたはそれらの製薬上許容できる塩;および、
c)前記第一および第二の剤形を包含させるための容器手段、
を含むキットが提供される。
【0061】
本発明のさらなる形態によれば:
a)第一の1回投与量中に、製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩;
b)第二の1回投与量中に、製薬上許容できる賦形剤またはキャリアーと共に、MEK阻害剤IIまたはそれらの製薬上許容できる塩;および、
c)前記第一および第二の剤形を包含させるための容器手段、
を含むキットが提供される。
【0062】
本発明のさらなる形態によれば、血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用する医薬品の製造における、温血動物(例えばヒト)における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0063】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0064】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0065】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、非小細胞肺癌(NSCLC)である。
【0066】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、結腸直腸癌(CRC)である。
【0067】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、膵臓癌である。
【0068】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、悪性黒色腫である。
【0069】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、非小細胞性の肺腫瘍である。
【0070】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、結腸または直腸の腫瘍である。
【0071】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、膵臓の腫瘍である。
【0072】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、悪性黒色腫である。
【0073】
本発明のさらなる形態によれば、温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0074】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0075】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0076】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、非小細胞肺癌(NSCLC)である。
【0077】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、結腸直腸癌(CRC)である。
【0078】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、膵臓癌である。
【0079】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、悪性黒色腫である。
【0080】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、非小細胞性の肺腫瘍である。
【0081】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、結腸または直腸の腫瘍である。
【0082】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、膵臓の腫瘍である。
【0083】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、悪性黒色腫である。
【0084】
本発明のさらなる形態によれば、AZD2171またはそれらの製薬上許容できる塩の有効量の投与(任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい)、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量の同時の、連続的な、または、別々の投与を含む併用療法が提供され;ここでAZD6244またはMEK阻害剤IIは、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよく;このような併用療法は、このような治療的処置が必要な温血動物(例えばヒト)になされる。
【0085】
このような治療的処置としては、血管新生抑制作用および/または血管透過性抑制作用、抗癌作用、および、抗腫瘍作用が挙げられる。
【0086】
本明細書において定義されるような本発明の併用療法は、前記治療の個々の構成要素を、同時に、連続的に、または、別々に投与することによって達成することもできる。本明細書において定義されるような併用療法は、単独療法として適用してもよいし、または、本発明の併用療法に加えて、外科手術もしくは放射線治療、または、追加の化学療法剤を併用してもよい。
【0087】
外科手術は、本明細書において説明されるAZD2171との併用療法を施す前に、その間に、または、その後に、部分的または完全に腫瘍を切除する工程を含んでもよい。
【0088】
任意に本発明の併用療法と共に使用することができるその他の化学療法剤としては、WO00/47212(参照により本発明に包含させる)で説明されているものが挙げられる。このような化学療法は、以下の9つの主要な治療剤のカテゴリーを包む可能性がある:
(i)その他の血管新生抑制剤、例えば血管標的薬剤;
(ii)細胞増殖抑制性剤;
(iii)生体応答調整物質(例えば、インターフェロン);
(iv)抗体(例えば、エドレコロマブ);および、
(v)抗増殖性/抗新生物薬、および、それらの組み合わせ、例えば臨床腫瘍学で用いられるもの;および、その他の物質のカテゴリーとしては、以下が挙げられる:
(vi)アンチセンス療法;
(vii)遺伝子治療アプローチ;および、
(ix)免疫療法アプローチ。
【0089】
本発明の併用療法と共に使用するための化学療法剤の具体的な例は、ペメトレキセド、ラルチトレキセド、エトポシド、ビノレルビン、パクリタキセル、ドセタキセル、シスプラチン、オキサリプラチン、カルボプラチン、ゲムシタビン、イリノテカン(CPT−11)、5−フルオロウラシル(5−FU(例えばカペシタビンなど))、ドキソルビシン、シクロホスファミド、テモゾロマイド、および、ヒドロキシ尿素である。このような組み合わせは、肺癌、頭頚部癌、脳の癌、結腸癌、直腸癌、食道癌、胃癌、子宮頚癌、卵巣癌、皮膚癌、乳癌、膀胱癌、前立腺癌、膵臓癌の治療に特に有用であることが期待され、加えて血液悪性疾患にも特に有用であることが期待される。このような組み合わせは、膵臓癌、結腸直腸癌、悪性黒色腫、および、非小細胞肺癌(NSCLC)の治療に特に有用であることが期待される。
【0090】
AZD2171、AZD6244および電離放射線の三種併用の投与は、AZD2171、AZD6244および電離放射線のいずれか単独で使用することによって達成される作用よりも大きい、AZD2171およびAZD6244の組み合わせを用いて達成される作用よりも大きい、AZD2171および電離放射線の組み合わせを用いて達成される作用よりも大きい、AZD6244および電離放射線の組み合わせを用いて達成される作用よりも大きい作用、例えば抗腫瘍作用を生じる可能性がある。
【0091】
AZD2171、MEK阻害剤IIおよび電離放射線三種併用の投与は、AZD2171、MEK阻害剤IIおよび電離放射線のいずれかを単独で用いて達成される作用よりも大きい、AZD2171およびMEK阻害剤IIの組み合わせを用いて達成される作用よりも大きい、AZD2171および電離放射線の組み合わせを用いて達成される作用よりも大きい、MEK阻害剤IIおよび電離放射線の組み合わせを用いて達成される作用よりも大きい作用、例えば抗腫瘍作用を生じる可能性がある。
【0092】
本発明によれば、温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時におよび電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0093】
本発明のさらなる形態によれば、温血動物(例えばヒト)における癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0094】
本発明のさらなる形態によれば、温血動物(例えばヒト)における充実性腫瘍に関連する癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0095】
本発明のさらなる形態によれば、温血動物(例えばヒト)における非小細胞肺癌(NSCLC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0096】
本発明のさらなる形態によれば、温血動物(例えばヒト)における結腸直腸癌(CRC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0097】
本発明のさらなる形態によれば、温血動物(例えばヒト)における膵臓癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0098】
本発明のさらなる形態によれば、温血動物(例えばヒト)における悪性黒色腫の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0099】
本発明のさらなる形態によれば、温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0100】
本発明のさらなる形態によれば、温血動物(例えばヒト)における癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0101】
本発明のさらなる形態によれば、温血動物(例えばヒト)における充実性腫瘍に関連する癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0102】
本発明のさらなる形態によれば、温血動物(例えばヒト)における非小細胞肺癌(NSCLC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0103】
本発明のさらなる形態によれば、温血動物(例えばヒト)における結腸直腸癌(CRC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0104】
本発明のさらなる形態によれば、温血動物(例えばヒト)における膵臓癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0105】
本発明のさらなる形態によれば、温血動物(例えばヒト)における悪性黒色腫の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0106】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0107】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0108】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0109】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、非小細胞肺癌(NSCLC)である。
【0110】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、結腸癌または直腸癌である。
【0111】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、膵臓癌である。
【0112】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、悪性黒色腫である。
【0113】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、非小細胞性の肺腫瘍である。
【0114】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、結腸または直腸の腫瘍である。
【0115】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、膵臓の腫瘍である。
【0116】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、悪性黒色腫である。
【0117】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0118】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0119】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0120】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、非小細胞肺癌(NSCLC)である。
【0121】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、結腸癌または直腸癌である。
【0122】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、膵臓癌である。
【0123】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、悪性黒色腫である。
【0124】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、非小細胞性の肺腫瘍である。
【0125】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、結腸または直腸の腫瘍である。
【0126】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、膵臓の腫瘍である。
【0127】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、悪性黒色腫である。
【0128】
本発明のさらなる形態によれば、このような治療的処置が必要な温血動物(例えばヒト)への、AZD2171またはそれらの製薬上許容できる塩の有効量の投与(任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい)、および、AZD6244またはそれらの製薬上許容できる塩の有効量の投与(任意に製薬上許容できる賦形剤またはキャリアーおよび電離放射線の有効量の投与と共に投与してもよい)を含む治療的併用療法が提供され、ここでAZD2171、AZD6244および電離放射線は、同時に、連続的に、または、別々に投与してもよいし、どのような順番で投与してもよい。
【0129】
本発明のさらなる形態によれば、このような治療的処置が必要な温血動物(例えばヒト)への、AZD2171またはそれらの製薬上許容できる塩の有効量の投与(任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい)、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩の有効量の投与(任意に製薬上許容できる賦形剤またはキャリアーおよび電離放射線の有効量の投与と共に投与してもよい)を含む治療的併用療法が提供され、ここでAZD2171、MEK阻害剤IIおよび電離放射線は、同時に、連続的に、または、別々に投与してもよいし、どのような順番で投与してもよい。
【0130】
電離放射線で治療されている温血動物(例えばヒト)は、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含む医薬品または併用療法の投与の前に、その後に、または、それと同時に、電離放射線で治療されている温血動物(例えばヒト)を意味する。例えば前記電離放射線は、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含む医薬品または併用療法の投与の1週間前からその1週間後の期間以内で前記温血動物(例えばヒト)に施してもよい。これは、AZD2171、AZD6244またはMEK阻害剤II、および、電離放射線は、別々に投与してもよいし、または、あらゆる順番で連続的に投与してもよいし、または、同時に投与してもよいことを意味する。このような温血動物は、AZD2171、AZD6244またはMEK阻害剤II、および、放射線それぞれの作用を同時に受ける可能性もある。
【0131】
本発明の一形態によれば、電離放射線は、AZD2171およびAZD6244のいずれか1種の前に投与されるか、または、AZD2171およびAZD6244のいずれか1種の後に投与される。
【0132】
本発明の一形態によれば、電離放射線は、AZD2171およびAZD6244の両方の前に投与されるか、または、AZD2171およびAZD6244の両方の後に投与される。
【0133】
本発明の一形態によれば、電離放射線は、AZD2171およびMEK阻害剤IIのいずれか1種の前に投与されるか、または、AZD2171およびMEK阻害剤IIのいずれか1種の後に投与される。
【0134】
本発明の一形態によれば、電離放射線は、AZD2171およびMEK阻害剤IIの両方の前に投与されるか、または、AZD2171およびMEK阻害剤IIの両方の後に投与される。
【0135】
本発明の一形態によれば、AZD2171は、温血動物を電離放射線で治療した後にその動物に投与される。
【0136】
本発明のその他の形態によれば、本発明の治療方法の作用は、単独で使用した前記治療の構成要素それぞれの作用の合計、すなわち、単独で使用したAZD2171およびAZD6244のそれぞれの作用の合計、または、単独で使用したAZD2171、AZD6244および電離放射線のそれぞれの作用の合計と少なくとも同等であることが期待される。
【0137】
本発明のその他の形態によれば、本発明の治療方法の作用が、単独で使用した前記治療の構成要素それぞれの作用の合計、すなわち、単独で使用したAZD2171およびAZD6244のそれぞれの作用の合計、または、単独で使用したAZD2171、AZD6244および電離放射線のそれぞれの作用の合計よりも大きいことが期待される。
【0138】
本発明のその他の形態によれば、本発明の治療方法の作用は、単独で使用した前記治療の構成要素それぞれの作用の合計、すなわち、単独で使用したAZD2171およびMEK阻害剤IIそれぞれの作用の合計、または、単独で使用したAZD2171、MEK阻害剤IIおよび電離放射線それぞれの合計と少なくとも同等であることが期待される。
【0139】
本発明のその他の形態によれば、本発明の治療方法の作用が、単独で使用した前記治療の構成要素それぞれの作用の合計、すなわち、単独で使用したAZD2171およびMEK阻害剤IIそれぞれの作用の合計、または、単独で使用したAZD2171、MEK阻害剤IIおよび電離放射線それぞれの合計よりも大きいことが期待される。
【0140】
本発明のその他の形態によれば、本発明の治療方法の作用は、相乗効果であることが期待される。
【0141】
本発明によれば、例えば応答の程度、反応速度、無増悪期間、または、生存期間によって測定した場合、その作用が、併用療法の構成要素のうちどれかをその従来の用量で投与した際に達成可能な作用よりも治療的に優れている場合、その併用療法は、相乗効果を提供するものと定義される。例えば、併用療法の作用が、AZD2171、または、AZD6244もしくはMEK阻害剤II、または、電離放射線を単独で用いて達成可能な作用よりも治療的に優れている場合、その併用療法の作用は相乗的である。さらに、AZD2171、または、AZD6244もしくはMEK阻害剤II、または、電離放射線単独に対して応答しない(または、不十分な応答しかしない)患者群で有益な作用がで得られる場合も、その併用療法の作用は相乗的である。加えて、構成要素のいずれか1種がその従来の用量で投与され、他方の構成要素が少ない用量で投与され、例えば応答の程度、反応速度、無増悪期間または生存期間によって測定した場合、治療効果が、その併用療法の構成要素を従来の量で投与した場合に達成可能な治療効果と同等である場合、その併用療法の作用は相乗効果を提供することと定義される。具体的には、応答の程度、反応速度、無増悪期間、および、生存データのうち1種またはそれ以上を損なうことなく、具体的には応答の持続時間を損なうことなく、ただし、各構成要素の従来の用量が用いられる場合に起こるやっかいな副作用がより少なくなるように、AZD2171、または、AZD6244もしくはMEK阻害剤II、または、電離放射線の従来の用量を減少させることが可能な場合、相乗効果があるとみなされる。
【0142】
上述したように本明細書において定義されるような本発明の併用療法は、それらの血管新生抑制および/または血管透過性抑制作用に関して有用である。血管新生および/または血管透過性の増加は、様々な病態で認められており、例えば、癌(例えば、白血病、多発性骨髄腫、および、リンパ腫)、糖尿病、乾癬、リウマチ様関節炎、カポジ肉腫、血管腫、急性および慢性腎症、アテローム、動脈の再狭窄、自己免疫疾患、急性 炎症、喘息、リンパ浮腫、子宮内膜症、不正子宮出血、および、網膜血管の増殖を伴う眼疾患、例えば加齢に関連した黄斑部変性などで認められる。
【0143】
本発明の併用療法は、癌およびカポジ肉腫のような病気の予防および治療において特に有用であることが期待される。具体的には、このような本発明の併用療法は、癌治療、例えば肺癌、頭頚部癌、脳の癌、結腸癌、直腸癌、食道癌、胃癌、肝臓癌、胆道癌、甲状腺癌、腎臓癌、子宮頚癌、卵巣癌、子宮癌、皮膚癌、乳癌、膀胱癌、前立腺癌、膵臓癌の治療において有用であることが期待され、加えて血液悪性疾患、例えば白血病、多発性骨髄腫、および、リンパ腫にも有用であることが期待される。具体的には、このような本発明の併用療法は、例えば結腸、直腸、膵臓、脳、膀胱、卵巣、乳房、前立腺、肺、肝臓および皮膚の原発性および再発性の充実性腫瘍の増殖を有利に遅延させることが期待される。本発明の併用療法は、悪性黒色腫、結腸直腸癌、膵臓癌癌、肝細胞癌、および、肺癌、例えば非小細胞肺癌(NSCLC)における腫瘍の増殖を有利に遅延させることが期待される。本発明の併用療法は、悪性黒色腫、結腸直腸癌、膵臓癌癌、および、肺癌、例えば非小細胞肺癌(NSCLC)における腫瘍の増殖を有利に遅延させることが期待される。より具体的には、このような本発明の併用療法は、VEGFに関連するあらゆる形態の癌、例えば白血病、多発性骨髄腫、および、リンパ腫を阻害することが期待され、さらに、例えば、VEGFに関連する原発性および再発性の充実性腫瘍、特に、増殖および蔓延に関して有意にVEGFに依存する腫瘍、例えば、結腸、直腸、膵臓、脳、膀胱、卵巣、乳房、前立腺、肺、陰門、肝臓および皮膚の所定の腫瘍の増殖を阻害することもが期待される。さらにより具体的には、本発明の併用療法は、悪性黒色腫における腫瘍の増殖を有利に遅延させることが期待される。さらにより具体的には、本発明の併用療法は、非小細胞肺癌(NSCLC)における腫瘍の増殖を有利に遅延させることが期待される。さらにより具体的には、本発明の併用療法は、結腸直腸癌(CRC)における腫瘍の増殖を有利に遅延させることが期待される。さらにより具体的には、本発明の併用療法は、膵臓癌における腫瘍の増殖を有利に遅延させることが期待される。さらにより具体的には、本発明の併用療法は、肝細胞癌における腫瘍の増殖を有利に遅延させることが期待される。
【0144】
本発明のその他の形態において、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIは、任意に電離放射線を伴って、VEGFに関連する原発性および再発性の充実性腫瘍、特に増殖および蔓延に関してVEGFに有意に依存する腫瘍の増殖を阻害することが期待される。
【0145】
本明細書において説明される組成物は、経口投与に適した形態、例えば錠剤またはカプセルのような形態であってもよいし、経鼻投与または吸入法による投与に適した形態、例えば粉末または溶液のような形態であってもよいし、非経口注射に適した形態(例えば、静脈内、皮下、筋肉内、血管内、または、輸液など)、例えば滅菌溶液、懸濁液またはエマルジョンのような形態であってもよいし、外用投与に適した形態、例えば軟膏またはクリームのような形態であってもよいし、直腸内投与に適した形態、例えば坐剤のような形態であってもよく、または、投与経路は、腫瘍への直接注射、または、領域への送達、または、局所送達によるものが可能である。本発明のその他の実施態様において、本併用療法のAZD2171、AZD6244またはMEK阻害剤IIは、内視鏡的、気管内、病巣内、経皮的、静脈内、皮下、腹腔内、または、腫瘍内に送達することができる。好ましくは、AZD2171は、経口投与される。好ましくは、AZD6244は、経口投与される。好ましくは、MEK阻害剤IIは、経口投与される。一般的に、本明細書において説明される組成物は、従来の方式で従来の賦形剤を用いて製造が可能である。本発明の組成物は、1回投与量で供与されることが有利である。
【0146】
一般的には、AZD2171は、温血動物に、動物の体面積1平方メートルあたり1〜50mgの範囲内の単位用量で投与されると予想され、例えばヒトの場合、約0.03〜1.5mg/kgで投与される。例えば0.01〜1.5mg/kg、好ましくは 0.03〜0.5mg/kgの範囲の単位用量が想定され、これは、一般的に治療有効量である。錠剤またはカプセルのような1回投与量は、通常、例えば1〜50mgの活性成分を含むと予想される。好ましくは、0.03〜0.5mg/kgの範囲の1日用量が用いられる。
【0147】
一般的に、AZD6244は、温血動物に、例えば0.1mg/kg〜75mg/kg体重の範囲の1日用量が摂取されるように投与されると予想され、必要があれば数回に分けた用量で投与される。AZD6244は、例えば錠剤またはカプセルで経口投与してもよい。AZD6244はまた、非経口投与してもよい。このようなケースにおいて、比較的少ない用量が用いられると予想される。従って、例えば静脈内投与の場合、一般的に0.1mg/kg〜30mg/kg体重の範囲の用量が用いられると予想される。
【0148】
一般的に、MEK阻害剤IIは、温血動物に、例えば0.1mg/kg〜75mg/kg体重の範囲の1日用量が摂取されるように投与されると予想され、必要があれば数回に分けた用量で投与される。MEK阻害剤IIは、例えば錠剤またはカプセルで経口投与してもよい。MEK阻害剤IIはまた、非経口投与してもよい。このようなケースにおいて、比較的少ない用量が用いられると予想される。従って、例えば静脈内投与の場合、一般的に0.1mg/kg〜30mg/kg体重の範囲の用量が用いられると予想される。
【0149】
本発明の組み合わせにおいて、AZD2171は、一般的にはAZD6244またはMEK阻害剤IIと組み合わされると予想されるが、本発明のいくつかの実施態様において、AZD6244で治療した患者は、MEK阻害剤IIに変更してもよいし、または、MEK阻害剤IIで治療した患者は、AZD6244に変更してもよい。
【0150】
投与量およびスケジュールは、具体的な病状、および、総合的な患者の状態に応じて様々であってよい。また、本発明の併用療法に加えて、1種またはそれ以上の追加の化学療法剤が用いられる場合も、投与量およびスケジュールは様々であってよい。スケジューリングは、それぞれ個別の患者を治療する専門家によって決定することができる。
【0151】
放射線治療は、臨床放射線治療においてよく知られている実践法に従って投与してもよい。電離放射線の投与量は、臨床放射線治療での使用に関してよく知られている投与量と予想される。用いられる放射線療法としては、例えば、γ線、X線、および/または、放射性同位体からの放射線の指向送達の使用が挙げられる。また、例えばマイクロ波、および、UV−放射線照射のようなDNA損傷因子のその他の形態も本発明に包含される。例えばX線は、1.8〜2.0Gyの1日線量で、週に5日間、5〜6週間与えてもよい。一般的に、全分割線量は、45〜60Gyの範囲内であると予想される。放射線治療の経過の一環として、例えば5〜10Gyもの比較的大きい単回線量を与えてもよい。手術中に、単回線量を与えてもよい。多分割放射線治療を用いてもよく、それによって少ない線量のX線が所定時間にわたり定期的に投与され、例えば数日にわたり0.1Gy/時間投与される。放射性同位体の線量範囲は広範にわたり様々であり、同位体の半減期、放出された放射線の強度およびタイプ、および、細胞による取り込みに依存する。
【0152】
具体的な病状の治療的または予防的処置に必要な各療法の用量の規模は、必然的に、治療される宿主、投与経路、および、治療されている疾患の重症度に応じて様々であると予想される。従って最適な投与量は、それぞれ個別の患者を治療する専門家によって決定することができる。例えば、毒性を減少させるために、上述した本併用療法の構成要素の用量を減らすことが必要であるか、または、望ましい場合がある。
【0153】
本発明は、AZD6244と、AZD2171またはAZD2171の塩との組み合わせ、および、MEK阻害剤IIと、AZD2171またはAZD2171の塩との組み合わせに関する。
【0154】
医薬組成物に使用するためのAZD2171の塩は、製薬上許容できる塩と予想されるが、AZD2171、および、その製薬上許容できる塩の生産において、その他の塩が有用な場合もある。製薬上許容できる塩としては、例えば、酸付加塩が挙げられる。このような酸付加塩としては、例えば、製薬上許容できるアニオンを提供する無機酸または有機酸との塩が挙げられ、例えばハロゲン化水素との塩、または、硫酸またはリン酸との塩、または、トリフルオロ酢酸、クエン酸またはマレイン酸との塩が挙げられる。加えて、製薬上許容できる塩は、製薬上許容できるカチオンを提供する無機塩基または有機塩基と形成することもできる。このような無機塩基または有機塩基との塩としては、例えば、アルカリ金属塩、例えばナトリウムまたはカリウム塩、および、アルカリ土類金属塩、例えばカルシウムまたはマグネシウム塩が挙げられる。好ましい塩は、国際特許出願公報番号05/061488で説明されているAZD2171のマレイン酸塩である。
【0155】
医薬組成物に使用するためのAZD6244の塩は、製薬上許容できる塩と予想されるが、AZD6244、および、その製薬上許容できる塩の生産において、その他の塩が有用な場合もある。好ましい塩は、AZD6244の硫酸水素塩である。
【0156】
医薬組成物に使用するためMEK阻害剤IIの塩は、製薬上許容できる塩と予想されるが、MEK阻害剤II、および、その製薬上許容できる塩の生産において、その他の塩が有用な場合もある。
【0157】
AZD2171は、WO00/47212で説明されている方法に従って、具体的にはWO00/47212の実施例240で説明されている方法で合成してもよい。
【0158】
AZD2171のマレイン酸塩は、WO05/061488で説明されている方法に従って合成してもよい。
【0159】
AZD6244は、WO03/077914で説明されている方法に従って、具体的にはWO03/077914の実施例10で説明されている方法で合成してもよい。
【0160】
硫酸水素塩であるAZD6244の塩は、C1〜6アルキルケトンのような有機液体中のAZD6244のスラリーと、少なくとも化学量論量の硫酸および水とを反応させ、続いて、例えば溶液混合物を冷却して塩を沈殿させることによって、得られた溶液から塩を回収することによって製造することができる。
【実施例】
【0161】
MEK阻害剤IIは、以下のように合成することができる:
工程A.2−クロロ−6−オキソ−1,6−ジヒドロ−ピリジン−3−カルボン酸の製造:米国特許第3,682,932号で説明されている手順に従って、2−クロロ−6−オキソ−1,6−ジヒドロ−ピリジン−3−カルボン酸を、ジクロロニコチン酸(3.00g,15.6mmol,アルドリッチ(Aldrich))から製造し、1.31g(48%)の望ましい生成物を得た。
【0162】
工程B.2−クロロ−1−メチル−6−オキソ−1,6−ジヒドロ−ピリジン−3−カルボン酸メチルエステルの製造:DMF(20mL)中の2−クロロ−6−オキソ−1,6−ジヒドロ−ピリジン−3−カルボン酸(0.644g,3.71mmol)の溶液に、水素化リチウム(95%,0.078g,9.28mmol)を添加し、この反応混合物をN2下で40分間撹拌した。次に、ヨウ化メチル(0.508mL,1.16g,8.16mmol)を添加し、この反応混合物をさらに45分間撹拌した。この反応混合物を、pHが6〜7になるまで2MのHClでクエンチした。この反応混合物をEtOAcと飽和NaClで希釈し、層を分離した。水層をEtOAc(1×)で逆抽出した。合わせた有機層を乾燥させ(Na2SO4)、減圧下で濃縮し、未精製の黄色の固体を得た。HPLC解析により4:1の比率の2種の生成物が示され、これをフラッシュカラムクロマトグラフィー(塩化メチレン/EtOAc、15:1〜10:1)によって分離し、0.466g(62%)の純粋な望ましい生成物を白色の結晶質固体として得た。
【0163】
工程C.メチル5−ブロモ−2−クロロ−1−メチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラートの製造:DMF(5mL)中のメチル2−クロロ−1−メチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラート(0.100g,0.496mmol)の溶液にN−ブロモスクシンイミド(0.177g,0.992mmol)を添加し、この反応混合物を、室温で、N2下で4時間撹拌した。この反応混合物を飽和亜硫酸水素ナトリウムでクエンチし、続いてEtOAcおよびH2Oで希釈し、層を分離した。水層をEtOAc(2×)で逆抽出した。合わせた有機層を乾燥させ(Na2SO4)、減圧下で濃縮し、黄色の固体を定量可能な収率で得た。
【0164】
工程D.メチル2−クロロ−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラートの製造:ジオキサン(8mL)中のメチル5−ブロモ−2−クロロ−1−メチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラート(0.400g,1.43mmol)、および、1,1’−ビス(ジフェニルホスフィノ)フェロセンジクロロパラジウム(II)(0.0587g,0.0713mmol)の懸濁液に、0℃、N2下で、ジメチル亜鉛(0.713mL,1.43mmol,トルエン中の2M溶液)を添加した。この反応混合物を即座に100℃で30分間加熱した。この反応混合物を0℃に冷却し、MeOH(0.800mL)でクエンチした。この反応混合物をEtOAcで希釈し、1MのHClで洗浄した。水層をEtOAc(1×)で逆抽出した。合わせた有機層を飽和NaClで洗浄し、乾燥させ(Na2SO4)、減圧下で濃縮し、暗黄色のゴムを得た。フラッシュカラムクロマトグラフィー(塩化メチレン/EtOAc、15:1)で精製し、0.164g(53%)の純粋な望ましい生成物を黄色の結晶質固体として得た。
【0165】
工程E:メチル−(2−フルオロ−4−ヨードフェニルアミノ)−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラートの製造:THF(2mL)中の2−フルオロ−4−ヨードベンゼンアミン(0.058g,0.31mmol)の溶液に、−78℃で、N2下で、リチウムビス(トリメチルシリル)アミド(0.56mL,0.56mmol,ヘキサン中の1M溶液)を一滴ずつ添加した。この反応混合物を−78℃で1時間撹拌した。次に、メチル2−クロロ−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラート(0.060g,0.28mmol)をTHF(1mL)中の溶液として一滴ずつ添加し、この反応混合物を−78℃で25分間撹拌した。この反応混合物をH2Oの添加によってクエンチし、pHを0.1MのHClで調節し、続いてEtOAcおよび飽和NaClで希釈し、層を分離した。水層をEtOAc(1×)で逆抽出した。合わせたEtOAc層を乾燥させ(Na2SO4)、減圧下で濃縮した。フラッシュカラムクロマトグラフィー(塩化メチレン/EtOAc、20:1)で精製したところ、0.086g(84%)の純粋な望ましい生成物が白色の結晶質固体として得られた。MS ESI(+)m/z 417(M+1)検出値; 1H NMR(400 MHz, CDCl3)d 9.56(s, 1H), 7.79(s, 1H), 7.49(d, 1H), 7.36(d, 1H), 6.43(t, 1H), 3.85(s, 3H), 3.30(s, 3H), 2.15(s, 3H)。
【0166】
工程F:2−(2−フルオロ−4−ヨードフェニルアミノ)−1,5−ジメチル−6−オキソ−N−(2−(ビニルオキシ)エトキシ)−1,6−ジヒドロピリジン−3−カルボキサミドの製造:THF(60mL)中のメチル2−(2−フルオロ−4−ヨードフェニルアミノ)−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラート(0.500g,1.20mmol)の溶液に、O−(2−ビニルオキシ−エチル)−ヒドロキシルアミン(0.149g,1.44mmol)を添加した。この溶液を0℃に冷却し、リチウムビス(トリメチルシリル)アミド(4.81ml、4.81mmol)(ヘキサン中の1M溶液)を一滴ずつ添加した。この反応混合物を室温に温めた。10分間撹拌した後、この反応混合物を1MのHClの添加によってクエンチし、EtOAcと飽和NaClとの間で分配した。層を分離し、有機層を乾燥させ(Na2SO4)、減圧下で濃縮し、未精製の黄色の固体を得て、これを精製せずに次の工程に用いた。
【0167】
工程G:2−(2−フルオロ−4−ヨードフェニルアミノ)−N−(2−ヒドロキシエトキシ)−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキサミドの製造:エタノール(10mL)中の未精製の2−(2−フルオロ−4−ヨードフェニルアミノ)−1,5−ジメチル−6−オキソ−N−(2−(ビニルオキシ)エトキシ)−1,6−ジヒドロピリジン−3−カルボキサミド(0.585g,1.20mmol)の溶液に、2MのHCl水溶液(3mL)を添加した。この反応混合物を室温で45分間撹拌した。この反応混合物のpHを1MのNaOHでpH7に調節した。この反応混合物をEtOAcおよびH2Oで希釈した。有機層を分離し、飽和NaClで洗浄した。合わせた水層を、EtOAc(1×)で逆抽出した。合わせた有機層を乾燥させ(Na2SO4)、減圧下で濃縮した。シリカゲルフラッシュカラムクロマトグラフィー(塩化メチレン/MeOH、15:1)で精製し、2−(2−フルオロ−4−ヨードフェニルアミノ)−N−(2−ヒドロキシエトキシ)−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキサミド(0.421g;二段階を経て76%)を薄黄色の固体として得た。MS ESI(+)m/z 462(M+1)パターンの検出値; 1H NMR(400 MHz, CDCl3)d 9.77(s, 1H), 8.50(s, 1H), 7.47(d, 1H), 7.36(d, 1H), 6.43(t, 1H), 4.04(br s, 2H), 3.85(br s, 1H), 3.74(br s, 2H), 3.29(s, 3H), 2.14(s, 3H)。
【0168】
以下の試験を用いて、AZD6244またはMEK阻害剤IIと組み合わせたAZD2171の活性を実証することができる。
【0169】
Calu−6ヒト肺癌異種移植片モデル
実験は、雌無胸腺マウス(スイス(Swiss)nu/nu遺伝子型,6週齢以上)で行った。背側のわき腹に、1×106個のCalu−6ヒト肺腫瘍異種移植片(体積100μl,50%マトリゲル(Matrigel)(R)を含む)を皮下注入することによって、それら細胞をマウス中に定着させた。腫瘍の体積は、両側に副尺が付いたノギスで少なくとも週2回測定することによって評価し、式(長さ×幅)×√(長さ×幅)×(π/6)を用いて計算した(ここで式中、長さは、腫瘍の端から端までの最長の直径を取り、幅は、その直径に対応して垂直の長さを取った)。マウスを無作為に4つの治療群(10匹のマウス/群)に分けたが、この場合の平均の腫瘍体積は約0.2cm3に達した。無作為に分けた後、マウスを、薬物用基材、AZD2171(1.5mg/kg,1日1回の投与)、または、AZD6244(3mg/kg,1日2回の投与)のいずれかで経口(p.o.)で24日間治療した。AZD2171の基材(1日1回投与)は1%ポリソルベート80であり、AZD6244の基材(1日2回投与した)はH.P.M.C(0.5%w/vメトセル(Methocel)/0.1%w/vトゥイーン(Tween)80)であった。追加の動物群に、単一の物質による治療で用いたのと同じ用量、スケジュールおよび持続時間を用いてAZD2171とAZD6244との組み合わせを投与したが、AZD2171は、最初のAZD6244の1日用量の2時間後に投与された。
【0170】
コントロールと治療された群との腫瘍体積の差を比較することによって、治療開始からの腫瘍増殖抑制を評価した。AZD2171とAZD6244とが投与された動物群における腫瘍増殖へのあらゆる作用と、1種類の物質による療法単独しか受けていない動物群の腫瘍増殖を比較することによって、併用療法の作用を評価した。
【0171】
図1に図表を用いてデータを示したが、これは、無胸腺マウスにおけるCalu−6腫瘍増殖に対するAZD2171、AZD6244または併用療法の作用を示すものであり、ここでx軸は、腫瘍を植え付けた後の日数であり、y軸は、平均腫瘍体積(cm3±SEM)である。この図において、四角は、基材コントロールに関し、丸は、AZD6244(3mg/kg,1日2回)に関し、垂直三角形は、AZD2171(1.5mg/kg,1日1回)に関し、逆三角形は、AZD6244(3mg/kg,1日2回)とAZD2171(1.5mg/kg,1日1回)との組み合わせに関する。
【0172】
上記組み合わせの腫瘍増殖抑制は、AZD6244単独(44%p=0.002)、または、AZD2171単独(47%p=0.0015)を用いて達成された抑制よりも有意に大きかった。
【0173】
類似の実験を用いて、AZD2171とMEK阻害剤IIとの組み合わせを調べることができる。
【0174】
類似の実験を用いて、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIと、電離放射線との組み合わせを調べることができる。
【技術分野】
【0001】
本発明は、ヒトのような温血動物(任意に電離放射線で治療されていてもよい)において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法、具体的には、AZD6244またはMEK阻害剤II;AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含む医薬組成物を併用したAZD2171の投与を含む、癌の治療方法、具体的には充実性腫瘍に関連する癌の治療方法;ヒトまたは動物の体を療法によって治療する方法で使用するための、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含む組み合わせ製品;AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含むキット;ヒトのような温血動物(任意に電離放射線で治療されていてもよい)において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用する医薬品の製造における、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIの使用に関する。
【背景技術】
【0002】
正常な血管新生は、胚発生、創傷治癒、および、雌の生殖機能の数々の要素などの様々なプロセスにおいて重要な役割を果たす。望ましくない、または、病的な血管新生は、糖尿病性網膜症、乾癬、癌、リウマチ様関節炎、アテローム、カポジ肉腫、および、血管腫などの病状に関連している(Fan et al, 1995, Trends Pharmacol. Sci. 16: 57-66; Folkman, 1995, Nature Medicine 1: 27-31)。血管透過性を変化させることは、正常な生理学的プロセスと病的な生理学的プロセスとの両方において役割を果たすと考えられる(Cullinan-Bove et al, 1993, Endocrinology 133: 829-837; Senger et al, 1993, Cancer and Metastasis Reviews, 12: 303-324)。インビトロにおける内皮細胞増殖を促進する活性を有する数種のポリペプチドが同定されており、例えば酸性および塩基性線維芽細胞増殖因子(aFGFおよびbFGF)、および、血管内皮増殖因子(VEGF)などが挙げられる。VEGFの増殖因子活性は、受容体の発現が制限されているために、FGFの増殖因子活性と比べて内皮細胞に対して特異的である。近年の証拠によれば、VEGFは、正常な、および、病的な血管新生(Jakeman et al, 1993, Endocrinology, 133: 848-859; Kolch et al, 1995, Breast Cancer Research and Treatment, 36:139-155)ならびに血管透過性(Connolly et al, 1989, J. Biol. Chem. 264: 20017-20024)の両方にとって重要な刺激因子であることが示されている。抗体がVEGFを捕獲することによるVEGF作用の拮抗作用のために、腫瘍増殖の阻害が生じる可能性がある(Kim et al, 1993, Nature 362: 841-844)。
【0003】
受容体チロシンキナーゼ(RTK)は、細胞の細胞質膜を通過する生化学シグナルの伝達において重要である。これらの膜貫通分子は、細胞質膜中のセグメントを介して細胞内のチロシンキナーゼドメインへ連結される細胞外のリガンド結合ドメインからなることを特徴とする。リガンドが受容体へ結合すると、受容体に関するチロシンキナーゼ活性の刺激が生じ、それにより、受容体およびその他の細胞内分子の両方においてチロシン残基のリン酸化が起こる。これらのチロシンリン酸化の変化は、様々な細胞の応答をもたらすシグナル伝達カスケードを開始させる。これまで、少なくとも19種の別個のRTKサブファミリーがアミノ酸配列相同性によって認識され、同定されている。現在のところ、これらのサブファミリーのうち1種は、fms様チロシンキナーゼ受容体、Flt−1(また、VEGFR−1とも称される)、キナーゼインサートドメイン含有受容体、KDR(また、VEGFR−2またはFlk−1とも称される)、および、その他のfms様チロシンキナーゼ受容体、Flt−4(また、VEGFR−3とも称される)で構成されている。これらの関連RTKのうち2種、すなわちFlt−1およびKDRは、VEGFと高親和性で結合することが示されている(De Vries et al, 1992, Science 255: 989-991; Terman et al, 1992, Biochem. Biophys. Res. Comm. 1992, 187: 1579-1586)。VEGFの異種細胞で発現されたそれらの受容体への結合は、細胞タンパク質のチロシンリン酸化状態の変化、および、カルシウム流出との関連を示す。
【0004】
VEGFは、脈管形成および血管新生に関する主要な刺激因子である。このサイトカインは、内皮細胞増殖、プロテアーゼ発現および移動、ならびにそれに続く毛細管を形成するための細胞の組織化を誘導することによって、血管を形成する表現型を誘導する(Keck, P.J., Hauser, S.D., Krivi, G., Sanzo, K., Warren, T., Feder, J., and Connolly, D.T., Science (Washington DC), 246: 1309-1312, 1989; Lamoreaux, W.J., Fitzgerald, M.E., Reiner, A., Hasty, K.A., and Charles, S.T., Microvasc. Res., 55: 29-42, 1998; Pepper, M.S., Montesano, R., Mandroita, S.J., Orci, L. and Vassalli, J.D., Enzyme Protein, 49: 138-162, 1996)。加えてVEGFは、有意な血管透過性(Dvorak, H.F., Detmar, M., Claffey, K.P., Nagy, J.A., van de Water, L., and Senger, D.R., (Int. Arch. Allergy Immunol., 107: 233-235, 1995; Bates, D.O., Heald, R.I., Curry, F.E. and Williams, B. J. Physiol. (Lond.), 533: 263-272, 2001)、病的な血管新生に特徴的な超透過性の未成熟な血管ネットワークの促進形成を誘導する。
【0005】
VEGFに対する全ての主要な表現型応答、例えば内皮細胞増殖、移動および生存、ならびに血管透過性の誘導を促進するには、KDR単独の活性化で十分であることが示されている(Meyer, M., Clauss, M., Lepple-Wienhues, A., Waltenberger, J., Augustin, H.G., Ziche, M., Lanz, C., Buttner, M., Rziha, H-J., and Dehio, C., EMBO J., 18: 363-374, 1999; Zeng, H., Sanyal, S. and Mukhopadhyay, D., J. Biol. Chem., 276: 32714-32719, 2001; Gille, H., Kowalski, J., Li, B., LeCouter, J., Moffat, B, Zioncheck, T.F., Pelletier, N. and Ferrara, N., J. Biol. Chem., 276: 3222-3230, 2001)。
【0006】
国際特許出願公報番号WO00/47212で、VEGF 受容体チロシンキナーゼの阻害剤であるキナゾリン誘導体が説明されている。WO00/47212において、AZD2171が説明されており、これは、そこでは実施例240である。AZD2171は、4−(4−フルオロ−2−メチル−1H−インドール−5−イルオキシ)−6−メトキシ−7−(3−(ピロリジン−1−イル)プロポキシ)キナゾリンである:
【0007】
【化1】

【0008】
WO00/47212(80〜83頁)で説明されているように、AZD2171は、インビトロでの(a)酵素および(b)HUVEC分析において優れた活性を示す。酵素分析において、単離したKDR(VEGFR−2)、Flt−1(VEGFR−1)、および、Flt−4(VEGFR−3)チロシンキナーゼ活性の阻害に関するAZD2171のIC50値は、それぞれ≦2nM、5±2nM、および、≦3nMであった。AZD2171は、VEGFによって刺激された内皮細胞増殖を強く阻害するが(HUVEC分析において、IC50値は0.4±0.2nM)、1250倍より高い濃度では基底の内皮細胞増殖をそれほど阻害しない(IC50値は、>500nMである)。WO00/47212(83頁)で説明されているインビボでの充実性腫瘍モデルにおけるCalu−6腫瘍の異種移植片の増殖は、それぞれ1.5、3および6mg/kg/日のAZD2171(P**≦0.01、P***≦0.0001;片側t検定)で1日1回経口治療してから28日後に、49%**、69%***、および、91%***阻害された。AZD2171は、1日1回経口投与した後の様々なモデルにおいて広範な抗腫瘍活性を惹起することが示されている(Wedge et al., 2005, Cancer Research 65: 4389-4440)。
【0009】
AZD2171、それに加えて、KDRを阻害することによって血管新生抑制作用および/または血管透過性抑制作用を生じさせることは、幹細胞因子受容体チロシンキナーゼ(SCF RTK、一般的にはc−Kitとしてよく知られている)の阻害を介して腫瘍細胞に追加の直接的な増殖抑制効果を有する可能性がある。我々は、AZD2171はc−Kitを阻害することを見出したことから、AZD2171が突然変異型および野生型c−Kitを阻害することが期待される。c−KitおよびそのリガンドSCFは、多数の充実性腫瘍および血液悪性疾患で見出されており、例えば、消化管間質腫瘍、原発性脳腫瘍、例えばグリア芽腫、神経膠腫、および、髄芽細胞腫、小細胞肺癌(SCLC)、悪性中皮腫、精巣腫瘍、例えば精上皮腫、および、精巣の奇形癌、卵巣腫瘍、例えば未分化胚細胞腫、および、性腺芽細胞腫、慢性骨髄性白血病(CML)、急性骨髄性白血病(AML)、ならびに、肥満細胞症などで見出されている(例えば、Jnl. Clin. Oncol., 2004, 22, 4514-4522を参照)。さらにc−Kitは、肝細胞癌(Am J Clin Pathol. 2005 Jul;124(1):31-6)、および、結腸直腸癌腫(Case Reports Tumour Biol. 1993;14(5):295-302)にも見出されている。c−Kitは、消化器系の腫瘍(GIST)(Bumming et al, 2003 Br J Cancer 89, 460-464)、小細胞肺癌(SCLC)(Pott et. al., 2003, Annals of Oncology 14: 894-879)、および、慢性骨髄性白血病(CML)、(Goselink et al.1992, Blood 80, 750-757 and Muroi et al, 1995, Leuk Lymphoma 16, 297-305)のような所定の癌における重要なシグナル伝達阻害剤である。またc−Kitは、平滑筋肉腫のような軟部組織肉腫においても重要なシグナル伝達阻害剤でもある。
【0010】
WO00/47212において、本発明の化合物は:
「単独療法として適用してもよいし、または、本発明の化合物に加えて、1種またはそれ以上のその他の物質および/または治療を併用してもよい。このような併用治療は、治療の個々の構成要素を同時に、連続的に、または、別々に投与することによって達成することもできる」
ということが述べられている。
【0011】
さらにWO00/47212では、このような併用治療の例、例えば外科手術、放射線治療、および、様々なタイプの化学療法剤などの説明が続く。
【0012】
WO00/47212に、本発明の化合物とMEK阻害剤との組み合わせを示唆する記載はどこにもない。
【0013】
WO00/47212に、癌などの何らかの病状を治療するための、本発明の化合物と、AZD6244またはMEK阻害剤IIとの組み合わせを示唆する記載はどこにもない。
【0014】
WO00/47212に、AZD2171およびAZD6244の特定の組み合わせを示唆する記載はどこにもない。
【0015】
WO00/47212に、AZD2171およびMEK阻害剤IIの特定の組み合わせを示唆する記載はどこにもない。
【0016】
WO05/061488において、AZD2171のマレイン酸塩が説明されている。WO05/061488において、「AZD2171のマレイン酸塩は、血管新生抑制剤および/または血管透過性抑制剤であり、単独療法として適用してもよいし、または、AZD2171のマレイン酸塩に加えて、1種またはそれ以上のその他の物質および/または治療を併用してもよい。このような併用治療は、治療の個々の構成要素を同時に、連続的に、または、別々に投与することによって達成することもできる」ということが述べられている。
【0017】
さらにWO05/016488は、続いて、このような併用治療の例、例えば外科手術、放射線治療、および、様々なタイプの化学療法剤などの説明が続く。
【0018】
WO05/061488に、本発明の化合物とMEK阻害剤との組み合わせを示唆する記載はどこにもない。
【0019】
WO05/061488に、癌などの何らかの病状を治療するための、本発明の化合物と、AZD6244またはMEK阻害剤IIとの組み合わせを示唆する記載はどこにもない。
【0020】
WO05/061488に、AZD2171およびAZD6244の特定の組み合わせを示唆する記載はどこにもない。
【0021】
WO05/061488に、AZD2171およびMEK阻害剤IIの特定の組み合わせを示唆する記載はどこにもない。
【0022】
WO00/47212およびWO05/061488に、本発明のいずれかの化合物とその他の治療との併用によって、驚くべき有益な作用を生じると予想されるということはどこにも述べられていない。
【先行技術文献】
【特許文献】
【0023】
【特許文献1】WO00/47212
【特許文献2】WO05/061488
【特許文献3】WO03/077914
【非特許文献】
【0024】
【非特許文献1】Fanet al, 1995, Trends Pharmacol. Sci. 16: 57-66
【非特許文献2】Folkman, 1995, Nature Medicine 1: 27-31)
【非特許文献3】Cullinan-Bove et al, 1993, Endocrinology 133: 829-837
【非特許文献4】Senger et al, 1993, Cancer and Metastasis Reviews, 12: 303-324
【非特許文献5】Jakeman et al, 1993, Endocrinology, 133: 848-859
【非特許文献6】Kolch et al, 1995, Breast Cancer Research and Treatment, 36:139-155
【非特許文献7】Connolly et al, 1989, J. Biol. Chem. 264: 20017-20024
【非特許文献8】Kim et al, 1993, Nature 362: 841-844
【非特許文献9】De Vrieset al, 1992, Science 255: 989-991
【非特許文献10】Termanet al, 1992, Biochem. Biophys. Res. Comm. 1992, 187: 1579-1586
【非特許文献11】Keck, P.J., Hauser, S.D., Krivi, G., Sanzo, K., Warren, T., Feder, J., and Connolly, D.T., Science (Washington DC)
【非特許文献12】Lamoreaux, W.J., Fitzgerald, M.E., Reiner, A., Hasty, K.A., and Charles, S.T., Microvasc. Res., 55: 29-42, 1998
【非特許文献13】Pepper, M.S., Montesano, R., Mandroita, S.J., Orci, L. and Vassalli, J.D., Enzyme Protein, 49: 138-162, 1996.
【非特許文献14】Dvorak, H.F., Detmar, M., Claffey, K.P., Nagy, J.A., van de Water, L., and Senger, D.R.,(Int. Arch. Allergy Immunol., 107: 233-235, 1995)
【非特許文献15】Bates, D.O., Heald, R.I., Curry, F.E. and Williams, B. J. Physiol.(Lond.), 533: 263-272, 2001
【非特許文献16】Meyer, M., Clauss, M., Lepple-Wienhues, A., Waltenberger, J., Augustin, H.G., Ziche, M., Lanz, C., Buttner, M., Rziha, H-J., and Dehio, C., EMBO J., 18: 363-374, 1999
【非特許文献17】Zeng, H., Sanyal, S. and Mukhopadhyay, D., J. Biol. Chem., 276: 32714-32719, 2001
【非特許文献18】Gille, H., Kowalski, J., Li, B., LeCouter, J., Moffat, B, Zioncheck, T.F., Pelletier, N. and Ferrara, N., J. Biol. Chem., 276: 3222-3230, 2001
【非特許文献19】Wedge et al., 2005, Cancer Research 65: 4389-4440
【非特許文献20】Jnl. Clin. Oncol., 2004, 22, 4514-4522
【非特許文献21】Am J Clin Pathol. 2005 Jul;124(1):31-6
【非特許文献22】Case Reports Tumour Biol. 1993;14(5):295-302
【非特許文献23】Bumming et al, 2003 Br J Cancer 89, 460-464
【非特許文献24】Pott et. al., 2003, Annals of Oncology 14: 894-879
【非特許文献25】Goselinket al.1992, Blood 80, 750-757
【非特許文献26】Muroiet al, 1995, Leuk Lymphoma 16, 297-305
【発明の概要】
【0025】
ここで我々は、意外なことに、および、驚くべきことに、特定の化合物AZD2171をMEK阻害剤であるAZD6244と組み合わせて使用すると、AZD2171およびAZD6244のいずれか一方を単独で使用した場合よりも有意に優れた作用を生じることを見出した。具体的には、AZD2171をAZD6244と組み合わせて使用すると、充実性腫瘍に対して、AZD2171およびAZD6244のいずれか一方を単独で使用した場合よりも有意に優れた作用を生じる。
【0026】
ここで我々は、意外なことに、および、驚くべきことに、特定の化合物AZD2171を、MEK阻害剤であるMEK阻害剤IIと組み合わせて使用すると、AZD2171およびMEK阻害剤IIのいずれか一方を単独で使用した場合よりも有意に優れた作用を生じることを見出した。具体的には、AZD2171をMEK阻害剤IIと組み合わせて使用すると、充実性腫瘍に対して、AZD2171およびMEK阻害剤IIのいずれか一方を単独で使用した場合よりも有意に優れた作用を生じる。
【図面の簡単な説明】
【0027】
【図1】無胸腺マウスにおけるCalu−6腫瘍増殖に対するAZD2171、AZD6244または併用療法の作用を示す。
【発明を実施するための形態】
【0028】
近年、細胞のDNAの一部が、腫瘍遺伝子、すなわち活性化されると悪性腫瘍細胞の形成を引き起こす遺伝子に形質転換されることによって、その細胞が癌化する可能性があることが発見された(Bradshaw, Mutagenesis, 1986, 1, 91)。悪性細胞の主要な特性の1つは、移動および侵入して、周囲の組織に移動して、宿主の組織破壊および二次的な転移性病巣の形成を引き起こす能力である。これを達成するために、腫瘍細胞は、様々なシグナル伝達経路の構成要素が腫瘍形成性を活性化した結果として、運動性および浸潤性の表現型を獲得しなければならない。腫瘍遺伝子は、増殖因子の受容体であるペプチドの生産を引き起こす。増殖因子と受容体との複合体が活性化されると、それに続いて細胞の増殖、運動性および浸潤の増加が起こる。腫瘍遺伝子は、受容体チロシンキナーゼ、セリン−スレオニンキナーゼ、または、下流シグナル伝達分子(例えばras遺伝子)のようなシグナル経路の構成要素の異常型をコードすることが多い。ras遺伝子は、結合したグアノシン三リン酸(GTP)をグアノシン二リン酸塩(GDP)に加水分解する、密接に関連した小さいグアニンヌクレオチド結合タンパク質をコードする。rasタンパク質は、それらがGTPに結合した場合に、細胞増殖、形質転換および浸潤の促進において活性であり、それらがGDPに結合した場合に不活性である。p21rasの形質転換による突然変異体は、それらのGTPアーゼ活性が不完全であるため、活性なGTPと結合した状態のままである。ras腫瘍遺伝子は、所定の癌において不可欠な役割を果たすことがわかっており、ヒトの癌の全ケースのうち20%を超えるケースにおいて形成に寄与することが見出された。
【0029】
増殖因子のようなリガンドによって活性化されると、分裂促進性の応答と共役する細胞表面受容体は、連鎖反応を開始させることができ、それにより、rasタンパク質においてグアニンヌクレオチド交換活性の活性化を起こすことができる。rasタンパク質がその活性なGTPに結合した状態の場合、細胞質膜で多数のその他のタンパクがrasと直接的に相互作用し、それにより、数種の別個の経路を介してシグナル伝達が起こる。最も特徴的なエフェクタータンパク質は、raf癌原遺伝子産物である。細胞増殖の制御において、rafとrasとの相互作用は主要な調節工程である。rafセリン−スレオニンキナーゼのras介在活性化は、順に、マイトジェン活性化プロテインキナーゼ(細胞外シグナルで調節されたプロテインキナーゼとして知られているMAPK、または、ERK1およびERK2)のすぐ上流の活性化因子である二重特異性を有するキナーゼMEK(MEK1およびMEK2)を活性化する。これまでMAPK以外にMEKの基質は同定されておらず、近年の報告によれば、MEKは、その他の上流シグナルタンパク質、例えばMEKK1およびCot/Tpl−2によって活性化される可能性もあることが示されている。活性化されたMAPKは移動して細胞核中に蓄積するが、ここでMAPKは、Elk−1およびSap1aのような転写因子をリン酸化して、活性化することができ、それにより、c−fosのような遺伝子の強化された発現が起こる。加えて、活性化されたMAPKはまた、その他のキナーゼ、例えばp90RSK、および、細胞骨格のタンパク質もリン酸化する。
【0030】
ras−依存性raf−MEK−MAPKカスケードは、細胞表面からの分裂促進、生存および浸潤シグナルそれぞれを細胞核に運搬して、遺伝子発現および細胞運命に変化をもたらすことに関与する主要なシグナル伝達経路の1つである。p21rasの形質転換による突然変異体は、構成的に活性であり、raf、MEKおよびMAPK活性、ならびに細胞の形質転換を引き起こす。構成的で高いキナーゼ活性を生じるBRAFの形質転換による突然変異体は、ヒトの癌のうち約7%に見出されており、MEKおよびMAPKの活性化を引き起こす。アンチセンスraf、ドミナントネガティブMEK突然変異体、または、選択的な阻害剤であるPD098059のいずれかを用いたMEK活性の阻害は、ras−形質転換線維芽細胞の増殖および形態学的な形質転換、細胞運動性および浸潤をブロックすることが示されている。
【0031】
raf、MEKおよびMAPKの活性化メカニズムは、特定のセリン、スレオニンまたはチロシン残基におけるリン酸化を介してなされる。活性化されたrafおよびその他のキナーゼは、S218およびS222においてMEK1をリン酸化し、S222およびS226においてMEK2をリン酸化する。それによりMEKの活性化が起こり、続いて、二重特異性を有するキナーゼMEK1およびMEK2により、T190およびY192においてERK1のリン酸化および活性化、ならびにT183およびY185においてERK2のリン酸化および活性化が起こる。MEKは多数のプロテインキナーゼによって活性化が可能であるが、活性なMAPKは、転写因子、その他のプロテインキナーゼおよび細胞質のタンパク質などの多数の基質タンパク質(そのうちいくつかは浸潤プロセスに関与する)をリン酸化して活性化し、MEKは、MAPKの特異的で唯一の活性化因子のようであり、いくつかのカスケードにまたがって調節するための中心として作用する可能性がある。MEK1およびMEK2アイソフォームは異常な特異性を示し、さらに、他の既知のMEKファミリーのどれにも存在しない触媒サブドメインIXとXとの間にプロリン豊富なインサートも含む。このようなMEKとその他のプロテインキナーゼとの差は、血管増殖性および浸潤性のシグナル伝達におけるMEK(MEK1、MEK2)および、最近ではMEK5の既知の役割と共に、増殖性疾患および浸潤性疾患に使用するための治療剤として、選択的なMEK阻害剤を発見して、それらを使用することは可能であることを示唆している。
【0032】
従って、MAPKキナーゼ経路の阻害剤は、充実性腫瘍関連の疾患の封じ込めおよび/または治療に使用するための増殖抑制剤および抗浸潤剤の両方として有用であろうということが認識されている。
【0033】
国際特許出願公報番号WO03/077914で、MEK阻害剤が説明されている。WO03/077914において、AZD6244が説明されており、これは、そこでは実施例10である。AZD6244は、6−(4−ブロモ−2−クロロ−フェニルアミノ)−7−フルオロ−3−メチル−3H−ベンゾイミダゾール−5−カルボン酸(2−ヒドロキシ−エトキシ)−アミドである:
【0034】
【化2】

【0035】
MEK阻害剤IIは、2−(2−フルオロ−4−ヨードフェニルアミノ)−N−(2−ヒドロキシエトキシ)−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキサミドである:
【0036】
【化3】

【0037】
本発明の治療方法の抗癌作用としては、これらに限定されないが、抗腫瘍作用、反応速度、無増悪期間、および、生存率が挙げられる。本発明の治療方法の抗腫瘍作用としては、これらに限定されないが、腫瘍増殖の阻害、腫瘍増殖の遅延、腫瘍の縮小、腫瘍の減少、治療中断中に腫瘍が再増殖するまでの時間を延長させること、病気の進行を減速させることが挙げられる。本発明の治療方法が癌治療が必要な温血動物(例えばヒト)に施される場合、前記治療方法は、例えば以下のうち1種またはそれ以上:抗腫瘍作用の程度、反応速度、無増悪期間および生存率によって測定した場合に、作用を生じると予想されることが期待される。抗癌作用は予防的治療を含み、加えてすでに罹っている病気の治療も含む。
【0038】
本発明によれば、温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0039】
本発明のさらなる形態によれば、温血動物(例えばヒト)における癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0040】
本発明のさらなる形態によれば、温血動物(例えばヒト)における充実性腫瘍に関連する癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0041】
本発明のさらなる形態によれば、温血動物(例えばヒト)における非小細胞肺癌(NSCLC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0042】
本発明のさらなる形態によれば、温血動物(例えばヒト)における結腸直腸癌(CRC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0043】
本発明のさらなる形態によれば、温血動物(例えばヒト)における膵臓癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0044】
本発明のさらなる形態によれば、温血動物(例えばヒト)における悪性黒色腫の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0045】
本発明のさらなる形態によれば、温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0046】
本発明のさらなる形態によれば、温血動物(例えばヒト)における癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0047】
本発明のさらなる形態によれば、温血動物(例えばヒト)における充実性腫瘍に関連する癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0048】
本発明のさらなる形態によれば、温血動物(例えばヒト)における非小細胞肺癌(NSCLC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0049】
本発明のさらなる形態によれば、温血動物(例えばヒト)における結腸直腸癌(CRC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0050】
本発明のさらなる形態によれば、温血動物(例えばヒト)における膵臓癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0051】
本発明のさらなる形態によれば、温血動物(例えばヒト)における悪性黒色腫の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み;ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0052】
本発明のさらなる形態によれば、製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩を含む医薬組成物が提供される。
【0053】
本発明のさらなる形態によれば、製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩を含む医薬組成物が提供される。
【0054】
本発明のさらなる形態によれば、ヒトまたは動物の体を療法によって治療する方法で使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩を含む組み合わせ製品が提供される。
【0055】
本発明のさらなる形態によれば、ヒトまたは動物の体を療法によって治療する方法で使用するための、AZD2171またはそれらの製薬上許容できる塩、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩を含む組み合わせ製品が提供される。
【0056】
本発明のさらなる形態によれば、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩を含むキットが提供される。
【0057】
本発明のさらなる形態によれば:
a)第一の1回投与量中に、AZD2171またはそれらの製薬上許容できる塩;
b)第二の1回投与量中に、AZD6244またはそれらの製薬上許容できる塩;および、
c)前記第一および第二の剤形を包含させるための容器手段、
含むキットが提供される。
【0058】
本発明のさらなる形態によれば:
a)第一の1回投与量中に、製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩;
b)第二の1回投与量中に、製薬上許容できる賦形剤またはキャリアーと共に、AZD6244またはそれらの製薬上許容できる塩;および、
c)前記第一および第二の剤形を包含させるための容器手段、
含むキットが提供される。
【0059】
本発明のさらなる形態によれば、AZD2171またはそれらの製薬上許容できる塩、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩を含むキットが提供される。
【0060】
本発明のさらなる形態によれば:
a)第一の1回投与量中に、AZD2171またはそれらの製薬上許容できる塩;
b)第二の1回投与量中に、MEK阻害剤IIまたはそれらの製薬上許容できる塩;および、
c)前記第一および第二の剤形を包含させるための容器手段、
を含むキットが提供される。
【0061】
本発明のさらなる形態によれば:
a)第一の1回投与量中に、製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩;
b)第二の1回投与量中に、製薬上許容できる賦形剤またはキャリアーと共に、MEK阻害剤IIまたはそれらの製薬上許容できる塩;および、
c)前記第一および第二の剤形を包含させるための容器手段、
を含むキットが提供される。
【0062】
本発明のさらなる形態によれば、血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用する医薬品の製造における、温血動物(例えばヒト)における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0063】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0064】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0065】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、非小細胞肺癌(NSCLC)である。
【0066】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、結腸直腸癌(CRC)である。
【0067】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、膵臓癌である。
【0068】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、悪性黒色腫である。
【0069】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、非小細胞性の肺腫瘍である。
【0070】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、結腸または直腸の腫瘍である。
【0071】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、膵臓の腫瘍である。
【0072】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、悪性黒色腫である。
【0073】
本発明のさらなる形態によれば、温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0074】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0075】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0076】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、非小細胞肺癌(NSCLC)である。
【0077】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、結腸直腸癌(CRC)である。
【0078】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、膵臓癌である。
【0079】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、悪性黒色腫である。
【0080】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、非小細胞性の肺腫瘍である。
【0081】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、結腸または直腸の腫瘍である。
【0082】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、膵臓の腫瘍である。
【0083】
本発明のさらなる形態によれば、温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、悪性黒色腫である。
【0084】
本発明のさらなる形態によれば、AZD2171またはそれらの製薬上許容できる塩の有効量の投与(任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい)、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量の同時の、連続的な、または、別々の投与を含む併用療法が提供され;ここでAZD6244またはMEK阻害剤IIは、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよく;このような併用療法は、このような治療的処置が必要な温血動物(例えばヒト)になされる。
【0085】
このような治療的処置としては、血管新生抑制作用および/または血管透過性抑制作用、抗癌作用、および、抗腫瘍作用が挙げられる。
【0086】
本明細書において定義されるような本発明の併用療法は、前記治療の個々の構成要素を、同時に、連続的に、または、別々に投与することによって達成することもできる。本明細書において定義されるような併用療法は、単独療法として適用してもよいし、または、本発明の併用療法に加えて、外科手術もしくは放射線治療、または、追加の化学療法剤を併用してもよい。
【0087】
外科手術は、本明細書において説明されるAZD2171との併用療法を施す前に、その間に、または、その後に、部分的または完全に腫瘍を切除する工程を含んでもよい。
【0088】
任意に本発明の併用療法と共に使用することができるその他の化学療法剤としては、WO00/47212(参照により本発明に包含させる)で説明されているものが挙げられる。このような化学療法は、以下の9つの主要な治療剤のカテゴリーを包む可能性がある:
(i)その他の血管新生抑制剤、例えば血管標的薬剤;
(ii)細胞増殖抑制性剤;
(iii)生体応答調整物質(例えば、インターフェロン);
(iv)抗体(例えば、エドレコロマブ);および、
(v)抗増殖性/抗新生物薬、および、それらの組み合わせ、例えば臨床腫瘍学で用いられるもの;および、その他の物質のカテゴリーとしては、以下が挙げられる:
(vi)アンチセンス療法;
(vii)遺伝子治療アプローチ;および、
(ix)免疫療法アプローチ。
【0089】
本発明の併用療法と共に使用するための化学療法剤の具体的な例は、ペメトレキセド、ラルチトレキセド、エトポシド、ビノレルビン、パクリタキセル、ドセタキセル、シスプラチン、オキサリプラチン、カルボプラチン、ゲムシタビン、イリノテカン(CPT−11)、5−フルオロウラシル(5−FU(例えばカペシタビンなど))、ドキソルビシン、シクロホスファミド、テモゾロマイド、および、ヒドロキシ尿素である。このような組み合わせは、肺癌、頭頚部癌、脳の癌、結腸癌、直腸癌、食道癌、胃癌、子宮頚癌、卵巣癌、皮膚癌、乳癌、膀胱癌、前立腺癌、膵臓癌の治療に特に有用であることが期待され、加えて血液悪性疾患にも特に有用であることが期待される。このような組み合わせは、膵臓癌、結腸直腸癌、悪性黒色腫、および、非小細胞肺癌(NSCLC)の治療に特に有用であることが期待される。
【0090】
AZD2171、AZD6244および電離放射線の三種併用の投与は、AZD2171、AZD6244および電離放射線のいずれか単独で使用することによって達成される作用よりも大きい、AZD2171およびAZD6244の組み合わせを用いて達成される作用よりも大きい、AZD2171および電離放射線の組み合わせを用いて達成される作用よりも大きい、AZD6244および電離放射線の組み合わせを用いて達成される作用よりも大きい作用、例えば抗腫瘍作用を生じる可能性がある。
【0091】
AZD2171、MEK阻害剤IIおよび電離放射線三種併用の投与は、AZD2171、MEK阻害剤IIおよび電離放射線のいずれかを単独で用いて達成される作用よりも大きい、AZD2171およびMEK阻害剤IIの組み合わせを用いて達成される作用よりも大きい、AZD2171および電離放射線の組み合わせを用いて達成される作用よりも大きい、MEK阻害剤IIおよび電離放射線の組み合わせを用いて達成される作用よりも大きい作用、例えば抗腫瘍作用を生じる可能性がある。
【0092】
本発明によれば、温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時におよび電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0093】
本発明のさらなる形態によれば、温血動物(例えばヒト)における癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0094】
本発明のさらなる形態によれば、温血動物(例えばヒト)における充実性腫瘍に関連する癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0095】
本発明のさらなる形態によれば、温血動物(例えばヒト)における非小細胞肺癌(NSCLC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0096】
本発明のさらなる形態によれば、温血動物(例えばヒト)における結腸直腸癌(CRC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0097】
本発明のさらなる形態によれば、温血動物(例えばヒト)における膵臓癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0098】
本発明のさらなる形態によれば、温血動物(例えばヒト)における悪性黒色腫の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む。
【0099】
本発明のさらなる形態によれば、温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0100】
本発明のさらなる形態によれば、温血動物(例えばヒト)における癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0101】
本発明のさらなる形態によれば、温血動物(例えばヒト)における充実性腫瘍に関連する癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0102】
本発明のさらなる形態によれば、温血動物(例えばヒト)における非小細胞肺癌(NSCLC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0103】
本発明のさらなる形態によれば、温血動物(例えばヒト)における結腸直腸癌(CRC)の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0104】
本発明のさらなる形態によれば、温血動物(例えばヒト)における膵臓癌の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0105】
本発明のさらなる形態によれば、温血動物(例えばヒト)における悪性黒色腫の治療方法が提供され、本方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含み、ここでAZD2171、および、AZD6244またはMEK阻害剤IIはそれぞれ、任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい。
【0106】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0107】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0108】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供される。
【0109】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、非小細胞肺癌(NSCLC)である。
【0110】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、結腸癌または直腸癌である。
【0111】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、膵臓癌である。
【0112】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記癌は、悪性黒色腫である。
【0113】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、非小細胞性の肺腫瘍である。
【0114】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、結腸または直腸の腫瘍である。
【0115】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、膵臓の腫瘍である。
【0116】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかの使用が提供され、ここで前記腫瘍は、悪性黒色腫である。
【0117】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0118】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0119】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供される。
【0120】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、非小細胞肺癌(NSCLC)である。
【0121】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、結腸癌または直腸癌である。
【0122】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、膵臓癌である。
【0123】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗癌作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記癌は、悪性黒色腫である。
【0124】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、非小細胞性の肺腫瘍である。
【0125】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、結腸または直腸の腫瘍である。
【0126】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、膵臓の腫瘍である。
【0127】
本発明のさらなる形態によれば、電離放射線で治療されている温血動物(例えばヒト)において抗腫瘍作用を生じさせるのに使用するための、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩のいずれかが提供され、ここで前記腫瘍は、悪性黒色腫である。
【0128】
本発明のさらなる形態によれば、このような治療的処置が必要な温血動物(例えばヒト)への、AZD2171またはそれらの製薬上許容できる塩の有効量の投与(任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい)、および、AZD6244またはそれらの製薬上許容できる塩の有効量の投与(任意に製薬上許容できる賦形剤またはキャリアーおよび電離放射線の有効量の投与と共に投与してもよい)を含む治療的併用療法が提供され、ここでAZD2171、AZD6244および電離放射線は、同時に、連続的に、または、別々に投与してもよいし、どのような順番で投与してもよい。
【0129】
本発明のさらなる形態によれば、このような治療的処置が必要な温血動物(例えばヒト)への、AZD2171またはそれらの製薬上許容できる塩の有効量の投与(任意に製薬上許容できる賦形剤またはキャリアーと共に投与してもよい)、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩の有効量の投与(任意に製薬上許容できる賦形剤またはキャリアーおよび電離放射線の有効量の投与と共に投与してもよい)を含む治療的併用療法が提供され、ここでAZD2171、MEK阻害剤IIおよび電離放射線は、同時に、連続的に、または、別々に投与してもよいし、どのような順番で投与してもよい。
【0130】
電離放射線で治療されている温血動物(例えばヒト)は、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含む医薬品または併用療法の投与の前に、その後に、または、それと同時に、電離放射線で治療されている温血動物(例えばヒト)を意味する。例えば前記電離放射線は、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIを含む医薬品または併用療法の投与の1週間前からその1週間後の期間以内で前記温血動物(例えばヒト)に施してもよい。これは、AZD2171、AZD6244またはMEK阻害剤II、および、電離放射線は、別々に投与してもよいし、または、あらゆる順番で連続的に投与してもよいし、または、同時に投与してもよいことを意味する。このような温血動物は、AZD2171、AZD6244またはMEK阻害剤II、および、放射線それぞれの作用を同時に受ける可能性もある。
【0131】
本発明の一形態によれば、電離放射線は、AZD2171およびAZD6244のいずれか1種の前に投与されるか、または、AZD2171およびAZD6244のいずれか1種の後に投与される。
【0132】
本発明の一形態によれば、電離放射線は、AZD2171およびAZD6244の両方の前に投与されるか、または、AZD2171およびAZD6244の両方の後に投与される。
【0133】
本発明の一形態によれば、電離放射線は、AZD2171およびMEK阻害剤IIのいずれか1種の前に投与されるか、または、AZD2171およびMEK阻害剤IIのいずれか1種の後に投与される。
【0134】
本発明の一形態によれば、電離放射線は、AZD2171およびMEK阻害剤IIの両方の前に投与されるか、または、AZD2171およびMEK阻害剤IIの両方の後に投与される。
【0135】
本発明の一形態によれば、AZD2171は、温血動物を電離放射線で治療した後にその動物に投与される。
【0136】
本発明のその他の形態によれば、本発明の治療方法の作用は、単独で使用した前記治療の構成要素それぞれの作用の合計、すなわち、単独で使用したAZD2171およびAZD6244のそれぞれの作用の合計、または、単独で使用したAZD2171、AZD6244および電離放射線のそれぞれの作用の合計と少なくとも同等であることが期待される。
【0137】
本発明のその他の形態によれば、本発明の治療方法の作用が、単独で使用した前記治療の構成要素それぞれの作用の合計、すなわち、単独で使用したAZD2171およびAZD6244のそれぞれの作用の合計、または、単独で使用したAZD2171、AZD6244および電離放射線のそれぞれの作用の合計よりも大きいことが期待される。
【0138】
本発明のその他の形態によれば、本発明の治療方法の作用は、単独で使用した前記治療の構成要素それぞれの作用の合計、すなわち、単独で使用したAZD2171およびMEK阻害剤IIそれぞれの作用の合計、または、単独で使用したAZD2171、MEK阻害剤IIおよび電離放射線それぞれの合計と少なくとも同等であることが期待される。
【0139】
本発明のその他の形態によれば、本発明の治療方法の作用が、単独で使用した前記治療の構成要素それぞれの作用の合計、すなわち、単独で使用したAZD2171およびMEK阻害剤IIそれぞれの作用の合計、または、単独で使用したAZD2171、MEK阻害剤IIおよび電離放射線それぞれの合計よりも大きいことが期待される。
【0140】
本発明のその他の形態によれば、本発明の治療方法の作用は、相乗効果であることが期待される。
【0141】
本発明によれば、例えば応答の程度、反応速度、無増悪期間、または、生存期間によって測定した場合、その作用が、併用療法の構成要素のうちどれかをその従来の用量で投与した際に達成可能な作用よりも治療的に優れている場合、その併用療法は、相乗効果を提供するものと定義される。例えば、併用療法の作用が、AZD2171、または、AZD6244もしくはMEK阻害剤II、または、電離放射線を単独で用いて達成可能な作用よりも治療的に優れている場合、その併用療法の作用は相乗的である。さらに、AZD2171、または、AZD6244もしくはMEK阻害剤II、または、電離放射線単独に対して応答しない(または、不十分な応答しかしない)患者群で有益な作用がで得られる場合も、その併用療法の作用は相乗的である。加えて、構成要素のいずれか1種がその従来の用量で投与され、他方の構成要素が少ない用量で投与され、例えば応答の程度、反応速度、無増悪期間または生存期間によって測定した場合、治療効果が、その併用療法の構成要素を従来の量で投与した場合に達成可能な治療効果と同等である場合、その併用療法の作用は相乗効果を提供することと定義される。具体的には、応答の程度、反応速度、無増悪期間、および、生存データのうち1種またはそれ以上を損なうことなく、具体的には応答の持続時間を損なうことなく、ただし、各構成要素の従来の用量が用いられる場合に起こるやっかいな副作用がより少なくなるように、AZD2171、または、AZD6244もしくはMEK阻害剤II、または、電離放射線の従来の用量を減少させることが可能な場合、相乗効果があるとみなされる。
【0142】
上述したように本明細書において定義されるような本発明の併用療法は、それらの血管新生抑制および/または血管透過性抑制作用に関して有用である。血管新生および/または血管透過性の増加は、様々な病態で認められており、例えば、癌(例えば、白血病、多発性骨髄腫、および、リンパ腫)、糖尿病、乾癬、リウマチ様関節炎、カポジ肉腫、血管腫、急性および慢性腎症、アテローム、動脈の再狭窄、自己免疫疾患、急性 炎症、喘息、リンパ浮腫、子宮内膜症、不正子宮出血、および、網膜血管の増殖を伴う眼疾患、例えば加齢に関連した黄斑部変性などで認められる。
【0143】
本発明の併用療法は、癌およびカポジ肉腫のような病気の予防および治療において特に有用であることが期待される。具体的には、このような本発明の併用療法は、癌治療、例えば肺癌、頭頚部癌、脳の癌、結腸癌、直腸癌、食道癌、胃癌、肝臓癌、胆道癌、甲状腺癌、腎臓癌、子宮頚癌、卵巣癌、子宮癌、皮膚癌、乳癌、膀胱癌、前立腺癌、膵臓癌の治療において有用であることが期待され、加えて血液悪性疾患、例えば白血病、多発性骨髄腫、および、リンパ腫にも有用であることが期待される。具体的には、このような本発明の併用療法は、例えば結腸、直腸、膵臓、脳、膀胱、卵巣、乳房、前立腺、肺、肝臓および皮膚の原発性および再発性の充実性腫瘍の増殖を有利に遅延させることが期待される。本発明の併用療法は、悪性黒色腫、結腸直腸癌、膵臓癌癌、肝細胞癌、および、肺癌、例えば非小細胞肺癌(NSCLC)における腫瘍の増殖を有利に遅延させることが期待される。本発明の併用療法は、悪性黒色腫、結腸直腸癌、膵臓癌癌、および、肺癌、例えば非小細胞肺癌(NSCLC)における腫瘍の増殖を有利に遅延させることが期待される。より具体的には、このような本発明の併用療法は、VEGFに関連するあらゆる形態の癌、例えば白血病、多発性骨髄腫、および、リンパ腫を阻害することが期待され、さらに、例えば、VEGFに関連する原発性および再発性の充実性腫瘍、特に、増殖および蔓延に関して有意にVEGFに依存する腫瘍、例えば、結腸、直腸、膵臓、脳、膀胱、卵巣、乳房、前立腺、肺、陰門、肝臓および皮膚の所定の腫瘍の増殖を阻害することもが期待される。さらにより具体的には、本発明の併用療法は、悪性黒色腫における腫瘍の増殖を有利に遅延させることが期待される。さらにより具体的には、本発明の併用療法は、非小細胞肺癌(NSCLC)における腫瘍の増殖を有利に遅延させることが期待される。さらにより具体的には、本発明の併用療法は、結腸直腸癌(CRC)における腫瘍の増殖を有利に遅延させることが期待される。さらにより具体的には、本発明の併用療法は、膵臓癌における腫瘍の増殖を有利に遅延させることが期待される。さらにより具体的には、本発明の併用療法は、肝細胞癌における腫瘍の増殖を有利に遅延させることが期待される。
【0144】
本発明のその他の形態において、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIは、任意に電離放射線を伴って、VEGFに関連する原発性および再発性の充実性腫瘍、特に増殖および蔓延に関してVEGFに有意に依存する腫瘍の増殖を阻害することが期待される。
【0145】
本明細書において説明される組成物は、経口投与に適した形態、例えば錠剤またはカプセルのような形態であってもよいし、経鼻投与または吸入法による投与に適した形態、例えば粉末または溶液のような形態であってもよいし、非経口注射に適した形態(例えば、静脈内、皮下、筋肉内、血管内、または、輸液など)、例えば滅菌溶液、懸濁液またはエマルジョンのような形態であってもよいし、外用投与に適した形態、例えば軟膏またはクリームのような形態であってもよいし、直腸内投与に適した形態、例えば坐剤のような形態であってもよく、または、投与経路は、腫瘍への直接注射、または、領域への送達、または、局所送達によるものが可能である。本発明のその他の実施態様において、本併用療法のAZD2171、AZD6244またはMEK阻害剤IIは、内視鏡的、気管内、病巣内、経皮的、静脈内、皮下、腹腔内、または、腫瘍内に送達することができる。好ましくは、AZD2171は、経口投与される。好ましくは、AZD6244は、経口投与される。好ましくは、MEK阻害剤IIは、経口投与される。一般的に、本明細書において説明される組成物は、従来の方式で従来の賦形剤を用いて製造が可能である。本発明の組成物は、1回投与量で供与されることが有利である。
【0146】
一般的には、AZD2171は、温血動物に、動物の体面積1平方メートルあたり1〜50mgの範囲内の単位用量で投与されると予想され、例えばヒトの場合、約0.03〜1.5mg/kgで投与される。例えば0.01〜1.5mg/kg、好ましくは 0.03〜0.5mg/kgの範囲の単位用量が想定され、これは、一般的に治療有効量である。錠剤またはカプセルのような1回投与量は、通常、例えば1〜50mgの活性成分を含むと予想される。好ましくは、0.03〜0.5mg/kgの範囲の1日用量が用いられる。
【0147】
一般的に、AZD6244は、温血動物に、例えば0.1mg/kg〜75mg/kg体重の範囲の1日用量が摂取されるように投与されると予想され、必要があれば数回に分けた用量で投与される。AZD6244は、例えば錠剤またはカプセルで経口投与してもよい。AZD6244はまた、非経口投与してもよい。このようなケースにおいて、比較的少ない用量が用いられると予想される。従って、例えば静脈内投与の場合、一般的に0.1mg/kg〜30mg/kg体重の範囲の用量が用いられると予想される。
【0148】
一般的に、MEK阻害剤IIは、温血動物に、例えば0.1mg/kg〜75mg/kg体重の範囲の1日用量が摂取されるように投与されると予想され、必要があれば数回に分けた用量で投与される。MEK阻害剤IIは、例えば錠剤またはカプセルで経口投与してもよい。MEK阻害剤IIはまた、非経口投与してもよい。このようなケースにおいて、比較的少ない用量が用いられると予想される。従って、例えば静脈内投与の場合、一般的に0.1mg/kg〜30mg/kg体重の範囲の用量が用いられると予想される。
【0149】
本発明の組み合わせにおいて、AZD2171は、一般的にはAZD6244またはMEK阻害剤IIと組み合わされると予想されるが、本発明のいくつかの実施態様において、AZD6244で治療した患者は、MEK阻害剤IIに変更してもよいし、または、MEK阻害剤IIで治療した患者は、AZD6244に変更してもよい。
【0150】
投与量およびスケジュールは、具体的な病状、および、総合的な患者の状態に応じて様々であってよい。また、本発明の併用療法に加えて、1種またはそれ以上の追加の化学療法剤が用いられる場合も、投与量およびスケジュールは様々であってよい。スケジューリングは、それぞれ個別の患者を治療する専門家によって決定することができる。
【0151】
放射線治療は、臨床放射線治療においてよく知られている実践法に従って投与してもよい。電離放射線の投与量は、臨床放射線治療での使用に関してよく知られている投与量と予想される。用いられる放射線療法としては、例えば、γ線、X線、および/または、放射性同位体からの放射線の指向送達の使用が挙げられる。また、例えばマイクロ波、および、UV−放射線照射のようなDNA損傷因子のその他の形態も本発明に包含される。例えばX線は、1.8〜2.0Gyの1日線量で、週に5日間、5〜6週間与えてもよい。一般的に、全分割線量は、45〜60Gyの範囲内であると予想される。放射線治療の経過の一環として、例えば5〜10Gyもの比較的大きい単回線量を与えてもよい。手術中に、単回線量を与えてもよい。多分割放射線治療を用いてもよく、それによって少ない線量のX線が所定時間にわたり定期的に投与され、例えば数日にわたり0.1Gy/時間投与される。放射性同位体の線量範囲は広範にわたり様々であり、同位体の半減期、放出された放射線の強度およびタイプ、および、細胞による取り込みに依存する。
【0152】
具体的な病状の治療的または予防的処置に必要な各療法の用量の規模は、必然的に、治療される宿主、投与経路、および、治療されている疾患の重症度に応じて様々であると予想される。従って最適な投与量は、それぞれ個別の患者を治療する専門家によって決定することができる。例えば、毒性を減少させるために、上述した本併用療法の構成要素の用量を減らすことが必要であるか、または、望ましい場合がある。
【0153】
本発明は、AZD6244と、AZD2171またはAZD2171の塩との組み合わせ、および、MEK阻害剤IIと、AZD2171またはAZD2171の塩との組み合わせに関する。
【0154】
医薬組成物に使用するためのAZD2171の塩は、製薬上許容できる塩と予想されるが、AZD2171、および、その製薬上許容できる塩の生産において、その他の塩が有用な場合もある。製薬上許容できる塩としては、例えば、酸付加塩が挙げられる。このような酸付加塩としては、例えば、製薬上許容できるアニオンを提供する無機酸または有機酸との塩が挙げられ、例えばハロゲン化水素との塩、または、硫酸またはリン酸との塩、または、トリフルオロ酢酸、クエン酸またはマレイン酸との塩が挙げられる。加えて、製薬上許容できる塩は、製薬上許容できるカチオンを提供する無機塩基または有機塩基と形成することもできる。このような無機塩基または有機塩基との塩としては、例えば、アルカリ金属塩、例えばナトリウムまたはカリウム塩、および、アルカリ土類金属塩、例えばカルシウムまたはマグネシウム塩が挙げられる。好ましい塩は、国際特許出願公報番号05/061488で説明されているAZD2171のマレイン酸塩である。
【0155】
医薬組成物に使用するためのAZD6244の塩は、製薬上許容できる塩と予想されるが、AZD6244、および、その製薬上許容できる塩の生産において、その他の塩が有用な場合もある。好ましい塩は、AZD6244の硫酸水素塩である。
【0156】
医薬組成物に使用するためMEK阻害剤IIの塩は、製薬上許容できる塩と予想されるが、MEK阻害剤II、および、その製薬上許容できる塩の生産において、その他の塩が有用な場合もある。
【0157】
AZD2171は、WO00/47212で説明されている方法に従って、具体的にはWO00/47212の実施例240で説明されている方法で合成してもよい。
【0158】
AZD2171のマレイン酸塩は、WO05/061488で説明されている方法に従って合成してもよい。
【0159】
AZD6244は、WO03/077914で説明されている方法に従って、具体的にはWO03/077914の実施例10で説明されている方法で合成してもよい。
【0160】
硫酸水素塩であるAZD6244の塩は、C1〜6アルキルケトンのような有機液体中のAZD6244のスラリーと、少なくとも化学量論量の硫酸および水とを反応させ、続いて、例えば溶液混合物を冷却して塩を沈殿させることによって、得られた溶液から塩を回収することによって製造することができる。
【実施例】
【0161】
MEK阻害剤IIは、以下のように合成することができる:
工程A.2−クロロ−6−オキソ−1,6−ジヒドロ−ピリジン−3−カルボン酸の製造:米国特許第3,682,932号で説明されている手順に従って、2−クロロ−6−オキソ−1,6−ジヒドロ−ピリジン−3−カルボン酸を、ジクロロニコチン酸(3.00g,15.6mmol,アルドリッチ(Aldrich))から製造し、1.31g(48%)の望ましい生成物を得た。
【0162】
工程B.2−クロロ−1−メチル−6−オキソ−1,6−ジヒドロ−ピリジン−3−カルボン酸メチルエステルの製造:DMF(20mL)中の2−クロロ−6−オキソ−1,6−ジヒドロ−ピリジン−3−カルボン酸(0.644g,3.71mmol)の溶液に、水素化リチウム(95%,0.078g,9.28mmol)を添加し、この反応混合物をN2下で40分間撹拌した。次に、ヨウ化メチル(0.508mL,1.16g,8.16mmol)を添加し、この反応混合物をさらに45分間撹拌した。この反応混合物を、pHが6〜7になるまで2MのHClでクエンチした。この反応混合物をEtOAcと飽和NaClで希釈し、層を分離した。水層をEtOAc(1×)で逆抽出した。合わせた有機層を乾燥させ(Na2SO4)、減圧下で濃縮し、未精製の黄色の固体を得た。HPLC解析により4:1の比率の2種の生成物が示され、これをフラッシュカラムクロマトグラフィー(塩化メチレン/EtOAc、15:1〜10:1)によって分離し、0.466g(62%)の純粋な望ましい生成物を白色の結晶質固体として得た。
【0163】
工程C.メチル5−ブロモ−2−クロロ−1−メチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラートの製造:DMF(5mL)中のメチル2−クロロ−1−メチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラート(0.100g,0.496mmol)の溶液にN−ブロモスクシンイミド(0.177g,0.992mmol)を添加し、この反応混合物を、室温で、N2下で4時間撹拌した。この反応混合物を飽和亜硫酸水素ナトリウムでクエンチし、続いてEtOAcおよびH2Oで希釈し、層を分離した。水層をEtOAc(2×)で逆抽出した。合わせた有機層を乾燥させ(Na2SO4)、減圧下で濃縮し、黄色の固体を定量可能な収率で得た。
【0164】
工程D.メチル2−クロロ−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラートの製造:ジオキサン(8mL)中のメチル5−ブロモ−2−クロロ−1−メチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラート(0.400g,1.43mmol)、および、1,1’−ビス(ジフェニルホスフィノ)フェロセンジクロロパラジウム(II)(0.0587g,0.0713mmol)の懸濁液に、0℃、N2下で、ジメチル亜鉛(0.713mL,1.43mmol,トルエン中の2M溶液)を添加した。この反応混合物を即座に100℃で30分間加熱した。この反応混合物を0℃に冷却し、MeOH(0.800mL)でクエンチした。この反応混合物をEtOAcで希釈し、1MのHClで洗浄した。水層をEtOAc(1×)で逆抽出した。合わせた有機層を飽和NaClで洗浄し、乾燥させ(Na2SO4)、減圧下で濃縮し、暗黄色のゴムを得た。フラッシュカラムクロマトグラフィー(塩化メチレン/EtOAc、15:1)で精製し、0.164g(53%)の純粋な望ましい生成物を黄色の結晶質固体として得た。
【0165】
工程E:メチル−(2−フルオロ−4−ヨードフェニルアミノ)−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラートの製造:THF(2mL)中の2−フルオロ−4−ヨードベンゼンアミン(0.058g,0.31mmol)の溶液に、−78℃で、N2下で、リチウムビス(トリメチルシリル)アミド(0.56mL,0.56mmol,ヘキサン中の1M溶液)を一滴ずつ添加した。この反応混合物を−78℃で1時間撹拌した。次に、メチル2−クロロ−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラート(0.060g,0.28mmol)をTHF(1mL)中の溶液として一滴ずつ添加し、この反応混合物を−78℃で25分間撹拌した。この反応混合物をH2Oの添加によってクエンチし、pHを0.1MのHClで調節し、続いてEtOAcおよび飽和NaClで希釈し、層を分離した。水層をEtOAc(1×)で逆抽出した。合わせたEtOAc層を乾燥させ(Na2SO4)、減圧下で濃縮した。フラッシュカラムクロマトグラフィー(塩化メチレン/EtOAc、20:1)で精製したところ、0.086g(84%)の純粋な望ましい生成物が白色の結晶質固体として得られた。MS ESI(+)m/z 417(M+1)検出値; 1H NMR(400 MHz, CDCl3)d 9.56(s, 1H), 7.79(s, 1H), 7.49(d, 1H), 7.36(d, 1H), 6.43(t, 1H), 3.85(s, 3H), 3.30(s, 3H), 2.15(s, 3H)。
【0166】
工程F:2−(2−フルオロ−4−ヨードフェニルアミノ)−1,5−ジメチル−6−オキソ−N−(2−(ビニルオキシ)エトキシ)−1,6−ジヒドロピリジン−3−カルボキサミドの製造:THF(60mL)中のメチル2−(2−フルオロ−4−ヨードフェニルアミノ)−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキシラート(0.500g,1.20mmol)の溶液に、O−(2−ビニルオキシ−エチル)−ヒドロキシルアミン(0.149g,1.44mmol)を添加した。この溶液を0℃に冷却し、リチウムビス(トリメチルシリル)アミド(4.81ml、4.81mmol)(ヘキサン中の1M溶液)を一滴ずつ添加した。この反応混合物を室温に温めた。10分間撹拌した後、この反応混合物を1MのHClの添加によってクエンチし、EtOAcと飽和NaClとの間で分配した。層を分離し、有機層を乾燥させ(Na2SO4)、減圧下で濃縮し、未精製の黄色の固体を得て、これを精製せずに次の工程に用いた。
【0167】
工程G:2−(2−フルオロ−4−ヨードフェニルアミノ)−N−(2−ヒドロキシエトキシ)−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキサミドの製造:エタノール(10mL)中の未精製の2−(2−フルオロ−4−ヨードフェニルアミノ)−1,5−ジメチル−6−オキソ−N−(2−(ビニルオキシ)エトキシ)−1,6−ジヒドロピリジン−3−カルボキサミド(0.585g,1.20mmol)の溶液に、2MのHCl水溶液(3mL)を添加した。この反応混合物を室温で45分間撹拌した。この反応混合物のpHを1MのNaOHでpH7に調節した。この反応混合物をEtOAcおよびH2Oで希釈した。有機層を分離し、飽和NaClで洗浄した。合わせた水層を、EtOAc(1×)で逆抽出した。合わせた有機層を乾燥させ(Na2SO4)、減圧下で濃縮した。シリカゲルフラッシュカラムクロマトグラフィー(塩化メチレン/MeOH、15:1)で精製し、2−(2−フルオロ−4−ヨードフェニルアミノ)−N−(2−ヒドロキシエトキシ)−1,5−ジメチル−6−オキソ−1,6−ジヒドロピリジン−3−カルボキサミド(0.421g;二段階を経て76%)を薄黄色の固体として得た。MS ESI(+)m/z 462(M+1)パターンの検出値; 1H NMR(400 MHz, CDCl3)d 9.77(s, 1H), 8.50(s, 1H), 7.47(d, 1H), 7.36(d, 1H), 6.43(t, 1H), 4.04(br s, 2H), 3.85(br s, 1H), 3.74(br s, 2H), 3.29(s, 3H), 2.14(s, 3H)。
【0168】
以下の試験を用いて、AZD6244またはMEK阻害剤IIと組み合わせたAZD2171の活性を実証することができる。
【0169】
Calu−6ヒト肺癌異種移植片モデル
実験は、雌無胸腺マウス(スイス(Swiss)nu/nu遺伝子型,6週齢以上)で行った。背側のわき腹に、1×106個のCalu−6ヒト肺腫瘍異種移植片(体積100μl,50%マトリゲル(Matrigel)(R)を含む)を皮下注入することによって、それら細胞をマウス中に定着させた。腫瘍の体積は、両側に副尺が付いたノギスで少なくとも週2回測定することによって評価し、式(長さ×幅)×√(長さ×幅)×(π/6)を用いて計算した(ここで式中、長さは、腫瘍の端から端までの最長の直径を取り、幅は、その直径に対応して垂直の長さを取った)。マウスを無作為に4つの治療群(10匹のマウス/群)に分けたが、この場合の平均の腫瘍体積は約0.2cm3に達した。無作為に分けた後、マウスを、薬物用基材、AZD2171(1.5mg/kg,1日1回の投与)、または、AZD6244(3mg/kg,1日2回の投与)のいずれかで経口(p.o.)で24日間治療した。AZD2171の基材(1日1回投与)は1%ポリソルベート80であり、AZD6244の基材(1日2回投与した)はH.P.M.C(0.5%w/vメトセル(Methocel)/0.1%w/vトゥイーン(Tween)80)であった。追加の動物群に、単一の物質による治療で用いたのと同じ用量、スケジュールおよび持続時間を用いてAZD2171とAZD6244との組み合わせを投与したが、AZD2171は、最初のAZD6244の1日用量の2時間後に投与された。
【0170】
コントロールと治療された群との腫瘍体積の差を比較することによって、治療開始からの腫瘍増殖抑制を評価した。AZD2171とAZD6244とが投与された動物群における腫瘍増殖へのあらゆる作用と、1種類の物質による療法単独しか受けていない動物群の腫瘍増殖を比較することによって、併用療法の作用を評価した。
【0171】
図1に図表を用いてデータを示したが、これは、無胸腺マウスにおけるCalu−6腫瘍増殖に対するAZD2171、AZD6244または併用療法の作用を示すものであり、ここでx軸は、腫瘍を植え付けた後の日数であり、y軸は、平均腫瘍体積(cm3±SEM)である。この図において、四角は、基材コントロールに関し、丸は、AZD6244(3mg/kg,1日2回)に関し、垂直三角形は、AZD2171(1.5mg/kg,1日1回)に関し、逆三角形は、AZD6244(3mg/kg,1日2回)とAZD2171(1.5mg/kg,1日1回)との組み合わせに関する。
【0172】
上記組み合わせの腫瘍増殖抑制は、AZD6244単独(44%p=0.002)、または、AZD2171単独(47%p=0.0015)を用いて達成された抑制よりも有意に大きかった。
【0173】
類似の実験を用いて、AZD2171とMEK阻害剤IIとの組み合わせを調べることができる。
【0174】
類似の実験を用いて、AZD2171、および、AZD6244またはAZD2171、および、MEK阻害剤IIと、電離放射線との組み合わせを調べることができる。
【特許請求の範囲】
【請求項1】
温血動物において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用。
【請求項2】
温血動物において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用。
【請求項3】
温血動物において抗腫瘍作用を生じさせるのに使用するための医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用
【請求項4】
電離放射線で治療されている温血動物において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用。
【請求項5】
電離放射線で治療されている温血動物において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用。
【請求項6】
電離放射線で治療されている温血動物において抗腫瘍作用を生じさせるのに使用するための医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用。
【請求項7】
前記腫瘍が、結腸または直腸の腫瘍であるか、または、肝臓の腫瘍であるか、または、膵臓の腫瘍であるか、または、悪性黒色腫であるか、または、非小細胞性の肺腫瘍である、請求項3または請求項6に記載の使用。
【請求項8】
前記癌が、非小細胞肺癌(NSCLC)、結腸直腸癌(CRC)、膵臓癌、肝細胞癌、または、悪性黒色腫である、請求項2または請求項5に記載の使用。
【請求項9】
製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩を含む医薬組成物。
【請求項10】
製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩を含む医薬組成物。
【請求項11】
AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩を含むキット。
【請求項12】
AZD2171またはそれらの製薬上許容できる塩、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩を含むキット。
【請求項13】
温血動物において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法であって、該方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩の有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の有効量を投与することを含む、上記方法。
【請求項14】
温血動物における血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法であって、該方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む、上記方法。
【請求項1】
温血動物において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用。
【請求項2】
温血動物において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用。
【請求項3】
温血動物において抗腫瘍作用を生じさせるのに使用するための医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用
【請求項4】
電離放射線で治療されている温血動物において血管新生抑制作用および/または血管透過性抑制作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用。
【請求項5】
電離放射線で治療されている温血動物において抗癌作用を生じさせるのに使用する医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用。
【請求項6】
電離放射線で治療されている温血動物において抗腫瘍作用を生じさせるのに使用するための医薬品の製造における、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の使用。
【請求項7】
前記腫瘍が、結腸または直腸の腫瘍であるか、または、肝臓の腫瘍であるか、または、膵臓の腫瘍であるか、または、悪性黒色腫であるか、または、非小細胞性の肺腫瘍である、請求項3または請求項6に記載の使用。
【請求項8】
前記癌が、非小細胞肺癌(NSCLC)、結腸直腸癌(CRC)、膵臓癌、肝細胞癌、または、悪性黒色腫である、請求項2または請求項5に記載の使用。
【請求項9】
製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩を含む医薬組成物。
【請求項10】
製薬上許容できる賦形剤またはキャリアーと共に、AZD2171またはそれらの製薬上許容できる塩、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩を含む医薬組成物。
【請求項11】
AZD2171またはそれらの製薬上許容できる塩、および、AZD6244またはそれらの製薬上許容できる塩を含むキット。
【請求項12】
AZD2171またはそれらの製薬上許容できる塩、および、MEK阻害剤IIまたはそれらの製薬上許容できる塩を含むキット。
【請求項13】
温血動物において血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法であって、該方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩の有効量を投与する前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の有効量を投与することを含む、上記方法。
【請求項14】
温血動物における血管新生抑制作用および/または血管透過性抑制作用を生じさせる方法であって、該方法は、前記動物に、AZD6244またはそれらの製薬上許容できる塩、または、MEK阻害剤IIまたはそれらの製薬上許容できる塩の有効量を投与する前に、その後に、または、それと同時に、さらに、電離放射線の有効量の前に、その後に、または、それと同時に、AZD2171またはそれらの製薬上許容できる塩の有効量を投与することを含む、上記方法。
【図1】




【公表番号】特表2010−523634(P2010−523634A)
【公表日】平成22年7月15日(2010.7.15)
【国際特許分類】
【出願番号】特願2010−502569(P2010−502569)
【出願日】平成20年4月11日(2008.4.11)
【国際出願番号】PCT/GB2008/001266
【国際公開番号】WO2008/125820
【国際公開日】平成20年10月23日(2008.10.23)
【出願人】(300022641)アストラゼネカ アクチボラグ (581)
【Fターム(参考)】
【公表日】平成22年7月15日(2010.7.15)
【国際特許分類】
【出願日】平成20年4月11日(2008.4.11)
【国際出願番号】PCT/GB2008/001266
【国際公開番号】WO2008/125820
【国際公開日】平成20年10月23日(2008.10.23)
【出願人】(300022641)アストラゼネカ アクチボラグ (581)
【Fターム(参考)】
[ Back to top ]

