Fターム[4H006AC81]の内容
有機低分子化合物及びその製造 (186,529) | 反応 (20,822) | 不斉合成;不斉保持合成 (948)
Fターム[4H006AC81]に分類される特許
161 - 180 / 948
アルミニウム錯体と分子内閉環反応における触媒としてのその使用
同一分子内にカルボニル−エン閉環反応を行い得るホルミル基と二重結合とを有する化合物の光学異性体混合物を閉環反応させた場合に、閉環化合物のみならず閉環しなかった化合物の光学異性体の比率を豊富化させる方法を提供すること。一般式[All(L1)l(L2)m(Lh)n]kで表される特定のアルミニウム錯体存在下に、同一分子内にカルボニル−エン閉環反応を行い得るホルミル基と二重結合とを有する化合物の光学異性体混合物を閉環反応させることを特徴とする光学異性体の比率を豊富化させる方法。 (もっと読む)
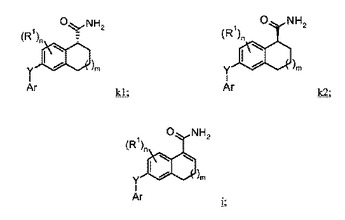
アミノ−メチルテトラリン誘導体の合成方法
式(j1)又は(j2)で表されるルテニウム触媒の存在下、水素ガスで;式(i)で表されるジヒドロナフタレンアミド化合物を還元することによる式(k1)又は(k2)で表される化合物を製造する方法;Ru(Z)2(L)=(j1)、Ru(E)(E’)(L)(D)=(j2);式中、m、n、Ar、Y、R1、E、E’、D、Z、及びLは本明細書で定義されたとおりである。
 (もっと読む)
(もっと読む)
アルミニウム錯体と分子内閉環反応における触媒としてのその使用
同一分子内にカルボニル−エン閉環反応を行い得るホルミル基と二重結合とを有する化合物の光学異性体混合物を閉環反応させた場合に、閉環化合物のみならず閉環しなかった化合物の光学異性体の比率を豊富化させる方法を提供すること。一般式[Al2(L1)n(L2)3-n]mで表される特定のアルミニウム錯体存在下に、同一分子内にカルボニル−エン閉環反応を行い得るホルミル基と二重結合とを有する化合物の光学異性体混合物を閉環反応させることを特徴とする光学異性体の比率を豊富化させる方法。 (もっと読む)
フルオロ硫酸エステル類の製造方法
【課題】フルオロ硫酸エステル類の実用的な製造方法を提供する。
【解決手段】アルコール類を塩基と水の存在下にスルフリルフルオリド(SO2F2)と反応させることにより、フルオロ硫酸エステル類を製造することができる。原料基質としては、光学活性2級アルコール類が好ましく、光学活性α−ヒドロキシエステル類および光学活性4−ヒドロキシプロリン類が特に好ましい。さらに水と混和しない反応溶媒の存在下に2相系で反応を行うことにより、所望の反応が特に良好に進行する。本発明は従来技術の問題点を全て解決し、工業的にも実施可能な製造方法である。
(もっと読む)
保護L−アラニン誘導体の調製方法
本発明は、μ/δオピオイドモジュレーターとして有用な化合物の合成における中間体として有用な、保護L−アラニン誘導体の新規調製プロセスに関する。 (もっと読む)
アミノ酸エステルまたはペプチドエステルまたはこれらの塩の製造方法
【課題】 アミノ酸エステルまたはペプチドエステルまたはこれらの塩を高収率で製造すると同時に、操作的に有利なアルコール溶媒を使用し、脱水剤の不使用、リフラックスを伴わず、加熱操作を行わなくても良い方法を提供する。
【解決手段】 上記課題は、アミノ酸またはペプチドを吸着させた陽イオン交換体カラムにアルコールを通液して水を除去しつつアミノ酸またはペプチドのエステル化をおこなうことを特徴とするアミノ酸エステルもしくはペプチドエステルまたはこれらの塩の製造方法によって達成される。
(もっと読む)
(1S,4R)−または(1R,4S)−4−(2−アミノ−6−クロロ−9H−プリン−9−イル)−2−シクロペンテン−1−メタノールの製造方法
【課題】(1S,4R)−または(1R,4S)−4−(2−アミノ−6−クロロ−9H−プリン−9−イル)−2−シクロペンテン−1−メタノールを簡単でコストが安く、かつ経済的に合成するための中間体である式XVIまたはXVIIのシクロペンテン誘導体のエナンチオマーの製造法の提供。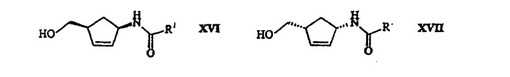
(式中、R1はC1〜4アルキル、C1〜4アルコキシ、アリールまたはアリロキシを表す。)
【解決手段】ラセミのシクロペンテン誘導体を唯一の窒素源および(または)唯一の炭素源として資化する能力をもった微生物を利用するか、またはN−アセチルアミノアルコール・ヒドロラーゼ活性などを有する酵素を利用するかして(1S,4R)−または(1R,4S)−1−アミノ−4−(ヒドロキシメチル)−2−シクロペンテンとしてから、アシル化する。
(もっと読む)
テバイン誘導体の製造方法
【課題】医薬品の合成中間体として重要な化合物であるテバイン誘導体の効率的な製造方法を提供する。
【解決手段】テバイン誘導体(I)を製造する方法であって、コデイノン誘導体を、(i)アセタール化工程と、(ii)溶媒留去工程と、(iii)脱アルコール工程によって、テバイン誘導体を製造する方法。および、粉末X線回折(CuKα、λ=1.54オングストローム)での相対強度10以上のピークに特徴を有するテバイン/メタンスルホン酸塩結晶。 (もっと読む)
(もっと読む)
光学活性α−アシルオキシリン酸エステル誘導体の製造方法
【課題】光学活性α−アシルオキシホスホン酸エステル誘導体の新規な製造方法を提供する。
【解決手段】光学活性オキサゾリン誘導体、銅塩、及び塩基の存在下、下記式(II)
(但し、R2は、炭素数1〜10のアルキル基などの基である。R3は、炭素数1〜3のアルキル基などの基である。)で示されるα−ヒドロキシリン酸エステル誘導体とカルボン酸ハライド化合物を反応させ、反応液から光学活性α−アシルオキシホスホン酸エステル誘導体を分離する方法。
(もっと読む)
キラル配位子
式(1):[式中、R1は、C1−C8−アルキル、非置換のシクロペンチル、シクロヘキシル、ノルボルニルもしくはアダマンチル、又は1〜3個のC1−C4−アルキルもしくはC1−C4−アルコキシによって置換されているシクロペンチルもしくはシクロヘキシル、又は非置換であるか、1〜3個のC1−C4−アルキル、C1−C4−アルコキシ、C1−C4−フルオロアルキル又はC1−C4−フルオロアルコキシ、F及びClによって置換されているベンジル、フェニル、ナフチル及びアントリルであり、R2及びR3は、各々独立して、C−結合炭化水素基又はヘテロ炭化水素基であり、R4は、C1−C4−アルキル、シクロペンチル、シクロヘキシル、フェニル、メチルフェニル、メチルベンジル又はベンジルである]の配位子を調製する方法であって、(a)式(A):(式中、R4は上記定義のとおりである)の化合物を、アミン側鎖のオルト位で立体選択的にメタル化し、式R1−PX2(ここで、R1は上記定義のとおりであり、Xは、Cl又はBrである)のジハライドと反応させ、立体選択的加水分解により、SPO基を含む化合物を得て、式H−PR2R3(ここで、R2及びR3は、上記定義のとおりである)の第二級ホスフィンとの反応により、式(1)の化合物を得ること、を含む方法。本方法によって得られた新規な配位子及びそれらの金属錯体。 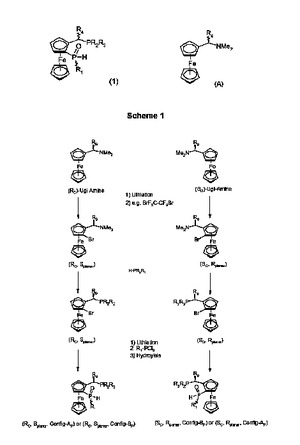 (もっと読む)
(もっと読む)
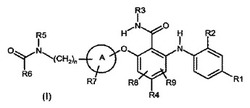
置換アミドフェノキシベンズアミド
本発明は一般式(I):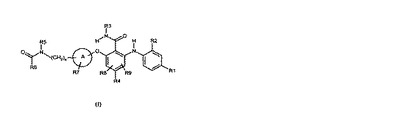
(上式中、A、R1、R2、R3、R4、R5、R6、R7、R8、R9及びnは、特許請求の範囲に規定されるとおりである)の置換アミドフェノキシベンズアミド化合物、上記化合物を含む医薬組成物及びコンビネーション、上記化合物の調製方法、ならびに、上記化合物又は組成物の過剰増殖性疾患及び/又は血管新生性疾患の治療のための単独剤としての、又は、他の活性成分との組み合わせでの使用に関する。
(もっと読む)
(1S,4R)−または(1R,4S)−4−(2−アミノ−6−クロロ−9H−プリン−9−イル)−2−シクロペンテン−1−メタノールの製造方法
【課題】医薬中間体として有用な4−(ヒドロキシメチル)−2−シクロペンテン誘導体の製造方法を提供する。
【解決手段】第一段階において、4−アミノ−2−シクロペンテンカルボン酸のラセミ体または光学活性な異性体のいずれか1つを、カルボン酸ハロゲン化物でアシル化して、4−アシルアミノ−2−シクロペンテンカルボン酸誘導体とし、第二段階において該アシルアミノ−2−シクロペンテンカルボン酸誘導体を還元することによる、下式で表される4−(ヒドロキシメチル)−2−シクロペンテン誘導体(XIII)の製造方法。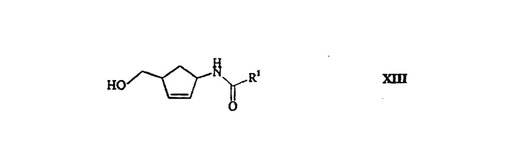
[式中、R1はC1〜4アルキル等を表す。]
(もっと読む)
新規不斉触媒、並びに光学活性エステル及び光学活性カルボン酸の製造方法
【課題】ラセミのカルボン酸から光学活性エステル及び光学活性カルボン酸を高エナンチオ選択的に製造することが可能な新規不斉触媒、並びにその不斉触媒を用いた光学活性エステル及び光学活性カルボン酸の製造方法を提供する。
【解決手段】本発明に係る新規不斉触媒は、下記式(I)若しくは(II)で表される化合物又はそのエナンチオマーである。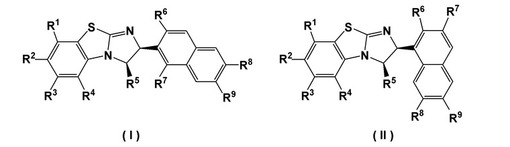
(式(I)、(II)中、R1〜R9は水素原子、ハロゲン原子、アルキル基等の置換基を示す。)
(もっと読む)
7−ヒドロキシ−ベンゾイミダゾール−4−イル−メタノン誘導体およびこれを含むPBK阻害剤
PBK阻害剤のために有用である、7−ヒドロキシ−ベンゾイミダゾール−4−イル−メタノン誘導体が提供される。 (もっと読む)
イロペリドン代謝産物の光学異性体
【課題】イロペリドン代謝物の新規異性体の製造、これらを含有する医薬組成物の提供。
【解決手段】イロペリドンの代謝産物P−88−8991の光学異性体、(R)−1−(4−{3−[4−(6−フルオロ−ベンゾ[d]イソキサゾール−3−イル)−ピペリジン−1−イル]−プロポキシ}−3−メトキシ−フェニル)−エタノールおよび(S)−1−(4−{3−[4−(6−フルオロ−ベンゾ[d]イソキサゾール−3−イル)−ピペリジン−1−イル]−プロポキシ}−3−メトキシ−フェニル)−エタノールの製造および医薬として使用。
(もっと読む)
光学活性シクロプロパンカルボン酸エステル化合物の製造方法、不斉銅錯体および光学活性サリチリデンアミノアルコール化合物
【課題】シス体に富んだ光学活性シクロプロパンカルボン酸エステル化合物の製造方法を提供する。
【解決手段】銅化合物と特定構造を有する光学活性サリチリデンアミノアルコール化合物との反応により得られる不斉銅錯体の存在下に、ジアゾ酢酸エステルと式(3)
で示される化合物とを反応させ一般式(4)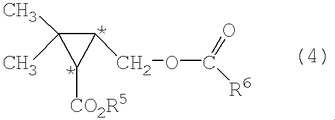
(式中、R5はアルキル基等を表わし、R6はアルキル基等を表わす。*は不斉中心を表わす。)で示される光学活性シクロプロパンカルボン酸エステル化合物を製造する。
(もっと読む)
高純度L−カルチニンの調製方法
【課題】本願発明の目的は、S−エピクロロヒドリンから開始するL−カルニチンを合成する全工程におけるキラル材料とキラル中間体の含有量を検出しコントロールすることにより、L−カルニチンの純度が97%以上であり、D−カルニチンの含有量が2%以下である高純度L−カルニチンの調製方法を提供することである。
【課題を解決するための手段】前記方法は、(1)GCおよびキラルカラムによりS−エピクロロヒドリンの光学異性体の含有量を検出し、S−エピクロロヒドリンの左旋性異性体の含有量を0%〜12%w/wの範囲内にコントロールする工程と、(2)合成工程において、中間体であるL−3−クロロ−2−ヒドロキシプロピルトリメチルアミンの比旋光度を旋光計で検出し、該比旋光度を−26.0°〜−29.4°の範囲内にコントロールする工程と、(3)中間体混合物であるL−3−シアン−2−ヒドロキシプロピルトリメチルアミンの光学的純度およびその右旋性異性体の含有量をキラル誘導体化試薬を使って検出し、前記右旋性異性体の含有量を0〜3.6%w/wの範囲内にコントロールする工程と、を有し、 前記キラル誘導体化試薬は、化学式(II)の光学的に純粋なD−もしくはL−化合物であり、前記化学式(II)のアスタリスクで示された炭素原子は、キラル炭素原子であり、Rは、C1〜C6の直鎖もしくは分岐鎖状のアルキル基、C6〜C10のアリール基、C2〜C6の直鎖もしくは分岐鎖状のアルケニルもしくはアルキニル基、またはC3〜C6のシクロアルキル基であり、Xは、ハロゲン原子を示す、高純度L−カルニチンの調製方法。
(もっと読む)
ジンゲロール類の製造法
【課題】安価で光学活性なジンゲロール類の製造方法の提供。
【解決手段】式1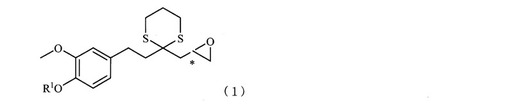
(R1は水酸基の保護基を示し、*は不斉炭素原子を示す)で表される化合物を出発物質として、式5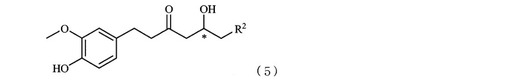
(R2はC2〜12の炭化水素基を示す)で表されるジンゲロール類の製造法。
(もっと読む)
α−トリフルオロメチル−β−置換−β−アミノ酸類の製造方法
【課題】α−トリフルオロメチル−β−置換−β−アミノ酸類の実用的な製造方法を提供する。
【解決手段】α−トリフルオロメチル−β−置換−α,β−不飽和エステル類とヒドロキシルアミンを反応させることによりα−トリフルオロメチル−β−置換−β−アミノ酸脱水素閉環体に変換し、該脱水素閉環体を加水素分解することによりα−トリフルオロメチル−β−置換−β−アミノ酸類を製造することができる。本製造方法では、官能基が保護されていないフリーのアミノ酸である、新規なα−トリフルオロメチル−β−置換−β−アミノ酸類を製造することができ、β位置換基も芳香環基または置換芳香環基に限定されず、α位とβ位の相対的な立体化学も制御することができる。
(もっと読む)
ホスフィノオキシドベースのルテニウム錯体を有するエステル基又はカルボニル基の水素化
本発明は、接触水素化の分野に関し、特に、ケトン、アルデヒド及びエステル又はラトンを、それぞれアルコール又はジオールへ還元するための水素化方法における特別なルテニウム触媒又はプレ触媒の使用に関する。前記触媒は、型(N−N)のリガンド及び型(P−PO)のリガンドを含むルテニウム錯体である。 (もっと読む)
161 - 180 / 948
[ Back to top ]