アゾールヌクレオシド、並びに、RNA/DNAウイルスポリメラーゼ阻害剤としての使用
【課題】アゾールヌクレオシド、並びに、RNA/DNAウイルスポリメラーゼ阻害剤としての使用。
【解決手段】式(I)及び(II)で表されるアゾールヌクレオシド:
[化1]

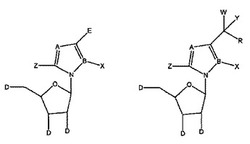
[式中、A=C又はNであり、B=C又はNであり、X=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、Z=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、E=(CH2)HONHR1であって、nは0〜6、より典型的には0〜3の整数であり、R1=アリール又はヘテロシクロであり、W、Y、Rは、それぞれ独立して、H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;O、OH、Oアルキル、Oアリール、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)からなる群より選択されるが、但し、W、Y及びRのうち少なくとも1つはH以外のものであって、W及びYは共に結びついて=Oとなっていてもよく、Dは、それぞれ独立して、OH、Oアルキル、Oアリール、Fl及びHである]、薬学的に許容されるその塩、そのプロドラッグ、並びに、その混合物を提供する。本開示の化合物は、以下に限定されないが、例えばインフルエンザ、ハンターンウイルス、クリミア・コンゴ出血熱ウイルス、B型肝炎、C型肝炎、ポリオ、コクサッキーA及びB、ライノ、エコー、オルソポックスウイルス(痘瘡)、HIV、エボラ、並びに、西ナイルウイルスのウイルスポリメラーゼ等のウイルスRNA/DNAポリメラーゼ阻害剤として、特にオルソポックスウイルス、HIV並びにB型肝炎といったウイルスRNA/DNAポリメラーゼ阻害剤として有用である。
【解決手段】式(I)及び(II)で表されるアゾールヌクレオシド:
[化1]

[式中、A=C又はNであり、B=C又はNであり、X=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、Z=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、E=(CH2)HONHR1であって、nは0〜6、より典型的には0〜3の整数であり、R1=アリール又はヘテロシクロであり、W、Y、Rは、それぞれ独立して、H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;O、OH、Oアルキル、Oアリール、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)からなる群より選択されるが、但し、W、Y及びRのうち少なくとも1つはH以外のものであって、W及びYは共に結びついて=Oとなっていてもよく、Dは、それぞれ独立して、OH、Oアルキル、Oアリール、Fl及びHである]、薬学的に許容されるその塩、そのプロドラッグ、並びに、その混合物を提供する。本開示の化合物は、以下に限定されないが、例えばインフルエンザ、ハンターンウイルス、クリミア・コンゴ出血熱ウイルス、B型肝炎、C型肝炎、ポリオ、コクサッキーA及びB、ライノ、エコー、オルソポックスウイルス(痘瘡)、HIV、エボラ、並びに、西ナイルウイルスのウイルスポリメラーゼ等のウイルスRNA/DNAポリメラーゼ阻害剤として、特にオルソポックスウイルス、HIV並びにB型肝炎といったウイルスRNA/DNAポリメラーゼ阻害剤として有用である。
【発明の詳細な説明】
【技術分野】
【0001】
本開示は、アゾール、とりわけ、ピラゾールやイミダゾール等のジアジン化合物、トリアジン化合物、及びプリン化合物に関する。これらの化合物は、以下に限定はされないが、インフルエンザ、ハンターンウイルス(HTNV)、クリミア・コンゴ出血熱ウイルス(CCHF)、リフトバレー熱ウイルス(RVFV)、B型肝炎、C型肝炎、ポリオ、コクサッキーA及びB、ライノ、エコー、オルソポックスウイルス(痘瘡)、HIV、エボラ及び西ナイルウイルスの各ウイルスポリメラーゼ等のウイルスRNA/DNAポリメラーゼ阻害剤として有用である。なかでも、インフルエンザ、並びに、ハンターンウイルス、クリミア・コンゴ出血熱ウイルス及びリフトバレー熱ウイルス等のブニヤウイルス科ウイルスのウイルスRNA/DNAポリメラーゼ阻害剤として有用である。
【0002】
本開示は、上記化合物を含む医薬組成物にも関する。本開示はまた、ウイルスRNA/DNAポリメラーゼを阻害する上で上記化合物を使用する方法、並びに、各種RNA/DNAウイルス及び各種ガンに起因する疾患の患者を治療する方法に関する。
【0003】
本開示はまた、本開示の化合物を調製する方法にも関する。
【背景技術】
【0004】
世界的に見て、ウイルス性疾患は死亡や経済的損失の主要な原因の一つである。各種ウイルス性疾患の中でも、インフルエンザ、HIV、HBV及びHCV感染はより深刻なものであり、多数の死者を出している。HIVに対する薬は幾つか存在し、HBVに対する薬もほんのわずか存在しているが、HCVに有効な薬は存在しない。C型肝炎はウイルス性の肝臓疾患であり、C型肝炎ウイルス(HCV)の感染により発症する。世界の慢性HCV感染患者数は約1億7000万人であり、そのうちの約270万人がアメリカに在住している。HCVは肝硬変の主な原因であり、肝細胞癌の一般的な原因でもある。また、HCVは、アメリカで行われる肝臓移植の主な理由にもなっている。HCVの治療法として認可されているのは、今のところ、αインターフェロン単独療法、及びαインターフェロンとリバビリンとの併用療法だけである。
【0005】
RNA/DNAウイルスポリメラーゼ阻害剤の開発が望まれている。
【発明の概要】
【課題を解決するための手段】
【0006】
本開示は特に、下記式で表される化合物:
【0007】
【化1】

[式中、A=C又はNであり、
B=C又はNであり、
X=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
Z=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br、I等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
E=(CH2)nONHR1であって、nは0〜6、より典型的には0〜3の整数であり、R1=アリール又はヘテロシクロであり、
W、Y、Rは、それぞれ独立して、H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;O、OH、Oアルキル、Oアリール、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)からなる群より選択されるが、但し、W、Y及びRのうち少なくとも1つはH及びNH2以外のものであって、W及びYは共に結びついて=Oとなっていてもよく、
Dはそれぞれ独立して、OH、Oアルキル、Oアリール、Fl及びHである]、
薬学的に許容されるその塩、そのプロドラッグ、及び、その混合物に関する。
【0008】
本開示の別の態様は、上記化合物を少なくとも1つ含有する医薬組成物に関する。
【0009】
本開示のさらなる態様は、上記化合物の少なくとも1つを、RNAウイルスポリメラーゼを阻害するのに有効な量で患者に投与することにより、当該患者においてRNAウイルスポリメラーゼを阻害する方法に関する。
【0010】
本開示の更に別の態様は、RNAウイルス感染患者を治療する方法であって、上記化合物の少なくとも1つを有効量で当該患者に投与することを含む方法に関する。
【0011】
以下の詳細な説明により、本開示の更に別の目的及び利点が当業者にとって容易に明らかとなるであろう。詳細な説明においては、単に考えられる最良の形態を示すことで好ましい実施形態を図示及び記載している。本開示に関して他の異なる実施形態も可能であることは明らかであり、いくつかの詳細については、本開示から逸脱することなく、各種の自明な点で変形が可能である。従って、本明細書は本質的に実施例を用いた説明的なものであり、これに限定されることはない。
【図面の簡単な説明】
【0012】
【図1】図1は、TA−18がヒトのアデノシンキナーゼの基質であることを示すグラフである。
【図2】図2は、ヒトCEM細胞中でTA−18がリン酸化代謝物に変換されたことを示すグラフである。
【図3】図3は、TA−18で処理することにより、GTPレベルが減少したことを示すグラフを表す。
【図4】図4は、ヨードツベルシジンを用いてアデノシンキナーゼ活性を阻害すると、ヒト細胞内におけるTA−18の代謝が阻害されたことを示すグラフである。
【図5】図5は、ヨードツベルシジンを用いてアデノシンキナーゼ活性を阻害すると、TA−18が引き起こすGTPレベルの減少もまた抑制されたことを示すグラフである。
【図6】図6は、リバビリンからよりもTA−18からの方が形成される細胞内代謝物がはるかに少ないことを示すグラフである。
【図7】図7は、リバビリンで処理することによっても、ヒト細胞内におけるGTPレベルが減少したことを示すグラフである。
【発明を実施するための形態】
【0013】
本開示は、とりわけ、下記式で表される化合物:
【0014】
【化2】

[式中、A=C又はNであり、
B=C又はNであり、
X=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
Z=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br、I等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
E=(CH2)nONHR1であって、nは0〜6、より典型的には0〜3の整数であり、R1=アリール又はヘテロシクロであり、
W、Y、Rは、それぞれ独立して、H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;O、OH、Oアルキル、Oアリール、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)からなる群より選択されるが、但し、W、Y及びRのうち少なくとも1つはH及びNH2以外のものであって、W及びYは共に結びついて=Oとなっていてもよく、
Dはそれぞれ独立して、OH、Oアルキル、Oアリール、Fl及びHである]、
薬学的に許容されるその塩、そのプロドラッグ、及び、その混合物に関する。
【0015】
これらの化合物の置換基の立体化学構造は、置換位置において(R)又は(S)のいずれであってもよい。当然、異なる立体異性体同士の混合物も考えられる。
【0016】
以下、本発明の説明に使用される各用語の定義を列挙する。これらの定義は、それそのものとして又はより大きなまとまりの一部として、特定の場合を除き、本明細書全体を通じて用いられるよう各用語に適用される。
【0017】
「アルキル」という用語は、直鎖又は分枝鎖状の非置換炭化水素基を表し、典型的には1〜6個の、より典型的には1〜3個の炭素原子を有している。
【0018】
アルキル基の好ましい例としては、メチル、エチル及びプロピルが挙げられる。分枝鎖アルキル基の例としては、イソプロピル及びt−ブチルが挙げられる。アルコキシ基の好ましい例としては、メトキシ、エトキシ及びプロポキシが挙げられる。
【0019】
シクロアルキル基は、典型的には3〜6個の炭素原子を有しており、シクロプロピル、シクロブチル、シクロペンチル及びシクロヘキシルを包含する。
【0020】
ハロ基の例としては、Cl、F、Br及びIが挙げられる。
【0021】
アルケニル基は、典型的には2〜6個の炭素原子を有しており、エテニル、プロペニル及びブテニルを包含する。
【0022】
シクロアルケニル基は、典型的には3〜6個の炭素原子を有しており、シクロプロペニル、シクロブテニル、シクロペンテニル及びシクロヘキセニルを包含する。
【0023】
アルキニル基は、典型的には2〜6個の炭素原子を有しており、アセチレニル及びプロピニルを包含する。
【0024】
「アリール」という用語は、単環式又は多環式の芳香族炭化水素基を表し、典型的には6〜14個の炭素原子を環部分に有している。アリールの例としては、フェニル、2−ナフチル、1−ナフチル、4−ビフェニル、3−ビフェニル、2−ビフェニル及びジフェニル基が挙げられ、それぞれ置換されていてもよい。
【0025】
「ヘテロシクロ」という用語は、飽和又は不飽和の単環基又は多環基を表す。
【0026】
多環式芳香族(不飽和)複素環(heterocycle)基の例としては、2−キノリニル、3−キノリニル、5−キノリニル、6−キノリニル、7−キノリニル、1−イソキノリニル、3−イソキノリニル、6−イソキノリニル、7−イソキノリニル、3−シンノリル(cinnolyl)、6−シンノリル、7−シンノリル、2−キナゾリニル、4−キナゾリニル、6−キナゾリニル、7−キナゾリニル、2−キノキサリニル、5−キノキサリニル、6−キノキサリニル、1−フタラオニル(phthalaonyl)、6−フタラジニル、1−5−ナフチリジン−2−イル、1,5−ナフチリジン−3−イル、1,6−ナフチリジン−3−イル、1,6−ナフチリジン−7−イル、1,7−ナフチリジン−3−イル、1,7−ナフチリジン−6−イル、1,8−ナフチリジン−3−イル、2,6−ナフチリジン−6−イル、2,7−ナフチリジン−3−イル、インドリル、1H−インダゾリル、プリニル、及び、プテリジニルが挙げられる。
【0027】
単環式複素環基の例としては、ピロリル、ピラニル、オキサゾリル、チアゾイル、チオフェニル、フラニル、イミダゾリル、ピラゾリル、ピリジニル、ピラジニル、ピリミジニル、4−ピリミジニル、3−ピリミジニル及び2−ピリミジニル、ピリダジニル、イソチアゾリル、及び、イソオキサゾリルが挙げられる。
【0028】
飽和複素環基の例としては、ピロリジニル、イミダゾリジニル、ピラゾリジニル、ピペリジニル、ピペラジニル、及び、モルホリニルが挙げられる。
【0029】
複素環基は、N、O及び/又はSを含み、典型的には5〜10個の原子を環構造内に有し、また典型的には1、2又は3個のヘテロ原子(例えば、−N、O及びS)を環構造内に有している。
【0030】
必要に応じて、上記アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール及びヘテロシクロ基は置換されていてもよい。置換されている場合、これらの基は典型的には、ハロゲン、及び/又は、アルキル置換基、及び/又は、(CH2)nONH2(式中、nは0〜6、より典型的には0〜3の整数である)で置換されている。本開示の化合物は、分子内の考え得る各種原子における全ての光学異性体及び立体異性体に関するということが当然ながら理解されよう。
【0031】
本開示に係る化合物は、アルコキシ基、アミノ酸基等をプロドラッグ形成部として使用して、ヒドロキシル又はアミノ官能基でプロドラッグを形成してもよい。例えば、ヒドロキシメチル部がモノ−、ジ−又はトリホスフェートを形成し、さらにこれらのホスフェートがプロドラッグを形成してもよい。ヒドロキシ及びヒドロキシメチル基を、−OCH2P(O)(OH)2に、さらにこのホスホネートのプロドラッグに変換してもよい。ヒドロキシメチルの酸素原子をCH2に変換し、その後CH2P(O)(OH)2に、さらにそのプロドラッグに変換してもよい。
【0032】
各種の窒素官能基(アミノ、ヒドロキシアミノ、アミド等)を有する化合物のプロドラッグ形態としては、以下に示すような誘導体が挙げられる。
(a)カルボキサミド:−NHC(O)R
(b)カルバメート:−NHC(O)OR
(c)(アシルオキシ)アルキルカルバメート:NHC(O)OROC(O)R
(d)エナミン:−NHCR(=CHCO2R)又は−NHCR(=CHCONR2)
(e)シッフ塩基:−N=CR2
(f)マンニッヒ塩基(カルボキシイミド化合物由来):RCONHCH2NR2
上記式中、R基はそれぞれ独立して、上記で定義されるような、水素、置換又は非置換のアルキル、アリール、アルケニル、アルキニル、複素環基、アルキルアリール、アラルキル、アラルケニル、アラルキニル、シクロアルキル、又は、シクロアルケニル基であってもよい。
【0033】
このようなプロドラッグ誘導体の調製については、各種文献で考察されている(例えば、AlexanderらによるJ.Med.Chem.1988,31,318;Aligas−MartinらによるPCT WO pp/41531のp.30)。本開示の化合物の窒素原子のうちの1つ(又は1つ以上)は、これらの誘導体の調製において変換される窒素官能基である。
【0034】
本開示の、カルボキシル含有化合物のプロドラッグ形態はエステル(−CO2R)を含む。上記式中、R基は、酵素又は加水分解プロセスによって薬学的に許容される程度に体内で放出される任意のアルコールに相当する。本開示のカルボン酸形態に由来する別のプロドラッグは、BodorらによるJ.Med.Chem.,1980,23,469に記載されている構造からなる以下のような第四級塩型であってもよい。
【0035】
【化3】

【0036】
本開示の化合物の薬学的に許容される塩としては、薬学的に許容される無機酸又は有機酸由来のものが挙げられる。好ましい酸の例としては、塩化水素酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、トルエン−p−スルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、ギ酸、安息香酸、マロン酸、ナフタレン−2−スルホン酸、トリフルオロ酢酸、及び、ベンゼンスルホン酸が挙げられる。適当な塩基に由来する塩は、ナトリウム及びアンモニア等のアルカリ類を含む。
【0037】
本開示の範囲内である化合物の幾つかは、以下の化学式によって表される。
【0038】
【化4】

【0039】
【化5】

【0040】
【化6】

【0041】
【化7】

【0042】
【化8】

【0043】
【化9】

【0044】
N−アリールカルボキサミドアゾールリボシドの代表例としては、以下のものが挙げられる。
【0045】
【化10】

【0046】
本開示に係る炭素置換アゾールリボシドの代表例としては以下のものが挙げられる。
【0047】
【化11】

【0048】
【化12】

【0049】
抗ウイルス薬スクリーニングにおいて合成された、代表的な新規1−β−D−リボフラノシル化合物の構造は、以下のように示される。
【0050】
【化13】

【0051】
化合物の合成
本開示の化合物は、以下のスキームに従って調製できる。
【0052】
[IA−3]N1−(3−フルオロフェニル)−イノシン
TBS−IA−3及びIA−3を合成するための反応スキーム
【0053】
【化14】

(i)TBS−Cl、イミダゾール、DMAP、DMF 室温 24時間
(ii)3−フルオロフェニルボロン酸、Cu2(OAc)2、ピリジン、ピリジン−N−オキシド、CH2Cl2、粉末モレキュラーシーブ4Å、O2
(iii)TBAF、THF、−10℃
【0054】
[RN−3]5−アミノ−4−N−3−フルオロフェニルカルボキサミド−1−β−D−リボフラノシル−1H−イミダゾール
RN−3を合成するための反応スキーム
【0055】
【化15】

(i)5NのNaOH、EtOH、還流4時間
TBS−IA−3は上述の通りに調製される。
【0056】
[TBS−TA−8](1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド
TBS−TA−8aを合成するための反応スキーム
【0057】
【化16】

a試薬及び条件:(i)1MのNaOMe、MeOH、室温、2時間;(ii)TBDMSCl、イミダゾール、DMAP、DMF、室温、18時間;(iii)DIBALH、CH2Cl2、−78℃、4時間
【0058】
TA−18:3−エチニル−1−(β−D−リボフラノシル)−[1,2,4]トリアゾール
TA−18aを合成するための反応スキーム
【0059】
【化17】

a(i)ジメチル−1−ジアゾ−2−オキソプロピルホスホネート、K2CO3、MeOH、室温、24時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0060】
TA−12:1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノール
TA−12aを合成するための反応スキーム
【0061】
【化18】

a試薬及び条件:(i)CH3MgCl、THF、0℃、3時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0062】
TA−13:1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノン
TA−13aを合成するための反応スキーム
【0063】
【化19】

a試薬及び条件:(i)PCC、CH2Cl2、室温、4時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0064】
TA−14:1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノール
TA−14aを合成するための反応スキーム
【0065】
【化20】

a試薬及び条件:(i)PhMgCl、THF、0℃、3時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0066】
TA−15:1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノン
TA−15aを合成するための反応スキーム
【0067】
【化21】

a試薬及び条件:(i)PCC、CH2Cl2、室温、4時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0068】
TA−17:3−(1,1−ジフルオロ−エチル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール
TA−17aを合成するための反応スキーム
【0069】
【化22】

a試薬及び条件:(i)DAST、CH2Cl2、還流、12時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0070】
TA−19:1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−2,2,2−トリフルオロエタノール
TA−19aを合成するための反応スキーム
【0071】
【化23】

a試薬及び条件:(i)CF3TMS、KOtBu、乾燥THF、0℃、3時間;(ii)1MのTBAFのTHF溶液、乾燥THF、室温、2.5時間
【0072】
TA−20:3−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオンアミド
TA−20aを合成するための反応スキーム
【0073】
【化24】

a試薬及び条件:(i)ブロモ酢酸エチル、Zn(金属)、THF、還流、4時間;(ii)NH3、MeOH、60℃、24時間;(iii)1MのTBAFのTHF溶液、室温、4時間
【0074】
各種化合物を、生物学的試験データと併せて以下に示す。
【0075】
化合物及び抗ウイルス活性の概要
1−β−D−リボフラノシル−アゾール誘導体化合物、及び、A(H3N2)型インフルエンザに対する抗ウイルス活性についてスクリーニングしたものを以下に示す。
【0076】
【化25】

【0077】
以下は、インフルエンザウイルスを例として用いた評価プロトコルの概要である。他の被験ウイルスに対しても同様のプロトコルが採用できると解される。
【0078】
2.0 抗インフルエンザウイルス評価プロトコルの概要
抗ウイルス及び毒性アッセイ:
抗インフルエンザウイルス評価アッセイにより、所定の単回投与濃度とした化合物の効果を試験する。アッセイにおいては、メイディン・ダービー・イヌ腎臓(Madin Darby canine kidney:MDCK)細胞を用い、インフルエンザA/Udorn/72の感染により誘発される細胞変性効果(CPE)に対する、化合物の抑制効果を試験する。典型的なプレート配置を以下の表1に示す。
【0079】
【表1】

【0080】
試験毎に、陽性対照化合物としてリバビリンを使用している。MDCK細胞のサブコンフルエント(Subconfluent)状態の培養物を384ウェルプレートで培養し、抗ウイルス活性(CPE)を分析する。24時間後、細胞に薬剤を加える。また、所定時間で、CPEウェルに組織培養感染量(TCID50)の100倍のA/Udorn/72を投入する。72時間後、CellTiter−Glo(Promega社)を用いて細胞生存度を求める。ウイルス誘発性CPEを50%を超えて阻害する化合物を有効とする。
【0081】
CellTiter−Gloによる細胞生存度の検出アッセイ
インフルエンザ誘発性CPEは、代謝的に活性な細胞の指標であるATPを定量することで測定される。CPEアッセイには、市販のCellTiter−Glo<R> Luminescent Cell Viability Kit〔Promega社(ウィスコンシン州、マディソン)〕を使用する。CPEアッセイは、培養物中の細胞毒性及び細胞増殖を測定する上で信頼性が高い方法である。この方法には、前もって培地で培養しておいたサブコンフルエントな細胞に1種類の試薬(CellTiter−Glo<R>試薬)を直接添加する工程が含まれる。これによって細胞溶解が起こり、存在するATP(生存度を示す生物マーカーである)の量に比例して、生物発光シグナルが生じる(細胞の種類によるが、半減期は5時間を越える)。
【0082】
3.0 材料及び方法
3.1 材料
・細胞
MDCK、ATCC Cat#CCL−34
・ウイルス
A/Udorn/72;H3N2;Passage#2;14OCT05
・エンドポイント試薬
CellTiter−GLO−Promega
基質:Cat#G755B
バッファ:Cat#G756B
・対照薬
リバビリン−MP Biomedicals,Inc.、Cat#196066
【0083】
3.2 方法
第1日目:MDCK細胞が集密度90%まで増殖したら、トリプシン処理、回収、遠心分離を行ってから、PBSで2回洗浄して残余血清を取り除く。その後、細胞を無血清DMEMで希釈し、384ウェルプレートに分注し(20μl/ウェル)、37℃で1晩かけてプレートに定着させる。
【0084】
第2日目:プレートから少量をランダムにサンプリングし、細胞の形態を目視観察する。試験する化合物(5μl)を各プレートウェルに添加し、最終濃度を10μMにし、DMSO濃度を0.5%未満とする。プレートは
【0085】
評価プロトコルについては、NoahらによるA cell−based luminescence assay is effective for high−throughput screening of potential influenza antivirals,Antiviral Reserch(2006)〔doi:10.1016/j.antiviral.2006.07.006(オンライン上、www.sciencedirect.comにてコピーを入手可能)〕に、さらに詳しい記載がみられる。この全開示内容を本願明細書に引用して援用する。
【0086】
アデノシンキナーゼ及びTA−18に関する先行研究より、以下の結論が導かれる。
【0087】
1.アデノシンキナーゼを用いた基質活性は、合成された幾つかのアナログを使用して測定された(表2参照)。
【0088】
2.放射標識されたTA−18を用いて、TA−18がヒトのアデノシンキナーゼの基質であることが確認された(図1参照)。次ページの表に示す結果における活性と、放射標識された化合物を用いた結果における活性とが一致していないのは、実験で用いた化合物の濃度が異なるためだと考えられる(表に示される結果では100μMを用い、他の全ての実験では10μMを用いた)。
【0089】
3.TA−18は、ヒト細胞内でリン酸化代謝物に変換された(図2参照)。
【0090】
4.TA−18で処理すると、ヒト細胞内でGTPレベルが減少した(以下の表3及び図3参照)。
【0091】
5.ヨードツベルシジンでアデノシンキナーゼの活性を阻害すると(図4参照)、ヒト細胞内でTA−18の代謝が阻害された。従って、この細胞系では、アデノシンキナーゼがTA−18の代謝に関与する主要酵素であることが示された。
【0092】
6.ヨードツベルシジンでアデノシンキナーゼの活性を阻害すると(図5参照)、TA−18が引き起こすGTPレベルの減少もまた抑制された。従って、TA−18で処理された細胞内で観察されたGTPレベルの減少は、TA−18の代謝物が原因であることが示された。
【0093】
7.リバビリンで処理した場合も、ヒト細胞内でGTPレベルが減少した(図7参照)。TA−18から得られた細胞内代謝物の方が、リバビリンから得られた細胞内代謝物よりもはるかに少なかったため(図6参照)、リバビリン代謝物よりもTA−18代謝物の方がGTPレベルの減少に効果があることがこの結果により示される。
【0094】
8.これらの先行結果より、TA−18の作用である抗ウイルスメカニズムは、細胞内GTPレベルの減少に起因していること、あるいはIMPデヒドロゲナーゼ活性の阻害に起因していることが示唆される。
【0095】
【表2】

【0096】
ヒトのアデノシンキナーゼを、各化合物100μM及びATPとインキュベートした。37℃で所望時間インキュベートした後、反応を止め、5’−モノホスフェートに変換された各化合物をHPLCで測定した。
【0097】
これらの化合物を試験する際、我々はこれら三種及びインフルエンザ間の阻害レベルの差を区別しなかった。本開示化合物の抗ウイルス活性試験において得られた結果を明らかにすると、以下の点となる。例えば、ハンターンウイルス(HTNV)、クリミア・コンゴ出血熱ウイルス(CCHFV)、リフトバレー熱ウイルス(RVFV)、及び、インフルエンザに対する抗ウイルス薬スクリーニングにより、ブニヤウイルス科内のウイルスにおいて本開示化合物が選択性を有することが示される。例えば、I8−0は、HTNV及びインフルエンザに対して抗ウイルス活性を示した。IA−3はHTNVに対して抗ウイルス活性を示し、IM−18はインフルエンザに対して抗ウイルス活性を示した。PZA−Oはインフルエンザに対して抗ウイルス活性を示した。RC−3は、HTNV及びインフルエンザに対して抗ウイルス活性を示し、RN−3はHTNVに対して活性を示した。TA−1はCCHFVに対して抗ウイルス活性を示し、TA12はHTNVに対して抗ウイルス活性を示し、TA−14及び16はHTNVに対して抗ウイルス活性を示し、TA18はHTNV、インフルエンザ及びCCHFVに対して抗ウイルス活性を示し、TA−23はRVFVに対して抗ウイルス活性を示した。T系化合物が好ましい。
【0098】
本開示を更に説明するための実施例を以下に示すが、本開示はこれらに限定されない。
【0099】
実施例1
【0100】
【化26】

2’,3’,5’−トリス−(O−tert−ブチルジメチルシリル)−イノシン(TBS−I):
TBS−Cl(18.1g、120mmol)及びイミダゾール(10.9g、160mmol)を用いたイノシン(5.36g、20mmol)の保護反応を、乾燥DMF(100mL)中にて室温下48時間行った。減圧下で濃縮した後、混合物をCH2Cl2で200に希釈し、それぞれ100mLの水(4回)、飽和NH4Cl(3回)、及び飽和NaClで洗浄した。続いて、EtOAc中で再結晶させて白色結晶固体(10.9g、17.8mmol、90%)を得た。FTIR(PTFEカード、cm−1)1706;1H NMR(400MHz、CDCl3−d)δ13.30(1H、s)、8.31(1H、s)、8.21(1H、s)、5.98(1H、d、J=4.8Hz)、4.46(1H、m)、4.26(1H、m)、4.09(1H、m)、3.96(1H、m)3.75(1H、m)、0.92−0.77(27H、mult.s)、0.11−−0.20(18H、mult.s);13C NMR(400MHz、CDCl3−d)δ159.3、148.8、145.3、138.8、124.8、88.2、85.2、76.4、71.5、62.2、TBS−は記載せず。
【0101】
実施例2
【0102】
【化27】

N1−(3−フルオロフェニル)−2’,3’,5’−トリス−(O−tert−ブチルジメチルシリル)−イノシン(TBS−IA−3):
TBS−I(2.4g、4.0mmol)、3−フルオロフェニルボロン酸(1.1g、8.0mmol)、無水Cu(OAc)2(800.0mg、4.4mmol)、ピリジン−N−オキシド(800mg、4.0mmol)、粉末モレキュラーシーブ4Å(約1g)及び攪拌子を、乾燥器で乾燥させたシュレンク管に入れた。続いて、シュレンク管をゴムセプタムで密封し、排気後、酸素をフラッシュした。その後、乾燥ピリジン(647μL、8.0mmol)、及び、モレキュラーシーブにより乾燥したCH2Cl2(20mL)を加え、室温下で24時間、反応系を激しく攪拌した。続いて、MeOH中の飽和NH4OH溶液(5mL中に0.5mL)で反応をクエンチした後、ヘキサンで500mLに希釈した。有機分を、それぞれ250mLの水、飽和NH4Cl、1MのNaCl、及び飽和NaClで洗浄した。その後、有機分をNa2SO4で乾燥し、減圧下で濃縮した。CH2Cl2/MeOHを溶離液として、中圧フラッシュクロマトグラフィー(Isco CombiFlash GRADUATE)により全ての化合物を精製し、白色非晶質固体(式量=705.1、1.93g、2.74mmol、67%)を得た。FTIR(PTFEカード、cm−1)1716;1H NMR(400MHz、CDCl3−d)δ8.20(1H、s)、7.99(1H、s)、7.45(1H、m)、7.16−7.13(3H、m)、5.99(1H、d、J=4.8Hz)、4.46(1H、m)、4.29(1H、m)、4.11(1H、m)、3.97(1H、m)3.77(1H、m)、0.93−0.80(27H、mult.s)、0.12−−0.16(18H、mult.s);13C NMR(400MHz、CDCl3−d)δ162.6(J=248.1Hz)、156.0、147.1、146.4、138.4(J=9.5Hz)、130.7(J=9.0Hz)、124.7、123.0、116.3(J=20.0Hz)、115.2(J=23.9Hz)、88.1、85.4、76.7、71.6、62.3、TBS−は記載せず;C34H57FN4O5Si3としての元素分析計算値:C,57.92;H,8.15;N,7.95 実測値:C,57.94;H,8.36;N,7.83。
【0103】
実施例3
【0104】
【化28】

N1−(3−フルオロフェニル)−イノシン(IA−3):
TBS3−IA−3(1.06g、1.5mmol)、乾燥THF(25mL)、及び攪拌子を丸底フラスコに入れ、−10℃で攪拌した。ここに1Mのフッ化テトラブチルアンモニウム/THF溶液を5.0mL加えた。1.5時間後(TLCにより完了が示されたとき)、アセトンを溶離液として、5cm径のシリカゲルオープンカラム(gravity column)(70〜230メッシュの60Åシリカゲルを約350mL)に溶液を直接充填し、テトラブチルアンモニウム塩の大半を取り除いた。その後、トルエン/EtOHを溶離液とし、中圧フラッシュクロマトグラフィー(Isco CombiFlash GRADUATE)にて固形分を精製し、白色非晶質固体(式量=362.3、469mg、1.29mmol、86%)を得た。FTIR(KBr、cm−1)3394、2931、1699、1601、1578、1546、1489、1226;1H NMR(CD3OD、400MHz)δ8.39(1H、s)、8.30(1H、s)、7.57(1H、m)、7.35−7.26(3H、m)、6.04(1H、d、J=5.9Hz)、4.63(1H、m)、4.33(1H、m)、4.13(1H、m)、3.86(1H、m)、3.75(1H、m);13C NMR(CD3OD、400MHz)δ164.1(J=245.4Hz)、157.9、149.2、148.7、141.5、139.9(J=10.2Hz)、132.1(J=8.7Hz)、125.3、124.8(J=2.3Hz)、117.4(J=21.2Hz)、116.4(J=23.9Hz)、90.4、87.5、76.3、72.0、62.9;C16H15FN4O5[M+1]+としてのMS(ESI)計算値:363.11m/z、実測値:363.26m/z。
【0105】
実施例4
【0106】
【化29】

5−アミノ−4−N−3−フルオロフェニルカルボキサミド−1−β−D−リボフラノシル−1H−イミダゾール(RN−3):
TBS−IA−3(1.41g、2mmol)を丸底フラスコに入れ、無水EtOH(30mL)に溶解させ、攪拌下、沸騰させた。その後、この溶液に5NのNaOH(10mL)を加え、4時間還流させた。フラスコを熱から下ろして室温まで冷やし、6NのHClで中和した(pH=約7)。続いて、その水性混合物をEtOAcで3回抽出した後、Na2SO4で乾燥して、減圧下で濃縮した。その後、固形分をEtOAc中で再結晶させ、淡桃色の結晶固体(式量=352.3、450mg、1.28mmol、64%)を得た。FTIR(KBr、cm−1)3558、3536、3489、3426、3363、3302、3117、2938、2927、1651、1607、1564;1H NMR(DMSO−d6、400MHz)δ9.57(1H、br s)、7.79(1H、m)、7.59(1H、m)、7.43(1H、s)、7.27(1H、m)、6.77(1H、m)、6.23(2H、br s)、5.52(1H、d、J=6.4Hz)、5.44(1H、d、J=6.4Hz)、4.94(1H、t、J=4.9Hz)、4.58(1H、d、J=5.2Hz)、4.30(1H、m)、4.05(1H、m)、3.91(1H、m)、3.59(2H、m);13C NMR(CD3OD、400MHz)δ164.8、164.3(J=240.5Hz)、145.9、141.9(J=11.0Hz)、131.2、131.1(J=10.0Hz)、115.92、113.6、110.5(J=21.7Hz)、107.5(J=26.5Hz)、90.7、87.4、74.0、72.1、62.5;C15H17FN4O5[M+1]+としてのMS(ESI)計算値:353.13m/z、実測値:353.25m/z。
【0107】
実施例5
【0108】
【化30】

(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボン酸メチルエステル:
メチル−1−(β−D−リボフラノシル)−1,2,4−トリアゾール−3−カルボキシレート(5.1345g、19.8mmol)とイミダゾール(10.78g、158.3mmol)とDMAP(50mg)との乾燥DMF(50mL)溶液に、tert−ブチルジメチルシリルクロリド(11.74g、77.9mmol)を加えた。反応混合物を室温で一晩攪拌した後、TLC分析(5%MeOH/CH2Cl2、Rf=0.62)によって1種の生成物における出発材料の総変換率を示した。白色スラリーを、水(100mL)とDCM(100mL)とからなる2層系に注入した。有機層を分離して、水相をDCM(50mLで3回)で繰り返し抽出した。合わせた有機抽出物を、乾燥(無水Na2SO4)し、ろ過して、減圧留去を行い、白色固体を得た。当該白色固体をヘキサンで再結晶させると、白色粉末状の目的生成物(式量:602.00、10.07g、84%)が得られた。1H NMR(200MHz、CDCl3)δ8.57(s、1H)、5.84(d、1H、J1’,2’=4.9Hz、H−1’)、4.45(m、1H、H−2’)、4.22(m、1H、H−3’)、4.17−4.09(m、1H、H−4’)、3.99(s、3H)、3.98−3.90(dd、1H、J5’a,5’b=11.9及びJ5’a,4’=3.7Hz、H−5a)、3.80−3.73(dd、1H、J5’b,5’a=11.4及びJ5’b,4’=2.5Hz、H−5b)、0.94(s、9H、tBu)、0.91(s、9H、tBu)、0.85(s、9H、tBu)、0.13(s、6H、2×CH3)、0.08(s、6H、2×CH3)、0.03(s、3H、CH3)、及び、−0.06(s、3H、CH3)。
【0109】
実施例7
【0110】
【化31】

(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8]:
(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボン酸メチルエステル(4.2140g、7.0mmol)の乾燥CH2Cl2(15mL)溶液(−78℃)に、DIBAL−H(17.5mL、1MのCH2Cl2中溶液)を、内部温度を−65℃未満に保つようにしてゆっくり加えた。反応系を−78℃で4時間攪拌させた後、低温(−78℃)のMeOH(7mL)を、内部温度を−65℃未満に保ちながらゆっくり加えて、反応をクエンチした。次に、得られた白色乳濁液を2時間にわたり旋回振とうさせて室温に戻した。続いて、CH2Cl2(25mL)を加えて反応混合物を希釈し、0.5MのNaOH(25mL)で洗浄した。更に、水性混合物をCH2Cl2(3回)で抽出した。合わせた有機溶液をブラインで洗浄し、無水Na2SO4で乾燥し、減圧下で濃縮して、浅黄色の油状液体の粗生成物を得た。続いて、当該粗生成物をシリカゲルカラム(5%MeOH/CH2Cl2)で精製し、無色油状液体の精製物を得た。その精製物を減圧下で5日間乾燥させると、白色固体(式量:571.97、3.1668g、78%)が得られた。1H NMR(200MHz、CDCl3)δ10.01(s、1H)、8.57(s、1H)、5.82(d、1H、J1’,2’=4.2Hz、H−1’)、4.48(m、1H、H−2’)、4.25(m、1H、H−3’)、4.18−4.09(m、1H、H−4’)、3.95−3.88(dd、1H、J5’a,5’b=11.9及びJ5’a,4’=3.7Hz、H−5a)、3.79−3.72(dd、1H、J5’b,5’a=11.5及びJ5’b,4’=2.6Hz、H−5b)、0.92(s、9H、tBu)、0.91(s、9H、tBu)、0.84(s、9H、tBu)、0.10−−0.09(mult.S、18H)。
【0111】
実施例8
【0112】
【化32】

3−エチニル−1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル)−1,2,4−トリアゾール[TBS−TA−18]:
1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8](572mg、1mmol)とジメチル−1−ジアゾ−2−オキソプロピルホスホネート(249mg、1.3mmol)との無水メタノール(5ml)溶液に攪拌下、無水K2CO3(208mg、2.1mmol)を加えた。得られた浅黄色の溶液を24時間攪拌した。混合物を水(10ml)でクエンチし、Et2O(20mlで4回)で抽出した。合わせた抽出物を、NaHCO3(水溶液)(飽和、10ml)及びブライン(飽和、10ml)で洗浄し、Na2SO4で乾燥した。減圧下で溶媒を取り除いて得られた粗生成物をフラッシュクロマトグラフィー(5%−20%EtOAC/ヘキサン)により精製して、白色固体を得た。当該白色固体をヘキサンで再結晶させると、白色粉末状の目的生成物(式量:567.98、435mg、76%)が得られた。1H NMR(200MHz、CDCl3)δ8.72(s、1H)、5.69(d、1H、J1’,2’=4.03Hz、H−1’)、4.45(m、1H、H−2’)、4.23(m、1H、H−3’)、4.11(m、1H、H−4’)、3.95−3.88(dd、1H、J5’a,5’b=11.5及びJ5’a,4’=4.03Hz、H−5a)、3.79−3.72(dd、1H、J5’b,5’a=11.35及びJ5’b,4’=2.9Hz、H−5b)、3.06(s、1H)、0.95−0.78(mult.s、27H)、0.14−−0.09(mult.s、18H)。C27H53N3O4Si3[M+1]+としてのLCMS(APCI)計算値:568.34m/z、実測値:568.28m/z。HPLC 100%CH3CN、室温6.62分。
【0113】
実施例9
【0114】
【化33】

3−エチニル−1−(β−D−リボフラノシル)−[1,2,4]トリアゾール[TA−18]:
3−エチニル−1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル)−1,2,4−トリアゾール[TBS−TA−18](125mg、0.22mmol)の無水THF(3ml)溶液に攪拌下、1MのTBAFのTHF溶液(0.8mL、0.8mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(50%−アセトン/CH2Cl2)で生成物を単離させ、白色固体を得た。当該白色固体を(5%MeOH/CH2Cl2)で再結晶させると、白色結晶粉末状の目的生成物(式量:225.20、41mg、82%)が得られた。1H NMR(200MHz、CD3OD)δ8.72(s、1H)、5.84(d、1H、J1’,2’=3.5Hz、H−1’)、4.43(m、1H、H−2’)、4.29(m、1H、H−3’)、4.09(m、1H、H−4’)、3.83−3.79(dd、1H、J5’a,5’b=12.3及びJ5’a,4’=3.3Hz、H−5a)、3.73(s、1H)、3.70−3.65(dd、1H、J5’b,5’a=12.9及びJ5‘b,4’=4.7Hz、H−5b)。13C NMR(CD3OD、400MHz)δ148.4、145.6、93.9、86.9、80.3、75.0、76.5、71.6、62.8。C9H11N3O4[M+1]+としてのLCMS(ESI)計算値:226.08m/z、実測値:225.23m/z。
【0115】
実施例10
【0116】
【化34】

1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノール[TBS−TA−12]:
アルゴン(1.1420g、2mmol)下の(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8]のTHF(50mL)溶液(0℃)に、CH3MgCl(1.35mL、3MのTHF中溶液)を滴下した。反応混合物を攪拌し、TLC(5%MeOH/CH2Cl2、Rf=0.3)により反応の進行度を確認した。3時間後、出発材料が完全に消失したのを確認した。続いて、反応混合物を飽和NH4Cl(水溶液)(20mL)でクエンチし、ジエチルエーテル(25mLで3回)で抽出した。合わせた有機抽出物を乾燥(無水Na2SO4)し、ろ過し、減圧留去を行って、無色油状液体を得た。これをシリカゲルカラム(5%MeOH/CH2Cl2)で精製すると、無色油状液体の生成物(式量:588.02、1.0216g、87%)が得られた。
【0117】
実施例11
【0118】
【化35】

1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノール[TBS−TA−12](392mg、0.67mmol)の無水THF(3ml)溶液に攪拌下、1MのTBAFのTHF溶液(0.8mL、0.8mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(50%−アセトン/CH2Cl2)により生成物を単離させて、無色油状液体(式量:245.10、130mg、79%)を得た。1H NMR(200MHz、CD3OD)δ8.63(s、1H)、5.82(d、1H、J1’,2’=3.91Hz、H−1’)、4.89(q、1H、J’=6.64Hz)、4.45(m、1H、H−2’)、4.32(m、1H、H−3’)、4.08(m、1H、H−4’)、 3.83−3.79(dd、1H、J5’a,5’b=12.1及びJ5’a,4’=3.1Hz、H−5a)、3.79−3.72(dd、1H、J5’b,5’a=12.30及びJ5’b,4’=4.5Hz、H−5b)、1.52(d、3H、J’=6.64Hz)。13C NMR(CD3OD、400MHz)δ168.4、145.6、93.4、86.9、76.4、71.8、64.8、63.1、22.5。C9H15N3O5[M+1]+としてのLCMS(ESI)計算値:246.11m/z、実測値:246.20m/z。
【0119】
実施例12
【0120】
【化36】

1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノン[TA−13]:
アルゴン下の1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノール[TBS−TA−12](1.764g、3mmol)と粉末モレキュラーシーブ(0.3g)とのCH2Cl2(15mL)懸濁液に、PCC(0.970g、4.5mmol)を加え、TLC(5%MeOH/CH2Cl2、Rf=0.7)により反応の進行度を確認しながら室温下で攪拌した。4時間後、出発材料が完全に消失したのを確認した。その後、フルオロシル(fluorosil)を通して反応混合物をろ過し、減圧下で濃縮した。次に、得られた残留物を水とジエチルエーテルとの間で分配させ、ジエチルエーテル(25mLで3回)で抽出した。合わせた有機抽出物を乾燥(無水Na2SO4)し、ろ過し、減圧留去を行って、フラッシュクロマトグラフィー(1%MeOH/CH2Cl2)により生成物を白色固体として単離させた(式量:586.00、1.102g、62%)。続いて、この生成物(207mg、0.35mmol)を無水THF(3ml)に溶解させ、1MのTBAFのTHF溶液(1mL、1mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(50%−アセトン/CH2Cl2)により生成物を単離させて、白色固体の目的生成物(式量:243.22、65mg、76%)を得た。1H NMR(200MHz、CD3OD)δ8.84(s、1H)、5.94(d、1H、J1’,2’=3.30Hz、H−1’)、4.49(m、1H、H−2’)、4.35(m、1H、H−3’)、4.13(m、1H、H−4’)、3.88−3.81(dd、1H、J5’a,5’b=12.1及びJ5’a,4’=3.3Hz、H−5a)、3.74−3.66(dd、1H、J5’b,5’a=12.10及びJ5’b,4’=4.4Hz、H−5b)、2.61(s、3H)。C9H13N3O5[M+1]+としてのLCMS(ESI)計算値:244.09m/z、実測値:244.25m/z。
【0121】
実施例13
【0122】
【化37】

1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノール[TA−14]:
アルゴン(320mg、0.56mmol)下の(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8]のTHF(2mL)溶液(0℃)に、PhMgCl(0.56mL、2MのTHF中溶液)を滴下した。反応混合物を攪拌し、TLC(5%MeOH/CH2Cl2、Rf=0.33)により反応の進行度を確認した。2時間後、出発材料が完全に消失したのを確認した。続いて、反応混合物を飽和NH4Cl(水溶液)(20mL)でクエンチし、ジエチルエーテル(25mLで3回)で抽出した。合わせた有機抽出物を、乾燥(無水Na2SO4)し、ろ過し、減圧留去を行って、無色油状液体の粗生成物を得た。当該粗生成物をフラッシュクロマトグラフィー(5%MeOH/CH2Cl2)で精製して、無色油状液体の1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノール[TBS−TA−14](式量:650.08、269mg、74%)を得た。
【0123】
TBS−TA−14(195mg、0.3mmol)の無水THF(3ml)溶液に攪拌下、1MのTBAFのTHF溶液(1mL、1mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(50%−アセトン/CH2Cl2)により生成物を単離させて、無色油状液体の生成物(式量:307.30、68mg、74%)を得た。1H NMR(400MHz、CD3OD、ジアステレオマーの複合混合物)δ8.62(s、1H)、7.49−7.23(m、5H)、5.82(d、1H、J1’,2’=3.71Hz、H−1’)、4.45(m、1H)、4.31(m、1H)、4.07(m、1H)、3.82−3.59(m、2H)、2.31(s、1H)。C14H17N3O5[M+1]+としてのLCMS(APCI)計算値:308.12m/z、実測値:308.24m/z。
【0124】
実施例14
【0125】
【化38】

1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノン[TA−15]:
アルゴン下の1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノール[TBS−TA−14][TBS−14](0.749g、1.15mmol)と粉末モレキュラーシーブ(0.2g)とのCH2Cl2(5mL)懸濁液に、PCC(0.373g、1.73mmol)を加え、TLC(5%MeOH/CH2Cl2、Rf=0.75)により反応の進行度を確認しながら、室温下で攪拌した。4時間後、出発材料が完全に消失したのを確認した。その後、フルオロシルを通して反応混合物をろ過し、減圧下で濃縮した。続いて、得られた残留物を水とジエチルエーテルとの間で分配させ、ジエチルエーテル(25mLで3回)で抽出した。合わせた有機抽出物を、乾燥(無水Na2SO4)し、ろ過し、減圧留去を行って、白色固体の粗生成物(式量:305.29、0.5021g、67%)を得た。その後、この生成物(0.198g、0.3mmol)を無水THF(3ml)に溶解させ、1MのTBAFのTHF溶液(1mL、1mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(アセトン)により生成物を単離させて、白色固体の目的生成物(式量:305.29、90mg、98%)を得た。1H NMR(200MHz、D2O)δ8.82(s、1H)、8.10(m、2H)、7.72(m、1H)、7.56(m、1H)、6.08(d、1H、J1’,2’=3.30Hz、H−1’)、4.62(m、1H、H−2’)、4.44(m、1H、H−3’)、4.19(m、1H、H−4’)、3.88−3.80(dd、1H、J5’a,5’b=12.82及びJ5’a,4’=3.3Hz、H−5a)、3.74−3.65(dd、1H、J5’b,5’a=12.82及びJ5’b,4’=5.1Hz、H−5b)。C9H13N3O5[M+1]+としてのLCMS(ESI)計算値:306.11m/z、実測値:306.29m/z。
【0126】
実施例15
【0127】
【化39】

3−(1,1−ジフルオロ−エチル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール[TA−17]:
1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノン[TBS−TA−13](87mg、0.14mmol)のCH2Cl2(5mL)溶液にDAST(20μL、0.16mmol)を加え、TLC(5%MeOH/CH2Cl2、Rf=0.7)により反応の進行度を確認しながら、還流を行った。12時間後、H2O(25mL)を滴下して反応混合物をクエンチし、CH2Cl2(25mL)を加え、有機層を分離して、飽和NaHCO3及びH2O(25mLで3回)で洗浄した。続いて、有機層を乾燥(無水Na2SO4)し、ろ過し、減圧留去を行って、フラッシュクロマトグラフィー(5%MeOH/CH2Cl2)により白色固体の生成物TBS−TA−17を単離させた(式量:608、36.4mg、42%)。
【0128】
TBS−TA−17(36.4mg、0.06mmol)の無水THF(3mL)溶液に、1MのTBAFのTHF溶液(0.2mL、1mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2mL)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(50%−アセトン/CH2Cl2)により生成物を単離させて、白色固体の目的生成物(式量:265.21、12mg、75%)を得た。1H NMR(400MHz、CD3OD)δ8.79(s、1H)、5.88(d、1H、J1’,2’=3.52Hz、H−1’)、4.46(m、1H、H−2’)、4.32(m、1H、H−3’)、4.10(m、1H、H−4’)、3.88−3.81(dd、1H、J5’a,5’b=12.1及びJ5’a,4’=3.5Hz、H−5a)、3.74−3.66(dd、1H、J5’b,5’a=12.1及びJ5’b,4’=4.7Hz、H−5b)、2.61(t、3H、J=18.5Hz)。
【0129】
実施例16
【0130】
【化40】

1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−2,2,2−トリフルオロエタノール[TA−19]:
(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8](100mg、0.17mmol)の乾燥THF(2mL)溶液(0℃)に、トリメチル(トリフルオロメチル)シラン(33μL、0.21mmol)及び触媒KOtBu(1mg)を加えた。アルゴン雰囲気下、この温度で4.5時間、反応系を攪拌した。反応混合物に対し室温で溶媒留去を行い、油状残留物をエーテル(4mL)に溶解させ、水(2mL)で洗浄し、無水Na2SO4で乾燥して、溶媒を留去した。粗生成物をシリカゲルカラム(移動相:ヘキサン中酢酸エチル勾配10%−20%)で精製し、無色油状液体の精製物TBS−TA−19(94mg、86%)を得た。FT−IR(NaCl、cm−1)2955、2931、1473、1258、1172、1136、837、779。1H NMR(200MHz、CDCl3)δ8.35(s、1H)、5.75(d、1H、J=4.9Hz)、5.16(q、1H、J=6.6Hz)、4.49−4.58(m、1H)、4.21−4.26(m、1H)、4.06−4.13(m、1H)、3.82−3.91(m、1H)、3.67−3.76(m、1H)、0.92(s、18H)、0.83(s、9H)、0.14(s、3H)、0.13(s、6H)、0.09(s、6H)、0.01(s、3H)。13C NMR(100MHz、CDCl3)δ158.69、144.34、123.48(q、J=282Hz)、91.91、86.17、76.10、71.90、67.63(q、J=34Hz)、62.47、25.97(3C)、25.78(3C)、25.61(3C)、18.43、18.01、17.89、−4.51、−4.69(2C)、−5.40、−5.51(2C)。
【0131】
TBS−TA−19(434mg、0.68mmol)の無水THF(3mL)溶液に攪拌下、1MのTBAFのTHF溶液(1.4mL、1.4mmol)を加えた。混合物を室温で2.5時間攪拌し、MeOH(1ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(30%アセトン70%ヘキサン)により生成物を単離させ、油状液体の目的生成物(95mg、47%)を得た。FT−IR(NaCl、cm−1)3350、1660、1524、1270、1183、1134、867。1H NMR(200MHz、CDCl3)δ8.66(s、1H)、5.86(d、1H、J=3.3Hz)、5.24(q、1H、J=7.0Hz)、4.50(m、1H)、4.37(m、1H)、4.07(m、1H)、3.77(dd、1H、J1=11.9Hz、J1=3.3Hz)、3.72(dd、1H、J1=11.9Hz、J1=3.3Hz)。13C NMR(100MHz、CDCl3)δ160.11、145.55、125.10(q、J=282Hz)、93.29、86.94、76.41、71.59、68.08(q、J=33Hz)、62.75。
【0132】
実施例17
【0133】
【化41】

3−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオンアミド[TA−20]:
金属亜鉛をEtOH、アセトン及びエーテルで洗浄し、乾燥させた。続いて、(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8](572mg、1.0mmol)とブロモ酢酸エチル(0.35ml、3.1mmol)とのTHF(10ml)溶液に、Zn(130mg、2.1mmol)を加えた。反応混合物を3.5時間還流させた。その後、溶液をCH2Cl2(25ml)で希釈し、水で3回洗浄し、Na2SO4で乾燥して、減圧下で濃縮した。得られた油状液体をシリカゲルカラム(10−20%EtOAc/ヘキサン)で精製し、精製物3−(2’,3’,5’−O−トリス(tert−ブチルジメチルシリル)−β−D−リボフラノシル)−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオン酸エチルエステル(式量:660.08、455mg、69%)を得た。この材料は次のステップで使用した。
【0134】
耐圧管中で、MeOH(15ml)を気体のNH3で飽和させ、この溶液に3−(2’,3’,5’−O−トリス(tert−ブチルジメチルシリル)−β−D−リボフラノシル)−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオン酸エチルエステル(306mg、0.46mmol)を加えた。反応系を60℃で24時間加熱した。得られた溶液を減圧下で濃縮した。フラッシュクロマトグラフィー(20−40%EtOAc/ヘキサン)により粗生成物を精製し、3−(2’,3’,5’−O−トリス(tert−ブチルジメチルシリル)−β−D−リボフラノシル)−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオンアミド(式量:631.04、240mg、88%)を得た。この材料は、次のステップで使用した。
【0135】
3−(2’,3’,5’−O−トリス(tert−ブチルジメチルシリル)−β−D−リボフラノシル)−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオンアミド(150mg、0.24mmol)を、1Mのフッ化テトラブチルアンモニウム溶液(0.8ml、0.8mmol)と乾燥THF(4ml)中で合わせて、室温で4時間攪拌した。5mlのMeOHで反応をクエンチして、減圧下で濃縮した。フラッシュクロマトグラフィー(50%EtOH/トルエン)により粗生成物を精製した(式量:288.26、24mg、35%)。1H NMR(200MHz、CD3OD)δ8.64(s、1H)、δ5.83(d、1H、J=3.7、H−1’)、δ5.16(m、1H)、δ4.45、1H、H−2’)、δ4.33(m、1H、H−3’)、δ4.09(m、1H、H−4’)、δ3.77−3.84(dd、1H、J5’a,4’=2.9、J5’a,5’b=12.1、H−5’a)、δ3.63−3.71(dd、1H、J5’b,4’=4.8、J5’b,5’a=12.8、H−5b’)δ2.75−2.81(m、2H)。
【0136】
剤形
本開示の化合物は、医薬品と共に使用することが可能な任意の従来手段によって投与することができ、それぞれ単一の治療剤としてもよく、又は他の治療剤と組み合わせてもよい。本開示の化合物は単独で投与してもよいが、一般的には医薬基剤と共に投与される。当該医薬基剤は、選択される投与経路と医薬分野の標準的な慣行とに基づいて選択される。上記化合物はまた、インターフェロン(IFN)、インターフェロンα−2a、インターフェロンα−2b、コンセンサス・インターフェロン(CIFN)、リバビリン、アマンタジン、リマンタジン、インターロイキン−12、ウルソデオキシコール酸(UDCA)及びグリシリジン等の他の治療剤と共に投与してもよい。
【0137】
本明細書で説明する薬学的に許容される基剤、例えば、ビヒクル、アジュバント、賦形剤又は希釈剤などは、当業者に周知である。一般的に、薬学的に許容される基剤は活性化合物に対して化学的に不活性であり、使用条件下において有害な副作用又は毒性を持つことはない。薬学的に許容される基剤としては、ポリマー及びポリマーマトリックスも含まれる。
【0138】
本開示の化合物は、医薬品と共に使用することが可能な任意の従来手段によって投与することができ、それぞれ単一の治療剤としてもよく、又は他の治療剤と組み合わせてもよい。
【0139】
投与量は当然ながら、薬剤の種類及びその投与の形態や経路といった薬力学的特徴;受容者の年齢、健康状態及び体重;症状の性質及び程度;併用療法の種類;治療頻度;並びに、所望の効果などの既知の要因に応じて異なるであろう。有効成分の1日当たりの投与量は、体重1キログラム(kg)当たり約0.001〜1000ミリグラム(mg)であると予想され、好ましくは0.1〜約30mg/kgである。
【0140】
投与形態(投与に適した組成物)には、1単位当たり約1mg〜約500mgの有効成分が含まれている。これらの医薬組成物には、通常、当該組成物の全重量に基づいて約0.5〜95重量%の量の有効成分が含まれるであろう。
【0141】
有効成分は、カプセル、錠剤及び散剤などの固形剤として経口投与されてもよく、あるいは、エリキシル剤、シロップ剤及び懸濁剤などの液剤として経口投与されてもよい。また、無菌液の投与形態で非経口投与してもよい。有効成分は、鼻腔内に投与してもよく(点鼻薬)、あるいは、薬剤パウダーミストの吸入によって投与してもよい。パッチ型や軟膏による経皮投与などの他の投与形態も可能な場合がある。
【0142】
経口投与に適した剤形は、(a)水、塩水、又はオレンジジュース等の希釈液に有効量の化合物を溶解させた液状溶液、(b)所望量の有効成分を固形物又は顆粒として含有しているカプセル、サシェ剤、錠剤、薬用ドロップ(lozenges)及びトローチ剤、(c)散剤、(d)適当な液体との懸濁剤、及び、(e)好適な乳剤から成っていてもよい。液剤の場合、水、並びに、エタノール、ベンジルアルコール、プロピレングリコール、グリセリン及びポリエチレンアルコール等のアルコール類などといった希釈剤が含まれてもよく、薬学的に許容される界面活性剤、懸濁化剤又は乳化剤が添加されていても、いなくてもよい。カプセル形態の場合、例えば、界面活性剤、滑沢剤、並びに、ラクトース、スクロース、リン酸カルシウム及びコーンスターチ等の不活性充填剤を含有している通常のハードシェルゼラチン型又はソフトシェルゼラチン型であってもよい。錠剤の場合、以下のものを1つ以上含んでいてもよい:ラクトース、スクロース、マンニトール、コーンスターチ、ジャガイモ澱粉、アルギン酸、微結晶セルロース、アラビアゴム、ゼラチン、グアーガム、コロイド二酸化ケイ素、クロスカルメロースナトリウム、タルク、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸亜鉛、ステアリン酸、及びその他の賦形剤、着色剤、希釈剤、緩衝剤、崩壊剤、湿潤剤、保存料、フレーバー付与剤、及び、薬理学的に適合した基剤。薬用ドロップ形態の場合、一般的にはスクロース、アラビアゴム又はトラガカントゴム等であるフレーバー中に有効成分を含んでいてもよく、香錠(pastilles)の場合も同様に、ゼラチン及びグリセリン、又は、スクロース及びアラビアゴム(acadia)、乳液、並びに、ゲル等の不活性な主材料中に有効成分を含んでいてもよく、この主材料中に有効成分に加えて当該技術分野で公知であるような基剤を含有していてもよい。
【0143】
本開示の化合物は、単独で、又は、他の好適な成分と組み合わせて、吸入投与用のエアロゾル剤形に調剤されてもよい。これらのエアロゾル剤形は、ジクロロジフルオロメタン、プロパン及び窒素などの許容される高圧噴射剤としてもよい。また、これらのエアロゾル剤形は、ネブライザー又はアトマイザー等といった非加圧式調剤用の医薬品に調剤されてもよい。
【0144】
非経口投与に適した剤形としては、酸化防止剤、緩衝剤、静菌剤、及び、製剤を対象受容者の血液と等張にする溶質を含む、水性及び非水性の等張無菌注射液;並びに、懸濁化剤、溶解剤、増粘剤、安定剤、及び保存料を含む、水性及び非水性無菌懸濁液が挙げられる。化合物は、医薬基剤中の生理学的に許容される希釈剤に含ませて投与してもよい。この生理学的に許容される希釈剤の例としては、無菌の液体又は液体混合物が挙げられ、水;塩水;デキストロース水溶液及び関連する糖液;エタノール、イソプロパノール又はヘキサデシルアルコール等のアルコール;プロピレングリコール、又は、例えばポリ(エチレングリコール)400等のポリエチレングリコールなどといったグリコール類;2,2−ジメチル−1,3−ジオキソラン−4−メタノール等のグリセロールケタル類;エーテル;オイル;脂肪酸;脂肪酸エステル又はグリセリド;あるいは、アセチル化脂肪酸グリセリドが含まれる。これらには、薬学的に許容される界面活性剤(石鹸又は洗浄剤など)、懸濁化剤(ペクチン、カルボマー、メチルセルロース、ヒドロキシプロピルメチルセルロース又はカルボキシメチルセルロース等)、又は乳化剤、並びに、他の医薬アジュバントが添加されていても、いなくてもよい。
【0145】
非経口剤形で使用されるオイルとしては、石油、動物油、植物油、又は合成油が挙げられる。オイルの具体例としては、ピーナッツ油、大豆油、ゴマ油、綿実油、コーン油、オリーブ油、ペトロラタム、及び鉱物油が挙げられる。非経口剤形に使用される好適な脂肪酸としては、オレイン酸、ステアリン酸、及びイソステアリン酸が挙げられる。好適な脂肪酸エステルの例としては、オレイン酸エチル及びミリスチン酸イソプロピルが挙げられる。非経口剤形に使用される好適な石鹸としては、脂肪酸アルカリ金属塩、脂肪酸アンモニウム塩、及び脂肪酸トリエタノールアミン塩が挙げられる。好適な洗浄剤としては、(a)例えばハロゲン化ジメチルジアルキルアンモニウム及びハロゲン化アルキルピリジニウム等のカチオン性洗浄剤、(b)例えばアルキル、アリール及びオレフィンスルホネート、アルキル、オレフィン、エーテル及びモノグリセリドスルフェート、並びに、スルホサクシネート等のアニオン性洗浄剤、(c)例えば脂肪族アミンオキシド、脂肪酸アルカノールアミド、及びポリオキシエチレンポリプロピレン共重合体などの非イオン性洗浄剤、(d)例えばアルキルβ−アミノプロピオネート、及び2−アルキルイミダゾリン第4級アンモニウム塩などの両性洗浄剤、(e)これらの混合物が挙げられる。
【0146】
非経口剤形は、一般的に約0.5〜約25重量%の有効成分を溶液中に含有している。このような剤形には、適当な保存料及び緩衝剤を使用してもよい。注射箇所への刺激を最小限に抑えるか、又は除くために、このような組成物には、親水親油バランス(HLB)が約12〜約17である非イオン性界面活性剤を1つ以上含有させてもよい。このような剤形における界面活性剤の量は、約5〜約15重量%である。好適な界面活性剤としては、モノオレイン酸ソルビタン、及び、疎水性塩基を用いた、その高分子量エチレンオキシド付加物(プロピレンオキシドとプロピレングリコールとの縮合により形成される)などのポリエチレンソルビタン脂肪酸エステルが挙げられる。
【0147】
薬学的に許容される賦形剤もまた、当業者には周知である。賦形剤は、化合物の種類や組成物の投与に使用される具体的な方法を幾分考慮して選択されるであろう。従って、本開示の医薬組成物においては、好適な剤形が多数考えられる。以下の方法及び賦形剤は単なる例示に過ぎず、これらに限定されない。薬学的に許容される賦形剤としては、有効成分の作用を阻害せず、不都合な副作用を引き起こさないものが好ましい。好適な基剤及び賦形剤としては、水、アルコール及びプロピレングリコール等の溶媒、固体の吸収剤及び希釈剤、界面活性剤、懸濁化剤、錠剤結合剤(tableting binders)、滑沢剤、フレーバー、並びに、着色剤が挙げられる。
【0148】
剤形は、単回投与用又は反復投与用として封をした容器(アンプル及びバイアル等)に封入してもよい。また、使用直前に水などの無菌液体賦形剤を添加するだけで注射可能となるフリーズドライ(凍結乾燥)状態で保存してもよい。無菌粉末、顆粒及び錠剤から、用時調製注射液及び懸濁液を調製してもよい。注射用組成物には有効な医薬基剤が必要であることは、当業者に周知である。Pharmaceutics and Pharmacy Practice,J.B.Lippincott Co.,Philadelphia,PA,Banker and Chalmers,Eds.,238−250(1982)、及び、ASHP Handbook on Injectable Drugs,Toissel,4th ed.,622−630(1986)を参照のこと。
【0149】
局所投与に適した剤形としては、一般的にはスクロース及びアラビアゴム又はトラガカントゴムといったフレーバー中に有効成分を含んでいる薬用ドロップ;ゼラチン及びグリセリン、又は、スクロース及びアラビアゴム等の不活性な主材料中に有効成分を含んでいる香錠;並びに、好適な液体基剤中に有効成分を含んでいる口内洗浄剤;さらに、有効成分に加えて当該技術分野で公知であるような基剤を含有しているクリーム、乳剤及びゲル剤が挙げられる。
【0150】
さらに、直腸投与に適した剤形を、乳化性の主材料又は水溶性の主材料などといった種々の主材料と混合することで坐薬として調製してもよい。膣投与に適した剤形を、有効成分に加えて当業者に公知の適当な基剤を含有させた膣坐薬、タンポン、クリーム、ゲル、ペースト、発泡体、又は、スプレー式剤形として調製してもよい。
【0151】
好適な医薬基剤については、当該分野の標準的な参考文献であるRemington’s Pharmaceutical Sciences,Mack Publishing Companyに記載されている。
【0152】
本開示において、動物、とりわけヒトへの投与量は、適度な期間にわたって体内で治療反応を引き起こすのに十分な量であるのが望ましい。投与量が、動物の体調や体重、さらには、治療される症状の重症度や段階などの種々の要因によって決定されることは当業者の解するところであろう。
【0153】
好適な投与量は、患者体内の活性物質の濃度に関して所望の反応を起こすとして知られている濃度をもたらす量である。扱いにくい副作用を起こすことなく、治療される症状を最大限抑制することとなる投与量が好ましい。
【0154】
投与量は、投与の経路、タイミング及び頻度、さらに、化合物の投与に伴って生じる何らかの不都合な副作用の有無、性質及び程度や所望の生理学的効果によっても決定される。
【0155】
本開示に係る化合物を投与するのに有用な薬学的投与形態は、以下のように説明される。
【0156】
ハードシェルカプセル
標準的な2ピース(two−piece)ハードゼラチンカプセル毎に、粉末状の有効成分100mg、ラクトース150mg、セルロース50mg、及び、ステアリン酸マグネシウム6mgを充填して、多数のカプセル単位を調製する。
【0157】
ソフトゼラチンカプセル
大豆油、綿実油又はオリーブ油等の消化可能なオイル中に有効成分を含ませて混合物を調製し、それを容積移送式ポンプで、溶かしたゼラチンに注入し、有効成分100mgを含有するソフトゼラチンカプセルを形成する。カプセルを洗浄し、乾燥させる。ポリエチレングリコールとグリセリンとソルビトールとの混合物に有効成分を溶解させ、水混和性の混合薬を調製してもよい。
【0158】
錠剤
有効成分100mg、コロイド二酸化ケイ素0.2mg、ステアリン酸マグネシウム5mg、微結晶セルロース275mg、デンプン11mg、及び、ラクトース98.8mgを含む投与単位となるように、従来の手順で多数の錠剤を調製する。嗜好性を増加させ、外観及び安定性を向上させるため、又は、吸収を遅らせるために適当な水性及び非水性コーティングを施してもよい。
【0159】
速放性(immediate release)錠剤/カプセル
従来のプロセスや新規のプロセスで調製される、経口投与用の固体投与形態である。これらの投与単位は、すぐに溶解して薬物を送達するので、水無しで経口的に摂取される。有効成分を、糖、ゼラチン、ペクチン及び甘味料などの成分を含有する液体に混合する。これらの液体を、フリーズドライ技術や固体状態で抽出する技術によって固体の錠剤又はカプレットへと固体化する。薬剤化合物を、粘弾性及び熱弾性の糖やポリマーあるいは起泡性成分と共に圧縮して、水無しで即時放出されるような多孔質マトリックスを調製してもよい。
【0160】
また、本開示の化合物は、点鼻薬、又は、定量吸入器や鼻腔用若しくは口腔用吸入器の形態で投与してもよい。薬剤は、細かい霧状の点鼻液、あるいはエアロゾル状の粉末によって送達してもよい。
【0161】
ここまで、本開示について例示し、説明した。また、本明細書では好ましい実施形態しか開示していないが、上述の通り、上記教示、及び/又は、関連技術の技術若しくは知識に相応する範囲において、様々な他の組み合わせ例、変形例及び環境のもとで本開示を用いることができ、本明細書に示した概念の範囲内であれば変更又は改変も可能であると解されるべきである。
【0162】
本明細書中、「含む(comprising)」という用語(及びその文法上の活用形)は、「有する(having)」又は「包含する(including)」という包括的な意味で用いられ、「のみから成る(consisting only of)」という限定的な意味では用いられない。本明細書中、「1つの(a)」(不定冠詞)及び「その(the)」(定冠詞)という用語は、単数と共に複数をも包含すると解される。
【0163】
さらに、上記実施形態は、実施するために現段階で分かっている最良の形態を説明することを意図したものであり、このような実施形態として、又は、別の実施形態として、さらには、具体的に適用若しくは使用するにあたって必要とされる各種の改変を施して、当業者が本開示を利用できるよう意図したものである。従って、本明細書に開示された形態に限定する意図はない。また、添付した特許請求の範囲は、代替の実施形態をも含むと解されるものである。
【0164】
本明細書に引用した全ての刊行物、特許文献及び特許出願文献は、各刊行物、特許文献又は特許出願文献をそれぞれ具体的に且つ個別に提示し、引用して援用するように、本明細書に引用され、任意のあらゆる目的に援用される。矛盾が生じる場合、本明細書が優先される。
【技術分野】
【0001】
本開示は、アゾール、とりわけ、ピラゾールやイミダゾール等のジアジン化合物、トリアジン化合物、及びプリン化合物に関する。これらの化合物は、以下に限定はされないが、インフルエンザ、ハンターンウイルス(HTNV)、クリミア・コンゴ出血熱ウイルス(CCHF)、リフトバレー熱ウイルス(RVFV)、B型肝炎、C型肝炎、ポリオ、コクサッキーA及びB、ライノ、エコー、オルソポックスウイルス(痘瘡)、HIV、エボラ及び西ナイルウイルスの各ウイルスポリメラーゼ等のウイルスRNA/DNAポリメラーゼ阻害剤として有用である。なかでも、インフルエンザ、並びに、ハンターンウイルス、クリミア・コンゴ出血熱ウイルス及びリフトバレー熱ウイルス等のブニヤウイルス科ウイルスのウイルスRNA/DNAポリメラーゼ阻害剤として有用である。
【0002】
本開示は、上記化合物を含む医薬組成物にも関する。本開示はまた、ウイルスRNA/DNAポリメラーゼを阻害する上で上記化合物を使用する方法、並びに、各種RNA/DNAウイルス及び各種ガンに起因する疾患の患者を治療する方法に関する。
【0003】
本開示はまた、本開示の化合物を調製する方法にも関する。
【背景技術】
【0004】
世界的に見て、ウイルス性疾患は死亡や経済的損失の主要な原因の一つである。各種ウイルス性疾患の中でも、インフルエンザ、HIV、HBV及びHCV感染はより深刻なものであり、多数の死者を出している。HIVに対する薬は幾つか存在し、HBVに対する薬もほんのわずか存在しているが、HCVに有効な薬は存在しない。C型肝炎はウイルス性の肝臓疾患であり、C型肝炎ウイルス(HCV)の感染により発症する。世界の慢性HCV感染患者数は約1億7000万人であり、そのうちの約270万人がアメリカに在住している。HCVは肝硬変の主な原因であり、肝細胞癌の一般的な原因でもある。また、HCVは、アメリカで行われる肝臓移植の主な理由にもなっている。HCVの治療法として認可されているのは、今のところ、αインターフェロン単独療法、及びαインターフェロンとリバビリンとの併用療法だけである。
【0005】
RNA/DNAウイルスポリメラーゼ阻害剤の開発が望まれている。
【発明の概要】
【課題を解決するための手段】
【0006】
本開示は特に、下記式で表される化合物:
【0007】
【化1】

[式中、A=C又はNであり、
B=C又はNであり、
X=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
Z=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br、I等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
E=(CH2)nONHR1であって、nは0〜6、より典型的には0〜3の整数であり、R1=アリール又はヘテロシクロであり、
W、Y、Rは、それぞれ独立して、H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;O、OH、Oアルキル、Oアリール、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)からなる群より選択されるが、但し、W、Y及びRのうち少なくとも1つはH及びNH2以外のものであって、W及びYは共に結びついて=Oとなっていてもよく、
Dはそれぞれ独立して、OH、Oアルキル、Oアリール、Fl及びHである]、
薬学的に許容されるその塩、そのプロドラッグ、及び、その混合物に関する。
【0008】
本開示の別の態様は、上記化合物を少なくとも1つ含有する医薬組成物に関する。
【0009】
本開示のさらなる態様は、上記化合物の少なくとも1つを、RNAウイルスポリメラーゼを阻害するのに有効な量で患者に投与することにより、当該患者においてRNAウイルスポリメラーゼを阻害する方法に関する。
【0010】
本開示の更に別の態様は、RNAウイルス感染患者を治療する方法であって、上記化合物の少なくとも1つを有効量で当該患者に投与することを含む方法に関する。
【0011】
以下の詳細な説明により、本開示の更に別の目的及び利点が当業者にとって容易に明らかとなるであろう。詳細な説明においては、単に考えられる最良の形態を示すことで好ましい実施形態を図示及び記載している。本開示に関して他の異なる実施形態も可能であることは明らかであり、いくつかの詳細については、本開示から逸脱することなく、各種の自明な点で変形が可能である。従って、本明細書は本質的に実施例を用いた説明的なものであり、これに限定されることはない。
【図面の簡単な説明】
【0012】
【図1】図1は、TA−18がヒトのアデノシンキナーゼの基質であることを示すグラフである。
【図2】図2は、ヒトCEM細胞中でTA−18がリン酸化代謝物に変換されたことを示すグラフである。
【図3】図3は、TA−18で処理することにより、GTPレベルが減少したことを示すグラフを表す。
【図4】図4は、ヨードツベルシジンを用いてアデノシンキナーゼ活性を阻害すると、ヒト細胞内におけるTA−18の代謝が阻害されたことを示すグラフである。
【図5】図5は、ヨードツベルシジンを用いてアデノシンキナーゼ活性を阻害すると、TA−18が引き起こすGTPレベルの減少もまた抑制されたことを示すグラフである。
【図6】図6は、リバビリンからよりもTA−18からの方が形成される細胞内代謝物がはるかに少ないことを示すグラフである。
【図7】図7は、リバビリンで処理することによっても、ヒト細胞内におけるGTPレベルが減少したことを示すグラフである。
【発明を実施するための形態】
【0013】
本開示は、とりわけ、下記式で表される化合物:
【0014】
【化2】

[式中、A=C又はNであり、
B=C又はNであり、
X=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
Z=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br、I等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
E=(CH2)nONHR1であって、nは0〜6、より典型的には0〜3の整数であり、R1=アリール又はヘテロシクロであり、
W、Y、Rは、それぞれ独立して、H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;O、OH、Oアルキル、Oアリール、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)からなる群より選択されるが、但し、W、Y及びRのうち少なくとも1つはH及びNH2以外のものであって、W及びYは共に結びついて=Oとなっていてもよく、
Dはそれぞれ独立して、OH、Oアルキル、Oアリール、Fl及びHである]、
薬学的に許容されるその塩、そのプロドラッグ、及び、その混合物に関する。
【0015】
これらの化合物の置換基の立体化学構造は、置換位置において(R)又は(S)のいずれであってもよい。当然、異なる立体異性体同士の混合物も考えられる。
【0016】
以下、本発明の説明に使用される各用語の定義を列挙する。これらの定義は、それそのものとして又はより大きなまとまりの一部として、特定の場合を除き、本明細書全体を通じて用いられるよう各用語に適用される。
【0017】
「アルキル」という用語は、直鎖又は分枝鎖状の非置換炭化水素基を表し、典型的には1〜6個の、より典型的には1〜3個の炭素原子を有している。
【0018】
アルキル基の好ましい例としては、メチル、エチル及びプロピルが挙げられる。分枝鎖アルキル基の例としては、イソプロピル及びt−ブチルが挙げられる。アルコキシ基の好ましい例としては、メトキシ、エトキシ及びプロポキシが挙げられる。
【0019】
シクロアルキル基は、典型的には3〜6個の炭素原子を有しており、シクロプロピル、シクロブチル、シクロペンチル及びシクロヘキシルを包含する。
【0020】
ハロ基の例としては、Cl、F、Br及びIが挙げられる。
【0021】
アルケニル基は、典型的には2〜6個の炭素原子を有しており、エテニル、プロペニル及びブテニルを包含する。
【0022】
シクロアルケニル基は、典型的には3〜6個の炭素原子を有しており、シクロプロペニル、シクロブテニル、シクロペンテニル及びシクロヘキセニルを包含する。
【0023】
アルキニル基は、典型的には2〜6個の炭素原子を有しており、アセチレニル及びプロピニルを包含する。
【0024】
「アリール」という用語は、単環式又は多環式の芳香族炭化水素基を表し、典型的には6〜14個の炭素原子を環部分に有している。アリールの例としては、フェニル、2−ナフチル、1−ナフチル、4−ビフェニル、3−ビフェニル、2−ビフェニル及びジフェニル基が挙げられ、それぞれ置換されていてもよい。
【0025】
「ヘテロシクロ」という用語は、飽和又は不飽和の単環基又は多環基を表す。
【0026】
多環式芳香族(不飽和)複素環(heterocycle)基の例としては、2−キノリニル、3−キノリニル、5−キノリニル、6−キノリニル、7−キノリニル、1−イソキノリニル、3−イソキノリニル、6−イソキノリニル、7−イソキノリニル、3−シンノリル(cinnolyl)、6−シンノリル、7−シンノリル、2−キナゾリニル、4−キナゾリニル、6−キナゾリニル、7−キナゾリニル、2−キノキサリニル、5−キノキサリニル、6−キノキサリニル、1−フタラオニル(phthalaonyl)、6−フタラジニル、1−5−ナフチリジン−2−イル、1,5−ナフチリジン−3−イル、1,6−ナフチリジン−3−イル、1,6−ナフチリジン−7−イル、1,7−ナフチリジン−3−イル、1,7−ナフチリジン−6−イル、1,8−ナフチリジン−3−イル、2,6−ナフチリジン−6−イル、2,7−ナフチリジン−3−イル、インドリル、1H−インダゾリル、プリニル、及び、プテリジニルが挙げられる。
【0027】
単環式複素環基の例としては、ピロリル、ピラニル、オキサゾリル、チアゾイル、チオフェニル、フラニル、イミダゾリル、ピラゾリル、ピリジニル、ピラジニル、ピリミジニル、4−ピリミジニル、3−ピリミジニル及び2−ピリミジニル、ピリダジニル、イソチアゾリル、及び、イソオキサゾリルが挙げられる。
【0028】
飽和複素環基の例としては、ピロリジニル、イミダゾリジニル、ピラゾリジニル、ピペリジニル、ピペラジニル、及び、モルホリニルが挙げられる。
【0029】
複素環基は、N、O及び/又はSを含み、典型的には5〜10個の原子を環構造内に有し、また典型的には1、2又は3個のヘテロ原子(例えば、−N、O及びS)を環構造内に有している。
【0030】
必要に応じて、上記アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール及びヘテロシクロ基は置換されていてもよい。置換されている場合、これらの基は典型的には、ハロゲン、及び/又は、アルキル置換基、及び/又は、(CH2)nONH2(式中、nは0〜6、より典型的には0〜3の整数である)で置換されている。本開示の化合物は、分子内の考え得る各種原子における全ての光学異性体及び立体異性体に関するということが当然ながら理解されよう。
【0031】
本開示に係る化合物は、アルコキシ基、アミノ酸基等をプロドラッグ形成部として使用して、ヒドロキシル又はアミノ官能基でプロドラッグを形成してもよい。例えば、ヒドロキシメチル部がモノ−、ジ−又はトリホスフェートを形成し、さらにこれらのホスフェートがプロドラッグを形成してもよい。ヒドロキシ及びヒドロキシメチル基を、−OCH2P(O)(OH)2に、さらにこのホスホネートのプロドラッグに変換してもよい。ヒドロキシメチルの酸素原子をCH2に変換し、その後CH2P(O)(OH)2に、さらにそのプロドラッグに変換してもよい。
【0032】
各種の窒素官能基(アミノ、ヒドロキシアミノ、アミド等)を有する化合物のプロドラッグ形態としては、以下に示すような誘導体が挙げられる。
(a)カルボキサミド:−NHC(O)R
(b)カルバメート:−NHC(O)OR
(c)(アシルオキシ)アルキルカルバメート:NHC(O)OROC(O)R
(d)エナミン:−NHCR(=CHCO2R)又は−NHCR(=CHCONR2)
(e)シッフ塩基:−N=CR2
(f)マンニッヒ塩基(カルボキシイミド化合物由来):RCONHCH2NR2
上記式中、R基はそれぞれ独立して、上記で定義されるような、水素、置換又は非置換のアルキル、アリール、アルケニル、アルキニル、複素環基、アルキルアリール、アラルキル、アラルケニル、アラルキニル、シクロアルキル、又は、シクロアルケニル基であってもよい。
【0033】
このようなプロドラッグ誘導体の調製については、各種文献で考察されている(例えば、AlexanderらによるJ.Med.Chem.1988,31,318;Aligas−MartinらによるPCT WO pp/41531のp.30)。本開示の化合物の窒素原子のうちの1つ(又は1つ以上)は、これらの誘導体の調製において変換される窒素官能基である。
【0034】
本開示の、カルボキシル含有化合物のプロドラッグ形態はエステル(−CO2R)を含む。上記式中、R基は、酵素又は加水分解プロセスによって薬学的に許容される程度に体内で放出される任意のアルコールに相当する。本開示のカルボン酸形態に由来する別のプロドラッグは、BodorらによるJ.Med.Chem.,1980,23,469に記載されている構造からなる以下のような第四級塩型であってもよい。
【0035】
【化3】

【0036】
本開示の化合物の薬学的に許容される塩としては、薬学的に許容される無機酸又は有機酸由来のものが挙げられる。好ましい酸の例としては、塩化水素酸、臭化水素酸、硫酸、硝酸、過塩素酸、フマル酸、マレイン酸、リン酸、グリコール酸、乳酸、サリチル酸、コハク酸、トルエン−p−スルホン酸、酒石酸、酢酸、クエン酸、メタンスルホン酸、ギ酸、安息香酸、マロン酸、ナフタレン−2−スルホン酸、トリフルオロ酢酸、及び、ベンゼンスルホン酸が挙げられる。適当な塩基に由来する塩は、ナトリウム及びアンモニア等のアルカリ類を含む。
【0037】
本開示の範囲内である化合物の幾つかは、以下の化学式によって表される。
【0038】
【化4】

【0039】
【化5】

【0040】
【化6】

【0041】
【化7】

【0042】
【化8】

【0043】
【化9】

【0044】
N−アリールカルボキサミドアゾールリボシドの代表例としては、以下のものが挙げられる。
【0045】
【化10】

【0046】
本開示に係る炭素置換アゾールリボシドの代表例としては以下のものが挙げられる。
【0047】
【化11】

【0048】
【化12】

【0049】
抗ウイルス薬スクリーニングにおいて合成された、代表的な新規1−β−D−リボフラノシル化合物の構造は、以下のように示される。
【0050】
【化13】

【0051】
化合物の合成
本開示の化合物は、以下のスキームに従って調製できる。
【0052】
[IA−3]N1−(3−フルオロフェニル)−イノシン
TBS−IA−3及びIA−3を合成するための反応スキーム
【0053】
【化14】

(i)TBS−Cl、イミダゾール、DMAP、DMF 室温 24時間
(ii)3−フルオロフェニルボロン酸、Cu2(OAc)2、ピリジン、ピリジン−N−オキシド、CH2Cl2、粉末モレキュラーシーブ4Å、O2
(iii)TBAF、THF、−10℃
【0054】
[RN−3]5−アミノ−4−N−3−フルオロフェニルカルボキサミド−1−β−D−リボフラノシル−1H−イミダゾール
RN−3を合成するための反応スキーム
【0055】
【化15】

(i)5NのNaOH、EtOH、還流4時間
TBS−IA−3は上述の通りに調製される。
【0056】
[TBS−TA−8](1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド
TBS−TA−8aを合成するための反応スキーム
【0057】
【化16】

a試薬及び条件:(i)1MのNaOMe、MeOH、室温、2時間;(ii)TBDMSCl、イミダゾール、DMAP、DMF、室温、18時間;(iii)DIBALH、CH2Cl2、−78℃、4時間
【0058】
TA−18:3−エチニル−1−(β−D−リボフラノシル)−[1,2,4]トリアゾール
TA−18aを合成するための反応スキーム
【0059】
【化17】

a(i)ジメチル−1−ジアゾ−2−オキソプロピルホスホネート、K2CO3、MeOH、室温、24時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0060】
TA−12:1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノール
TA−12aを合成するための反応スキーム
【0061】
【化18】

a試薬及び条件:(i)CH3MgCl、THF、0℃、3時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0062】
TA−13:1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノン
TA−13aを合成するための反応スキーム
【0063】
【化19】

a試薬及び条件:(i)PCC、CH2Cl2、室温、4時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0064】
TA−14:1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノール
TA−14aを合成するための反応スキーム
【0065】
【化20】

a試薬及び条件:(i)PhMgCl、THF、0℃、3時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0066】
TA−15:1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノン
TA−15aを合成するための反応スキーム
【0067】
【化21】

a試薬及び条件:(i)PCC、CH2Cl2、室温、4時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0068】
TA−17:3−(1,1−ジフルオロ−エチル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール
TA−17aを合成するための反応スキーム
【0069】
【化22】

a試薬及び条件:(i)DAST、CH2Cl2、還流、12時間;(ii)1MのTBAFのTHF溶液、室温、2時間
【0070】
TA−19:1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−2,2,2−トリフルオロエタノール
TA−19aを合成するための反応スキーム
【0071】
【化23】

a試薬及び条件:(i)CF3TMS、KOtBu、乾燥THF、0℃、3時間;(ii)1MのTBAFのTHF溶液、乾燥THF、室温、2.5時間
【0072】
TA−20:3−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオンアミド
TA−20aを合成するための反応スキーム
【0073】
【化24】

a試薬及び条件:(i)ブロモ酢酸エチル、Zn(金属)、THF、還流、4時間;(ii)NH3、MeOH、60℃、24時間;(iii)1MのTBAFのTHF溶液、室温、4時間
【0074】
各種化合物を、生物学的試験データと併せて以下に示す。
【0075】
化合物及び抗ウイルス活性の概要
1−β−D−リボフラノシル−アゾール誘導体化合物、及び、A(H3N2)型インフルエンザに対する抗ウイルス活性についてスクリーニングしたものを以下に示す。
【0076】
【化25】

【0077】
以下は、インフルエンザウイルスを例として用いた評価プロトコルの概要である。他の被験ウイルスに対しても同様のプロトコルが採用できると解される。
【0078】
2.0 抗インフルエンザウイルス評価プロトコルの概要
抗ウイルス及び毒性アッセイ:
抗インフルエンザウイルス評価アッセイにより、所定の単回投与濃度とした化合物の効果を試験する。アッセイにおいては、メイディン・ダービー・イヌ腎臓(Madin Darby canine kidney:MDCK)細胞を用い、インフルエンザA/Udorn/72の感染により誘発される細胞変性効果(CPE)に対する、化合物の抑制効果を試験する。典型的なプレート配置を以下の表1に示す。
【0079】
【表1】

【0080】
試験毎に、陽性対照化合物としてリバビリンを使用している。MDCK細胞のサブコンフルエント(Subconfluent)状態の培養物を384ウェルプレートで培養し、抗ウイルス活性(CPE)を分析する。24時間後、細胞に薬剤を加える。また、所定時間で、CPEウェルに組織培養感染量(TCID50)の100倍のA/Udorn/72を投入する。72時間後、CellTiter−Glo(Promega社)を用いて細胞生存度を求める。ウイルス誘発性CPEを50%を超えて阻害する化合物を有効とする。
【0081】
CellTiter−Gloによる細胞生存度の検出アッセイ
インフルエンザ誘発性CPEは、代謝的に活性な細胞の指標であるATPを定量することで測定される。CPEアッセイには、市販のCellTiter−Glo<R> Luminescent Cell Viability Kit〔Promega社(ウィスコンシン州、マディソン)〕を使用する。CPEアッセイは、培養物中の細胞毒性及び細胞増殖を測定する上で信頼性が高い方法である。この方法には、前もって培地で培養しておいたサブコンフルエントな細胞に1種類の試薬(CellTiter−Glo<R>試薬)を直接添加する工程が含まれる。これによって細胞溶解が起こり、存在するATP(生存度を示す生物マーカーである)の量に比例して、生物発光シグナルが生じる(細胞の種類によるが、半減期は5時間を越える)。
【0082】
3.0 材料及び方法
3.1 材料
・細胞
MDCK、ATCC Cat#CCL−34
・ウイルス
A/Udorn/72;H3N2;Passage#2;14OCT05
・エンドポイント試薬
CellTiter−GLO−Promega
基質:Cat#G755B
バッファ:Cat#G756B
・対照薬
リバビリン−MP Biomedicals,Inc.、Cat#196066
【0083】
3.2 方法
第1日目:MDCK細胞が集密度90%まで増殖したら、トリプシン処理、回収、遠心分離を行ってから、PBSで2回洗浄して残余血清を取り除く。その後、細胞を無血清DMEMで希釈し、384ウェルプレートに分注し(20μl/ウェル)、37℃で1晩かけてプレートに定着させる。
【0084】
第2日目:プレートから少量をランダムにサンプリングし、細胞の形態を目視観察する。試験する化合物(5μl)を各プレートウェルに添加し、最終濃度を10μMにし、DMSO濃度を0.5%未満とする。プレートは
【0085】
評価プロトコルについては、NoahらによるA cell−based luminescence assay is effective for high−throughput screening of potential influenza antivirals,Antiviral Reserch(2006)〔doi:10.1016/j.antiviral.2006.07.006(オンライン上、www.sciencedirect.comにてコピーを入手可能)〕に、さらに詳しい記載がみられる。この全開示内容を本願明細書に引用して援用する。
【0086】
アデノシンキナーゼ及びTA−18に関する先行研究より、以下の結論が導かれる。
【0087】
1.アデノシンキナーゼを用いた基質活性は、合成された幾つかのアナログを使用して測定された(表2参照)。
【0088】
2.放射標識されたTA−18を用いて、TA−18がヒトのアデノシンキナーゼの基質であることが確認された(図1参照)。次ページの表に示す結果における活性と、放射標識された化合物を用いた結果における活性とが一致していないのは、実験で用いた化合物の濃度が異なるためだと考えられる(表に示される結果では100μMを用い、他の全ての実験では10μMを用いた)。
【0089】
3.TA−18は、ヒト細胞内でリン酸化代謝物に変換された(図2参照)。
【0090】
4.TA−18で処理すると、ヒト細胞内でGTPレベルが減少した(以下の表3及び図3参照)。
【0091】
5.ヨードツベルシジンでアデノシンキナーゼの活性を阻害すると(図4参照)、ヒト細胞内でTA−18の代謝が阻害された。従って、この細胞系では、アデノシンキナーゼがTA−18の代謝に関与する主要酵素であることが示された。
【0092】
6.ヨードツベルシジンでアデノシンキナーゼの活性を阻害すると(図5参照)、TA−18が引き起こすGTPレベルの減少もまた抑制された。従って、TA−18で処理された細胞内で観察されたGTPレベルの減少は、TA−18の代謝物が原因であることが示された。
【0093】
7.リバビリンで処理した場合も、ヒト細胞内でGTPレベルが減少した(図7参照)。TA−18から得られた細胞内代謝物の方が、リバビリンから得られた細胞内代謝物よりもはるかに少なかったため(図6参照)、リバビリン代謝物よりもTA−18代謝物の方がGTPレベルの減少に効果があることがこの結果により示される。
【0094】
8.これらの先行結果より、TA−18の作用である抗ウイルスメカニズムは、細胞内GTPレベルの減少に起因していること、あるいはIMPデヒドロゲナーゼ活性の阻害に起因していることが示唆される。
【0095】
【表2】

【0096】
ヒトのアデノシンキナーゼを、各化合物100μM及びATPとインキュベートした。37℃で所望時間インキュベートした後、反応を止め、5’−モノホスフェートに変換された各化合物をHPLCで測定した。
【0097】
これらの化合物を試験する際、我々はこれら三種及びインフルエンザ間の阻害レベルの差を区別しなかった。本開示化合物の抗ウイルス活性試験において得られた結果を明らかにすると、以下の点となる。例えば、ハンターンウイルス(HTNV)、クリミア・コンゴ出血熱ウイルス(CCHFV)、リフトバレー熱ウイルス(RVFV)、及び、インフルエンザに対する抗ウイルス薬スクリーニングにより、ブニヤウイルス科内のウイルスにおいて本開示化合物が選択性を有することが示される。例えば、I8−0は、HTNV及びインフルエンザに対して抗ウイルス活性を示した。IA−3はHTNVに対して抗ウイルス活性を示し、IM−18はインフルエンザに対して抗ウイルス活性を示した。PZA−Oはインフルエンザに対して抗ウイルス活性を示した。RC−3は、HTNV及びインフルエンザに対して抗ウイルス活性を示し、RN−3はHTNVに対して活性を示した。TA−1はCCHFVに対して抗ウイルス活性を示し、TA12はHTNVに対して抗ウイルス活性を示し、TA−14及び16はHTNVに対して抗ウイルス活性を示し、TA18はHTNV、インフルエンザ及びCCHFVに対して抗ウイルス活性を示し、TA−23はRVFVに対して抗ウイルス活性を示した。T系化合物が好ましい。
【0098】
本開示を更に説明するための実施例を以下に示すが、本開示はこれらに限定されない。
【0099】
実施例1
【0100】
【化26】

2’,3’,5’−トリス−(O−tert−ブチルジメチルシリル)−イノシン(TBS−I):
TBS−Cl(18.1g、120mmol)及びイミダゾール(10.9g、160mmol)を用いたイノシン(5.36g、20mmol)の保護反応を、乾燥DMF(100mL)中にて室温下48時間行った。減圧下で濃縮した後、混合物をCH2Cl2で200に希釈し、それぞれ100mLの水(4回)、飽和NH4Cl(3回)、及び飽和NaClで洗浄した。続いて、EtOAc中で再結晶させて白色結晶固体(10.9g、17.8mmol、90%)を得た。FTIR(PTFEカード、cm−1)1706;1H NMR(400MHz、CDCl3−d)δ13.30(1H、s)、8.31(1H、s)、8.21(1H、s)、5.98(1H、d、J=4.8Hz)、4.46(1H、m)、4.26(1H、m)、4.09(1H、m)、3.96(1H、m)3.75(1H、m)、0.92−0.77(27H、mult.s)、0.11−−0.20(18H、mult.s);13C NMR(400MHz、CDCl3−d)δ159.3、148.8、145.3、138.8、124.8、88.2、85.2、76.4、71.5、62.2、TBS−は記載せず。
【0101】
実施例2
【0102】
【化27】

N1−(3−フルオロフェニル)−2’,3’,5’−トリス−(O−tert−ブチルジメチルシリル)−イノシン(TBS−IA−3):
TBS−I(2.4g、4.0mmol)、3−フルオロフェニルボロン酸(1.1g、8.0mmol)、無水Cu(OAc)2(800.0mg、4.4mmol)、ピリジン−N−オキシド(800mg、4.0mmol)、粉末モレキュラーシーブ4Å(約1g)及び攪拌子を、乾燥器で乾燥させたシュレンク管に入れた。続いて、シュレンク管をゴムセプタムで密封し、排気後、酸素をフラッシュした。その後、乾燥ピリジン(647μL、8.0mmol)、及び、モレキュラーシーブにより乾燥したCH2Cl2(20mL)を加え、室温下で24時間、反応系を激しく攪拌した。続いて、MeOH中の飽和NH4OH溶液(5mL中に0.5mL)で反応をクエンチした後、ヘキサンで500mLに希釈した。有機分を、それぞれ250mLの水、飽和NH4Cl、1MのNaCl、及び飽和NaClで洗浄した。その後、有機分をNa2SO4で乾燥し、減圧下で濃縮した。CH2Cl2/MeOHを溶離液として、中圧フラッシュクロマトグラフィー(Isco CombiFlash GRADUATE)により全ての化合物を精製し、白色非晶質固体(式量=705.1、1.93g、2.74mmol、67%)を得た。FTIR(PTFEカード、cm−1)1716;1H NMR(400MHz、CDCl3−d)δ8.20(1H、s)、7.99(1H、s)、7.45(1H、m)、7.16−7.13(3H、m)、5.99(1H、d、J=4.8Hz)、4.46(1H、m)、4.29(1H、m)、4.11(1H、m)、3.97(1H、m)3.77(1H、m)、0.93−0.80(27H、mult.s)、0.12−−0.16(18H、mult.s);13C NMR(400MHz、CDCl3−d)δ162.6(J=248.1Hz)、156.0、147.1、146.4、138.4(J=9.5Hz)、130.7(J=9.0Hz)、124.7、123.0、116.3(J=20.0Hz)、115.2(J=23.9Hz)、88.1、85.4、76.7、71.6、62.3、TBS−は記載せず;C34H57FN4O5Si3としての元素分析計算値:C,57.92;H,8.15;N,7.95 実測値:C,57.94;H,8.36;N,7.83。
【0103】
実施例3
【0104】
【化28】

N1−(3−フルオロフェニル)−イノシン(IA−3):
TBS3−IA−3(1.06g、1.5mmol)、乾燥THF(25mL)、及び攪拌子を丸底フラスコに入れ、−10℃で攪拌した。ここに1Mのフッ化テトラブチルアンモニウム/THF溶液を5.0mL加えた。1.5時間後(TLCにより完了が示されたとき)、アセトンを溶離液として、5cm径のシリカゲルオープンカラム(gravity column)(70〜230メッシュの60Åシリカゲルを約350mL)に溶液を直接充填し、テトラブチルアンモニウム塩の大半を取り除いた。その後、トルエン/EtOHを溶離液とし、中圧フラッシュクロマトグラフィー(Isco CombiFlash GRADUATE)にて固形分を精製し、白色非晶質固体(式量=362.3、469mg、1.29mmol、86%)を得た。FTIR(KBr、cm−1)3394、2931、1699、1601、1578、1546、1489、1226;1H NMR(CD3OD、400MHz)δ8.39(1H、s)、8.30(1H、s)、7.57(1H、m)、7.35−7.26(3H、m)、6.04(1H、d、J=5.9Hz)、4.63(1H、m)、4.33(1H、m)、4.13(1H、m)、3.86(1H、m)、3.75(1H、m);13C NMR(CD3OD、400MHz)δ164.1(J=245.4Hz)、157.9、149.2、148.7、141.5、139.9(J=10.2Hz)、132.1(J=8.7Hz)、125.3、124.8(J=2.3Hz)、117.4(J=21.2Hz)、116.4(J=23.9Hz)、90.4、87.5、76.3、72.0、62.9;C16H15FN4O5[M+1]+としてのMS(ESI)計算値:363.11m/z、実測値:363.26m/z。
【0105】
実施例4
【0106】
【化29】

5−アミノ−4−N−3−フルオロフェニルカルボキサミド−1−β−D−リボフラノシル−1H−イミダゾール(RN−3):
TBS−IA−3(1.41g、2mmol)を丸底フラスコに入れ、無水EtOH(30mL)に溶解させ、攪拌下、沸騰させた。その後、この溶液に5NのNaOH(10mL)を加え、4時間還流させた。フラスコを熱から下ろして室温まで冷やし、6NのHClで中和した(pH=約7)。続いて、その水性混合物をEtOAcで3回抽出した後、Na2SO4で乾燥して、減圧下で濃縮した。その後、固形分をEtOAc中で再結晶させ、淡桃色の結晶固体(式量=352.3、450mg、1.28mmol、64%)を得た。FTIR(KBr、cm−1)3558、3536、3489、3426、3363、3302、3117、2938、2927、1651、1607、1564;1H NMR(DMSO−d6、400MHz)δ9.57(1H、br s)、7.79(1H、m)、7.59(1H、m)、7.43(1H、s)、7.27(1H、m)、6.77(1H、m)、6.23(2H、br s)、5.52(1H、d、J=6.4Hz)、5.44(1H、d、J=6.4Hz)、4.94(1H、t、J=4.9Hz)、4.58(1H、d、J=5.2Hz)、4.30(1H、m)、4.05(1H、m)、3.91(1H、m)、3.59(2H、m);13C NMR(CD3OD、400MHz)δ164.8、164.3(J=240.5Hz)、145.9、141.9(J=11.0Hz)、131.2、131.1(J=10.0Hz)、115.92、113.6、110.5(J=21.7Hz)、107.5(J=26.5Hz)、90.7、87.4、74.0、72.1、62.5;C15H17FN4O5[M+1]+としてのMS(ESI)計算値:353.13m/z、実測値:353.25m/z。
【0107】
実施例5
【0108】
【化30】

(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボン酸メチルエステル:
メチル−1−(β−D−リボフラノシル)−1,2,4−トリアゾール−3−カルボキシレート(5.1345g、19.8mmol)とイミダゾール(10.78g、158.3mmol)とDMAP(50mg)との乾燥DMF(50mL)溶液に、tert−ブチルジメチルシリルクロリド(11.74g、77.9mmol)を加えた。反応混合物を室温で一晩攪拌した後、TLC分析(5%MeOH/CH2Cl2、Rf=0.62)によって1種の生成物における出発材料の総変換率を示した。白色スラリーを、水(100mL)とDCM(100mL)とからなる2層系に注入した。有機層を分離して、水相をDCM(50mLで3回)で繰り返し抽出した。合わせた有機抽出物を、乾燥(無水Na2SO4)し、ろ過して、減圧留去を行い、白色固体を得た。当該白色固体をヘキサンで再結晶させると、白色粉末状の目的生成物(式量:602.00、10.07g、84%)が得られた。1H NMR(200MHz、CDCl3)δ8.57(s、1H)、5.84(d、1H、J1’,2’=4.9Hz、H−1’)、4.45(m、1H、H−2’)、4.22(m、1H、H−3’)、4.17−4.09(m、1H、H−4’)、3.99(s、3H)、3.98−3.90(dd、1H、J5’a,5’b=11.9及びJ5’a,4’=3.7Hz、H−5a)、3.80−3.73(dd、1H、J5’b,5’a=11.4及びJ5’b,4’=2.5Hz、H−5b)、0.94(s、9H、tBu)、0.91(s、9H、tBu)、0.85(s、9H、tBu)、0.13(s、6H、2×CH3)、0.08(s、6H、2×CH3)、0.03(s、3H、CH3)、及び、−0.06(s、3H、CH3)。
【0109】
実施例7
【0110】
【化31】

(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8]:
(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボン酸メチルエステル(4.2140g、7.0mmol)の乾燥CH2Cl2(15mL)溶液(−78℃)に、DIBAL−H(17.5mL、1MのCH2Cl2中溶液)を、内部温度を−65℃未満に保つようにしてゆっくり加えた。反応系を−78℃で4時間攪拌させた後、低温(−78℃)のMeOH(7mL)を、内部温度を−65℃未満に保ちながらゆっくり加えて、反応をクエンチした。次に、得られた白色乳濁液を2時間にわたり旋回振とうさせて室温に戻した。続いて、CH2Cl2(25mL)を加えて反応混合物を希釈し、0.5MのNaOH(25mL)で洗浄した。更に、水性混合物をCH2Cl2(3回)で抽出した。合わせた有機溶液をブラインで洗浄し、無水Na2SO4で乾燥し、減圧下で濃縮して、浅黄色の油状液体の粗生成物を得た。続いて、当該粗生成物をシリカゲルカラム(5%MeOH/CH2Cl2)で精製し、無色油状液体の精製物を得た。その精製物を減圧下で5日間乾燥させると、白色固体(式量:571.97、3.1668g、78%)が得られた。1H NMR(200MHz、CDCl3)δ10.01(s、1H)、8.57(s、1H)、5.82(d、1H、J1’,2’=4.2Hz、H−1’)、4.48(m、1H、H−2’)、4.25(m、1H、H−3’)、4.18−4.09(m、1H、H−4’)、3.95−3.88(dd、1H、J5’a,5’b=11.9及びJ5’a,4’=3.7Hz、H−5a)、3.79−3.72(dd、1H、J5’b,5’a=11.5及びJ5’b,4’=2.6Hz、H−5b)、0.92(s、9H、tBu)、0.91(s、9H、tBu)、0.84(s、9H、tBu)、0.10−−0.09(mult.S、18H)。
【0111】
実施例8
【0112】
【化32】

3−エチニル−1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル)−1,2,4−トリアゾール[TBS−TA−18]:
1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8](572mg、1mmol)とジメチル−1−ジアゾ−2−オキソプロピルホスホネート(249mg、1.3mmol)との無水メタノール(5ml)溶液に攪拌下、無水K2CO3(208mg、2.1mmol)を加えた。得られた浅黄色の溶液を24時間攪拌した。混合物を水(10ml)でクエンチし、Et2O(20mlで4回)で抽出した。合わせた抽出物を、NaHCO3(水溶液)(飽和、10ml)及びブライン(飽和、10ml)で洗浄し、Na2SO4で乾燥した。減圧下で溶媒を取り除いて得られた粗生成物をフラッシュクロマトグラフィー(5%−20%EtOAC/ヘキサン)により精製して、白色固体を得た。当該白色固体をヘキサンで再結晶させると、白色粉末状の目的生成物(式量:567.98、435mg、76%)が得られた。1H NMR(200MHz、CDCl3)δ8.72(s、1H)、5.69(d、1H、J1’,2’=4.03Hz、H−1’)、4.45(m、1H、H−2’)、4.23(m、1H、H−3’)、4.11(m、1H、H−4’)、3.95−3.88(dd、1H、J5’a,5’b=11.5及びJ5’a,4’=4.03Hz、H−5a)、3.79−3.72(dd、1H、J5’b,5’a=11.35及びJ5’b,4’=2.9Hz、H−5b)、3.06(s、1H)、0.95−0.78(mult.s、27H)、0.14−−0.09(mult.s、18H)。C27H53N3O4Si3[M+1]+としてのLCMS(APCI)計算値:568.34m/z、実測値:568.28m/z。HPLC 100%CH3CN、室温6.62分。
【0113】
実施例9
【0114】
【化33】

3−エチニル−1−(β−D−リボフラノシル)−[1,2,4]トリアゾール[TA−18]:
3−エチニル−1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル)−1,2,4−トリアゾール[TBS−TA−18](125mg、0.22mmol)の無水THF(3ml)溶液に攪拌下、1MのTBAFのTHF溶液(0.8mL、0.8mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(50%−アセトン/CH2Cl2)で生成物を単離させ、白色固体を得た。当該白色固体を(5%MeOH/CH2Cl2)で再結晶させると、白色結晶粉末状の目的生成物(式量:225.20、41mg、82%)が得られた。1H NMR(200MHz、CD3OD)δ8.72(s、1H)、5.84(d、1H、J1’,2’=3.5Hz、H−1’)、4.43(m、1H、H−2’)、4.29(m、1H、H−3’)、4.09(m、1H、H−4’)、3.83−3.79(dd、1H、J5’a,5’b=12.3及びJ5’a,4’=3.3Hz、H−5a)、3.73(s、1H)、3.70−3.65(dd、1H、J5’b,5’a=12.9及びJ5‘b,4’=4.7Hz、H−5b)。13C NMR(CD3OD、400MHz)δ148.4、145.6、93.9、86.9、80.3、75.0、76.5、71.6、62.8。C9H11N3O4[M+1]+としてのLCMS(ESI)計算値:226.08m/z、実測値:225.23m/z。
【0115】
実施例10
【0116】
【化34】

1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノール[TBS−TA−12]:
アルゴン(1.1420g、2mmol)下の(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8]のTHF(50mL)溶液(0℃)に、CH3MgCl(1.35mL、3MのTHF中溶液)を滴下した。反応混合物を攪拌し、TLC(5%MeOH/CH2Cl2、Rf=0.3)により反応の進行度を確認した。3時間後、出発材料が完全に消失したのを確認した。続いて、反応混合物を飽和NH4Cl(水溶液)(20mL)でクエンチし、ジエチルエーテル(25mLで3回)で抽出した。合わせた有機抽出物を乾燥(無水Na2SO4)し、ろ過し、減圧留去を行って、無色油状液体を得た。これをシリカゲルカラム(5%MeOH/CH2Cl2)で精製すると、無色油状液体の生成物(式量:588.02、1.0216g、87%)が得られた。
【0117】
実施例11
【0118】
【化35】

1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノール[TBS−TA−12](392mg、0.67mmol)の無水THF(3ml)溶液に攪拌下、1MのTBAFのTHF溶液(0.8mL、0.8mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(50%−アセトン/CH2Cl2)により生成物を単離させて、無色油状液体(式量:245.10、130mg、79%)を得た。1H NMR(200MHz、CD3OD)δ8.63(s、1H)、5.82(d、1H、J1’,2’=3.91Hz、H−1’)、4.89(q、1H、J’=6.64Hz)、4.45(m、1H、H−2’)、4.32(m、1H、H−3’)、4.08(m、1H、H−4’)、 3.83−3.79(dd、1H、J5’a,5’b=12.1及びJ5’a,4’=3.1Hz、H−5a)、3.79−3.72(dd、1H、J5’b,5’a=12.30及びJ5’b,4’=4.5Hz、H−5b)、1.52(d、3H、J’=6.64Hz)。13C NMR(CD3OD、400MHz)δ168.4、145.6、93.4、86.9、76.4、71.8、64.8、63.1、22.5。C9H15N3O5[M+1]+としてのLCMS(ESI)計算値:246.11m/z、実測値:246.20m/z。
【0119】
実施例12
【0120】
【化36】

1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノン[TA−13]:
アルゴン下の1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノール[TBS−TA−12](1.764g、3mmol)と粉末モレキュラーシーブ(0.3g)とのCH2Cl2(15mL)懸濁液に、PCC(0.970g、4.5mmol)を加え、TLC(5%MeOH/CH2Cl2、Rf=0.7)により反応の進行度を確認しながら室温下で攪拌した。4時間後、出発材料が完全に消失したのを確認した。その後、フルオロシル(fluorosil)を通して反応混合物をろ過し、減圧下で濃縮した。次に、得られた残留物を水とジエチルエーテルとの間で分配させ、ジエチルエーテル(25mLで3回)で抽出した。合わせた有機抽出物を乾燥(無水Na2SO4)し、ろ過し、減圧留去を行って、フラッシュクロマトグラフィー(1%MeOH/CH2Cl2)により生成物を白色固体として単離させた(式量:586.00、1.102g、62%)。続いて、この生成物(207mg、0.35mmol)を無水THF(3ml)に溶解させ、1MのTBAFのTHF溶液(1mL、1mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(50%−アセトン/CH2Cl2)により生成物を単離させて、白色固体の目的生成物(式量:243.22、65mg、76%)を得た。1H NMR(200MHz、CD3OD)δ8.84(s、1H)、5.94(d、1H、J1’,2’=3.30Hz、H−1’)、4.49(m、1H、H−2’)、4.35(m、1H、H−3’)、4.13(m、1H、H−4’)、3.88−3.81(dd、1H、J5’a,5’b=12.1及びJ5’a,4’=3.3Hz、H−5a)、3.74−3.66(dd、1H、J5’b,5’a=12.10及びJ5’b,4’=4.4Hz、H−5b)、2.61(s、3H)。C9H13N3O5[M+1]+としてのLCMS(ESI)計算値:244.09m/z、実測値:244.25m/z。
【0121】
実施例13
【0122】
【化37】

1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノール[TA−14]:
アルゴン(320mg、0.56mmol)下の(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8]のTHF(2mL)溶液(0℃)に、PhMgCl(0.56mL、2MのTHF中溶液)を滴下した。反応混合物を攪拌し、TLC(5%MeOH/CH2Cl2、Rf=0.33)により反応の進行度を確認した。2時間後、出発材料が完全に消失したのを確認した。続いて、反応混合物を飽和NH4Cl(水溶液)(20mL)でクエンチし、ジエチルエーテル(25mLで3回)で抽出した。合わせた有機抽出物を、乾燥(無水Na2SO4)し、ろ過し、減圧留去を行って、無色油状液体の粗生成物を得た。当該粗生成物をフラッシュクロマトグラフィー(5%MeOH/CH2Cl2)で精製して、無色油状液体の1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノール[TBS−TA−14](式量:650.08、269mg、74%)を得た。
【0123】
TBS−TA−14(195mg、0.3mmol)の無水THF(3ml)溶液に攪拌下、1MのTBAFのTHF溶液(1mL、1mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(50%−アセトン/CH2Cl2)により生成物を単離させて、無色油状液体の生成物(式量:307.30、68mg、74%)を得た。1H NMR(400MHz、CD3OD、ジアステレオマーの複合混合物)δ8.62(s、1H)、7.49−7.23(m、5H)、5.82(d、1H、J1’,2’=3.71Hz、H−1’)、4.45(m、1H)、4.31(m、1H)、4.07(m、1H)、3.82−3.59(m、2H)、2.31(s、1H)。C14H17N3O5[M+1]+としてのLCMS(APCI)計算値:308.12m/z、実測値:308.24m/z。
【0124】
実施例14
【0125】
【化38】

1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノン[TA−15]:
アルゴン下の1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノール[TBS−TA−14][TBS−14](0.749g、1.15mmol)と粉末モレキュラーシーブ(0.2g)とのCH2Cl2(5mL)懸濁液に、PCC(0.373g、1.73mmol)を加え、TLC(5%MeOH/CH2Cl2、Rf=0.75)により反応の進行度を確認しながら、室温下で攪拌した。4時間後、出発材料が完全に消失したのを確認した。その後、フルオロシルを通して反応混合物をろ過し、減圧下で濃縮した。続いて、得られた残留物を水とジエチルエーテルとの間で分配させ、ジエチルエーテル(25mLで3回)で抽出した。合わせた有機抽出物を、乾燥(無水Na2SO4)し、ろ過し、減圧留去を行って、白色固体の粗生成物(式量:305.29、0.5021g、67%)を得た。その後、この生成物(0.198g、0.3mmol)を無水THF(3ml)に溶解させ、1MのTBAFのTHF溶液(1mL、1mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(アセトン)により生成物を単離させて、白色固体の目的生成物(式量:305.29、90mg、98%)を得た。1H NMR(200MHz、D2O)δ8.82(s、1H)、8.10(m、2H)、7.72(m、1H)、7.56(m、1H)、6.08(d、1H、J1’,2’=3.30Hz、H−1’)、4.62(m、1H、H−2’)、4.44(m、1H、H−3’)、4.19(m、1H、H−4’)、3.88−3.80(dd、1H、J5’a,5’b=12.82及びJ5’a,4’=3.3Hz、H−5a)、3.74−3.65(dd、1H、J5’b,5’a=12.82及びJ5’b,4’=5.1Hz、H−5b)。C9H13N3O5[M+1]+としてのLCMS(ESI)計算値:306.11m/z、実測値:306.29m/z。
【0126】
実施例15
【0127】
【化39】

3−(1,1−ジフルオロ−エチル)−1−β−D−リボフラノシル−[1,2,4]トリアゾール[TA−17]:
1−(2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−エタノン[TBS−TA−13](87mg、0.14mmol)のCH2Cl2(5mL)溶液にDAST(20μL、0.16mmol)を加え、TLC(5%MeOH/CH2Cl2、Rf=0.7)により反応の進行度を確認しながら、還流を行った。12時間後、H2O(25mL)を滴下して反応混合物をクエンチし、CH2Cl2(25mL)を加え、有機層を分離して、飽和NaHCO3及びH2O(25mLで3回)で洗浄した。続いて、有機層を乾燥(無水Na2SO4)し、ろ過し、減圧留去を行って、フラッシュクロマトグラフィー(5%MeOH/CH2Cl2)により白色固体の生成物TBS−TA−17を単離させた(式量:608、36.4mg、42%)。
【0128】
TBS−TA−17(36.4mg、0.06mmol)の無水THF(3mL)溶液に、1MのTBAFのTHF溶液(0.2mL、1mmol)を加えた。混合物を室温で2時間攪拌し、TLC(5%MeOH/CH2Cl2)により反応の完了が示されたら、MeOH(2mL)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(50%−アセトン/CH2Cl2)により生成物を単離させて、白色固体の目的生成物(式量:265.21、12mg、75%)を得た。1H NMR(400MHz、CD3OD)δ8.79(s、1H)、5.88(d、1H、J1’,2’=3.52Hz、H−1’)、4.46(m、1H、H−2’)、4.32(m、1H、H−3’)、4.10(m、1H、H−4’)、3.88−3.81(dd、1H、J5’a,5’b=12.1及びJ5’a,4’=3.5Hz、H−5a)、3.74−3.66(dd、1H、J5’b,5’a=12.1及びJ5’b,4’=4.7Hz、H−5b)、2.61(t、3H、J=18.5Hz)。
【0129】
実施例16
【0130】
【化40】

1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−2,2,2−トリフルオロエタノール[TA−19]:
(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8](100mg、0.17mmol)の乾燥THF(2mL)溶液(0℃)に、トリメチル(トリフルオロメチル)シラン(33μL、0.21mmol)及び触媒KOtBu(1mg)を加えた。アルゴン雰囲気下、この温度で4.5時間、反応系を攪拌した。反応混合物に対し室温で溶媒留去を行い、油状残留物をエーテル(4mL)に溶解させ、水(2mL)で洗浄し、無水Na2SO4で乾燥して、溶媒を留去した。粗生成物をシリカゲルカラム(移動相:ヘキサン中酢酸エチル勾配10%−20%)で精製し、無色油状液体の精製物TBS−TA−19(94mg、86%)を得た。FT−IR(NaCl、cm−1)2955、2931、1473、1258、1172、1136、837、779。1H NMR(200MHz、CDCl3)δ8.35(s、1H)、5.75(d、1H、J=4.9Hz)、5.16(q、1H、J=6.6Hz)、4.49−4.58(m、1H)、4.21−4.26(m、1H)、4.06−4.13(m、1H)、3.82−3.91(m、1H)、3.67−3.76(m、1H)、0.92(s、18H)、0.83(s、9H)、0.14(s、3H)、0.13(s、6H)、0.09(s、6H)、0.01(s、3H)。13C NMR(100MHz、CDCl3)δ158.69、144.34、123.48(q、J=282Hz)、91.91、86.17、76.10、71.90、67.63(q、J=34Hz)、62.47、25.97(3C)、25.78(3C)、25.61(3C)、18.43、18.01、17.89、−4.51、−4.69(2C)、−5.40、−5.51(2C)。
【0131】
TBS−TA−19(434mg、0.68mmol)の無水THF(3mL)溶液に攪拌下、1MのTBAFのTHF溶液(1.4mL、1.4mmol)を加えた。混合物を室温で2.5時間攪拌し、MeOH(1ml)でクエンチした。減圧下で溶媒を取り除き、フラッシュクロマトグラフィー(30%アセトン70%ヘキサン)により生成物を単離させ、油状液体の目的生成物(95mg、47%)を得た。FT−IR(NaCl、cm−1)3350、1660、1524、1270、1183、1134、867。1H NMR(200MHz、CDCl3)δ8.66(s、1H)、5.86(d、1H、J=3.3Hz)、5.24(q、1H、J=7.0Hz)、4.50(m、1H)、4.37(m、1H)、4.07(m、1H)、3.77(dd、1H、J1=11.9Hz、J1=3.3Hz)、3.72(dd、1H、J1=11.9Hz、J1=3.3Hz)。13C NMR(100MHz、CDCl3)δ160.11、145.55、125.10(q、J=282Hz)、93.29、86.94、76.41、71.59、68.08(q、J=33Hz)、62.75。
【0132】
実施例17
【0133】
【化41】

3−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオンアミド[TA−20]:
金属亜鉛をEtOH、アセトン及びエーテルで洗浄し、乾燥させた。続いて、(1−[2’,3’,5’−トリス(O−tert−ブチルジメチルシリル)−β−D−リボフラノシル]−(1,2,4−トリアゾール−3−イル)−カルボキシアルデヒド[TBS−TA−8](572mg、1.0mmol)とブロモ酢酸エチル(0.35ml、3.1mmol)とのTHF(10ml)溶液に、Zn(130mg、2.1mmol)を加えた。反応混合物を3.5時間還流させた。その後、溶液をCH2Cl2(25ml)で希釈し、水で3回洗浄し、Na2SO4で乾燥して、減圧下で濃縮した。得られた油状液体をシリカゲルカラム(10−20%EtOAc/ヘキサン)で精製し、精製物3−(2’,3’,5’−O−トリス(tert−ブチルジメチルシリル)−β−D−リボフラノシル)−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオン酸エチルエステル(式量:660.08、455mg、69%)を得た。この材料は次のステップで使用した。
【0134】
耐圧管中で、MeOH(15ml)を気体のNH3で飽和させ、この溶液に3−(2’,3’,5’−O−トリス(tert−ブチルジメチルシリル)−β−D−リボフラノシル)−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオン酸エチルエステル(306mg、0.46mmol)を加えた。反応系を60℃で24時間加熱した。得られた溶液を減圧下で濃縮した。フラッシュクロマトグラフィー(20−40%EtOAc/ヘキサン)により粗生成物を精製し、3−(2’,3’,5’−O−トリス(tert−ブチルジメチルシリル)−β−D−リボフラノシル)−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオンアミド(式量:631.04、240mg、88%)を得た。この材料は、次のステップで使用した。
【0135】
3−(2’,3’,5’−O−トリス(tert−ブチルジメチルシリル)−β−D−リボフラノシル)−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオンアミド(150mg、0.24mmol)を、1Mのフッ化テトラブチルアンモニウム溶液(0.8ml、0.8mmol)と乾燥THF(4ml)中で合わせて、室温で4時間攪拌した。5mlのMeOHで反応をクエンチして、減圧下で濃縮した。フラッシュクロマトグラフィー(50%EtOH/トルエン)により粗生成物を精製した(式量:288.26、24mg、35%)。1H NMR(200MHz、CD3OD)δ8.64(s、1H)、δ5.83(d、1H、J=3.7、H−1’)、δ5.16(m、1H)、δ4.45、1H、H−2’)、δ4.33(m、1H、H−3’)、δ4.09(m、1H、H−4’)、δ3.77−3.84(dd、1H、J5’a,4’=2.9、J5’a,5’b=12.1、H−5’a)、δ3.63−3.71(dd、1H、J5’b,4’=4.8、J5’b,5’a=12.8、H−5b’)δ2.75−2.81(m、2H)。
【0136】
剤形
本開示の化合物は、医薬品と共に使用することが可能な任意の従来手段によって投与することができ、それぞれ単一の治療剤としてもよく、又は他の治療剤と組み合わせてもよい。本開示の化合物は単独で投与してもよいが、一般的には医薬基剤と共に投与される。当該医薬基剤は、選択される投与経路と医薬分野の標準的な慣行とに基づいて選択される。上記化合物はまた、インターフェロン(IFN)、インターフェロンα−2a、インターフェロンα−2b、コンセンサス・インターフェロン(CIFN)、リバビリン、アマンタジン、リマンタジン、インターロイキン−12、ウルソデオキシコール酸(UDCA)及びグリシリジン等の他の治療剤と共に投与してもよい。
【0137】
本明細書で説明する薬学的に許容される基剤、例えば、ビヒクル、アジュバント、賦形剤又は希釈剤などは、当業者に周知である。一般的に、薬学的に許容される基剤は活性化合物に対して化学的に不活性であり、使用条件下において有害な副作用又は毒性を持つことはない。薬学的に許容される基剤としては、ポリマー及びポリマーマトリックスも含まれる。
【0138】
本開示の化合物は、医薬品と共に使用することが可能な任意の従来手段によって投与することができ、それぞれ単一の治療剤としてもよく、又は他の治療剤と組み合わせてもよい。
【0139】
投与量は当然ながら、薬剤の種類及びその投与の形態や経路といった薬力学的特徴;受容者の年齢、健康状態及び体重;症状の性質及び程度;併用療法の種類;治療頻度;並びに、所望の効果などの既知の要因に応じて異なるであろう。有効成分の1日当たりの投与量は、体重1キログラム(kg)当たり約0.001〜1000ミリグラム(mg)であると予想され、好ましくは0.1〜約30mg/kgである。
【0140】
投与形態(投与に適した組成物)には、1単位当たり約1mg〜約500mgの有効成分が含まれている。これらの医薬組成物には、通常、当該組成物の全重量に基づいて約0.5〜95重量%の量の有効成分が含まれるであろう。
【0141】
有効成分は、カプセル、錠剤及び散剤などの固形剤として経口投与されてもよく、あるいは、エリキシル剤、シロップ剤及び懸濁剤などの液剤として経口投与されてもよい。また、無菌液の投与形態で非経口投与してもよい。有効成分は、鼻腔内に投与してもよく(点鼻薬)、あるいは、薬剤パウダーミストの吸入によって投与してもよい。パッチ型や軟膏による経皮投与などの他の投与形態も可能な場合がある。
【0142】
経口投与に適した剤形は、(a)水、塩水、又はオレンジジュース等の希釈液に有効量の化合物を溶解させた液状溶液、(b)所望量の有効成分を固形物又は顆粒として含有しているカプセル、サシェ剤、錠剤、薬用ドロップ(lozenges)及びトローチ剤、(c)散剤、(d)適当な液体との懸濁剤、及び、(e)好適な乳剤から成っていてもよい。液剤の場合、水、並びに、エタノール、ベンジルアルコール、プロピレングリコール、グリセリン及びポリエチレンアルコール等のアルコール類などといった希釈剤が含まれてもよく、薬学的に許容される界面活性剤、懸濁化剤又は乳化剤が添加されていても、いなくてもよい。カプセル形態の場合、例えば、界面活性剤、滑沢剤、並びに、ラクトース、スクロース、リン酸カルシウム及びコーンスターチ等の不活性充填剤を含有している通常のハードシェルゼラチン型又はソフトシェルゼラチン型であってもよい。錠剤の場合、以下のものを1つ以上含んでいてもよい:ラクトース、スクロース、マンニトール、コーンスターチ、ジャガイモ澱粉、アルギン酸、微結晶セルロース、アラビアゴム、ゼラチン、グアーガム、コロイド二酸化ケイ素、クロスカルメロースナトリウム、タルク、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸亜鉛、ステアリン酸、及びその他の賦形剤、着色剤、希釈剤、緩衝剤、崩壊剤、湿潤剤、保存料、フレーバー付与剤、及び、薬理学的に適合した基剤。薬用ドロップ形態の場合、一般的にはスクロース、アラビアゴム又はトラガカントゴム等であるフレーバー中に有効成分を含んでいてもよく、香錠(pastilles)の場合も同様に、ゼラチン及びグリセリン、又は、スクロース及びアラビアゴム(acadia)、乳液、並びに、ゲル等の不活性な主材料中に有効成分を含んでいてもよく、この主材料中に有効成分に加えて当該技術分野で公知であるような基剤を含有していてもよい。
【0143】
本開示の化合物は、単独で、又は、他の好適な成分と組み合わせて、吸入投与用のエアロゾル剤形に調剤されてもよい。これらのエアロゾル剤形は、ジクロロジフルオロメタン、プロパン及び窒素などの許容される高圧噴射剤としてもよい。また、これらのエアロゾル剤形は、ネブライザー又はアトマイザー等といった非加圧式調剤用の医薬品に調剤されてもよい。
【0144】
非経口投与に適した剤形としては、酸化防止剤、緩衝剤、静菌剤、及び、製剤を対象受容者の血液と等張にする溶質を含む、水性及び非水性の等張無菌注射液;並びに、懸濁化剤、溶解剤、増粘剤、安定剤、及び保存料を含む、水性及び非水性無菌懸濁液が挙げられる。化合物は、医薬基剤中の生理学的に許容される希釈剤に含ませて投与してもよい。この生理学的に許容される希釈剤の例としては、無菌の液体又は液体混合物が挙げられ、水;塩水;デキストロース水溶液及び関連する糖液;エタノール、イソプロパノール又はヘキサデシルアルコール等のアルコール;プロピレングリコール、又は、例えばポリ(エチレングリコール)400等のポリエチレングリコールなどといったグリコール類;2,2−ジメチル−1,3−ジオキソラン−4−メタノール等のグリセロールケタル類;エーテル;オイル;脂肪酸;脂肪酸エステル又はグリセリド;あるいは、アセチル化脂肪酸グリセリドが含まれる。これらには、薬学的に許容される界面活性剤(石鹸又は洗浄剤など)、懸濁化剤(ペクチン、カルボマー、メチルセルロース、ヒドロキシプロピルメチルセルロース又はカルボキシメチルセルロース等)、又は乳化剤、並びに、他の医薬アジュバントが添加されていても、いなくてもよい。
【0145】
非経口剤形で使用されるオイルとしては、石油、動物油、植物油、又は合成油が挙げられる。オイルの具体例としては、ピーナッツ油、大豆油、ゴマ油、綿実油、コーン油、オリーブ油、ペトロラタム、及び鉱物油が挙げられる。非経口剤形に使用される好適な脂肪酸としては、オレイン酸、ステアリン酸、及びイソステアリン酸が挙げられる。好適な脂肪酸エステルの例としては、オレイン酸エチル及びミリスチン酸イソプロピルが挙げられる。非経口剤形に使用される好適な石鹸としては、脂肪酸アルカリ金属塩、脂肪酸アンモニウム塩、及び脂肪酸トリエタノールアミン塩が挙げられる。好適な洗浄剤としては、(a)例えばハロゲン化ジメチルジアルキルアンモニウム及びハロゲン化アルキルピリジニウム等のカチオン性洗浄剤、(b)例えばアルキル、アリール及びオレフィンスルホネート、アルキル、オレフィン、エーテル及びモノグリセリドスルフェート、並びに、スルホサクシネート等のアニオン性洗浄剤、(c)例えば脂肪族アミンオキシド、脂肪酸アルカノールアミド、及びポリオキシエチレンポリプロピレン共重合体などの非イオン性洗浄剤、(d)例えばアルキルβ−アミノプロピオネート、及び2−アルキルイミダゾリン第4級アンモニウム塩などの両性洗浄剤、(e)これらの混合物が挙げられる。
【0146】
非経口剤形は、一般的に約0.5〜約25重量%の有効成分を溶液中に含有している。このような剤形には、適当な保存料及び緩衝剤を使用してもよい。注射箇所への刺激を最小限に抑えるか、又は除くために、このような組成物には、親水親油バランス(HLB)が約12〜約17である非イオン性界面活性剤を1つ以上含有させてもよい。このような剤形における界面活性剤の量は、約5〜約15重量%である。好適な界面活性剤としては、モノオレイン酸ソルビタン、及び、疎水性塩基を用いた、その高分子量エチレンオキシド付加物(プロピレンオキシドとプロピレングリコールとの縮合により形成される)などのポリエチレンソルビタン脂肪酸エステルが挙げられる。
【0147】
薬学的に許容される賦形剤もまた、当業者には周知である。賦形剤は、化合物の種類や組成物の投与に使用される具体的な方法を幾分考慮して選択されるであろう。従って、本開示の医薬組成物においては、好適な剤形が多数考えられる。以下の方法及び賦形剤は単なる例示に過ぎず、これらに限定されない。薬学的に許容される賦形剤としては、有効成分の作用を阻害せず、不都合な副作用を引き起こさないものが好ましい。好適な基剤及び賦形剤としては、水、アルコール及びプロピレングリコール等の溶媒、固体の吸収剤及び希釈剤、界面活性剤、懸濁化剤、錠剤結合剤(tableting binders)、滑沢剤、フレーバー、並びに、着色剤が挙げられる。
【0148】
剤形は、単回投与用又は反復投与用として封をした容器(アンプル及びバイアル等)に封入してもよい。また、使用直前に水などの無菌液体賦形剤を添加するだけで注射可能となるフリーズドライ(凍結乾燥)状態で保存してもよい。無菌粉末、顆粒及び錠剤から、用時調製注射液及び懸濁液を調製してもよい。注射用組成物には有効な医薬基剤が必要であることは、当業者に周知である。Pharmaceutics and Pharmacy Practice,J.B.Lippincott Co.,Philadelphia,PA,Banker and Chalmers,Eds.,238−250(1982)、及び、ASHP Handbook on Injectable Drugs,Toissel,4th ed.,622−630(1986)を参照のこと。
【0149】
局所投与に適した剤形としては、一般的にはスクロース及びアラビアゴム又はトラガカントゴムといったフレーバー中に有効成分を含んでいる薬用ドロップ;ゼラチン及びグリセリン、又は、スクロース及びアラビアゴム等の不活性な主材料中に有効成分を含んでいる香錠;並びに、好適な液体基剤中に有効成分を含んでいる口内洗浄剤;さらに、有効成分に加えて当該技術分野で公知であるような基剤を含有しているクリーム、乳剤及びゲル剤が挙げられる。
【0150】
さらに、直腸投与に適した剤形を、乳化性の主材料又は水溶性の主材料などといった種々の主材料と混合することで坐薬として調製してもよい。膣投与に適した剤形を、有効成分に加えて当業者に公知の適当な基剤を含有させた膣坐薬、タンポン、クリーム、ゲル、ペースト、発泡体、又は、スプレー式剤形として調製してもよい。
【0151】
好適な医薬基剤については、当該分野の標準的な参考文献であるRemington’s Pharmaceutical Sciences,Mack Publishing Companyに記載されている。
【0152】
本開示において、動物、とりわけヒトへの投与量は、適度な期間にわたって体内で治療反応を引き起こすのに十分な量であるのが望ましい。投与量が、動物の体調や体重、さらには、治療される症状の重症度や段階などの種々の要因によって決定されることは当業者の解するところであろう。
【0153】
好適な投与量は、患者体内の活性物質の濃度に関して所望の反応を起こすとして知られている濃度をもたらす量である。扱いにくい副作用を起こすことなく、治療される症状を最大限抑制することとなる投与量が好ましい。
【0154】
投与量は、投与の経路、タイミング及び頻度、さらに、化合物の投与に伴って生じる何らかの不都合な副作用の有無、性質及び程度や所望の生理学的効果によっても決定される。
【0155】
本開示に係る化合物を投与するのに有用な薬学的投与形態は、以下のように説明される。
【0156】
ハードシェルカプセル
標準的な2ピース(two−piece)ハードゼラチンカプセル毎に、粉末状の有効成分100mg、ラクトース150mg、セルロース50mg、及び、ステアリン酸マグネシウム6mgを充填して、多数のカプセル単位を調製する。
【0157】
ソフトゼラチンカプセル
大豆油、綿実油又はオリーブ油等の消化可能なオイル中に有効成分を含ませて混合物を調製し、それを容積移送式ポンプで、溶かしたゼラチンに注入し、有効成分100mgを含有するソフトゼラチンカプセルを形成する。カプセルを洗浄し、乾燥させる。ポリエチレングリコールとグリセリンとソルビトールとの混合物に有効成分を溶解させ、水混和性の混合薬を調製してもよい。
【0158】
錠剤
有効成分100mg、コロイド二酸化ケイ素0.2mg、ステアリン酸マグネシウム5mg、微結晶セルロース275mg、デンプン11mg、及び、ラクトース98.8mgを含む投与単位となるように、従来の手順で多数の錠剤を調製する。嗜好性を増加させ、外観及び安定性を向上させるため、又は、吸収を遅らせるために適当な水性及び非水性コーティングを施してもよい。
【0159】
速放性(immediate release)錠剤/カプセル
従来のプロセスや新規のプロセスで調製される、経口投与用の固体投与形態である。これらの投与単位は、すぐに溶解して薬物を送達するので、水無しで経口的に摂取される。有効成分を、糖、ゼラチン、ペクチン及び甘味料などの成分を含有する液体に混合する。これらの液体を、フリーズドライ技術や固体状態で抽出する技術によって固体の錠剤又はカプレットへと固体化する。薬剤化合物を、粘弾性及び熱弾性の糖やポリマーあるいは起泡性成分と共に圧縮して、水無しで即時放出されるような多孔質マトリックスを調製してもよい。
【0160】
また、本開示の化合物は、点鼻薬、又は、定量吸入器や鼻腔用若しくは口腔用吸入器の形態で投与してもよい。薬剤は、細かい霧状の点鼻液、あるいはエアロゾル状の粉末によって送達してもよい。
【0161】
ここまで、本開示について例示し、説明した。また、本明細書では好ましい実施形態しか開示していないが、上述の通り、上記教示、及び/又は、関連技術の技術若しくは知識に相応する範囲において、様々な他の組み合わせ例、変形例及び環境のもとで本開示を用いることができ、本明細書に示した概念の範囲内であれば変更又は改変も可能であると解されるべきである。
【0162】
本明細書中、「含む(comprising)」という用語(及びその文法上の活用形)は、「有する(having)」又は「包含する(including)」という包括的な意味で用いられ、「のみから成る(consisting only of)」という限定的な意味では用いられない。本明細書中、「1つの(a)」(不定冠詞)及び「その(the)」(定冠詞)という用語は、単数と共に複数をも包含すると解される。
【0163】
さらに、上記実施形態は、実施するために現段階で分かっている最良の形態を説明することを意図したものであり、このような実施形態として、又は、別の実施形態として、さらには、具体的に適用若しくは使用するにあたって必要とされる各種の改変を施して、当業者が本開示を利用できるよう意図したものである。従って、本明細書に開示された形態に限定する意図はない。また、添付した特許請求の範囲は、代替の実施形態をも含むと解されるものである。
【0164】
本明細書に引用した全ての刊行物、特許文献及び特許出願文献は、各刊行物、特許文献又は特許出願文献をそれぞれ具体的に且つ個別に提示し、引用して援用するように、本明細書に引用され、任意のあらゆる目的に援用される。矛盾が生じる場合、本明細書が優先される。
【特許請求の範囲】
【請求項1】
下記式で表される化合物:
【化1】

[式中、A=C又はNであり、
B=C又はNであり、
X=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
Z=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ、ハロゲン、OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
E=(CH2)nONHR1であって、nは0〜6の整数であり、R1=アリール又はヘテロシクロであり、
W、Y、Rは、それぞれ独立して、H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ、ハロゲン、O、OH、Oアルキル、Oアリール、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)からなる群より選択されるが、但し、W、Y及びRのうち少なくとも1つはH及びNH2以外のものであって、W及びYは共に結びついて=Oとなっていてもよく、
Dはそれぞれ独立して、OH、Oアルキル、Oアリール、Fl及びHである]、
薬学的に許容されるその塩、そのプロドラッグ、及び、その混合物。
【請求項2】
N1−(3−フルオロフェニル)−イノシンである、請求項1に記載の化合物。
【請求項3】
5−アミノ−4−N−3−フルオロフェニルカルボキサミド−1−β−D−リボフラノシル−1H−イミダゾールである、請求項1に記載の化合物。
【請求項4】
3−エチニル−1−(β−D−リボフラノシル)−[1,2,4]トリアゾールである、請求項1に記載の化合物。
【請求項5】
1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノールである、請求項1に記載の化合物。
【請求項6】
1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノンである、請求項1に記載の化合物。
【請求項7】
3−(1,1−ジフルオロ−エチル)−1−β−D−リボフラノシル−[1,2,4]トリアゾールである、請求項1に記載の化合物。
【請求項8】
1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−2,2,2−トリフルオロエタノールである、請求項1に記載の化合物。
【請求項9】
3−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオンアミドである、請求項1に記載の化合物。
【請求項10】
請求項1に記載の化合物と薬学的に許容される基剤とを含む医薬組成物。
【請求項11】
請求項1に記載の化合物を少なくとも1つ患者に投与することにより、当該患者においてRNAウイルスポリメラーゼを阻害する方法。
【請求項12】
RNAウイルス感染患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つを有効量で当該患者に投与することを含む方法。
【請求項13】
インフルエンザ患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つを有効量で当該患者に投与することを含む方法。
【請求項14】
ハンターンウイルス患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つを有効量で当該患者に投与することを含む方法。
【請求項15】
クリミア・コンゴ出血熱ウイルス患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つを有効量で当該患者に投与することを含む方法。
【請求項16】
ブニヤウイルス科ウイルス患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つを有効量で当該患者に投与することを含む方法。
【請求項17】
RNAウイルスポリメラーゼを、その阻害を必要とする患者において阻害する方法であって、
請求項1に記載の化合物の少なくとも1つ、並びに、
インターフェロン(IFN)、インターフェロンα−2a、インターフェロンα−2b、コンセンサスインターフェロン(CIFN)、リバビリン、アマンタジン、リマンタジン、インターロイキン−12、ウルソデオキシコール酸(UDCA)及びグリシリジンからなる群より関連する(related from the group consisting of)さらに他の治療剤の少なくとも1つ
を有効量で当該患者に投与することを含む方法。
【請求項18】
RNAウイルス感染患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つ、並びに、
インターフェロン(IFN)、インターフェロンα−2a、インターフェロンα−2b、コンセンサスインターフェロン(CIFN)、リバビリン、アマンタジン、リマンタジン、インターロイキン−12、ウルソデオキシコール酸(UDCA)及びグリシリジンから選択されるさらに他の治療剤の少なくとも1つ
を有効量で当該患者に投与することを含む方法。
【請求項19】
前記RNAウイルス感染症は、インフルエンザ、ハンターンウイルス、クリミア・コンゴ出血熱ウイルス、HCV、HBV、コクサッキーA、コクサッキーB、エコー、ライノウイルス感染症、痘瘡ウイルス感染症、エボラウイルス感染症、ポリオウイルス感染症、及び西ナイルウイルス感染症からなる群より選択される少なくとも1つを含む、請求項18に記載の方法。
【請求項1】
下記式で表される化合物:
【化1】

[式中、A=C又はNであり、
B=C又はNであり、
X=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ;F、Cl、Br及びI等のハロゲン;OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
Z=H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ、ハロゲン、OH、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)であり、
E=(CH2)nONHR1であって、nは0〜6の整数であり、R1=アリール又はヘテロシクロであり、
W、Y、Rは、それぞれ独立して、H;C1−C6アルキル、シクロアルキル、アルケニル、シクロアルケニル、アルキニル、アリール、ヘテロシクロ、ハロゲン、O、OH、Oアルキル、Oアリール、NH2、NH−(C1−C6アルキル、シクロアルキル、アリール又はヘテロシクロ)からなる群より選択されるが、但し、W、Y及びRのうち少なくとも1つはH及びNH2以外のものであって、W及びYは共に結びついて=Oとなっていてもよく、
Dはそれぞれ独立して、OH、Oアルキル、Oアリール、Fl及びHである]、
薬学的に許容されるその塩、そのプロドラッグ、及び、その混合物。
【請求項2】
N1−(3−フルオロフェニル)−イノシンである、請求項1に記載の化合物。
【請求項3】
5−アミノ−4−N−3−フルオロフェニルカルボキサミド−1−β−D−リボフラノシル−1H−イミダゾールである、請求項1に記載の化合物。
【請求項4】
3−エチニル−1−(β−D−リボフラノシル)−[1,2,4]トリアゾールである、請求項1に記載の化合物。
【請求項5】
1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノールである、請求項1に記載の化合物。
【請求項6】
1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−フェニルメタノンである、請求項1に記載の化合物。
【請求項7】
3−(1,1−ジフルオロ−エチル)−1−β−D−リボフラノシル−[1,2,4]トリアゾールである、請求項1に記載の化合物。
【請求項8】
1−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−2,2,2−トリフルオロエタノールである、請求項1に記載の化合物。
【請求項9】
3−(1−β−D−リボフラノシル−[1,2,4]トリアゾール−3−イル)−3−ヒドロキシプロピオンアミドである、請求項1に記載の化合物。
【請求項10】
請求項1に記載の化合物と薬学的に許容される基剤とを含む医薬組成物。
【請求項11】
請求項1に記載の化合物を少なくとも1つ患者に投与することにより、当該患者においてRNAウイルスポリメラーゼを阻害する方法。
【請求項12】
RNAウイルス感染患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つを有効量で当該患者に投与することを含む方法。
【請求項13】
インフルエンザ患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つを有効量で当該患者に投与することを含む方法。
【請求項14】
ハンターンウイルス患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つを有効量で当該患者に投与することを含む方法。
【請求項15】
クリミア・コンゴ出血熱ウイルス患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つを有効量で当該患者に投与することを含む方法。
【請求項16】
ブニヤウイルス科ウイルス患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つを有効量で当該患者に投与することを含む方法。
【請求項17】
RNAウイルスポリメラーゼを、その阻害を必要とする患者において阻害する方法であって、
請求項1に記載の化合物の少なくとも1つ、並びに、
インターフェロン(IFN)、インターフェロンα−2a、インターフェロンα−2b、コンセンサスインターフェロン(CIFN)、リバビリン、アマンタジン、リマンタジン、インターロイキン−12、ウルソデオキシコール酸(UDCA)及びグリシリジンからなる群より関連する(related from the group consisting of)さらに他の治療剤の少なくとも1つ
を有効量で当該患者に投与することを含む方法。
【請求項18】
RNAウイルス感染患者を治療する方法であって、
請求項1に記載の化合物の少なくとも1つ、並びに、
インターフェロン(IFN)、インターフェロンα−2a、インターフェロンα−2b、コンセンサスインターフェロン(CIFN)、リバビリン、アマンタジン、リマンタジン、インターロイキン−12、ウルソデオキシコール酸(UDCA)及びグリシリジンから選択されるさらに他の治療剤の少なくとも1つ
を有効量で当該患者に投与することを含む方法。
【請求項19】
前記RNAウイルス感染症は、インフルエンザ、ハンターンウイルス、クリミア・コンゴ出血熱ウイルス、HCV、HBV、コクサッキーA、コクサッキーB、エコー、ライノウイルス感染症、痘瘡ウイルス感染症、エボラウイルス感染症、ポリオウイルス感染症、及び西ナイルウイルス感染症からなる群より選択される少なくとも1つを含む、請求項18に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2010−502748(P2010−502748A)
【公表日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願番号】特願2009−527620(P2009−527620)
【出願日】平成19年9月11日(2007.9.11)
【国際出願番号】PCT/US2007/078139
【国際公開番号】WO2008/067002
【国際公開日】平成20年6月5日(2008.6.5)
【出願人】(507258674)サザン リサーチ インスティテュート (11)
【出願人】(509069135)ニューメキシコ ステイト ユニバーシティ (1)
【Fターム(参考)】
【公表日】平成22年1月28日(2010.1.28)
【国際特許分類】
【出願日】平成19年9月11日(2007.9.11)
【国際出願番号】PCT/US2007/078139
【国際公開番号】WO2008/067002
【国際公開日】平成20年6月5日(2008.6.5)
【出願人】(507258674)サザン リサーチ インスティテュート (11)
【出願人】(509069135)ニューメキシコ ステイト ユニバーシティ (1)
【Fターム(参考)】
[ Back to top ]

