ハイブリダイゼーション法およびその装置
【課題】FISH法などの核酸のハイブリダイゼーションにおいて、通常一晩の処理を必要とするハイブリダイゼーション反応を短時間で済ませ、かつ安定性・再現性の高い処理方法を提供する。
【解決手段】標的核酸を固定した反応基板に検出用核酸を含むハイブリダイゼーション液を接触させることにより標的核酸と検出用核酸とをハイブリダイズさせる方法において、該ハイブリダイゼーション液の温度を調節して、該ハイブリダイゼーション液の温度を該標的核酸の温度に対して高い温度でハイブリダイズさせることを特徴とする、前記方法。
【解決手段】標的核酸を固定した反応基板に検出用核酸を含むハイブリダイゼーション液を接触させることにより標的核酸と検出用核酸とをハイブリダイズさせる方法において、該ハイブリダイゼーション液の温度を調節して、該ハイブリダイゼーション液の温度を該標的核酸の温度に対して高い温度でハイブリダイズさせることを特徴とする、前記方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、in situハイブリダイゼーション法、特にFISH(fluorescence in situ hybridization)法などの核酸のハイブリダイゼーション法において、ハイブリダイゼーションの安定性・再現性を高め、反応時間を大幅に短縮する方法およびその装置に関する。
【背景技術】
【0002】
近年の医療、分子生物学の進展により、ゲノム上の特定遺伝子の検出を応用した疾患の診断法や治療法などが実用化され始めている。通常の生物のDNAは、4種類の塩基、アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)がそれぞれ特異的に結合し、全体として相補的なDNA分子1対が結合した二重らせん構造をなしている。その駆動力は水素結合であり、A−T間では2個、G−C間では3個の水素結合によって結合する。
【0003】
代表的な検出法である蛍光in situハイブリダイゼーション(FISH)法では、スライドガラス等に固定したターゲット(標的核酸)を変性処理して一本鎖核酸とし、蛍光色素等で標識したDNAプローブ(検出用核酸)を滴下して反応基板上の一本鎖核酸とハイブリダイズさせ、未反応の標識核酸を除去して蛍光顕微鏡で観察する。
【0004】
核酸分子の解離・結合は配列に応じた特定の温度で起こり、昇温により解離し、降温によって再結合するが、変性後のハイブリダイゼーション反応を推進するためには適度な温度が必要である。ハイブリダイゼーションの温度は(1)プローブ核酸の流動性、(2)ブラウン運動による一本鎖核酸同士の会合機会、(3)ミスハイブリした核酸の結合を解離させ、正しいハイブリダイゼーションを促進する作用等の条件によって決定される。また、ハイブリダイズに要する時間は核酸の長さと温度に依存するが、一般的なDNA-DNAハイブリダイゼーションの場合、安定性を考慮すると反応時の温度は37〜42℃程度が適切であり、反応時間は数時間から一晩の処理を必要とする。
【0005】
病理組織検査では、ホルマリン固定パラフィン包埋標本を試料として用いることが多く、この場合には十分なシグナル強度が得られないことがある。非特許文献1ではマイクロ波迅速試料処理装置で300W、1時間(3秒照射、2秒停止)の間欠照射を行うことにより、ハイブリダイゼーションが迅速化し、ホルマリン固定パラフィン包埋細胞切片でも検出可能であるとしている。
【0006】
マイクロ波照射によるハイブリダイズの迅速化は、FISH法に限らず放射性標識プローブや免疫組織化学的な検出法におけるハイブリダイズや、DNAマイクロアレイ等のハイブリダイゼーションでも有効である。特許文献1では、DNAマイクロアレイにおいてガラス基板やシリコン基板上に固定された検出用核酸に対して標的核酸を滴下してハイブリダイゼーションを行う際に、反応領域をマイクロ波で加熱することによって、再現性を保持した上でハイブリダイゼーションを促進できるとしている。
【0007】
また特許文献2では、ホーンアンテナを用いて特定方向に電磁波を照射し、反応部を一定温度に保つことによってハイブリダイゼーションを加速する方法が開示されている。
【0008】
また特許文献3では、酵素によるDNA断片の連結(ライゲーション)に対してマイクロ波を照射することで迅速化する方法が開示されている。
【0009】
しかしながらこれらの方法では、反応系全体が均質であるという前提の下に、反応基板温度を検出することによって反応温度を推定する方式がとられており、マイクロ波の出力を増減したり、間欠駆動によって温度制御する方式をとっている。そのため実際のハイブリダイゼーション液の温度は未知であって、反応速度を正確に制御できないばかりか、生成物の安定性を損なう危険性がある。
【0010】
【非特許文献1】五十嵐久喜ほか,医学検査,Vol.51,No.3,212−215,2002
【特許文献1】特開2005−91251公報
【特許文献2】特開2005−218353公報
【特許文献3】特開2003−265175公報
【発明の開示】
【発明が解決しようとする課題】
【0011】
従来のマイクロ波を用いたハイブリダイゼーション法は、ハイブリダイゼーション液や標的核酸の温度を正確に把握しておらず、ハイブリダイズ中のプローブや標的核酸が想定以上の高温にさらされているという危険性があるため、ハイブリダイゼーション速度、並びにハイブリダイゼーションにおける試料(すなわち、二本鎖核酸)の安定性・再現性に問題があった。
【0012】
そこで、本発明は、ハイブリダイゼーションにおける試料の安定性・再現性を保持し、かつより効率的なハイブリダイゼーションを実現する方法及びその装置を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明者らは、上記問題を回避するため、反応基板に固定した標的核酸の温度とハイブリダイゼーション液の温度とを精密に測定することにより、ハイブリダイゼーションにおける試料の安定性・再現性を担保することを試み、その過程で、ハイブリダイゼーション液の温度に対して標的核酸の温度を低く保持することによってハイブリダイゼーションの反応速度を著しく向上することを見出し、本発明を完成させるに至った。
【0014】
すなわち、本発明は以下の特徴を包含する:
(1) 標的核酸を固定した反応基板に検出用核酸を含むハイブリダイゼーション液を接触させることにより標的核酸と検出用核酸とをハイブリダイズさせる方法において、該ハイブリダイゼーション液の温度を調節して、該ハイブリダイゼーション液の温度を該標的核酸の温度に対して高い温度でハイブリダイズさせることを特徴とする、前記方法。
【0015】
(2) 前記標的核酸と前記検出用核酸とを、前記ハイブリダイゼーション液の温度が前記反応基板の温度に対して0.1〜20℃高い温度でハイブリダイズさせることを特徴とする上記(1)記載の方法。
【0016】
(3) 前記ハイブリダイゼーション液の温度を、マイクロ波照射による加熱、及び該ハイブリダイゼーション液の加熱領域の温度の測定によって調節することを特徴とする上記(1)記載の方法。
【0017】
(4) 前記測定を、ハイブリダイゼーション液を被覆する固定部材の温度を測定することによって実施することを特徴とする上記(3)記載の方法。
【0018】
(5) 前記固定部材は、ハイブリダイゼーション液と接触する面に対抗する面上の少なくとも一部に反射率が既知の被膜を有することを特徴とする上記(4)記載の方法。
【0019】
(6) 前記標的核酸の温度を調節することをさらに含むことを特徴とする上記(1)記載の方法。
【0020】
(7) 前記標的核酸の温度調節を、前記反応基板の一部に接触した熱媒体の加熱・冷却、及び該反応基板又は熱媒体の温度の測定によって調節することを特徴とする上記(1)記載の方法。
【0021】
(8) 反応基板上に固定した標的核酸とハイブリダイゼーション液中に含まれる検出用核酸とをハイブリダイズさせるための装置であって、該ハイブリダイゼーション液の温度調節手段を具備するハイブリダイゼーション装置。
【0022】
(9) ハイブリダイゼーション液の温度調節手段は、ハイブリダイゼーション液を被覆する固定部材と、該ハイブリダイゼーション液にマイクロ波を照射するマイクロ波照射手段と、該固定部材の遠隔位置に設置された放射温度計と、該放射温度計により測定した該固定部材の温度に基づいて該マイクロ波照射を制御する手段と、を含むことを特徴とする上記(8)記載の装置。
【0023】
(10) 前記固定部材は、ハイブリダイゼーション液と接触する面に対抗する面上の少なくとも一部に反射率が既知の被膜を有することを特徴とする上記(9)記載の装置。
【0024】
(11) 前記標的核酸の温度調節手段をさらに具備する、上記(8)記載の装置。
【0025】
(12) 前記標的核酸の温度調節手段が、反応基板の一部に接触した熱媒体と、該熱媒体の加熱・冷却手段と、該熱媒体又は反応基板の温度測定手段と、該温度測定手段によって測定される温度に基づいて該加熱・冷却手段を制御する手段と、を含むことを特徴とする上記(11)記載の装置。
【発明の効果】
【0026】
本発明の方法及び装置によれば、ハイブリダイゼーションにおける試料の安定性・再現性を担保し、かつハイブリダイゼーション反応速度を飛躍的に向上させることができる。
【発明を実施するための最良の形態】
【0027】
「標的核酸」とは、本発明の方法又は装置により検出されるべき核酸を指す。前記標的核酸はDNAとRNAのいずれであってもよい。
【0028】
「検出用核酸」は、上記標的核酸を検出するための核酸を指す。前記検出用核酸としてDNA、RNA、DNA-RNAキメラのいずれを用いてもよい。検出用核酸は、必要に応じて、当業者に公知の方法により標識することができる。例えば、放射性同位元素、酵素、蛍光物質等による標識が挙げられ、この目的のために、これに限定されるものではないが、FITC、32P、アルカリホスファターゼ、ローダミン、フルオレサミン、ダンシル、インドカルボシアニン又はそれらの誘導体などが利用可能である。
【0029】
「標的核酸の温度」とは、ハイブリダイゼーション処理中の標的核酸の温度を指す。標的核酸の温度は、後述するように、典型的には該標的核酸を固定する反応基板の温度を測定することによって推定することができる。
【0030】
「ハイブリダイゼーション液の温度」とは、ハイブリダイゼーション処理中のハイブリダイゼーション液、特に加熱領域のハイブリダイゼーション液、の温度を指す。「加熱領域」とは、ハイブリダイゼーション液の全体ではなく、加熱されるハイブリダイゼーション液の局所領域を指す。ハイブリダイゼーション液の温度は、後述するように、典型的にはハイブリダイゼーション液を被覆する固定部材の温度を測定することによって推定することができる。
【0031】
以下、本発明のハイブリダイゼーション方法及び装置について説明する。
【0032】
本発明のハイブリダイゼーション方法は、標的核酸を固定した反応基板(例えば、スライドガラス、プラスチック基板、シリコン基板など)に検出用核酸を含むハイブリダイゼーション液を接触させることにより標的核酸と検出用核酸とをハイブリダイゼーションさせる方法において、ハイブリダイゼーション液の温度を標的核酸の温度に対して高い温度でハイブリダイズさせることを特徴とする。本発明において、ハイブリダイゼーション液と標的核酸との前記温度差は、ハイブリダイゼーション液の温度を調節することにより実施することができる。
【0033】
調節されるハイブリダイゼーション液の温度と標的核酸との温度差は、0.1〜20℃、好ましくは0.5℃〜10℃、より好ましくは1℃〜5℃、例えば1℃〜3.0℃となるように調節する。かかる温度差の範囲を実現することにより、標的核酸と検出用核酸とのハイブリダイゼーション速度を向上させることができる。
【0034】
ハイブリダイゼーション液の温度の適切な範囲は、適用するハイブリダイゼーション方法、検出対象とする核酸の長さ及び配列に応じて当業者が適宜設定することができる。このようなハイブリダイゼーション液の温度の適切な範囲は、当業者に公知であるか、当業者が適切に設定することができる。例えば、本発明の方法をin situハイブリダイゼーションに適用する場合には、ハイブリダイゼーションの安定性・再現性の観点から、ハイブリダイゼーション液の温度を30℃〜50℃、好ましくは35℃〜46℃、より好ましくは動植物では37℃〜42℃、微生物では37〜46℃に調節することが好ましい。
【0035】
ハイブリダイゼーション液の温度の調節は、ハイブリダイゼーション液の温度を適切な温度に維持することが可能であればその手法は問わない。本発明では、好ましくは、マイクロ波照射による加熱と、該ハイブリダイゼーション液の加熱領域の温度の測定との組合せによりハイブリダイゼーション液の温度を調節する。すなわち、マイクロ波照射の強度を、測定されるハイブリダイゼーション液の加熱領域の温度に基づいて制御することによりハイブリダイゼーション液の温度を調節することができる。この場合、加熱領域は、例えば、マイクロ波の照射部分の温度を指す。上記組合せが好ましいとする理由は以下の通りである。
【0036】
マイクロ波は、電波法で規定されている通り、0.1〜100cmの波長をもつ、300MHz〜300GHzの間の電磁波である。マイクロ波を物質に照射すると、水などの誘電損失の高い物質ではそのエネルギーを吸収して加熱される。誘電体の誘電損失は内部分極の外部電界への追従の遅れを生じ、この遅れが熱に変わる。分極の種類によって吸収する電磁波の周波数領域が異なり、マイクロ波を吸収する分極は比較大きな分子や分子団の配光分極や界面分極である。
【0037】
マイクロ波はある種の化学反応を劇的に加速することで知られており、触媒の表面に吸着した基質の反応が、マイクロ波による局所的な加熱効果によって加速したり、金属イオンが関与する錯体合成の反応時間が従来法では数時間かかっていた反応が、マイクロ波加熱反応では分単位で終了する例などが数多く報告されている。またハイブリダイゼーション反応におけるマイクロ波照射の効果として、ハイブリダイゼーション液中のプローブ分子と反応基板に固定された標的分子との間の相互作用に関与して、反応系の中の局所的熱効果によって、反応を加速させることが考えられる。このような理由から、マイクロ波はハイブリダイゼーション速度の向上に効果的である考えられるが、一般的にこの局所的熱効果は測定が困難であり、ハイブリダイゼーション液の温度が未知であることに起因して、ハイブリダイゼーションの安定性・再現性については問題であった。
【0038】
しかし、本発明では、ハイブリダイゼーション液の局所的な加熱領域を測定しながらマイクロ波照射を制御することにより試料の過剰な高温状態を回避することができるため、ハイブリダイゼーションの安定性・再現性には問題がなく、かつマイクロ波による上記有用な効果も期待できる。
【0039】
ハイブリダイゼーション液の温度の測定は、これに限定されるものではないが、以下のようにして実施することができる。即ち、ハイブリダイゼーション液を被覆する固定部材(例えばカバーガラスなど)の温度を測定することによって、ハイブリダイゼーション液の温度を推定することができる。前記固定部材の温度の測定は、例えば、放射温度計を用い、前記固定部材の遠隔位置から測定することができる。放射温度計を用いて測定する場合、前記固定部材の表面反射がないことが好ましいため、典型的には該固定部材の外表面に放射率が既知の被膜を設け、放射温度計によって該被膜の放射温度を測定する(測定法については、三栄レポート No.106, NEC三栄株式会社(2004)参照)。なおこの場合、前記放射温度計の視野角が前記被膜内に収まることに留意する。
【0040】
上記「放射率」とは、十分な厚さと平らな表面をもつ純粋物質と、同じ温度での完全黒体との単位面積当たり単位時間ごとに放射される全エネルギーの比を指す。かかる放射率が公知の被膜は当業者に公知である。本発明に使用することができる前記被膜は、放射率が公知でありかつマイクロ波照射を妨げないものであれば特に限定されず、例えば、黒体スプレー(THI-1B, タスコジャパン、放射率0.94)などを挙げることができる。また、固定部材上に上記被膜を設ける方法として、スプレーによる塗布のほか、ディッピングやはけ塗りによってもよい。また、被膜を設ける代わりに前記固定部材そのものの表面反射を抑え、放射率を安定させることも有効である。この場合、誘電損失の大きな材料や導電性の材料はマイクロ波照射によって温度上昇を招くのでふさわしくなく、2.45GHzにおける誘電損失が0.04以下の樹脂やフィラー、顔料などの組合せが好ましい。例えば低誘電損失ポリエステル樹脂にアニリンブラック等の有機顔料を混合して使用することができる。
【0041】
本発明に使用することができる固定部材は、例えばガラス、プラスチックなどを使用することができる。具体的に、固定部材として、透明なカバーガラスのほか、着色したカバーガラスなどを使用することができる。着色方法については上記の通りである。
【0042】
その他、ハイブリダイゼーション液の温度の調節は、カバーガラス上から赤外線を照射することによって行うことも可能である。ハイブリダイゼーション液は30〜50%の水を含むので、波長8〜13μmの赤外線を吸収するが、通常は1μm以下の厚みしかないので、十分な量の赤外線を吸収できないため、カバーガラス上に着色した被膜を形成するか、着色したカバーガラスを使用するとよい。この場合上記と同様の低誘電損失ポリエステル樹脂にアニリンブラック等の有機顔料を混合したものを使用することができる。
【0043】
本発明の方法は、標的核酸の温度を調節することをさらに含むことができる。これにより、標的核酸とハイブリダイゼーション液の温度差を正確に調節することができる。
【0044】
標的核酸の温度調節は、標的核酸の温度を適切な温度に維持することが可能であればその手法は問わない。例えば、標的核酸の温度は、該標的核酸が固定される反応基板を加熱・冷却することによって調節することができる。本発明では、好ましくは、反応基板の一部に接触した熱媒体の加熱・冷却、及び該熱媒体又は反応基板の温度の測定の組合せによって調節する。すなわち、熱媒体の加熱・冷却を、測定される熱媒体又は反応基板の温度に基づいて切り替えることにより、熱媒体の温度を調節し、それによって標的核酸の温度を調節することができる。この場合、熱媒体として液体、固体、気体の媒体を用いることが可能である。熱媒体を加熱・冷却する手段は、使用する熱媒体に応じて当業者が適宜選択することができる。本発明の方法に適当な熱媒体の例は、これに限定されるものではないが、水、フッ素系溶媒(例えば、フロリナート(住友3M)、ノベック(同)、ガルデン(ソルベイソクレシス)など)、熱伝導性セラミックス、乾燥空気、窒素などを挙げることができる。なお、標的核酸の温度は、前記のようにして設定したハイブリダイゼーション液の設定温度範囲に基づいて、両者の温度差が0.1〜20℃、好ましくは0.5℃〜10℃、より好ましくは1℃〜5℃、例えば1℃〜3.0℃となるように設定すればよい。
【0045】
本発明の方法によれば、標的核酸の温度とハイブリダイゼーション液の温度とを正確に推定することが可能であり、ハイブリダイゼーション液の温度に対して標的核酸の温度を低く保持することによって、ハイブリダイゼーションにおける試料の安定性を保ちながら、反応速度を向上させることができる。
【0046】
本発明のハイブリダイゼーション方法は、in situハイブリダイゼーションにおける核酸ハイブリダイゼーション、DNAマイクロアレイ法における核酸ハイブリダイゼーションなどに使用することができる。ただしDNAマイクロアレイの場合は、構造上、検出用核酸を基板に固定し、標的核酸を含むハイブリダイゼーション液を用いてハイブリダイズする。したがって、本発明の方法は、標的核酸を反応基板に固定して検出用核酸とのハイブリダイゼーションを行う方法のほか、検出用核酸を反応基板に固定して標的核酸とのハイブリダイゼーションを行う方法に使用してもよい。本発明の方法は、in situハイブリダイゼーション、特にFISH法に使用することが好ましい。
【0047】
ハイブリダイゼーション液の温度は、適用するハイブリダイゼーション法に応じて変化する。例えば、本発明の方法をin situハイブリダイゼーションに使用する場合には、30℃〜50℃、好ましくは35℃〜46℃、より好ましくは動植物では37℃〜42℃、微生物では37℃〜46℃に調節することが好ましい。標的核酸の温度の調節をさらに行う場合に、標的核酸の温度範囲をハイブリダイゼーション液の温度範囲に応じて設定することは上記の通りである。
【0048】
また本発明のin situハイブリダイゼーションの手順は、標的核酸とハイブリダイゼーション液との温度差を、上記適切な範囲に維持するほか、特別な方法を用いる必要はない。具体的には、反応基板に固定した標的核酸を、70℃〜75℃で変性し、検出用核酸を含むハイブリダイゼーション液を滴下してカバーガラスを載せ、ハイブリダイズした後、洗浄し、傾向顕微鏡で観察することにより実施することができる。この場合、本発明のハイブリダイゼーション液は、これに限定されるものではないが、例えば50〜60%ホルムアミド、10%硫酸デキストラン、2×SSC(クエン酸食塩水)およびプローブを含むことができる。標的核酸の反応基板への固定は当該技術分野で周知である。
【0049】
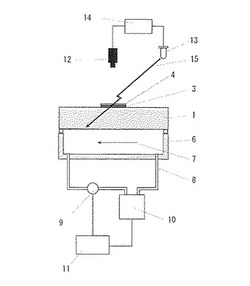
本発明はまた、反応基板上に固定した標的核酸とハイブリダイゼーション液中に含まれる検出用核酸とをハイブリダイズさせるための装置であって、ハイブリダイゼーションにおける試料の安定性・再現性を担保し、かつハイブリダイゼーション反応速度を向上させる前記ハイブリダイゼーション装置を提供することを目的とする。以下、本発明のハイブリダイゼーション装置の例の概略図(図1及び2)を参照しながら説明する。
【0050】
本発明のハイブリダイゼーション装置は、検出用核酸を含むハイブリダイゼーション液の温度調節手段を具備することを特徴とする。前述した通り、従来は反応基板温度を検出することによってハイブリダイゼーション温度を推定する方式が採用されていたが、本発明のハイブリダイゼーション装置は、ハイブリダイゼーション液の反応領域又は加熱領域の温度を直接調節する構成を具備するため、ハイブリダイゼーションにおける安定性・再現性の面で優れたものである。
【0051】
本発明の装置において、前記ハイブリダイゼーション液の温度調節手段は、該ハイブリダイゼーション液の加熱・冷却手段と、該ハイブリダイゼーション液の加熱領域の温度を測定する手段と、ハイブリダイゼーション液の温度に基づいて該加熱・冷却手段を切り替える制御手段とを備える任意の手段である。
【0052】
典型的に、本発明のハイブリダイゼーション液の温度調節手段は、ハイブリダイゼーション液(3)を被覆する固定部材(4)と、ハイブリダイゼーション液(3)にマイクロ波を照射するマイクロ波照射手段(13)と、固定部材(4)の遠隔位置に設置された放射温度計(12)と、マイクロ波照射を制御する手段(14)とを含むことができる。この場合、ハイブリダイゼーション液(3)の加熱領域の温度は、ハイブリダイゼーション液(3)を被覆する固定部材(4)の温度を測定することにより推定される。
【0053】
また放射温度計(12)による測定の便宜から、固定部材(4)の、ハイブリダイゼーション液と接触する面に対抗する面上に、反射率が既知の被膜(5)を設けることもできる。被膜(5)は、固定部材(4)全体又は少なくとも一部に設けることができる。
【0054】
固定部材(4)として、これに限定されるものではないが、例えば、カバーガラスなどを使用することができる。また本発明の装置に使用することができる被膜(5)は、放射率が既知でありかつマイクロ波の透過を妨げない限り特に制限されず、例えば黒体スプレー(THI-1B, タスコジャパン、放射率0.94)を使用することができる。ただし、マイクロ波照射による温度上昇を避けるために、低誘電損失(波長2.45GHzにおいて0.04以下)のバインダーやフィラー、顔料など材料を選ぶ必要がある。たとえば低誘電損失ポリエステル樹脂にアニリンブラックなどの有機顔料を混合して使用することができる。
【0055】
固定部材(4)の温度は、放射温度計(12)により測定され、この測定値に基づいてマイクロ波照射制御手段(14)がマイクロ波照射手段(13)の出力を制御することにより、ハイブリダイゼーション液(3)の加熱領域の温度を調節する。マイクロ波照射制御手段(14)には、放射温度計(12)で測定した温度をもとに出力をPID制御することによって固定部材(4)の温度を一定値に制御する動作をマイクロ波照射手段(13)に指示するプログラムを搭載させることができる。なお、設定温度範囲は検出用核酸の長さ及び配列に基づいて実施者が適宜設定することができる。
【0056】
前記放射温度計の位置は、前記固定部材又は被膜の鉛直線上に配置することが好ましい。前記固定部材上の被膜は薄いほうが好ましいが(数十μm程度)、表面反射が残りやすく、周囲の熱源からの赤外線が背景雑音として入射することがあるため、放射温度計を固定部材又は被膜に対して鉛直線上に配置することでこれを避けることができる。
【0057】
マイクロ波照射手段としては、シングルモードのマイクロ波照射装置が好ましい。マイクロ波源としては500W級のマグネトロン管(東芝ホクト電子製2M216など)や固体素子型マイクロ波源(エーイーティー製AMPS100-04-2450など)を使用することができる。
【0058】
本発明の装置は、標的核酸の温度調節手段をさらに具備することができる。これにより、標的核酸の温度とハイブリダイゼーション液の温度とをそれぞれ独立に制御することができ、効率的なハイブリダイゼーションを実現するハイブリダイゼーション液と標的核酸との温度差を正確に維持することができる。
【0059】
本発明の装置において、前記標的核酸の温度調節手段は、該標的核酸の加熱・冷却手段と、該標的核酸の温度測定手段と、該標的核酸の温度に応じて該加熱・冷却手段を切り替える制御する手段とを備える任意の手段である。
【0060】
かかる標的核酸の温度調節手段は、標的核酸を固定する反応基板の温度を調節することによって該標的核酸の温度を間接的に調節する手段であってもよい。
【0061】
典型的に、本発明の標的核酸の温度調節手段は、反応基板の一部に接触した熱媒体と、該熱媒体の加熱・冷却手段と、該熱媒体又は反応基板の温度測定手段と、加熱・冷却制御手段とを含む。即ち、この場合、標的核酸の温度は反応基板又は熱媒体の温度を測定することによって推定する。
【0062】
熱媒体の温度は、温度センサーなどの熱媒体の温度測定手段によって測定され、加熱・冷却制御手段がこの測定値に基づいて加熱・冷却手段の動作の切り替えを指示することによって熱媒体の温度を調節する。温度制御手段には、熱媒体の温度が設定温度範囲以下になった時点で加熱に切り替え、熱媒体の温度が設定温度以上になった時点で冷却に切り替えるような動作を加熱・冷却手段に実行させるプログラムを搭載させることができる。なお、設定温度範囲は、ハイブリダイゼーション液の設定温度範囲に基づき、ハイブリダイゼーション液の設定温度と熱媒体の設定温度とが、上記の温度差を維持するような範囲に設定するものとする。このとき、設定温度と温度差の制御をマイクロコンピューターで行ってもよい。
【0063】
熱媒体としては、固体、液体、又は気体のいずれを用いてもよい。
【0064】
本発明の標的核酸の温度調節手段は、熱媒体(7)として液体を使用する場合には、該液体を収容する熱媒体容器(6)をさらに有することができる。この場合、熱媒体容器(6)は、収容する液体が反応基板(1)の標的核酸を固定した面に対抗する面に接するように配置することが好ましい。また熱媒体容器(6)に液体が循環する循環路(8)を設け、この循環路の領域で温度の調節及び測定を行うことができるように前記温度測定手段(9)と前記加熱・冷却手段(10)とを設けてもよい。
【0065】
熱媒体に使用する液体としては水を用いてもよいが、マイクロ波電力の多くの部分が循環水に吸収されることになるので、循環水の冷却機構が必須である。熱媒体としての液体はマイクロ波の損失が少ないフッ素系溶媒(例えば、フロリナート(住友3M)、ノベック(同)、ガルデン(ソルベイソクレシス)など)が望ましい。
【0066】
また、熱媒体として熱伝導率がよく、マイクロ波損失の少ない熱伝導性セラミックスを用いることもできる。加熱・冷却手段としてはペルチェ素子を用いた電子加熱冷却装置、温度検出手段としては熱電対温度センサー等を熱伝導性セラミックスに設置することで全固体化できる。また、前記反応基板の下方から乾燥空気や窒素を熱媒体として用いて吹きつけることにより、加熱冷却を行うことも可能である。
【0067】
その他、本発明の装置に適当な熱媒体の例は、これに限定されるものではないが、水、フッ素系溶媒、熱伝導性セラミックス、乾燥空気、窒素などのほかに、温度制御を伴わない良熱伝導性ステージなどを挙げることができる。温度制御を伴わない良熱伝導性のステージはハイブリダイゼーション液(3)の温度に対して、低い温度を反応基板(1)に与えることができる。構造上、反応基板の温度がハイブリダイゼーション液の温度に対して一定の範囲で低く保たれる場合には、マイクロコンピューター等の制御を必要としない。また、反応基板の温度測定手段としては熱媒体の温度を熱電対等で測定する方法のほか、反応基板の温度を直接測定することもできる。一例として反応基板の表面または裏面の一部に形成した放射率が既知の被膜の表面温度を、遠隔位置から放射温度計で非接触的に測定することができる。
【0068】
前記加熱・冷却手段は、選択される熱媒体に応じて当業者が適宜選択することができる。
【0069】
以下、実施例を用いて本発明をより詳細に説明するが、本発明の範囲は以下の実施例に限定されない。
【実施例】
【0070】
本実施例では、本発明によるハイブリダイゼーション方法の有用性の評価を行った。
【0071】
スライドガラス(1)上に、マウス(オス)の細胞(2)を固定し、標本を70℃ホットプレート上で2時間ハードニングした。次に70℃の70%ホルムアミド/2×SSC中で2分間変性処理後、氷冷した70%エタノールに5分浸漬し、DNAを一本鎖にした。別の70%エタノールで洗った後、100%エタノールに5分浸漬後風乾した。
【0072】
蛍光色素Cy3(Indocarbocyanine)で標識したセントロメア用プローブを含有するハイブリダイゼーション液(3)(組成:50〜60%ホルムアミド、10%硫酸デキストラン、2×SSC(クエン酸食塩水)およびプローブ)をチューブに入れ、75℃で10分変性処理後、5分以上氷冷した。
【0073】
ターゲット(2)に上記ハイブリダイゼーション液(3)を10μlアプライし、カバーグラス(4)をかけ、37℃でハイブリダイゼーションを行った。カバーガラス(4)は、黒体スプレー(5)を均一に塗抹したものを使用した。
【0074】
ハイブリダイゼーションは、シングルモードマイクロ波照射装置(13)(エーイーティー製マイクロ波加熱装置AMH2450-001)で160Wのマイクロ波(15)を照射しながら行った。プレパラート(1、2、3及び4)はポリプロピレン製容器に入れ、プレパラートの下に恒温槽(6)で温めた34℃前後の水(7)を通した。マイクロ波照射中、放射温度計(12)でカバーガラス(4)上を測定し、37℃になるように温度を調節した。
【0075】
カバーガラス(4)上の温度をハイブリダイゼーション液(3)の温度とし、マイクロ波照射装置から出てきた水の温度を熱電対温度計(9)で測定し、反応基板(1)の温度とした。ハイブリダイゼーション液(3)の温度と反応基板(1)の温度の差は1.0〜3.0℃の間だった。
【0076】
2×SSC中5分浸漬しカバーグラス(4)を静かにはずし、37℃の50%ホルムアミド/2×SSC中20分浸漬した。2×SSCですすいだ後、1×SSC中15分浸漬し、DAPI染色後、落射式蛍光顕微鏡で観察した。
【0077】
同様の手順で、マイクロ波を用いない通常のハイブリダイゼーションを、恒温機中で乾燥しないように水のはいった容器を入れて行った。
【0078】
セントロメアのプローブ部位のみモニター上で検出できるように、バックグラウンドを調整後、露光時間を統一し(760ミリ秒)、染色体の画像を取り込み、細胞全体のプローブ輝度を計測した。計測した値を一元配置分散分析で有意差検定を行い、さらにダンカン多重検定を行った(n=10、p<0.05)。
【0079】
表1と図3に結果を示した。染色体のハイブリダイゼーションは通常、恒温機で一晩行う(オーバーナイト)。セントロメア用のプローブは恒温機3時間でもある程度の輝度が検出されるが、恒温機一晩、マイクロ波1時間、マイクロ波2時間、マイクロ波3時間のハイブリダイゼーションより有意に輝度の値が低く、検鏡の結果もセントロメアがはっきり観察されなかった。
【0080】
一方、マイクロ波0.5時間照射では、恒温機一晩、マイクロ波1時間、マイクロ波2時間のハイブリダイゼーションと同程度の輝度があったが(有意差なし)、マイクロ波1時間ハイブリダイゼーションのほうがプローブの輝度が十分に検出されていた。
【0081】
以上のことから、マイクロ波を照射しながらハイブリダイゼーションを行うことにより、通常一晩行うハイブリダイゼーションを1時間に短縮できることが示された。
【0082】
表1にハイブリダイゼーションの方法・時間と検出されたプローブの輝度の実測値を示す。
【0083】
【表1】

【0084】
図3にハイブリダイゼーションの方法・時間と検出されたプローブの輝度の相対値を示す。恒温機一晩ハイブリダイゼーションした輝度の平均を100%としたときのそれぞれの条件の平均を相対値で表した。
【図面の簡単な説明】
【0085】
【図1】図1はハイブリダイゼーション法の基本操作を説明するイラスト図を示す。
【図2】図2は本発明のハイブリダイゼーション装置の一例の断面模式図を示す。
【図3】図3は本発明の方法によるプローブ輝度と慣用のハイブリダイゼーション方法によるプローブ輝度との比較を示す。
【符号の説明】
【0086】
1 反応基板
2 標的核酸
3 ハイブリダイゼーション液
4 固定部材
5 被膜
6 熱媒体容器
7 熱媒体
8 熱媒体循環路
9 温度測定手段
10 加熱・冷却手段
11 加熱・冷却制御手段
12 放射温度計
13 マイクロ波照射装置
14 マイクロ波照射制御手段
15 マイクロ波
【技術分野】
【0001】
本発明は、in situハイブリダイゼーション法、特にFISH(fluorescence in situ hybridization)法などの核酸のハイブリダイゼーション法において、ハイブリダイゼーションの安定性・再現性を高め、反応時間を大幅に短縮する方法およびその装置に関する。
【背景技術】
【0002】
近年の医療、分子生物学の進展により、ゲノム上の特定遺伝子の検出を応用した疾患の診断法や治療法などが実用化され始めている。通常の生物のDNAは、4種類の塩基、アデニン(A)、チミン(T)、グアニン(G)、シトシン(C)がそれぞれ特異的に結合し、全体として相補的なDNA分子1対が結合した二重らせん構造をなしている。その駆動力は水素結合であり、A−T間では2個、G−C間では3個の水素結合によって結合する。
【0003】
代表的な検出法である蛍光in situハイブリダイゼーション(FISH)法では、スライドガラス等に固定したターゲット(標的核酸)を変性処理して一本鎖核酸とし、蛍光色素等で標識したDNAプローブ(検出用核酸)を滴下して反応基板上の一本鎖核酸とハイブリダイズさせ、未反応の標識核酸を除去して蛍光顕微鏡で観察する。
【0004】
核酸分子の解離・結合は配列に応じた特定の温度で起こり、昇温により解離し、降温によって再結合するが、変性後のハイブリダイゼーション反応を推進するためには適度な温度が必要である。ハイブリダイゼーションの温度は(1)プローブ核酸の流動性、(2)ブラウン運動による一本鎖核酸同士の会合機会、(3)ミスハイブリした核酸の結合を解離させ、正しいハイブリダイゼーションを促進する作用等の条件によって決定される。また、ハイブリダイズに要する時間は核酸の長さと温度に依存するが、一般的なDNA-DNAハイブリダイゼーションの場合、安定性を考慮すると反応時の温度は37〜42℃程度が適切であり、反応時間は数時間から一晩の処理を必要とする。
【0005】
病理組織検査では、ホルマリン固定パラフィン包埋標本を試料として用いることが多く、この場合には十分なシグナル強度が得られないことがある。非特許文献1ではマイクロ波迅速試料処理装置で300W、1時間(3秒照射、2秒停止)の間欠照射を行うことにより、ハイブリダイゼーションが迅速化し、ホルマリン固定パラフィン包埋細胞切片でも検出可能であるとしている。
【0006】
マイクロ波照射によるハイブリダイズの迅速化は、FISH法に限らず放射性標識プローブや免疫組織化学的な検出法におけるハイブリダイズや、DNAマイクロアレイ等のハイブリダイゼーションでも有効である。特許文献1では、DNAマイクロアレイにおいてガラス基板やシリコン基板上に固定された検出用核酸に対して標的核酸を滴下してハイブリダイゼーションを行う際に、反応領域をマイクロ波で加熱することによって、再現性を保持した上でハイブリダイゼーションを促進できるとしている。
【0007】
また特許文献2では、ホーンアンテナを用いて特定方向に電磁波を照射し、反応部を一定温度に保つことによってハイブリダイゼーションを加速する方法が開示されている。
【0008】
また特許文献3では、酵素によるDNA断片の連結(ライゲーション)に対してマイクロ波を照射することで迅速化する方法が開示されている。
【0009】
しかしながらこれらの方法では、反応系全体が均質であるという前提の下に、反応基板温度を検出することによって反応温度を推定する方式がとられており、マイクロ波の出力を増減したり、間欠駆動によって温度制御する方式をとっている。そのため実際のハイブリダイゼーション液の温度は未知であって、反応速度を正確に制御できないばかりか、生成物の安定性を損なう危険性がある。
【0010】
【非特許文献1】五十嵐久喜ほか,医学検査,Vol.51,No.3,212−215,2002
【特許文献1】特開2005−91251公報
【特許文献2】特開2005−218353公報
【特許文献3】特開2003−265175公報
【発明の開示】
【発明が解決しようとする課題】
【0011】
従来のマイクロ波を用いたハイブリダイゼーション法は、ハイブリダイゼーション液や標的核酸の温度を正確に把握しておらず、ハイブリダイズ中のプローブや標的核酸が想定以上の高温にさらされているという危険性があるため、ハイブリダイゼーション速度、並びにハイブリダイゼーションにおける試料(すなわち、二本鎖核酸)の安定性・再現性に問題があった。
【0012】
そこで、本発明は、ハイブリダイゼーションにおける試料の安定性・再現性を保持し、かつより効率的なハイブリダイゼーションを実現する方法及びその装置を提供することを目的とする。
【課題を解決するための手段】
【0013】
本発明者らは、上記問題を回避するため、反応基板に固定した標的核酸の温度とハイブリダイゼーション液の温度とを精密に測定することにより、ハイブリダイゼーションにおける試料の安定性・再現性を担保することを試み、その過程で、ハイブリダイゼーション液の温度に対して標的核酸の温度を低く保持することによってハイブリダイゼーションの反応速度を著しく向上することを見出し、本発明を完成させるに至った。
【0014】
すなわち、本発明は以下の特徴を包含する:
(1) 標的核酸を固定した反応基板に検出用核酸を含むハイブリダイゼーション液を接触させることにより標的核酸と検出用核酸とをハイブリダイズさせる方法において、該ハイブリダイゼーション液の温度を調節して、該ハイブリダイゼーション液の温度を該標的核酸の温度に対して高い温度でハイブリダイズさせることを特徴とする、前記方法。
【0015】
(2) 前記標的核酸と前記検出用核酸とを、前記ハイブリダイゼーション液の温度が前記反応基板の温度に対して0.1〜20℃高い温度でハイブリダイズさせることを特徴とする上記(1)記載の方法。
【0016】
(3) 前記ハイブリダイゼーション液の温度を、マイクロ波照射による加熱、及び該ハイブリダイゼーション液の加熱領域の温度の測定によって調節することを特徴とする上記(1)記載の方法。
【0017】
(4) 前記測定を、ハイブリダイゼーション液を被覆する固定部材の温度を測定することによって実施することを特徴とする上記(3)記載の方法。
【0018】
(5) 前記固定部材は、ハイブリダイゼーション液と接触する面に対抗する面上の少なくとも一部に反射率が既知の被膜を有することを特徴とする上記(4)記載の方法。
【0019】
(6) 前記標的核酸の温度を調節することをさらに含むことを特徴とする上記(1)記載の方法。
【0020】
(7) 前記標的核酸の温度調節を、前記反応基板の一部に接触した熱媒体の加熱・冷却、及び該反応基板又は熱媒体の温度の測定によって調節することを特徴とする上記(1)記載の方法。
【0021】
(8) 反応基板上に固定した標的核酸とハイブリダイゼーション液中に含まれる検出用核酸とをハイブリダイズさせるための装置であって、該ハイブリダイゼーション液の温度調節手段を具備するハイブリダイゼーション装置。
【0022】
(9) ハイブリダイゼーション液の温度調節手段は、ハイブリダイゼーション液を被覆する固定部材と、該ハイブリダイゼーション液にマイクロ波を照射するマイクロ波照射手段と、該固定部材の遠隔位置に設置された放射温度計と、該放射温度計により測定した該固定部材の温度に基づいて該マイクロ波照射を制御する手段と、を含むことを特徴とする上記(8)記載の装置。
【0023】
(10) 前記固定部材は、ハイブリダイゼーション液と接触する面に対抗する面上の少なくとも一部に反射率が既知の被膜を有することを特徴とする上記(9)記載の装置。
【0024】
(11) 前記標的核酸の温度調節手段をさらに具備する、上記(8)記載の装置。
【0025】
(12) 前記標的核酸の温度調節手段が、反応基板の一部に接触した熱媒体と、該熱媒体の加熱・冷却手段と、該熱媒体又は反応基板の温度測定手段と、該温度測定手段によって測定される温度に基づいて該加熱・冷却手段を制御する手段と、を含むことを特徴とする上記(11)記載の装置。
【発明の効果】
【0026】
本発明の方法及び装置によれば、ハイブリダイゼーションにおける試料の安定性・再現性を担保し、かつハイブリダイゼーション反応速度を飛躍的に向上させることができる。
【発明を実施するための最良の形態】
【0027】
「標的核酸」とは、本発明の方法又は装置により検出されるべき核酸を指す。前記標的核酸はDNAとRNAのいずれであってもよい。
【0028】
「検出用核酸」は、上記標的核酸を検出するための核酸を指す。前記検出用核酸としてDNA、RNA、DNA-RNAキメラのいずれを用いてもよい。検出用核酸は、必要に応じて、当業者に公知の方法により標識することができる。例えば、放射性同位元素、酵素、蛍光物質等による標識が挙げられ、この目的のために、これに限定されるものではないが、FITC、32P、アルカリホスファターゼ、ローダミン、フルオレサミン、ダンシル、インドカルボシアニン又はそれらの誘導体などが利用可能である。
【0029】
「標的核酸の温度」とは、ハイブリダイゼーション処理中の標的核酸の温度を指す。標的核酸の温度は、後述するように、典型的には該標的核酸を固定する反応基板の温度を測定することによって推定することができる。
【0030】
「ハイブリダイゼーション液の温度」とは、ハイブリダイゼーション処理中のハイブリダイゼーション液、特に加熱領域のハイブリダイゼーション液、の温度を指す。「加熱領域」とは、ハイブリダイゼーション液の全体ではなく、加熱されるハイブリダイゼーション液の局所領域を指す。ハイブリダイゼーション液の温度は、後述するように、典型的にはハイブリダイゼーション液を被覆する固定部材の温度を測定することによって推定することができる。
【0031】
以下、本発明のハイブリダイゼーション方法及び装置について説明する。
【0032】
本発明のハイブリダイゼーション方法は、標的核酸を固定した反応基板(例えば、スライドガラス、プラスチック基板、シリコン基板など)に検出用核酸を含むハイブリダイゼーション液を接触させることにより標的核酸と検出用核酸とをハイブリダイゼーションさせる方法において、ハイブリダイゼーション液の温度を標的核酸の温度に対して高い温度でハイブリダイズさせることを特徴とする。本発明において、ハイブリダイゼーション液と標的核酸との前記温度差は、ハイブリダイゼーション液の温度を調節することにより実施することができる。
【0033】
調節されるハイブリダイゼーション液の温度と標的核酸との温度差は、0.1〜20℃、好ましくは0.5℃〜10℃、より好ましくは1℃〜5℃、例えば1℃〜3.0℃となるように調節する。かかる温度差の範囲を実現することにより、標的核酸と検出用核酸とのハイブリダイゼーション速度を向上させることができる。
【0034】
ハイブリダイゼーション液の温度の適切な範囲は、適用するハイブリダイゼーション方法、検出対象とする核酸の長さ及び配列に応じて当業者が適宜設定することができる。このようなハイブリダイゼーション液の温度の適切な範囲は、当業者に公知であるか、当業者が適切に設定することができる。例えば、本発明の方法をin situハイブリダイゼーションに適用する場合には、ハイブリダイゼーションの安定性・再現性の観点から、ハイブリダイゼーション液の温度を30℃〜50℃、好ましくは35℃〜46℃、より好ましくは動植物では37℃〜42℃、微生物では37〜46℃に調節することが好ましい。
【0035】
ハイブリダイゼーション液の温度の調節は、ハイブリダイゼーション液の温度を適切な温度に維持することが可能であればその手法は問わない。本発明では、好ましくは、マイクロ波照射による加熱と、該ハイブリダイゼーション液の加熱領域の温度の測定との組合せによりハイブリダイゼーション液の温度を調節する。すなわち、マイクロ波照射の強度を、測定されるハイブリダイゼーション液の加熱領域の温度に基づいて制御することによりハイブリダイゼーション液の温度を調節することができる。この場合、加熱領域は、例えば、マイクロ波の照射部分の温度を指す。上記組合せが好ましいとする理由は以下の通りである。
【0036】
マイクロ波は、電波法で規定されている通り、0.1〜100cmの波長をもつ、300MHz〜300GHzの間の電磁波である。マイクロ波を物質に照射すると、水などの誘電損失の高い物質ではそのエネルギーを吸収して加熱される。誘電体の誘電損失は内部分極の外部電界への追従の遅れを生じ、この遅れが熱に変わる。分極の種類によって吸収する電磁波の周波数領域が異なり、マイクロ波を吸収する分極は比較大きな分子や分子団の配光分極や界面分極である。
【0037】
マイクロ波はある種の化学反応を劇的に加速することで知られており、触媒の表面に吸着した基質の反応が、マイクロ波による局所的な加熱効果によって加速したり、金属イオンが関与する錯体合成の反応時間が従来法では数時間かかっていた反応が、マイクロ波加熱反応では分単位で終了する例などが数多く報告されている。またハイブリダイゼーション反応におけるマイクロ波照射の効果として、ハイブリダイゼーション液中のプローブ分子と反応基板に固定された標的分子との間の相互作用に関与して、反応系の中の局所的熱効果によって、反応を加速させることが考えられる。このような理由から、マイクロ波はハイブリダイゼーション速度の向上に効果的である考えられるが、一般的にこの局所的熱効果は測定が困難であり、ハイブリダイゼーション液の温度が未知であることに起因して、ハイブリダイゼーションの安定性・再現性については問題であった。
【0038】
しかし、本発明では、ハイブリダイゼーション液の局所的な加熱領域を測定しながらマイクロ波照射を制御することにより試料の過剰な高温状態を回避することができるため、ハイブリダイゼーションの安定性・再現性には問題がなく、かつマイクロ波による上記有用な効果も期待できる。
【0039】
ハイブリダイゼーション液の温度の測定は、これに限定されるものではないが、以下のようにして実施することができる。即ち、ハイブリダイゼーション液を被覆する固定部材(例えばカバーガラスなど)の温度を測定することによって、ハイブリダイゼーション液の温度を推定することができる。前記固定部材の温度の測定は、例えば、放射温度計を用い、前記固定部材の遠隔位置から測定することができる。放射温度計を用いて測定する場合、前記固定部材の表面反射がないことが好ましいため、典型的には該固定部材の外表面に放射率が既知の被膜を設け、放射温度計によって該被膜の放射温度を測定する(測定法については、三栄レポート No.106, NEC三栄株式会社(2004)参照)。なおこの場合、前記放射温度計の視野角が前記被膜内に収まることに留意する。
【0040】
上記「放射率」とは、十分な厚さと平らな表面をもつ純粋物質と、同じ温度での完全黒体との単位面積当たり単位時間ごとに放射される全エネルギーの比を指す。かかる放射率が公知の被膜は当業者に公知である。本発明に使用することができる前記被膜は、放射率が公知でありかつマイクロ波照射を妨げないものであれば特に限定されず、例えば、黒体スプレー(THI-1B, タスコジャパン、放射率0.94)などを挙げることができる。また、固定部材上に上記被膜を設ける方法として、スプレーによる塗布のほか、ディッピングやはけ塗りによってもよい。また、被膜を設ける代わりに前記固定部材そのものの表面反射を抑え、放射率を安定させることも有効である。この場合、誘電損失の大きな材料や導電性の材料はマイクロ波照射によって温度上昇を招くのでふさわしくなく、2.45GHzにおける誘電損失が0.04以下の樹脂やフィラー、顔料などの組合せが好ましい。例えば低誘電損失ポリエステル樹脂にアニリンブラック等の有機顔料を混合して使用することができる。
【0041】
本発明に使用することができる固定部材は、例えばガラス、プラスチックなどを使用することができる。具体的に、固定部材として、透明なカバーガラスのほか、着色したカバーガラスなどを使用することができる。着色方法については上記の通りである。
【0042】
その他、ハイブリダイゼーション液の温度の調節は、カバーガラス上から赤外線を照射することによって行うことも可能である。ハイブリダイゼーション液は30〜50%の水を含むので、波長8〜13μmの赤外線を吸収するが、通常は1μm以下の厚みしかないので、十分な量の赤外線を吸収できないため、カバーガラス上に着色した被膜を形成するか、着色したカバーガラスを使用するとよい。この場合上記と同様の低誘電損失ポリエステル樹脂にアニリンブラック等の有機顔料を混合したものを使用することができる。
【0043】
本発明の方法は、標的核酸の温度を調節することをさらに含むことができる。これにより、標的核酸とハイブリダイゼーション液の温度差を正確に調節することができる。
【0044】
標的核酸の温度調節は、標的核酸の温度を適切な温度に維持することが可能であればその手法は問わない。例えば、標的核酸の温度は、該標的核酸が固定される反応基板を加熱・冷却することによって調節することができる。本発明では、好ましくは、反応基板の一部に接触した熱媒体の加熱・冷却、及び該熱媒体又は反応基板の温度の測定の組合せによって調節する。すなわち、熱媒体の加熱・冷却を、測定される熱媒体又は反応基板の温度に基づいて切り替えることにより、熱媒体の温度を調節し、それによって標的核酸の温度を調節することができる。この場合、熱媒体として液体、固体、気体の媒体を用いることが可能である。熱媒体を加熱・冷却する手段は、使用する熱媒体に応じて当業者が適宜選択することができる。本発明の方法に適当な熱媒体の例は、これに限定されるものではないが、水、フッ素系溶媒(例えば、フロリナート(住友3M)、ノベック(同)、ガルデン(ソルベイソクレシス)など)、熱伝導性セラミックス、乾燥空気、窒素などを挙げることができる。なお、標的核酸の温度は、前記のようにして設定したハイブリダイゼーション液の設定温度範囲に基づいて、両者の温度差が0.1〜20℃、好ましくは0.5℃〜10℃、より好ましくは1℃〜5℃、例えば1℃〜3.0℃となるように設定すればよい。
【0045】
本発明の方法によれば、標的核酸の温度とハイブリダイゼーション液の温度とを正確に推定することが可能であり、ハイブリダイゼーション液の温度に対して標的核酸の温度を低く保持することによって、ハイブリダイゼーションにおける試料の安定性を保ちながら、反応速度を向上させることができる。
【0046】
本発明のハイブリダイゼーション方法は、in situハイブリダイゼーションにおける核酸ハイブリダイゼーション、DNAマイクロアレイ法における核酸ハイブリダイゼーションなどに使用することができる。ただしDNAマイクロアレイの場合は、構造上、検出用核酸を基板に固定し、標的核酸を含むハイブリダイゼーション液を用いてハイブリダイズする。したがって、本発明の方法は、標的核酸を反応基板に固定して検出用核酸とのハイブリダイゼーションを行う方法のほか、検出用核酸を反応基板に固定して標的核酸とのハイブリダイゼーションを行う方法に使用してもよい。本発明の方法は、in situハイブリダイゼーション、特にFISH法に使用することが好ましい。
【0047】
ハイブリダイゼーション液の温度は、適用するハイブリダイゼーション法に応じて変化する。例えば、本発明の方法をin situハイブリダイゼーションに使用する場合には、30℃〜50℃、好ましくは35℃〜46℃、より好ましくは動植物では37℃〜42℃、微生物では37℃〜46℃に調節することが好ましい。標的核酸の温度の調節をさらに行う場合に、標的核酸の温度範囲をハイブリダイゼーション液の温度範囲に応じて設定することは上記の通りである。
【0048】
また本発明のin situハイブリダイゼーションの手順は、標的核酸とハイブリダイゼーション液との温度差を、上記適切な範囲に維持するほか、特別な方法を用いる必要はない。具体的には、反応基板に固定した標的核酸を、70℃〜75℃で変性し、検出用核酸を含むハイブリダイゼーション液を滴下してカバーガラスを載せ、ハイブリダイズした後、洗浄し、傾向顕微鏡で観察することにより実施することができる。この場合、本発明のハイブリダイゼーション液は、これに限定されるものではないが、例えば50〜60%ホルムアミド、10%硫酸デキストラン、2×SSC(クエン酸食塩水)およびプローブを含むことができる。標的核酸の反応基板への固定は当該技術分野で周知である。
【0049】
本発明はまた、反応基板上に固定した標的核酸とハイブリダイゼーション液中に含まれる検出用核酸とをハイブリダイズさせるための装置であって、ハイブリダイゼーションにおける試料の安定性・再現性を担保し、かつハイブリダイゼーション反応速度を向上させる前記ハイブリダイゼーション装置を提供することを目的とする。以下、本発明のハイブリダイゼーション装置の例の概略図(図1及び2)を参照しながら説明する。
【0050】
本発明のハイブリダイゼーション装置は、検出用核酸を含むハイブリダイゼーション液の温度調節手段を具備することを特徴とする。前述した通り、従来は反応基板温度を検出することによってハイブリダイゼーション温度を推定する方式が採用されていたが、本発明のハイブリダイゼーション装置は、ハイブリダイゼーション液の反応領域又は加熱領域の温度を直接調節する構成を具備するため、ハイブリダイゼーションにおける安定性・再現性の面で優れたものである。
【0051】
本発明の装置において、前記ハイブリダイゼーション液の温度調節手段は、該ハイブリダイゼーション液の加熱・冷却手段と、該ハイブリダイゼーション液の加熱領域の温度を測定する手段と、ハイブリダイゼーション液の温度に基づいて該加熱・冷却手段を切り替える制御手段とを備える任意の手段である。
【0052】
典型的に、本発明のハイブリダイゼーション液の温度調節手段は、ハイブリダイゼーション液(3)を被覆する固定部材(4)と、ハイブリダイゼーション液(3)にマイクロ波を照射するマイクロ波照射手段(13)と、固定部材(4)の遠隔位置に設置された放射温度計(12)と、マイクロ波照射を制御する手段(14)とを含むことができる。この場合、ハイブリダイゼーション液(3)の加熱領域の温度は、ハイブリダイゼーション液(3)を被覆する固定部材(4)の温度を測定することにより推定される。
【0053】
また放射温度計(12)による測定の便宜から、固定部材(4)の、ハイブリダイゼーション液と接触する面に対抗する面上に、反射率が既知の被膜(5)を設けることもできる。被膜(5)は、固定部材(4)全体又は少なくとも一部に設けることができる。
【0054】
固定部材(4)として、これに限定されるものではないが、例えば、カバーガラスなどを使用することができる。また本発明の装置に使用することができる被膜(5)は、放射率が既知でありかつマイクロ波の透過を妨げない限り特に制限されず、例えば黒体スプレー(THI-1B, タスコジャパン、放射率0.94)を使用することができる。ただし、マイクロ波照射による温度上昇を避けるために、低誘電損失(波長2.45GHzにおいて0.04以下)のバインダーやフィラー、顔料など材料を選ぶ必要がある。たとえば低誘電損失ポリエステル樹脂にアニリンブラックなどの有機顔料を混合して使用することができる。
【0055】
固定部材(4)の温度は、放射温度計(12)により測定され、この測定値に基づいてマイクロ波照射制御手段(14)がマイクロ波照射手段(13)の出力を制御することにより、ハイブリダイゼーション液(3)の加熱領域の温度を調節する。マイクロ波照射制御手段(14)には、放射温度計(12)で測定した温度をもとに出力をPID制御することによって固定部材(4)の温度を一定値に制御する動作をマイクロ波照射手段(13)に指示するプログラムを搭載させることができる。なお、設定温度範囲は検出用核酸の長さ及び配列に基づいて実施者が適宜設定することができる。
【0056】
前記放射温度計の位置は、前記固定部材又は被膜の鉛直線上に配置することが好ましい。前記固定部材上の被膜は薄いほうが好ましいが(数十μm程度)、表面反射が残りやすく、周囲の熱源からの赤外線が背景雑音として入射することがあるため、放射温度計を固定部材又は被膜に対して鉛直線上に配置することでこれを避けることができる。
【0057】
マイクロ波照射手段としては、シングルモードのマイクロ波照射装置が好ましい。マイクロ波源としては500W級のマグネトロン管(東芝ホクト電子製2M216など)や固体素子型マイクロ波源(エーイーティー製AMPS100-04-2450など)を使用することができる。
【0058】
本発明の装置は、標的核酸の温度調節手段をさらに具備することができる。これにより、標的核酸の温度とハイブリダイゼーション液の温度とをそれぞれ独立に制御することができ、効率的なハイブリダイゼーションを実現するハイブリダイゼーション液と標的核酸との温度差を正確に維持することができる。
【0059】
本発明の装置において、前記標的核酸の温度調節手段は、該標的核酸の加熱・冷却手段と、該標的核酸の温度測定手段と、該標的核酸の温度に応じて該加熱・冷却手段を切り替える制御する手段とを備える任意の手段である。
【0060】
かかる標的核酸の温度調節手段は、標的核酸を固定する反応基板の温度を調節することによって該標的核酸の温度を間接的に調節する手段であってもよい。
【0061】
典型的に、本発明の標的核酸の温度調節手段は、反応基板の一部に接触した熱媒体と、該熱媒体の加熱・冷却手段と、該熱媒体又は反応基板の温度測定手段と、加熱・冷却制御手段とを含む。即ち、この場合、標的核酸の温度は反応基板又は熱媒体の温度を測定することによって推定する。
【0062】
熱媒体の温度は、温度センサーなどの熱媒体の温度測定手段によって測定され、加熱・冷却制御手段がこの測定値に基づいて加熱・冷却手段の動作の切り替えを指示することによって熱媒体の温度を調節する。温度制御手段には、熱媒体の温度が設定温度範囲以下になった時点で加熱に切り替え、熱媒体の温度が設定温度以上になった時点で冷却に切り替えるような動作を加熱・冷却手段に実行させるプログラムを搭載させることができる。なお、設定温度範囲は、ハイブリダイゼーション液の設定温度範囲に基づき、ハイブリダイゼーション液の設定温度と熱媒体の設定温度とが、上記の温度差を維持するような範囲に設定するものとする。このとき、設定温度と温度差の制御をマイクロコンピューターで行ってもよい。
【0063】
熱媒体としては、固体、液体、又は気体のいずれを用いてもよい。
【0064】
本発明の標的核酸の温度調節手段は、熱媒体(7)として液体を使用する場合には、該液体を収容する熱媒体容器(6)をさらに有することができる。この場合、熱媒体容器(6)は、収容する液体が反応基板(1)の標的核酸を固定した面に対抗する面に接するように配置することが好ましい。また熱媒体容器(6)に液体が循環する循環路(8)を設け、この循環路の領域で温度の調節及び測定を行うことができるように前記温度測定手段(9)と前記加熱・冷却手段(10)とを設けてもよい。
【0065】
熱媒体に使用する液体としては水を用いてもよいが、マイクロ波電力の多くの部分が循環水に吸収されることになるので、循環水の冷却機構が必須である。熱媒体としての液体はマイクロ波の損失が少ないフッ素系溶媒(例えば、フロリナート(住友3M)、ノベック(同)、ガルデン(ソルベイソクレシス)など)が望ましい。
【0066】
また、熱媒体として熱伝導率がよく、マイクロ波損失の少ない熱伝導性セラミックスを用いることもできる。加熱・冷却手段としてはペルチェ素子を用いた電子加熱冷却装置、温度検出手段としては熱電対温度センサー等を熱伝導性セラミックスに設置することで全固体化できる。また、前記反応基板の下方から乾燥空気や窒素を熱媒体として用いて吹きつけることにより、加熱冷却を行うことも可能である。
【0067】
その他、本発明の装置に適当な熱媒体の例は、これに限定されるものではないが、水、フッ素系溶媒、熱伝導性セラミックス、乾燥空気、窒素などのほかに、温度制御を伴わない良熱伝導性ステージなどを挙げることができる。温度制御を伴わない良熱伝導性のステージはハイブリダイゼーション液(3)の温度に対して、低い温度を反応基板(1)に与えることができる。構造上、反応基板の温度がハイブリダイゼーション液の温度に対して一定の範囲で低く保たれる場合には、マイクロコンピューター等の制御を必要としない。また、反応基板の温度測定手段としては熱媒体の温度を熱電対等で測定する方法のほか、反応基板の温度を直接測定することもできる。一例として反応基板の表面または裏面の一部に形成した放射率が既知の被膜の表面温度を、遠隔位置から放射温度計で非接触的に測定することができる。
【0068】
前記加熱・冷却手段は、選択される熱媒体に応じて当業者が適宜選択することができる。
【0069】
以下、実施例を用いて本発明をより詳細に説明するが、本発明の範囲は以下の実施例に限定されない。
【実施例】
【0070】
本実施例では、本発明によるハイブリダイゼーション方法の有用性の評価を行った。
【0071】
スライドガラス(1)上に、マウス(オス)の細胞(2)を固定し、標本を70℃ホットプレート上で2時間ハードニングした。次に70℃の70%ホルムアミド/2×SSC中で2分間変性処理後、氷冷した70%エタノールに5分浸漬し、DNAを一本鎖にした。別の70%エタノールで洗った後、100%エタノールに5分浸漬後風乾した。
【0072】
蛍光色素Cy3(Indocarbocyanine)で標識したセントロメア用プローブを含有するハイブリダイゼーション液(3)(組成:50〜60%ホルムアミド、10%硫酸デキストラン、2×SSC(クエン酸食塩水)およびプローブ)をチューブに入れ、75℃で10分変性処理後、5分以上氷冷した。
【0073】
ターゲット(2)に上記ハイブリダイゼーション液(3)を10μlアプライし、カバーグラス(4)をかけ、37℃でハイブリダイゼーションを行った。カバーガラス(4)は、黒体スプレー(5)を均一に塗抹したものを使用した。
【0074】
ハイブリダイゼーションは、シングルモードマイクロ波照射装置(13)(エーイーティー製マイクロ波加熱装置AMH2450-001)で160Wのマイクロ波(15)を照射しながら行った。プレパラート(1、2、3及び4)はポリプロピレン製容器に入れ、プレパラートの下に恒温槽(6)で温めた34℃前後の水(7)を通した。マイクロ波照射中、放射温度計(12)でカバーガラス(4)上を測定し、37℃になるように温度を調節した。
【0075】
カバーガラス(4)上の温度をハイブリダイゼーション液(3)の温度とし、マイクロ波照射装置から出てきた水の温度を熱電対温度計(9)で測定し、反応基板(1)の温度とした。ハイブリダイゼーション液(3)の温度と反応基板(1)の温度の差は1.0〜3.0℃の間だった。
【0076】
2×SSC中5分浸漬しカバーグラス(4)を静かにはずし、37℃の50%ホルムアミド/2×SSC中20分浸漬した。2×SSCですすいだ後、1×SSC中15分浸漬し、DAPI染色後、落射式蛍光顕微鏡で観察した。
【0077】
同様の手順で、マイクロ波を用いない通常のハイブリダイゼーションを、恒温機中で乾燥しないように水のはいった容器を入れて行った。
【0078】
セントロメアのプローブ部位のみモニター上で検出できるように、バックグラウンドを調整後、露光時間を統一し(760ミリ秒)、染色体の画像を取り込み、細胞全体のプローブ輝度を計測した。計測した値を一元配置分散分析で有意差検定を行い、さらにダンカン多重検定を行った(n=10、p<0.05)。
【0079】
表1と図3に結果を示した。染色体のハイブリダイゼーションは通常、恒温機で一晩行う(オーバーナイト)。セントロメア用のプローブは恒温機3時間でもある程度の輝度が検出されるが、恒温機一晩、マイクロ波1時間、マイクロ波2時間、マイクロ波3時間のハイブリダイゼーションより有意に輝度の値が低く、検鏡の結果もセントロメアがはっきり観察されなかった。
【0080】
一方、マイクロ波0.5時間照射では、恒温機一晩、マイクロ波1時間、マイクロ波2時間のハイブリダイゼーションと同程度の輝度があったが(有意差なし)、マイクロ波1時間ハイブリダイゼーションのほうがプローブの輝度が十分に検出されていた。
【0081】
以上のことから、マイクロ波を照射しながらハイブリダイゼーションを行うことにより、通常一晩行うハイブリダイゼーションを1時間に短縮できることが示された。
【0082】
表1にハイブリダイゼーションの方法・時間と検出されたプローブの輝度の実測値を示す。
【0083】
【表1】

【0084】
図3にハイブリダイゼーションの方法・時間と検出されたプローブの輝度の相対値を示す。恒温機一晩ハイブリダイゼーションした輝度の平均を100%としたときのそれぞれの条件の平均を相対値で表した。
【図面の簡単な説明】
【0085】
【図1】図1はハイブリダイゼーション法の基本操作を説明するイラスト図を示す。
【図2】図2は本発明のハイブリダイゼーション装置の一例の断面模式図を示す。
【図3】図3は本発明の方法によるプローブ輝度と慣用のハイブリダイゼーション方法によるプローブ輝度との比較を示す。
【符号の説明】
【0086】
1 反応基板
2 標的核酸
3 ハイブリダイゼーション液
4 固定部材
5 被膜
6 熱媒体容器
7 熱媒体
8 熱媒体循環路
9 温度測定手段
10 加熱・冷却手段
11 加熱・冷却制御手段
12 放射温度計
13 マイクロ波照射装置
14 マイクロ波照射制御手段
15 マイクロ波
【特許請求の範囲】
【請求項1】
標的核酸を固定した反応基板に検出用核酸を含むハイブリダイゼーション液を接触させることにより標的核酸と検出用核酸とをハイブリダイズさせる方法において、該ハイブリダイゼーション液の温度を調節して、該ハイブリダイゼーション液の温度を該標的核酸の温度に対して高い温度でハイブリダイズさせることを特徴とする、前記方法。
【請求項2】
前記標的核酸と前記検出用核酸とを、前記ハイブリダイゼーション液の温度が前記反応基板の温度に対して0.1〜20℃高い温度でハイブリダイズさせることを特徴とする請求項1記載の方法。
【請求項3】
前記ハイブリダイゼーション液の温度を、マイクロ波照射による加熱、及び該ハイブリダイゼーション液の加熱領域の温度の測定によって調節することを特徴とする請求項1記載の方法。
【請求項4】
前記測定を、ハイブリダイゼーション液を被覆する固定部材の温度を測定することによって実施することを特徴とする請求項3記載の方法。
【請求項5】
前記固定部材は、ハイブリダイゼーション液と接触する面に対抗する面上の少なくとも一部に反射率が既知の被膜を有することを特徴とする請求項4記載の方法。
【請求項6】
前記標的核酸の温度を調節することをさらに含むことを特徴とする請求項1記載の方法。
【請求項7】
前記標的核酸の温度調節を、前記反応基板の一部に接触した熱媒体の加熱・冷却、及び該反応基板又は熱媒体の温度の測定によって調節することを特徴とする請求項1記載の方法。
【請求項8】
反応基板上に固定した標的核酸とハイブリダイゼーション液中に含まれる検出用核酸とをハイブリダイズさせるための装置であって、該ハイブリダイゼーション液の温度調節手段を具備するハイブリダイゼーション装置。
【請求項9】
ハイブリダイゼーション液の温度調節手段は、ハイブリダイゼーション液を被覆する固定部材と、該ハイブリダイゼーション液にマイクロ波を照射するマイクロ波照射手段と、該固定部材の遠隔位置に設置された放射温度計と、該放射温度計により測定した該固定部材の温度に基づいて該マイクロ波照射を制御する手段と、を含むことを特徴とする請求項8記載の装置。
【請求項10】
前記固定部材は、ハイブリダイゼーション液と接触する面に対抗する面上の少なくとも一部に反射率が既知の被膜を有することを特徴とする請求項9記載の装置。
【請求項11】
前記標的核酸の温度調節手段をさらに具備する、請求項8記載の装置。
【請求項12】
前記標的核酸の温度調節手段が、反応基板の一部に接触した熱媒体と、該熱媒体の加熱・冷却手段と、該熱媒体又は反応基板の温度測定手段と、該温度測定手段によって測定される温度に基づいて該加熱・冷却手段を制御する手段と、を含むことを特徴とする請求項11記載の装置。
【請求項1】
標的核酸を固定した反応基板に検出用核酸を含むハイブリダイゼーション液を接触させることにより標的核酸と検出用核酸とをハイブリダイズさせる方法において、該ハイブリダイゼーション液の温度を調節して、該ハイブリダイゼーション液の温度を該標的核酸の温度に対して高い温度でハイブリダイズさせることを特徴とする、前記方法。
【請求項2】
前記標的核酸と前記検出用核酸とを、前記ハイブリダイゼーション液の温度が前記反応基板の温度に対して0.1〜20℃高い温度でハイブリダイズさせることを特徴とする請求項1記載の方法。
【請求項3】
前記ハイブリダイゼーション液の温度を、マイクロ波照射による加熱、及び該ハイブリダイゼーション液の加熱領域の温度の測定によって調節することを特徴とする請求項1記載の方法。
【請求項4】
前記測定を、ハイブリダイゼーション液を被覆する固定部材の温度を測定することによって実施することを特徴とする請求項3記載の方法。
【請求項5】
前記固定部材は、ハイブリダイゼーション液と接触する面に対抗する面上の少なくとも一部に反射率が既知の被膜を有することを特徴とする請求項4記載の方法。
【請求項6】
前記標的核酸の温度を調節することをさらに含むことを特徴とする請求項1記載の方法。
【請求項7】
前記標的核酸の温度調節を、前記反応基板の一部に接触した熱媒体の加熱・冷却、及び該反応基板又は熱媒体の温度の測定によって調節することを特徴とする請求項1記載の方法。
【請求項8】
反応基板上に固定した標的核酸とハイブリダイゼーション液中に含まれる検出用核酸とをハイブリダイズさせるための装置であって、該ハイブリダイゼーション液の温度調節手段を具備するハイブリダイゼーション装置。
【請求項9】
ハイブリダイゼーション液の温度調節手段は、ハイブリダイゼーション液を被覆する固定部材と、該ハイブリダイゼーション液にマイクロ波を照射するマイクロ波照射手段と、該固定部材の遠隔位置に設置された放射温度計と、該放射温度計により測定した該固定部材の温度に基づいて該マイクロ波照射を制御する手段と、を含むことを特徴とする請求項8記載の装置。
【請求項10】
前記固定部材は、ハイブリダイゼーション液と接触する面に対抗する面上の少なくとも一部に反射率が既知の被膜を有することを特徴とする請求項9記載の装置。
【請求項11】
前記標的核酸の温度調節手段をさらに具備する、請求項8記載の装置。
【請求項12】
前記標的核酸の温度調節手段が、反応基板の一部に接触した熱媒体と、該熱媒体の加熱・冷却手段と、該熱媒体又は反応基板の温度測定手段と、該温度測定手段によって測定される温度に基づいて該加熱・冷却手段を制御する手段と、を含むことを特徴とする請求項11記載の装置。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2009−122005(P2009−122005A)
【公開日】平成21年6月4日(2009.6.4)
【国際特許分類】
【出願番号】特願2007−297510(P2007−297510)
【出願日】平成19年11月16日(2007.11.16)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(507380540)有限会社クロモソームサイエンスラボ (1)
【Fターム(参考)】
【公開日】平成21年6月4日(2009.6.4)
【国際特許分類】
【出願日】平成19年11月16日(2007.11.16)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(507380540)有限会社クロモソームサイエンスラボ (1)
【Fターム(参考)】
[ Back to top ]

