不活性炭化水素の水酸化方法およびダミー分子
【課題】シトクロムP450モノオキシゲナーゼを用いて不活性炭化水素を工業的に水酸化できる方法を提供すること。
【解決手段】シトクロムP450モノオキシゲナーゼと、ダミー分子と、不活性炭化水素とを共存させて、不活性炭化水素を水酸化する。ダミー分子としては、シトクロムP450モノオキシゲナーゼの結合部位に結合可能な末端構造と、アルキル鎖と、を持ち、アルキル鎖に含まれる少なくとも一部の水素がフッ素で置換されているものを用いる。
【解決手段】シトクロムP450モノオキシゲナーゼと、ダミー分子と、不活性炭化水素とを共存させて、不活性炭化水素を水酸化する。ダミー分子としては、シトクロムP450モノオキシゲナーゼの結合部位に結合可能な末端構造と、アルキル鎖と、を持ち、アルキル鎖に含まれる少なくとも一部の水素がフッ素で置換されているものを用いる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、シトクロムP450モノオキシゲナーゼとダミー分子とを用いて不活性炭化水素を水酸化する方法、および、この水酸化方法に用いられるダミー分子に関する。
【背景技術】
【0002】
細菌由来の酵素であるシトクロムP450は、真核生物由来のシトクロムP450に比べて高い触媒活性を持つことが知られている。細菌由来のシトクロムP450として、緑膿菌(Pseudomonas aeruginosa)由来のシトクロムP450camや、バチルス属菌細菌の一種であるBacillus megaterium由来のシトクロムP450BM3等の、シトクロムP450モノオキシゲナーゼが知られている。
【0003】
例えば、シトクロムP450camは、樟脳(カンファー)の水酸化反応を、毎分1000回転を超える速さで触媒することができる。この触媒活性は、哺乳類のP450の触媒活性(毎分数回から数十回転程度)と比較すると非常に高い。シトクロムP450BM3は、脂肪酸の末端から数えて1〜3番目(ω−1〜ω−3)のメチレン基の水酸化を触媒する。シトクロムP450BM3の触媒活性は毎分数千回転に達し、シトクロムP450BM3はシトクロムP450モノオキシゲナーゼとしては最大の活性を有する。
【0004】
また、真核生物由来のP450は膜蛋白質であるため、水に対する親和性が著しく低い。これに対して上述したシトクロムP450モノオキシゲナーゼは、水に対する親和性が高く、酵素蛋白の精製、結晶化ならびに取り扱いが容易である。
【0005】
また、シトクロムP450は、NADPHなどの電子供与体(以下、P450還元系と呼ぶ)と酸素とを用い、基質の水酸化を触媒する。単離したシトクロムP450の触媒活性を向上させるためには、P450還元系からP450への電子伝達を効率よく進行させる必要がある。上述したシトクロムP450BM3は、通常のシトクロムP450とは異なり、P450還元系の一部(シトクロムP450BM3ではFADおよびFMN)とP450とが融合して、1本のポリペプチドとして存在している。そして、P450還元系の一部とP450とが融合し非常に近接していることが、シトクロムP450モノオキシゲナーゼの優れた触媒活性の一つの要因となっている。換言すると、シトクロムP450BM3は融合蛋白であるため、非常に優れた触媒活性を示す。P450camは融合蛋白ではない。このため、P450camの触媒反応には、プチダレドキシン(Pdx)とプチダレドキシン還元酵素(PdR)とが必須である。しかしP450camもまた、上述したように優れた触媒活性を示す。
【0006】
これらの理由により、シトクロムP450モノオキシゲナーゼは、バイオ触媒として適していると考えられる。
【0007】
ところで、野生型のシトクロムP450の基質とならない物質、または、野生型のシトクロムP450によって水酸化され難い基質を水酸化するため、野生型のシトクロムP450を生産する細菌を形質転換して、これらの物質を基質とし得るシトクロムP450(以下、変異型シトクロムP450と呼ぶ)を発現させる技術が提案されている(例えば、特許文献1〜3参照)。
【0008】
例えば、野生型のシトクロムP450モノオキシゲナーゼは、シクロヘキサン、プロパン、ベンゼン、エタン、メタン等の不活性炭化水素に対する触媒活性が非常に低い。しかし変異型シトクロムP450モノオキシゲナーゼであれば、これらの不活性炭化水素の水酸化を触媒できる可能性がある。
【0009】
しかし、変異型シトクロムP450モノオキシゲナーゼを安価に量産するのは困難である。このため変異型シトクロムP450モノオキシゲナーゼは、不活性炭化水素を大量かつ継続的に(すなわち工業的に)水酸化するのには適していない問題があった。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特表2000−508163号公報
【特許文献2】特表2003−517815号公報
【特許文献3】特表2003−521889号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は上記事情に鑑みてなされたものであり、シトクロムP450モノオキシゲナーゼを用いて不活性炭化水素を工業的に水酸化できる方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
上記課題を解決する本発明の不活性炭化水素の水酸化方法は、シトクロムP450モノオキシゲナーゼと、ダミー分子と、不活性炭化水素とを共存させて、該不活性炭化水素を水酸化する工程を含み、
該ダミー分子は、該シトクロムP450モノオキシゲナーゼの結合部位に結合可能な末端構造と、アルキル鎖と、を持ち、
該アルキル鎖に含まれる少なくとも一部の水素がフッ素で置換されていることを特徴とする。
【0013】
本発明の不活性炭化水素の水酸化方法は、以下の(1)〜(5)の何れかを備えるのが好ましく、(1)〜(5)の複数を備えるのがより好ましい。
【0014】
(1)前記シトクロムP450モノオキシゲナーゼは、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持つシトクロムP450モノオキシゲナーゼおよび/またはシトクロムP450camのアミノ酸配列と40%以上の相同性を持つシトクロムP450モノオキシゲナーゼである。
【0015】
(2)前記ダミー分子のなかで、少なくともアルキル鎖の末端から数えて1〜3番目のアルキル基に含まれる水素は、フッ素で置換されている。
【0016】
(3)前記末端構造は、水素末端、水酸基、アルデヒド基、カルボキシル基から選ばれる少なくとも一種である。
【0017】
(4)前記不活性炭化水素は、シクロヘキサン、ブタン、プロパン、ベンゼンから選ばれる少なくとも一種である。
【0018】
(5)前記シトクロムP450モノオキシゲナーゼは、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持ち、
前記ダミー分子は、パーフルオロカルボン酸である。
【0019】
上記課題を解決する本発明のダミー分子は、シトクロムP450モノオキシゲナーゼおよび不活性炭化水素と共存させて、該不活性炭化水素を水酸化するためのダミー分子であって、
該シトクロムP450モノオキシゲナーゼの結合部位に結合可能な末端構造と、アルキル鎖と、を持ち、
該アルキル鎖に含まれる少なくとも一部の水素がフッ素で置換されていることを特徴とする。
【0020】
本発明のダミー分子は以下の(6)〜(8)の何れかを備えるのが好ましく、(6)〜(8)の複数を備えるのがより好ましい。
【0021】
(6)少なくともアルキル鎖の末端から数えて1〜3番目のアルキル基に含まれる水素がフッ素で置換されている。
【0022】
(7)前記末端構造は、水素末端、水酸基、アルデヒド基、カルボキシル基から選ばれる少なくとも一種である。
【0023】
(8)前記シトクロムP450モノオキシゲナーゼは、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持ち、
前記ダミー分子は、パーフルオロカルボン酸である。
【発明の効果】
【0024】
以下、シトクロムP450モノオキシゲナーゼをP450と略する。P450の触媒反応は、以下のように開始すると考えられている。
【0025】
P450の活性中心には、基質が結合する結合部位が存在する。基質が結合部位に結合すると、活性中心に存在する水分子が活性中心から押し出される。以下、この状態を活性化スイッチが入る、と呼ぶ。活性中心は、その後、電子や酸素分子等の作用を受けた後に、基質の水酸化を触媒する。したがって、活性化スイッチが入らないと、P450の触媒反応は開始しないと考えられている。なお、野生型のP450の基質としては、ラウリン酸、ミリスチン酸、パルミチン酸が知られている。これらの基質は、結合部位に結合する末端構造(カルボキシル基)と、アルキル鎖とを持つ。
【0026】
本発明の不活性炭化水素の水酸化方法は、ダミー分子の共存下で、P450によって不活性炭化水素の水酸化を触媒する方法である。ダミー分子は、P450の結合部位に結合可能な部分(末端構造)と、アルキル鎖とを持つ。このためダミー分子とP450とを共存させると、ダミー分子が基質のかわりにP450の結合部位に結合し、活性化スイッチが入ると考えられる。
【0027】
上述したように、不活性炭化水素に対する野生型P450の触媒活性は非常に低い。しかし、活性化スイッチが入ることで、不活性炭化水素に対する野生型P450の触媒活性が向上する。したがって、本発明の不活性炭化水素の水酸化方法によると、野生型のP450を用いて不活性炭化水素を水酸化できる。
【0028】
また、このダミー分子において、アルキル鎖に含まれる少なくとも一部の水素は、フッ素で置換されている。このため、ダミー分子は活性中心の疎水性を高め、水分子を活性中心から排除すると考えられる。このため、本発明の不活性炭化水素の水酸化方法によると、P450における活性化スイッチが入り易く、触媒反応が進行し易い。
【0029】
これらの作用によって、本発明の不活性炭化水素の水酸化方法によると、野生型のP450によっても不活性炭化水素を水酸化できる。よって、本発明の不活性炭化水素の水酸化方法によると、シトクロムP450モノオキシゲナーゼを用いて不活性炭化水素を工業的に水酸化できる。なお、本発明の不活性炭化水素の水酸化方法によると、変異型P450を用いて不活性炭化水素を水酸化することも可能である。
【図面の簡単な説明】
【0030】
【図1】プロパンの水酸化確認試験で用いた反応装置を模式的に表す説明図である。
【図2】ダミー分子のアルキル鎖長、プロパノール生成量およびNADPH消費量の関係を表すグラフである。
【図3】反応時間、プロパノール生成量およびNADPH消費量の関係を表すグラフである。
【図4】パルミチン酸が結合したP450BM3の活性中心、および、PFC10が結合したP450BM3の活性中心を模式的に表す説明図である。
【図5】ダミー分子の鎖長、ヘキサンの有無およびNADPH消費量の関係を表すグラフである。
【図6】シクロヘキサンの水酸化確認試験で得られたガスクロマトグラフィー分析結果を表すグラフである。
【図7】ダミー分子の鎖長、シクロヘキサノール生成量およびNADPH消費量の関係を表すグラフである。
【図8】ベンゼンの水酸化確認試験で得られたガスクロマトグラフィー分析結果を表すグラフである。
【図9】ダミー分子のアルキル鎖長、フェノール生成量およびNADPH消費量の関係を表すグラフである。
【図10】ダミー分子のアルキル鎖長、2−ブタノール生成量およびNADPH消費量の関係を表すグラフである。
【発明を実施するための形態】
【0031】
本発明の不活性炭化水素の水酸化方法で用いるP450としては、シトクロムP450BM3(CYP102A1)および/またはシトクロムP450cam(カンファー5−モノオキシゲナーゼ、CYP101)を特に好ましく選択できる。上述したように、これらのP450は触媒活性に優れるからである。
【0032】
また、P450としては、シトクロムP450BM3、シトクロムP450camのみでなく、これらの酵素のアミノ酸配列とアミノ酸配列が一部異なる酵素を用いても良い。例えば、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持つP450(シトクロムP450BM3のファミリー酵素)や、シトクロムP450BM3のアミノ酸配列と55%以上の相同性を持つP450(シトクロムP450BM3のサブファミリー酵素)を好ましく用いることができる。或いは、シトクロムP450camのアミノ酸配列と40%以上の相同性を持つP450(シトクロムP450camのファミリー酵素)や、シトクロムP450camのアミノ酸配列と55%以上の相同性を持つP450(シトクロムP450camのサブファミリー酵素)を好ましく用いることができる。なお、シトクロムP450BM3のファミリー酵素またはサブファミリー酵素は脂肪酸を水酸化可能であるのが好ましく、シトクロムP450camのファミリー酵素またはサブファミリー酵素はカンファー(C10H16O)を水酸化可能であるのが好ましい。
なお、シトクロムP450BM3のアミノ酸配列は、例えばJ.Biol.chem.264(19),10987−10998(1989)や、NCBIのベータベース(National Center for Biotechnology Information http://www.ncbi.nlm.nih.gov/protein/P14779.2)に開示されているように、公知である。また、シトクロムP450camのアミノ酸もまた、NCBIデータベース(http://www.ncbi.nlm.nih.gov/protein/YP_714029)に開示されているように公知である。本発明の不活性炭化水素の水酸化方法で用いるダミー分子は、末端構造とアルキル鎖とを持つ。ダミー分子の一例を下式1に示す。
(式1)

【0033】
末端構造(式1中R)は、P450の結合部位に結合可能であれば良く、水素末端、水酸基、アルデヒド基、カルボキシル基等が例示される。ダミー分子の末端構造は1のみであっても良いし、複数であっても良い。1つのダミー分子に含まれる複数の末端構造は、同一の構造であっても良いし、互いに異なる構造であっても良い。
【0034】
ダミー分子におけるアルキル鎖の鎖長は特に限定されない。また、ダミー分子のアルキル鎖は1のみであっても良いし、複数に分岐していても良いし、環状であっても良い。本発明のダミー分子においては、このアルキル鎖に含まれる一部または全部の水素がフッ素置換されていれば良いが、後述するように、少なくともアルキル鎖の末端から数えて1〜3番目のアルキル基に含まれる水素がフッ素で置換されているのが好ましい。少なくとも、アルキル鎖の末端から数えて1〜7番目のアルキル基に含まれる水素がフッ素で置換されているのがさらに好ましい。
【0035】
ダミー分子としては、例えば式2に示すようなものを用いることもできる。
(式2)

【0036】
本発明の不活性炭化水素の水酸化方法において、P450、ダミー分子および不活性炭化水素の反応は、バッチ式でおこなっても良いし、連続的におこなっても良い。反応を連続的におこなう場合には、P450を公知の酵素固定手段(例えば、反応槽の壁面やフィルタ等)に固定化すれば良い。さらに、本発明の不活性炭化水素の水酸化方法における反応系は、NADPH(NADP)、酸素分子等のP450の反応に必要な因子を含むのが良い。
【0037】
P450としては、野生型を用いても良いし、変異型を用いても良いが、上述したように不活性炭化水素を工業的に水酸化するためには、野生型を用いるのが好ましい。
【実施例】
【0038】
以下、本発明の不活性炭化水素の水酸化方法およびダミー分子を具体的に説明する。
【0039】
1.P450の調製
〔1〕シトクロムP450BM3の調製
以下の方法により、シトクロムP450BM3(以下、P450BM3と略する)を部分精製した。
【0040】
先ず、大腸菌(DH5α株)に、P450BM3全長の塩基配列を挿入したpUCベクターを組み込んで、P450BM3遺伝子を発現させた。
【0041】
この大腸菌を培養し、得られた大腸菌を超音波破砕することで、大腸菌が生産したP450BM3を大腸菌から抽出した。
【0042】
得られた破砕液を、硫酸アンモニウム沈殿法により分画(塩析)し、硫酸アンモニウムの飽和度40〜60(%飽和)で生じた沈殿を回収した。この沈殿をTris−HCl緩衝溶液pH7.4(以下緩衝液Aと呼ぶ)に分散させた。上述した沈殿の100倍量(体積比)の緩衝液Aを用いて、沈殿分散液を2回透析した。この操作によって沈殿分散液中の硫酸アンモニウムを脱塩した。
【0043】
透析後の沈殿分散液(粗酵素液と呼ぶ)を陰イオン交換カラム(DEAE650SまたはDE−52)に通し、粗酵素液に含まれるP450BM3をカラムに吸着させた。カラムに吸着したP450BM3を、KCl水溶液(濃度勾配0〜500mmol/l)を用いて溶出し、P450BM3の色である茶色のピーク画分を回収した。
【0044】
回収した粗酵素液に含まれるP450BM3には、基質が結合している可能性がある。この基質をP450BM3から除去するために、回収した粗酵素液に500mmol/l程度となる量のNADPHを加え、4℃で30分間反応させた。反応後、残存するNADPHを分離し、かつ、緩衝液を置換するため、粗酵素液をゲルろ過カラム(Sephacryl S300)に通した。ここで用いた緩衝液は、緩衝液Aに100mmol/lとなる量のKClを加えた緩衝液(以下緩衝液Bと呼ぶ)である。ゲルろ過カラムを通して得られた茶色のピーク画分を回収し、得られた画分(P450BM3溶液と呼ぶ)をP450として以下の試験に用いた。
【0045】
2.ダミー分子の調製
ダミー分子として、炭素数8〜14のパーフルオロ脂肪酸を準備した。
【0046】
PFC8〜PFC14は、アルキル鎖に含まれる水素全てがフッ素で置換されている。各ダミー分子をそれぞれメタノールに溶解させたものを、ダミー分子溶液として以下の試験に用いた。
【0047】
3.P450およびダミー分子を用いた不活性炭化水素の水酸化試験
〔1〕プロパンの水酸化確認試験
上述したP450BM3溶液およびPFC10溶液を用いて、不活性炭化水素の一種であるプロパンを水酸化した。
【0048】
高純度プロパンガスと高純度酸素ガスとを80:20(体積比)で混合した混合ガスを準備した。この混合ガスを上述した緩衝液Bに吹き込み、混合ガス飽和緩衝液Bを調製した。この混合ガス飽和緩衝液Bに、P450BM3溶液、PFC10溶液、およびNADPHを加えて、プロパンの水酸化反応を開始した。混合ガス飽和緩衝液Bは、反応開始時の反応液中に90体積%以上含まれていた。また、反応開始時の反応液中において、P450BM3の濃度は500nmol/lであり、PFC10の濃度は100μmol/lであり、NADPHの濃度は5mmol/lであった。さらに、この反応液は0.5体積%のメタノールを含んでいた。
【0049】
図1に示すように、反応は密閉したバイアルで行った。このバイアルには、上述した混合ガスで満たしたバルーンを接続した。バルーンの加圧下で、反応液を撹拌しながら、反応を進行させた。反応開始30分後に、反応で生成したアルコール(プロパノール)をガスクロマトグラフィーにより検出・定量した。なお、対照実験として、PFC10に代えて0.5体積%のメタノールのみを添加した系と、プロパンガスを添加していない系とを同様に反応させ、反応液中のプロパノールをガスクロマトグラフィー分析した。
【0050】
ガスクロマトグラフィー分析は以下のようにおこなった。
【0051】
先ず、反応液中のアルコールを亜硝酸エステルに誘導体化した。アルコールの誘導体化は、文献(Nguyen et al.,Anal.Sci.2001,17,639−643及びPeters et al.,J.AM.Chem.Soc.2003,125,13442−13450)にならっておこなった。詳しくは、反応液1mlに0.15gの亜硝酸ナトリウムを加え、次いで0.5mlのヘキサンを加えた後に、氷上で反応液に20%硫酸を150ml滴下し、15分間反応させることで、反応液中のアルコールを誘導体化した。
【0052】
誘導体化後、ヘキサン相を回収し、回収したヘキサン相を純水で洗浄した。洗浄後のヘキサン相をガスクロマトグラフィー用の分析試料とした。ガスクロマトグラフは島津社製のFID検出器を有するGC−2014を用い、カラムはRestek社製のRtx−1カラム(内径0.53mm、液層の膜厚3mm、カラム長60m)を用いた。ガスクロマトグラフにおける試料注入口温度は250℃であった。カラムオーブンの温度プログラムは、50℃で5分維持し、その後6分かけて200℃まで昇温し、そのまま3分間維持するよう設定した。検出器は250℃に設定した。
【0053】
反応液をガスクロマトクラフィー分析した結果、P450BM3、ダミー分子およびプロパンガスを含む反応系では、対照試験では見られないピークが一つだけ得られた。このピークが反応生成物のピークだと考えられる。プロパンを水酸化すると、1−プロパノールもしくは2−プロパノールが生成する可能性がある。そこで、2−プロパノールをガスクロマトグラフィー分析したところ、2−プロパノールのピーク(保持時間)は、反応生成物のピークと一致した。この結果から、反応生成物が2−プロパノールであることがわかった。
【0054】
また、上記のガスクロマトグラフィー分析では、誘導体化したプロパノールに相当するピークは検出されなかった。この結果から、亜硝酸エステルに誘導体化したプロパノールは、本条件下では不安定であり亜硝酸エステルとして検出することはできないこと、および、分解してプロパノールそのものとして検出されることがわかった。
【0055】
なお、内部標準として1mmol/lのエタノールを用い、反応液中の2−プロパノールを定量した結果、上記条件で30分間反応させると600μmol/lを超える2−プロパノールが生じた。
【0056】
〔2〕プロパンを基質とする場合のダミー分子の評価
アルキル鎖長10〜13のダミー分子(PFC10〜PFC13)を用い、ダミー分子のアルキル鎖長とプロパンの水酸化との相関を調べた。P450としてはP450BM3溶液を用いた。また、反応条件は上述した反応条件と同じである。なお、1molのプロパノールを生成する際には、1molのNADPHが消費される。このため、カップリング率は、プロパノール生成量 (μmol/分)÷NADPH消費量(μmol/分)×100で算出できる。NADPH量は、UVスペクトル(340nm)における吸光度の減少と、NADPHのモル吸光係数ε340nm=6200M−1cm−1とを用いて算出した。ダミー分子のアルキル鎖長、プロパノール生成量およびNADPH消費量の関係を表すグラフを図2に示す。また、ダミー分子のアルキル鎖長、プロパノール生成量、NADPH消費量およびカップリング率の関係を表1に示す。
【0057】
【表1】

【0058】
表1および図2に示すように、ダミー分子としてPFC9〜PFC13の何れを用いた場合にも、NADPHが消費された。このため、ダミー分子(PFC9〜PFC13)によってP450BM3の活性化スイッチが入ったと考えられる。
【0059】
また、ダミー分子としてPFC9〜PFC13の何れを用いた場合にも、プロパンからプロパノールが生成した。この結果から、これらのダミー分子を用いることでP450BM3のプロパン水酸化活性を高めることができ、プロパンを水酸化できることがわかる。また、P450BM3によるプロパノール生成量は、PFC10>PFC11>PFC12≧PFC9>PFC13の順に高い値を示した。この結果から、P450BM3のプロパン水酸化活性を高めるためには、ダミー分子のアルキル鎖長が9〜12であるのが好ましく、アルキル鎖長が10〜11であるのがより好ましく、アルキル鎖長が10であるのが特に好ましいことがわかる。
【0060】
〔3〕P450BM3およびPFC10によるプロパン水酸化の経時変化
P450BM3とPFC10とを用い、反応開始10分後、30分後、60分後および180分後におけるプロパノール生成量およびNADPH消費量を測定することで、プロパンの水酸化反応の経時変化を調べた。反応条件は上述した反応条件と同じである。反応時間、プロパノール生成量およびNADPH消費量の関係を表すグラフを図3に示す。また、反応時間、プロパノール生成量、NADPH消費量およびカップリング率の関係を表2に示す。
【0061】
【表2】

【0062】
表2および図3に示すように、P450BM3およびPFC10によるプロパンの水酸化反応は、NADPHを消費するまで進行した。
【0063】
〔4〕P450BM3の活性中心における基質およびダミー分子の配位
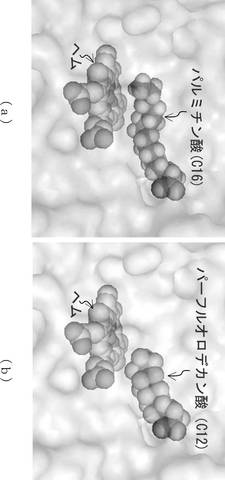
野生型P450BM3の基質であるパルミチン酸が結合したP450BM3の活性中心を模式的に表す説明図を図4(a)に示し、PFC10が結合したP450BM3の活性中心を模式的に表す説明図を図4(b)に示す。図4(a)、(b)は、基質結合型のP450BM3の結晶構造の基質をPFC10に置き換えたものである。なお、この結晶構造は、PDB(蛋白質構造データバンク Protein Data Bank)のデータベースに格納されている構造データであり、そのエントリーID(PDB ID)は1FAGである。
【0064】
P450は活性部位にヘムを持つ。ヘムは水酸化反応の反応場であり、図4(a)、(b)に示すように、ヘムの上方には基質やダミー分子が結合する結合部位が存在する。
【0065】
上述したように、プロパンを水酸化する場合、P450BM3の水酸化活性は、アルキル鎖長10のPFC10をダミー分子として用いたとき非常に高くなる。これは、野生型P450BM3の基質であるパルミチン酸(アルキル鎖長16)に対し、PFC10(アルキル鎖長10)のアルキル鎖長は6短いため、反応場であるヘム上方に、プロパンが取り込まれる空間が確保されるためと考えられる。
【0066】
また、PFC10、すなわちフッ素置換されたダミー分子が活性中心の結合部位に結合することで、反応場の疎水性が高められると考えられる。このため、同じく疎水性のプロパンが活性中心の反応場に入り込み易くなり、かつ、水分子が反応場から排除されると考えられる。このため、活性化スイッチが入り、プロパンの水酸化反応が進行すると考えられる。
【0067】
また、PFC9(アルキル鎖長9)をダミー分子として用いた場合には、ダミー分子のアルキル鎖長が短いために、活性化スイッチが十分に入らないと考えられる。このため、ダミー分子としてPFC9を用いる場合には、ダミー分子としてPFC10を用いる場合に比べて、プロパノール生成量(すなわちP450の水酸化活性)とNADPH消費量の双方が低下したと解釈できる。
【0068】
また、PFC13(アルキル鎖長13)をダミー分子として用いた場合には、ダミー分子のアルキル鎖長が長いために、プロパノール生成量(P450の水酸化活性)が低下する。これは、ダミー分子のアルキル鎖長が過剰に長いと、反応場上方の空間(基質が取り込まれる空間)が狭くなり、プロパンが取り込まれ難くなるためと考えられる。なお、この場合にも活性化スイッチは入るために、NADPHの消費は十分に早く進行する。
【0069】
活性化スイッチを入れ、かつ、P450BM3の水酸化活性を充分に高めることを考慮すると、P450BM3によってプロパンを水酸化するためのダミー分子としては、PFC10(パーフルオロデカン酸)を用いるのが特に好ましいと考えられる。
【0070】
〔5〕シクロヘキサンの水酸化確認試験
上述したP450BM3溶液およびダミー分子(PFC8〜14)溶液を用いて、不活性炭化水素の一種であるシクロヘキサンを水酸化した。
【0071】
上述した緩衝液Bに、P450BM3溶液、ダミー分子溶液、NADPHおよびシクロヘキサンを加えて、シクロヘキサンの水酸化反応を開始した。シクロヘキサンは、エタノールに溶解したものを用いた。反応開始時の反応液中において、P450BM3の濃度は100nmol/lであり、ダミー分子の濃度は0.1mmol/lであり、NADPHの濃度は1mmol/lであり、シクロヘキサンの濃度は10mmol/lであった。さらに、この反応液は1体積%のエタノールを含んでいた。
【0072】
反応液を攪拌しつつ室温で一晩放置し、シクロヘキサンの水酸化反応を進行させた。その後、反応で生成したアルコール(シクロヘキサノール)をガスクロマトグラフィーにより検出・定量した。なお、対照実験として、ダミー分子溶液に代えて0.5体積%のエタノールのみを添加した系(ダミー分子なし)を同様に反応させ、反応液中のシクロヘキサノールをガスクロマトグラフィー分析した。
【0073】
反応液をガスクロマトクラフィー分析した結果、図6に示すように、ダミー分子、P450BM3、およびシクロヘキサンを含む反応液からはシクロヘキサノールが検出された。ダミー分子を含まない反応液からは、有意な量のシクロヘキサノールは検出されなかった。この結果から、ダミー分子(PFC8〜14)を共存させることで、P450BM3のシクロヘキサン水酸化活性を向上させ得ることがわかる。
【0074】
〔6〕シクロヘキサンを基質とする場合のダミー分子の評価
アルキル鎖長8〜14のダミー分子(PFC8〜PFC14)を用い、ダミー分子のアルキル鎖長とシクロヘキサンの水酸化との相関を調べた。P450としてはP450BM3溶液を用いた。反応条件は、反応時間が10分間であったこと以外は、上述した反応条件と同じであった。反応で生成したシクロヘキサノール量(μmol/分)と、反応で消費したNADPH量(μmol/分)とを、使用したダミー分子毎に比較した。また、シクロヘキサノール生成に利用されたNADPH量のNADPH消費量(全量)に対する割合(カップリング率(%))を算出した。
【0075】
ダミー分子の鎖長、シクロヘキサノール生成量およびNADPH消費量の関係を表すグラフを図7に示す。また、ダミー分子のアルキル鎖長、シクロヘキサノール生成量、NADPH消費量およびカップリング率の関係を表3に示す。
【0076】
【表3】

【0077】
表3および図7に示すように、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、NADPHが消費された。上述したように、活性化スイッチがはいるとNADPHが消費されるため、ダミー分子の存在によって活性化スイッチが入ると考えられる。なお、ダミー分子を添加せず、同様に10分間反応させた場合、シクロヘキサノールは検出されなかった。
【0078】
また、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、シクロヘキサンからシクロヘキサノールが生成した。この結果から、アルキル鎖長(ここでは炭素数)8〜14程度のダミー分子を用いることでP450BM3のシクロヘキサン水酸化活性を高めることができ、シクロヘキサンを反応性高く水酸化できることがわかる。また、シクロヘキサノール生成量およびNADPH消費量はダミー分子のアルキル鎖長に応じて異なっていた。P450BM3によるシクロヘキサノール生成量は、PFC9>PFC10>PFC8>PFC11>PFC12>PFC13>PFC14の順に高い値を示した。この結果から、P450BM3のシクロヘキサン水酸化活性を高めるためには、ダミー分子のアルキル鎖長が8〜12であるのが好ましく、アルキル鎖長が8〜11であるのがより好ましく、アルキル鎖長が9であるのが特に好ましいことがわかる。
【0079】
〔7〕ベンゼンの水酸化確認試験
上述したP450BM3溶液およびダミー分子(PFC8〜PFC14)溶液を用いて、不活性炭化水素の一種であるベンゼンを水酸化した。ベンゼンはエタノールに溶解したものを用いた。それ以外は、上述したシクロヘキサンの水酸化と同じである。検出は、HPLCで行った。
【0080】
反応開始時の反応液中において、P450BM3の濃度は500nmol/lであり、ダミー分子の濃度は100μmol/lであり、NADPHの濃度は5mmol/lであった。さらに、この反応液は1体積%のエタノールを含んでいた。反応開始10分後に、反応で生成したアルコール(フェノール)をHPLCにより検出・定量した。なお、対照実験として、ダミー分子にかえて緩衝液Bを添加した系を同様に反応させ、反応液中のフェノールを分析した。
【0081】
反応液をガスクロマトクラフィー分析した結果、図8に示すように、P450BM3、ダミー分子およびベンゼンを含む反応系では、ベンゼンのピークおよびフェノールのピークが確認された。図示していないが、対照実験の反応系では、ベンゼンのピークのみが確認され、フェノールのピークは確認されなかった。この結果から、P450BM3およびダミー分子によって反応液中のベンゼンが水酸化され、フェノールが生じることが確認された。そしてこの結果から、ダミー分子(PFC8〜PFC14)を用いることで、P450BM3のベンゼン水酸化活性を向上させ得ることがわかる。
【0082】
〔8〕ベンゼンを基質とする場合のダミー分子の評価
アルキル鎖長8〜14のダミー分子(PFC8〜PFC14)を用い、ダミー分子のアルキル鎖長とベンゼンの水酸化との相関を調べた。P450としてはP450BM3溶液を用いた。また、反応条件は上述した反応条件と同じである。ダミー分子のアルキル鎖長、フェノール生成量およびNADPH消費量の関係を表すグラフを図9に示す。また、ダミー分子のアルキル鎖長、フェノール生成量、NADPH消費量およびカップリング率の関係を表4に示す。
【0083】
【表4】

【0084】
表4および図9に示すように、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、NADPHが消費された。このため、PFC8〜PFC14によりP450BM3の活性化スイッチが入ったと考えられる。
【0085】
また、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、ベンゼンからフェノールが生成した。この結果から、これらのダミー分子を用いることでP450BM3のベンゼン水酸化活性を高めることができ、ベンゼンを水酸化できることがわかる。また、P450BM3によるフェノール生成量は、PFC9>PFC10>PFC11>PFC12>PFC8>PFC13>PFC14の順に高い値を示した。この結果から、P450BM3のベンゼン水酸化活性を高めるためには、ダミー分子のアルキル鎖長が9〜12であるのが好ましく、アルキル鎖長が9〜11であるのがより好ましく、アルキル鎖長が9であるのが特に好ましいことがわかる。
【0086】
〔9〕ブタンを基質とする場合のダミー分子の評価
アルキル鎖長8〜14のダミー分子(PFC8〜PFC14)、および、部分的にフッ素化された脂肪酸からなるダミー分子(PartialFC10と呼ぶ)を用い、ダミー分子のアルキル鎖長とブタンの水酸化との相関を調べた。P450としてはP450BM3溶液を用いた。また、反応条件は上述した反応条件と同じである。ダミー分子のアルキル鎖長、2−ブタノール生成量およびNADPH消費量の関係を表すグラフを図10に示す。また、ダミー分子のアルキル鎖長、2−ブタノール生成量、NADPH消費量およびカップリング率の関係を表5に示す。なお、PartialFC10は、PFC10の2,2,3,3位がフッ素化されず水素のままのダミー分子である。PartialFC10については、2−ブタノール生成量のみを測定した。
【0087】
【表5】

【0088】
表5および図10に示すように、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、NADPHが消費された。このため、PFC8〜PFC14によりP450BM3の活性化スイッチが入ったと考えられる。
【0089】
また、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、ブタンから2−ブタノールが生成した。この結果から、これらのダミー分子を用いることでP450BM3のブタン水酸化活性を高めることができ、ブタンを水酸化できることがわかる。また、P450BM3による2−ブタノール生成量は、PFC9>PFC10>PFC11>PFC12>PFC13>PFC14>PFC18の順に高い値を示した。この結果から、P450BM3のブタン水酸化活性を高めるためには、ダミー分子のアルキル鎖長が9〜12であるのが好ましく、アルキル鎖長が9〜10であるのがより好ましく、アルキル鎖長が9であるのが特に好ましいことがわかる。なお、PartialFC10をダミー分子として用いた場合にも、2−ブタノール生成量は非常に高い値を示した。この結果から、ダミー分子は、アルキル鎖に含まれる全ての水素がフッ素で置換されてなくても良く、一部の水素がフッ素で置換されていれば良いことがわかる。
【産業上の利用可能性】
【0090】
本発明の不活性炭化水素の水酸化方法およびダミー分子は、不活性炭化水素を水酸化して、シクロヘキサノール、ブタノール、プロパノール、フェノール等のアルコールを製造するための方法として用いることができる。
【技術分野】
【0001】
本発明は、シトクロムP450モノオキシゲナーゼとダミー分子とを用いて不活性炭化水素を水酸化する方法、および、この水酸化方法に用いられるダミー分子に関する。
【背景技術】
【0002】
細菌由来の酵素であるシトクロムP450は、真核生物由来のシトクロムP450に比べて高い触媒活性を持つことが知られている。細菌由来のシトクロムP450として、緑膿菌(Pseudomonas aeruginosa)由来のシトクロムP450camや、バチルス属菌細菌の一種であるBacillus megaterium由来のシトクロムP450BM3等の、シトクロムP450モノオキシゲナーゼが知られている。
【0003】
例えば、シトクロムP450camは、樟脳(カンファー)の水酸化反応を、毎分1000回転を超える速さで触媒することができる。この触媒活性は、哺乳類のP450の触媒活性(毎分数回から数十回転程度)と比較すると非常に高い。シトクロムP450BM3は、脂肪酸の末端から数えて1〜3番目(ω−1〜ω−3)のメチレン基の水酸化を触媒する。シトクロムP450BM3の触媒活性は毎分数千回転に達し、シトクロムP450BM3はシトクロムP450モノオキシゲナーゼとしては最大の活性を有する。
【0004】
また、真核生物由来のP450は膜蛋白質であるため、水に対する親和性が著しく低い。これに対して上述したシトクロムP450モノオキシゲナーゼは、水に対する親和性が高く、酵素蛋白の精製、結晶化ならびに取り扱いが容易である。
【0005】
また、シトクロムP450は、NADPHなどの電子供与体(以下、P450還元系と呼ぶ)と酸素とを用い、基質の水酸化を触媒する。単離したシトクロムP450の触媒活性を向上させるためには、P450還元系からP450への電子伝達を効率よく進行させる必要がある。上述したシトクロムP450BM3は、通常のシトクロムP450とは異なり、P450還元系の一部(シトクロムP450BM3ではFADおよびFMN)とP450とが融合して、1本のポリペプチドとして存在している。そして、P450還元系の一部とP450とが融合し非常に近接していることが、シトクロムP450モノオキシゲナーゼの優れた触媒活性の一つの要因となっている。換言すると、シトクロムP450BM3は融合蛋白であるため、非常に優れた触媒活性を示す。P450camは融合蛋白ではない。このため、P450camの触媒反応には、プチダレドキシン(Pdx)とプチダレドキシン還元酵素(PdR)とが必須である。しかしP450camもまた、上述したように優れた触媒活性を示す。
【0006】
これらの理由により、シトクロムP450モノオキシゲナーゼは、バイオ触媒として適していると考えられる。
【0007】
ところで、野生型のシトクロムP450の基質とならない物質、または、野生型のシトクロムP450によって水酸化され難い基質を水酸化するため、野生型のシトクロムP450を生産する細菌を形質転換して、これらの物質を基質とし得るシトクロムP450(以下、変異型シトクロムP450と呼ぶ)を発現させる技術が提案されている(例えば、特許文献1〜3参照)。
【0008】
例えば、野生型のシトクロムP450モノオキシゲナーゼは、シクロヘキサン、プロパン、ベンゼン、エタン、メタン等の不活性炭化水素に対する触媒活性が非常に低い。しかし変異型シトクロムP450モノオキシゲナーゼであれば、これらの不活性炭化水素の水酸化を触媒できる可能性がある。
【0009】
しかし、変異型シトクロムP450モノオキシゲナーゼを安価に量産するのは困難である。このため変異型シトクロムP450モノオキシゲナーゼは、不活性炭化水素を大量かつ継続的に(すなわち工業的に)水酸化するのには適していない問題があった。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特表2000−508163号公報
【特許文献2】特表2003−517815号公報
【特許文献3】特表2003−521889号公報
【発明の概要】
【発明が解決しようとする課題】
【0011】
本発明は上記事情に鑑みてなされたものであり、シトクロムP450モノオキシゲナーゼを用いて不活性炭化水素を工業的に水酸化できる方法を提供することを目的とする。
【課題を解決するための手段】
【0012】
上記課題を解決する本発明の不活性炭化水素の水酸化方法は、シトクロムP450モノオキシゲナーゼと、ダミー分子と、不活性炭化水素とを共存させて、該不活性炭化水素を水酸化する工程を含み、
該ダミー分子は、該シトクロムP450モノオキシゲナーゼの結合部位に結合可能な末端構造と、アルキル鎖と、を持ち、
該アルキル鎖に含まれる少なくとも一部の水素がフッ素で置換されていることを特徴とする。
【0013】
本発明の不活性炭化水素の水酸化方法は、以下の(1)〜(5)の何れかを備えるのが好ましく、(1)〜(5)の複数を備えるのがより好ましい。
【0014】
(1)前記シトクロムP450モノオキシゲナーゼは、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持つシトクロムP450モノオキシゲナーゼおよび/またはシトクロムP450camのアミノ酸配列と40%以上の相同性を持つシトクロムP450モノオキシゲナーゼである。
【0015】
(2)前記ダミー分子のなかで、少なくともアルキル鎖の末端から数えて1〜3番目のアルキル基に含まれる水素は、フッ素で置換されている。
【0016】
(3)前記末端構造は、水素末端、水酸基、アルデヒド基、カルボキシル基から選ばれる少なくとも一種である。
【0017】
(4)前記不活性炭化水素は、シクロヘキサン、ブタン、プロパン、ベンゼンから選ばれる少なくとも一種である。
【0018】
(5)前記シトクロムP450モノオキシゲナーゼは、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持ち、
前記ダミー分子は、パーフルオロカルボン酸である。
【0019】
上記課題を解決する本発明のダミー分子は、シトクロムP450モノオキシゲナーゼおよび不活性炭化水素と共存させて、該不活性炭化水素を水酸化するためのダミー分子であって、
該シトクロムP450モノオキシゲナーゼの結合部位に結合可能な末端構造と、アルキル鎖と、を持ち、
該アルキル鎖に含まれる少なくとも一部の水素がフッ素で置換されていることを特徴とする。
【0020】
本発明のダミー分子は以下の(6)〜(8)の何れかを備えるのが好ましく、(6)〜(8)の複数を備えるのがより好ましい。
【0021】
(6)少なくともアルキル鎖の末端から数えて1〜3番目のアルキル基に含まれる水素がフッ素で置換されている。
【0022】
(7)前記末端構造は、水素末端、水酸基、アルデヒド基、カルボキシル基から選ばれる少なくとも一種である。
【0023】
(8)前記シトクロムP450モノオキシゲナーゼは、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持ち、
前記ダミー分子は、パーフルオロカルボン酸である。
【発明の効果】
【0024】
以下、シトクロムP450モノオキシゲナーゼをP450と略する。P450の触媒反応は、以下のように開始すると考えられている。
【0025】
P450の活性中心には、基質が結合する結合部位が存在する。基質が結合部位に結合すると、活性中心に存在する水分子が活性中心から押し出される。以下、この状態を活性化スイッチが入る、と呼ぶ。活性中心は、その後、電子や酸素分子等の作用を受けた後に、基質の水酸化を触媒する。したがって、活性化スイッチが入らないと、P450の触媒反応は開始しないと考えられている。なお、野生型のP450の基質としては、ラウリン酸、ミリスチン酸、パルミチン酸が知られている。これらの基質は、結合部位に結合する末端構造(カルボキシル基)と、アルキル鎖とを持つ。
【0026】
本発明の不活性炭化水素の水酸化方法は、ダミー分子の共存下で、P450によって不活性炭化水素の水酸化を触媒する方法である。ダミー分子は、P450の結合部位に結合可能な部分(末端構造)と、アルキル鎖とを持つ。このためダミー分子とP450とを共存させると、ダミー分子が基質のかわりにP450の結合部位に結合し、活性化スイッチが入ると考えられる。
【0027】
上述したように、不活性炭化水素に対する野生型P450の触媒活性は非常に低い。しかし、活性化スイッチが入ることで、不活性炭化水素に対する野生型P450の触媒活性が向上する。したがって、本発明の不活性炭化水素の水酸化方法によると、野生型のP450を用いて不活性炭化水素を水酸化できる。
【0028】
また、このダミー分子において、アルキル鎖に含まれる少なくとも一部の水素は、フッ素で置換されている。このため、ダミー分子は活性中心の疎水性を高め、水分子を活性中心から排除すると考えられる。このため、本発明の不活性炭化水素の水酸化方法によると、P450における活性化スイッチが入り易く、触媒反応が進行し易い。
【0029】
これらの作用によって、本発明の不活性炭化水素の水酸化方法によると、野生型のP450によっても不活性炭化水素を水酸化できる。よって、本発明の不活性炭化水素の水酸化方法によると、シトクロムP450モノオキシゲナーゼを用いて不活性炭化水素を工業的に水酸化できる。なお、本発明の不活性炭化水素の水酸化方法によると、変異型P450を用いて不活性炭化水素を水酸化することも可能である。
【図面の簡単な説明】
【0030】
【図1】プロパンの水酸化確認試験で用いた反応装置を模式的に表す説明図である。
【図2】ダミー分子のアルキル鎖長、プロパノール生成量およびNADPH消費量の関係を表すグラフである。
【図3】反応時間、プロパノール生成量およびNADPH消費量の関係を表すグラフである。
【図4】パルミチン酸が結合したP450BM3の活性中心、および、PFC10が結合したP450BM3の活性中心を模式的に表す説明図である。
【図5】ダミー分子の鎖長、ヘキサンの有無およびNADPH消費量の関係を表すグラフである。
【図6】シクロヘキサンの水酸化確認試験で得られたガスクロマトグラフィー分析結果を表すグラフである。
【図7】ダミー分子の鎖長、シクロヘキサノール生成量およびNADPH消費量の関係を表すグラフである。
【図8】ベンゼンの水酸化確認試験で得られたガスクロマトグラフィー分析結果を表すグラフである。
【図9】ダミー分子のアルキル鎖長、フェノール生成量およびNADPH消費量の関係を表すグラフである。
【図10】ダミー分子のアルキル鎖長、2−ブタノール生成量およびNADPH消費量の関係を表すグラフである。
【発明を実施するための形態】
【0031】
本発明の不活性炭化水素の水酸化方法で用いるP450としては、シトクロムP450BM3(CYP102A1)および/またはシトクロムP450cam(カンファー5−モノオキシゲナーゼ、CYP101)を特に好ましく選択できる。上述したように、これらのP450は触媒活性に優れるからである。
【0032】
また、P450としては、シトクロムP450BM3、シトクロムP450camのみでなく、これらの酵素のアミノ酸配列とアミノ酸配列が一部異なる酵素を用いても良い。例えば、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持つP450(シトクロムP450BM3のファミリー酵素)や、シトクロムP450BM3のアミノ酸配列と55%以上の相同性を持つP450(シトクロムP450BM3のサブファミリー酵素)を好ましく用いることができる。或いは、シトクロムP450camのアミノ酸配列と40%以上の相同性を持つP450(シトクロムP450camのファミリー酵素)や、シトクロムP450camのアミノ酸配列と55%以上の相同性を持つP450(シトクロムP450camのサブファミリー酵素)を好ましく用いることができる。なお、シトクロムP450BM3のファミリー酵素またはサブファミリー酵素は脂肪酸を水酸化可能であるのが好ましく、シトクロムP450camのファミリー酵素またはサブファミリー酵素はカンファー(C10H16O)を水酸化可能であるのが好ましい。
なお、シトクロムP450BM3のアミノ酸配列は、例えばJ.Biol.chem.264(19),10987−10998(1989)や、NCBIのベータベース(National Center for Biotechnology Information http://www.ncbi.nlm.nih.gov/protein/P14779.2)に開示されているように、公知である。また、シトクロムP450camのアミノ酸もまた、NCBIデータベース(http://www.ncbi.nlm.nih.gov/protein/YP_714029)に開示されているように公知である。本発明の不活性炭化水素の水酸化方法で用いるダミー分子は、末端構造とアルキル鎖とを持つ。ダミー分子の一例を下式1に示す。
(式1)

【0033】
末端構造(式1中R)は、P450の結合部位に結合可能であれば良く、水素末端、水酸基、アルデヒド基、カルボキシル基等が例示される。ダミー分子の末端構造は1のみであっても良いし、複数であっても良い。1つのダミー分子に含まれる複数の末端構造は、同一の構造であっても良いし、互いに異なる構造であっても良い。
【0034】
ダミー分子におけるアルキル鎖の鎖長は特に限定されない。また、ダミー分子のアルキル鎖は1のみであっても良いし、複数に分岐していても良いし、環状であっても良い。本発明のダミー分子においては、このアルキル鎖に含まれる一部または全部の水素がフッ素置換されていれば良いが、後述するように、少なくともアルキル鎖の末端から数えて1〜3番目のアルキル基に含まれる水素がフッ素で置換されているのが好ましい。少なくとも、アルキル鎖の末端から数えて1〜7番目のアルキル基に含まれる水素がフッ素で置換されているのがさらに好ましい。
【0035】
ダミー分子としては、例えば式2に示すようなものを用いることもできる。
(式2)

【0036】
本発明の不活性炭化水素の水酸化方法において、P450、ダミー分子および不活性炭化水素の反応は、バッチ式でおこなっても良いし、連続的におこなっても良い。反応を連続的におこなう場合には、P450を公知の酵素固定手段(例えば、反応槽の壁面やフィルタ等)に固定化すれば良い。さらに、本発明の不活性炭化水素の水酸化方法における反応系は、NADPH(NADP)、酸素分子等のP450の反応に必要な因子を含むのが良い。
【0037】
P450としては、野生型を用いても良いし、変異型を用いても良いが、上述したように不活性炭化水素を工業的に水酸化するためには、野生型を用いるのが好ましい。
【実施例】
【0038】
以下、本発明の不活性炭化水素の水酸化方法およびダミー分子を具体的に説明する。
【0039】
1.P450の調製
〔1〕シトクロムP450BM3の調製
以下の方法により、シトクロムP450BM3(以下、P450BM3と略する)を部分精製した。
【0040】
先ず、大腸菌(DH5α株)に、P450BM3全長の塩基配列を挿入したpUCベクターを組み込んで、P450BM3遺伝子を発現させた。
【0041】
この大腸菌を培養し、得られた大腸菌を超音波破砕することで、大腸菌が生産したP450BM3を大腸菌から抽出した。
【0042】
得られた破砕液を、硫酸アンモニウム沈殿法により分画(塩析)し、硫酸アンモニウムの飽和度40〜60(%飽和)で生じた沈殿を回収した。この沈殿をTris−HCl緩衝溶液pH7.4(以下緩衝液Aと呼ぶ)に分散させた。上述した沈殿の100倍量(体積比)の緩衝液Aを用いて、沈殿分散液を2回透析した。この操作によって沈殿分散液中の硫酸アンモニウムを脱塩した。
【0043】
透析後の沈殿分散液(粗酵素液と呼ぶ)を陰イオン交換カラム(DEAE650SまたはDE−52)に通し、粗酵素液に含まれるP450BM3をカラムに吸着させた。カラムに吸着したP450BM3を、KCl水溶液(濃度勾配0〜500mmol/l)を用いて溶出し、P450BM3の色である茶色のピーク画分を回収した。
【0044】
回収した粗酵素液に含まれるP450BM3には、基質が結合している可能性がある。この基質をP450BM3から除去するために、回収した粗酵素液に500mmol/l程度となる量のNADPHを加え、4℃で30分間反応させた。反応後、残存するNADPHを分離し、かつ、緩衝液を置換するため、粗酵素液をゲルろ過カラム(Sephacryl S300)に通した。ここで用いた緩衝液は、緩衝液Aに100mmol/lとなる量のKClを加えた緩衝液(以下緩衝液Bと呼ぶ)である。ゲルろ過カラムを通して得られた茶色のピーク画分を回収し、得られた画分(P450BM3溶液と呼ぶ)をP450として以下の試験に用いた。
【0045】
2.ダミー分子の調製
ダミー分子として、炭素数8〜14のパーフルオロ脂肪酸を準備した。
【0046】
PFC8〜PFC14は、アルキル鎖に含まれる水素全てがフッ素で置換されている。各ダミー分子をそれぞれメタノールに溶解させたものを、ダミー分子溶液として以下の試験に用いた。
【0047】
3.P450およびダミー分子を用いた不活性炭化水素の水酸化試験
〔1〕プロパンの水酸化確認試験
上述したP450BM3溶液およびPFC10溶液を用いて、不活性炭化水素の一種であるプロパンを水酸化した。
【0048】
高純度プロパンガスと高純度酸素ガスとを80:20(体積比)で混合した混合ガスを準備した。この混合ガスを上述した緩衝液Bに吹き込み、混合ガス飽和緩衝液Bを調製した。この混合ガス飽和緩衝液Bに、P450BM3溶液、PFC10溶液、およびNADPHを加えて、プロパンの水酸化反応を開始した。混合ガス飽和緩衝液Bは、反応開始時の反応液中に90体積%以上含まれていた。また、反応開始時の反応液中において、P450BM3の濃度は500nmol/lであり、PFC10の濃度は100μmol/lであり、NADPHの濃度は5mmol/lであった。さらに、この反応液は0.5体積%のメタノールを含んでいた。
【0049】
図1に示すように、反応は密閉したバイアルで行った。このバイアルには、上述した混合ガスで満たしたバルーンを接続した。バルーンの加圧下で、反応液を撹拌しながら、反応を進行させた。反応開始30分後に、反応で生成したアルコール(プロパノール)をガスクロマトグラフィーにより検出・定量した。なお、対照実験として、PFC10に代えて0.5体積%のメタノールのみを添加した系と、プロパンガスを添加していない系とを同様に反応させ、反応液中のプロパノールをガスクロマトグラフィー分析した。
【0050】
ガスクロマトグラフィー分析は以下のようにおこなった。
【0051】
先ず、反応液中のアルコールを亜硝酸エステルに誘導体化した。アルコールの誘導体化は、文献(Nguyen et al.,Anal.Sci.2001,17,639−643及びPeters et al.,J.AM.Chem.Soc.2003,125,13442−13450)にならっておこなった。詳しくは、反応液1mlに0.15gの亜硝酸ナトリウムを加え、次いで0.5mlのヘキサンを加えた後に、氷上で反応液に20%硫酸を150ml滴下し、15分間反応させることで、反応液中のアルコールを誘導体化した。
【0052】
誘導体化後、ヘキサン相を回収し、回収したヘキサン相を純水で洗浄した。洗浄後のヘキサン相をガスクロマトグラフィー用の分析試料とした。ガスクロマトグラフは島津社製のFID検出器を有するGC−2014を用い、カラムはRestek社製のRtx−1カラム(内径0.53mm、液層の膜厚3mm、カラム長60m)を用いた。ガスクロマトグラフにおける試料注入口温度は250℃であった。カラムオーブンの温度プログラムは、50℃で5分維持し、その後6分かけて200℃まで昇温し、そのまま3分間維持するよう設定した。検出器は250℃に設定した。
【0053】
反応液をガスクロマトクラフィー分析した結果、P450BM3、ダミー分子およびプロパンガスを含む反応系では、対照試験では見られないピークが一つだけ得られた。このピークが反応生成物のピークだと考えられる。プロパンを水酸化すると、1−プロパノールもしくは2−プロパノールが生成する可能性がある。そこで、2−プロパノールをガスクロマトグラフィー分析したところ、2−プロパノールのピーク(保持時間)は、反応生成物のピークと一致した。この結果から、反応生成物が2−プロパノールであることがわかった。
【0054】
また、上記のガスクロマトグラフィー分析では、誘導体化したプロパノールに相当するピークは検出されなかった。この結果から、亜硝酸エステルに誘導体化したプロパノールは、本条件下では不安定であり亜硝酸エステルとして検出することはできないこと、および、分解してプロパノールそのものとして検出されることがわかった。
【0055】
なお、内部標準として1mmol/lのエタノールを用い、反応液中の2−プロパノールを定量した結果、上記条件で30分間反応させると600μmol/lを超える2−プロパノールが生じた。
【0056】
〔2〕プロパンを基質とする場合のダミー分子の評価
アルキル鎖長10〜13のダミー分子(PFC10〜PFC13)を用い、ダミー分子のアルキル鎖長とプロパンの水酸化との相関を調べた。P450としてはP450BM3溶液を用いた。また、反応条件は上述した反応条件と同じである。なお、1molのプロパノールを生成する際には、1molのNADPHが消費される。このため、カップリング率は、プロパノール生成量 (μmol/分)÷NADPH消費量(μmol/分)×100で算出できる。NADPH量は、UVスペクトル(340nm)における吸光度の減少と、NADPHのモル吸光係数ε340nm=6200M−1cm−1とを用いて算出した。ダミー分子のアルキル鎖長、プロパノール生成量およびNADPH消費量の関係を表すグラフを図2に示す。また、ダミー分子のアルキル鎖長、プロパノール生成量、NADPH消費量およびカップリング率の関係を表1に示す。
【0057】
【表1】

【0058】
表1および図2に示すように、ダミー分子としてPFC9〜PFC13の何れを用いた場合にも、NADPHが消費された。このため、ダミー分子(PFC9〜PFC13)によってP450BM3の活性化スイッチが入ったと考えられる。
【0059】
また、ダミー分子としてPFC9〜PFC13の何れを用いた場合にも、プロパンからプロパノールが生成した。この結果から、これらのダミー分子を用いることでP450BM3のプロパン水酸化活性を高めることができ、プロパンを水酸化できることがわかる。また、P450BM3によるプロパノール生成量は、PFC10>PFC11>PFC12≧PFC9>PFC13の順に高い値を示した。この結果から、P450BM3のプロパン水酸化活性を高めるためには、ダミー分子のアルキル鎖長が9〜12であるのが好ましく、アルキル鎖長が10〜11であるのがより好ましく、アルキル鎖長が10であるのが特に好ましいことがわかる。
【0060】
〔3〕P450BM3およびPFC10によるプロパン水酸化の経時変化
P450BM3とPFC10とを用い、反応開始10分後、30分後、60分後および180分後におけるプロパノール生成量およびNADPH消費量を測定することで、プロパンの水酸化反応の経時変化を調べた。反応条件は上述した反応条件と同じである。反応時間、プロパノール生成量およびNADPH消費量の関係を表すグラフを図3に示す。また、反応時間、プロパノール生成量、NADPH消費量およびカップリング率の関係を表2に示す。
【0061】
【表2】

【0062】
表2および図3に示すように、P450BM3およびPFC10によるプロパンの水酸化反応は、NADPHを消費するまで進行した。
【0063】
〔4〕P450BM3の活性中心における基質およびダミー分子の配位
野生型P450BM3の基質であるパルミチン酸が結合したP450BM3の活性中心を模式的に表す説明図を図4(a)に示し、PFC10が結合したP450BM3の活性中心を模式的に表す説明図を図4(b)に示す。図4(a)、(b)は、基質結合型のP450BM3の結晶構造の基質をPFC10に置き換えたものである。なお、この結晶構造は、PDB(蛋白質構造データバンク Protein Data Bank)のデータベースに格納されている構造データであり、そのエントリーID(PDB ID)は1FAGである。
【0064】
P450は活性部位にヘムを持つ。ヘムは水酸化反応の反応場であり、図4(a)、(b)に示すように、ヘムの上方には基質やダミー分子が結合する結合部位が存在する。
【0065】
上述したように、プロパンを水酸化する場合、P450BM3の水酸化活性は、アルキル鎖長10のPFC10をダミー分子として用いたとき非常に高くなる。これは、野生型P450BM3の基質であるパルミチン酸(アルキル鎖長16)に対し、PFC10(アルキル鎖長10)のアルキル鎖長は6短いため、反応場であるヘム上方に、プロパンが取り込まれる空間が確保されるためと考えられる。
【0066】
また、PFC10、すなわちフッ素置換されたダミー分子が活性中心の結合部位に結合することで、反応場の疎水性が高められると考えられる。このため、同じく疎水性のプロパンが活性中心の反応場に入り込み易くなり、かつ、水分子が反応場から排除されると考えられる。このため、活性化スイッチが入り、プロパンの水酸化反応が進行すると考えられる。
【0067】
また、PFC9(アルキル鎖長9)をダミー分子として用いた場合には、ダミー分子のアルキル鎖長が短いために、活性化スイッチが十分に入らないと考えられる。このため、ダミー分子としてPFC9を用いる場合には、ダミー分子としてPFC10を用いる場合に比べて、プロパノール生成量(すなわちP450の水酸化活性)とNADPH消費量の双方が低下したと解釈できる。
【0068】
また、PFC13(アルキル鎖長13)をダミー分子として用いた場合には、ダミー分子のアルキル鎖長が長いために、プロパノール生成量(P450の水酸化活性)が低下する。これは、ダミー分子のアルキル鎖長が過剰に長いと、反応場上方の空間(基質が取り込まれる空間)が狭くなり、プロパンが取り込まれ難くなるためと考えられる。なお、この場合にも活性化スイッチは入るために、NADPHの消費は十分に早く進行する。
【0069】
活性化スイッチを入れ、かつ、P450BM3の水酸化活性を充分に高めることを考慮すると、P450BM3によってプロパンを水酸化するためのダミー分子としては、PFC10(パーフルオロデカン酸)を用いるのが特に好ましいと考えられる。
【0070】
〔5〕シクロヘキサンの水酸化確認試験
上述したP450BM3溶液およびダミー分子(PFC8〜14)溶液を用いて、不活性炭化水素の一種であるシクロヘキサンを水酸化した。
【0071】
上述した緩衝液Bに、P450BM3溶液、ダミー分子溶液、NADPHおよびシクロヘキサンを加えて、シクロヘキサンの水酸化反応を開始した。シクロヘキサンは、エタノールに溶解したものを用いた。反応開始時の反応液中において、P450BM3の濃度は100nmol/lであり、ダミー分子の濃度は0.1mmol/lであり、NADPHの濃度は1mmol/lであり、シクロヘキサンの濃度は10mmol/lであった。さらに、この反応液は1体積%のエタノールを含んでいた。
【0072】
反応液を攪拌しつつ室温で一晩放置し、シクロヘキサンの水酸化反応を進行させた。その後、反応で生成したアルコール(シクロヘキサノール)をガスクロマトグラフィーにより検出・定量した。なお、対照実験として、ダミー分子溶液に代えて0.5体積%のエタノールのみを添加した系(ダミー分子なし)を同様に反応させ、反応液中のシクロヘキサノールをガスクロマトグラフィー分析した。
【0073】
反応液をガスクロマトクラフィー分析した結果、図6に示すように、ダミー分子、P450BM3、およびシクロヘキサンを含む反応液からはシクロヘキサノールが検出された。ダミー分子を含まない反応液からは、有意な量のシクロヘキサノールは検出されなかった。この結果から、ダミー分子(PFC8〜14)を共存させることで、P450BM3のシクロヘキサン水酸化活性を向上させ得ることがわかる。
【0074】
〔6〕シクロヘキサンを基質とする場合のダミー分子の評価
アルキル鎖長8〜14のダミー分子(PFC8〜PFC14)を用い、ダミー分子のアルキル鎖長とシクロヘキサンの水酸化との相関を調べた。P450としてはP450BM3溶液を用いた。反応条件は、反応時間が10分間であったこと以外は、上述した反応条件と同じであった。反応で生成したシクロヘキサノール量(μmol/分)と、反応で消費したNADPH量(μmol/分)とを、使用したダミー分子毎に比較した。また、シクロヘキサノール生成に利用されたNADPH量のNADPH消費量(全量)に対する割合(カップリング率(%))を算出した。
【0075】
ダミー分子の鎖長、シクロヘキサノール生成量およびNADPH消費量の関係を表すグラフを図7に示す。また、ダミー分子のアルキル鎖長、シクロヘキサノール生成量、NADPH消費量およびカップリング率の関係を表3に示す。
【0076】
【表3】

【0077】
表3および図7に示すように、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、NADPHが消費された。上述したように、活性化スイッチがはいるとNADPHが消費されるため、ダミー分子の存在によって活性化スイッチが入ると考えられる。なお、ダミー分子を添加せず、同様に10分間反応させた場合、シクロヘキサノールは検出されなかった。
【0078】
また、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、シクロヘキサンからシクロヘキサノールが生成した。この結果から、アルキル鎖長(ここでは炭素数)8〜14程度のダミー分子を用いることでP450BM3のシクロヘキサン水酸化活性を高めることができ、シクロヘキサンを反応性高く水酸化できることがわかる。また、シクロヘキサノール生成量およびNADPH消費量はダミー分子のアルキル鎖長に応じて異なっていた。P450BM3によるシクロヘキサノール生成量は、PFC9>PFC10>PFC8>PFC11>PFC12>PFC13>PFC14の順に高い値を示した。この結果から、P450BM3のシクロヘキサン水酸化活性を高めるためには、ダミー分子のアルキル鎖長が8〜12であるのが好ましく、アルキル鎖長が8〜11であるのがより好ましく、アルキル鎖長が9であるのが特に好ましいことがわかる。
【0079】
〔7〕ベンゼンの水酸化確認試験
上述したP450BM3溶液およびダミー分子(PFC8〜PFC14)溶液を用いて、不活性炭化水素の一種であるベンゼンを水酸化した。ベンゼンはエタノールに溶解したものを用いた。それ以外は、上述したシクロヘキサンの水酸化と同じである。検出は、HPLCで行った。
【0080】
反応開始時の反応液中において、P450BM3の濃度は500nmol/lであり、ダミー分子の濃度は100μmol/lであり、NADPHの濃度は5mmol/lであった。さらに、この反応液は1体積%のエタノールを含んでいた。反応開始10分後に、反応で生成したアルコール(フェノール)をHPLCにより検出・定量した。なお、対照実験として、ダミー分子にかえて緩衝液Bを添加した系を同様に反応させ、反応液中のフェノールを分析した。
【0081】
反応液をガスクロマトクラフィー分析した結果、図8に示すように、P450BM3、ダミー分子およびベンゼンを含む反応系では、ベンゼンのピークおよびフェノールのピークが確認された。図示していないが、対照実験の反応系では、ベンゼンのピークのみが確認され、フェノールのピークは確認されなかった。この結果から、P450BM3およびダミー分子によって反応液中のベンゼンが水酸化され、フェノールが生じることが確認された。そしてこの結果から、ダミー分子(PFC8〜PFC14)を用いることで、P450BM3のベンゼン水酸化活性を向上させ得ることがわかる。
【0082】
〔8〕ベンゼンを基質とする場合のダミー分子の評価
アルキル鎖長8〜14のダミー分子(PFC8〜PFC14)を用い、ダミー分子のアルキル鎖長とベンゼンの水酸化との相関を調べた。P450としてはP450BM3溶液を用いた。また、反応条件は上述した反応条件と同じである。ダミー分子のアルキル鎖長、フェノール生成量およびNADPH消費量の関係を表すグラフを図9に示す。また、ダミー分子のアルキル鎖長、フェノール生成量、NADPH消費量およびカップリング率の関係を表4に示す。
【0083】
【表4】

【0084】
表4および図9に示すように、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、NADPHが消費された。このため、PFC8〜PFC14によりP450BM3の活性化スイッチが入ったと考えられる。
【0085】
また、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、ベンゼンからフェノールが生成した。この結果から、これらのダミー分子を用いることでP450BM3のベンゼン水酸化活性を高めることができ、ベンゼンを水酸化できることがわかる。また、P450BM3によるフェノール生成量は、PFC9>PFC10>PFC11>PFC12>PFC8>PFC13>PFC14の順に高い値を示した。この結果から、P450BM3のベンゼン水酸化活性を高めるためには、ダミー分子のアルキル鎖長が9〜12であるのが好ましく、アルキル鎖長が9〜11であるのがより好ましく、アルキル鎖長が9であるのが特に好ましいことがわかる。
【0086】
〔9〕ブタンを基質とする場合のダミー分子の評価
アルキル鎖長8〜14のダミー分子(PFC8〜PFC14)、および、部分的にフッ素化された脂肪酸からなるダミー分子(PartialFC10と呼ぶ)を用い、ダミー分子のアルキル鎖長とブタンの水酸化との相関を調べた。P450としてはP450BM3溶液を用いた。また、反応条件は上述した反応条件と同じである。ダミー分子のアルキル鎖長、2−ブタノール生成量およびNADPH消費量の関係を表すグラフを図10に示す。また、ダミー分子のアルキル鎖長、2−ブタノール生成量、NADPH消費量およびカップリング率の関係を表5に示す。なお、PartialFC10は、PFC10の2,2,3,3位がフッ素化されず水素のままのダミー分子である。PartialFC10については、2−ブタノール生成量のみを測定した。
【0087】
【表5】

【0088】
表5および図10に示すように、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、NADPHが消費された。このため、PFC8〜PFC14によりP450BM3の活性化スイッチが入ったと考えられる。
【0089】
また、ダミー分子としてPFC8〜PFC14の何れを用いた場合にも、ブタンから2−ブタノールが生成した。この結果から、これらのダミー分子を用いることでP450BM3のブタン水酸化活性を高めることができ、ブタンを水酸化できることがわかる。また、P450BM3による2−ブタノール生成量は、PFC9>PFC10>PFC11>PFC12>PFC13>PFC14>PFC18の順に高い値を示した。この結果から、P450BM3のブタン水酸化活性を高めるためには、ダミー分子のアルキル鎖長が9〜12であるのが好ましく、アルキル鎖長が9〜10であるのがより好ましく、アルキル鎖長が9であるのが特に好ましいことがわかる。なお、PartialFC10をダミー分子として用いた場合にも、2−ブタノール生成量は非常に高い値を示した。この結果から、ダミー分子は、アルキル鎖に含まれる全ての水素がフッ素で置換されてなくても良く、一部の水素がフッ素で置換されていれば良いことがわかる。
【産業上の利用可能性】
【0090】
本発明の不活性炭化水素の水酸化方法およびダミー分子は、不活性炭化水素を水酸化して、シクロヘキサノール、ブタノール、プロパノール、フェノール等のアルコールを製造するための方法として用いることができる。
【特許請求の範囲】
【請求項1】
シトクロムP450モノオキシゲナーゼと、ダミー分子と、不活性炭化水素とを共存させて、該不活性炭化水素を水酸化する工程を含み、
該ダミー分子は、該シトクロムP450モノオキシゲナーゼの結合部位に結合可能な末端構造と、アルキル鎖と、を持ち、
該アルキル鎖に含まれる少なくとも一部の水素がフッ素で置換されていることを特徴とする不活性炭化水素の水酸化方法。
【請求項2】
前記シトクロムP450モノオキシゲナーゼは、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持つシトクロムP450モノオキシゲナーゼおよび/またはシトクロムP450camのアミノ酸配列と40%以上の相同性を持つシトクロムP450モノオキシゲナーゼである請求項1に記載の不活性炭化水素の水酸化方法。
【請求項3】
前記ダミー分子のなかで、少なくともアルキル鎖の末端から数えて1〜3番目のアルキル基に含まれる水素は、フッ素で置換されている請求項1または請求項2に記載の不活性炭化水素の水酸化方法。
【請求項4】
前記末端構造は、水素末端、水酸基、アルデヒド基、カルボキシル基から選ばれる少なくとも一種である請求項1〜請求項3の何れか一つに記載の不活性炭化水素の水酸化方法。
【請求項5】
前記不活性炭化水素は、シクロヘキサン、ブタン、プロパン、ベンゼンから選ばれる少なくとも一種である請求項1〜請求項4の何れか一つに記載の不活性炭化水素の水酸化方法。
【請求項6】
前記シトクロムP450モノオキシゲナーゼは、アミノ酸配列と40%以上の相同性を持ち、
前記ダミー分子は、パーフルオロカルボン酸である請求項1〜請求項5の何れか一つに記載の不活性炭化水素の水酸化方法。
【請求項7】
シトクロムP450モノオキシゲナーゼおよび不活性炭化水素と共存させて、該不活性炭化水素を水酸化するためのダミー分子であって、
該シトクロムP450モノオキシゲナーゼの結合部位に結合可能な末端構造と、アルキル鎖と、を持ち、
該アルキル鎖に含まれる少なくとも一部の水素がフッ素で置換されていることを特徴とするダミー分子。
【請求項8】
少なくともアルキル鎖の末端から数えて1〜3番目のアルキル基に含まれる水素がフッ素で置換されている請求項7に記載のダミー分子。
【請求項9】
前記末端構造は、水素末端、水酸基、アルデヒド基、カルボキシル基から選ばれる少なくとも一種である請求項7または請求項8に記載の不活性炭化水素の水酸化方法。
【請求項10】
前記シトクロムP450モノオキシゲナーゼは、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持ち、
前記ダミー分子はパーフルオロカルボン酸である請求項7〜請求項9の何れか一つに記載のダミー分子。
【請求項1】
シトクロムP450モノオキシゲナーゼと、ダミー分子と、不活性炭化水素とを共存させて、該不活性炭化水素を水酸化する工程を含み、
該ダミー分子は、該シトクロムP450モノオキシゲナーゼの結合部位に結合可能な末端構造と、アルキル鎖と、を持ち、
該アルキル鎖に含まれる少なくとも一部の水素がフッ素で置換されていることを特徴とする不活性炭化水素の水酸化方法。
【請求項2】
前記シトクロムP450モノオキシゲナーゼは、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持つシトクロムP450モノオキシゲナーゼおよび/またはシトクロムP450camのアミノ酸配列と40%以上の相同性を持つシトクロムP450モノオキシゲナーゼである請求項1に記載の不活性炭化水素の水酸化方法。
【請求項3】
前記ダミー分子のなかで、少なくともアルキル鎖の末端から数えて1〜3番目のアルキル基に含まれる水素は、フッ素で置換されている請求項1または請求項2に記載の不活性炭化水素の水酸化方法。
【請求項4】
前記末端構造は、水素末端、水酸基、アルデヒド基、カルボキシル基から選ばれる少なくとも一種である請求項1〜請求項3の何れか一つに記載の不活性炭化水素の水酸化方法。
【請求項5】
前記不活性炭化水素は、シクロヘキサン、ブタン、プロパン、ベンゼンから選ばれる少なくとも一種である請求項1〜請求項4の何れか一つに記載の不活性炭化水素の水酸化方法。
【請求項6】
前記シトクロムP450モノオキシゲナーゼは、アミノ酸配列と40%以上の相同性を持ち、
前記ダミー分子は、パーフルオロカルボン酸である請求項1〜請求項5の何れか一つに記載の不活性炭化水素の水酸化方法。
【請求項7】
シトクロムP450モノオキシゲナーゼおよび不活性炭化水素と共存させて、該不活性炭化水素を水酸化するためのダミー分子であって、
該シトクロムP450モノオキシゲナーゼの結合部位に結合可能な末端構造と、アルキル鎖と、を持ち、
該アルキル鎖に含まれる少なくとも一部の水素がフッ素で置換されていることを特徴とするダミー分子。
【請求項8】
少なくともアルキル鎖の末端から数えて1〜3番目のアルキル基に含まれる水素がフッ素で置換されている請求項7に記載のダミー分子。
【請求項9】
前記末端構造は、水素末端、水酸基、アルデヒド基、カルボキシル基から選ばれる少なくとも一種である請求項7または請求項8に記載の不活性炭化水素の水酸化方法。
【請求項10】
前記シトクロムP450モノオキシゲナーゼは、シトクロムP450BM3のアミノ酸配列と40%以上の相同性を持ち、
前記ダミー分子はパーフルオロカルボン酸である請求項7〜請求項9の何れか一つに記載のダミー分子。
【図1】


【図2】


【図3】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図4】




【図2】


【図3】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図4】


【公開番号】特開2012−24009(P2012−24009A)
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願番号】特願2010−164828(P2010−164828)
【出願日】平成22年7月22日(2010.7.22)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願日】平成22年7月22日(2010.7.22)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
[ Back to top ]

