活性化好中球の検出方法
【課題】本発明は、正常白血球の分類および活性化好中球の検出を可能にする活性化好中球の検出方法を提供することを課題とする。
【解決手段】生体試料中の赤血球が溶血され、白血球の核酸が核酸染色性の蛍光色素によって染色された測定試料を調製し、この試料に光を照射し、該試料中の粒子から生じる散乱光強度および蛍光強度を測定して得た散乱光強度および蛍光強度に基づいて、前記生体試料中の白血球を少なくとも好中球を含む集団と好酸球を含む集団とに分類し、好中球を含む集団と好酸球を含む集団との間に存在する粒子を、活性化好中球として検出する方法により、上記の課題を解決する。
【解決手段】生体試料中の赤血球が溶血され、白血球の核酸が核酸染色性の蛍光色素によって染色された測定試料を調製し、この試料に光を照射し、該試料中の粒子から生じる散乱光強度および蛍光強度を測定して得た散乱光強度および蛍光強度に基づいて、前記生体試料中の白血球を少なくとも好中球を含む集団と好酸球を含む集団とに分類し、好中球を含む集団と好酸球を含む集団との間に存在する粒子を、活性化好中球として検出する方法により、上記の課題を解決する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体試料中の活性化好中球を検出する方法に関する。
【背景技術】
【0002】
正常な白血球は、通常、好中球、好酸球および好塩基球からなる顆粒球、ならびにリンパ球および単球に分類される。それらの中でも、好中球は、白血球の50〜60%を占めており、細菌、真菌などの病原微生物に対する生体防御において重要な役割を果たしている。例えば、細菌感染などにより生体に異物が侵入したとき、好中球は、生体の炎症反応などに起因する刺激によって活性化され、感染部位に遊走して異物を貪食する。好中球に貪食された異物は、好中球内で産生されている各種の分解酵素および強力な毒性物質である活性酸素種(ROS)によって殺菌される。
【0003】
他方で、刺激により活性化された好中球(以下、「活性化好中球」ともいう)は、生体内で正常組織を傷害する場合がある。例えば、活性化好中球により産生される過剰なROSは、虚血再灌流障害、自己免疫疾患などの炎症反応において、生体の自己組織を傷害することが知られている。また、活性化好中球により産生されたROSは、急性呼吸窮迫症候群、潰瘍性大腸炎、急性胃粘液膜病変などの病変形成に関与することが知られている。さらに、輸血関連急性肺障害においても、活性化好中球の関与が知られている。
【0004】
このように、活性化好中球は種々の疾患および障害に関与することから、血液検査において、白血球の分類計数のみならず、活性化好中球も検出することは、疾患の診断、病態の把握、治療モニタリングなどに極めて有用な情報を得ることができる。
【0005】
近年、臨床検査の分野においては、検体中の白血球の分類計数は、フローサイトメトリーの原理を応用した自動血球計数装置により行われている。また、そのような装置による測定のための血球分類用試薬も市販されている。この試薬を用いて検体を自動血球計数装置で測定すると、検出された各血球のシグナルはそれぞれスキャッタグラム上の所定の領域に出現する。
【0006】
上記のような試薬を用いて白血球を分類計数する方法は、当該技術においていくつか知られている。例えば、特許文献1には、RNAを特異的に染色する染色液と、カチオン性界面活性剤およびノニオン性界面活性剤を含む溶血剤との組み合わせからなる試薬キットを用いて、異常白血球と正常白血球との両方を分類計数する方法が開示されている。また、特許文献2および3には、所定の蛍光色素を含む染色液と、カチオン性界面活性剤および/またはノニオン性界面活性剤を含む溶血剤を含有する試薬を用いて、白血球を4種または5種に分類して計数する方法が開示されている。しかしながら、これらの特許文献のいずれにも、活性化好中球を検出することについては開示されていない。
【0007】
活性化好中球を含み得る検体を測定した例としては、J. Linssenらの文献(非特許文献1)が挙げられる。J. Linssenらは、刺激物質により活性化処理した全血を検体として自動血球計数装置XE-2100(シスメックス株式会社製)で測定すると、白血球分類・計数チャンネル(DIFF-channel)において、好中球として分類された集団の平均側方散乱光強度(NEUT-X)および平均蛍光強度(NEUT-Y)が、未処理の検体に比べて低下することを報告している。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特許第4248017号公報
【特許文献2】米国特許出願第2009/0023129号
【特許文献3】米国特許出願第2011/0027788号
【非特許文献】
【0009】
【非特許文献1】J. Linssenら, Cytometry Part B (Clinical Cytometry), 74B, 295-309 (2008)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、正常白血球を分類計数することができ、且つ活性化好中球を検出することを可能にする活性化好中球の検出方法を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者らは、活性化刺激され、且つ活性酸素種を産生している好中球について、自動血球計数装置を用いた測定において、そのシグナルがどのように変化するかを検討した。その結果、驚くべきことに、上記のJ. Linssenらの報告とは異なって、活性酸素種を産生している好中球は、好中球を含む集団と好酸球を含む集団との間に存在すること、さらに、その蛍光強度が通常の好中球以下であり、且つ散乱光強度が通常の好中球よりも高いこと、すなわち散乱光強度が通常の好中球と好酸球との間であることを見出して、本発明を完成した。
【0012】
すなわち、本発明は、
生体試料中の赤血球が溶血され、白血球の核酸が核酸染色性の蛍光色素によって染色された測定試料を調製する工程と、
調製された測定試料に光を照射し、該試料中の粒子から生じる散乱光強度および蛍光強度を測定する工程と、
取得した散乱光強度および蛍光強度に基づいて、前記生体試料中の白血球を少なくとも好中球を含む集団と好酸球を含む集団とに分類する工程と、
好中球を含む集団と好酸球を含む集団との間に存在する粒子を、活性化好中球として検出する工程と
を含む、活性化好中球の検出方法を提供する。
【発明の効果】
【0013】
本発明の活性化好中球の検出方法によれば、生体試料中の正常白血球を分類計数し、且つ活性化好中球を検出することを可能にする。
【図面の簡単な説明】
【0014】
【図1】正常な白血球をフローサイトメータにより測定したときのスキャッタグラムである。
【図2】本発明の測定装置の外観を示す図である。
【図3】測定部の機能ブロック図である。
【図4】検出部の構成図である。
【図5】測定試料を検出部で測定する流れを示す図である。
【図6】データ処理部の機能ブロック図である。
【図7】データ処理部の処理のフローチャートである。
【図8】データ処理部により表示される結果表示画面の一例を示す図である。
【図9】データ処理部により表示される結果表示画面の変形例を示す図である。
【図10】実施例1の測定により得られたスキャッタグラムである。
【図11】参考例1の結果を示す顕微鏡写真である。
【図12】参考例2の結果を示す電子顕微鏡写真である。
【図13】実施例2の測定により得られたスキャッタグラムである。
【発明を実施するための形態】
【0015】
本発明の実施形態において、生体試料は、白血球を含む体液試料であれば特に限定されず、例えば、哺乳動物、好ましくはヒトから採取された血液、骨髄液、尿、アフェレーシスなどで採取した試料などが挙げられる。また、生体試料は、活性化好中球を含む可能性のある試料であってもよい。
【0016】
本明細書において、「活性化好中球」との用語は、刺激によって活性化された好中球を意味し、正常な白血球に含まれる通常の(未刺激の)好中球とは区別される血球を示す語として用いられる。
本発明の実施形態においては、活性化好中球として、例えば、活性酸素種(ROS)を産生している好中球が挙げられる。当該技術において、活性化好中球により産生されるROSとしては、スーパーオキサイド、ヒドロキシラジカル、過酸化水素、一重項酸素などが知られている。
また、異物を貪食した活性化好中球においては、異物は貪食空胞に入り、そして、この空胞に分解酵素およびROSを含んだ顆粒が融合してファゴリソソームが形成されることが知られており、形態学的観察において、活性化好中球の細胞質には空胞変性が認められる。よって、本発明の実施形態においては、細胞質において空胞変性が生じている好中球も活性化好中球に含まれる。
【0017】
[活性化好中球の検出方法]
以下に、本発明の活性化好中球の検出方法(以下、単に「検出方法」ともいう)について説明する。
本発明の検出方法では、まず、生体試料中の赤血球が溶血され、白血球の核酸が核酸染色性の蛍光色素によって染色された測定試料を調製する(調製工程)。具体的には、生体試料と、核酸を染色するための蛍光色素と、赤血球を溶血させ、白血球の細胞膜に前記蛍光色素が透過できる程度の損傷を与えるための界面活性剤を含有する溶血剤とを混合して、測定試料を調製する。
この調製工程では、上記の溶血剤の作用によって生体試料に含まれる赤血球が速やかに溶血され、且つ白血球の細胞膜に蛍光色素が透過できる程度の損傷が与えられる。そして、上記の蛍光色素が、損傷を受けた白血球の細胞膜から入り込むことによって、白血球の核酸が染色される。生体試料中に活性化好中球が存在する場合は、活性化好中球の核酸も染色される。
【0018】
[蛍光色素]
本発明の検出方法に用いられる蛍光色素は、核酸を染色可能な蛍光色素であれば特に限定されず、光源から照射される光の波長に応じて適宜選択することができる。そのような蛍光色素としては、例えば、プロピジウムアイオダイド、エチジウムブロマイド、エチジウム−アクリジンヘテロダイマー、エチジウムジアジド、エチジウムホモダイマー−1、エチジウムホモダイマー−2、エチジウムモノアジド、トリメチレンビス[[3‐[[4‐[[(3‐メチルベンゾチアゾール‐3‐イウム)‐2‐イル]メチレン]‐1,4‐ジヒドロキノリン]‐1‐イル]プロピル]ジメチルアミニウム]・テトラヨージド(TOTO−1)、4‐[(3‐メチルベンゾチアゾール‐2(3H)‐イリデン)メチル]‐1‐[3‐(トリメチルアミニオ)プロピル]キノリニウム・ジヨージド(TO−PRO−1)、N,N,N',N'‐テトラメチル‐N,N'‐ビス[3‐[4‐[3‐[(3‐メチルベンゾチアゾール‐3‐イウム)‐2‐イル]‐2‐プロペニリデン]‐1,4‐ジヒドロキノリン‐1‐イル]プロピル]‐1,3‐プロパンジアミニウム・テトラヨージド(TOTO−3)、または2‐[3‐[[1‐[3‐(トリメチルアミニオ)プロピル]‐1,4‐ジヒドロキノリン]‐4‐イリデン]‐1‐プロペニル]‐3‐メチルベンゾチアゾール‐3‐イウム・ジヨージド(TO−PRO−3)および以下の式(I)で表される蛍光色素が挙げられる。それらの中でも、式(I)で表される蛍光色素が好ましい。
【0019】
【化1】

【0020】
上記の式(I)中、R1およびR4は互いに同一または異なって、水素原子、アルキル基、ヒドロキシ基を有するアルキル鎖、エーテル基を有するアルキル鎖、エステル基を有するアルキル鎖、または置換基を有していてもよいベンジル基であり;R2およびR3は互いに同一または異なって、水素原子、ヒドロキシル基、ハロゲン、アルキル基、アルケニル基、アルキニル基、アルコキシ基、アルキルスルホニル基またはフェニル基であり;Zは硫黄原子、酸素原子、またはメチル基を有する炭素原子であり;nは0、1、2または3であり;X-はアニオンである。
【0021】
本発明の実施形態において、アルキル基は直鎖状または分枝鎖状のいずれであってもよい。また、本発明の実施形態においては、上記の式(I)中、R1およびR4のいずれか一方が炭素数6〜18のアルキル基である場合、他方は水素原子又は炭素数6未満のアルキル基であることが好ましい。炭素数6〜18のアルキル基の中でも、炭素数が6、8または10のアルキル基が好ましい。
【0022】
本発明の実施形態においては、上記の式(I)中、R1およびR4のベンジル基の置換基として、例えば、炭素数1〜20のアルキル基、炭素数2〜20のアルケニル基または炭素数2〜20のアルキニル基が挙げられる。それらの中でも、メチル基またはエチル基が特に好ましい。
【0023】
本発明の実施形態においては、上記の式(I)中、R2およびR3のアルケニル基として、例えば炭素数2〜20のアルケニル基が挙げられる。また、R2およびR3のアルコキシ基としては、炭素数1〜20のアルコキシ基が挙げられる。それらの中でも、特にメトキシ基またはエトキシ基が好ましい。
【0024】
本発明の実施形態においては、上記の式(I)中、アニオンX-として、F-、Cl-、Br-およびI-のようなハロゲンイオン、CF3SO3-、BF4-などが挙げられる。
【0025】
本発明の実施形態において、調製工程に用いられる蛍光色素は1種類であってもよいし、2種類以上であってもよい。
【0026】
本発明の実施形態において、核酸を染色するための蛍光色素は溶液の形態にあってもよい。蛍光色素を溶解するための溶媒は特に限定されないが、例えば、水、有機溶媒およびこれらの混合物が挙げられる。有機溶媒としては、例えばアルコール、エチレングリコール、ジメチルスルホキシド(DMSO)などが挙げられる。なお、蛍光色素は、水溶液中での保存安定性が悪い場合があるので、有機溶媒に溶解させることが好ましい。
調製工程において、蛍光色素の溶液を用いる場合、蛍光色素の濃度は適宜設定できるが、通常0.01〜100μg/L、好ましくは0.1〜10μg/Lである。例えば、蛍光色素として上記の式(I)で表される蛍光色素を用いる場合、その溶液における蛍光色素の濃度は、好ましくは0.2〜0.6μg/Lであり、より好ましくは0.3〜0.5μg/Lである。
【0027】
本発明の実施形態においては、蛍光色素として、市販の白血球測定用の染色試薬を用いてもよい。そのような染色試薬としては、例えばストマトライザー4DS(シスメックス株式会社)が挙げられる。ストマトライザー4DSは、上記の式(1)で示される蛍光色素を含む染色試薬である。
【0028】
[溶血剤]
本発明の検出方法に用いられる溶血剤は、赤血球を溶血させ、白血球の細胞膜に上記の蛍光色素が透過できる程度の損傷を与えるための界面活性剤を含む。そのような界面活性剤としては、カチオン性界面活性剤およびノニオン性界面活性剤が挙げられる。
【0029】
本発明の実施形態において、カチオン性界面活性剤として、第四級アンモニウム塩型界面活性剤およびピリジニウム塩型界面活性剤が挙げられる。第四級アンモニウム塩型界面活性剤としては、例えば以下の式(II)で表される、全炭素数が9〜30の界面活性剤が好適に用いられる。
【0030】
【化2】

【0031】
上記の式(II)中、R1は炭素数6〜18のアルキル基またはアルケニル基であり;R2およびR3は互いに同一または異なって、炭素数1〜4のアルキル基またはアルケニル基であり;R4は炭素数1〜4のアルキル基もしくはアルケニル基、またはベンジル基であり;X-はハロゲン原子である。
【0032】
上記の式(II)中、R1としては、炭素数が6、8、10、12および14のアルキル基またはアルケニル基が好ましく、特に直鎖のアルキル基が好ましい。より具体的なR1としては、オクチル基、デシル基およびドデシル基が挙げられる。R2およびR3としては、メチル基、エチル基およびプロピル基が好ましい。R4としては、メチル基、エチル基およびプロピル基が好ましい。
【0033】
ピリジニウム塩型界面活性剤としては、例えば以下の式(III)で表される界面活性剤が好適に用いられる。
【0034】
【化3】

【0035】
上記の式(III)中、R1は炭素数6〜18のアルキル基またはアルケニル基であり;X-はハロゲン原子である。
【0036】
上記の式(III)中、R1としては、炭素数が6、8、10、12および14のアルキル基またはアルケニル基が好ましく、特に直鎖のアルキル基が好ましい。より具体的なR1としてはオクチル基、デシル基およびドデシル基が挙げられる。
【0037】
本発明の実施形態においては、ノニオン性界面活性剤として、以下の式(VI)で表されるポリオキシエチレン系ノニオン界面活性剤が好適に用いられる。
【化4】

【0038】
上記の式(VI)中、R1は炭素数8〜25のアルキル基、アルケニル基またはアルキニル基であり;R2は−O−、−COO−または
【0039】
【化5】

であり;nは10〜50の整数である。
【0040】
上記のノニオン性界面活性剤の具体例としては、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンステロール、ポリオキシエチレンヒマシ油、ポリオキシエチレンソルビット脂肪酸エステル、ポリオキシエチレンアルキルアミン、ポリオキシエチレンポリオキシプロピレンアルキルエーテルなどが挙げられる。
本発明の実施形態において、溶血剤に含まれる界面活性剤は1種類であってもよいし、2種類以上であってもよい。2種類以上の界面活性剤が含まれる場合、その組合せは、カチオン性界面活性剤とノニオン性界面活性剤との組合せであってもよいし、カチオン性界面活性剤どうしの組合せであってもよいし、アニオン性界面活性剤どうしの組合せであってもよい。
【0041】
本発明の実施形態において、界面活性剤は溶液の形態にあってもよい。界面活性剤を溶解するための溶媒は特に限定されないが、例えば水、有機溶媒およびそれらの混合物が挙げられる。有機溶媒としては、例えばアルコール、エチレングリコール、DMSOなどが挙げられる。
調製工程において、界面活性剤の溶液を用いる場合、その濃度は界面活性剤の種類に応じて適宜設定できるが、カチオン性界面活性剤の場合は通常10〜10000 ppm、好ましくは100〜1000 ppmであり、ノニオン性界面活性剤の場合は通常10〜100000 ppm、好ましくは100〜10000 ppm、より好ましくは1000〜5000 ppmである。
【0042】
本発明の実施形態においては、溶血剤は、芳香族の有機酸を含んでいてもよい。芳香族の有機酸としては、例えば、フタル酸、安息香酸、サリチル酸、馬尿酸、p-アミノベンゼンスルホン酸、ベンゼンスルホン酸およびそれらの塩が好適に用いられる。溶血剤に含まれる芳香族の有機酸は1種類であってもよいし、2種類以上であってもよい。
【0043】
本発明の実施形態において、溶血剤は、pHを一定に保つために緩衝剤を含んでいてもよい。そのような緩衝剤としては、例えば、クエン酸塩、HEPESおよびリン酸塩などが挙げられる。なお、上記の芳香族の有機酸が緩衝作用を示す場合、溶血剤への緩衝剤の添加は任意である。
【0044】
本発明の実施形態において、溶血剤のpHおよび浸透圧は特に限定されないが、赤血球を効率よく溶血させる観点から、pHは5.0〜9.0であり、浸透圧は20〜150 mOsm/kgであることが好ましい。溶血剤のpHは、水酸化ナトリウム、塩酸などのpH調節剤を添加して調整することができる。また、溶血剤の浸透圧は、糖、アミノ酸、有機溶媒、塩化ナトリウムなどの浸透圧調節剤を添加して調製することができる。糖としては、例えばグルコース、キシリトール、マンニトール、アラビノース、リビトールなどが挙げられる。アミノ酸としては、アラニン、プロリン、グリシン、バリンなどが挙げられる。有機溶媒としては、エチレングリコール、グリセリンなどが挙げられる。
【0045】
本発明の実施形態においては、溶血剤として、市販の白血球測定用試薬を用いてもよい。そのような試薬としては、例えばストマトライザー4DL(シスメックス株式会社)が挙げられる。ストマトライザー4DLは、上記したカチオン性界面活性剤と、ノニオン性界面活性剤と、芳香族の有機酸とを含み、pHおよび浸透圧が上記範囲内の溶血剤である。
【0046】
[測定試料の調製]
上記の調製工程において、生体試料と、蛍光色素と、溶血剤とを混合する順序は特に限定されない。例えば、蛍光色素と溶血剤とを先に混合し、この混合液と生体試料とを混合してもよい。また、溶血剤と生体試料とを先に混合し、この混合液と蛍光色素とを混合してもよい。本発明の実施形態においては、いずれの順序で混合しても同等の結果を得ることができる。
【0047】
本発明の実施形態において、生体試料と蛍光色素と溶血剤との混合は、生体試料:蛍光色素および溶血剤の混合物の体積比が1:5〜1:1000、好ましくは1:10〜1:100となるように行うことが好ましい。この場合、該混合物における蛍光色素と溶血剤との比は、1:1〜1:1000、好ましくは1:10〜1:100が好ましい。このような比で生体試料と蛍光色素と溶血剤とを混合することにより、赤血球の溶血が速やかに進行し、白血球の核酸を染色することができる。なお、生体試料の量は5〜500μL程度で測定に十分である。
【0048】
本発明の実施形態においては、生体試料と蛍光色素と溶血剤とを混合した後に、15〜50℃、好ましくは30〜45℃の温度で5〜120秒間、好ましくは5〜30秒間インキュベーションすることが好ましい。
【0049】
[散乱光強度および蛍光強度の測定]
本発明の方法では、上記の工程で調製された測定試料に光を照射して、該試料中の粒子から生じる散乱光強度および蛍光強度を測定する(測定工程)。
本発明の実施形態において、測定工程はフローサイトメータにより行われることが好ましい。フローサイトメータによる測定では、測定試料がフローサイトメータのフローセルを通過するときに光を照射されることにより、該試料中の粒子、例えば染色された白血球などから発せられるシグナルについて散乱光強度および蛍光強度を得ることができる。
【0050】
本発明の実施形態において、散乱光強度は、一般に市販されるフローサイトメータで測定できる散乱光の強度であれば特に限定されず、例えば前方散乱光(例えば、受光角度0〜20度付近)および側方散乱光(受光角度90度付近)の強度が挙げられる。
当該技術においては、側方散乱光は細胞の核や顆粒などの内部情報を反映し、前方散乱光は細胞の大きさの情報を反映することが知られている。本発明の実施形態においては、散乱光強度として側方散乱光強度を測定することが好ましい。
【0051】
蛍光強度は、測定試料に適当な波長の励起光を照射した際に、蛍光色素によって染色された細胞内の核酸などから発せられる、励起された蛍光を測定して得られる情報である。なお、励起光波長および受光波長は、用いた蛍光色素の種類に応じて適宜選択できる。
【0052】
本発明の実施形態において、フローサイトメータの光源は特に限定されず、蛍光色素の励起に好適な波長の光源が選択される。そのような光源としては、例えば赤色半導体レーザ、青色半導体レーザ、アルゴンレーザ、He-Neレーザ、水銀アークランプなどが使用される。特に半導体レーザは、気体レーザに比べて非常に安価であるので好適である。
【0053】
[白血球の分類および活性化好中球の検出]
本発明の方法では、取得した散乱光強度および蛍光強度に基づいて、上記の生体試料中の白血球を少なくとも好中球を含む集団と好酸球を含む集団とに分類するとともに(分類工程)、活性化好中球を検出する(検出工程)。
分類工程では、測定された粒子が正常な白血球である場合、該粒子は、散乱光強度および蛍光強度に基づいて、リンパ球、単球、好酸球、および好酸球以外の顆粒球の4種類の集団(クラスター)に分類される。ここで、好酸球以外の顆粒球とは、好中球及び好塩基球を表す。好中球及び好塩基球の集団に含まれる好塩基球はごく僅かであるので、好中球及び好塩基球の集団は、好中球の集団とみなすことができる。そして、検出工程において、測定された粒子のうち、好中球を含む集団と好酸球を含む集団との間に存在する粒子が、活性化好中球として検出される。好ましくは、測定された粒子のうち、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である粒子が、活性化好中球として検出される。
なお、本発明の実施形態においては、正常な白血球は、リンパ球、単球、好中球、好酸球および好塩基球の5種類の集団に分類されてもよい。
【0054】
本発明の好ましい実施形態においては、白血球の分類は、散乱光強度と蛍光強度を二軸とするスキャッタグラムを作成し、得られたスキャッタグラムに基づいて行われる。当該技術においては、リンパ球、単球、好中球、好酸球および好塩基球の各集団が出現するスキャッタグラム上の領域は、正常な白血球について蓄積されたデータから予め特定されている。したがって、例えば、横軸に側方散乱光強度を、縦軸に蛍光強度をとったスキャッタグラムを作成することにより、正常な白血球である粒子は、図1に示すように4種類の集団に分類される。さらに、適当な解析ソフトを用いることにより、スキャッタグラム上で各集団を囲むウィンドウを設けて、その中の細胞数を計数し、各集団の細胞数を取得することができる。
【0055】
上記の活性化好中球の検出においては、好中球を含む集団と好酸球を含む集団との間に存在する粒子、好ましくは、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である粒子(図1にて、丸い枠で囲まれた粒子)が1つでも存在すれば、該粒子を活性化好中球として検出してもよい。
本発明の別の実施形態においては、活性化好中球の検出は次のようにして行ってもよい。まず、測定結果に基づいて、好中球を含む集団と好酸球を含む集団との間に存在する粒子、好ましくは、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である粒子を検出し、計数する。次に、該粒子の計数値が所定の値よりも大きい場合に、該粒子を活性化好中球として検出する。なお、所定の値は、活性化好中球を含む生体試料の測定から蓄積されたデータに基づいて、適宜設定することができる。
【0056】
[測定装置]
本発明の測定装置は、生体試料中の白血球を分類するとともに、活性化好中球を検出するための装置である。
本発明の測定装置について、その一実施形態の外観を図2に示す。本実施形態の測定装置1は、多項目自動血球分析装置として構成されており、測定部2とデータ処理部3とを有する。測定部2は、生体試料と上記の蛍光色素および溶血剤とを混合して測定試料を調製する装置と、得られた測定試料について散乱光強度および蛍光強度を測定する装置とを有する。データ処理部3は、測定部2から出力された測定結果を分析して、白血球の分類と活性化好中球の検出を行う装置を有する。
なお、図2では、測定部2とデータ処理部3とは別個の装置として構成されているが、両者は一体の装置として構成されていてもよい。
【0057】
図3は、測定部2のブロック図を示している。この図に示されるように、測定部2は、血球の検出部4、該検出部4の出力に対するアナログ処理部5、マイクロコンピュータ部6、表示・操作部7、および装置機構部8を備えている。
検出部4は、白血球を検出する白血球検出部を備えている。また、検出部4は、白血球検出部の他、赤血球数および血小板数を測定するRBC/PLT検出部、血液中の血色素量を測定するHGB検出部、幼若球を検出するIMI検出部も備えている。なお、検出部4は、光学式検出部、より具体的にはフローサイトメトリー法による検出部として構成されている。
【0058】
図4は、検出部4の光学系の構成を示している。この図において、レーザダイオード401から出射されたビームは、照射レンズ系402を介してシースフローセル403内を通過する粒子(白血球など)に照射される。この検出部4では、光が照射されたシースフローセル内の粒子から発せされる前方散乱光、側方散乱光および側方蛍光が検出される。
【0059】
図4に示されるように、シースフローセル403を通過する粒子(白血球など)から発せられる前方散乱光は、集光レンズ404とピンホール部405を介してフォトダイオード(前方散乱光受光部)406によって受光される。側方散乱光は、集光レンズ407、ダイクロイックミラー408、光学フィルタ409、およびピンホール部410を介してフォトマルチプライヤ(側方散乱光受光部)411によって受光される。側方蛍光は、集光レンズ407およびダイクロイックミラー408を介してフォトマルチプライヤ(側方蛍光受光部)412によって受光される。
【0060】
各受光部406、411および412から出力された受光信号は、それぞれ、アンプ51、52および53を有するアナログ処理部5によって増幅・波形処理などのアナログ処理が施され、マイクロコンピュータ部6に送られる。
【0061】
図3に示されるように、マイクロコンピュータ部6は、A/D変換部61と、該A/D変換部61から出力されたデジタル信号に対して所定の演算処理を行う演算部62と、制御用プロセッサおよび制御用プロセッサ動作のためのメモリからなる制御部64とを備えている。さらに、マイクロコンピュータ部6は、表示・操作部7との間に介在するインタフェース部66と、装置機構部8との間に介在するインタフェース部67とを備えている。
なお、演算部62は、インタフェース部63およびバス68を介して制御部64と接続されている。また、制御部64は、インタフェース部66、67およびバス68を介して検出部4および装置機構部8と接続され、インタフェース部65およびバス69を介してデータ処理部3と接続されている。
【0062】
A/D変換部61は、アナログ処理部5から出力された受光信号をデジタル信号に変換して、演算部62に出力する。演算部62は、A/D変換部61から出力されたデジタル信号に対して所定の演算処理を行う。そして、演算部62は、演算結果(測定結果)をインタフェース部63およびバス68を介して制御部64に出力する。
【0063】
制御部64は、外部インタフェース部65を介してデータ処理部3と接続されており、演算部62から出力された演算結果をデータ処理部3へ送信することができる。また、制御部64は、試料容器を自動供給するサンプラ(図示省略)、試料の調製・測定のための流体系などからなる装置機構部8の制御およびその他の制御を行う。
【0064】
図5は、測定部2において、生体試料と蛍光色素および溶血剤とを混合して測定試料を調製し、得られた測定試料を検出部4で測定する様子を示している。
図5において、試料容器11内の生体試料は、吸引ピペット(図示省略)からサンプリングバルブ12へと吸引される。サンプリングバルブ12で定量された生体試料は、所定量の溶血剤と混合され、得られた混合物が反応チャンバ13に運ばれる。反応チャンバ13には、所定量の蛍光色素が供給され、上記の混合物と混合される。生体試料と蛍光色素および溶血剤との混合物を反応チャンバ13にて所定の時間反応させることにより、生体試料中の赤血球が溶血され、白血球が染色された測定試料が得られる。
得られた測定試料は、シース液(例えば、セルパック(II)、シスメックス株式会社製)とともに検出部4に送られ、該検出部4においてフローサイトメトリー法により測定される。
【0065】
図6に、データ処理部3の構成を示す。データ処理部3は、本体301と、表示部302と、入力デバイス303とから主として構成される。本体301において、CPU301aと、ROM301bと、RAM301cと、ハードディスク301dと、読出装置301eと、入出力インタフェース301fと、画像出力インタフェース301gとは、バス301hによって互いにデータ通信可能に接続されている。
【0066】
CPU301aは、ROM301bに記憶されているコンピュータプログラムおよびRAM301cにロードされたコンピュータプログラムを実行することが可能である。CPU301aが、後述するアプリケーションプログラム305aを実行することにより、後述する各機能ブロックが実現されて、コンピュータがデータ処理部3として機能する。
ROM301bは、マスクROM、PROM、EPROM、EEPROMなどによって構成され、CPU301aにより実行されるコンピュータプログラムおよびこれに用いるデータが記録されている。
【0067】
RAM301cは、SRAMまたはDRAMなどによって構成される。RAM301cは、ROM301bおよびハードディスク301dに記録されているコンピュータプログラムの読み出しに用いられる。また、RAM301cは、CPU301aがこれらのコンピュータプログラムを実行するときの作業領域として利用される。
ハードディスク301dには、オペレーティングシステムおよびアプリケーションシステムプログラムなどの、CPU301aに実行させるための種々のコンピュータプログラムおよびコンピュータプログラムの実行に用いるデータがインストールされている。後述するアプリケーションプログラム305a(活性化好中球の検出用コンピュータプログラム)および活性化好中球の検出に用いられる所定の値もハードディスク301dにインストールされている。
【0068】
読出装置301eは、フレキシブルディスクドライブ、CD−ROMドライブ、またはDVD−ROMドライブなどによって構成されている。読出装置301eは、可搬型記憶媒体305に記録されたコンピュータプログラムまたはデータを読み出すことができる。また、可搬型記憶媒体305には、コンピュータがオペレーションを実行するためのアプリケーションプログラム305aが格納されている。CPU301aが可搬型記憶媒体305からアプリケーションプログラム305aを読み出し、該アプリケーションプログラム305aをハードディスク301dにインストールすることも可能である。
【0069】
なお、アプリケーションプログラム305aは、可搬型記録媒体305によって提供されるのみならず、電気通信回線(有線、無線を問わない)によってデータ処理部3と通信可能に接続された外部機器から上記の電気通信回線を通じて提供することも可能である。例えば、該アプリケーションプログラム305aがインターネット上のサーバコンピュータのハードディスク内に格納されており、このサーバコンピュータにデータ処理部3がアクセスして、該コンピュータプログラムをダウンロードし、これをハードディスク301dにインストールすることも可能である。
また、ハードディスク301dには、例えば米国マイクロソフト社が製造販売するWindows(登録商標)などのグラフィカルユーザインタフェース環境を提供するオペレーションシステムがインストールされている。以下の説明において、本発明の実施形態に係るアプリケーションプログラム305aは、該オペレーティングシステム上で動作するものとする。
【0070】
入出力インタフェース301fは、例えばUSB、IEEE1394、RS−232Cなどのシリアルインタフェース、SCSI、IDE、IEEE1284などのパラレルインタフェース、およびD/A変換器、A/D変換器などからなるアナログインタフェースなどから構成される。入出力インタフェース301fには、キーボードおよびマウスからなる入力デバイス303が接続されている。そのため、ユーザが該入力デバイス303を使用することにより、コンピュータ本体301にデータを入力できる。
画像出力インタフェース301hは、LCDまたはCRTなどで構成される表示部302に接続されており、CPU301aから与えられる画像データに応じて映像信号を表示部302に出力する。表示部302は、入力された映像信号にしたがって、画像データ(画面)を表示する。
【0071】
以下に、本発明の実施形態に係る活性化好中球の検出用コンピュータプログラムによるデータ処理部3の処理フローを、図7に示す。
まず、ユーザの操作などにより、データ処理部3から測定部2へ測定開始指示が送信される(ステップS101)。データ処理部3のCPU301aは、測定部2から測定結果を受信するまで待機する(ステップS102にてNO)。
測定部2は、受信した測定開始指示に応答して、測定試料の調製および測定を行ない、測定結果をデータ処理部3に送信する。データ処理部3のCPU301aは、入出力インタフェース301fを介して測定部2から測定結果を受信すると(ステップS102にてYES)、受信した測定結果をRAM301cに記憶させ、測定結果に対して白血球の分類処理を行う(ステップS103)。
【0072】
本発明の好ましい実施形態では、ステップS103において、データ処理部3は、横軸に側方散乱光強度を、縦軸に蛍光強度をとったスキャッタグラム(粒子分布図)を作成する。データ処理部3のCPU301aは、ハードディスク301dに予め記憶させておいた、リンパ球、単球、好中球、好酸球および好塩基球の各集団が出現すると予測されるスキャッタグラム上の領域に関するデータを読みだし、作成したスキャッタグラムを該データに基づいて分析する。これにより、スキャッタグラム上の各集団を「リンパ球の粒子集団」、「単球の粒子集団」、「好中球および好塩基球の粒子集団」および「好酸球の粒子集団」の4種類に分類し、認識する。また、このステップにおいて、データ処理部3は、当該分析により各集団における粒子の計数を行ってもよい。
【0073】
データ処理部3は、ステップS103の分類結果に基づいて、好中球を含む集団と好酸球を含む集団との間に存在する粒子、好ましくは、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である粒子が存在する場合、該粒子を検出・計数して、これを活性化好中球として認識する(ステップS104)。このとき、「好中球および好塩基球の粒子集団」は、「好中球の粒子集団」とみなされる。
本発明の実施形態では、このステップS104において、データ処理部3のCPU301aは、ハードディスク301dに予め記憶させておいた活性化好中球の検出に用いる所定の値に関するデータを読み出し、蛍光強度が好中球よりも低く、且つ散乱光強度が好中球と好酸球との間である粒子の検出数が該所定の値よりも大きい場合に、試料中に活性化好中球が存在すると認識してもよい。
本発明の別の実施形態では、このステップS104において、データ処理部3のCPU301aは、好中球を含む集団と好酸球を含む集団との間に存在する粒子、好ましくは、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である粒子を少なくとも1つ検出した場合に、試料中に活性化好中球が存在すると認識してもよい。
【0074】
データ処理部3のCPU301aは、上記の分類結果および検出結果をハードディスク301dに記憶させるとともに、画像出力インタフェース301gを介して表示部302に出力する(ステップS105)。図8に、データ処理部3により表示部302に表示される結果表示画面SC1の一例を示す。結果表示画面SC1には、各測定項目についての数値データの表示するための表示領域SC1aと、所定の項目(WBC,RBC,PLT,DIFF等)における粒子の数、大きさなどの分布を示すスキャッタグラム等を表示するための表示領域SC1bとが含まれている。
【0075】
ステップS104において、活性化好中球が検出された場合、結果表示画面SC1には、注記SC1cが表示される。注記SC1cは、生体試料中に活性化好中球が存在していることを示す。図9は、表示領域SC1bに注記SC1cを表示した例である。
【0076】
以下に、本発明を実施例により詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【実施例】
【0077】
(実施例1)
健常人から、血液学検査用のヘパリン採血管を用いて末梢血を採取した。得られた血液を、室温でモノポリ分離溶液(大日本住友製薬)を用いた遠心分離により、純度90%以上の多核球試料を得た。なお、この操作は、メーカー(大日本住友製薬)のインストラクションに従って行った。そして、得られた多核球(2×105個)を、1mLの0.1%ウシ血清アルブミン(リン酸緩衝生理食塩水)に懸濁した。多核球のうち好中球を染色するため、得られた懸濁液に、フィコエリスリン(PE)で蛍光標識したCD16(抗ヒトCD16 FcガンマレセプターIII (clone: DJ130c)・マウスモノクローナル抗体/RPE標識フローサイトメトリー用好中球特異的抗体;ダコ社)(終濃度750μg/L)を添加し、室温で10分間インキュベートした。次に、ROS検出用試薬であるAPF (Aminophenyl Fluorescein;積水メディカル)(終濃度10μM)を添加し、室温で30分間静置した。最後に、好中球を活性化するための刺激物質であるPMA(Phorbol 12-myristate 13-acetate;シグマアルドリッチ社)(終濃度0.32 nM)またはfMLP(N-Formyl-Met-Leu-Phe;シグマアルドリッチ社)(終濃度50 nM)を添加し、室温で10分間静置して、活性化好中球を含む試料を調製した。
また、コントロール試料として、PMAおよびfMLPのいずれも添加しなかったこと以外は、上記と同様に処理した試料を調製した。
【0078】
上記の試料9μLと、白血球分類用試薬ストマトライザー4DL(442μL)と、ストマトライザー4DS(9μL)(いずれもシスメックス社製)とを混合し、室温で2分間インキュベートして測定試料を得た。ここで、ストマトライザー4DLは、赤血球を溶血させ、白血球の細胞膜に蛍光色素が透過できる程度の損傷を与えるための界面活性剤を含む希釈液である。また、ストマトライザー4DSは、核酸染色性蛍光色素を含む溶液である。
測定試料を汎用フローサイトメータFACSCalibur(ベクトン・ディッキンソン社製)により測定し、「CD16由来蛍光強度(CD16-PE、585 nm)−前方散乱光強度(FSC)」、「ストマトライザー4DS中の核酸染色性蛍光色素由来蛍光強度(4DS、665 nm)−側方散乱光強度(SSC)」および「APF由来蛍光強度(APF、515 nm)−前方散乱光強度(FSC)」のスキャッタグラムを取得した。
【0079】
得られたスキャッタグラムを、図10(A)および図10(B)に示す。図10(A)には、CD16由来蛍光強度とFSCとを二軸とするスキャッタグラム(以下、「CD16−FSC」という)、および、ストマトライザー4DS中の核酸染色性蛍光色素由来蛍光強度とSSCとを二軸とするスキャッタグラム(以下、「4DS−SSC」という)を示した。図10(B)には、4DS−SSC、および、APF由来蛍光強度とFSCとを二軸とするスキャッタグラム(以下、「APF−FSC」という)を示した。
【0080】
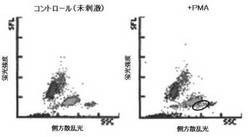
図10(A)を参照して、CD16−FSCにおいてCD16陽性細胞として特定された粒子を、好中球として特定した(CD16−FSCおよび4DS−SSCにて丸い枠で囲まれた粒子)。4DS−SSCより、PMAおよびfMLPのパネルでは、Control(無刺激)のパネルで示されている通常の好中球出現領域だけでなく、別の領域にも好中球が出現することが分かった(図10(B)にて、点線で囲まれた粒子)。このような好中球は、通常の好中球出現領域の右下側(好中球を含む集団と好酸球を含む集団との間)の領域に出現している。すなわち、該好中球は、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間であった。
このような通常の好中球出現領域の右下側に出現する好中球について、APF−FSCにより、活性化好中球の指標であるROS産生を確認した。図10(B)を参照して、APF−FSCにおいて点線で囲まれた粒子は、4DS−SSCにおいて通常の好中球出現領域の右下側に出現する好中球である。APF−FSCより、点線で囲まれた好中球は、通常の好中球に比べてROS産生が高いことが分かった。
以上のことから、4DS−SSCのスキャッタにおいて、好中球を含む集団と好酸球を含む集団との間に存在する好中球、すなわち、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である好中球は、刺激により活性化してROS産生能が亢進している好中球であることが分かった。
【0081】
(参考例1)
上記の実施例1の結果を検証するため、刺激により活性化された好中球が、顕微鏡観察においてもROS産生能の亢進を示すか否かを検討した。
実施例1と同様にして、健常人の末梢血から活性化好中球を含む試料を調製した。ただし、好中球の刺激物質としてはPMAのみを用いた。また、コントロール試料としてAPFおよび刺激物質で処理しなかった試料(−APF)、および刺激物質で処理しなかった試料(+APF)を調製した。
調製した各試料を、ポリ-L-リジンでコートしたガラスボトムディッシュに移し、該試料中の細胞を共焦点レーザ顕微鏡(IX81(オリンパス社製)、CSU-X1(横河電機製)、ImagEM(浜松フォトニクス製))で好中球を観察した。
【0082】
結果を図11に示した。図11において、PMAを添加した試料では、APFに由来する強い蛍光を発している好中球が観察された。したがって、PMAで刺激された好中球は、ROS産生能が明らかに亢進していることが分かった。よって、この共焦点レーザ顕微鏡による観察結果は、上記の実施例1の結果と一致する。
【0083】
(参考例2)
活性化好中球は、その特徴として、脱顆粒および空胞変性という形態の変化を示すことが知られている。上記の実施例1において作製した試料に、活性化好中球に特徴的な変化を示す細胞が存在するか否かを検討した。
実施例1と同様にして、健常人の末梢血から活性化好中球を含む試料を調製した。また、コントロール試料として刺激物質で処理しなかった試料を調製した。
この試料を2.5%グルタールアルデヒドで固定し、発明者らの文献(Mari Kono et al. (2009), ' Morphological definition of CD71 positive reticulocytes by various staining techniques and electron microscopy compared to reticulocytes detected by an automated hematology analyzer', Clinica Chimica Acta , Vol.404, p105-110.)に記載の方法に従って、電子顕微鏡試料を作製した。得られた試料を、透過型電子顕微鏡(日立 H-7500)を用いて解析した。
観察の結果を、図12に示す。図12より、PMAまたはfMLPを添加した試料では、細胞質において脱顆粒と空胞が生じた好中球が多く見られた。
【0084】
上記の実施例1、参考例1および2の結果より、刺激物質による処理により、試料中の好中球は確かに活性化されることが分かった。さらに、細胞質に空胞の形成が見られROS産生能が亢進している活性化好中球は、白血球分類試薬とフローサイトメータを用いた測定では、好中球を含む集団と好酸球を含む集団との間に存在すること、すなわち、その蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間であることが分かった。
【0085】
(実施例2)
全血を生体試料とした測定においても、実施例1と同様に活性化好中球を検出できるか否かを検討した。
健常人から、血液学検査用のEDTA-2K入り採血管を用いて末梢血を採取した。得られた血液に、PMA(シグマアルドリッチ社製)(終濃度0.32 nM)を添加し、室温10分間静置した。コントロール試料として、PMAを添加しない全血を用いた。
調製した試料を自動血液分析装置XE-2100(シスメックス株式会社製)に供して測定を行ない、4DS−SSCのDIFFスキャッタグラムを取得した。なお、自動血液分析装置XE-2100は、ストマトライザー4DLおよびストマトライザー4DS(シスメックス社製)を用いて、上記のようにして調製した試料を自動的に処理し、測定試料を調製する。
【0086】
結果を図13に示す。図13より、生体試料として全血を用いた場合でも、実施例1と同様に、4DS−SSCのスキャッタグラムにおいて、好中球を含む集団と好酸球を含む集団との間、すなわち、その蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である活性化好中球が出現することが分かった(丸い枠で囲まれた粒子)。ここで出現したのは、PMAの刺激により細胞質に空胞を形成し、ROS産生能が亢進している活性化好中球であると考えられる。
【0087】
なお、上記実施例2における全血を生体試料とした測定を、自動血液分析装置XE-2100(シスメックス株式会社製)に実施例1の結果に基づいて作成された活性化好中球検出用コンピュータプログラムを組込んで改造した装置を用いて行なった場合においても、上記した実施例2と同様の結果を得ることができた。
【符号の説明】
【0088】
1 測定装置
2 測定部
3 データ処理部
【技術分野】
【0001】
本発明は、生体試料中の活性化好中球を検出する方法に関する。
【背景技術】
【0002】
正常な白血球は、通常、好中球、好酸球および好塩基球からなる顆粒球、ならびにリンパ球および単球に分類される。それらの中でも、好中球は、白血球の50〜60%を占めており、細菌、真菌などの病原微生物に対する生体防御において重要な役割を果たしている。例えば、細菌感染などにより生体に異物が侵入したとき、好中球は、生体の炎症反応などに起因する刺激によって活性化され、感染部位に遊走して異物を貪食する。好中球に貪食された異物は、好中球内で産生されている各種の分解酵素および強力な毒性物質である活性酸素種(ROS)によって殺菌される。
【0003】
他方で、刺激により活性化された好中球(以下、「活性化好中球」ともいう)は、生体内で正常組織を傷害する場合がある。例えば、活性化好中球により産生される過剰なROSは、虚血再灌流障害、自己免疫疾患などの炎症反応において、生体の自己組織を傷害することが知られている。また、活性化好中球により産生されたROSは、急性呼吸窮迫症候群、潰瘍性大腸炎、急性胃粘液膜病変などの病変形成に関与することが知られている。さらに、輸血関連急性肺障害においても、活性化好中球の関与が知られている。
【0004】
このように、活性化好中球は種々の疾患および障害に関与することから、血液検査において、白血球の分類計数のみならず、活性化好中球も検出することは、疾患の診断、病態の把握、治療モニタリングなどに極めて有用な情報を得ることができる。
【0005】
近年、臨床検査の分野においては、検体中の白血球の分類計数は、フローサイトメトリーの原理を応用した自動血球計数装置により行われている。また、そのような装置による測定のための血球分類用試薬も市販されている。この試薬を用いて検体を自動血球計数装置で測定すると、検出された各血球のシグナルはそれぞれスキャッタグラム上の所定の領域に出現する。
【0006】
上記のような試薬を用いて白血球を分類計数する方法は、当該技術においていくつか知られている。例えば、特許文献1には、RNAを特異的に染色する染色液と、カチオン性界面活性剤およびノニオン性界面活性剤を含む溶血剤との組み合わせからなる試薬キットを用いて、異常白血球と正常白血球との両方を分類計数する方法が開示されている。また、特許文献2および3には、所定の蛍光色素を含む染色液と、カチオン性界面活性剤および/またはノニオン性界面活性剤を含む溶血剤を含有する試薬を用いて、白血球を4種または5種に分類して計数する方法が開示されている。しかしながら、これらの特許文献のいずれにも、活性化好中球を検出することについては開示されていない。
【0007】
活性化好中球を含み得る検体を測定した例としては、J. Linssenらの文献(非特許文献1)が挙げられる。J. Linssenらは、刺激物質により活性化処理した全血を検体として自動血球計数装置XE-2100(シスメックス株式会社製)で測定すると、白血球分類・計数チャンネル(DIFF-channel)において、好中球として分類された集団の平均側方散乱光強度(NEUT-X)および平均蛍光強度(NEUT-Y)が、未処理の検体に比べて低下することを報告している。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特許第4248017号公報
【特許文献2】米国特許出願第2009/0023129号
【特許文献3】米国特許出願第2011/0027788号
【非特許文献】
【0009】
【非特許文献1】J. Linssenら, Cytometry Part B (Clinical Cytometry), 74B, 295-309 (2008)
【発明の概要】
【発明が解決しようとする課題】
【0010】
本発明は、正常白血球を分類計数することができ、且つ活性化好中球を検出することを可能にする活性化好中球の検出方法を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者らは、活性化刺激され、且つ活性酸素種を産生している好中球について、自動血球計数装置を用いた測定において、そのシグナルがどのように変化するかを検討した。その結果、驚くべきことに、上記のJ. Linssenらの報告とは異なって、活性酸素種を産生している好中球は、好中球を含む集団と好酸球を含む集団との間に存在すること、さらに、その蛍光強度が通常の好中球以下であり、且つ散乱光強度が通常の好中球よりも高いこと、すなわち散乱光強度が通常の好中球と好酸球との間であることを見出して、本発明を完成した。
【0012】
すなわち、本発明は、
生体試料中の赤血球が溶血され、白血球の核酸が核酸染色性の蛍光色素によって染色された測定試料を調製する工程と、
調製された測定試料に光を照射し、該試料中の粒子から生じる散乱光強度および蛍光強度を測定する工程と、
取得した散乱光強度および蛍光強度に基づいて、前記生体試料中の白血球を少なくとも好中球を含む集団と好酸球を含む集団とに分類する工程と、
好中球を含む集団と好酸球を含む集団との間に存在する粒子を、活性化好中球として検出する工程と
を含む、活性化好中球の検出方法を提供する。
【発明の効果】
【0013】
本発明の活性化好中球の検出方法によれば、生体試料中の正常白血球を分類計数し、且つ活性化好中球を検出することを可能にする。
【図面の簡単な説明】
【0014】
【図1】正常な白血球をフローサイトメータにより測定したときのスキャッタグラムである。
【図2】本発明の測定装置の外観を示す図である。
【図3】測定部の機能ブロック図である。
【図4】検出部の構成図である。
【図5】測定試料を検出部で測定する流れを示す図である。
【図6】データ処理部の機能ブロック図である。
【図7】データ処理部の処理のフローチャートである。
【図8】データ処理部により表示される結果表示画面の一例を示す図である。
【図9】データ処理部により表示される結果表示画面の変形例を示す図である。
【図10】実施例1の測定により得られたスキャッタグラムである。
【図11】参考例1の結果を示す顕微鏡写真である。
【図12】参考例2の結果を示す電子顕微鏡写真である。
【図13】実施例2の測定により得られたスキャッタグラムである。
【発明を実施するための形態】
【0015】
本発明の実施形態において、生体試料は、白血球を含む体液試料であれば特に限定されず、例えば、哺乳動物、好ましくはヒトから採取された血液、骨髄液、尿、アフェレーシスなどで採取した試料などが挙げられる。また、生体試料は、活性化好中球を含む可能性のある試料であってもよい。
【0016】
本明細書において、「活性化好中球」との用語は、刺激によって活性化された好中球を意味し、正常な白血球に含まれる通常の(未刺激の)好中球とは区別される血球を示す語として用いられる。
本発明の実施形態においては、活性化好中球として、例えば、活性酸素種(ROS)を産生している好中球が挙げられる。当該技術において、活性化好中球により産生されるROSとしては、スーパーオキサイド、ヒドロキシラジカル、過酸化水素、一重項酸素などが知られている。
また、異物を貪食した活性化好中球においては、異物は貪食空胞に入り、そして、この空胞に分解酵素およびROSを含んだ顆粒が融合してファゴリソソームが形成されることが知られており、形態学的観察において、活性化好中球の細胞質には空胞変性が認められる。よって、本発明の実施形態においては、細胞質において空胞変性が生じている好中球も活性化好中球に含まれる。
【0017】
[活性化好中球の検出方法]
以下に、本発明の活性化好中球の検出方法(以下、単に「検出方法」ともいう)について説明する。
本発明の検出方法では、まず、生体試料中の赤血球が溶血され、白血球の核酸が核酸染色性の蛍光色素によって染色された測定試料を調製する(調製工程)。具体的には、生体試料と、核酸を染色するための蛍光色素と、赤血球を溶血させ、白血球の細胞膜に前記蛍光色素が透過できる程度の損傷を与えるための界面活性剤を含有する溶血剤とを混合して、測定試料を調製する。
この調製工程では、上記の溶血剤の作用によって生体試料に含まれる赤血球が速やかに溶血され、且つ白血球の細胞膜に蛍光色素が透過できる程度の損傷が与えられる。そして、上記の蛍光色素が、損傷を受けた白血球の細胞膜から入り込むことによって、白血球の核酸が染色される。生体試料中に活性化好中球が存在する場合は、活性化好中球の核酸も染色される。
【0018】
[蛍光色素]
本発明の検出方法に用いられる蛍光色素は、核酸を染色可能な蛍光色素であれば特に限定されず、光源から照射される光の波長に応じて適宜選択することができる。そのような蛍光色素としては、例えば、プロピジウムアイオダイド、エチジウムブロマイド、エチジウム−アクリジンヘテロダイマー、エチジウムジアジド、エチジウムホモダイマー−1、エチジウムホモダイマー−2、エチジウムモノアジド、トリメチレンビス[[3‐[[4‐[[(3‐メチルベンゾチアゾール‐3‐イウム)‐2‐イル]メチレン]‐1,4‐ジヒドロキノリン]‐1‐イル]プロピル]ジメチルアミニウム]・テトラヨージド(TOTO−1)、4‐[(3‐メチルベンゾチアゾール‐2(3H)‐イリデン)メチル]‐1‐[3‐(トリメチルアミニオ)プロピル]キノリニウム・ジヨージド(TO−PRO−1)、N,N,N',N'‐テトラメチル‐N,N'‐ビス[3‐[4‐[3‐[(3‐メチルベンゾチアゾール‐3‐イウム)‐2‐イル]‐2‐プロペニリデン]‐1,4‐ジヒドロキノリン‐1‐イル]プロピル]‐1,3‐プロパンジアミニウム・テトラヨージド(TOTO−3)、または2‐[3‐[[1‐[3‐(トリメチルアミニオ)プロピル]‐1,4‐ジヒドロキノリン]‐4‐イリデン]‐1‐プロペニル]‐3‐メチルベンゾチアゾール‐3‐イウム・ジヨージド(TO−PRO−3)および以下の式(I)で表される蛍光色素が挙げられる。それらの中でも、式(I)で表される蛍光色素が好ましい。
【0019】
【化1】

【0020】
上記の式(I)中、R1およびR4は互いに同一または異なって、水素原子、アルキル基、ヒドロキシ基を有するアルキル鎖、エーテル基を有するアルキル鎖、エステル基を有するアルキル鎖、または置換基を有していてもよいベンジル基であり;R2およびR3は互いに同一または異なって、水素原子、ヒドロキシル基、ハロゲン、アルキル基、アルケニル基、アルキニル基、アルコキシ基、アルキルスルホニル基またはフェニル基であり;Zは硫黄原子、酸素原子、またはメチル基を有する炭素原子であり;nは0、1、2または3であり;X-はアニオンである。
【0021】
本発明の実施形態において、アルキル基は直鎖状または分枝鎖状のいずれであってもよい。また、本発明の実施形態においては、上記の式(I)中、R1およびR4のいずれか一方が炭素数6〜18のアルキル基である場合、他方は水素原子又は炭素数6未満のアルキル基であることが好ましい。炭素数6〜18のアルキル基の中でも、炭素数が6、8または10のアルキル基が好ましい。
【0022】
本発明の実施形態においては、上記の式(I)中、R1およびR4のベンジル基の置換基として、例えば、炭素数1〜20のアルキル基、炭素数2〜20のアルケニル基または炭素数2〜20のアルキニル基が挙げられる。それらの中でも、メチル基またはエチル基が特に好ましい。
【0023】
本発明の実施形態においては、上記の式(I)中、R2およびR3のアルケニル基として、例えば炭素数2〜20のアルケニル基が挙げられる。また、R2およびR3のアルコキシ基としては、炭素数1〜20のアルコキシ基が挙げられる。それらの中でも、特にメトキシ基またはエトキシ基が好ましい。
【0024】
本発明の実施形態においては、上記の式(I)中、アニオンX-として、F-、Cl-、Br-およびI-のようなハロゲンイオン、CF3SO3-、BF4-などが挙げられる。
【0025】
本発明の実施形態において、調製工程に用いられる蛍光色素は1種類であってもよいし、2種類以上であってもよい。
【0026】
本発明の実施形態において、核酸を染色するための蛍光色素は溶液の形態にあってもよい。蛍光色素を溶解するための溶媒は特に限定されないが、例えば、水、有機溶媒およびこれらの混合物が挙げられる。有機溶媒としては、例えばアルコール、エチレングリコール、ジメチルスルホキシド(DMSO)などが挙げられる。なお、蛍光色素は、水溶液中での保存安定性が悪い場合があるので、有機溶媒に溶解させることが好ましい。
調製工程において、蛍光色素の溶液を用いる場合、蛍光色素の濃度は適宜設定できるが、通常0.01〜100μg/L、好ましくは0.1〜10μg/Lである。例えば、蛍光色素として上記の式(I)で表される蛍光色素を用いる場合、その溶液における蛍光色素の濃度は、好ましくは0.2〜0.6μg/Lであり、より好ましくは0.3〜0.5μg/Lである。
【0027】
本発明の実施形態においては、蛍光色素として、市販の白血球測定用の染色試薬を用いてもよい。そのような染色試薬としては、例えばストマトライザー4DS(シスメックス株式会社)が挙げられる。ストマトライザー4DSは、上記の式(1)で示される蛍光色素を含む染色試薬である。
【0028】
[溶血剤]
本発明の検出方法に用いられる溶血剤は、赤血球を溶血させ、白血球の細胞膜に上記の蛍光色素が透過できる程度の損傷を与えるための界面活性剤を含む。そのような界面活性剤としては、カチオン性界面活性剤およびノニオン性界面活性剤が挙げられる。
【0029】
本発明の実施形態において、カチオン性界面活性剤として、第四級アンモニウム塩型界面活性剤およびピリジニウム塩型界面活性剤が挙げられる。第四級アンモニウム塩型界面活性剤としては、例えば以下の式(II)で表される、全炭素数が9〜30の界面活性剤が好適に用いられる。
【0030】
【化2】

【0031】
上記の式(II)中、R1は炭素数6〜18のアルキル基またはアルケニル基であり;R2およびR3は互いに同一または異なって、炭素数1〜4のアルキル基またはアルケニル基であり;R4は炭素数1〜4のアルキル基もしくはアルケニル基、またはベンジル基であり;X-はハロゲン原子である。
【0032】
上記の式(II)中、R1としては、炭素数が6、8、10、12および14のアルキル基またはアルケニル基が好ましく、特に直鎖のアルキル基が好ましい。より具体的なR1としては、オクチル基、デシル基およびドデシル基が挙げられる。R2およびR3としては、メチル基、エチル基およびプロピル基が好ましい。R4としては、メチル基、エチル基およびプロピル基が好ましい。
【0033】
ピリジニウム塩型界面活性剤としては、例えば以下の式(III)で表される界面活性剤が好適に用いられる。
【0034】
【化3】

【0035】
上記の式(III)中、R1は炭素数6〜18のアルキル基またはアルケニル基であり;X-はハロゲン原子である。
【0036】
上記の式(III)中、R1としては、炭素数が6、8、10、12および14のアルキル基またはアルケニル基が好ましく、特に直鎖のアルキル基が好ましい。より具体的なR1としてはオクチル基、デシル基およびドデシル基が挙げられる。
【0037】
本発明の実施形態においては、ノニオン性界面活性剤として、以下の式(VI)で表されるポリオキシエチレン系ノニオン界面活性剤が好適に用いられる。
【化4】

【0038】
上記の式(VI)中、R1は炭素数8〜25のアルキル基、アルケニル基またはアルキニル基であり;R2は−O−、−COO−または
【0039】
【化5】

であり;nは10〜50の整数である。
【0040】
上記のノニオン性界面活性剤の具体例としては、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンステロール、ポリオキシエチレンヒマシ油、ポリオキシエチレンソルビット脂肪酸エステル、ポリオキシエチレンアルキルアミン、ポリオキシエチレンポリオキシプロピレンアルキルエーテルなどが挙げられる。
本発明の実施形態において、溶血剤に含まれる界面活性剤は1種類であってもよいし、2種類以上であってもよい。2種類以上の界面活性剤が含まれる場合、その組合せは、カチオン性界面活性剤とノニオン性界面活性剤との組合せであってもよいし、カチオン性界面活性剤どうしの組合せであってもよいし、アニオン性界面活性剤どうしの組合せであってもよい。
【0041】
本発明の実施形態において、界面活性剤は溶液の形態にあってもよい。界面活性剤を溶解するための溶媒は特に限定されないが、例えば水、有機溶媒およびそれらの混合物が挙げられる。有機溶媒としては、例えばアルコール、エチレングリコール、DMSOなどが挙げられる。
調製工程において、界面活性剤の溶液を用いる場合、その濃度は界面活性剤の種類に応じて適宜設定できるが、カチオン性界面活性剤の場合は通常10〜10000 ppm、好ましくは100〜1000 ppmであり、ノニオン性界面活性剤の場合は通常10〜100000 ppm、好ましくは100〜10000 ppm、より好ましくは1000〜5000 ppmである。
【0042】
本発明の実施形態においては、溶血剤は、芳香族の有機酸を含んでいてもよい。芳香族の有機酸としては、例えば、フタル酸、安息香酸、サリチル酸、馬尿酸、p-アミノベンゼンスルホン酸、ベンゼンスルホン酸およびそれらの塩が好適に用いられる。溶血剤に含まれる芳香族の有機酸は1種類であってもよいし、2種類以上であってもよい。
【0043】
本発明の実施形態において、溶血剤は、pHを一定に保つために緩衝剤を含んでいてもよい。そのような緩衝剤としては、例えば、クエン酸塩、HEPESおよびリン酸塩などが挙げられる。なお、上記の芳香族の有機酸が緩衝作用を示す場合、溶血剤への緩衝剤の添加は任意である。
【0044】
本発明の実施形態において、溶血剤のpHおよび浸透圧は特に限定されないが、赤血球を効率よく溶血させる観点から、pHは5.0〜9.0であり、浸透圧は20〜150 mOsm/kgであることが好ましい。溶血剤のpHは、水酸化ナトリウム、塩酸などのpH調節剤を添加して調整することができる。また、溶血剤の浸透圧は、糖、アミノ酸、有機溶媒、塩化ナトリウムなどの浸透圧調節剤を添加して調製することができる。糖としては、例えばグルコース、キシリトール、マンニトール、アラビノース、リビトールなどが挙げられる。アミノ酸としては、アラニン、プロリン、グリシン、バリンなどが挙げられる。有機溶媒としては、エチレングリコール、グリセリンなどが挙げられる。
【0045】
本発明の実施形態においては、溶血剤として、市販の白血球測定用試薬を用いてもよい。そのような試薬としては、例えばストマトライザー4DL(シスメックス株式会社)が挙げられる。ストマトライザー4DLは、上記したカチオン性界面活性剤と、ノニオン性界面活性剤と、芳香族の有機酸とを含み、pHおよび浸透圧が上記範囲内の溶血剤である。
【0046】
[測定試料の調製]
上記の調製工程において、生体試料と、蛍光色素と、溶血剤とを混合する順序は特に限定されない。例えば、蛍光色素と溶血剤とを先に混合し、この混合液と生体試料とを混合してもよい。また、溶血剤と生体試料とを先に混合し、この混合液と蛍光色素とを混合してもよい。本発明の実施形態においては、いずれの順序で混合しても同等の結果を得ることができる。
【0047】
本発明の実施形態において、生体試料と蛍光色素と溶血剤との混合は、生体試料:蛍光色素および溶血剤の混合物の体積比が1:5〜1:1000、好ましくは1:10〜1:100となるように行うことが好ましい。この場合、該混合物における蛍光色素と溶血剤との比は、1:1〜1:1000、好ましくは1:10〜1:100が好ましい。このような比で生体試料と蛍光色素と溶血剤とを混合することにより、赤血球の溶血が速やかに進行し、白血球の核酸を染色することができる。なお、生体試料の量は5〜500μL程度で測定に十分である。
【0048】
本発明の実施形態においては、生体試料と蛍光色素と溶血剤とを混合した後に、15〜50℃、好ましくは30〜45℃の温度で5〜120秒間、好ましくは5〜30秒間インキュベーションすることが好ましい。
【0049】
[散乱光強度および蛍光強度の測定]
本発明の方法では、上記の工程で調製された測定試料に光を照射して、該試料中の粒子から生じる散乱光強度および蛍光強度を測定する(測定工程)。
本発明の実施形態において、測定工程はフローサイトメータにより行われることが好ましい。フローサイトメータによる測定では、測定試料がフローサイトメータのフローセルを通過するときに光を照射されることにより、該試料中の粒子、例えば染色された白血球などから発せられるシグナルについて散乱光強度および蛍光強度を得ることができる。
【0050】
本発明の実施形態において、散乱光強度は、一般に市販されるフローサイトメータで測定できる散乱光の強度であれば特に限定されず、例えば前方散乱光(例えば、受光角度0〜20度付近)および側方散乱光(受光角度90度付近)の強度が挙げられる。
当該技術においては、側方散乱光は細胞の核や顆粒などの内部情報を反映し、前方散乱光は細胞の大きさの情報を反映することが知られている。本発明の実施形態においては、散乱光強度として側方散乱光強度を測定することが好ましい。
【0051】
蛍光強度は、測定試料に適当な波長の励起光を照射した際に、蛍光色素によって染色された細胞内の核酸などから発せられる、励起された蛍光を測定して得られる情報である。なお、励起光波長および受光波長は、用いた蛍光色素の種類に応じて適宜選択できる。
【0052】
本発明の実施形態において、フローサイトメータの光源は特に限定されず、蛍光色素の励起に好適な波長の光源が選択される。そのような光源としては、例えば赤色半導体レーザ、青色半導体レーザ、アルゴンレーザ、He-Neレーザ、水銀アークランプなどが使用される。特に半導体レーザは、気体レーザに比べて非常に安価であるので好適である。
【0053】
[白血球の分類および活性化好中球の検出]
本発明の方法では、取得した散乱光強度および蛍光強度に基づいて、上記の生体試料中の白血球を少なくとも好中球を含む集団と好酸球を含む集団とに分類するとともに(分類工程)、活性化好中球を検出する(検出工程)。
分類工程では、測定された粒子が正常な白血球である場合、該粒子は、散乱光強度および蛍光強度に基づいて、リンパ球、単球、好酸球、および好酸球以外の顆粒球の4種類の集団(クラスター)に分類される。ここで、好酸球以外の顆粒球とは、好中球及び好塩基球を表す。好中球及び好塩基球の集団に含まれる好塩基球はごく僅かであるので、好中球及び好塩基球の集団は、好中球の集団とみなすことができる。そして、検出工程において、測定された粒子のうち、好中球を含む集団と好酸球を含む集団との間に存在する粒子が、活性化好中球として検出される。好ましくは、測定された粒子のうち、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である粒子が、活性化好中球として検出される。
なお、本発明の実施形態においては、正常な白血球は、リンパ球、単球、好中球、好酸球および好塩基球の5種類の集団に分類されてもよい。
【0054】
本発明の好ましい実施形態においては、白血球の分類は、散乱光強度と蛍光強度を二軸とするスキャッタグラムを作成し、得られたスキャッタグラムに基づいて行われる。当該技術においては、リンパ球、単球、好中球、好酸球および好塩基球の各集団が出現するスキャッタグラム上の領域は、正常な白血球について蓄積されたデータから予め特定されている。したがって、例えば、横軸に側方散乱光強度を、縦軸に蛍光強度をとったスキャッタグラムを作成することにより、正常な白血球である粒子は、図1に示すように4種類の集団に分類される。さらに、適当な解析ソフトを用いることにより、スキャッタグラム上で各集団を囲むウィンドウを設けて、その中の細胞数を計数し、各集団の細胞数を取得することができる。
【0055】
上記の活性化好中球の検出においては、好中球を含む集団と好酸球を含む集団との間に存在する粒子、好ましくは、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である粒子(図1にて、丸い枠で囲まれた粒子)が1つでも存在すれば、該粒子を活性化好中球として検出してもよい。
本発明の別の実施形態においては、活性化好中球の検出は次のようにして行ってもよい。まず、測定結果に基づいて、好中球を含む集団と好酸球を含む集団との間に存在する粒子、好ましくは、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である粒子を検出し、計数する。次に、該粒子の計数値が所定の値よりも大きい場合に、該粒子を活性化好中球として検出する。なお、所定の値は、活性化好中球を含む生体試料の測定から蓄積されたデータに基づいて、適宜設定することができる。
【0056】
[測定装置]
本発明の測定装置は、生体試料中の白血球を分類するとともに、活性化好中球を検出するための装置である。
本発明の測定装置について、その一実施形態の外観を図2に示す。本実施形態の測定装置1は、多項目自動血球分析装置として構成されており、測定部2とデータ処理部3とを有する。測定部2は、生体試料と上記の蛍光色素および溶血剤とを混合して測定試料を調製する装置と、得られた測定試料について散乱光強度および蛍光強度を測定する装置とを有する。データ処理部3は、測定部2から出力された測定結果を分析して、白血球の分類と活性化好中球の検出を行う装置を有する。
なお、図2では、測定部2とデータ処理部3とは別個の装置として構成されているが、両者は一体の装置として構成されていてもよい。
【0057】
図3は、測定部2のブロック図を示している。この図に示されるように、測定部2は、血球の検出部4、該検出部4の出力に対するアナログ処理部5、マイクロコンピュータ部6、表示・操作部7、および装置機構部8を備えている。
検出部4は、白血球を検出する白血球検出部を備えている。また、検出部4は、白血球検出部の他、赤血球数および血小板数を測定するRBC/PLT検出部、血液中の血色素量を測定するHGB検出部、幼若球を検出するIMI検出部も備えている。なお、検出部4は、光学式検出部、より具体的にはフローサイトメトリー法による検出部として構成されている。
【0058】
図4は、検出部4の光学系の構成を示している。この図において、レーザダイオード401から出射されたビームは、照射レンズ系402を介してシースフローセル403内を通過する粒子(白血球など)に照射される。この検出部4では、光が照射されたシースフローセル内の粒子から発せされる前方散乱光、側方散乱光および側方蛍光が検出される。
【0059】
図4に示されるように、シースフローセル403を通過する粒子(白血球など)から発せられる前方散乱光は、集光レンズ404とピンホール部405を介してフォトダイオード(前方散乱光受光部)406によって受光される。側方散乱光は、集光レンズ407、ダイクロイックミラー408、光学フィルタ409、およびピンホール部410を介してフォトマルチプライヤ(側方散乱光受光部)411によって受光される。側方蛍光は、集光レンズ407およびダイクロイックミラー408を介してフォトマルチプライヤ(側方蛍光受光部)412によって受光される。
【0060】
各受光部406、411および412から出力された受光信号は、それぞれ、アンプ51、52および53を有するアナログ処理部5によって増幅・波形処理などのアナログ処理が施され、マイクロコンピュータ部6に送られる。
【0061】
図3に示されるように、マイクロコンピュータ部6は、A/D変換部61と、該A/D変換部61から出力されたデジタル信号に対して所定の演算処理を行う演算部62と、制御用プロセッサおよび制御用プロセッサ動作のためのメモリからなる制御部64とを備えている。さらに、マイクロコンピュータ部6は、表示・操作部7との間に介在するインタフェース部66と、装置機構部8との間に介在するインタフェース部67とを備えている。
なお、演算部62は、インタフェース部63およびバス68を介して制御部64と接続されている。また、制御部64は、インタフェース部66、67およびバス68を介して検出部4および装置機構部8と接続され、インタフェース部65およびバス69を介してデータ処理部3と接続されている。
【0062】
A/D変換部61は、アナログ処理部5から出力された受光信号をデジタル信号に変換して、演算部62に出力する。演算部62は、A/D変換部61から出力されたデジタル信号に対して所定の演算処理を行う。そして、演算部62は、演算結果(測定結果)をインタフェース部63およびバス68を介して制御部64に出力する。
【0063】
制御部64は、外部インタフェース部65を介してデータ処理部3と接続されており、演算部62から出力された演算結果をデータ処理部3へ送信することができる。また、制御部64は、試料容器を自動供給するサンプラ(図示省略)、試料の調製・測定のための流体系などからなる装置機構部8の制御およびその他の制御を行う。
【0064】
図5は、測定部2において、生体試料と蛍光色素および溶血剤とを混合して測定試料を調製し、得られた測定試料を検出部4で測定する様子を示している。
図5において、試料容器11内の生体試料は、吸引ピペット(図示省略)からサンプリングバルブ12へと吸引される。サンプリングバルブ12で定量された生体試料は、所定量の溶血剤と混合され、得られた混合物が反応チャンバ13に運ばれる。反応チャンバ13には、所定量の蛍光色素が供給され、上記の混合物と混合される。生体試料と蛍光色素および溶血剤との混合物を反応チャンバ13にて所定の時間反応させることにより、生体試料中の赤血球が溶血され、白血球が染色された測定試料が得られる。
得られた測定試料は、シース液(例えば、セルパック(II)、シスメックス株式会社製)とともに検出部4に送られ、該検出部4においてフローサイトメトリー法により測定される。
【0065】
図6に、データ処理部3の構成を示す。データ処理部3は、本体301と、表示部302と、入力デバイス303とから主として構成される。本体301において、CPU301aと、ROM301bと、RAM301cと、ハードディスク301dと、読出装置301eと、入出力インタフェース301fと、画像出力インタフェース301gとは、バス301hによって互いにデータ通信可能に接続されている。
【0066】
CPU301aは、ROM301bに記憶されているコンピュータプログラムおよびRAM301cにロードされたコンピュータプログラムを実行することが可能である。CPU301aが、後述するアプリケーションプログラム305aを実行することにより、後述する各機能ブロックが実現されて、コンピュータがデータ処理部3として機能する。
ROM301bは、マスクROM、PROM、EPROM、EEPROMなどによって構成され、CPU301aにより実行されるコンピュータプログラムおよびこれに用いるデータが記録されている。
【0067】
RAM301cは、SRAMまたはDRAMなどによって構成される。RAM301cは、ROM301bおよびハードディスク301dに記録されているコンピュータプログラムの読み出しに用いられる。また、RAM301cは、CPU301aがこれらのコンピュータプログラムを実行するときの作業領域として利用される。
ハードディスク301dには、オペレーティングシステムおよびアプリケーションシステムプログラムなどの、CPU301aに実行させるための種々のコンピュータプログラムおよびコンピュータプログラムの実行に用いるデータがインストールされている。後述するアプリケーションプログラム305a(活性化好中球の検出用コンピュータプログラム)および活性化好中球の検出に用いられる所定の値もハードディスク301dにインストールされている。
【0068】
読出装置301eは、フレキシブルディスクドライブ、CD−ROMドライブ、またはDVD−ROMドライブなどによって構成されている。読出装置301eは、可搬型記憶媒体305に記録されたコンピュータプログラムまたはデータを読み出すことができる。また、可搬型記憶媒体305には、コンピュータがオペレーションを実行するためのアプリケーションプログラム305aが格納されている。CPU301aが可搬型記憶媒体305からアプリケーションプログラム305aを読み出し、該アプリケーションプログラム305aをハードディスク301dにインストールすることも可能である。
【0069】
なお、アプリケーションプログラム305aは、可搬型記録媒体305によって提供されるのみならず、電気通信回線(有線、無線を問わない)によってデータ処理部3と通信可能に接続された外部機器から上記の電気通信回線を通じて提供することも可能である。例えば、該アプリケーションプログラム305aがインターネット上のサーバコンピュータのハードディスク内に格納されており、このサーバコンピュータにデータ処理部3がアクセスして、該コンピュータプログラムをダウンロードし、これをハードディスク301dにインストールすることも可能である。
また、ハードディスク301dには、例えば米国マイクロソフト社が製造販売するWindows(登録商標)などのグラフィカルユーザインタフェース環境を提供するオペレーションシステムがインストールされている。以下の説明において、本発明の実施形態に係るアプリケーションプログラム305aは、該オペレーティングシステム上で動作するものとする。
【0070】
入出力インタフェース301fは、例えばUSB、IEEE1394、RS−232Cなどのシリアルインタフェース、SCSI、IDE、IEEE1284などのパラレルインタフェース、およびD/A変換器、A/D変換器などからなるアナログインタフェースなどから構成される。入出力インタフェース301fには、キーボードおよびマウスからなる入力デバイス303が接続されている。そのため、ユーザが該入力デバイス303を使用することにより、コンピュータ本体301にデータを入力できる。
画像出力インタフェース301hは、LCDまたはCRTなどで構成される表示部302に接続されており、CPU301aから与えられる画像データに応じて映像信号を表示部302に出力する。表示部302は、入力された映像信号にしたがって、画像データ(画面)を表示する。
【0071】
以下に、本発明の実施形態に係る活性化好中球の検出用コンピュータプログラムによるデータ処理部3の処理フローを、図7に示す。
まず、ユーザの操作などにより、データ処理部3から測定部2へ測定開始指示が送信される(ステップS101)。データ処理部3のCPU301aは、測定部2から測定結果を受信するまで待機する(ステップS102にてNO)。
測定部2は、受信した測定開始指示に応答して、測定試料の調製および測定を行ない、測定結果をデータ処理部3に送信する。データ処理部3のCPU301aは、入出力インタフェース301fを介して測定部2から測定結果を受信すると(ステップS102にてYES)、受信した測定結果をRAM301cに記憶させ、測定結果に対して白血球の分類処理を行う(ステップS103)。
【0072】
本発明の好ましい実施形態では、ステップS103において、データ処理部3は、横軸に側方散乱光強度を、縦軸に蛍光強度をとったスキャッタグラム(粒子分布図)を作成する。データ処理部3のCPU301aは、ハードディスク301dに予め記憶させておいた、リンパ球、単球、好中球、好酸球および好塩基球の各集団が出現すると予測されるスキャッタグラム上の領域に関するデータを読みだし、作成したスキャッタグラムを該データに基づいて分析する。これにより、スキャッタグラム上の各集団を「リンパ球の粒子集団」、「単球の粒子集団」、「好中球および好塩基球の粒子集団」および「好酸球の粒子集団」の4種類に分類し、認識する。また、このステップにおいて、データ処理部3は、当該分析により各集団における粒子の計数を行ってもよい。
【0073】
データ処理部3は、ステップS103の分類結果に基づいて、好中球を含む集団と好酸球を含む集団との間に存在する粒子、好ましくは、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である粒子が存在する場合、該粒子を検出・計数して、これを活性化好中球として認識する(ステップS104)。このとき、「好中球および好塩基球の粒子集団」は、「好中球の粒子集団」とみなされる。
本発明の実施形態では、このステップS104において、データ処理部3のCPU301aは、ハードディスク301dに予め記憶させておいた活性化好中球の検出に用いる所定の値に関するデータを読み出し、蛍光強度が好中球よりも低く、且つ散乱光強度が好中球と好酸球との間である粒子の検出数が該所定の値よりも大きい場合に、試料中に活性化好中球が存在すると認識してもよい。
本発明の別の実施形態では、このステップS104において、データ処理部3のCPU301aは、好中球を含む集団と好酸球を含む集団との間に存在する粒子、好ましくは、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である粒子を少なくとも1つ検出した場合に、試料中に活性化好中球が存在すると認識してもよい。
【0074】
データ処理部3のCPU301aは、上記の分類結果および検出結果をハードディスク301dに記憶させるとともに、画像出力インタフェース301gを介して表示部302に出力する(ステップS105)。図8に、データ処理部3により表示部302に表示される結果表示画面SC1の一例を示す。結果表示画面SC1には、各測定項目についての数値データの表示するための表示領域SC1aと、所定の項目(WBC,RBC,PLT,DIFF等)における粒子の数、大きさなどの分布を示すスキャッタグラム等を表示するための表示領域SC1bとが含まれている。
【0075】
ステップS104において、活性化好中球が検出された場合、結果表示画面SC1には、注記SC1cが表示される。注記SC1cは、生体試料中に活性化好中球が存在していることを示す。図9は、表示領域SC1bに注記SC1cを表示した例である。
【0076】
以下に、本発明を実施例により詳細に説明するが、本発明はこれらの実施例に限定されるものではない。
【実施例】
【0077】
(実施例1)
健常人から、血液学検査用のヘパリン採血管を用いて末梢血を採取した。得られた血液を、室温でモノポリ分離溶液(大日本住友製薬)を用いた遠心分離により、純度90%以上の多核球試料を得た。なお、この操作は、メーカー(大日本住友製薬)のインストラクションに従って行った。そして、得られた多核球(2×105個)を、1mLの0.1%ウシ血清アルブミン(リン酸緩衝生理食塩水)に懸濁した。多核球のうち好中球を染色するため、得られた懸濁液に、フィコエリスリン(PE)で蛍光標識したCD16(抗ヒトCD16 FcガンマレセプターIII (clone: DJ130c)・マウスモノクローナル抗体/RPE標識フローサイトメトリー用好中球特異的抗体;ダコ社)(終濃度750μg/L)を添加し、室温で10分間インキュベートした。次に、ROS検出用試薬であるAPF (Aminophenyl Fluorescein;積水メディカル)(終濃度10μM)を添加し、室温で30分間静置した。最後に、好中球を活性化するための刺激物質であるPMA(Phorbol 12-myristate 13-acetate;シグマアルドリッチ社)(終濃度0.32 nM)またはfMLP(N-Formyl-Met-Leu-Phe;シグマアルドリッチ社)(終濃度50 nM)を添加し、室温で10分間静置して、活性化好中球を含む試料を調製した。
また、コントロール試料として、PMAおよびfMLPのいずれも添加しなかったこと以外は、上記と同様に処理した試料を調製した。
【0078】
上記の試料9μLと、白血球分類用試薬ストマトライザー4DL(442μL)と、ストマトライザー4DS(9μL)(いずれもシスメックス社製)とを混合し、室温で2分間インキュベートして測定試料を得た。ここで、ストマトライザー4DLは、赤血球を溶血させ、白血球の細胞膜に蛍光色素が透過できる程度の損傷を与えるための界面活性剤を含む希釈液である。また、ストマトライザー4DSは、核酸染色性蛍光色素を含む溶液である。
測定試料を汎用フローサイトメータFACSCalibur(ベクトン・ディッキンソン社製)により測定し、「CD16由来蛍光強度(CD16-PE、585 nm)−前方散乱光強度(FSC)」、「ストマトライザー4DS中の核酸染色性蛍光色素由来蛍光強度(4DS、665 nm)−側方散乱光強度(SSC)」および「APF由来蛍光強度(APF、515 nm)−前方散乱光強度(FSC)」のスキャッタグラムを取得した。
【0079】
得られたスキャッタグラムを、図10(A)および図10(B)に示す。図10(A)には、CD16由来蛍光強度とFSCとを二軸とするスキャッタグラム(以下、「CD16−FSC」という)、および、ストマトライザー4DS中の核酸染色性蛍光色素由来蛍光強度とSSCとを二軸とするスキャッタグラム(以下、「4DS−SSC」という)を示した。図10(B)には、4DS−SSC、および、APF由来蛍光強度とFSCとを二軸とするスキャッタグラム(以下、「APF−FSC」という)を示した。
【0080】
図10(A)を参照して、CD16−FSCにおいてCD16陽性細胞として特定された粒子を、好中球として特定した(CD16−FSCおよび4DS−SSCにて丸い枠で囲まれた粒子)。4DS−SSCより、PMAおよびfMLPのパネルでは、Control(無刺激)のパネルで示されている通常の好中球出現領域だけでなく、別の領域にも好中球が出現することが分かった(図10(B)にて、点線で囲まれた粒子)。このような好中球は、通常の好中球出現領域の右下側(好中球を含む集団と好酸球を含む集団との間)の領域に出現している。すなわち、該好中球は、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間であった。
このような通常の好中球出現領域の右下側に出現する好中球について、APF−FSCにより、活性化好中球の指標であるROS産生を確認した。図10(B)を参照して、APF−FSCにおいて点線で囲まれた粒子は、4DS−SSCにおいて通常の好中球出現領域の右下側に出現する好中球である。APF−FSCより、点線で囲まれた好中球は、通常の好中球に比べてROS産生が高いことが分かった。
以上のことから、4DS−SSCのスキャッタにおいて、好中球を含む集団と好酸球を含む集団との間に存在する好中球、すなわち、蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である好中球は、刺激により活性化してROS産生能が亢進している好中球であることが分かった。
【0081】
(参考例1)
上記の実施例1の結果を検証するため、刺激により活性化された好中球が、顕微鏡観察においてもROS産生能の亢進を示すか否かを検討した。
実施例1と同様にして、健常人の末梢血から活性化好中球を含む試料を調製した。ただし、好中球の刺激物質としてはPMAのみを用いた。また、コントロール試料としてAPFおよび刺激物質で処理しなかった試料(−APF)、および刺激物質で処理しなかった試料(+APF)を調製した。
調製した各試料を、ポリ-L-リジンでコートしたガラスボトムディッシュに移し、該試料中の細胞を共焦点レーザ顕微鏡(IX81(オリンパス社製)、CSU-X1(横河電機製)、ImagEM(浜松フォトニクス製))で好中球を観察した。
【0082】
結果を図11に示した。図11において、PMAを添加した試料では、APFに由来する強い蛍光を発している好中球が観察された。したがって、PMAで刺激された好中球は、ROS産生能が明らかに亢進していることが分かった。よって、この共焦点レーザ顕微鏡による観察結果は、上記の実施例1の結果と一致する。
【0083】
(参考例2)
活性化好中球は、その特徴として、脱顆粒および空胞変性という形態の変化を示すことが知られている。上記の実施例1において作製した試料に、活性化好中球に特徴的な変化を示す細胞が存在するか否かを検討した。
実施例1と同様にして、健常人の末梢血から活性化好中球を含む試料を調製した。また、コントロール試料として刺激物質で処理しなかった試料を調製した。
この試料を2.5%グルタールアルデヒドで固定し、発明者らの文献(Mari Kono et al. (2009), ' Morphological definition of CD71 positive reticulocytes by various staining techniques and electron microscopy compared to reticulocytes detected by an automated hematology analyzer', Clinica Chimica Acta , Vol.404, p105-110.)に記載の方法に従って、電子顕微鏡試料を作製した。得られた試料を、透過型電子顕微鏡(日立 H-7500)を用いて解析した。
観察の結果を、図12に示す。図12より、PMAまたはfMLPを添加した試料では、細胞質において脱顆粒と空胞が生じた好中球が多く見られた。
【0084】
上記の実施例1、参考例1および2の結果より、刺激物質による処理により、試料中の好中球は確かに活性化されることが分かった。さらに、細胞質に空胞の形成が見られROS産生能が亢進している活性化好中球は、白血球分類試薬とフローサイトメータを用いた測定では、好中球を含む集団と好酸球を含む集団との間に存在すること、すなわち、その蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間であることが分かった。
【0085】
(実施例2)
全血を生体試料とした測定においても、実施例1と同様に活性化好中球を検出できるか否かを検討した。
健常人から、血液学検査用のEDTA-2K入り採血管を用いて末梢血を採取した。得られた血液に、PMA(シグマアルドリッチ社製)(終濃度0.32 nM)を添加し、室温10分間静置した。コントロール試料として、PMAを添加しない全血を用いた。
調製した試料を自動血液分析装置XE-2100(シスメックス株式会社製)に供して測定を行ない、4DS−SSCのDIFFスキャッタグラムを取得した。なお、自動血液分析装置XE-2100は、ストマトライザー4DLおよびストマトライザー4DS(シスメックス社製)を用いて、上記のようにして調製した試料を自動的に処理し、測定試料を調製する。
【0086】
結果を図13に示す。図13より、生体試料として全血を用いた場合でも、実施例1と同様に、4DS−SSCのスキャッタグラムにおいて、好中球を含む集団と好酸球を含む集団との間、すなわち、その蛍光強度が好中球を含む集団以下であり、且つ散乱光強度が好中球を含む集団と好酸球を含む集団との間である活性化好中球が出現することが分かった(丸い枠で囲まれた粒子)。ここで出現したのは、PMAの刺激により細胞質に空胞を形成し、ROS産生能が亢進している活性化好中球であると考えられる。
【0087】
なお、上記実施例2における全血を生体試料とした測定を、自動血液分析装置XE-2100(シスメックス株式会社製)に実施例1の結果に基づいて作成された活性化好中球検出用コンピュータプログラムを組込んで改造した装置を用いて行なった場合においても、上記した実施例2と同様の結果を得ることができた。
【符号の説明】
【0088】
1 測定装置
2 測定部
3 データ処理部
【特許請求の範囲】
【請求項1】
生体試料中の赤血球が溶血され、白血球の核酸が核酸染色性の蛍光色素によって染色された測定試料を調製する工程と、
調製された測定試料に光を照射し、該試料中の粒子から生じる散乱光強度および蛍光強度を測定する工程と、
取得した散乱光強度および蛍光強度に基づいて、前記生体試料中の白血球を少なくとも好中球を含む集団と好酸球を含む集団とに分類する工程と、
前記好中球を含む集団と前記好酸球を含む集団との間に存在する粒子を、活性化好中球として検出する工程と
を含む、活性化好中球の検出方法。
【請求項2】
前記検出工程において、蛍光強度が前記好中球を含む集団以下であり、且つ散乱光強度が前記好中球を含む集団と前記好酸球を含む集団との間である粒子を前記活性化好中球として検出する請求項1に記載の方法。
【請求項3】
前記好中球を含む集団が、さらに好塩基球を含む請求項1または請求項2に記載の方法。
【請求項4】
前記活性化好中球が、細胞質において空胞変性が生じている請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記検出工程において、前記好中球を含む集団と前記好酸球を含む集団との間に存在する粒子を計数する請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記検出工程において、前記計数した値が所定の値よりも大きい場合に、前記粒子を活性化好中球として検出する請求項5に記載の方法。
【請求項7】
前記測定試料中の赤血球が、界面活性剤により溶血されている請求項1〜6に記載の方法。
【請求項8】
前記界面活性剤が、ノニオン性界面活性剤およびカチオン性界面活性剤から選択される少なくとも1つである請求項7に記載の方法。
【請求項9】
前記散乱光強度が、側方散乱光強度である請求項1〜8のいずれか1項に記載の方法。
【請求項1】
生体試料中の赤血球が溶血され、白血球の核酸が核酸染色性の蛍光色素によって染色された測定試料を調製する工程と、
調製された測定試料に光を照射し、該試料中の粒子から生じる散乱光強度および蛍光強度を測定する工程と、
取得した散乱光強度および蛍光強度に基づいて、前記生体試料中の白血球を少なくとも好中球を含む集団と好酸球を含む集団とに分類する工程と、
前記好中球を含む集団と前記好酸球を含む集団との間に存在する粒子を、活性化好中球として検出する工程と
を含む、活性化好中球の検出方法。
【請求項2】
前記検出工程において、蛍光強度が前記好中球を含む集団以下であり、且つ散乱光強度が前記好中球を含む集団と前記好酸球を含む集団との間である粒子を前記活性化好中球として検出する請求項1に記載の方法。
【請求項3】
前記好中球を含む集団が、さらに好塩基球を含む請求項1または請求項2に記載の方法。
【請求項4】
前記活性化好中球が、細胞質において空胞変性が生じている請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記検出工程において、前記好中球を含む集団と前記好酸球を含む集団との間に存在する粒子を計数する請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記検出工程において、前記計数した値が所定の値よりも大きい場合に、前記粒子を活性化好中球として検出する請求項5に記載の方法。
【請求項7】
前記測定試料中の赤血球が、界面活性剤により溶血されている請求項1〜6に記載の方法。
【請求項8】
前記界面活性剤が、ノニオン性界面活性剤およびカチオン性界面活性剤から選択される少なくとも1つである請求項7に記載の方法。
【請求項9】
前記散乱光強度が、側方散乱光強度である請求項1〜8のいずれか1項に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10(A)】


【図10(B)】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10(A)】


【図10(B)】


【図11】


【図12】


【図13】


【公開番号】特開2013−92433(P2013−92433A)
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願番号】特願2011−234176(P2011−234176)
【出願日】平成23年10月25日(2011.10.25)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
【公開日】平成25年5月16日(2013.5.16)
【国際特許分類】
【出願日】平成23年10月25日(2011.10.25)
【出願人】(390014960)シスメックス株式会社 (810)
【Fターム(参考)】
[ Back to top ]

