Fターム[2G041DA16]の内容
その他の電気的手段による材料の調査、分析 (22,023) | イオン源 (4,018) | 粒子衝撃、FAB、SIMS (265)
Fターム[2G041DA16]に分類される特許
181 - 200 / 265
マイクロ流体システム(MS)
【課題】液体試料の被検体をMS被検体として質量分析計に提示する方法を開示する。
【解決手段】この方法は、(a)(i)液体試料を、マイクロ流体デバイスのマイクロチャンネル構造(I)であって、MS−ポートをも含む構造の試料引入れポート(I)に適用し、(ii)マイクロチャンネル構造(I)において液流により被検体を輸送することによって、被検体をMS被検体に変換させ、そして(iii)MSポートを介して質量分析計にMS被検体を提示する工程を含み、そして(b)慣性力を用いてマイクロチャンネル構造(I)の少なくとも一部内で液流を作り出すことを特徴とする。(a)ディスクの面に垂直な対称軸、(b)引出しポートよりも短い半径距離のところに内部適用領域を含み、MSポートおよび試料引入れポート(I)を含むマイクロチャンネル構造(I)を含むマイクロ流体ディスクを開示する。
(もっと読む)
標識された核酸プライマー結合物体、その製造方法、ならびにその用途
【課題】 例えば、バイオアッセイに用いる核酸プライマー分子の固定化に利用される微細な粒子状の基体等、微小な物体に対しても、必要に応じて多数種の標識を付す際に有効な物体の標識方法、ならびに該方法により標識が付された物体の提供。
【解決手段】 微小な物体に対しても、それを構成する材料の一部として、予め選択される複数種の原子の種類数(n)と、前記選択された原子個々の含有量の有無、あるいは、含有量の水準とを利用して、少なくとも二進法n桁の数値情報に相当する、含有原子の組成条件に従って調製される標識用材料を用いることで、必要に応じて多数種の標識を付すが可能となる。さらには、該標識方法によって標識を付された物体を基体に利用することで、該基体に固定化されている核酸プライマー分子の特定が容易となる。
(もっと読む)
標識されたプローブ結合物体、その製造方法、及びその利用方法
【課題】 バイオアッセイに用いるプローブ分子の固定化に利用される微細な粒子状の基体等、微小な物体に対しても、必要に応じて多数種の標識を付す際に有効な物体の標識方法の提供。されには上記標識が施された物体の提供。
【解決手段】 微小な物体に対しても、それを構成する材料の一部として、予め選択される複数種の原子の種類数(n)と、前記選択された原子個々の含有量の有無、あるいは、含有量の水準とを利用して、少なくとも二進法n桁の数値情報に相当する、含有原子の組成条件に従って調製される標識用材料を用いることで、必要に応じて多数種の標識を付すが可能となる。さらには上記標識方法によって標識された物体によって、上記バイオアッセイが可能となる。
(もっと読む)
試料イオンの飛行時間測定用装置,飛行時間型質量分析装置,飛行時間型質量分析方法
【課題】 測定用ビームば照射された試料から散乱した試料イオンの質量にかかわらず均一な質量分解能を実現し,且つ,コンパクトな装置でありながら長い飛行距離を確保して長時間試料イオンを飛行させることにより高い質量分解能を実現すること。
【解決手段】 測定用ビームHが試料Sに照射されることにより該試料Sから散乱した試料イオンの飛行時間に基づいて上記散乱イオンの質量を分析する飛行時間型質量分析装置において,試料Sにおける上記測定用ビームHの照射部を通る所定の基準軸Gに沿った所定領域に,その基準軸Gに平行な磁場をソレノイドコイル35で発生させ,発生された磁場中を旋回飛行する試料イオンをイオン検出器21で検出し,検出された試料イオンの所定距離における飛行時間を測定し,測定された飛行時間に基づいて上記散乱イオンの質量を分析する。
(もっと読む)
酸化膜厚の測定方法
【課題】基板上に形成された薄い酸化膜の膜厚を、二次イオン質量分析法により、より簡便且つ正確に測定する。
【解決手段】既知の膜厚を有する酸化膜に一次イオンを照射することでスパッタリングしつつ放射される二次イオンの検出強度の最大値を取得して膜厚と二次イオンの検出最大値との関係を示す検量線を作製し、次いで、未知の膜厚を有する同一酸化膜に対して同様に二次イオンの検出最大値を取得し、その値を先の検量線に外挿することによって膜厚に換算することにより未知の膜厚を得る。
(もっと読む)
解析支援システムおよび解析支援方法
【課題】 複数の方法で測定された質量分析データを用いた試料の同定を支援する。
【解決手段】 第一方法に基づく質量分析により試料の第一測定スペクトルを取得するとともに、第二方法に基づく質量分析により試料の第二測定スペクトルを取得する(S103、S109)。第一測定スペクトルに基づいて試料の同定を行い、試料の第一候補タンパク質を抽出する(S105)。第一候補タンパク質の配列データに基づき、第二方法により得られる第一候補タンパク質の第二理論スペクトルを取得する(S107)。そして、第一候補タンパク質の第二理論スペクトルを第二測定スペクトルとともに重ね合わせて表示する(S111)。
(もっと読む)
組織切片の質量分析法による分析のための光解離または断片化により開裂可能なリンカーとの接合体の使用
本発明は、少なくとも1種類の(A−X)n−B接合体(式中、Aは既知分子量のタグ分子であり、Xは試料の脱離/イオン化の際に開裂されるリンカーであり、nは少なくとも1の整数であり、Bは上記タグ分子に特異的に結合する結合分子である)を用いて、組織切片における少なくとも1種類のターゲット分子マップを決定する方法に関する。MALDI質量分析法を用いるときには、上記リンカー分子Xは、上記MALDIレーザーの波長で光開裂可能であるときには、試料のレーザー照射の際の光解離によって開裂することができる。あるいは、UV−MALDI、IR−MALDI、SIMSまたはDESI質量分析法を用いるときには、上記リンカー分子Xは、試料の脱離/イオン化の際に断片化によって開裂することができる。  (もっと読む)
(もっと読む)
イオン及び荷電粒子を混合するための方法及び構成
【課題】 荷電粒子を衝突セルに導入するための装置を提供する。
【解決手段】 本発明の装置は、イオンと荷電粒子とを混合するための装置であって、イオン出口端を有する多重極装置と、イオン出口端に接続されている質量分析器と、質量分析器に接続されている荷電粒子源とを備え、荷電粒子源によって生成される荷電粒子が質量分析器を通って、イオン出口端を介して、多重極装置内に入るように構成されていることを特徴とする。
(もっと読む)
二酸化炭素放出量の構成比率の推定方法
【課題】森林内の生態系呼吸の構成要素であり二酸化炭素排出源である土壌呼吸と植物の地上部の呼吸の二酸化炭素放出量を分離して評価することを可能とする。
【解決手段】生態系呼吸の二酸化炭素の量cE、土壌呼吸の二酸化炭素の量csoil及び植物の地上部の呼吸の二酸化炭素の量cav、並びに、生態系呼吸の二酸化炭素の炭素安定同位体比δ13CE、土壌呼吸の二酸化炭素の炭素安定同位体比δ13Csoil及び植物の地上部の呼吸の二酸化炭素の炭素安定同位体比δ13Cavの間の関係式をδ13CE×cE=δ13Csoil×csoil+δ13Cav×cavとし、δ13CE、δ13Csoil及びδ13Cavの値から土壌呼吸の二酸化炭素の量と植物の地上部の呼吸の二酸化炭素の量の比率を算出するようにした。
(もっと読む)
マススペクトルを用いた化学的に架橋された細胞サンプルの分類方法
化学的に架橋された分析物を含む細胞のサンプルを分析する方法が提供される。前記分析には質量分析法を使用することが典型的である。 (もっと読む)
固体試料の分析方法
本発明は、固体試料を分析する方法に関する。この種類の方法は、特に、固体表面内又は上の材料組成及び分布の分析に使用される。本発明の方法では、分析される表面は、少なくとも部分的に及び/又は複数の領域においてセシウムで被覆される。また、表面は、1イオンあたり少なくとも3原子を有する多原子イオンを主に又は排他的に含む分析ビームにより照射される。生成される二次イオンは、セシウム化合物で分析される。 (もっと読む)
デコンボリューション解析装置、デコンボリューション解析プログラム及びデコンボリューション解析方法
【課題】試料最表面に存在する極めて薄い薄膜や極めて急峻な傾きを持つ不純物分布であっても正しい深さ方向分布に解析する。
【解決手段】スパッタリング初期における深さ方向へのスパッタ率変化に基づいて補正するとともに(S4)、補正された深さ方向分布の深さ軸を伸張させ(S5)、深さ軸を伸張させられた深さ方向分布に対し、深さ方向分布を2n個のデータ点で構成し、かつ、各データ間の距離を等間隔にデータ補間し(S6)、データ補間した深さ方向分布のデータ点間距離およびデータ数に合わせて、S3で抽出した深さ方向分解能関数パラメータを用いて深さ方向分解能関数の分布データを作成し(S7)、作成された深さ方向分解能関数分布データと補間により求めた深さ方向分布とに基づいてデコンボリューション解析し(S8)、デコンボリューション解析されたデータの伸張されている深さ軸を実際の深さ軸に戻す(S9)。
(もっと読む)
マススペクロトメトリーを強めるトリチル誘導体
式(I)のイオンを形成する方法を提供する。該方法は、(i)式(IIa)
の化合物を、Mと反応して共有結合を形成する能力を有する少なくとも1つの基を有するバイオポリマーBPと反応させて、式(IIIa)のバイオポリマー誘導体を提供する工程;および(ii)Xと式(IIIa)の誘導体のα-炭素原子の間のC−X結合を開裂させて、式(II)のイオンを形成させる工程;を含み、式中、(IV)は正の単一電荷または負の単一電荷を持つ炭素原子であり;Xはα-炭素原子から切断されて式(I)のイオンを形成する能力を持つα-炭素に直接結合したチオエーテル硫黄原子を含む基である。
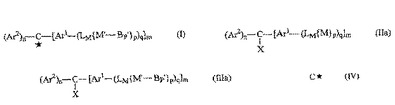 (もっと読む)
(もっと読む)
代謝物の定量方法
【課題】
本発明の課題は、生体内における代謝物の網羅的な定量方法を見出すことにある。
【解決手段】
代謝的に同位体標識された第一の代謝物群を調製し、サンプルと混合して質量分析装置で測定することにより、サンプル(例えば、組織、生体液、細胞など)中の複数の代謝物を精度よく定量することが可能となった。また、代謝的に同位体標識された第一の代謝物群中の代謝物を定量しておくことにより、代謝物の網羅的な絶対定量が可能となった。
(もっと読む)
質量分析計
入口電極(2)及び出口電極(3)を有するイオンガイド又はイオントラップ(1)が開示される。出口電極(3)の電位は、比較的短期間の間、周期的に降下され、いくつかのイオンがイオンガイド又はイオントラップ(1)から出口電極(3)における開口を介して脱出することを可能にする。出口電極(3)の電位が降下される期間は、漸次増加され、イオンは、イオンガイド又はイオントラップ(1)から質量電荷比に依存して出現する。イオンガイド又はイオントラップ(1)は、質量セパレータ又は低分解能質量分析器として動作され得る。 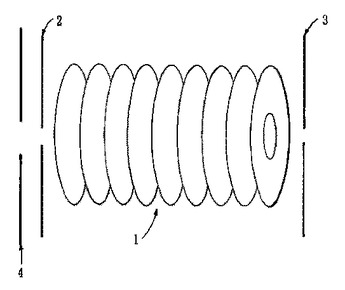 (もっと読む)
(もっと読む)
質量分析システムおよび質量分析方法
【課題】微量なタンパク質由来のペプチドなどを、ユーザの欲するタンデム質量分析ターゲットとして計測の無駄なく自動的に判定処理する。
【解決手段】測定対象物質をイオン化し、生成した種々のイオン種を質量分析し、生成した種々のイオン種の中から特定の質量対電荷比を持つイオン種を選択して解離させ、イオンの質量分析測定をn段階(n=1,2,…)繰り返すタンデム型の分析システムである。n段階目の質量分析であるMSn結果で、イオンの質量対電荷比に対するピークで表されたイオン強度に基づき、MSnの次の分析の制御内容を分析対象イオン毎に判定するデータ処理する。イオン化検出部14は試料から計測されイオン化されたデータを高精度に照合、同位体ピーク判定する。データ処理部15は、ある一定期間に測定した、例えば親イオンペプチドのMS1のカウント数をIとするとき、ペプチドのMS2の積算回数又は分析時間を1/Iに比例させる。
(もっと読む)
質量分析計
イオン検出器からの電圧信号が分析される質量分析方法が開示される。各電圧信号の二階微分を取得し、観測された電圧ピークの開始及び終了時間を決定する。次いで、各電圧ピークの強度及び平均時間を決定し、その強度及び時間値を記憶する。次いで、複数回の実験実行から観測された各電圧ピークに関係する強度及び時間値を組み合わせることにより、中間の合成マススペクトルを形成する。次いで、時間及び強度データの種々のペアを積分して平滑な連続マススペクトルを生成する。次いで、連続マススペクトルは、連続マススペクトルの二階微分を決定することによってさらに処理し得る。連続マススペクトルにおいて観測される質量ピークの開始及び終了時間を決定し得る。次いで、連続マススペクトルにおいて観測される各質量ピークの強度及び質量電荷比を決定し得る。次いで、イオン種ごとの強度値及び質量電荷比だけを含む最終の離散マススペクトルを表示又は出力し得る。 (もっと読む)
クロマトグラフ分析装置
【課題】 GC/MSでカラム入口切除等の分離条件の変更を行った場合に、その前に設定してあるSIM測定パラメータを1つずつ変更しなければならず面倒である。
【解決手段】 分離条件の変更の後、所定の参照成分を含む標準試料を分析すると、データ処理部31ではその分析により得られるクロマトグラムに現れている参照成分のピークの保持時間の実測値を求め、その実測値と分析条件情報格納部34に格納されている分離条件変更前の参照成分の保持時間の情報とに基づいて、目的成分のピークの保持時間のずれを推定して分析条件情報格納部34に格納されているSIM測定パラメータの各イオンセットの測定時間範囲を修正する。目的試料を分析する際に修正されたパラメータに従ってSIM測定を行うことにより、オペレータが所望する測定が行える。
(もっと読む)
ナトリウム利尿ペプチドに関連したポリペプチド、並びにこれらの同定および使用法
本発明は、関心対象の所望のポリペプチドに対する抗体と結合するポリペプチドの同定および使用に関する。ナトリウム利尿ペプチドおよびこれらの前駆体、特にBNPを一例として使用し、本発明は、生体試料中、最も好ましくは血液由来試料中に産生される、BNPに対する抗体に結合する多くのナトリウム利尿ペプチド断片を記載する。このような断片の産生は、なかでも組織内へのナトリウム利尿ペプチドの放出を誘発する事象の開始と試料を入手または解析する時間との間の経過時間;試料獲得と試料を解析した時間との間の経過時間;問題の組織試料のタイプ;貯蔵条件;存在するタンパク質分解酵素の量などの関数でありうる持続的なプロセスであることから、正確な予後または診断の結果を提供するために、1つまたは複数のナトリウム利尿ペプチドのためのアッセイ法をデザインするとき、およびこのようなアッセイ法を行うときの両方においてこのような断片を使用してもよい。 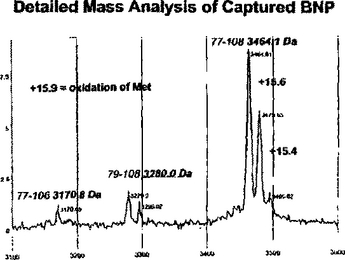 (もっと読む)
(もっと読む)
新規肝がんバイオマーカーおよび該バイオマーカーを用いた肝がんの検出方法
【課題】 正常人と肝がん患者において存在の有無、存在量が異なるタンパク質およびその部分ペプチドを用いて肝がんを検出する方法、ならびに該タンパク質および部分ペプチドからなる肝がん検出のためのバイオマーカーの提供。
【解決手段】 配列番号1で表されるアミノ酸配列からなるフィブリノーゲンα鎖、配列番号3で表されるアミノ酸配列からなるフィブリノペプチドA like、配列番号5で表されるアミノ酸配列からなる補体C4A、配列番号7で表されるアミノ酸配列からなるインターαトリプシンインヒビター、配列番号9で表されるアミノ酸配列からなるゲルソリン、配列番号11で表されるアミノ酸配列からなるアポリポプロテインA1、配列番号13で表されるアミノ酸配列からなるα2マクログロブリン、配列番号15で表されるアミノ酸配列からなるα1アンチトリプシン、配列番号2で表されるアミノ酸配列からなるフィブリノーゲンα鎖の部分ペプチド、配列番号4で表されるアミノ酸配列からなるフィブリノペプチドA likeの部分ペプチド、配列番号6で表されるアミノ酸配列からなる補体C4Aの部分ペプチド、配列番号8で表されるアミノ酸配列からなるインターαトリプシンインヒビターの部分ペプチド、配列番号10で表されるアミノ酸配列からなるゲルソリンの部分ペプチド、配列番号12で表されるアミノ酸配列からなるアポリポプロテインA1の部分ペプチド、配列番号14で表されるアミノ酸配列からなるα2マクログロブリンの部分ペプチド、配列番号16で表されるアミノ酸配列からなるα1アンチトリプシンの部分ペプチド、配列番号17で表されるアミノ酸配列からなるインターαトリプシンインヒビター重鎖H4前駆体の部分ペプチドからなる群から選択される少なくとも1つのタンパク質またはペプチドからなる肝がん検出のための肝がんバイオマーカー。
(もっと読む)
181 - 200 / 265
[ Back to top ]