Fターム[4C085BB31]の内容
抗原、抗体含有医薬:生体内診断剤 (92,173) | ハプテン抗原又は抗体 (10,241) | 免疫グロブリン (4,174)
Fターム[4C085BB31]の下位に属するFターム
Fターム[4C085BB31]に分類される特許
781 - 800 / 922
ME−5、ME−2、及びEPP2:子宮内膜症に罹患している女性の血清中に存在する自己抗体と反応するヒト蛋白質抗原
【課題】子宮内膜症を特異的に診断するためのツール
【解決手段】3個のヒト子宮内膜抗原、ME-5、ME-2及びEPP2、並びにそれらの組み合わせを、子宮内膜症に罹患している女性の血清中に存在する抗体のターゲットとし、これらの蛋白質生成物及びヒト抗体のそれらとの反応性を、子宮内膜症患者を診断する診断(用)のアッセイ用ツールとして使用する。
(もっと読む)
副作用が軽減された治療抗体
治療標的へのタンパク質の結合を阻害するペプチドで修飾され、それによってタンパク質に起因する副作用を軽減する、治療抗体等の治療タンパク質。 (もっと読む)
改変トランスフェリン−抗体の融合タンパク質
増大した血清半減期または血清安定性を有する、トランスフェリンおよび治療タンパク質または治療ペプチド(好ましくは抗体可変領域)の改変された融合タンパク質が開示されている。好ましい融合タンパク質には、トランスフェリン成分が、全くグリコシル化されないかグリコシル化が低下している、鉄に対して全く結合しないか結合が低下している、トランスフェリン受容体に対して全く結合しないか結合が低下している、の少なくともいずれかであるように改変された融合タンパク質が含まれる。 (もっと読む)
βアミロイド誘導Mib遺伝子
【課題】
βアミロイドによりアストログリア細胞で発現が誘導される新規な遺伝子を見出すことであり、さらに該遺伝子がコードするポリペプチドを同定し、該遺伝子および該ポリペプチド等をβアミロイドに関連した神経疾患の診断および治療を目的とする手段として使用すること。
【解決手段】
βアミロイド刺激により発現が誘導される新規遺伝子をcDNAサブトラクション法により取得し、新規ポリヌクレオチド、該ポリヌクレオチドがコードするポリペプチド、該ポリヌクレオチドを含む組換えベクター、該組換えベクターを有する形質転換体、該ポリペプチドに対する抗体、該ポリペプチドの製造法、上記のものを用いた該遺伝子および/または蛋白質の発現を調節する化合物の同定法、該方法で得られる化合物、ならびにこれらを用いたβアミロイドに関連した神経疾患のための医薬組成物、診断方法、診断用キット、治療方法等を提供する。
(もっと読む)
抗イディオタイプ抗体を得る方法
自己免疫疾患関連自己抗体(auto−antibody)(自己抗体(autoantibodies))の1イディオタイプを模倣する分子の同定方法。該方法は、以下の段階、すなわち(a)自己免疫疾患に苦しめられている1人若しくはそれ以上の患者の血清から自己抗体を精製すること;(b)該自己抗体を固相に結合してアフィニティーマトリックスを形成すること;(c)免疫グロブリンを含んでなるプールした血漿若しくはB細胞をアフィニティーマトリックスと接触させること、次いで未結合の血漿成分を除去すること;(d)自己抗体に対する抗イディオタイプ抗体(抗Id)である結合した免疫グロブリンをマトリックスから溶出すること;(e)複数の分子メンバーを含んでなる分子ライブラリーを提供すること;ならびに(e)該分子ライブラリーと抗Idを接触させること、および該抗Idにより結合される結合した分子を単離すること(該結合した分子は自己抗体の1イディオタイプを模倣する分子である)を含んでなる。こうした分子もまた開示される。 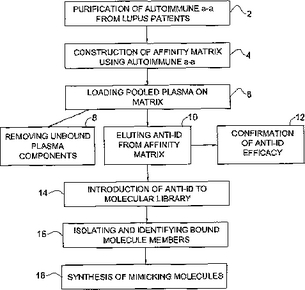 (もっと読む)
(もっと読む)
mAbCL1−R2から得られる抗CD160特異的化合物の血管新生と免疫の用途
【課題】本発明は、抗CDモノクローナル抗体(CL1−R2 CNCM I−3204)及びその保存的均等物に関する。
【解決手段】更に、特にEC血管新生、NK、及びTサイトカイン生成の分野におけるこれらの抗CD160化合物の適用に関する。
(もっと読む)
GlcNAcMan5Man3GlcNAc2グリコフォームを支配的に含む免疫グロブリン
本発明は、特定エフェクター機能を与える、免疫グロブリン糖タンパク質の支配的グリコフォーム構造を有する免疫グロブリン糖タンパク質組成物に関する。加えて、本発明は、特定の富化N−グリカン構造を有する抗体を含み、前記N−グリカン構造がGlcNAcMan5GlcNAc2である医薬組成物に関する。 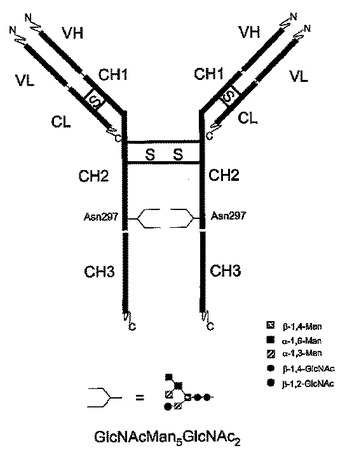 (もっと読む)
(もっと読む)
VEGF媒介性活性をブロックすることによるI型糖尿病を処置する方法
VEGF媒介性活性をブロックまたは阻害することによって、哺乳動物、特にヒトにおける糖尿病を処置する方法。VEGF媒介性活性の好ましいインヒビターは、VEGFに結合および阻害し得る配列番号2のVEGF融合タンパク質トラップのようなVEGFアンタゴニストである。本発明の方法は、インスリン治療法のような他の治療法と組み合わせられ得る。特定の実施形態において、本発明の処置する方法は、血清グルコースレベルの低下、グルコース耐性の改善、および/または血糖コントロールの改善を生じる。 (もっと読む)
新規な抗IGF−IR抗体及びその使用
本発明は、ヒトインスリン様成長因子I受容体IGF−IRと特異的に結合することができ、且つ/又はそのIGF−IRのチロシンキナーゼ活性を特異的に阻害することができる新規な抗体、特にマウスのモノクローナル抗体、キメラモノクローナル抗体及びヒト化モノクローナル抗体、並びにこれらの抗体をコードするアミノ酸配列及び核酸配列に関する。本発明はまた、IGF−IRを過剰発現する癌又はその受容体の過剰発現に関連した病状の予防的処置及び/又は治療的処置を目的とした薬剤としての、並びにIGF−IRの過剰発現に関連した疾患の診断のための方法又はキットにおけるこれら抗体の使用を含む。本発明は最後に、このような抗体と、抗EGFR抗体、及び/又は抗VEGF抗体、及び/又は腫瘍進行もしくは転移に関与する他の成長因子に対する抗体、及び/又は化合物、及び/又は抗癌剤、又は毒素と共役した物質とを組み合わせて含む、製品及び/又は組成物、並びに特定の癌の予防及び/又は治療のためのその使用に関する。
【配列表】
SEQUENCE LISTING
<110> PIERRE FABRE MEDICAMENT
<120> Novel anti-IGF-IR antibodies and uses thereof
<130> D22514
<140> PCT/IB2005/002619
<141> 2005-07-27
<150> US 60/591 932
<151> 2004-07-29
<150> FR 04/08379
<151> 2004-07-29
<160> 26
<170> PatentIn version 3.1
<210> 1
<211> 16
<212> PRT
<213> Mus musculus
<400> 1
Arg Ser Ser Gln Thr Ile Ile His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 2
<211> 7
<212> PRT
<213> Mus musculus
<400> 2
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 3
<211> 10
<212> PRT
<213> Mus musculus
<400> 3
Phe Gln Gly Ser His Val Pro Tyr Thr Phe
1 5 10
<210> 4
<211> 5
<212> PRT
<213> Mus musculus
<400> 4
Asp Tyr Trp Met Asn
1 5
<210> 5
<211> 17
<212> PRT
<213> Mus musculus
<400> 5
Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe Tyr
1 5 10 15
Asp
<210> 6
<211> 13
<212> PRT
<213> Mus musculus
<400> 6
Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Mus musculus
<400> 7
Lys Ala Ser Gln Asn Val Val Thr Asn Val Ala
1 5 10
<210> 8
<211> 7
<212> PRT
<213> Mus musculus
<400> 8
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 9
<211> 9
<212> PRT
<213> Mus musculus
<400> 9
His Gln Tyr Asn Asn Phe Pro Leu Thr
1 5
<210> 10
<211> 5
<212> PRT
<213> Mus musculus
<400> 10
Glu Tyr Gly Val Ser
1 5
<210> 11
<211> 16
<212> PRT
<213> Mus musculus
<400> 11
Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
<210> 12
<211> 6
<212> PRT
<213> Mus musculus
<400> 12
His Glu Gly Met Asp Tyr
1 5
<210> 13
<211> 11
<212> PRT
<213> Mus musculus
<400> 13
Ile Thr Ser Thr Asp Ile Asp Asp Asp Met Asn
1 5 10
<210> 14
<211> 7
<212> PRT
<213> Mus musculus
<400> 14
Glu Gly Asn Thr Leu Arg Pro
1 5
<210> 15
<211> 9
<212> PRT
<213> Mus musculus
<400> 15
Leu Gln Ser Asp Lys Met Pro Leu Thr
1 5
<210> 16
<211> 5
<212> PRT
<213> Mus musculus
<400> 16
Asn Tyr Ala Met Ser
1 5
<210> 17
<211> 16
<212> PRT
<213> Mus musculus
<400> 17
Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys Gly
1 5 10 15
<210> 18
<211> 9
<212> PRT
<213> Mus musculus
<400> 18
Glu Gly Gly Leu Val Trp Phe Ala Tyr
1 5
<210> 19
<211> 112
<212> PRT
<213> Mus musculus
<400> 19
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Ile Ile His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 20
<211> 123
<212> PRT
<213> Mus musculus
<400> 20
Gln Ala Gln Leu Gln Gln Pro Gly Ala Val Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Ser Tyr Ser Phe Thr Asp Tyr
20 25 30
Trp Met Asn Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Gln Trp Ile
35 40 45
Gly Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Phe Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 21
<211> 107
<212> PRT
<213> Mus musculus
<400> 21
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Val Thr Asn
20 25 30
Val Ala Trp Tyr Gln His Lys Pro Gly His Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys His Gln Tyr Asn Asn Phe Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 22
<211> 114
<212> PRT
<213> Mus musculus
<400> 22
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 23
<211> 114
<212> PRT
<213> Mus musculus
<400> 23
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 24
<211> 107
<212> PRT
<213> Mus musculus
<400> 24
Glu Thr Thr Val Thr Gln Ser Pro Ala Ser Leu Ser Val Ala Thr Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Leu Thr Ile Glu Asn Thr Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Lys Met Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 25
<211> 117
<212> PRT
<213> Mus musculus
<400> 25
Glu Val Asn Leu Val Glu Ser Gly Gly Ile Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Arg Asn Ile Leu Tyr Leu
65 70 75 80
Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Gly Leu Val Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 26
<211> 16
<212> PRT
<213> Mus musculus
<400> 26
Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
(もっと読む)
DKK−1に対する抗体
本発明は、Dkk−1ポリペプチド類に特異的に結合する抗体およびその免疫機能性フラグメントを提供する。対象の抗体およびフラグメントは、Dkk−1タンパク質のカルボキシ領域に位置する配座エピトープに高親和性で結合する。このような抗体またはそのフラグメント、ならびに抗体またはそのフラグメントを含有する生理的に受容可能な組成物を調製する方法もまた提供する。骨疾患、炎症性疾患、神経系疾患、眼疾患、腎疾患、肺疾患および皮膚疾患など、種々の疾患を治療するための抗体およびフラグメントの使用法もまた開示する。  (もっと読む)
(もっと読む)
Man3GlcNAc2グリコフォームを支配的に含む免疫グロブリン
本発明は、特定エフェクター機能を与える、免疫グロブリン糖タンパク質上の支配的グリコフォーム構造を有する免疫グロブリン糖タンパク質組成物に関する。加えて、本発明は、特定の富化N−グリカン構造を有する抗体を含み、前記N−グリカン構造がMan3GlcNAc2である医薬組成物に関する。 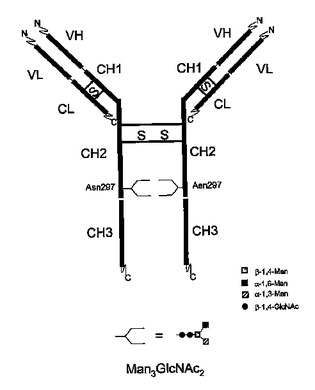 (もっと読む)
(もっと読む)
HIF−1アルファのsiRNA阻害に関する組成物及び方法
【解決手段】 HIF−1アルファmRNAを標的とする低分子干渉RNAを使用するRNA干渉は、HIF−1アルファ遺伝子の発現を抑制する。HIF−1アルファがVEGFの転写調節因子であるとき、VEGFの発現もまた抑制される。HIF−1アルファのsiRNA媒介下方制御を介したVEGF産物の調節は血管新生、特に糖尿病性網膜症、加齢性黄斑変性、及び種々の癌腫等の疾患における血管新生を阻害するために用いられ得る。 (もっと読む)
抗体又はその断片の結晶化
本開示は抗体又はその断片の結晶化及び/又は濃縮の方法に関する。本方法は、二価カチオンの塩を含有する溶液に抗体又はその断片を接触させることを含む。抗体又はその断片の結晶及び/又はタンパク質ゲルは組成物又は製剤において有用である。 (もっと読む)
腫瘍細胞成長阻害のための組成物及び方法
【課題】腫瘍細胞成長を阻害し、腫瘍を治療するための方法・組成物、及び抗腫瘍化合物を同定するためのスクリーニング方法を提供する。
【解決手段】新規なポリペプチド、及びそれらをコードする核酸分子を見出し、該配列を含むベクター及び宿主細胞、異種ポリペプチド配列に融合したポリペプチドを含むキメラポリペプチド分子、結合抗体及びそれらを製造する方法を提供する。
(もっと読む)
β−アミロイドペプチドを認識するヒト化抗体
本発明は、患者の脳中のAβのアミロイド沈着物を伴う疾患の処置のための改良された作用物質および方法を提供する。好ましい作用物質はヒト化抗体を包含する。 (もっと読む)
血液凝固を阻害する抗体及びその使用方法
本発明は、生の(未変性の)ヒトTFに高い親和性と特異性で結合することによって優れた抗凝固活性を提供する抗体を含んでいる。本発明の抗体は、インビトロでの血液凝固を効果的に阻害することができる。本発明の抗体は、それのみで、又はTF:VIIa複合体中に存在して、第X因子又は第IX因子がTF又は当該複合体に結合することを妨げるよう、未変性のヒトTFと結合することが可能であり、そうすることによって血液凝固を低下させるものである。本発明の好ましい抗体は、未変性のヒトTFに対して優位なエピトープの配座に特異的に結合する。当該エピトープは非常に強い抗体結合部位を有する。TFに結合するヒト型抗体及びその断片も又提供される。 (もっと読む)
筋疾患の治療のためのCHN−1/CHIPアンタゴニスト
本発明は、カエノルハブディティス・エレガンス(Caenorhabditis elegans)CHN−1および/またはヒトCHIP(Hsc70相互作用タンパク質のカルボキシル末端)の哺乳動物オルソログの阻害剤/負の制御因子/アンタゴニストを含む、薬剤組成物に関する。さらに、医学的設定および薬学的設定における、前記阻害剤/負の制御因子/アンタゴニストの使用を記載する。さらに、CHIP/CHN−1阻害剤/アンタゴニストの同定のためのスクリーニング法およびツールを提供する。 (もっと読む)
生物兵器防衛のための免疫療法
ヒト中和抗体(全長または機能的フラグメント)は、例えば、炭疽菌、ボツリヌス菌、天然痘、ベネズエラウマ脳脊髄炎ウイルス(VEEV)、西ナイルウイルス(WNV)などの感染性因子に対する、抗毒素剤または抗感染剤として有用である。ファージディスプレイ技術および予防接種したヒトまたは回復期のヒトのリンパ細胞由来のメッセンジャーRNAを使用して、本明細書中に記載した方法に従って、感染性因子由来の抗原に結合する抗体フラグメント(Fab)のパネルを迅速に同定することが可能である。 (もっと読む)
糖尿病およびインスリン抵抗性の診断および治療の方法
本発明は、糖尿病およびインスリン抵抗性の診断および治療のための組成物および方法を提供する。特に、本発明は、本発明のポリヌクレオチドまたはポリペプチドの修飾物質を同定する方法およびこれらの修飾物質を糖尿病の治療に用いる方法、さらには患者における本発明のポリヌクレオチドまたはポリペプチドのレベルを測定することによって糖尿病を診断する方法を提供する。 (もっと読む)
ブチロフィリン4またはB7−L1によるT細胞活性化阻害
本発明は、免疫細胞をBTF4またはB7−L1介在シグナル化を調節する物質に接触させることを含む免疫反応を調節するための方法を提供する。BTF4またはB7−L1介在シグナル化は、増加することで免疫反応をダウンレギュレートするか、代わりに減少することで免疫反応をアップレギュレートする。調節は活性化または阻害のいずれかで、接触はインビボまたはインビトロにおいて発生する。インビボでの該方法の実行はまた、免疫反応のアップレギュレーションまたはダウンレギュレーションから利益を得る個体の治療となりうる可能性がある。免疫反応をダウンレギュレートする、かかる調節は、例えば、臓器移植を受けた個体、またはアレルギーまたは自己免疫疾患などの状態を有する個体に対する治療として役立つ。また、免疫反応をアップレギュレートする調節は、例えば、免疫抑制疾患または腫瘍などの状態を有する個体に対する治療として役立つ。BTF4シグナルまたはB7−L1シグナルを調節する物質を同定する方法もまた提供する。 (もっと読む)
781 - 800 / 922
[ Back to top ]

