Fターム[4C085GG04]の内容
抗原、抗体含有医薬:生体内診断剤 (92,173) | 適用部位 (8,178) | 注射 (6,087) | 皮下 (1,059)
Fターム[4C085GG04]に分類される特許
941 - 960 / 1,059
血管新生において差次的に発現するESM−1遺伝子、そのアンタゴニスト、および、それらを使用する方法
本発明は、血管形成および発癌において発現が調節される、核酸およびそのコードされるポリペプチドであるESM−1に関する。本発明はまた、前記ポリペプチドに対する特異性を有する抗体に関する。本発明はまた、アンチセンス分子に関する。本発明はさらに、このような生物学的効果を必要としている哺乳動物における血管形成を治療または調節するのに有用な方法に関する。 (もっと読む)
CMV/R核酸コンストラクトを含むAIDSに対するワクチン
本開示は、ヒト免疫不全ウイルスに対する免疫応答、例えば予防的免疫応答を誘導するための組成物を提供する。組成物は、複数の分岐群又は系統のHIV抗原ポリペプチドをコードする核酸コンストラクトを含む。被験体に組成物を投与することにより免疫応答を誘導する方法も提供される。 (もっと読む)
活性酸素種を産生する抗体の抗微生物活性
本発明は、一重項酸素に暴露したときに活性酸素種を産生できる抗体を有する組成物、ならびにその組成物の、例えば、微生物感染を処置するための使用を提供する。 (もっと読む)
抗原提示ヒトγδT細胞の調製及び免疫療法における使用
本発明は、有効である抗原提示ヒトγδT細胞の調製方法、この方法によって調製されたγδT細胞、ならびに免疫療法、ワクチン接種、ワクチン開発及び診断におけるその使用に関する。本発明のヒトγδT細胞は、その能力及び効果において樹状細胞(DC)と同等であり、αβT細胞に抗原ペプチドを提示し、ナイーブなαβT細胞に抗原特異的な応答(増殖及び分化)を誘導する。γδT細胞は末梢血から簡単に精製することが可能であり、刺激下でin vitro培養を行うことで1日以内に「成熟」状態(接着分子、共刺激分子及び主要組織適合遺伝子複合体分子の発現)を獲得し、ヘルパーT細胞及び細胞障害性T細胞の強力な一次及び二次応答を誘導する。本発明のγδT細胞は、腫瘍や慢性または再発性感染症の治療方法、新たな腫瘍または病原体由来抗原の特定、及び患者の免疫能の診断に使用することができる。 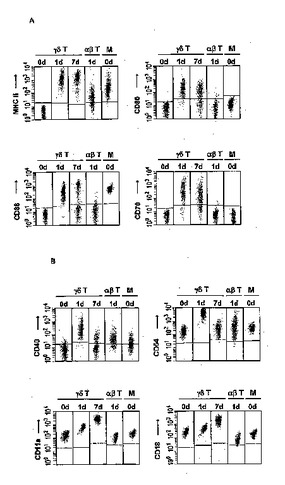 (もっと読む)
(もっと読む)
シヌクレイノパシー(synucleinopathic)およびアミロイド生成性疾患の予防および処置
本発明は、患者の脳内にあるα−シヌクレインのレビー小体など、シヌクレインが原因となる疾患に関連する疾患の治療用の改善された薬剤および方法を提供する。このような方法は、レビー小体に対する有益な免疫原性反応を誘導する薬剤を投与することを伴う。本方法はパーキンソン病の予防上および治療上の処置に特に有用である。1つの局面において、本発明は、脳におけるレビー小体またはα−シヌクレイン凝集を特徴とする疾患の予防または治療を達成する方法であって、該疾患に罹病しているか、そのリスクを有する患者に、配列番号1によって番号付けされた、ヒトα−シヌクレインの1〜20位の残基の中にあるエピトープに特異的に結合する抗体の有効な投与計画を行うことを含む方法を提供する。  (もっと読む)
(もっと読む)
細胞表面糖タンパク質
本発明は、本明細書で細胞表面糖タンパク質として同定された新規なタンパク質(INSP201と称される)並びに疾患の診断、予防及び治療における前記タンパク質及びそのコード遺伝子に由来する核酸の使用に関する。 (もっと読む)
バイオマーカーを用いたアッセイおよび方法
哺乳動物組織または細胞試料における一ないし複数のバイオマーカーの発現を検査する方法およびアッセイを提供する。開示した方法およびアッセイによって、一ないし複数のバイオマーカーの発現の検出が、該組織または細胞試料がApo2L/TRAILおよび抗DR5アゴニスト抗体などのアポトーシス誘導剤に対して感受性があるか否かを予測するものである。試験しうる特定のバイオマーカーには、フコシルトランスフェラーゼ、特にフコシルトランスフェラーゼ3(FUT3)および/またはフコシルトランスフェラーゼ6(FUT6)、並びにシアリルルイスAおよび/またはX抗原が含まれる。また、キットおよび製造品も提供される。 (もっと読む)
RAGE融合タンパク質及び使用方法
第二の非RAGEポリペプチドと連結したRAGEポリペプチド配列を含むRAGE融合タンパク質を開示する。前記RAGE融合タンパク質は、RAGEリガンド結合部位を含むRAGEポリペプチド・ドメイン、及び免疫グロブリンCH2ドメインに直接連結されたドメイン間リンカーを利用できる。そのような融合タンパク質は、RAGEリガンドに対する特異的で、高い親和性結合を提供しうる。また、RAGE媒介性病理の治療法としてのRAGE融合タンパク質の使用も開示しうる。 (もっと読む)
ハプテン担体抱合体およびその用法
本発明は、規則的で反復性のアレイの形を取る、ハプテンと担体から成る抱合体を含む組成物、そのような組成物の製造法を提供する。本発明の抱合体および組成物は、真核細胞性のウィルスまたはバクテリオファージから得られたウィルス様粒子を担体として含み、この担体は、ホルモン、毒素および薬物、特に、ニコチンのような依存性薬物を含む各種ハプテンと結合される。本発明の組成物および抱合体は、ハプテンに対して免疫反応を誘発するのに有用であり、これらの組成物および抱合体は、各種治療、予防および診断処方において有用である可能性がある。いくつかの実施態様では、本発明の抱合体、組成物および方法によって生成された免疫反応は、乱用薬剤の依存症、および、薬物依存と関連して起こる病気を予防または治療するのに有用である。  (もっと読む)
(もっと読む)
新規な抗IGF−IR抗体及びその使用
本発明は、ヒトインスリン様成長因子I受容体IGF−IRと特異的に結合することができ、且つ/又はそのIGF−IRのチロシンキナーゼ活性を特異的に阻害することができる新規な抗体、特にマウスのモノクローナル抗体、キメラモノクローナル抗体及びヒト化モノクローナル抗体、並びにこれらの抗体をコードするアミノ酸配列及び核酸配列に関する。本発明はまた、IGF−IRを過剰発現する癌又はその受容体の過剰発現に関連した病状の予防的処置及び/又は治療的処置を目的とした薬剤としての、並びにIGF−IRの過剰発現に関連した疾患の診断のための方法又はキットにおけるこれら抗体の使用を含む。本発明は最後に、このような抗体と、抗EGFR抗体、及び/又は抗VEGF抗体、及び/又は腫瘍進行もしくは転移に関与する他の成長因子に対する抗体、及び/又は化合物、及び/又は抗癌剤、又は毒素と共役した物質とを組み合わせて含む、製品及び/又は組成物、並びに特定の癌の予防及び/又は治療のためのその使用に関する。
【配列表】
SEQUENCE LISTING
<110> PIERRE FABRE MEDICAMENT
<120> Novel anti-IGF-IR antibodies and uses thereof
<130> D22514
<140> PCT/IB2005/002619
<141> 2005-07-27
<150> US 60/591 932
<151> 2004-07-29
<150> FR 04/08379
<151> 2004-07-29
<160> 26
<170> PatentIn version 3.1
<210> 1
<211> 16
<212> PRT
<213> Mus musculus
<400> 1
Arg Ser Ser Gln Thr Ile Ile His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 2
<211> 7
<212> PRT
<213> Mus musculus
<400> 2
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 3
<211> 10
<212> PRT
<213> Mus musculus
<400> 3
Phe Gln Gly Ser His Val Pro Tyr Thr Phe
1 5 10
<210> 4
<211> 5
<212> PRT
<213> Mus musculus
<400> 4
Asp Tyr Trp Met Asn
1 5
<210> 5
<211> 17
<212> PRT
<213> Mus musculus
<400> 5
Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe Tyr
1 5 10 15
Asp
<210> 6
<211> 13
<212> PRT
<213> Mus musculus
<400> 6
Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Mus musculus
<400> 7
Lys Ala Ser Gln Asn Val Val Thr Asn Val Ala
1 5 10
<210> 8
<211> 7
<212> PRT
<213> Mus musculus
<400> 8
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 9
<211> 9
<212> PRT
<213> Mus musculus
<400> 9
His Gln Tyr Asn Asn Phe Pro Leu Thr
1 5
<210> 10
<211> 5
<212> PRT
<213> Mus musculus
<400> 10
Glu Tyr Gly Val Ser
1 5
<210> 11
<211> 16
<212> PRT
<213> Mus musculus
<400> 11
Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
<210> 12
<211> 6
<212> PRT
<213> Mus musculus
<400> 12
His Glu Gly Met Asp Tyr
1 5
<210> 13
<211> 11
<212> PRT
<213> Mus musculus
<400> 13
Ile Thr Ser Thr Asp Ile Asp Asp Asp Met Asn
1 5 10
<210> 14
<211> 7
<212> PRT
<213> Mus musculus
<400> 14
Glu Gly Asn Thr Leu Arg Pro
1 5
<210> 15
<211> 9
<212> PRT
<213> Mus musculus
<400> 15
Leu Gln Ser Asp Lys Met Pro Leu Thr
1 5
<210> 16
<211> 5
<212> PRT
<213> Mus musculus
<400> 16
Asn Tyr Ala Met Ser
1 5
<210> 17
<211> 16
<212> PRT
<213> Mus musculus
<400> 17
Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys Gly
1 5 10 15
<210> 18
<211> 9
<212> PRT
<213> Mus musculus
<400> 18
Glu Gly Gly Leu Val Trp Phe Ala Tyr
1 5
<210> 19
<211> 112
<212> PRT
<213> Mus musculus
<400> 19
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Ile Ile His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 20
<211> 123
<212> PRT
<213> Mus musculus
<400> 20
Gln Ala Gln Leu Gln Gln Pro Gly Ala Val Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Ser Tyr Ser Phe Thr Asp Tyr
20 25 30
Trp Met Asn Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Gln Trp Ile
35 40 45
Gly Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Phe Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 21
<211> 107
<212> PRT
<213> Mus musculus
<400> 21
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Val Thr Asn
20 25 30
Val Ala Trp Tyr Gln His Lys Pro Gly His Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys His Gln Tyr Asn Asn Phe Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 22
<211> 114
<212> PRT
<213> Mus musculus
<400> 22
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 23
<211> 114
<212> PRT
<213> Mus musculus
<400> 23
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 24
<211> 107
<212> PRT
<213> Mus musculus
<400> 24
Glu Thr Thr Val Thr Gln Ser Pro Ala Ser Leu Ser Val Ala Thr Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Leu Thr Ile Glu Asn Thr Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Lys Met Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 25
<211> 117
<212> PRT
<213> Mus musculus
<400> 25
Glu Val Asn Leu Val Glu Ser Gly Gly Ile Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Arg Asn Ile Leu Tyr Leu
65 70 75 80
Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Gly Leu Val Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 26
<211> 16
<212> PRT
<213> Mus musculus
<400> 26
Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
(もっと読む)
HIF−1アルファのsiRNA阻害に関する組成物及び方法
【解決手段】 HIF−1アルファmRNAを標的とする低分子干渉RNAを使用するRNA干渉は、HIF−1アルファ遺伝子の発現を抑制する。HIF−1アルファがVEGFの転写調節因子であるとき、VEGFの発現もまた抑制される。HIF−1アルファのsiRNA媒介下方制御を介したVEGF産物の調節は血管新生、特に糖尿病性網膜症、加齢性黄斑変性、及び種々の癌腫等の疾患における血管新生を阻害するために用いられ得る。 (もっと読む)
VEGF媒介性活性をブロックすることによるI型糖尿病を処置する方法
VEGF媒介性活性をブロックまたは阻害することによって、哺乳動物、特にヒトにおける糖尿病を処置する方法。VEGF媒介性活性の好ましいインヒビターは、VEGFに結合および阻害し得る配列番号2のVEGF融合タンパク質トラップのようなVEGFアンタゴニストである。本発明の方法は、インスリン治療法のような他の治療法と組み合わせられ得る。特定の実施形態において、本発明の処置する方法は、血清グルコースレベルの低下、グルコース耐性の改善、および/または血糖コントロールの改善を生じる。 (もっと読む)
ヒトIL−4に対するヒトモノクローナル抗体
ヒトインターロイキン−4特異的抗体ならびにIL−4および/またはIgE介在疾患の処置におけるそれらの使用。 (もっと読む)
CD2拮抗薬を投与することによりT細胞悪性腫瘍を予防または治療する方法
本発明はCD2拮抗薬、好ましくはMEDI-507、その類似体、誘導体または抗原結合フラグメントの、癌、特にT細胞悪性腫瘍、またはその1以上の症状を予防、治療、管理、または改善するための単剤療法としての使用を包含する。本発明はまた、CD2拮抗薬、好ましくはMEDI-507、その類似体、誘導体または抗原結合フラグメントの、他の癌療法と併用しての使用も包含する。本発明は、CD2拮抗薬、好ましくはMEDI-507、その類似体、誘導体または抗原結合フラグメントの、癌、特にT細胞悪性腫瘍、またはその1以上の症状を予防、治療、管理、または改善するために有効な量を含む医薬組成物を提供する。 (もっと読む)
エリシペロトリックス属のその他の菌種である血清型18由来の豚丹毒菌感染防御活性を有する新規ポリペプチドとその遺伝子および製法
【課題】豚丹毒感染症予防用ワクチン等の医薬品組成物の主成分として利用するため、豚に免疫したときに高い安全性と優れた有効性を示す組換えポリペプチドとその製造法を提供する。
【解決手段】SpaC(エリシペロトリックス 属のその他の菌種に属する血清型18菌由来の表層防御抗原ポリペプチド)及びそのカルボキシル末端に存在する237アミノ酸を除去した部分ポリペプチド(SpaCΔC)を作製することにより、豚に対して高い安全性と優れた有効性を示す防御抗原を提供できる。
【効果】該成分は組換えポリペプチドとして大量に発現され、提供した製造方法により容易に調製することが可能である。SpaC及びSpaCΔCポリペプチドは、豚丹毒感染症の予防のためのワクチンの成分として、および豚丹毒に対する抗体測定のための抗原として有用に利用することができる。
(もっと読む)
シェーグレン症候群の治療方法
治療に適切な患者のシェーグレン症候群の治療方法であって、B細胞表面マーカーに結合するアンタゴニストの有効量を患者に投与して、視覚的類似尺度において乾燥、疲労および関節痛のうちの2つ以上の基準に対して有意な改善を示す方法と、そのための製造品が提供される。また、治療に適切な被検体のシェーグレン症候群を治療することを伴う方法及び製造品は、B細胞表面マーカーに結合する抗体の有効量を被検体に投与することを伴い、特定の投与計画期間内に抗体への初回曝露と続く曝露を提供するものと、そのための製造品を提供する。  (もっと読む)
(もっと読む)
アムホテリシンB抗真菌療法に関連した毒性を防ぐためのIL−2受容体抗体の使用
本発明は、真菌感染を有する患者を処置する方法に関する。本発明は、患者に、治療有効量のポリエン系抗真菌剤(例えばアムホテリシンB)を、治療有効量のインターロイキン−2(例えばヒトインターロイキン−2受容体のp55サブユニットに結合し、インターロイキン−2がインターロイキン−2受容体に結合するのを阻害するキメラまたはヒト化モノクローナル抗体)と共に投与することを含む。 (もっと読む)
ワクチン
この発明は、IL−13の中和により治療可能な疾患、例えばCOPD、喘息および、花粉症、接触アレルギー、アトピー性皮膚炎などのアトピー性疾患、の治療におけるIL−13ワクチンおよびそれらの使用に関する。この発明のワクチンは、IL−13免疫原と、サポニンおよび少なくとも1つの非メチル化ジヌクレオチドを含む免疫賦活性オリゴヌクレオチドの組合せであるアジュバント組成物とを含む。この発明はさらに、そのような免疫原を含む医薬組成物、医療へのそれらの使用、およびそれらを製造する方法に関する。 (もっと読む)
陽イオン性カルジオリピン類似体およびその使用
本発明は陽イオン性カルジオリピン化合物、並びにそれらをリポソーム調製、遺伝子トランスフェクションなどにおいて合成および使用する方法を提供する。特に、本発明は、ヒトおよび動物の疾患を治療する為に活性な薬剤を送達すること、および/または診断分析における、陽イオン性カルジオリピン類似体を含むリポソーム、陽イオン性カルジオリピン類似体を含む医薬組成物、並びにかかるリポソームおよび組成物の使用方法を提供する。 (もっと読む)
低量の抗体の投与を含む神経障害状態に関連する症状を軽減する方法
本発明は、効果的な量の抗グルタミン酸脱炭酸酵素(抗GAD)抗体を含む医薬品組成物で神経障害状態の症状を軽減する方法及び組成物を提供する。 (もっと読む)
941 - 960 / 1,059
[ Back to top ]

