Fターム[4H006BE51]の内容
有機低分子化合物及びその製造 (186,529) | 反応試剤 (8,106) | SOX2、SO2X2 (111)
Fターム[4H006BE51]に分類される特許
41 - 60 / 111
新規な4−(ジオキサジン−3−イル)スルファモイルピラゾール化合物の製造方法およびその中間体
【課題】4−(ジオキサジン−3−イル)スルファモイルピラゾール化合物の新規な製造方法およびその中間体の提供。
【解決手段】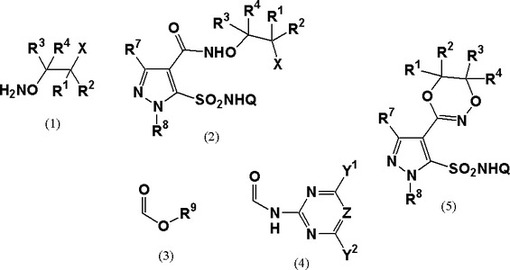
式中、R1、R2、R3、R4はそれぞれ独立して水素、アルキル基等で表される4−(ジオキサジン−3−イル)スルファモイルピラゾール化合物の製造方法。
(もっと読む)
ビスフェノールモノエステル化合物、該化合物を有効成分とする安定剤及び該安定剤を含有する熱可塑性ポリマー組成物
【課題】熱可塑性ポリマーの熱安定性を一層、向上させるための新規な化合物を提供する。
【解決手段】式(1)で表されるビスフェノールモノエステル化合物。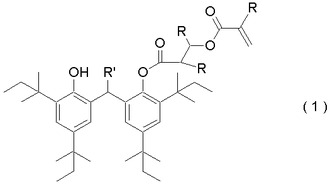
(式(1)中、Rは、それぞれ独立に、水素原子又はメチル基を表し、R’は、炭素数1〜6のアルキル基又は水素原子を表す。)
(もっと読む)
(7−メトキシ−1−ナフチル)アセトニトリル合成のための新規な方法及びアゴメラチンの合成における用途
本発明は、式(I)の化合物の工業的合成方法に関連する。本発明は、アゴメラチンの合成に使用することができる。 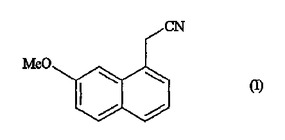 (もっと読む)
(もっと読む)
スルホニウム塩化合物の製造方法
【課題】レジスト用酸発生剤あるいは光カチオン重合開始剤、光ラジカル重合開始剤として有用なスルホニウム塩化合物につき、工業的規模で経済的に実施可能であり、汎用性に優れ、安全かつ安価な製造方法を提供する。
【解決手段】アリールハライド化合物と一般式(2)で表わされる化合物をルイス酸の存在下で反応させ、反応の後処理工程において水で反応を停止し、二層分離した反応混合物から水層を分取し、水層を有機溶剤で抽出処理して副生物を抽出除去し、抽出処理後の水層に塩化合物を添加することでスルホニウム塩化合物を結晶として晶析させ、これを固液分離によって単離することを含む一般式(1)で表わされるスルホニウム塩化合物を製造する方法。一般式(1)
一般式(2)
[Arはアリール残基、XはArに置換したハロゲン、nは1〜7の整数、Zはハロゲン化物のイオン以外のアニオン、Y1、Y2はハロゲン等を表す。]
(もっと読む)
スルホニウム塩開始剤
式(I)[式中、Xは、単結合、CRaRbO、S、NRc、NCORc、CO、SO又はSO2であり;L、L1、L2、L3、L4、L5、L6、L7及びL8は、例えば水素、R1又はCOTであり;Tは、T1又はO−T2を示し;T1及びT2は、例えば水素、C1〜C20アルキル、C3〜C12シクロアルキル、C2〜C20アルケニル、C5〜C12シクロアルケニル、C6〜C14アリール、C3〜C12ヘテロアリール、1つ以上のDで置換されたC1〜C20アルキル、1つ以上のEで中断されたC2〜C20アルキル、1つ以上のDで置換され且つ1つ以上のE又はQで中断されたC2〜C20アルキルであり;R1、R2、R3、R4、Ra、Rb及びRcは、T1であり;Dは、例えばR5、OR5、SR5又はQ1であり;Eは、例えばO、S、COO又はQ2であり;R5及びR6は、例えば水素、C1〜C12アルキル又はフェニルであり;Qは、例えばC6〜C12ビシクロアルキル、C6〜C12ビシクロアルケニル又はC6〜C12トリシクロアルキルであり;Q1は、例えばC6〜C14アリール又はC3〜C12ヘテロアリールであり;Q2は、例えばC6〜C14アリーレン又はC3〜C12ヘテロアリーレンであり;Yは、アニオンであり;及びMは、カチオンであり;但し、L、L1、L2、L3、L4、L5、L6、L7及びL8の内の少なくとも1つは、水素以外であり;並びに、但し、(i)T1又はT2の内の少なくとも1つは、基Qであり;又は(ii)少なくとも1つのDは、基Q1であり;又は(iii)少なくとも1つのEは、基Q2である]の化合物は、光潜在性触媒として適切である。  (もっと読む)
(もっと読む)
ジハロビフェニル化合物の製造方法
【課題】ジハロビフェニル化合物の製造方法を提供すること。
【解決手段】無機塩と式(1)
(式中、Aはアルカリ金属、X1は塩素、臭素又はヨウ素、kは0〜3を、R1は、フッ素、アルキル、アルコキシ、アリール、アリールオキシ、アシル又はシアノを表わす。)
で示されるジハロビフェニル化合物とを含む水溶液と、
(i)炭素数4以上のモノアルコール溶媒もしくは該モノアルコール溶媒と疎水性有機溶媒との混合溶媒、
(ii)水酸基を有さない親水性有機溶媒もしくは該親水性有機溶媒と疎水性有機溶媒との混合溶媒、又は
(iii)水と任意の割合で混合するアルコール溶媒と疎水性有機溶媒との混合溶媒とを混合し、水層と式(1)で示されるジハロビフェニル化合物を含む有機層とを分離する工程を含むことを特徴とするジハロビフェニル化合物の製造方法。
(もっと読む)
E1活性化酵素阻害剤の合成のためのプロセス
E1活性化酵素は、ユビキチン様分子(ubl)結合経路の第1のステップで機能する。したがって、E1活性化酵素を阻害すれば、ubl修飾に伴う下流の生物学的作用を特異的に調節すると思われる。本発明は、E1活性化酵素阻害剤であり、細胞増殖の障害、特にE1活性に関連する癌および他の障害の処置に有用な4−置換((1S,2S,4R)−2−ヒドロキシ−4−{7H−ピロロ[2,3−d]ピリミジン−7−イル}シクロペンチル)メチルスルファマートを合成するためのプロセスおよび合成中間体を提供する。 (もっと読む)
2−ブチル−3−(4−[3−(ジブチルアミノ)プロポキシ]ベンゾイル)−5−ニトロベンゾフラン塩酸塩およびその製造
【課題】ドロネダロンの中間体として有用な4-[3-(ジブチルアミノ)プロポキシ]ベンゾイル誘導体の製造方法の提供。
【解決手段】a)1-ジブチルアミノ-3-クロロプロパンとC1-C4アルキル-p-ヒドロキシベンゾエートとを塩基剤の存在下に反応させて、C1-C4アルキル-4-[3-(ジブチルアミノ)プロポキシ]ベンゾエートを生成させ、b)このようにして得られるエステルを水酸化アルカリ金属の存在下にけん化し、次いで塩酸を用いてこのようにして形成される塩を処理して4-[3-(ジブチルアミノ)プロポキシ]安息香酸塩酸塩を形成させ、c)塩素化剤を用いてこのようにして得られる塩酸塩を処理して所望の化合物を生成させることからなる、4-[3-(ジブチルアミノ)プロポキシ]ベンゾイルクロライド塩酸塩の製造方法。
(もっと読む)
4−(トリクロロメチルチオ)アニリン類およびその製造方法、ならびに4−(トリフルオロメチルチオ)アニリン類の製造方法
【課題】工業的に入手が容易な原料を用い、汎用的な製造設備を用いて、4−(トリフルオロメチルチオ)アニリン類を高収率で製造することができる方法を提供する。
【解決手段】下記一般式(II):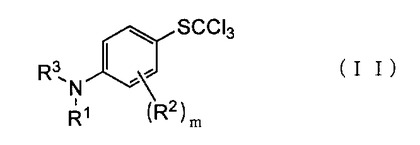
(式中、R1は、水素原子または炭素数1〜3のアルキル基を表わす。R2は、独立して、ハロゲン原子、炭素数1〜3のアルキル基または炭素数1〜3のパーフルオロアルキル基を表わす。R3は、ホルミル基、アセチル基またはトリフルオロアセチル基を表わす。mは、0〜4の整数を表わす。)で示される4−(トリクロロメチルチオ)アニリン類およびその製造方法、ならびに該化合物を用いた4−(トリフルオロメチルチオ)アニリン類の製造方法。
(もっと読む)
アルファ、ベータ−不飽和カルボニルハロゲン化物を形成するプロセス
マイクロリアクター中でα,β−不飽和カルボニルハロゲン化物を形成するプロセスが記述される。この反応物質は、α,β−不飽和カルボン酸、ハロゲン化剤、及び触媒を含む。第1の流入ストリーム、第2の流入ストリーム、及び任意選択の第3の流入ストリームが貫流マイクロリアクターの反応チャンバに流入し、α,β−不飽和カルボニルハロゲン化物を含む反応生成物を生成する。  (もっと読む)
(もっと読む)
2,5−ジメチルアセトフェノン誘導体、2,5−ジメチルアセトフェノン誘導体から得られる2,5−ジメチルフェニル酢酸及びその誘導体の製造方法
【課題】純度が高い2.5−ジメチルアセトフェノン誘導体、2.5−ジメチルアセトフェノン誘導体から得られる2,5−ジメチルフェニル酢酸及びその誘導体を高収率で製造する方法を提供する。
【解決手段】2,5−ジメチルアセトフェノン、硫黄、及びモルホリンを100℃以上、反応系の沸点以下の温度で反応させて2,5−ジメチルフェニルチオアセトモルホリドを製造する。前記温度は、100〜125℃程度であってもよい。前記製造方法において、2,5−ジメチルフェニルチオアセトモルホリドを晶析により単離する工程を含んでいてもよい。また、前記製造方法において、2,5−ジメチルアセトフェノン1モルに対して、硫黄の割合が1〜2モル程度であり、モルホリンの割合が過剰モルであってもよい。
(もっと読む)
酸塩化物の新規合成方法
薬学的に活性な化合物の製造の中間体として有用な式(I)の酸ハロゲン化物の製造方法。 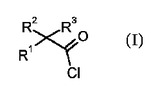 (もっと読む)
(もっと読む)
ガランタミンの製造方法
(−)−ガランタミンの合成における中間体として有用なN−メチル−N−(2−[4−ヒドロキシフェニル]エチル]−5−ヒドロキシ−4−メトキシベンゼンカルボキサミドの新規な製造方法は、5−ヒドロキシ−4−メトキシ安息香酸誘導体とN−メチル−N−(2−[4−ヒドロキシフェニル]エチル)アミンとの反応を含む。 (もっと読む)
含フッ素ジオール化合物の製造方法
【課題】本発明は、簡便かつ効率的に1,1,1−トリフルオロ−2,3−プロパンジオールを製造する方法を提供する。
【解決手段】一般式(2):
(式中、Rfはポリフルオロアルキル基を示す。)
で表されるジオール化合物の製造方法であって、一般式(1):
(式中、R1はアルキル基を示し、Rfは前記に同じ。)
で表される化合物をヒドリド還元剤と反応させることを特徴とする製造方法。
(もっと読む)
光学活性α−フルオロカルボン酸エステルの製造方法
【課題】医農薬および光学材料の重要中間体である光学活性α−フルオロカルボン酸エステルの量産に適した製造方法を提供する。
【解決手段】光学活性α−ヒドロキシカルボン酸エステルを、有機塩基の存在下かつ反応溶媒の非存在下に、スルフリルフルオリド(SO2F2)、トリフルオロメタンスルホニルフルオリド(CF3SO2F)またはノナフルオロブタンスルホニルフルオリド(C4F9SO2F)と反応させることにより、光学活性α−フルオロカルボン酸エステルを製造する。さらに好ましくは、反応終了液に酸を加えて蒸留精製することにより、一層純度の高い光学活性α−フルオロカルボン酸エステルを製造することができる。
この方法により光学活性α−フルオロカルボン酸エステルを大量規模で有利に製造することができる。
(もっと読む)
1−アミノ、3−置換フェニルシクロペンタンカルボン酸エステルの個々の立体異性体の製造および単離方法
本発明は、1−アミノ、3−置換フェニルシクロペンタンカルボン酸エステルの個々の立体異性体の製造および単離方法を開示するものである。 (もっと読む)
イオンチャネルモジュレータ−としてのカルボキサミド誘導体
本教示は、式(I)の化合物を提供する。
式中、Ar、R1、R2、R3、X、pおよびnは、本明細書に定義されている。さらに、本教示は、上述の化合物を製造するプロセス、および上述の化合物を用いて、ある病的な状態または障害を治療する方法、またはその症状を改善する方法を提供する。上述の化合物は、1つ以上の電位依存性カルシウムチャネルの異常な調節状態に関連する種々の状態を治療することを含む、イオンチャネルの活性を調節することに有用な場合がある。
(もっと読む)
ジェットループ型反応器における塩素化されたカルボニル化合物の製造方法
【課題】塩素化された又は部分塩素化されたカルボニル化合物の製造方法であって、従来技術の欠点を克服し、そして高い選択性と生成物純度を伴う廉価な方法となるような方法を提供する。
【解決手段】塩素化された又は部分塩素化されたカルボニル化合物の製造方法において、塩素化されていない又は部分塩素化されたカルボニル化合物と塩素化剤とをジェットループ型反応器中で反応させる。
(もっと読む)
有機スルホン酸クロリドの製造法
【課題】 有機スルホン酸アルカリ金属塩から対応する有機スルホン酸クロリドを高い収率で安定に製造できる方法を提供する。
【解決手段】 本発明の有機スルホン酸クロリドの製造法は、下記式(1)
RSO3M (1)
(式中、Rは炭化水素基、Mはアルカリ金属を示す)
で表される有機スルホン酸アルカリ金属塩に塩化チオニルを反応させて、下記式(2)
RSO2Cl (2)
(式中、Rは前記に同じ)
で表される有機スルホン酸クロリドを製造する方法であって、水分含量0.5重量%以下の式(1)で表される有機スルホン酸アルカリ金属塩を反応に用いることを特徴とする。前記Rは、例えば炭素数3〜20のアルケニル基である。
(もっと読む)
アリールオキシプロピルアミンおよびヘテロアリールオキシプロピルアミンを合成する方法
本発明は、式(II)の適切なアミノアルコールから出発する、式(I)のアリールオキシプロピルアミンおよびヘテロアリールオキシプロピルアミン(式中、Aはアリールもしくはヘテロアリールで、アリールは、好ましくはベンジルならびにトリルから選択される、置換されていてもよいフェニルであり、ならびにヘテロアリールは好ましくはチオフェニルであり;Yはアリール、好ましくはフェニル、置換フェニルまたはナフチルであり、置換フェニルは、好ましくはトリル、トリハロメチルトリルおよびアルコキシトリルから選択される。)を合成する方法に関する。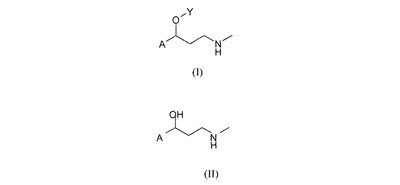
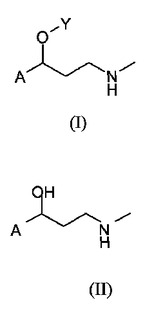 (もっと読む)
(もっと読む)
41 - 60 / 111
[ Back to top ]

