Fターム[4B063QS26]の内容
酵素、微生物を含む測定、試験 (178,766) | 処理,操作 (34,251) | 測定,試験における各種前処理,中間処理 (13,775) | 検出物,試薬等の増量,増幅(←増殖) (8,475) | 酵素的サイクリング (265)
Fターム[4B063QS26]に分類される特許
221 - 240 / 265
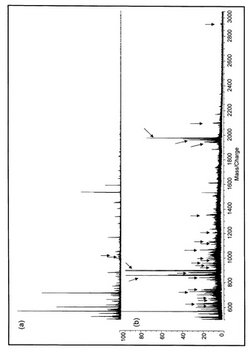
細胞内ヌクレオチドアデニリルに基づく細胞数の検知及び計量のためのATP法、特に無ATP菌の決定のための利用及び方法
【解決手段】本発明は、所与の種の試料液中に存在し得る生きた細胞数の検知及び計量のための反応式(1)ルシフェリン+ATP+O2 +Mg2++ルシフェラーゼ→オキシルシフェリン+光子による生物発光の利用に関するもので、本利用は、所与の非ウィルス種の生きた細胞のATPの形で表される細胞内の自由ヌクレオチドアデニリル(AN)の全含有量の測定が、(i) ATPの添加無しと(ii)既知量のATPの添加後とに行われ、前記族の細胞内の自由なATP、ADP及びAMPの総計が、ミオキナーゼ及びピルビル酸キナーゼによって細胞内自由ADP及びAMPがATPに転換した後、関係式(2)[AN]=[ATP]+[ADP]+[AMP]=Cteにより一定であるという点が利用されることが特徴である。また、ATP法による細胞数の検知及び計量の方法に関する。 (もっと読む)
α−メチルアシル−CoAラセマーゼのための酵素循環に基づくアッセイ
本発明は、α−メチルアシル−CoAラセマーゼ活性をアッセイする方法を提供する。このアッセイでは、α−メチルアシル−CoAラセマーゼを含有するサンプル、またはα−メチルアシル−CoAラセマーゼを含有する疑いのあるサンプルを、(2R)−2−メチルアシル−CoAと接触させる。α−メチルアシルCoAラセマーゼが、サンプル中に存在している場合、(2R)−2−メチルアシルCoAは、(2S)−メチルアシル−CoAに変換される。本方法は、次に、α−メチルアシル−CoAラセマーゼ活性に対応する検出可能なシグナルを発生する、(2S)−メチルアシルCoAとトランス−2,3デヒドロアシル−CoAとの間の循環反応系を利用する。同じ原理に基づく、α−メチルアシル−CoAラセマーゼをアッセイするためのキットもまた、提供される。 (もっと読む)
タンパク質の定量解析方法及びキット
【課題】生体由来試料など非精製の試料についても効果的に用いることができ、且つ、従来のNBS法よりも検出感度及び定量性に優れたタンパク質の網羅的定量解析方法を提供する。
【解決手段】解析すべきタンパク質試料Iと対照タンパク質試料IIとの2種類の状態のタンパク質試料を用意し、タンパク質試料I、IIを、尿素又はグアニジン塩酸塩で可溶化し、可溶化されたタンパク質試料I、IIを、NBSCl(heavy)試薬及びNBSCl(light)試薬を用いてラベル化し、ラベル化タンパク質試料I、IIを混合し、脱塩し、尿素又はグアニジン塩酸塩で再可溶化し、還元・アルキル化し、尿素又はグアニジン塩酸塩の存在下でトリプシン消化し、得られたペプチド混合物を、フェニル基を有する担体により分離し、好ましくは3-CHCA、3H4NBA又は3H4NBAと4-CHCAとの混合物をマトリックスに用いて質量分析する、タンパク質の網羅的定量解析方法。
(もっと読む)
フローインジェクション分析装置およびフローインジェクション分析方法
【課題】 酵素に対する活性制御成分の活性特性を測定することを可能とするフローインジェクション分析装置、フローインジェクション分析方法を提供する。
【解決手段】 本発明は、輸送媒体を送液ポンプから送出し、注入装置により輸送媒体内に試料とカラム内に保持した固定化酵素との反応活性を制御活性制御成分とを交互に注入し、活性制御成分よりも前に注入された試料のピーク高さAと、検出装置により活性制御成分よりも時間的に遅れて注入された試料による固定化酵素との阻害下での反応で与えられるピーク高さBとを検出して阻害率または賦活率を計算し、さらに、その後に注入される試料のピーク高さCを使用して回復率を計算することにより、酵素−活性制御成分の間の生化学的キャラクタリゼーションを行う。
(もっと読む)
スタチンおよびスタチン中間体の合成のための酵素化学的方法
本発明は、新規なアルドラーゼ、前記をコードする核酸、並びに前記の製造および使用方法(β,δ-ジヒドロキシヘプタン酸側鎖を製造する酵素化学的プロセスを含む)、並びにこれら側鎖、例えば[R-(R*,R*)]-2-(4-フルオロフェニル)-b,d-ジヒドロキシ-5-(1-メチルエチル)-3-フェニル-4-(フェニルアミノ)-カルボニル]-1H-ピロール-1-ヘプタン酸(アトルバスタチン、LIPITOR(登録商標))、ロスバスタチン(CRESTOR(登録商標))、フルバスタチン(fluvastatin)(LESCOL(登録商標))、関連化合物および前記の中間体を含む組成物を提供する。  (もっと読む)
(もっと読む)
三価金属媒介均一発光近接アッセイ
(1)高いアッセイシグナル対バックグラウンド比(S/B)および広いアッセイシグナル対バックグラウンド範囲(S−B)を示し;(2)均一系であり;(3)非放射性であり;そして(4)リン酸特異的抗体を必要としない、インビトロのプロテインキナーゼアッセイ技術。このアッセイは、3価の金属イオン(例えばGa3+、Fe3+、Al3+、In3+、Ru3+、Sc3+、Y3+)を、増幅した発光近接アッセイアクセプタービーズまたはドナービーズの表面に、例えば、ニトリロ三酢酸(NTA;カルボキシメチルリジンとも呼ばれる)、イミノ二酢酸(IDA)または適切に置換されたN含有複素環、例えばトリアゾ複素環(例えば1−プロピルアミノ−4−アセタト−1,4,7−トリアザシクロノナンなどのトリアゾシクロノナネオノナン)などの適切なリンカーを媒介として、錯体形成させることを含む。 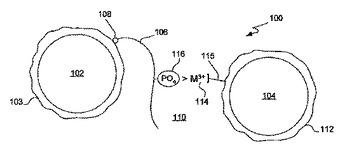 (もっと読む)
(もっと読む)
ベータ−セクレターゼ活性を阻害する二環式化合物およびその使用方法
本発明は、二環式ベータ-セクレターゼ阻害剤、およびアルツハイマー病の治療方法を含む該阻害剤を使用するための方法を提供する。 (もっと読む)
抗生物質不活化性酵素の検出のための装置および方法
微生物がAmpC β-ラクタマーゼを産生するかどうかの判定方法を開示し、該方法においては、β-ラクタム含有抗生物質を不活化するβ-ラクタマーゼを産生する疑いのある微生物の培養物を、有効量のi) β-ラクタム含有抗生物質、ii) AmpC β-ラクタマーゼが耐性であるβ-ラクタマーゼインヒビター、および iii) 非増殖抑制性の微生物易透化量で存在する上記微生物用の易透化剤の各々と混合してアッセイ培養物を調製する。このアッセイ培養物を、適切な培養条件下に且つ上記微生物の上記AmpC β-ラクタマーゼ耐性インヒビターおよび抗菌化合物との相互作用を判定するのに十分な時間維持し、それによってAmpC β-ラクタマーゼの存在を判定し、陽性試験がAmpC β-ラクタマーゼの存在を指示する。  (もっと読む)
(もっと読む)
ハナビラタケの人工栽培方法
【課題】従来のハナビラタケよりβグルカンを多く含み、施設において工業的に、高品質かつ安価に、短期間に効率よく製造することが可能なハナビラタケの新菌株を提供し、さらに、ハナビラタケ子実体、菌糸体レベルでの特定系統の識別を可能とするハナビラタケの系統識別方法を提供する。
【解決手段】 βグルカンを子実体乾燥重量100gあたり48.0g以上含むことを特徴とするハナビラタケであり、好ましくはハナビラタケ(Sparassis crispa)UT−18(FERM P−19768)、ハナビラタケ(Sparassis crispa)UT−21(FERM P−19769)、ハナビラタケ(Sparassis crispa)UT−31(FERM P−19770)及びハナビラタケ(Sparassis crispa)UT−33(FERM P−19771)であるハナビラタケ及び前記菌株を用いたハナビラタケの人工栽培方法。
(もっと読む)
抗HIV治療化合物を同定するための方法および組成物
カルボキシルエステルまたはホスホネートエステル基で置換された抗HIV治療化合物を同定するための方法が提供される。このような化合物のライブラリーが、必要に応じて、新規酵素GS−7340エステルヒドロラーゼを使用してスクリーニングされる。GS−7340エステルヒドロラーゼに関連する組成物および方法がまた提供される。1つの実施形態において、以下:(a)非ヌクレオチドプロトタイプ化合物を同定する工程;(b)該プロトタイプ化合物をホスホネート含有基で置換して、候補化合物を生成する工程;および(c)該候補化合物の抗HIV活性を決定する工程、を包含する、方法が提供される。 (もっと読む)
リアルタイム核酸増幅データから初期核酸濃度を定量化する方法
【課題】リアルタイム核酸増幅データから初期核酸濃度を定量化する方法を提供する。
【解決手段】生物またはウイルスなどから抽出した核酸(DNAまたはRNA)を酵素を利用して増幅した後、背景蛍光信号を除外した最大蛍光信号の強度の半分に該当する増幅サイクル数または増幅時間と、最大増幅効率に該当する増幅サイクル数または増幅時間と、背景蛍光信号を除外した核酸の増幅前蛍光信号の強度とを算出して核酸の初期濃度を求める。これにより、微分/積分方法を使用せずとも核酸の初期濃度を求めることができる。
(もっと読む)
ヒトおよび動物における病原体の迅速な同定方法
本発明は、ヒトおよび動物由来の生物学的サンプル中の病原体を同定する方法、ヒトおよび動物から得られるサンプル中に存在する複数の病原体を分析する方法、病原体についての詳細な遺伝情報または病原体を決定する方法、そして環境的サンプル、臨床的サンプルまたはその他のサンプル由来の生体物質を迅速に検出および同定する方法を提供する。 (もっと読む)
増幅反応分析のためのサンプリング方法および装置
本発明は核酸増幅反応の定量的分析を可能にするサンプリング方法およびサンプリング装置を提供する。増幅レジメン中に蓄積した定量的情報は詳細な増幅プロファイルの開発を可能にし、これは順次、元の鋳型の量の確実な決定を可能にする。開示した方法は、同一の増幅反応および多数の増幅反応の両者において、多数の遺伝子または転写単位の定量的発現分析のために特に有用である。 (もっと読む)
酵素の直接媒介によりサンプル中の分析物の濃度を測定する方法
血液のグルコース含量を、血液サンプルを、補因子としてのPQQ(またはその誘導体または異性体)に依存性のグルコースデヒドロゲナーゼ、テトラゾリウム塩指示薬を含有するが、メディエータを含有しない試験ストリップと、接触させることにより、決定することができる。 (もっと読む)
酵素的なグリコレート−グリオキシレート循環反応によってミエロペルオキシダーゼをアッセイするための方法およびキット
本発明は、ミエロペルオキシダーゼ活性をアッセイするための方法を提供する。このアッセイにおいて、ミエロペルオキシダーゼを含むサンプルまたはミエロペルオキシダーゼを含むことが推定されるサンプルは、セリン、過酸化水素、およびハライド含む基質に接触される。このサンプル中にミエロペルオキシダーゼが存在する場合、セリンは、グリコールアルデヒドに変換され、このグリコールアルデヒドは、グリコールアルデヒド変換酵素(例えば、グリコールアルデヒドデヒドロゲナーゼ)(1.2.1.21)によってさらにグリコレートに変換される。次いでこの方法は、グリコレートとグリオキシレートとの間の循環反応系を利用して、このミエロペルオキシダーゼ活性に対応する検出可能なシグナルをもたらす。同じ原理に基づいてミエロペルオキシダーゼをアッセイするためのキットもまた、提供される。 (もっと読む)
肝線維症の診断方法
本発明は単離されたサンプル内のTIMP-1(メタロプロテイナーゼIの組織阻害剤)、フェリチン、A2M(α‐2‐マクログロブリン)からなる群から選択される少なくとも1つの付加的なパラメーターおよびPI(プロトロンビン指数)の測定、場合により、少なくとも1つの付加的な生化学的または臨床的パラメーターの測定、ならびにこれらのパラメーターの存在または測定レベルに基づき、肝疾患の存在および/または重症度の診断を含む、患者における肝疾患の存在および/または重症度を検出する方法に関する。本方法は肝線維症の治療および段階化をモニタリングするために使用できる。 (もっと読む)
抗体ジスルフィド異性体、その使用及びその分析法
本発明はヒト腫瘍壊死因子アルファ(TNFα)の抗原決定基に特異性を有する抗体のジスルフィド異性体に関する。本発明はまた、その異性体を含む組成物及びその抗体の治療上の使用にも関する。本発明はまた、TNFα抗体ジスルフィド異性体及びTNFα抗体の酸化されたメチオニル形の検出の分析方法にも関する。 (もっと読む)
フォンビルブランド因子切断酵素の特異的基質および活性測定法
本発明は、フォンビルブランド因子切断酵素ADAMTS−13の特異的基質、ならびにそれらを用いるADAMTS−13欠損患者の診断、診断用組成物、およびキットに関する。特に好ましいADAMTS−13基質ポリペプチドは配列表の配列番号:1のアミノ酸1587から始まり、アミノ酸1668で終わるもの、およびアミノ酸1596から始まり、アミノ酸1668で終わる終わるものである。これらのADAMTS−13基質ポリペプチドは基質特異性が強く、定量性にも優れ、組み換え法による製造に適したサイズである。 (もっと読む)
組み合わせた指数関数的および直線的増幅
核酸の感度良い検出および定量のための方法および組成物が提供される。さらに、遺伝子型決定のための方法および組成物が提供される。本発明のプローブにより、一本鎖、二本鎖ポリヌクレオチドおよびピロホスフェート(PPi)に関する標的開始増幅が可能になる。DNA酵素仲介検出法もまた、一本鎖最終産物の検出のために提供される。  (もっと読む)
(もっと読む)
Δ4,5グリクロニダーゼおよびその使用
本発明は、実質的に純粋なΔ4,5グリクロニダーゼを提供する。本発明の1つの実施形態において、実質的に純粋なΔ4,5グリクロニダーゼは、組換え的に産生されたグリクロニダーゼである。組換え発現は、1つの実施形態において発現ベクターにより達成され得る。発現ベクターは、配列番号2(必要に応じてプロモーターと作動可能に連結される)についての核酸であり得る。別の実施形態において、発現ベクターは、配列番号4についての核酸またはこれらの改変体であり得、また必要に応じてプロモーターと作動可能に連結され得る。1つの実施形態において、実質的に純粋なΔ4,5グリクロニダーゼは、発現ベクターを含有する宿主細胞を使用して産生される。別の実施形態において、実質的に純粋なΔ4,5グリクロニダーゼは、合成グリクロニダーゼである。 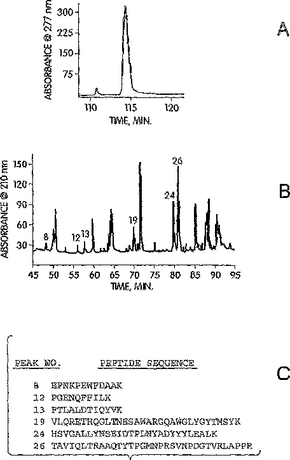 (もっと読む)
(もっと読む)
221 - 240 / 265
[ Back to top ]