Fターム[4B065BA08]の内容
微生物、その培養処理 (127,014) | 微生物の創製、選別 (16,082) | 細胞融合 (936)
Fターム[4B065BA08]の下位に属するFターム
倍数体生成 (7)
Fターム[4B065BA08]に分類される特許
781 - 800 / 929
前立腺癌腫瘍マーカー
本発明は、前立腺肥大症組織の上皮組織片又は上皮細胞で免疫した哺乳動物の免疫細胞と哺乳動物のミエローマ細胞とを融合して得られ、前立腺分泌細胞に対して反応するが間質には反応しないモノクローナル抗体を産生する、ハイブリドーマ又はそれに由来する細胞株に関する。 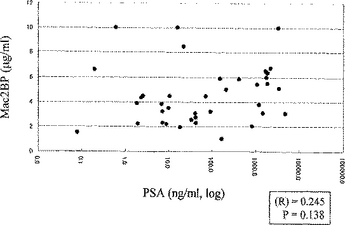 (もっと読む)
(もっと読む)
GANP遺伝子導入トランスジェニック哺乳動物及びその利用
本発明の目的は、各種疾患の診断薬及び治療薬として有効な高親和性抗体、当該抗体を産生するためのトランスジェニック哺乳動物、該高親和性抗体又は高親和性抗体産生細胞を用いた薬剤を提供することである。本発明によれば、GANP遺伝子を導入したトランスジェニック哺乳動物、その子孫又はそれらの一部、並びにそれを用いた高親和性抗体の産生方法が提供される。 (もっと読む)
避妊ターゲット
本発明は概して卵巣特異的遺伝子(O1-180、O1-184およびO1-236)およびそれらがコードするタンパク質に関する。また、生殖組織における細胞増殖性障害または細胞変性障害を検出する方法も提供する。さらにまた本発明は、卵巣特異的遺伝子と相互作用する化合物および/または卵巣特異的遺伝子の発現または活性を調整する化合物のスクリーニング方法も提供する。これらの化合物は避妊薬および/または妊娠薬である可能性がある。 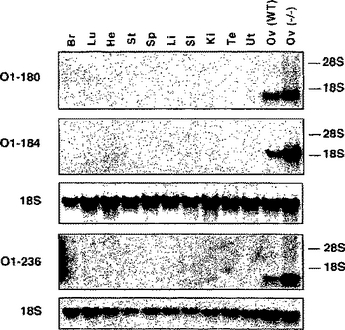 (もっと読む)
(もっと読む)
ニューモリシンに対する結合メンバー
本発明は、ニューモリシンに特異的に結合することができる少なくとも1つの結合ドメインを含む抗−溶血結合メンバー、特に、少なくとも2つの結合ドメインを有する結合メンバー、診断方法における、ならびに治療のための該結合メンバーの使用に関する。好ましい実施形態において、結合メンバーはヒト抗体のような抗体、またはその断片であり、それは二重特異的抗体であってもよい。この結合ドメインは、1×10−6未満であるニューモリシンに対する解離定数Kdを有する。好ましくは、結合ドメインを含む結合メンバーは前記定義の解離定数Kdを有する。 (もっと読む)
インテグリンα−v−β−6に結合する抗体およびその使用方法
本発明は、インテグリンαvβ6に結合するモノクローナル抗体mBLA3および他の等価の抗体を提供する。本発明はまた、癌関連抗原インテグリンαvβ6の種々のヒト癌に関する同定および特徴付け、ならびにこれらのヒト癌の診断方法および処置方法を、提供する。本発明は、インテグリンのβ6サブユニットに結合する抗体およびポリペプチド、ならびにインテグリンのβ6サブユニットに結合するこれらの抗体およびポリペプチドの製造方法および使用方法を提供する。 (もっと読む)
抗ヒトTRAIL受容体DR5モノクローナル抗体(AD5−10)およびその製法と用途
【課題】
本発明は、ヒト腫瘍壊死因子関連アポトーシス誘導リガンド受容体DR5(死受容体5(death receptor 5))の細胞外領域に対するモノクローナル抗体(AD5−10)に関する。また、本発明は、前記モノクローナル抗体の生産方法、および前記モノクローナル抗体の重鎖および軽鎖の可変領域のアミノ酸配列を提供するものであり、また前記モノクローナル抗体を各種癌および/またはAIDS治療の治療薬の生産に使用することを提供する。
(もっと読む)
抗原PIPAおよびそれに結合する抗体
本明細書中には、疾患および癌に関連する抗原PIPAの同定および特長づけに関する開示が提供される。本発明はまた、抗原PIPAに結合するモノクローナル抗体のファミリー、ならびに、PIPAを発現する様々なヒト癌および疾患を診断および処置する方法を提供する。本発明は、病変細胞および/または癌性細胞との反応性を有するモノクローナル抗体(抗PIPA)を作製する方法を提供する。本発明は、PIPが優先的に結合するエピトープと同じPIPA上のエピトープに優先的に結合する調節因子、抗体またはポリペプチド(これは抗体であってもよく、または抗体でなくてもよい)である。 (もっと読む)
βアミロイド誘導Mib遺伝子
【課題】
βアミロイドによりアストログリア細胞で発現が誘導される新規な遺伝子を見出すことであり、さらに該遺伝子がコードするポリペプチドを同定し、該遺伝子および該ポリペプチド等をβアミロイドに関連した神経疾患の診断および治療を目的とする手段として使用すること。
【解決手段】
βアミロイド刺激により発現が誘導される新規遺伝子をcDNAサブトラクション法により取得し、新規ポリヌクレオチド、該ポリヌクレオチドがコードするポリペプチド、該ポリヌクレオチドを含む組換えベクター、該組換えベクターを有する形質転換体、該ポリペプチドに対する抗体、該ポリペプチドの製造法、上記のものを用いた該遺伝子および/または蛋白質の発現を調節する化合物の同定法、該方法で得られる化合物、ならびにこれらを用いたβアミロイドに関連した神経疾患のための医薬組成物、診断方法、診断用キット、治療方法等を提供する。
(もっと読む)
バイオリアクター
【課題】流動床型のバイオリアクターを提供することを課題とする。また、比較的簡易な構造で、連続発酵などの処理ができるバイオリアクター装置を提供することを課題とする。
【解決手段】管体の下方から上方に向かって水流を生じさせる水流発生手段が具備され、且つ前記管体の上方に、生体触媒によって処理された処理液が取り出される取出口が設けられており、該水流発生手段によって生体触媒が流動し被処理液を処理するバイオリアクターであって、前記管体の上方内部には、筒状の隔壁が管体の内周面に対して間隔を空けて設けられており、前記隔壁の下端部が取出口の下方に延出されていることを特徴とするバイオリアクター。
(もっと読む)
AAVベクター組成物および免疫グロブリンの発現の増強のための方法ならびにその使用方法
免疫グロブリン分子またはそのフラグメントの発現のための1つのAAVベクター構築物、およびそれを作製し使用する方法が記載される。AAVベクターには、第1の免疫グロブリンコード配列と第2の免疫グロブリンコード配列との間に自己プロセシング切断配列が含まれており、これによって、1つのプロモーターを使用して機能性の抗体分子を発現することができる。ベクター構築物にはさらに、さらなるタンパク質分解的切断配列が含まれる場合があり、この切断配列は、発現させられた免疫グロブリン分子またはそのフラグメントから自己プロセシングペプチド配列を除去するための手段を提供する。ベクター構築物は、インビトロおよびインビボでの生物学的に活性な免疫グロブリンまたはそのフラグメントの産生の増強において有用性を見出す。 (もっと読む)
痛みのシグナル伝達分子
本発明は概して、最近同定された痛みの感覚に関与するGタンパク質共役受容体(図6B)のファミリーの1つであるヒトMrgDポリペプチドに関する。痛みの感覚を変化させる際にアゴニストおよびアンタゴニストを利用する方法とともに、ヒトMrgDのアゴニストおよびアンタゴニストを同定する特定の方法が提供される。 (もっと読む)
新規な抗IGF−IR抗体及びその使用
本発明は、ヒトインスリン様成長因子I受容体IGF−IRと特異的に結合することができ、且つ/又はそのIGF−IRのチロシンキナーゼ活性を特異的に阻害することができる新規な抗体、特にマウスのモノクローナル抗体、キメラモノクローナル抗体及びヒト化モノクローナル抗体、並びにこれらの抗体をコードするアミノ酸配列及び核酸配列に関する。本発明はまた、IGF−IRを過剰発現する癌又はその受容体の過剰発現に関連した病状の予防的処置及び/又は治療的処置を目的とした薬剤としての、並びにIGF−IRの過剰発現に関連した疾患の診断のための方法又はキットにおけるこれら抗体の使用を含む。本発明は最後に、このような抗体と、抗EGFR抗体、及び/又は抗VEGF抗体、及び/又は腫瘍進行もしくは転移に関与する他の成長因子に対する抗体、及び/又は化合物、及び/又は抗癌剤、又は毒素と共役した物質とを組み合わせて含む、製品及び/又は組成物、並びに特定の癌の予防及び/又は治療のためのその使用に関する。
【配列表】
SEQUENCE LISTING
<110> PIERRE FABRE MEDICAMENT
<120> Novel anti-IGF-IR antibodies and uses thereof
<130> D22514
<140> PCT/IB2005/002619
<141> 2005-07-27
<150> US 60/591 932
<151> 2004-07-29
<150> FR 04/08379
<151> 2004-07-29
<160> 26
<170> PatentIn version 3.1
<210> 1
<211> 16
<212> PRT
<213> Mus musculus
<400> 1
Arg Ser Ser Gln Thr Ile Ile His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 2
<211> 7
<212> PRT
<213> Mus musculus
<400> 2
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 3
<211> 10
<212> PRT
<213> Mus musculus
<400> 3
Phe Gln Gly Ser His Val Pro Tyr Thr Phe
1 5 10
<210> 4
<211> 5
<212> PRT
<213> Mus musculus
<400> 4
Asp Tyr Trp Met Asn
1 5
<210> 5
<211> 17
<212> PRT
<213> Mus musculus
<400> 5
Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe Tyr
1 5 10 15
Asp
<210> 6
<211> 13
<212> PRT
<213> Mus musculus
<400> 6
Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp
1 5 10
<210> 7
<211> 11
<212> PRT
<213> Mus musculus
<400> 7
Lys Ala Ser Gln Asn Val Val Thr Asn Val Ala
1 5 10
<210> 8
<211> 7
<212> PRT
<213> Mus musculus
<400> 8
Ser Ala Ser Tyr Arg Tyr Ser
1 5
<210> 9
<211> 9
<212> PRT
<213> Mus musculus
<400> 9
His Gln Tyr Asn Asn Phe Pro Leu Thr
1 5
<210> 10
<211> 5
<212> PRT
<213> Mus musculus
<400> 10
Glu Tyr Gly Val Ser
1 5
<210> 11
<211> 16
<212> PRT
<213> Mus musculus
<400> 11
Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
<210> 12
<211> 6
<212> PRT
<213> Mus musculus
<400> 12
His Glu Gly Met Asp Tyr
1 5
<210> 13
<211> 11
<212> PRT
<213> Mus musculus
<400> 13
Ile Thr Ser Thr Asp Ile Asp Asp Asp Met Asn
1 5 10
<210> 14
<211> 7
<212> PRT
<213> Mus musculus
<400> 14
Glu Gly Asn Thr Leu Arg Pro
1 5
<210> 15
<211> 9
<212> PRT
<213> Mus musculus
<400> 15
Leu Gln Ser Asp Lys Met Pro Leu Thr
1 5
<210> 16
<211> 5
<212> PRT
<213> Mus musculus
<400> 16
Asn Tyr Ala Met Ser
1 5
<210> 17
<211> 16
<212> PRT
<213> Mus musculus
<400> 17
Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys Gly
1 5 10 15
<210> 18
<211> 9
<212> PRT
<213> Mus musculus
<400> 18
Glu Gly Gly Leu Val Trp Phe Ala Tyr
1 5
<210> 19
<211> 112
<212> PRT
<213> Mus musculus
<400> 19
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Ile Ile His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 20
<211> 123
<212> PRT
<213> Mus musculus
<400> 20
Gln Ala Gln Leu Gln Gln Pro Gly Ala Val Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Ser Tyr Ser Phe Thr Asp Tyr
20 25 30
Trp Met Asn Trp Val Lys Arg Arg Pro Gly Gln Gly Leu Gln Trp Ile
35 40 45
Gly Leu Ile His Pro Ser Asp Ser Glu Thr Arg Leu Asp Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Phe Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Val Ile Tyr Tyr Gly Asn Tyr Arg Trp Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 21
<211> 107
<212> PRT
<213> Mus musculus
<400> 21
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Val Thr Asn
20 25 30
Val Ala Trp Tyr Gln His Lys Pro Gly His Ser Pro Lys Pro Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Tyr Phe Cys His Gln Tyr Asn Asn Phe Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 22
<211> 114
<212> PRT
<213> Mus musculus
<400> 22
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Arg Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 23
<211> 114
<212> PRT
<213> Mus musculus
<400> 23
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Asn Glu Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys His Glu Gly Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
100 105 110
Ser Ser
<210> 24
<211> 107
<212> PRT
<213> Mus musculus
<400> 24
Glu Thr Thr Val Thr Gln Ser Pro Ala Ser Leu Ser Val Ala Thr Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Leu Thr Ile Glu Asn Thr Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Lys Met Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 25
<211> 117
<212> PRT
<213> Mus musculus
<400> 25
Glu Val Asn Leu Val Glu Ser Gly Gly Ile Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Ser Ile Gly Ser Ala Gly Tyr Ile His Tyr Pro Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Arg Asn Ile Leu Tyr Leu
65 70 75 80
Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Glu Gly Gly Leu Val Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 26
<211> 16
<212> PRT
<213> Mus musculus
<400> 26
Val Ile Trp Gly Gly Gly Asp Thr Tyr Tyr His Ser Pro Leu Lys Ser
1 5 10 15
(もっと読む)
インターロイキン−8と相同なポリペプチドとその治療用途
本発明は、IL−8と構造的相同性を有する新規ポリペプチド、及びそれらポリペプチドをコードする核酸分子に関する。また、ここで提供されているのは、それら核酸配列を含むベクター及び宿主細胞、異種ポリペプチドと融合している本発明のポリペプチドを含むキメラポリペプチド分子、本発明のポリペプチドと結合する抗体、及び本発明のポリペプチドを生産する方法に関する。さらに、ここで提供されているのは、炎症性弛緩の治療及び診断のための方法である。 (もっと読む)
サイトカイン受容体
IL-28r及びCRF2−4によりヘテロダイマー受容体複合体を形成するための新規方法が開示される。前記方法は、インビトロ及びインビボでのウィルス感染の検出及び処理のために使用され得る。本発明はまた、タンパク質の形成方法、そのタンパク質の使用及びそのタンパク質に対する抗体も包含する。 (もっと読む)
インターロイキン13受容体α1(IL−13Rα1)に対するモノクローナル抗体
本発明は概してインターロイキン13受容体α1鎖(IL-13Rα1)に結合し、そしてIL-13および/またはIL-4によるIL-13受容体を介したシグナル伝達に拮抗する抗体に関する。さらに特に、本発明は哺乳動物、特にIL-13Rα1に対するヒト化またはヒト抗体を提供する。これらの抗体はIL-13および/またはIL-4介在性の疾患または症状の治療または予防における用途を有する。本発明はさらに対象抗体の投与によりIL-13および/またはIL-4介在性疾患または症状を調節する方法を企図する。本発明はさらにIL-13受容体複合体を介したIL-13および/またはIL-4シグナル伝達を調節する抗体またはその他の作用物質を同定するのに有用なアッセイ系を提供する。従って、IL-13Rα1/リガンド相互作用のモジュレーターをスクリーニングする方法もまた提供される。 (もっと読む)
ローソニアイントラセルラリスの診断方法
本発明は、動物の健康の分野に関し、特にローソニアイントラセルラリスに関する。特に、本発明は、ローソニアイントラセルラリス感染を診断する方法及びローソニアイントラセルラリス特異的抗体を使用する診断試験キットに関する。本発明はまた、ローソニアイントラセルラリス感染を診断するための、前記方法または試験キットの使用に関する。 (もっと読む)
疾患処置におけるMGD−CSFのための組成物およびその使用方法
開示されるのは、本明細書において「単球、顆粒球および樹状細胞コロニー刺激因子」(MGD−CSF)として同定された、新規に同定された分泌型分子、ポリペプチド配列、およびそのポリペプチド配列をコードするポリヌクレオチドである。また、例えば、ベクターおよび宿主細胞を使用する組み換え技術によって、ポリペプチドを産生するためのい手順も提供される。さらに、本発明の開示された新規な分子を改変して融合タンパク質を調製する手順が開示される。また、例えば、ガン、自己免疫疾患および炎症性疾患、感染性疾患、および再発性の流産を含む種々の疾患の処置のためにポリペプチドおよびその活性なフラグメントを用いるための方法も開示される。 (もっと読む)
ヒト人工染色体(HAC)ベクター
本発明は、ヒト人工染色体(HAC)ベクター及びその作製方法に関する。また本発明は、ヒト人工染色体ベクターを用いた外来DNAの導入方法及び外来DNA発現細胞の作製方法に関する。さらに本発明は、タンパク質の製造方法に関する。 (もっと読む)
脳損傷に対するマーカー
新鮮な脳組織を用いた脳損傷に対するマーカーの同定方法、ならびにそれらのマーカーを検出するための方法および組成物を開示する。 (もっと読む)
齲蝕原性細菌に特異的なモノクローナル抗体
放線菌属(Actinomyces)または乳酸桿菌属(Lactobacillus)齲蝕原性細菌に特異的に結合する抗体、ならびにその結合断片および模倣体を提供する。本結合剤、例えば抗体、その断片および模倣体等は、標的細菌に対して高感度でありかつ非常に特異的であることを特徴とする。齲蝕原性細菌の存在に関して試料をスクリーニングするための方法および装置もまた提供する。さらに、治療の処置手順および組成物も提供する。 (もっと読む)
781 - 800 / 929
[ Back to top ]

