Fターム[4C056AE02]の内容
N、O含有複素環式化合物 (21,500) | 複素環の二重結合数(環原子相互間及び環原子と非環原子間のもの) (2,347) | 1 (570)
Fターム[4C056AE02]に分類される特許
141 - 160 / 570
新規二環式抗生物質
式Iで表される化合物(式中、X1、X3;X4及びX6は、互いに独立して、窒素原子又はCR2を表すが、但し、X1、X3;X4及びX6のうちの少なくとも1個は窒素原子を表し;X2は、C−H、C−(C1−C6アルキル)、C−(C1−C6アルコキシ)、C−ハロゲン、C−COOHを表し;X5は、C−H又はC−(C1−C6アルキル)、C−ハロゲンを表し;R1及びR2は、互いに独立して、水素を表すか、又はヒドロキシ、ハロゲン、カルボキシ、アミノ、C1−C6アルキルアミノ、ジ(C1−C6アルキル)アミノ、メルカプト、シアノ、ニトロ、C1−C6アルキル、C1−C6アルコキシ、C1−C6アルキルチオ、C1−C6アルキルアミノカルボニルオキシ、C2−C6アルケニル、C2−C6アルキニル、C1−C6アルキルカルボニルオキシ、C1−C6アルキルスルホニルオキシ、C1−C6ヘテロアルキルカルボニルオキシ、C5−C6ヘテロシクリルカルボニルオキシ、C1−C6ヘテロアルキル、C1−C6ヘテロアルコキシから選択される置換基を表し、ここで、前記ヘテロアルキル、ヘテロアルコキシ基又はヘテロシクリルは、窒素、酸素及び硫黄から選択される1、2又は3個のヘテロ原子を含み、この置換基では、アルキル部分は、非置換であるか、又はハロゲノ、シアノ、ヒドロキシ、C1−C4アルコキシ、C1−C4アルキルカルボニル、C1−C4アルコキシカルボニル、非置換もしくは置換フェノキシもしくはフェニルカルボニル、非置換もしくは置換C5−C6ヘテロシクリルもしくはカルボキシにより更に置換され;A1は、以下の式:−O−(CH2)m−(CH2)−、−S−(CH2)m−(CH2)−又は−(C=O)O−(CH2)m−(CH2)−のうちの1個で表される二価基を表し、前記(CH2)m部分は、場合により、C1−C4アルキル、C2−C4アルケニル、C3−C6シクロアルキル、C3−C6シクロアルキルメチル、モルホリノメチル、ハロゲン、カルボキシ、ヒドロキシ、C1−C4アルコキシ;C1−C4アルコキシC1−C4アルキル、C1−C4アルコキシ(C1−C4アルキレンオキシ)C1−C4アルキル、ベンジルオキシC1−C4アルキル、アミノ、モノ−もしくはジ−(C1−C4アルキル)アミノ又はアシルアミノにより置換され、この置換基では、アルキル部分は、1個以上のフルオロ原子により更に置換されてもよく;mは、0、1又は2であるが、但し、A1の2個の末端原子価(terminal valencies)間の直接鎖(direct chain)における原子数は、少なくとも3であり、この基A1は、末端(CH2)−部分を介してA2に結合し;A2は、C3−C8シクロアルキレン;窒素、酸素及び硫黄から選択される1、2又は3個のヘテロ原子を含む飽和及び不飽和の4〜8員ヘテロシクロジイルから選択され、この基A2は、非置換であるか又は置換されており;R4は、水素又はC1−C4アルキルを表し;A3は、C1−C4アルキレン、C2−C4アルケニレン、>C=O、−C(O)C1−C3アルキレン−、−C(=O)NH−を表すか、又は、炭素原子を介して隣接するNR4−基に結合している−C2H4NH−、−C2H4O−、及び−C2H4S−から選択される基を表し;Gは、アリール又はヘテロアリールを表し、この基は、非置換であるか又は置換されており;nは、0、1又は2である)で表される化合物;又はその薬学的に許容しうる塩、水和物もしくは溶媒和物は、有益な抗菌剤である。 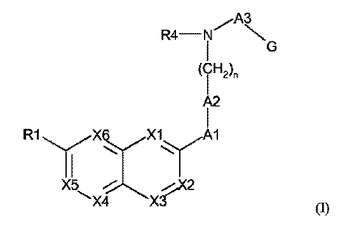 (もっと読む)
(もっと読む)
癌並びに免疫及び自己免疫疾患の治療用アポトーシス誘導剤
抗アポトーシスBcl−2蛋白質の活性を阻害する式(I):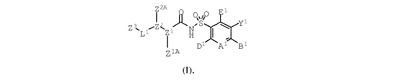
の化合物、前記化合物を含有する組成物及び疾病期間中に抗アポトーシスBcl−2蛋白質が発現される疾病の治療方法を開示する。 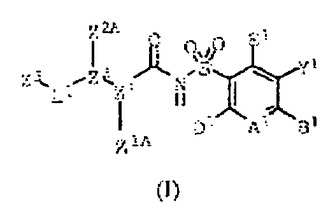 (もっと読む)
(もっと読む)
マクロファージ遊走阻止因子(MIF)を心臓由来心筋抑制因子として含む、処置方法およびバイオアッセイ
【課題】現在治療が利用可能でない、心臓抑制、心機能障害、熱傷関連の罹患率および心臓保護のための治療を提供する。
【解決手段】本発明の1実施形態は、薬学的組成物であって、治療上有効な量の少なくとも1つの抗MIF抗体と;少なくとも1つの薬学的に受容可能なキャリアとを含む、薬学的組成物に関する。本発明の別の実施形態は、薬学的組成物であって、治療上有効な量の少なくとも1つの抗CD74抗体と;少なくとも1つの薬学的に受容可能なキャリアとを含む、薬学的組成物に関する。本発明の別の実施形態は、薬学的組成物であって、治療上有効な量の少なくとも1つの抗TNFR抗体と;治療上有効な量の少なくとも1つの抗MIF抗体と;少なくとも1つの薬学的に受容可能なキャリアとを含む、薬学的組成物に関する。
(もっと読む)
フッ素含有化合物およびその使用法
フッ素化化合物およびフッ素化化合物の製造法が本明細書に記載されている。例えば、フッ素化ベンラファキシン、フッ素化デュロキセチン、フッ素化バレニクリン、フッ素化アトモキセチン、フッ素化セルトラリン、フッ素化トラゾドン、フッ素化ミルタザピン、フッ素化アミトリプチリン、フッ素化アモキサピン、フッ素化クロミプラミン、フッ素化イミプラミン、フッ素化ノルトリプチリン、フッ素化トリミプラミン、フッ素化マプロチリン、フッ素化ネファゾドン、フッ素化シブトラミン、18F置換ブプロピオンなどが提供される。 (もっと読む)
CETP阻害薬
【課題】HDL(高密度リポタンパク質)−コレステロールの上昇、LDL(低密度リポタンパク質)−コレステロールの低下およびアテローム性動脈硬化の治療または予防において有用であるCETP阻害薬の提供。
【解決手段】コレステロールエステル転送タンパク質(CETP)を阻害することから、アテローム性動脈硬化の治療および予防において有用となり得る下記構造を有する化合物又はその化合物の製薬上許容される塩。 (もっと読む)
(もっと読む)
嚢胞性線維症膜コンダクタンス調節因子のモジュレーター
本発明は、ATP−結合カセット(「ABC」)トランスポーターまたはそのフラグメントのモジュレーターに関し、嚢胞性線維症膜コンダクタンス調節因子、その組成物、およびそれを用いた方法を含む。本発明はまた、そのようなCFTRモジュレーターを用いて、疾患を治療する方法に関する。本発明の化合物および薬学的に許容される組成物は、CFTRの変異に伴う様々な疾患、障害、または状態を治療する、またはその重症度を低下させるために有用である。 (もっと読む)
無脊椎動物害虫を駆除するためのイミン化合物
本発明は、無脊椎動物害虫、特に節足動物害虫および線虫を駆除または防除するのに有用なイミン化合物に関する。また本発明は、これらの化合物を使用することにより無脊椎動物害虫を防除する方法、および前記化合物を含む植物増殖材料、ならびに前記化合物を含む農業用および獣医学用組成物に関する。 (もっと読む)
有害動物を駆除するための置換アミジン化合物
本発明は、式(I)の置換アミジン化合物、その鏡像異性体、ジアステレオマー及び塩、並びにそのような化合物を含む組成物に関する。本発明は、有害動物を駆除するための置換アミジン化合物、それらの塩、又はそれらを含む組成物の使用にも関する。さらに、本発明は、そのような置換アミジン化合物を適用する方法にも関する。本発明の置換アミジン化合物は、式(I)によって定義され、式(I)において、A1〜A4、B1〜B3、R1〜R3、(R4)p、(R5)q、X及びYは、明細書の通りに定義される。
【化1】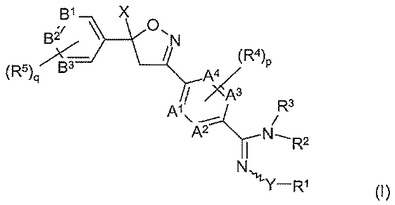 (もっと読む)
(もっと読む)
IXa因子阻害薬としてのモルホリノン化合物
本発明は、本明細書に記載の式(I)の化合物またはそれの製薬上許容される塩もしくは溶媒和物を提供する。本発明はまた、1以上の前記化合物を含む医薬組成物、ならびに血栓症、塞栓症、凝固性亢進または線維性変化を治療もしくは予防することを目的とした前記化合物の使用方法をも提供する。
【化1】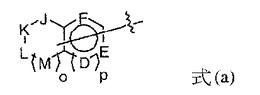
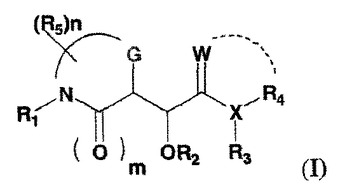 (もっと読む)
(もっと読む)
2,2’−シクロプロピリデン−ビス(オキサゾリン類)の再生方法
本発明は、シリカゲル等の吸着剤に2,2’−シクロプロピリデン−ビス(オキサゾリン類)を選択的に吸着させ、反応混合物から前記吸着剤を単離し、前記吸着剤から適した有機溶媒を用いて2,2’−シクロプロピリデン−ビス(オキサゾリン類)を脱着させ、脱着過程で用いた前記有機溶媒から2,2’−シクロプロピリデン−ビス(オキサゾリン類)を最終的に回収することによって、前記反応混合物から、
例えば立体選択的付加反応に錯体触媒の部分として用いられる、(3aR,3’aR,8aS,8’aS)−2,2’−シクロプロピリデンビス−[3a,8a]−ジヒドロ−8H−インデノ−[l,2−d]−オキサゾール及び(4S,4’S,5R,5’R)−2,2’−シクロプロピル−インデンビス−4,5−ジフェニルジヒドロ−4,5−オキサゾール等のキラル2,2’−シクロプロピリデン−ビス(オキサゾリン類)を再生する方法を提供する。回収した化合物の触媒品質は新たに調製する触媒と変わらない。
(もっと読む)
新規な抗微生物薬
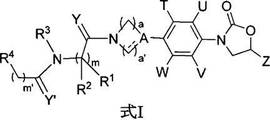
本発明は、式Iの新規なフェニルオキサゾリジノン化合物、その製薬学的に許容される類似体、互変異性型、立体異性体、多形体、プロドラッグ、代謝産物、塩、またはその溶媒和物に係わる。本発明は、式Iの新規な化合物もしくはその製薬学的に許容される類似体、互変異性型、立体異性体、多形体、プロドラッグ、代謝産物、塩、またはその溶媒和物を合成する方法にも係わる。本発明はまた、式Iの新規な化合物を含有する医薬組成物とその使用方法を提供する。本発明の化合物は抗微生物薬として有用であり、Staphylococcus属、Streptococcus属、Enterococcus属、Bacteroides属、Clostridium属の多剤耐性種、インフルエンザ菌、Moraxella属種、結核菌などの抗酸性生物、並びにStaphylococcus属およびEnterococcus属のリネゾリド耐性種など多くの好気性および/または嫌気性グラム陽性および/またはグラム陰性病原菌に対して有効である。 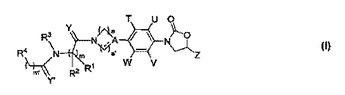 (もっと読む)
(もっと読む)
抗菌オキサゾリジノン、ヒダントインおよびイミダゾリジノン組成物
本出願は、式I: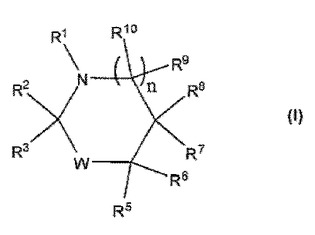
を有するN−クロロ化オキサゾリジノン、ヒダントインおよびイミダゾリジノン化合物、またはその医薬的に許容される塩、および関連する組成物およびそれらの抗微生物剤としての使用方法に関する。 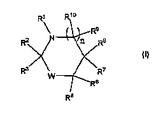 (もっと読む)
(もっと読む)
置換アミドフェノキシベンズアミド
本発明は一般式(I):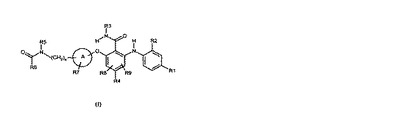
(上式中、A、R1、R2、R3、R4、R5、R6、R7、R8、R9及びnは、特許請求の範囲に規定されるとおりである)の置換アミドフェノキシベンズアミド化合物、上記化合物を含む医薬組成物及びコンビネーション、上記化合物の調製方法、ならびに、上記化合物又は組成物の過剰増殖性疾患及び/又は血管新生性疾患の治療のための単独剤としての、又は、他の活性成分との組み合わせでの使用に関する。
(もっと読む)
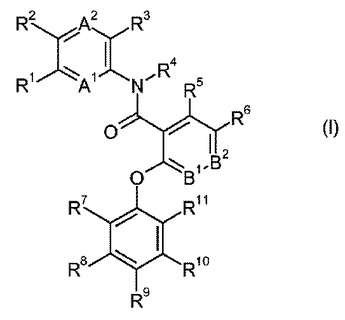
新規フェニルアミドまたはピリジルアミド誘導体、およびGPBAR1アゴニストとしてのそれらの使用
本発明は、式(I)(式中、A1、A2、B1、B2、及びR1〜R11は明細書及び請求項で定義されたとおりである)で示される新規フェニルアミドまたはピリジルアミド誘導体、ならびにその薬学的に許容される塩に関する。これらの化合物は、GPBAR1アゴニストであり、2型糖尿病などの疾患の処置用の医薬として使用することができる。
 (もっと読む)
(もっと読む)
タンパク質イソプレニルトランスフェラーゼの阻害剤
【課題】タンパク質イソプレニルトランスフェラーゼ(例えば、タンパク質ファルネシルトランスフェラーゼおよびタンパク質ゲラニルゲラニルトランスフェラーゼ)の阻害、並びに発癌遺伝子タンパク質Rasおよび他の関連した小さいgタンパク質のファルネシル化またはゲラニルゲラニル化の阻害に有用な新規化合物の提供。
【解決手段】[4-(1-エチルチオ−3−シクロヘキシルプロパ-2-イルアミノメチル)-2-(2-メチルフェニル)ベンゾイル]メチオニンなどの化合物。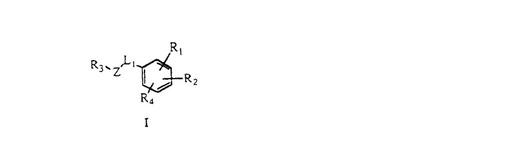 (もっと読む)
(もっと読む)
ヘテロ環置換チオフェノール化合物の製造中間体および製造法
【課題】除草剤の製造中間体並びにその製造法の提供。
【解決手段】下記化合物(4)を(5)から製造する。
(式中、R1は、C1−4アルキル基を表し、R2は、水素原子またはC1−4アルキル基を表し、R3は、水素原子,シアノ基,アミド基,C1−4アルキルカルボニル基またはC1−4アルコキシカルボニル基を表し、R5は、水素原子,シアノ基,C1−4アルキルカルボニル基またはC1−4アルコキシカルボニル基を表し、Qはイソオキサゾリル基等を表す。) (もっと読む)
(もっと読む)
アルケニルオキサゾリン
【課題】貯蔵中及び輸送中に増粘や着色などの変質が起こらず、長期間に安定的に保存でき、且つ重合反応の際の重合性は低下しない、機能性モノマーのアルケニルオキサゾリンを提供する。
【解決手段】アルケニルオキサゾリンに、保存安定剤としてN,N−ジアルキルヒドロキシルアミン及び/又はN,N−ジアリールヒドロキシルアミンを1〜1000ppm含有させる。特に、N,N−ジフェニルヒドロキシルアミンとN,N−ジベンジルヒドロキシルアミンが好ましい。
(もっと読む)
α−トリフルオロメチル−β−置換−β−アミノ酸類の製造方法
【課題】α−トリフルオロメチル−β−置換−β−アミノ酸類の実用的な製造方法を提供する。
【解決手段】α−トリフルオロメチル−β−置換−α,β−不飽和エステル類とヒドロキシルアミンを反応させることによりα−トリフルオロメチル−β−置換−β−アミノ酸脱水素閉環体に変換し、該脱水素閉環体を加水素分解することによりα−トリフルオロメチル−β−置換−β−アミノ酸類を製造することができる。本製造方法では、官能基が保護されていないフリーのアミノ酸である、新規なα−トリフルオロメチル−β−置換−β−アミノ酸類を製造することができ、β位置換基も芳香環基または置換芳香環基に限定されず、α位とβ位の相対的な立体化学も制御することができる。
(もっと読む)
イソキサゾリン置換ベンズアミド化合物及び有害生物防除剤
【課題】新規な有害生物防除剤、特に殺虫剤又は殺ダニ剤を提供する。
【解決手段】一般式(1):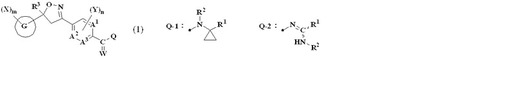
[式中、A1、A2及びA3は各々独立して炭素原子又は窒素原子を表し、Gはベンゼン環等を表し、QはQ-1、Q-2等で表される構造を表し、Wは酸素原子又は硫黄原子を表し、Xはハロゲン原子、C1〜C2ハロアルキル等を表し、Yはハロゲン原子、C1〜C2アルキル等を表し、QがQ-1を表すとき、R1はC1〜C4ハロアルキル、-C(O)N(R13)R12、D-22、D-52等を表し、R2は水素原子、シアノメチル、メトキシメチル、エトキシメチル、-C(O)R15、-C(O)OR16等を表し、QがQ-2を表すとき、R1は-OR1a、-N(R1c)R1b等を表す。]で表されるイソキサゾリン置換ベンズアミド化合物又はその塩、及びそれらを含有する有害生物防除剤。
(もっと読む)
複素環式化合物の製造方法
【課題】工業的規模で実施できる方法であって、改善された空時収量を特徴とし、更に反応混合物からの目的生成物の分離をアミノアルコールの高級同族体の使用によって可能にする方法を提供する。
【解決手段】式(I)の複素環式化合物を、式(II)の芳香族ジニトリルと、式(III)のアミノアルコールとの触媒的反応によって製造するための方法[式中、R1、R2、R3、R4、R5及びR6は、明細書中に記載の意味を有する]において、式(III)のアミノアルコール及び触媒を装入し、式(II)の芳香族ジニトリルを反応温度で計量供給し、その際、反応の間に付加的な溶剤が省かれ、引き続き、反応完了後に過剰のアミノアルコールを、完全にもしくはほぼ完全に、非極性溶剤と置き換え、式(I)の複素環式化合物の量に対して最大20質量%のアミノアルコールの含有率を有する粗生成物を得る方法によって解決される。
(もっと読む)
141 - 160 / 570
[ Back to top ]