Fターム[4B063QS25]の内容
酵素、微生物を含む測定、試験 (178,766) | 処理,操作 (34,251) | 測定,試験における各種前処理,中間処理 (13,775) | 検出物,試薬等の増量,増幅(←増殖) (8,475) | PCR法 (6,886)
Fターム[4B063QS25]に分類される特許
1,981 - 2,000 / 6,886
遺伝子破壊白癬菌
【課題】高頻度での相同組換え(標的遺伝子破壊)が可能な新規白癬菌株を提供する。
【解決手段】白癬菌Trichophyton mentagrophytes TIMM2789株のku80遺伝子ホモログであるTmku80遺伝子を相同組換えによって破壊したTmku80破壊白癬菌#49株(FERM AP-21532)。
(もっと読む)
ヒトパルボウイルスB19核酸の検出のためのアッセイ
【課題】ヒト・パルボウイルスB19ゲノムDNAに特異的な核酸オリゴマーを開示する。生物学的標本中のヒト・パルボウイルスB19核酸を増幅しそして検出するための方法を提供する。
【解決手段】生物学的試料に存在するパルボウイルスB19核酸配列を増幅するためのプライマーおよび該配列を検出するためのプローブ。増幅された配列の部分に特異的にハイブリダイズする配列特異的プローブ。少なくとも2の別個の核酸増幅オリゴマーを含む、ヒト・パルボウイルスから核酸を増幅するための組成物。
(もっと読む)
リボヌクレオチド標識核酸検出
【課題】標的核酸配列の検出のために有用な配列セグメントを有する5’末端を含んで成るポリヌクレオチド、及び標的核酸の検出へのそれらの使用方法を提供する。
【解決手段】ポリヌクレオチドは、1又は複数のリボヌクレオチドの存在下での標的核酸の配列を増幅するために使用される。リボヌクレオチドは、5’末端配列セグメントに対して相補的な、規則的間隔での増幅生成物に組込まれる。組込まれたリボヌクレオチドのすぐ3’側の結合での増幅生成物の分解は、標的核酸の存在又は不在を示す、検出的に明確なフラグメントを生成する。
(もっと読む)
反応における複数の核酸配列の同時検出
本発明は、反応において核酸配列を同時に増幅及び検出するための方法であって、以下の工程、(i)少なくとも一つの核酸分子を含む試料を準備する工程、(ii)少なくとも4つ、好ましくは少なくとも5つ、さらに好ましくは少なくとも6つのプローブを含む、増幅反応を行うための試薬を準備する工程、ここで、(a)各プローブは、核酸配列に特異的であり、(b)少なきとも2つ、好ましくは少なくとも3つのプローブは、同じ標識を有し、そして(c)同じ標識を持つ各プローブの融解温度(Tm)は、同じ標識を持つ他のプローブの融解温度に対して、加熱によりプローブが標的の核酸配列から解離する際には、2℃より大きい差を有し、(iii)反応において核酸配列を増幅する工程、(iv)標識されたプローブがその核酸配列に結合しているか否かを測定することにより増幅された核酸を検出する工程、そして(v)各所与の標識されたプローブが、結合した核酸配列から解離する温度を検出する工程、を含む方法に関する。本発明はまた、このような方法に用いるキットに関する。 (もっと読む)
細胞の脱分化を行う方法
本発明は、少なくとも部分的に分化した細胞の脱分化を行うか、または未分化細胞の多分化能および/または自己複製特性を維持する方法を提供する。この方法は、細胞におけるErrタンパク質、またはその機能的フラグメントの量または活性を増大させることを含む。 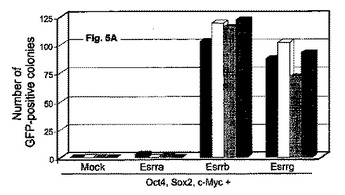 (もっと読む)
(もっと読む)
HLA−DRB1遺伝子を含むヒト遺伝子のアレル多型のタイピング方法及びこれに用いるキット
【課題】 スループットの効率化及びコスト削減を可能とするヒト遺伝子のアレル多型のタイピング方法と、該遺伝子アレル多型のタイピング用キットとを開発すること。
【解決手段】 本発明は、ヒト遺伝子のアレル多型のタイピング方法を提供する。本発明のタイピング方法は、HLA−DRB1遺伝子アレル多型検出用オリゴヌクレオチドプライマーの第1セットと、HLA−DRB1とは異なる他の遺伝子のアレル多型検出用オリゴヌクレオチドプライマーのセットとを含む第1容器と、HLA−DRB1遺伝子のアレル多型検出用遺伝子増幅プライマーの第2セットと、HLA−DRB1及び前記他の遺伝子とは異なる更に別の遺伝子のアレル多型検出用オリゴヌクレオチドプライマーのセットとを含む第2容器とを用意するステップを含む。
(もっと読む)
複数のポリヌクレオチドを用いた製品のラベル方法、ラベリングの同定方法、及び、ラベルされた製品
本発明は、製品をラベルする方法、ラベリングを同定する方法、及び、本発明の方法によってラベルされた製品に関する。本発明に使用されるラベリングは、一本鎖核酸に基づいている。本発明のラベリング方法は、複数の一本鎖ポリヌクレオチドを前記製品の上又は前記製品の中に添加するステップを含み、前記複数のポリヌクレオチドは:所定の長さ及び配列の一本鎖ポリヌクレオチドを含む少なくとも1つの標的ポリヌクレオチド、並びに、同一又は異なる所定の長さ、及び、同一又は異なる所定の配列を有したデコイポリヌクレオチドを含み、前記デコイポリヌクレオチドは、前記少なくとも1つの標的ポリヌクレオチドと同一又は異なる1又は複数の長さ、及び、前記少なくとも1つの標的ポリヌクレオチドの配列とは異なる配列を有し、前記1又は複数の標的ポリヌクレオチド及びデコイポリヌクレオチドのそれぞれは、前記複数のポリヌクレオチドのうちその他のポリヌクレオチドのいずれともハイブリッドを形成しない。本発明の方法によって、例えば、香水、化粧品、衛生品、食品、調味料、1又は複数の植物の抽出物、タバコ、飲料、布地、皮、薬品、粉末剤、ニス、インク、炭化水素、紙、ペンキ、並びに、化学製品及び化合物をラベルすることが可能になる。 (もっと読む)
ざ瘡、脂漏性皮膚炎、または皮脂分泌過多の治療におけるイソバレリルCoAデヒドロゲナーゼの調節剤
本発明は、ざ瘡、脂漏性皮膚炎、または皮脂分泌過多に関連する皮膚障害を予防的または治癒的に治療するための候補化合物をin vitroまたはin vivoでスクリーニングする方法であって、イソバレリルCoAデヒドロゲナーゼの発現または活性を調節する化合物の能力を決定するステップを含む方法に関し、ざ瘡、脂漏性皮膚炎、または皮脂分泌過多に関連する皮膚障害を治療するための、これらの酵素のいずれかの発現または活性に対する調節剤の使用にも関する。本発明は、これらの病変をin vitroで診断またはin vitroで予後診断する方法にも関する。 (もっと読む)
SCA7遺伝子及び使用方法
【課題】運動失調の可能性ある個体を診断するための方法を提供すること。
【解決手段】脊髄小脳性運動失調7型を進展させる危険のある個体を同定するための方法であって、脊髄小脳性運動失調7型遺伝子のCAG反復領域を分析して該CAG反復領域内のCAG反復を検出するステップであって脊髄小脳性運動失調7型を進展させる危険のある個体は前記CAG反復領域内に少なくとも約30のCAG反復を有することを特徴とするステップを含む方法等を提供する。
(もっと読む)
分子多型の検出
【課題】病原性を左右するヘリコバクター・ピロリ由来CagA分子多型を簡便に検出する方法を提供する。
【解決手段】ヘリコバクター・ピロリ由来CagA分子多型を検出する方法であって、繰り返し配列に完全マッチでアニールする部位と不完全マッチでアニールする部位とを有するフォワードプライマー及び対応するリバースプライマーにより遺伝子増幅を行い、増幅核酸のサイズ変化を測定することを特徴とする分子多型検出方法。
(もっと読む)
アクネ、脂漏性皮膚炎または脂漏過多症の処置におけるCIDEAモジュレータ
本発明は、CIDEAタンパク質の発現または活性を調節する化合物の能力の判定を含む、アクネ、脂漏性皮膚炎または脂漏過多症随伴性皮膚障害の予防的または治療的処置のための候補化合物をスクリーニングするためのインビトロまたはインビボの方法に関し、アクネ、脂漏性皮膚炎または脂漏過多症随伴性皮膚障害を処置するためのこのタンパク質の発現または活性モジュレータの使用にも関する。本発明はまた、これら病態のインビトロ診断またはインビトロ予後診断のための方法にも関する。 (もっと読む)
重亜硫酸塩処理の改良された方法
【課題】重亜硫酸塩反応を行って核酸中のメチル化位置、すなわちメチル化および非メチル化シトシンを決定する方法を提供する。
【解決手段】核酸を含む溶液中で核酸を1.5〜3.5時間の間、70〜90℃の間の温度でインキュベートし、ここで溶液中の重亜硫酸塩の濃度が3 M〜6.25 Mの間であり、溶液のpH値が5.0〜6.0の間であり、核酸、すなわち核酸中のシトシン塩基が脱アミノ化される。脱アミノ化された核酸を含む溶液は、次いで脱スルホン酸化される。さらに、特定のpHを有し、重亜硫酸塩を伴う溶液を含むキット。
(もっと読む)
低酸素調節性遺伝子
【課題】低酸素調整性遺伝子を同定する。
【解決手段】低酸素を調節する遺伝子をコードする、精製され、単離されそしてクローン化された、特定の核酸配列、およびそのタンパク質およびタンパク質に対する抗体、が開示される。更に、これら配列のトランスジェニック動物および細胞株ならびにノックアウト生物を提供する。更に、血管形成またはアポトーシスを調節する方法、あるいは治療を必要とする患者において、低酸素状態に対する応答を調節する方法を提供する。また、特定の配列を含む群において示された、少なくとも1つの発現された遺伝子(上向き調節)の遺伝子産物の存在について、患者からの体液または組織試料を分析し、そして上向き調節遺伝子または遺伝子産物が確かめられたなら、虚血と決定する、ステップを包含する、患者における虚血の存在を診断する方法を提供する。
(もっと読む)
高度に単純化された側方流動ベースの核酸サンプル調製および受動的流体流動制御
高度に単純化された側方流動クロマトグラフィ核酸サンプル調製の方法、デバイスおよび統合システムが、効率的な濃度の微量サンプルおよび核酸増幅インヒビタの除去のために提供されている。側方流動デバイスのポリビニルピロリドン処理要素を用いる、核酸増幅反応のインヒビタ、例えば、フミン酸の捕獲および減少のための方法も提供される。さらに、側方流動アッセイでの使用のための受動的流体制御方法およびシステムが提供されている。 (もっと読む)
大腸菌群に属する細菌の検出方法
【課題】多種の大腸菌群についてより迅速に検出する方法を提供する。
【解決手段】大腸菌群に属する細菌が有するlacZ遺伝子をコードする核酸配列中に含まれる下記配列(A)から(E)からなる群より選ばれる1種または2種以上の核酸配列を、試料中から検出して、大腸菌群に属する細菌を検出する。(A)特定の核酸配列1またはこれと相補的な核酸配列に含まれる連続した20bp以上の核酸配列。(B)特定の核酸配列2またはこれと相補的な核酸配列に含まれる連続した20bp以上の核酸配列。(C)特定の核酸配列3またはこれと相補的な核酸配列に含まれる連続した20bp以上の核酸配列。(D)特定の核酸配列4またはこれと相補的な核酸配列に含まれる連続した20bp以上の核酸配列。および(E)特定の核酸配列5またはこれと相補的な核酸配列に含まれる連続した20bp以上の核酸配列。
(もっと読む)
二本鎖RNAを用いた害虫駆除剤
【課題】本発明は、害虫を特異的に駆除することが可能な、RNA干渉を利用した害虫駆除剤を提供することを目的とする。
【解決手段】特定の標的遺伝子の全部又は一部と相補的な塩基配列を含むセンス鎖、及び前記センス鎖と相補的な配列からなるアンチセンス鎖からなる二本鎖RNAであり、前記標的遺伝子に対してRNA干渉を有する二本鎖RNAを含有し、前記標的遺伝子が害虫に含まれるものである害虫駆除剤を提供する。
(もっと読む)
ざ瘡、脂漏性皮膚炎、または皮脂分泌過多の治療におけるアセチルCoAアシルトランスフェラーゼ1またはアセチルCoAアシルトランスフェラーゼ2の調節剤
本発明は、ざ瘡、脂漏性皮膚炎、または皮脂分泌過多に関連する皮膚障害を予防的または治癒的に治療するための候補化合物をin vitroでスクリーニングする方法であって、アセチルCoAアシルトランスフェラーゼ1(ACAA1)またはアセチルCoAアシルトランスフェラーゼ2(ACAA2)の発現または活性を調節する化合物の能力を決定するステップを含む方法に関し、ざ瘡、脂漏性皮膚炎、または皮脂分泌過多に関連する皮膚障害を治療するための、これらの酵素のいずれかの発現または活性に対する調節剤の使用にも関する。本発明は、これらの病変をin vitroで診断またはin vitroで予後診断する方法にも関する。 (もっと読む)
DNAに基づくプロファイリングアッセイのための物質及び方法
【課題】
【解決手段】
本発明は、以下の工程:分析される試料を提供すること、少なくとも20個の遺伝子座の同時ポリメラーゼ連鎖反応増幅に必要である、試薬、酵素、及びプライマーオリゴヌクレオチドを提供すること、前記遺伝子座を増幅すること、増幅産物を検出すること、を含む、DNAプロファイリングアッセイ法であって、前記増幅産物、及び増幅される前記遺伝子座が、以下の特徴によって特徴付けられる方法:増幅される各遺伝子座は、母集団に存在することが知られる少なくとも1つの欠失-挿入多型によって特徴づけられ、各遺伝子座からの2つの対立遺伝子は、その大きさにおいて2ヌクレオチド超かつ100ヌクレオチド未満だけ異なること、少なくとも2つの異なる遺伝子座から生じ、かつ大きさが約20ヌクレオチドから約300ヌクレオチドの範囲にある、少なくとも2つの増幅産物の第一のセットは、第一の標識を有すること、少なくとも2つの異なる遺伝子座から生じ、かつ大きさが約20ヌクレオチドから約300ヌクレオチドの範囲にある、少なくとも2つの増幅産物の第二のセットは、第二の標識を有すること、少なくとも2つの異なる遺伝子座から生じ、かつ大きさが約20ヌクレオチドから約300ヌクレオチドの範囲にある、少なくとも2つの増幅産物の第三のセットは、第三の標識を有すること、標識1、標識2、及び標識3は、例えば、DNA配列決定装置と組合せたマルチカラー検出器によって区別され、かつ同時に検出され得る、それぞれ異なる蛍光標識であること、に関する。
(もっと読む)
骨吸収調節剤
【課題】副作用の少ない新規の骨吸収抑制剤・破骨細胞分化抑制剤・骨増成促進剤を提供すること、および、改善された破骨細胞の分化程度を検出するためのマーカーを提供することを、本発明の課題とする。
【解決手段】上記課題は、NHA2が優れた破骨細胞の分化程度を検出するためのマーカーであり、そして、NHA2の発現および/または機能を抑制することによって、破骨細胞の分化を抑制し、その結果、骨吸収活性が抑制されることを見出すことによって、解決された。
本発明に従って、骨吸収抑制剤および破骨細胞分化抑制剤が提供される。さらに、本発明に従って、破骨細胞の分化程度を検出するためのマーカー、ならびに、骨吸収抑制剤および/または骨増成促進剤をスクリーニングするためのキットおよび骨吸収抑制剤および/または骨増成促進剤をスクリーニングするための方法が提供される。
(もっと読む)
真珠貝の貝殻、真珠の色調を制御する遺伝子とそのタンパク質
【課題】貝殻、真珠の色に関与する遺伝子などについての情報を飛躍的に増大することによって、真珠養殖の効率化と改善に資する。
【解決手段】アコヤ貝外套膜cDNAの網羅的な解析(EST解析)と、TOF-MSによるタンパク質の同定、という二つのアプローチにより、真珠および貝殻の色調の制御に関係する遺伝子の同定を効率的に行った。その結果、外套膜において特異的に発現する2種類のチロシナーゼ遺伝子を同定した。
(もっと読む)
1,981 - 2,000 / 6,886
[ Back to top ]



