Fターム[4H045EA30]の内容
Fターム[4H045EA30]に分類される特許
41 - 60 / 209
サブユニットを殆ど含まない糖タンパク質組成物及びその製造方法
本発明は、サブユニットを殆ど含まない糖タンパク質組成物をを提供する。本発明はまた、その製造方法を提供する。 (もっと読む)
GLP−1ペプチドまたはその類似体をコードし、分泌する、封入された細胞を用いた、急性心筋梗塞(AMI)の処置
本願は、GLP−1、そのフラグメントまたはバリアント、あるいはGLP−1、そのフラグメントまたはバリアントを含んでいる融合ペプチドをコードし、分泌する細胞、例えば、間葉系の幹細胞または間葉系の間質細胞あるいは任意のさらなる適切な細胞の、急性心筋梗塞(AMIまたはMI)の処置のための、使用に関する。このGLP−1、そのフラグメントまたはバリアント、あるいはGLP−1、そのフラグメントまたはバリアントを含んでいる融合ペプチドをコードし、分泌する細胞は、処置される患者の免疫系の応答を防止するように、(球状の)マイクロカプセルに封入されている。また、本願は、これらの(球状の)マイクロカプセル、またはこれらの細胞もしくは(球状の)マイクロカプセルを含んでいる薬学的組成物の、急性心筋梗塞(AMIまたはMI)の処置のための使用にも関する。 (もっと読む)
N末端において修飾されたグルコース依存性インスリン分泌刺激ポリペプチド(GIP)のアナログ
グルコース依存性インスリン分泌刺激ポリペプチドのアナログの新規の系列、前記化合物を含む医薬組成物、ならびにGIP受容体に仲介される病気、例えばインスリン非依存性糖尿病および肥満の治療のためのGIP受容体作動薬または拮抗薬としての前記化合物の使用を提供する。 (もっと読む)
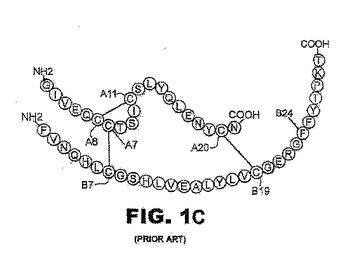
ハロゲン安定化インスリン
インスリン類似体は、B24位、B25位またはB26位にてハロゲン化フェニルアラニンが組み込まれたB鎖ポリペプチドを含む。ハロゲン化フェニルアラニンは、オルト−モノフルオロ−フェニルアラニン、オルト−モノブロモ−フェニルアラニンまたはオルト−モノクロロ−フェニルアラニンであってよい。類似体は、ヒトインスリンのような哺乳動物インスリンのものであってよい。核酸は、このようなインスリン類似体をコードする。ハロゲン化インスリン類似体は、著しい活性を保持する。患者を治療する方法は、生理的有効量のインスリン類似体またはその生理的に許容される塩を患者に投与することを含む。インスリンのハロゲン置換に基づく安定化は、冷蔵のない開発途上の地域における真性糖尿病の治療を向上させ得る。
 (もっと読む)
(もっと読む)
ポリエチレングリコール−GRF結合体の部位特異的調製方法
【課題】ペプチド又は蛋白質へのPEGの結合は、一般に1以上のアミノ酸残基へのPEGの非特異的結合を生ずる。従って、この方法の重要な問題点の一つは特定のアミノ酸残基にPEG分子を共有結合させる適当な化学的方法を見いだすことである。
【解決手段】方法は、hGRFペプチド及び活性化PEG間の結合反応が溶液中に実施され、所望のhGRF−PEG結合体がクロマトグラフィーにより精製できることを特徴とする、Lys12及び/又はLys21及び/又はNαに共有結合した1またはそれ以上のPEG単位(hGRF当たり)を含むhGRF−PEG結合体の部位特異的調製方法について記載される。本法により調製された結合体、及び成長ホルモン欠失の治療、予防又は診断へのその使用も本発明の目的である。
(もっと読む)
ペプチド−ポリマー共役体
本発明は、ポリマー部分とインターフェロン部分、エリスロポエチン部分、または成長ホルモン部分との共役体に関する。 (もっと読む)
修飾サイトカインの精製
本発明は、修飾サイトカインの効率的な精製方法を提供する。そのプロセスは、望ましいサイトカインの精製のためにクロマトグラフィー技術を使用することを含む。その精製サイトカインを、治療組成物として使用し得る。本発明の局面は、ダルベポエチンのアイソフォームを単離するためのプロセスを提供する。実施態様において、そのプロセスを、ダルベポエチンの低pIアイソフォームの単離のために使用する。特定の実施態様において、そのプロセスを、約4.5またはそれより低いpIのアイソフォームの単離のために使用する。 (もっと読む)
豚のαS1カゼイン遺伝子、そのプロモーター、及びその用途
本発明は、豚αS1カゼイン遺伝子、豚αS1カゼイン遺伝子プロモーター、及び上記プロモーターを用いた発現ベクター、上記発現ベクターを用いた目的たんぱく質の製造方法を提供する。本発明のプロモーターは、目的たんぱく質の乳線特異的発現を促進するので、本発明のプロモーターを用いて形質転換された動物は乳汁の中に目的たんぱく質を高濃度で分泌するようになって有用たんぱく質の生産に有利に使用できるという長所を有する。 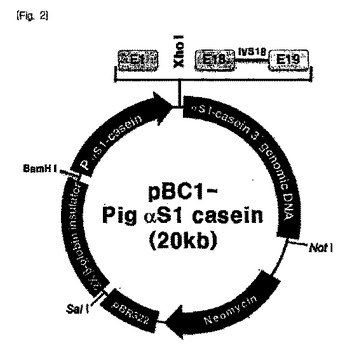 (もっと読む)
(もっと読む)
インシュリンの再折りたたみ方法
本発明は、システイン架橋が正確に結合したインシュリン前駆体、そのアナログまたは誘導体を入手する方法に関する。本方法は、システインまたは塩酸システインおよび1つ以上のカオトロピズム促進剤を含む水溶液または緩衝液にインシュリン前駆体、インシュリンアナログまたは誘導体を可溶化する工程を含む。可溶化させた混合物に希釈剤を添加すること(リバース希釈)によって、前記可溶化された前駆体は再び折り畳まれる。さらにまた、可溶化された前駆体(前駆体濃度は0.65g/リットルよりも高い)の再折畳みは、場合によって約5−40%(v/v)の1つ以上のアルコール性溶媒または非プロトン性溶媒を含む希釈剤で反応混合物を希釈することによってもまた実施することができる。 (もっと読む)
成長因子−模倣(mimicking)ペプチド及びその用途
本発明は、成長因子活性を示す成長因子−模倣ペプチド、これを含む皮膚状態改善または創傷治療用組成物及び皮膚状態改善または創傷治療方法に関する。本発明の成長因子−模倣ペプチドは、天然のヒト成長因子と同一な機能または作用をすることができ、安定性が天然成長因子と比較して非常に優れており、皮膚透過度に非常に優れている。したがって、本発明のペプチドを含む組成物は、成長因子の活性が要求される疾患または状態を治療、予防または改善するのに非常に優れた効能を発揮する。また、本発明のペプチドの優れた活性及び安定性は、医薬、医薬外品及び化粧品に非常に有利に適用できる。 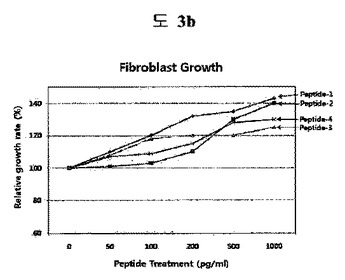 (もっと読む)
(もっと読む)
二本鎖ポリエチレングリコール化成長ホルモン、その製造方法およびその使用
本発明は、生物活性の高い、二本鎖PEGでシングルサイトに修飾された成長ホルモンの製造方法、調製物、及び、治療に成長ホルモンを必要とする医薬品分野への使用を提供する。本発明の著しい特徴は、優れている反応条件と単離方法で、PEGでシングルサイトに修飾された細胞学的活性の低い成長ホルモンの含有量を顕著に減少させたことであって、細胞学的活性の低い成長ホルモンは、適当な濃度の単離ゲルで細胞学的活性の高いシングルサイト修飾成長ホルモンから完全に分離して二つのバンドを呈し、その見かけ分子量は細胞学的活性の高いシングルサイト修飾成長ホルモンよりも大きい。組み換えヒト成長ホルモンに比べて、二本鎖PEGでシングルサイトに修飾された細胞学的活性の高い成長ホルモンは、体内生物活性を上昇させ、薬理学的な長期性という特徴を有し、薬物代謝半減期を延長した。 (もっと読む)
IGF−1の結晶化
【課題】IGF−1の結晶とその生産方法、さらにIGF−1間接アゴニストを同定する方法を提供する。
【解決手段】IGF−1を含む水溶液を、沈殿剤を含むリザーバ液と混合し、生成した混合物を結晶化、場合によっては再結晶化を行い分離する、IGF−1の結晶化方法。さらに、結合タンパク質IGFBP−1又はIGFBP−3のIGF−1に対する結合の阻害レベルのスタンダードとして、界面活性剤を使用し、また構造に基づく薬剤設計のため、間接アゴニストの候補が結合するIGF−1の結合ポケットの座標を使用して、IGF−1間接アゴニストを同定する方法。
(もっと読む)
甲状腺刺激ホルモン融合タンパク質
本発明者らは、TSHαおよび/またはTSHβを含むTSH融合タンパク質ならびにTSHアゴニストおよびTSHアンタゴニストの投与が有効であろう疾患を治療するための方法を開示する。  (もっと読む)
(もっと読む)
ペプチド含有摂食調節剤
【課題】摂食調節能を有する医薬品、医薬部外品、食品添加物及び機能性食品等に広く利用できるMCHもしくはその酵素分解物を提供すること。
【解決手段】魚類および哺乳類のMCHあるいはその酵素分解物として、摂食調節ペプチドを得る。また、得られた物質は生体内生理活性物質であるため、安全面にも優れており、広範な用途に利用できる。
(もっと読む)
エステルに基づいたペプチドプロドラッグ
生体活性ポリペプチドのプロドラッグ製剤が提供され、ここで生体活性ポリペプチドは、ジペプチドの、エステル結合を介した生体活性ポリペプチドへの結合により修飾されている。本明細書に開示されているプロドラッグは、幾つかの実施態様において、少なくとも1.5時間(例えば、少なくとも10時間)、より典型的には20時間を超えて70時間未満の延長された半減期を有し、化学不安定性により駆動される非酵素反応により、生理学的条件下で活性形態に変換される。 (もっと読む)
メラノコルチン−4受容体に対するモノクローナル抗体およびその結合断片と、悪液質および関連病状および疾患の治療におけるそれらの使用
ヒトメラノコルチン−4受容体に対する、モノクローナル抗体、結合断片、およびその誘導体、ならびにこれらを含む医薬組成物、およびこのようなモノクローナル抗体、結合断片、誘導体、および医薬組成物を使用して、悪液質および関連病状および疾患を治療する方法を含む、治療上の使用が開示される。 (もっと読む)
GLP−1アナログの半組換え調製
組換え発現技術と化学的ペプチド合成法を組み合わせた非タンパク新生アミノ酸をN末端部に有するGLP−1アナログ及び誘導体の生産の半組換え方法が開示される。 (もっと読む)
ニュートロカインα
【課題】特定の配列より成る新規サイトカインに少なくとも95%同一のポリヌクレオチドを含む、単離された核酸分子を提供する。
【解決手段】(a)完全なアミノ酸配列を有するニュートロカインαポリペプチドをコードする配列(b)1996年10月22日のATCC寄託に含まれるcDNAクローンによってコードされる完全なアミノ酸配列を有するニュートロカインαをコードする配列(c)ニュートロカインαポリペプチド細胞外ドメインをコードする配列(d)ニュートロカインαポリペプチド膜貫通ドメインをコードする配列(e)ニュートロカインαポリペプチド細胞内ドメインをコードする配列(f)膜貫通ドメインを欠除する溶解性ニュートロカインαポリペプチドをコードする配列、及び(g)(a)、(b)、(c)、(d)、(e)、または(f)の任意の配列に相補的な配列。
(もっと読む)
固相及び溶液相の組み合わせ技術を使用したインシュリン分泌性ペプチド合成
本発明は、固相及び溶液相(「ハイブリッド」)アプローチを使用して合成されるインシュリン分泌性ペプチドの調製に関する。一般的に、アプローチは、固相化学を使用して3つの異なるペプチド中間体フラグメントを合成することを含む。溶液相化学を次に使用して、追加のアミノ酸材料を第3のフラグメントに加えて、それを次に第2のフラグメントに、そして次に第1のフラグメントに溶液中で結合させる。あるいは、異なる第2のフラグメントを、第1のフラグメントに固相中で結合させる。次に、溶液相化学を次に使用して、追加のアミノ酸材料を異なる第3のフラグメントに加える。後に、この異なる第3のフラグメントを、結合した第1の及び異なる第2のフラグメントに溶液相中で結合させる。フラグメントの1つにおける疑似プロリンの使用によって、そのフラグメントの固相合成が容易になり、また、このフラグメントの他のフラグメントへの後の溶液相結合が容易になる。本発明は、インシュリン分泌性ペプチド、例えばGLP−1(7−36)並びにその天然及び非天然対応物などを形成するために非常に有用である。 (もっと読む)
新規な非選択的ソマトスタチン類似体
本発明は、添付の本明細書に報告されている、ソマトスタチンの非選択的機能性類似体である、式(I)の新規なシクロペプチド類に関する。  (もっと読む)
(もっと読む)
41 - 60 / 209
[ Back to top ]