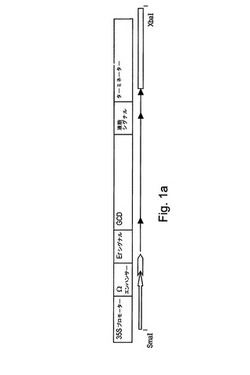
Fターム[4H045GA21]の内容
Fターム[4H045GA21]の下位に属するFターム
ゲルクロマトグラフィー (346)
イオン交換クロマトグラフィー (616)
ヒドロキシアパタイトクロマトグラフィー (66)
逆相クロマトグラフィー (501)
アフィニティークロマトグラフィー (2,012)
Fターム[4H045GA21]に分類される特許
41 - 60 / 615
VEGF結合タンパク質素子
【課題】血管内皮細胞増殖因子検出に有用な血管内皮細胞増殖因子結合タンパク質を提供する。
【解決手段】血管内皮細胞増殖因子受容体1のイムノグロブリンドメイン2と膜貫通領域とを融合させたタンパク質。
(もっと読む)
高温安定性酸素担体を含む医薬組成物の製造方法およびその使用
哺乳類における使用に適切な高効率な酸素送達を有し、腎障害および血管収縮の原因とはならない、高温安定性で高精製された架橋化(任意に≧70%β−β架橋化された)された四量体ヘモグロビンが提供される。ヘモグロビンの二量体形態は変性され、精製プロセスが全血からの赤血球において行われる。瞬間細胞溶解装置における制御された低張溶解は白血球の溶解を防止する。白血球からの核酸およびリン脂質不純物は検出されない。スルフヒドリル試薬による反応性スルフヒドリル基の阻害は、酸素化環境において行われる。流液カラムクロマトグラフィは異なる血漿タンパク質不純物を除去する。N−アセチルシステインが架橋四量体ヘモグロビンに対して添加され、低濃度のメトヘモグロビンが維持される。安定化されたヘモグロビンは、アルミニウム上包装を有する注入バッグ中に保存され、酸素の侵入によるメトヘモグロビンの形成を防止する。生成物は組織酸素化および癌治療における使用を提供する。 (もっと読む)
生産性および不凍活性を向上させた改変型不凍タンパク質とその製造方法
【課題】必要十分な氷結晶成長抑制能を有し、DNA組換え発現による大量生産を可能とする優れた生産性を有する改良型不凍タンパク質を提供する。
【解決手段】SP型不凍タンパク質のアミノ酸配列において氷結晶結合に関与するアミノ酸残基の1または複数が、QAE型不凍タンパク質のアミノ酸配列において該アミノ酸残基の1または複数に相対的に対応する位置にある、氷結晶結合に関与するアミノ酸残基の1または複数で置換されてなる、改変型不凍タンパク質。
(もっと読む)
骨芽細胞増殖促進活性を有するペプチドおよびその利用
【課題】骨芽細胞増殖促進活性を有する新規なペプチドおよびこれを含有する骨形成促進用医薬を提供するとともに、当該ペプチドを利用する優れた用途を提供する。
【解決手段】Ala−Glu−Serで表わされるアミノ酸配列からなるペプチド、特定のアミノ酸配列を含み、骨芽細胞増殖促進活性を有するペプチド、またはそれらの薬学的に許容される塩。当該ペプチドのスレオニン残基、アスパラギン残基およびセリン残基から選ばれる少なくとも1つのアミノ酸残基の側鎖には単糖または糖鎖が結合していてもよい。当該ペプチドは骨形成促進用医薬の有効成分として有用である。
(もっと読む)
第IX凝固因子などのビタミンK依存性タンパク質の精製方法
成長因子タンパク質の精製方法
低赤血球溶解性の抗微生物ペプチド、医薬組成物およびその使用
植物培養における高マンノースタンパク質の製造
【課題】
リソソーム蓄積疾患の処置のための組成物を提供する。
【解決手段】
有効成分としての、高マンノース組み換えタンパク質を発現する植物細胞、及び医薬的に許容され得るキャリアを含む医薬組成物。
(もっと読む)
β−ラクタム系抗菌薬の活性を増強する橋かけ型リポ糖ペプチド関連出願の相互参照該当なし
免疫グロブリン溶液を精製するための方法
本明細書では、発酵の直後または、一つもしくは複数の予備的精製工程、例えばプロテインAアフィニティクロマトグラフィーの後のどちらかにおいて、細胞培養上澄み液を精製するための方法を報告する。酸のpH値の範囲を調節すること及びそれに続く酸性化された溶液のインキュベーションによって、宿主細胞核酸及び宿主細胞タンパク質が沈殿され得るが、標的ポリペプチドは、溶液にとどまる。その後沈殿として、混入した宿主細胞成分が簡単な物理的分離工程によって除去されうる。
 (もっと読む)
(もっと読む)
抗菌剤として有用なペプチド化合物
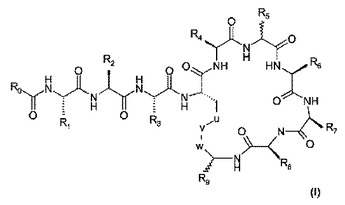
本発明は、抗菌剤として使用することができるペプチド化合物に関し、これらの化合物は式(I)を有す:式中、R0は分岐(C8−C11)アルキル、CH3−(CH2)m−、CH3−O−(CH2CH2O)2CH2−またはフェニル−(CH2)x−であり;m=6〜10;x=1〜3;R1、R3、R4、R7およびR8は、式GF−(CH2)n−(ここで、n=1〜4;GF=−NH2または−NH−C(=NH)−NH2である)から独立に選択され;R2は、−CH(CH3)(OH)、−CH(CH3)2、−CH2NH2または−CH2OHであり;R5およびR6は、H、直鎖または分岐−(C1−C4)アルキル、−(CH2)−R10、−CH2−CH2−S−CH3および−CH−(CH3)−OHから独立に選択され;R9は、CONH2、−CH(CH3)(OH)またはCONHR11であり;R10は、フェニル、3−インドリル、4−イミダゾリル、4−ヒドロキシフェニル、αもしくはβ−ナフチル、または2−、3−もしくは4−ピリジルであり;R11は、特定のペプチド配列であり;uは、CH2またはSであり;vは、NHまたはSであり;wはCH2またはCOであり、ただし、R9がCONH2の場合、(a)R5またはR6は−CH(CH3)(OH)であるか、または(b)R5およびR6はHであるか;または(c)R9と結合したCの配置はS型であるか、または(d)R5と結合したCの配置はR型であり;また、R9が−CH(CH3)OHである場合、R8はGF(CH2)n(ここで、nは3であり、GFは−NH−C(=NH)−NH2である)であり、かつ、R7はGF(CH2)n(ここで、nは2であり、GFはNH2である)である。これらの化合物は、細菌感染の処置に有用であることが分かった。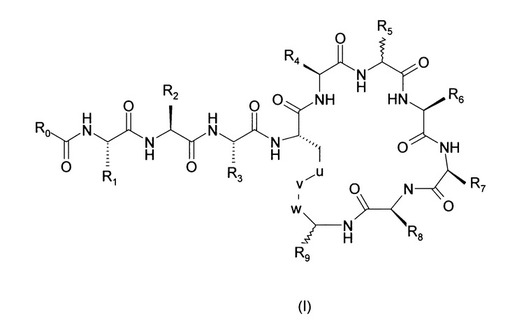
 (もっと読む)
(もっと読む)
組織因子経路インヒビター(TFPI)に対する最適化されたモノクローナル抗体
ヒト組織因子経路インヒビター(TFPI)に結合する単離されたモノクローナル抗体が提供される。TFPIに結合するモノクローナル抗体をコードする単離された核酸分子もまた考えられる。抗−TFPIモノクローナル抗体を含む医薬組成物および該抗体の投与による凝固における欠乏または欠損を処置する方法もまた提供される。該抗体を生産する方法もまた提供される。 (もっと読む)
遊離システイン残基を含有するタンパク質をリフォールディングする方法
【課題】本発明は、遊離システインを有する不溶性または凝集性タンパク質を製造またはリフォールディングする新規な方法を提供する。
【解決手段】本発明は、遊離システインを有する不溶性または凝集性タンパク質を製造またはリフォールディングする方法は、タンパク質を発現する宿主細胞をシステイン・ブロッキング剤に暴露する方法に関する。そのような新規な方法により製造される可溶性でリフォールディングされたタンパク質は、修飾し、それらの有効性を高めることができる。そのような修飾には、PEG部分を結合してPEG化タンパク質を作成することが含まれる。
(もっと読む)
単一ユニット抗体精製
本発明は、中間精製およびポリッシングの工程を少なくとも包含する、バイオリアクターにおいて生成されたタンパク質混合物からの抗体の精製のための方法に関し、当該中間精製およびポリッシング工程は、フロースルー様式での、インラインのアニオン交換クロマトグラフィー(AEX)処理および疎水性相互作用クロマトグラフィー(HIC)処理を含む。本発明はさらに、アニオン交換クロマトグラフィー部分および疎水性相互作用クロマトグラフィー部分の両方を連続的に連結して含む単一操作ユニットに関し、当該ユニットは、アニオン交換クロマトグラフィー部分の上流端において入口を含みかつ疎水性相互作用クロマトグラフィー部分の下流端において出口を含み、当該ユニットはまた、アニオン交換クロマトグラフィー部分と疎水性相互作用クロマトグラフィー部分との間にも入口を含む。 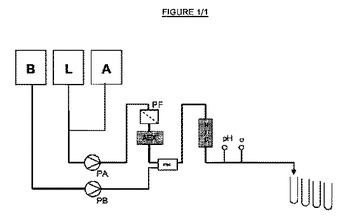 (もっと読む)
(もっと読む)
レプリキンペプチドとその使用
【課題】本発明は、迅速な複製に関連するペプチドの新規クラス並びに疾患の診断、予防及び処置におけるそれらの使用を提供する。
【解決手段】特定のモチーフから成るインフルエンザペプチド。
(もっと読む)
プロテアソーム酵素阻害のための化合物
【課題】酵素阻害の化合物、並びに酵素阻害に基づく治療法を提供する。
【解決手段】N−末端求核性(Ntn)ヒドロラーゼ類の特異的活性を効率的かつ選択的に阻害するヘテロ原子含有の三員環を含むペプチド−ベースの化合物であって、エポキシドまたはアジリジンを含み、N−末端官能化を含む上記ペプチド−ベースの化合物による、複数の活性を有するNtnの諸活性、並びに、20Sプロテアソームのキモトリプシン様活性の選択的阻害。前記ペプチド−ベースの化合物による抗炎症性特性および細胞増殖阻害作用に基づく治療法。
(もっと読む)
CXCR4拮抗活性を有するテンプレート固定βヘアピンペプチド擬似体
【課題】テンプレート固定β−ヘアピンペプチド擬似体を提供する。
【解決手段】一般式(I)(式中、Zはテンプレートに固定された12、14または18個のα-アミノ酸残基の鎖であり、前記アミノ酸残基は、鎖中の残基の位置(N末端アミノ酸を開始点として数えた位置)に応じて、Gly、NMeGly、ProもしくはPipであるか、または特定のタイプの残基であるテンプレート固定β-ヘアピンペプチド擬似体およびその塩からなる。これらのβ-ヘアピンペプチド擬似体は、混合型の固相および液相合成法に基づいた方法によって製造することができる。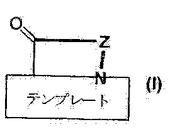 (もっと読む)
(もっと読む)
修飾されているブタのソマトトロピンポリペプチドおよびそれらの使用
修飾されているブタのソマトトロピンポリペプチドおよびそれの使用が提供される。 (もっと読む)
タンパク質の可逆的デュアルラベリング法
【課題】「タグ」部分が小さく、可逆的、かつ、特異的であり、1標的分子あたりの標識が制御可能であり、デュアルラベルが可能な標的タンパク質・ポリペプチドの標識のための「タグ」を単離する方法、および、そのような特徴を有する「タグ」を提供することを、本発明の課題とする。
【解決手段】上記課題は、3種のPYペプチド、ePY、P4S、および、P4Wをリガンドとして、これらに結合するタグペプチドを、リボソームディスプレイを用いて単離することによって解決した。
(もっと読む)
薬理学的活性ペプチド/タンパク質の血清中半減期を上昇させるためのトランスサイレチンペプチド/タンパク質融合物の使用
【課題】トランスサイレチン(TTR)を生物学的活性物質との融合パートナーとして使用することにより、選択した生物学的活性物質の血清中半減期を上昇させるための手段を提供する。
【解決手段】TTR(又はTTR変異体)−生物学的活性物質融合物及びPEG−TTR(PEG−TTR変異体)−生物学的活性物質融合物の実質的に均質な製剤。製剤を製造する方法は、(a)TTRのアミノ酸配列内の特定アミノ酸位置にシステイン残基を工作して上記TTRの変異体を得る(b)上記システイン残基での上記TTR変異体にポリエチレングリコールを複合体化してPEG−TTRを得(c)上記PEG−TTRを対象ペプチドに融合してPEG−TTR−ペプチド融合物を得る(d)上記PEG−TTR−ペプチド融合物を単離する。
(もっと読む)
41 - 60 / 615
[ Back to top ]