Fターム[4B063QR33]の内容
酵素、微生物を含む測定、試験 (178,766) | 試薬 (61,469) | 試薬としての核酸(←オリゴマー(3以上)) (12,299) | DNA (7,792) | プラスミド,組換えプラスミド (652)
Fターム[4B063QR33]に分類される特許
521 - 540 / 652
c−Jun二量化のペプチド阻害剤及びその使用
本発明は、核酸断片発現ライブラリーをスクリーニングし、標的のタンパク質又は核酸の活性を調節する能力と、標的のタンパク質又は核酸の一部分と、しかし反復部ではないその一部分と適合する、保存された立体配座を取る能力に基づいて、コードされたペプチドを選択する方法を提供する。本発明は、虚血を診断し、治療する方法も提供する。本発明は、虚血の治療に有用なc-Jun二量化阻害ペプチド及びその類縁体も提供する。 (もっと読む)
細胞増殖のTEL/ETV6−介在阻害
Stat3依存性およびサイトカイン−感受性細胞増殖の調節法、ならびにStat3依存性およびサイトカイン−感受性細胞増殖に影響する薬剤のスクリーニング法を提供する。方法は、TEL/Etv6の調節により例示される。 (もっと読む)
タンパク質分解によってタンパク質の配座を推定する方法
本発明は、タンパク質の構造的な特性について多型又は突然変異の効果を決定するための方法に関し、この方法は、タンパク質の構造的な特性及びタンパク質分解の間のその切断を利用する。 (もっと読む)
イネのアントラニル酸合成酵素遺伝子OASA2の新規改変遺伝子およびその利用
【課題】 トリプトファンによるフィードバック阻害に対する抵抗性を獲得した改変イネアントラニル酸合成酵素および当該改変酵素をコードする新規改変遺伝子を提供する。
【解決手段】 イネアントラニル酸合成酵素遺伝子OASA2の塩基配列に変異を導入し、特定の複数のアミノ酸に置換が生じたイネアントラニル酸合成酵素は、トリプトファンによるフィードバック阻害に対する抵抗性を獲得すると共に野生型イネアントラニル酸合成酵素と同程度以上の酵素活性を維持している。
(もっと読む)
膜結合前駆タンパク質の構造およびプロセシングを調節する物質の同定のための方法
本発明は、目的の膜タンパク質の切断を変化させ得る分子構造の大きいライブラリーからの物質のスクリーニングと同定の方法を提供する。膜タンパク質の切断を調節する本発明の方法により同定される物質は、炎症、糖尿病、ガン、アルツハイマー病、パーキンソン病等の疾患の治療と予防に用いることができる。本方法は、セクレターゼの切断の効率が調節されるように膜タンパク質の構造の構造的変化を引き起こす目的の膜タンパク質に結合するエフェクター物質を選択し、同定する。さらに、本方法は膜タンパク質プロセシングの条件に類似または同一の生理条件をそなえるインビボシステムで実施される。膜タンパク質のセクレターゼ切断の量を減少または増加させる能力に関して、物質が選択され得る。 (もっと読む)
P−Rex1、RACのためのPTDINS(3,4,5)P3−G−β−γにより制御されたグアニンヌクレオチド交換因子
炎症抑制の標的としての新規のタンパク質が記載される。該タンパク質の製造方法及び抗炎症剤の同定のためのアッセイにおける該タンパク質の使用が記載される。該タンパク質をコードする遺伝子についてのノックアウトマウスの作成方法も記載される。  (もっと読む)
(もっと読む)
イネ由来デンプン合成酵素SSIIaを発現させたシアノバクテリアの形質転換体、これを用いたSSIIaの機能解析法、並びに同形質転換体によって生産される多糖
【課題】 イネ由来デンプン合成酵素SSIIaをコードする遺伝子をシアノバクテリアに導入することにより得られたシアノバクテリアの形質転換体、これを用いたSSIIaの機能解析法、並びに同形質転換体によって生産される多糖を提供すること。
【解決手段】 前駆体型SSIIa発現用のプラスミド、および、成熟型SSIIa発現用のプラスミドをそれぞれ構築して、シアノバクテリアのグリコーゲン合成酵素欠損株の形質転換を行った。そして、形質転換株における貯蔵多糖の構造を解析したところ、前駆体型、成熟型いずれのSSIIaを発現させた場合にも、グルコース重合機能が失われた形質転換株においてグルカン糖鎖が検出された。このことから、シアノバクテリアに導入された前駆体型および成熟型のSSIIaは、宿主内において糖鎖合成の機能を発揮していることが明らかになった。
(もっと読む)
より成長が早いかつ/又はより収量が高い生物の作製
参照生物と比較してより成長が早い及び/又は収量が増加した非ヒト生物の作製方法であって、該生物又はその一以上の部分で配列番号2、107、125、129又は137の活性を参照生物に比較して増加させることを含む、上記方法。  (もっと読む)
(もっと読む)
マイクロサテライト不安定性における遺伝子の発現の差次的発現
本発明は、低レベルのマイクロサテライト不安定性(MSS)を示す腫瘍に対して、高レベルのマイクロサテライト不安定性(MSI−H)を示す結腸直腸腫瘍において過剰発現され、したがって、患者においてMSI−Hを同定するために使用でき、さらに患者の予後に役立ち、疾患の進行/退縮をモニターし、適当な治療計画を同定し、治療の有効性を評価するために使用できる核酸配列に関する。 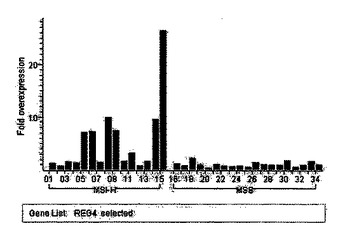 (もっと読む)
(もっと読む)
腎不全治療薬をスクリーニングする方法
腎不全治療薬を得るためのスクリーニングツール及び簡便なスクリーニング方法、並びに腎不全治療用医薬組成物及びその製造方法を開示する。前記スクリーニングツールはCTGFプロモーターを活性化することができるポリペプチドであるG蛋白質共役型受容体FGK、その機能的等価改変体、又は相同ポリペプチドであるか、あるいは前記ポリペプチドを発現している細胞である。スクリーニング方法は、前記ポリペプチドの阻害を指標とする方法である。 (もっと読む)
分類および同定のためのオリゴヌクレオチドタグ
【課題】化合物の探知、回収、および同定のための分子タグ化システムを提供すること。
【解決手段】固相支持体上でポリヌクレオチドの集団からポリヌクレオチドを分類する方法であって:(a)タグのレパートリー由来のオリゴヌクレオチドタグを、該レパートリー由来の各オリゴヌクレオチドタグが最少に交差ハイブリダイズする同じセットから選択されるように、ポリヌクレオチド集団中の各ポリヌクレオチドに結合させる工程;(b)該集団中の実質的にすべての異なるポリヌクレオチドが異なる結合オリゴヌクレオチドタグを有するように、ポリヌクレオチドの該集団をサンプリングする工程;および(c)オリゴヌクレオチドタグをその個々の相補物と特異的にハイブリダイズさせることにより、該集団から該ポリヌクレオチドを分類する工程、を包含する。
(もっと読む)
グアニル酸シクラーゼ活性を検出するための方法およびアッセイ
本発明は、可溶性グアニル酸シクラーゼ(sGC)という酵素に関する。詳細には、本発明は、可溶性グアニル酸シクラーゼの酵素活性を高効率および高感度で検出することを可能にする細胞ベースアッセイ系を提供する。好ましい実施形態ではsGCの酵素活性を刺激または阻害することによりsGCと相互作用し、またsGC媒介性の機能障害もしくは疾患の診断または治療に使用することができる分子をスクリーニングする方法を提供する。本発明はさらに、前記方法で使用するための遺伝子構築物、ベクター、および細胞を提供する。 (もっと読む)
オリゴアデニレートシンテターゼ様遺伝子の同定
本発明は、動物における受胎を調節するための組成物および方法に関する。より具体的には、該組成物は、配偶子形成および初期発生においてmRNAの分解を調節する。さらに本発明は、過剰増殖性疾患のような生殖器官の疾患を調節するための医薬組成物および方法に関する。  (もっと読む)
(もっと読む)
テロメラーゼ抗原に対する免疫応答を惹起するための方法および組成物
【課題】 ヒトおよびヒトでない動物におけるこれらおよび他の疾患を予防および処置するための免疫学的方法を提供。
【解決手段】
Tリンパ球を、組換え核酸によってコードされるテロメラーゼ逆転写酵素(TRT)ポリペプチドを発現する樹状細胞と接触させることによりTリンパ球を活性化する方法ならびに組換えTRT発現カセットを含む組換え樹状細胞(1つの実施態様では、この組換え発現カセットは、幹細胞に形質導入され、次いでこの幹細胞は樹状細胞に分化される)、ならびに上記の樹状細胞および薬学的に受容可能なキャリアを含む薬学的組成物。
(もっと読む)
細胞周期を知らせる細胞系
【課題】細胞周期調節機構の主要なエレメントを、規定の組み合わせで使用し、二重の独立した細胞性レポーターを駆動して、個々の生細胞における細胞周期のすべての期での細胞周期の状態を決定する新規手段を提供すること。
【解決手段】本発明は、生細胞の細胞周期位置を決定するための非破壊的で動的な手段に関する。本発明は、細胞周期位置を決定するのに使用することができる安定細胞系を、細胞周期位置に対する被検薬剤の効果を測定するための方法と共に提供する。
(もっと読む)
抗プリオン活性を有する分子のスクリーニングキットおよび抗プリオン活性を有する分子のスクリーニング方法およびスクリーニングされた分子
本発明は、抗プリオン活性を有する分子のスクリーニングに関する。より詳細には、本発明は、抗プリオン活性を有する分子のスクリーニング用のキットであって、[PSI+]の表現型酵母、アンチビオグラムおよび有効量未満の用量のプリオン除去剤を組み合わせて含み、該酵母菌は、ADE遺伝子のadel−14対立遺伝子および不活性化されたERG6遺伝子を含むことを特徴とするキット、スクリーニング法、および本発明スクリーンによって単離された抗プリオン活性を有する分子ファミリーに関する。本発明は、医薬を生成するため、特にタンパク質凝集に由来する神経変性病を治療するための抗プリオン剤に適用できる。  (もっと読む)
(もっと読む)
条件複製起点をもつ環状DNA分子、それらの製造方法、及び、遺伝子治療におけるそれらの使用
条件複製起点を活性化させる非相同性の複製開始蛋白質と、非相同性の治療用遺伝子及び条件複製起点を持つ染色体外DNA分子を含み、原核生物組換え体の宿主細胞における前記条件複製起点の機能にはその宿主細胞に外来の複製開始蛋白質が必要な、原核生物組換え体の宿主細胞が記載される。この宿主細胞は少なくとも1つの変異(この変異はコピー数制御部位、pir遺伝子ロイシンジッパー様モチーフ、若しくはpir遺伝子DNA結合部位において起こっていてよい。)を有するpir遺伝子を含んでいてよい。 (もっと読む)
C−マンノシルトランスフェラーゼに関するアッセイ
本発明は、C−マンノシルトランスフェラーゼ(CMT)活性を検出するための細胞に基づくアッセイ、およびCMT活性の調節に有効な薬剤に関するスクリーニングアッセイを提供する。 (もっと読む)
糖代謝関連遺伝子の転写因子の分解方法、分解阻害方法および分解阻害剤
m−カルパインまたはμ−カルパインが、膵臓β細胞において糖代謝関連遺伝子の発現に関与する転写因子ネットワークを形成する、ヘパトサイトヌクレアーファクター4α(HNF−4α)、ヘパトサイトヌクレアーファクター1α(HNF−1α)およびインシュリンプロモーターファクター1(IPF−1)を分解することを見出し、これら転写因子の分解方法;分解阻害方法;分解阻害剤;これらが転写因子として作用する遺伝子の遺伝子産物産生促進剤および産生促進方法;これら転写因子の分解に起因する疾患の防止剤および/または治療剤並びに防止方法および/または治療方法;カルパインによるこれら転写因子分解を阻害する化合物の同定方法;該同定方法で得られた化合物;さらにカルパイン、これら転写因子、これら転写因子をコードするポリヌクレオチド、該ポリヌクレオチドを含有するベクターを含んでなる試薬キットを提供した。 (もっと読む)
アポトーシスのモジュレーターを同定するためのp75NTRスクリーニングアッセイ
本発明は、p75NTR誘導性アポトーシスを調節する試験化合物能力を同定する方法を提供し、該方法は:i.p75NTR(配列番号2)もしくはその細胞死誘導フラグメントをコードするベクターで真核細胞の懸濁液をトランスフェクションすること、ii.試験する化合物と該細胞を接触させること、およびiii.該細胞におけるアポトーシス応答を決定すること(ここで、該試験化合物の不在下でのアポトーシス応答と比較した該試験化合物の存在下でのアポトーシス応答の改変は、p75NTR誘導性アポトーシスを調節する該試験化合物の能力の指標である)を含んでなる。本発明のこの方法において、真核細胞の懸濁液は、0.4〜3.0x104細胞/100μlの細胞密度で使用されそして6〜1のDNAに対するトランスフェクション試薬の比率で、特に4の比率で脂質ベースのトランスフェクション試薬の存在下でトランスフェクションされるHek293T細胞からなる。10mlの最終トランスフェクションミックス当たりで表されるトランスフェクション試薬の量は8.0〜12.0μlの範囲においてであり、そしてDNAの量は2.0〜3.5μgの範囲においてである。本発明の方法における細胞のアポトーシス応答は、当該技術分野で既知である方法を用いて決定される。特にアネキシンVもしくは核染色を用いる。好ましい態様において、アポトーシス応答はアネキシン−V−Alexa Fluor 488およびヘキスト33342を用いて決定される。上記に使用するようなp75NTR細胞死誘導フラグメントは、p75 Chopperドメイン(配列番号10)を含んでなり、そして特にp75_ICD(配列番号4)、p75_CD(配列番号6)もしくはp75_TNF(配列番号8)からなる。 (もっと読む)
521 - 540 / 652
[ Back to top ]


