Fターム[4C057AA19]の内容
Fターム[4C057AA19]に分類される特許
41 - 60 / 135
二置換アミノジフルオロスルフィニウム塩、その調製プロセスおよびデオキソフッ素化試薬としての使用方法
本発明は式(I)
によって表される二置換アミノジフルオロスルフィニウム塩に関する。同物質を調製する方法、およびデオキソフッ素化試薬として使用する方法もまた提供される。 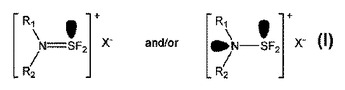 (もっと読む)
(もっと読む)
化学プロセス
本明細書では、グルコピラノシルオキシピラゾール誘導体の製造方法が開示される。特に、本発明は、SGLT2阻害活性を有するグルコピラノシルオキシピラゾール誘導体ならびにそれらの製造方法および中間体に関する。 (もっと読む)
2’−O−フコシルラクトースの合成方法
本発明は、式:
の三糖の改良された合成方法、該合成に用いる新規中間体、および該中間体の製造方法に関する。  (もっと読む)
(もっと読む)
6’−シアリルラクトース塩並びに6’−シアリルラクトース塩及び他のA−シアリルオリゴ糖の合成方法
本発明は、α−シアリルオリゴ糖の合成に関し、特に工業的規模での使用を可能にする条件下でのケーニッヒ・クノール反応によるカップリングのステップを含む6’−シアリルラクトース及びその塩の合成方法に関する。 (もっと読む)
セルロース加水分解のためのインプリント生体模倣触媒
本開示は、セルロースなどのグルコースポリマー、およびセロビオースなどのオリゴマーを、その後のエタノール生成のためにグルコースに加水分解するのに有用な方法および生体模倣触媒を記載する。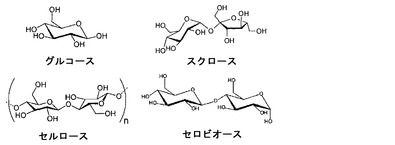
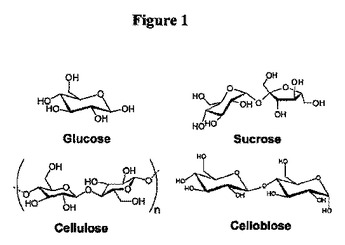 (もっと読む)
(もっと読む)
糖結合型スピロクラウンエーテル誘導体
【課題】ヘミケタール構造のアノマー炭素原子をクラウンエーテルの環状炭素原子に含み、糖分子とクラウンエーテルがスピロ構造となる糖結合型スピロクラウンエーテル誘導体とその製造法の提供。
【解決手段】2,3,4,6-テトラ-O-ベンジル-1-C-ビニル-α-D-グルコピラノースと、一つの水酸基をベンゾイル基で保護したエチレングリコール誘導体を用い、ビスマス(III)トリフレート、またはトリフルオロメタンスルホン酸を活性化剤に用いることで、糖結合型スピロクラウンエーテル誘導体を製造することができた。
(もっと読む)
無水糖の製造方法
【課題】分離回収が容易な固体触媒を用い、穏やかな反応条件下にて無水糖を得る新規合成法の提供を目的とする。
【解決手段】非プロトン性極性溶媒中にて、固体酸触媒の存在下、単糖から無水糖を得ることを特徴とする。
グルコースからレボグルコサンと1,6−アンヒドログルコフラノースを得ることができる。
(もっと読む)
デオキシリボフラノース化合物の製造方法
【課題】デオキシリボフラノース化合物の製造方法の提供。
【解決手段】本発明は、化合物(2)などのデオキシリボフラノース化合物を製造する方法に関する。上記デオキシリボフラノース化合物は、5−アミノ−3−(2’−O−アセチル−3’−デオキシ−β−D−リボフラノシル)−3H−チアゾロ[4,5−d]ピリミジン−2−オンなどの医薬化合物の製造における有用な中間体である。
[化1] (もっと読む)
(もっと読む)
糖又はその誘導体の製造方法
【課題】従来よりも効率的にセルロース系材料を分解糖化して糖又はその誘導体を製造する方法の提供。
【解決手段】固体酸触媒とセルロース系材料とを、マイクロ波の照射下で接触させて、該セルロース系材料を糖化することにより、糖又はその誘導体を製造する方法。該固体酸触媒は、ブレンステッド酸点を有する固体であり、前記ブレンステッド酸点としては、−OH基、−CO2H基及び−SO3H基からなる群から選択される1種又は2種以上であることが好ましい。前記固体酸触媒は、珪酸塩化合物、カーボン系固体材料及び固体超強酸から選択される1種又は2種以上であることが好ましい。
(もっと読む)
マクロライド系化合物の合成方法
本発明は、抗菌活性を有することが知られ、哺乳動物における細菌感染症の治療に有用なマクロライド系化合物の合成方法に関する。より具体的には、本発明は、新規な触媒の立体配置、化学構造および/または方法を用いる、マクロライド系抗生物質、ガミスロマイシンの合成方法に関する。本発明の一実施形態は、化学中間体を単離せずに複数の化学反応を進行させることを含むことができる。従って、複数の反応を1つの反応器中で行うことができ、サイクル時間のかなりの削減が可能になる。本発明はまた、医薬組成物の構造体を単離する間の分解を抑制するための新規方法を提供する。 (もっと読む)
デシタビンの合成
本発明は、デシタビン最終製品と同様にデシタビンの保護前駆体を高収率かつ高純度で生成する方法を提供する。 (もっと読む)
オリゴヌクレオチドの合成方法
本発明は、オリゴヌクレオチドの合成方法に関する。この方法は、縮合反応条件下で式(1)の化合物と式(2)の化合物とを液体反応溶媒中で反応させ、式(3)の化合物を得ることを含む。本発明の方法で適宜な保護基を用いて保護しようとする官能基を保護し、式(1)の化合物(OH−成分)にある連結しようとする5’末端のヒドロキシル基と式(2)の化合物(P−成分)にある連結しようとする3’末端のリン酸塩とを遊離にして、液体反応溶媒中で縮合反応を行い、OH−成分とP−成分とを連結し、DNAまたは短鎖RNAを得る。本発明の方法は、固相カラムを使用する必要がなく、液体反応溶媒中で実施できて、オリゴヌクレオチドを大規模に合成することが可能である。 (もっと読む)
1,6:2,3−ジアンヒドロ−β−D−マンノピラノースの短い合成経路
本発明は、1,6:2,3−ジアンヒドロ−β−D−マンノピラノースの調製方法に関し、水酸化アンモニウムおよび無機塩基から選択される塩基の存在下、Rが活性化剤である化合物Bの環化工程を含むことを特徴とする。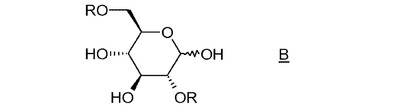
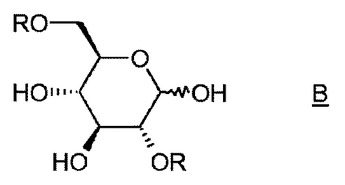 (もっと読む)
(もっと読む)
糖類のアルキルエーテル化物の製造方法
【課題】 糖類のアルキルエーテル化物の製造方法において、糖鎖が切断されること無く、かつ選択的に非対称の脱水エーテル化が高効率で進行する、糖類のアルキルエーテル化物の製造方法を提供する。
【解決手段】 糖類のアルキルエーテル化物の製造方法において、触媒と溶剤の存在下、超臨界状態の二酸化炭素中で、上記糖類と分子内に水酸基を有する化合物とを脱水縮合反応させることを特徴とするアルキルエーテル化物の製造方法である。
(もっと読む)
ラムノシドエステル誘導体およびその製造方法
【課題】異なる保護基で二つ以上の水酸基が保護されたラムノシドエステル誘導体の提供。
【解決手段】ジアルキル錫化合物、塩基の存在下、ラムノシドエステル化合物と保護基導入剤とを反応させることによって、一般式(I)
(式中、Xは、炭素数1〜8のアルキル基、又はアリール基であり、R1、及びR2は、アシル基、スルホニル基、又はオキシカルボニル基であり、R1、及びR2は、夫々互いに異なる保護基である。)で示されるラムノシドジエステル化合物を提供する。
(もっと読む)
UV吸収剤及び抗酸化剤としてのベンゾトロポロン誘導体の使用並びに日焼け止め及び/又は化粧品組成物におけるその使用
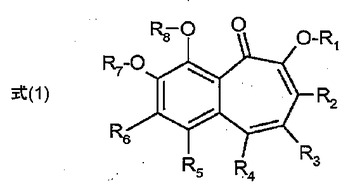
UV照射に対してヒト及び動物の毛髪及び皮膚を防護するための、ベンゾトロポロン及びそれらの誘導体、特に式(1);[式中、R2、R3、R4、R5及びR6は、互いに独立して、水素;OH;C1〜C30アルキル、C2〜C30アルケニル、C1〜C30アルコキシ、C3〜C12シクロアルキル又はC1〜C30ヒドロキシアルキル(これらは、1個又は複数のEで置換されているか、及び/又は1個若しくは複数のDで中断されていてもよい);C6〜C20アリール(これは、1個又は複数のGで置換されていてもよい);C4〜C20ヘテロアリール(これは、1個又は複数のG、C2〜C18アルケニル、C2〜C18アルキニル、C7〜C25アラルキル、CN、又は-CO-R17で置換されていてもよい);C1〜C30モノ又はジアルキルアミノ;COR9;COOR9;CONR9R10;CN;SO2R9;OCOOR9;OCOR9;NHCOOR9;NR9COR10;NH2;*-(CO)-NH-(CH2)n1-(PO)-(OR11)2;-(CO)-O-(CH2)n1-(PO)-(OR11)2;サルフェート;スルホネート;ホスフェート;ホスホネート;-(CH2)n2-[O-(SO2)]n3-OR11;-O-(CH2)n4(CO)n5-R11;-(O)n6-(CH2)n7-(PO)-(OR9)2;-(O)n6-(CH2)n7-SO2-OR9;ハロゲン;オルガノシラニル;オルガノシロキサニル;又は糖残基(アノマー酸素を介してベンゾトロポロン系にα-又はβ-様式で直接連結されているか、又は直鎖若しくは分岐のアルキレン、アルケニレン、アルカジエン若しくはアルカトリエンスペーサを介して連結されている(糖-(CH2)n-(X1)1-ベンゾトロポロン系、式中、n=1〜10、X1=-O-;-(CO)-;-O-CO-;-COO-;-NH-;-S-;-SO2-))であり、R1、R7及びR8は、互いに独立して、水素;C1〜C12アルキル又はC3〜C12-シクロアルキル(これらは、1個若しくは複数のEで置換されているか、及び/又は1個若しくは複数のDで中断されていてもよい);C6〜C20アリール(これは、1個又は複数のGで置換されていてもよい);C4〜C20ヘテロアリール(これは、1個又は複数のG、C2〜C18アルケニル、C2〜C18アルキニル、C7〜C25アラルキル、又はCOOR9で置換されていてもよい);COR9;CONR9R10;SO3R9;SO2R9;PO3(R9)2;PO2(R9)2;オルガノシラニル;オルガノシロキサニル;又は糖残基(アノマー酸素を介してベンゾトロポロン系にα-又はβ-様式で直接連結されているか、又は直鎖若しくは分岐のアルキレン、アルケニレン、アルカジエン若しくはアルカトリエンスペーサを介して連結されている(糖-(CH2)n-(X2)1又は0-*、式中、n=1〜10、X2=-C(=O)-;-O-CO-*))であり、R9及びR10は、互いに独立して、水素;C1〜C18アルキル又はC3〜C12-シクロアルキル(これらは、1個若しくは複数のEで置換されているか、及び/又は1個若しくは複数のDで中断されていてもよい);C6〜C20アリール(これは、1個又は複数のGで置換されていてもよい);C4〜C20ヘテロアリール(これは、1個又は複数のGで置換されていてもよい);オルガノシラニル;オルガノシロキサニル;若しくは糖残基(アノマー酸素を介してα-又はβ-様式で直接連結されているか、又は直鎖若しくは分岐のアルキレン、アルケニレン、アルカジエン若しくはアルカトリエンスペーサを介して連結されている(糖-(CH2)n-*、式中、n=1〜10))であるか、又はR9及びR10は一緒になって、5若しくは6員環を形成し、R11は水素;又はC1〜C5アルキルであり、n1、n2、n4及びn7は、互いに独立して、1から5の数であり、n3、n5及びn6は、互いに独立して、0;又は1であり、Dは、-CO-;-COO-;-S-;-SO-;-SO2-;-O-;-NR14-;-S1R19R20-;-POR11-;-CR12=CR13-;又は-C≡C-であり、Eは、-OR18;-SR18;-NR14R15;-NR14COR15;-COR17;-COOR16;-CONR14R15;-CN;ハロゲン;若しくはSO3R18;SO2R18;PO3(R18)2;PO2(R18)2;オルガノシラニル;オルガノシロキサニル;又は糖残基(アノマー酸素を介してα-又はβ-様式で直接連結されているか、又は直鎖若しくは分岐のアルキレン、アルケニレン、アルカジエン若しくはアルカトリエンスペーサを介して連結されている(糖-(CH2)n-(X1)1又は0-*、式中、n=1〜10、X1=-O-;-C(=O)-;-O-CO-;-COO-;-NH-;-S-;-SO2-))であり、Gは、E;C1〜C18アルキル(これは、Dで任意により中断されている);C1〜C18ペルフルオロアルキル;C1〜C18アルコキシ(これは、Eで任意により置換されているか、及び/又はDで任意により中断されている)であり、ここで、R12、R13、R14及びR15は、互いに独立して、水素;C6〜C18アリール(これは、OH、C1〜C18アルキル又はC1〜C18アルコキシで任意により置換されている);C1〜C18アルキル(これは、-O-で任意により中断されている)であるか、又はR14及びR15は一緒になって、5若しくは6員環を形成し、R16は、水素;C6〜C18アリール(これは、OH、C1〜C18アルキル又はC1〜C18アルコキシで任意により置換されている);C1〜C18アルキル(これは、-O-で任意により中断されている)であり、R17は、H;C6〜C18アリール(これは、OH、C1〜C18アルキル又はC1〜C18アルコキシで任意により置換されている);又はC1〜C18アルキル(これは、-O-で任意により中断されている)であり、R18は、水素;C6〜C18アリール(これは、OH、C1〜C18アルキル又はC1〜C18アルコキシで任意により置換されている);C1〜C18アルキル(これは、-O-で任意により中断されている)であり、R19及びR20は、互いに独立して、水素;C1〜C18アルキル;C6〜C18アリール(これは、C1〜C18アルキルで任意により置換されている)であり、R21は、C1〜C18アルキル;又はC6〜C18アリール(これは、C1〜C18アルキルで置換されている)であり、*は、この基が、ベンゾトロポロン部分に向けられていることを意味する]の化合物の使用が記載される。
(もっと読む)
複素環を有する化合物の重水素化方法
【課題】生体内動態や様々な生理活性の作用機序等を解明するために有用な重水素化された複素環を有する化合物を得る方法として、重水素化還元試薬を用いることなく、高い重水素化率で、該化合物を構成する複素環を位置選択的に重水素化することができる新規な重水素化方法を提供する。
【解決手段】重水素化された溶媒中において、複素環を有する化合物にラジカル還元剤を反応させることにより、該化合物を構成する複素環上に存在するラジカル反応に対して活性を示す官能基が、重水素に置換されることを特徴とする重水素化方法。
(もっと読む)
糖鎖の構築方法
【課題】 人工プロテオグリカンや人工グリコサミノグリカンの作製のためなどに有用な糖鎖の構築方法を提供すること。
【解決手段】 非還元末端に不飽和ヘキスロン酸を有するオリゴ糖の不飽和ヘキスロン酸の不飽和結合のオキシ水銀化(ただし使用する水銀塩はオリゴ糖に対して最大で5モル当量とする)とそれに続く還元的脱水銀化を行うことで非還元末端の不飽和ヘキスロン酸をヘキスロン酸に変換した後、ヘキスロン酸のグリコシル化を行うことを特徴とする。本発明は、非還元末端の不飽和ヘキスロン酸のヘキスロン酸への変換とヘキスロン酸へのグリコシル化を行うことによる糖鎖を伸長するための新たな方法論を提供する。
(もっと読む)
キシロシドエステル誘導体およびその製造方法
【課題】異なる保護基で二つ以上の水酸基が保護されたキシロシドエステル誘導体を提供する。
【解決手段】ジアルキル錫化合物、塩基の存在下、キシロシドエステル化合物と保護基導入剤とを反応させることによって、下記一般式(I)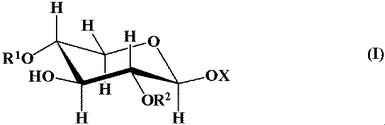
(式中、Xは、炭素数1〜8のアルキル基、又はアリール基であり、R1、及びR2は、アシル基、スルホニル基、又はオキシカルボニル基であり、R1、及びR2は、夫々互いに異なる保護基である。)で示されるキシロシドジエステル化合物を得る。
(もっと読む)
スクラロースを製造する方法
本発明は、反応媒体においてスクロース−6−アシレートを含む供給流からスクラロースを製造する方法であって、(i)スクロース−6−アシレートの4位、1’位、及び6’位を塩素化するよう、スクロース−6−アシレートと塩素化剤とを反応させること、(ii)(i)の生成物流を塩基の水溶液でクエンチして、スクラロース−6−アシレート及び該塩基の塩化物塩を得る、クエンチすることであって、塩基の水溶液の濃度が、塩基の塩化物塩の少なくとも一部が沈降物として形成されるほど十分に高い、クエンチすること、(iii)(ii)の生成物流を塩基で処理することによって、スクラロース−6−アシレートを脱アシル化した後、沈降した塩を除去して、スクラロースを含む生成物流を得る、脱アシル化した後に除去すること、又は(ii)の生成物流から沈降した塩を除去した後、塩基で処理することによってスクラロース−6−アシレートを脱アシル化して、スクラロースを含む生成物流を得る、除去した後に脱アシル化すること、並びに(iv)スクラロースを(iii)の生成物流から単離することを含む、方法を提供する。 (もっと読む)
41 - 60 / 135
[ Back to top ]



