カンナビノイドCB2レセプターに対して活性を有するイミダゾール(1,2−a)ピリジン及び関連化合物
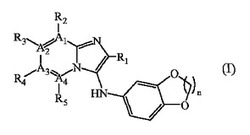
本明細書中には、式Iの化合物或いはそれの薬学的に許容される塩、エステル又はアミド、及びカンナビノイドCB2レセプターの活性を調節する方法であって、式Iの化合物をカンナビノイドCB2レセプターに接触させることを含んでなる方法が開示される。また、ポジトロン放出断層撮影法による組織のイメージング方法であって、放射性同位体を含む式Iの化合物を被験体に投与する段階を含んでなる方法も開示される。また、放射性同位体を含む式Iの化合物を使用することで、被験体の組織中におけるカンナビノイドCB2レセプターの相対濃度を測定する方法も開示される。加えて、被験体における疾患を診断する方法も開示される。
【化1】
【化1】
Notice: Undefined index: DEJ in /mnt/www/gzt_disp.php on line 298
【特許請求の範囲】
【請求項1】
下記式Iの化合物或いはそれの薬学的に許容される塩、エステル、アミド又はプロドラッグ。
【化1】

(式中、
a)A1、A2、A3及びA4は各々独立に炭素又は窒素であり、
b)R1は任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換された炭素環、及び任意に置換された複素環からなる群から選択され、
c)R2、R3、R4及びR5は各々独立に、水素、アルキル、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたヘテロアリサイクリル、ハロゲン、スルフェニル、スルフィニル、スルホニル、ハロアルキル、ハロアルコキシ、ペルハロアルキル、CN、C(=Z)R’、C(=Z)OR’、C(=Z)NR’R”、−C(R’)=NR’、−NR’R”、−N=CR’R”、N(R’)C(=Z)R’、N(R’)C(=Z)NR’R”、−S(O)NR’R”、−S(O)2NR’R”、N(R’)S(=O)R’、N(R’)S(=O)2R’、−OR’、−SR’及びOC(=Z)R’(式中、R’及びR”は各々独立に水素、アルキル、シクロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、及び任意に置換されたヘテロアリサイクリルからなる群から選択され、Zは酸素又は硫黄である。)からなる群から選択されるが、
A1が窒素である場合にR2は存在せず、
A2が窒素である場合にR3は存在せず、
A3が窒素である場合にR4は存在せず、
A4が窒素である場合にR5は存在しない
ことを条件とし、
d)nは1又は2である。)
【請求項2】
A1、A2、A3及びA4の3以上が炭素である、請求項1記載の化合物。
【請求項3】
A1、A2、A3及びA4の2以上が炭素である、請求項1記載の化合物。
【請求項4】
A1、A2、A3及びA4の1以上が炭素である、請求項1記載の化合物。
【請求項5】
当該化合物中の1以上の原子が放射性同位体である、請求項1記載の化合物。
【請求項6】
放射性同位体が水素、炭素、窒素、酸素又はハロゲンの同位体である、請求項5記載の化合物。
【請求項7】
ハロゲンがフッ素又はヨウ素である、請求項6記載の化合物。
【請求項8】
R1が任意に置換されたヘテロアリールである、請求項1記載の化合物。
【請求項9】
ヘテロアリールが、フラン、チオフェン、フタラジノン、ピロール、オキサゾール、チアゾール、イミダゾール、ピラゾール、イソキサゾール、イソチアゾール、トリアゾール、チアジアゾール、ピラン、ピリジン、ピリダジン、ピリミジン、ピラジン及びトリアジンからなる群から選択される、請求項8記載の化合物。
【請求項10】
ヘテロアリールがピリジル又はチオフェニルである、請求項8記載の化合物。
【請求項11】
R1が任意に置換されたアリールである、請求項1記載の化合物。
【請求項12】
アリールがフェニルである、請求項11記載の化合物。
【請求項13】
R1が下記式の基である、請求項1記載の化合物。
【化2】

(式中、
R11、R12、R13、R14及びR15は各々独立に、水素、アルキル、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたヘテロアリサイクリル、ハロゲン、スルフェニル、スルフィニル、スルホニル、ハロアルキル、ハロアルコキシ、ペルハロアルキル、CN、C(=Z)R’、C(=Z)OR’、C(=Z)NR’R”、−C(R’)=NR’、−NR’R”、−N=CR’R”、N(R’)C(=Z)R’、N(R’)C(=Z)NR’R”、−S(O)NR’R”、−S(O)2NR’R”、N(R’)S(=O)R’、N(R’)S(=O)2R’、−OR’、−SR’及びOC(=Z)R’(式中、R’及びR”は各々独立に水素、アルキル、シクロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、及び任意に置換されたヘテロアリサイクリルからなる群から選択され、Zは酸素又は硫黄である。)からなる群から選択されるか、或いは
R11及びR12はこれらが結合している炭素原子と一緒になって、又はR12及びR13はこれらが結合している炭素原子と一緒になって、又はR13及びR14はこれらが結合している炭素原子と一緒になって、又はR14及びR15はこれらが結合している炭素原子と一緒になって、五員若しくは六員の任意に置換された炭素環又は任意に置換された複素環を形成し、或いは六員の任意に置換されたアリール又は任意に置換されたヘテロアリールを形成する。)
【請求項14】
アルキルがメチル、エチル、n−プロピル、イソプロピル、n−ブチル、sec−ブチル、tert−ブチル及びメチレンシクロプロピルからなる群から選択される、請求項13記載の化合物。
【請求項15】
アルコキシがメトキシ、エトキシ、n−プロポキシ、イソプロポキシ、n−ブトキシ、sec−ブトキシ及びtert−ブトキシからなる群から選択される、請求項13記載の化合物。
【請求項16】
ハロがフルオロ、クロロ、ブロモ及びヨードからなる群から選択される、請求項13記載の化合物。
【請求項17】
フルオロが放射性同位体である、請求項16記載の化合物。
【請求項18】
R1が下記式の基である、請求項1記載の化合物。
【化3】

(式中、
a)B1、B2、B3、B4、B5及びB6は各々独立に炭素、硫黄、酸素及び窒素からなる群から選択され、
b)B7、B8、B9、B10及びB11は各々独立に炭素、硫黄、酸素及び窒素からなる群から選択され、
c)R16、R17、R18、R19及びR20は各々独立に、水素、アルキル、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたヘテロアリサイクリル、ハロゲン、スルフェニル、スルフィニル、スルホニル、ハロアルキル、ハロアルコキシ、ペルハロアルキル、CN、C(=Z)R’、C(=Z)OR’、C(=Z)NR’R”、−C(R’)=NR’、−NR’R”、−N=CR’R”、N(R’)C(=Z)R’、N(R’)C(=Z)NR’R”、−S(O)NR’R”、−S(O)2NR’R”、N(R’)S(=O)R’、N(R’)S(=O)2R’、−OR’、−SR’及びOC(=Z)R’(式中、R’及びR”は各々独立に水素、アルキル、シクロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、及び任意に置換されたヘテロアリサイクリルからなる群から選択され、Zは酸素又は硫黄である。)からなる群から選択されるか、或いは
R16及びR17はこれらが結合している炭素原子と一緒になって、又はR17及びR18はこれらが結合している炭素原子と一緒になって、又はR18及びR19はこれらが結合している炭素原子と一緒になって、又はR19及びR20はこれらが結合している炭素原子と一緒になって、五員若しくは六員の任意に置換された炭素環又は任意に置換された複素環を形成し、或いは六員の任意に置換されたアリール又は任意に置換されたヘテロアリールを形成するが、
B2が炭素でない場合にR16は存在せず、
B3が炭素でない場合にR17は存在せず、
B4が炭素でない場合にR18は存在せず、
B5が炭素でない場合にR19は存在せず、
B6が炭素でない場合にR20は存在しない
ことを条件とし、
d)R21、R22、R23及びR24は各々独立に、水素、アルキル、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたヘテロアリサイクリル、ハロゲン、スルフェニル、スルフィニル、スルホニル、ハロアルキル、ハロアルコキシ、ペルハロアルキル、CN、C(=Z)R’、C(=Z)OR’、C(=Z)NR’R”、−C(R’)=NR’、−NR’R”、−N=CR’R”、N(R’)C(=Z)R’、N(R’)C(=Z)NR’R”、−S(O)NR’R”、−S(O)2NR’R”、N(R’)S(=O)R’、N(R’)S(=O)2R’、−OR’、−SR’及びOC(=Z)R’(式中、R’及びR”は各々独立に水素、アルキル、シクロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、及び任意に置換されたヘテロアリサイクリルからなる群から選択され、Zは酸素又は硫黄である。)からなる群から選択されるか、或いは
R21及びR22はこれらが結合している炭素原子と一緒になって、又はR22及びR23はこれらが結合している炭素原子と一緒になって、又はR23及びR24はこれらが結合している炭素原子と一緒になって、五員若しくは六員の任意に置換された炭素環又は任意に置換された複素環を形成し、或いは六員の任意に置換されたアリール又は任意に置換されたヘテロアリールを形成するが、
B8が炭素でない場合にR21は存在せず、
B9が炭素でない場合にR22は存在せず、
B10が炭素でない場合にR23は存在せず、
B11が炭素でない場合にR24は存在しない
ことを条件とする。)
【請求項19】
B1、B2、B3、B4、B5及びB6の3以上が炭素である、請求項18記載の化合物。
【請求項20】
B1、B2、B3、B4、B5及びB6の2以上が炭素である、請求項18記載の化合物。
【請求項21】
B1、B2、B3、B4、B5及びB6の1以上が炭素である、請求項18記載の化合物。
【請求項22】
B7、B8、B9、B10及びB11の3以上が炭素である、請求項18記載の化合物。
【請求項23】
B7、B8、B9、B10及びB11の2以上が炭素である、請求項18記載の化合物。
【請求項24】
B7、B8、B9、B10及びB11の1以上が炭素である、請求項18記載の化合物。
【請求項25】
R1が下記のものからなる群から選択される、請求項13記載の化合物。
【化4】

【化5】

【請求項26】
A1が窒素であり、A2、A3及びA4が炭素である、請求項1記載の化合物。
【請求項27】
A2が窒素であり、A1、A3及びA4が炭素である、請求項1記載の化合物。
【請求項28】
R2、R3、R4及びR5が各々独立にアルキルであり、該アルキルがメチル、エチル、n−プロピル、イソプロピル、n−ブチル、sec−ブチル、tert−ブチル及びメチレンシクロプロピルからなる群から選択される、請求項1記載の化合物。
【請求項29】
R2、R3、R4及びR5が各々独立にハロであり、該ハロがフルオロ、クロロ、ブロモ及びヨードからなる群から選択される、請求項1記載の化合物。
【請求項30】
フルオロが放射性同位体である、請求項29記載の化合物。
【請求項31】
式
【化6】

の部分が下記のものからなる群から選択される、請求項1記載の化合物。
【化7】

【化8】

【請求項32】
当該化合物がCR−1ないしCR−130及びCR−132ないしCR−136からなる群から選択される、請求項1記載の化合物。
【請求項33】
カンナビノイドCB2レセプターの活性を調節する方法であって、式Iの化合物をカンナビノイドCB2レセプターに接触させることを含んでなる方法。
【請求項34】
式Iの化合物がカンナビノイドCB1レセプターに比べてカンナビノイドCB2レセプターに優先的に結合する、請求項33記載の方法。
【請求項35】
カンナビノイドCB2レセプター活性がインビトロで調節される、請求項33記載の方法。
【請求項36】
カンナビノイドCB2レセプター活性がインビボで調節される、請求項33記載の方法。
【請求項37】
式Iの化合物がカンナビノイドCB2レセプターのアゴニストである、請求項33記載の方法
【請求項38】
式Iの化合物がカンナビノイドCB2レセプターのアンタゴニストである、請求項33記載の方法
【請求項39】
式Iの化合物がカンナビノイドCB2レセプターの部分アゴニストである、請求項33記載の方法
【請求項40】
式Iの化合物がカンナビノイドCB2レセプターの逆アゴニストである、請求項33記載の方法
【請求項41】
被験体の組織の第1の領域のインビボイメージングを行う方法であって、
放射性同位体を含む式Iの化合物を含んでなる医薬品組成物を被験体に投与する段階、
組織の第1の領域から放射性同位体によって放出される信号を測定する段階、及び
組織の第1の領域から放出される信号の量を対照試料から放出される信号の量と比較する段階
を含んでなる方法。
【請求項42】
対照試料が被験体の内部にある、請求項41記載の方法。
【請求項43】
対照試料が類似の組織又は同じ組織の第2の領域である、請求項42記載の方法。
【請求項44】
対照試料が被験体の外部にある、請求項41記載の方法。
【請求項45】
対照試料が複数の被験体から収集した放出物のデータベースである、請求項41記載の方法。
【請求項46】
組織の第1の領域が中枢神経系(CNS)、神経系、免疫系、胃腸管、肺、皮膚、肝臓、心臓血管系又は筋肉系の一部である、請求項41記載の方法。
【請求項47】
被験体の組織の第1の領域におけるカンナビノイドCB2レセプターの相対濃度を測定する方法であって、
放射性同位体を含む式Iの化合物を含んでなる医薬品組成物を被験体に投与する段階、
組織の第1の領域から放射性同位体によって放出される信号を測定する段階、及び
組織の第1の領域から放射性同位体によって放出される信号を組織の第2の領域から放射性同位体によって放出される信号と比較する段階
を含んでなる方法。
【請求項48】
被験体における疾患を診断する方法であって、
放射性同位体を含む式Iの化合物を被験体に投与する段階、
放射性同位体を含む式Iの化合物を含んでなる医薬品組成物を被験体に投与する段階、
被験体の組織の第1の領域から放射性同位体によって放出される信号を測定する段階、
被験体の組織の第2の領域から放射性同位体によって放出される信号を測定する段階、
組織の第1の領域から放射性同位体によって放出される信号を組織の第2の領域から放射性同位体によって放出される信号と比較する段階、及び
組織の第1の領域から放射性同位体によって放出される信号が組織の第2の領域から放射性同位体によって放出される信号より大きいか否かを判定する段階
を含んでなる方法。
【請求項49】
疾患が、急性及び慢性疼痛、炎症性疼痛、術後疼痛、ニューロパシー性疼痛、筋弛緩症、免疫抑制を必要とする病気又は疾患、炎症、アレルギー、緑内障、気管支拡張症、神経保護、骨粗鬆症及び骨格系の疾患、癌、神経変性疾患、アルツハイマー病、パーキンソン病(PD)、ハンティングトン病、多発性硬化症(MS)、筋肉痙攣、振顫、線維筋肉痛、狼瘡、慢性関節リウマチ、重症筋無力症、自己免疫疾患、過敏性腸症候群、間質性膀胱炎、片頭痛、掻痒症、エクセマ(excema)、脂漏症、乾癬、帯状疱疹、脳虚血、脳出血、頭蓋脳外傷、卒中、脊髄損傷、肝硬変、肝線維症、アテローム性動脈硬化症、鎮咳剤としての用途、喘息、悪心、嘔吐、胃潰瘍及び下痢からなる群から選択される、請求項48記載の方法。
【請求項50】
疾患が、多発性硬化症、慢性関節リウマチ、関節炎、全身性エリテマトーデス(SLE)、重症筋無力症、I型糖尿病、肝炎、乾癬、卒中、片頭痛、群発性頭痛、慢性変性疾患、パーキンソン病、アルツハイマー病、筋萎縮性側索硬化症、ハンティングトン舞踏病、刑務所関連神経変性、末梢性疼痛、内臓痛、ニューロパシー性疼痛、炎症性疼痛、関連痛、不整脈、高血圧、心筋虚血、筋肉痙攣、振顫、悪性脳腫瘍、皮膚腫瘍、肺腺癌、神経膠腫及び甲状腺上皮腫からなる群から選択される、請求項48記載の方法。
【請求項51】
疾患が、臓器移植での組織拒絶、吸収不良症候群、セリアック病、肺疾患、喘息、シェーグレン症候群、炎症性腸疾患及びリウマチ病からなる群から選択される免疫関連疾患である、請求項48記載の方法。
【請求項52】
CB2レセプターに関連する病気又は疾患を治療する方法であって、それを必要とする被験体を同定する段階、及び式Iの化合物の治療的に有効な量を被験体に投与する段階を含んでなる方法。
【請求項53】
病気又は疾患が、急性及び慢性疼痛、炎症性疼痛、術後疼痛、ニューロパシー性疼痛、筋弛緩症、免疫抑制を必要とする病気又は疾患、炎症、アレルギー、緑内障、気管支拡張症、神経保護、骨粗鬆症及び骨格系の疾患、癌、神経変性疾患、アルツハイマー病、パーキンソン病(PD)、ハンティングトン病、多発性硬化症(MS)、筋肉痙攣、振顫、線維筋肉痛、狼瘡、慢性関節リウマチ、重症筋無力症、自己免疫疾患、過敏性腸症候群、間質性膀胱炎、片頭痛、掻痒症、エクセマ(excema)、脂漏症、乾癬、帯状疱疹、脳虚血、脳出血、頭蓋脳外傷、卒中、脊髄損傷、肝硬変、肝線維症、アテローム性動脈硬化症、鎮咳剤としての用途、喘息、悪心、嘔吐、胃潰瘍及び下痢からなる群から選択される、請求項52記載の方法。
【請求項54】
病気又は疾患が、多発性硬化症、慢性関節リウマチ、関節炎、全身性エリテマトーデス(SLE)、重症筋無力症、I型糖尿病、肝炎、乾癬、卒中、片頭痛、群発性頭痛、慢性変性疾患、パーキンソン病、アルツハイマー病、筋萎縮性側索硬化症、ハンティングトン舞踏病、刑務所関連神経変性、末梢性疼痛、内臓痛、ニューロパシー性疼痛、炎症性疼痛、関連痛、不整脈、高血圧、心筋虚血、筋肉痙攣、振顫、悪性脳腫瘍、皮膚腫瘍、肺腺癌、神経膠腫及び甲状腺上皮腫からなる群から選択される、請求項52記載の方法。
【請求項55】
疾患が、臓器移植での組織拒絶、吸収不良症候群、セリアック病、肺疾患、喘息、シェーグレン症候群、炎症性腸疾患及びリウマチ病からなる群から選択される免疫関連疾患である、請求項52記載の方法。
【請求項56】
ポジトロン放出断層撮影法(PET)又は単光子放出コンピューター断層撮影法(SPECT)によるCB2イメージング方法であって、(a)式Iの放射性標識化合物の一定量を被験体に投与する段階、及び(b)PET又はSPECTによって被験体内における放射性標識化合物の分布を測定する段階を含んでなる方法。
【請求項57】
被験体はCB2レセプターに関連する病気又は疾患を有することが疑われる、請求項56記載の方法。
【請求項58】
病気又は疾患が、急性及び慢性疼痛、炎症性疼痛、術後疼痛、ニューロパシー性疼痛、筋弛緩症、免疫抑制を必要とする病気又は疾患、炎症、アレルギー、緑内障、気管支拡張症、神経保護、骨粗鬆症及び骨格系の疾患、癌、神経変性疾患、アルツハイマー病、パーキンソン病(PD)、ハンティングトン病、多発性硬化症(MS)、筋肉痙攣、振顫、線維筋肉痛、狼瘡、慢性関節リウマチ、重症筋無力症、自己免疫疾患、過敏性腸症候群、間質性膀胱炎、片頭痛、掻痒症、エクセマ(excema)、脂漏症、乾癬、帯状疱疹、脳虚血、脳出血、頭蓋脳外傷、卒中、脊髄損傷、肝硬変、肝線維症、アテローム性動脈硬化症、鎮咳剤としての用途、喘息、悪心、嘔吐、胃潰瘍及び下痢からなる群から選択される、請求項57記載の方法。
【請求項59】
病気又は疾患が、多発性硬化症、慢性関節リウマチ、関節炎、全身性エリテマトーデス(SLE)、重症筋無力症、I型糖尿病、肝炎、乾癬、卒中、片頭痛、群発性頭痛、慢性変性疾患、パーキンソン病、アルツハイマー病、筋萎縮性側索硬化症、ハンティングトン舞踏病、刑務所関連神経変性、末梢性疼痛、内臓痛、ニューロパシー性疼痛、炎症性疼痛、関連痛、不整脈、高血圧、心筋虚血、筋肉痙攣、振顫、悪性脳腫瘍、皮膚腫瘍、肺腺癌、神経膠腫及び甲状腺上皮腫からなる群から選択される、請求項52記載の方法。
【請求項60】
疾患が、臓器移植での組織拒絶、吸収不良症候群、セリアック病、肺疾患、喘息、シェーグレン症候群、炎症性腸疾患及びリウマチ病からなる群から選択される免疫関連疾患である、請求項57記載の方法。
【請求項61】
組織中におけるCB2レセプターの分布を決定する方法であって、式Iの放射性標識化合物を組織に投与する段階、及び組織の画像を得る段階を含んでなる方法。
【請求項62】
画像がX線フィルム上に生み出される、請求項61記載の方法。
【請求項63】
画像が崩壊放出物のパターンによって原子核乳剤上に生み出される、請求項61記載の方法。
【請求項64】
化合物がインビボで組織に投与される、請求項61記載の方法。
【請求項65】
化合物がインビトロで組織に投与される、請求項61記載の方法。
【請求項66】
下記のものから選択される化合物。
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−7−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−7−メチル−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
2−(2,6−ジクロロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−7−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)−7−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−7−メチルイミダゾ[1,2−a]ピリジン−2−イル)−3−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)イミダゾ[1,2−a]ピリジン−3−アミン、
2−(2,6−ジフルオロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)イミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−a]ピリジン−2−イル)−3−メトキシフェノール、
2−(3,5−ジクロロピリジン−4−イル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−5−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−5−メチル−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
2−(2,6−ジクロロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−5−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)−5−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−5−メチルイミダゾ[1,2−a]ピリジン−2−イル)−3−メトキシフェノール、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−6−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−6−メチル−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
2−(2,6−ジクロロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
2−(2−クロロ−6−フルオロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
2−(2,6−ジフルオロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメチルフェニル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
2−(2−クロロ−6−ニトロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−6−メチルイミダゾ[1,2−a]ピリジン−2−イル)−3−メトキシフェノール、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−8−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−8−メチル−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメチルフェニル)−8−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−8−メチルイミダゾ[1,2−a]ピリジン−2−イル)−3−メトキシフェノール、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−a]ピラジン−2−イル)−2−メトキシフェノール、
2−(2,6−ジクロロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)イミダゾ[1,2−a]ピラジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)イミダゾ[1,2−a]ピラジン−3−アミン、
2−(2,6−ジフルオロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)イミダゾ[1,2−a]ピラジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメチルフェニル)イミダゾ[1,2−a]ピラジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2−フルオロ−6−メトキシフェニル)イミダゾ[1,2−a]ピラジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−a]ピリミジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリミジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)イミダゾ[1,2−a]ピリミジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメチルフェニル)イミダゾ[1,2−a]ピリミジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−a]ピリミジン−2−イル)−3−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2−フルオロ−6−メトキシフェニル)イミダゾ[1,2−a]ピリミジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−c]ピリミジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)イミダゾ[1,2−c]ピリミジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−c]ピリミジン−2−イル)−3−メトキシフェノール、
4−(3−(ベンゾ[d][1,3]ジオキソール−5−イルアミノ)−7−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
3−(2−(2−クロロ−6−フルオロフェニル)イミダゾ[1,2−a]ピリジン−3−イルアミノ)ベンゾニトリル、
4−(3−(ベンゾ[d][1,3]ジオキソール−5−イルアミノ)イミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
N−(ベンゾ[d][1,3]ジオキソール−5−イル)−2−(2−クロロ−6−フルオロフェニル)−5−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(ベンゾ[d][1,3]ジオキソール−5−イルアミノ)−5−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
4−(3−(ベンゾ[d][1,3]ジオキソール−5−イルアミノ)−6−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
N−(ベンゾ[d][1,3]ジオキソール−5−イル)−2−(2−クロロ−6−フルオロフェニル)−8−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(3−フルオロピリジン−2−イル)−7−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−3−イル)−7−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−2−イル)−7−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(3−フルオロピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−3−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−5−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(3−フルオロピリジン−2−イル)−5−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−2−イル)−5−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−6−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(3−フルオロピリジン−2−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、及び
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−2−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン。
【請求項1】
下記式Iの化合物或いはそれの薬学的に許容される塩、エステル、アミド又はプロドラッグ。
【化1】

(式中、
a)A1、A2、A3及びA4は各々独立に炭素又は窒素であり、
b)R1は任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換された炭素環、及び任意に置換された複素環からなる群から選択され、
c)R2、R3、R4及びR5は各々独立に、水素、アルキル、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたヘテロアリサイクリル、ハロゲン、スルフェニル、スルフィニル、スルホニル、ハロアルキル、ハロアルコキシ、ペルハロアルキル、CN、C(=Z)R’、C(=Z)OR’、C(=Z)NR’R”、−C(R’)=NR’、−NR’R”、−N=CR’R”、N(R’)C(=Z)R’、N(R’)C(=Z)NR’R”、−S(O)NR’R”、−S(O)2NR’R”、N(R’)S(=O)R’、N(R’)S(=O)2R’、−OR’、−SR’及びOC(=Z)R’(式中、R’及びR”は各々独立に水素、アルキル、シクロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、及び任意に置換されたヘテロアリサイクリルからなる群から選択され、Zは酸素又は硫黄である。)からなる群から選択されるが、
A1が窒素である場合にR2は存在せず、
A2が窒素である場合にR3は存在せず、
A3が窒素である場合にR4は存在せず、
A4が窒素である場合にR5は存在しない
ことを条件とし、
d)nは1又は2である。)
【請求項2】
A1、A2、A3及びA4の3以上が炭素である、請求項1記載の化合物。
【請求項3】
A1、A2、A3及びA4の2以上が炭素である、請求項1記載の化合物。
【請求項4】
A1、A2、A3及びA4の1以上が炭素である、請求項1記載の化合物。
【請求項5】
当該化合物中の1以上の原子が放射性同位体である、請求項1記載の化合物。
【請求項6】
放射性同位体が水素、炭素、窒素、酸素又はハロゲンの同位体である、請求項5記載の化合物。
【請求項7】
ハロゲンがフッ素又はヨウ素である、請求項6記載の化合物。
【請求項8】
R1が任意に置換されたヘテロアリールである、請求項1記載の化合物。
【請求項9】
ヘテロアリールが、フラン、チオフェン、フタラジノン、ピロール、オキサゾール、チアゾール、イミダゾール、ピラゾール、イソキサゾール、イソチアゾール、トリアゾール、チアジアゾール、ピラン、ピリジン、ピリダジン、ピリミジン、ピラジン及びトリアジンからなる群から選択される、請求項8記載の化合物。
【請求項10】
ヘテロアリールがピリジル又はチオフェニルである、請求項8記載の化合物。
【請求項11】
R1が任意に置換されたアリールである、請求項1記載の化合物。
【請求項12】
アリールがフェニルである、請求項11記載の化合物。
【請求項13】
R1が下記式の基である、請求項1記載の化合物。
【化2】

(式中、
R11、R12、R13、R14及びR15は各々独立に、水素、アルキル、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたヘテロアリサイクリル、ハロゲン、スルフェニル、スルフィニル、スルホニル、ハロアルキル、ハロアルコキシ、ペルハロアルキル、CN、C(=Z)R’、C(=Z)OR’、C(=Z)NR’R”、−C(R’)=NR’、−NR’R”、−N=CR’R”、N(R’)C(=Z)R’、N(R’)C(=Z)NR’R”、−S(O)NR’R”、−S(O)2NR’R”、N(R’)S(=O)R’、N(R’)S(=O)2R’、−OR’、−SR’及びOC(=Z)R’(式中、R’及びR”は各々独立に水素、アルキル、シクロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、及び任意に置換されたヘテロアリサイクリルからなる群から選択され、Zは酸素又は硫黄である。)からなる群から選択されるか、或いは
R11及びR12はこれらが結合している炭素原子と一緒になって、又はR12及びR13はこれらが結合している炭素原子と一緒になって、又はR13及びR14はこれらが結合している炭素原子と一緒になって、又はR14及びR15はこれらが結合している炭素原子と一緒になって、五員若しくは六員の任意に置換された炭素環又は任意に置換された複素環を形成し、或いは六員の任意に置換されたアリール又は任意に置換されたヘテロアリールを形成する。)
【請求項14】
アルキルがメチル、エチル、n−プロピル、イソプロピル、n−ブチル、sec−ブチル、tert−ブチル及びメチレンシクロプロピルからなる群から選択される、請求項13記載の化合物。
【請求項15】
アルコキシがメトキシ、エトキシ、n−プロポキシ、イソプロポキシ、n−ブトキシ、sec−ブトキシ及びtert−ブトキシからなる群から選択される、請求項13記載の化合物。
【請求項16】
ハロがフルオロ、クロロ、ブロモ及びヨードからなる群から選択される、請求項13記載の化合物。
【請求項17】
フルオロが放射性同位体である、請求項16記載の化合物。
【請求項18】
R1が下記式の基である、請求項1記載の化合物。
【化3】

(式中、
a)B1、B2、B3、B4、B5及びB6は各々独立に炭素、硫黄、酸素及び窒素からなる群から選択され、
b)B7、B8、B9、B10及びB11は各々独立に炭素、硫黄、酸素及び窒素からなる群から選択され、
c)R16、R17、R18、R19及びR20は各々独立に、水素、アルキル、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたヘテロアリサイクリル、ハロゲン、スルフェニル、スルフィニル、スルホニル、ハロアルキル、ハロアルコキシ、ペルハロアルキル、CN、C(=Z)R’、C(=Z)OR’、C(=Z)NR’R”、−C(R’)=NR’、−NR’R”、−N=CR’R”、N(R’)C(=Z)R’、N(R’)C(=Z)NR’R”、−S(O)NR’R”、−S(O)2NR’R”、N(R’)S(=O)R’、N(R’)S(=O)2R’、−OR’、−SR’及びOC(=Z)R’(式中、R’及びR”は各々独立に水素、アルキル、シクロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、及び任意に置換されたヘテロアリサイクリルからなる群から選択され、Zは酸素又は硫黄である。)からなる群から選択されるか、或いは
R16及びR17はこれらが結合している炭素原子と一緒になって、又はR17及びR18はこれらが結合している炭素原子と一緒になって、又はR18及びR19はこれらが結合している炭素原子と一緒になって、又はR19及びR20はこれらが結合している炭素原子と一緒になって、五員若しくは六員の任意に置換された炭素環又は任意に置換された複素環を形成し、或いは六員の任意に置換されたアリール又は任意に置換されたヘテロアリールを形成するが、
B2が炭素でない場合にR16は存在せず、
B3が炭素でない場合にR17は存在せず、
B4が炭素でない場合にR18は存在せず、
B5が炭素でない場合にR19は存在せず、
B6が炭素でない場合にR20は存在しない
ことを条件とし、
d)R21、R22、R23及びR24は各々独立に、水素、アルキル、アルケニル、アルキニル、シクロアルキル、シクロアルケニル、任意に置換されたアリール、任意に置換されたヘテロアリール、任意に置換されたヘテロアリサイクリル、ハロゲン、スルフェニル、スルフィニル、スルホニル、ハロアルキル、ハロアルコキシ、ペルハロアルキル、CN、C(=Z)R’、C(=Z)OR’、C(=Z)NR’R”、−C(R’)=NR’、−NR’R”、−N=CR’R”、N(R’)C(=Z)R’、N(R’)C(=Z)NR’R”、−S(O)NR’R”、−S(O)2NR’R”、N(R’)S(=O)R’、N(R’)S(=O)2R’、−OR’、−SR’及びOC(=Z)R’(式中、R’及びR”は各々独立に水素、アルキル、シクロアルキル、任意に置換されたアリール、任意に置換されたヘテロアリール、及び任意に置換されたヘテロアリサイクリルからなる群から選択され、Zは酸素又は硫黄である。)からなる群から選択されるか、或いは
R21及びR22はこれらが結合している炭素原子と一緒になって、又はR22及びR23はこれらが結合している炭素原子と一緒になって、又はR23及びR24はこれらが結合している炭素原子と一緒になって、五員若しくは六員の任意に置換された炭素環又は任意に置換された複素環を形成し、或いは六員の任意に置換されたアリール又は任意に置換されたヘテロアリールを形成するが、
B8が炭素でない場合にR21は存在せず、
B9が炭素でない場合にR22は存在せず、
B10が炭素でない場合にR23は存在せず、
B11が炭素でない場合にR24は存在しない
ことを条件とする。)
【請求項19】
B1、B2、B3、B4、B5及びB6の3以上が炭素である、請求項18記載の化合物。
【請求項20】
B1、B2、B3、B4、B5及びB6の2以上が炭素である、請求項18記載の化合物。
【請求項21】
B1、B2、B3、B4、B5及びB6の1以上が炭素である、請求項18記載の化合物。
【請求項22】
B7、B8、B9、B10及びB11の3以上が炭素である、請求項18記載の化合物。
【請求項23】
B7、B8、B9、B10及びB11の2以上が炭素である、請求項18記載の化合物。
【請求項24】
B7、B8、B9、B10及びB11の1以上が炭素である、請求項18記載の化合物。
【請求項25】
R1が下記のものからなる群から選択される、請求項13記載の化合物。
【化4】

【化5】

【請求項26】
A1が窒素であり、A2、A3及びA4が炭素である、請求項1記載の化合物。
【請求項27】
A2が窒素であり、A1、A3及びA4が炭素である、請求項1記載の化合物。
【請求項28】
R2、R3、R4及びR5が各々独立にアルキルであり、該アルキルがメチル、エチル、n−プロピル、イソプロピル、n−ブチル、sec−ブチル、tert−ブチル及びメチレンシクロプロピルからなる群から選択される、請求項1記載の化合物。
【請求項29】
R2、R3、R4及びR5が各々独立にハロであり、該ハロがフルオロ、クロロ、ブロモ及びヨードからなる群から選択される、請求項1記載の化合物。
【請求項30】
フルオロが放射性同位体である、請求項29記載の化合物。
【請求項31】
式
【化6】

の部分が下記のものからなる群から選択される、請求項1記載の化合物。
【化7】

【化8】

【請求項32】
当該化合物がCR−1ないしCR−130及びCR−132ないしCR−136からなる群から選択される、請求項1記載の化合物。
【請求項33】
カンナビノイドCB2レセプターの活性を調節する方法であって、式Iの化合物をカンナビノイドCB2レセプターに接触させることを含んでなる方法。
【請求項34】
式Iの化合物がカンナビノイドCB1レセプターに比べてカンナビノイドCB2レセプターに優先的に結合する、請求項33記載の方法。
【請求項35】
カンナビノイドCB2レセプター活性がインビトロで調節される、請求項33記載の方法。
【請求項36】
カンナビノイドCB2レセプター活性がインビボで調節される、請求項33記載の方法。
【請求項37】
式Iの化合物がカンナビノイドCB2レセプターのアゴニストである、請求項33記載の方法
【請求項38】
式Iの化合物がカンナビノイドCB2レセプターのアンタゴニストである、請求項33記載の方法
【請求項39】
式Iの化合物がカンナビノイドCB2レセプターの部分アゴニストである、請求項33記載の方法
【請求項40】
式Iの化合物がカンナビノイドCB2レセプターの逆アゴニストである、請求項33記載の方法
【請求項41】
被験体の組織の第1の領域のインビボイメージングを行う方法であって、
放射性同位体を含む式Iの化合物を含んでなる医薬品組成物を被験体に投与する段階、
組織の第1の領域から放射性同位体によって放出される信号を測定する段階、及び
組織の第1の領域から放出される信号の量を対照試料から放出される信号の量と比較する段階
を含んでなる方法。
【請求項42】
対照試料が被験体の内部にある、請求項41記載の方法。
【請求項43】
対照試料が類似の組織又は同じ組織の第2の領域である、請求項42記載の方法。
【請求項44】
対照試料が被験体の外部にある、請求項41記載の方法。
【請求項45】
対照試料が複数の被験体から収集した放出物のデータベースである、請求項41記載の方法。
【請求項46】
組織の第1の領域が中枢神経系(CNS)、神経系、免疫系、胃腸管、肺、皮膚、肝臓、心臓血管系又は筋肉系の一部である、請求項41記載の方法。
【請求項47】
被験体の組織の第1の領域におけるカンナビノイドCB2レセプターの相対濃度を測定する方法であって、
放射性同位体を含む式Iの化合物を含んでなる医薬品組成物を被験体に投与する段階、
組織の第1の領域から放射性同位体によって放出される信号を測定する段階、及び
組織の第1の領域から放射性同位体によって放出される信号を組織の第2の領域から放射性同位体によって放出される信号と比較する段階
を含んでなる方法。
【請求項48】
被験体における疾患を診断する方法であって、
放射性同位体を含む式Iの化合物を被験体に投与する段階、
放射性同位体を含む式Iの化合物を含んでなる医薬品組成物を被験体に投与する段階、
被験体の組織の第1の領域から放射性同位体によって放出される信号を測定する段階、
被験体の組織の第2の領域から放射性同位体によって放出される信号を測定する段階、
組織の第1の領域から放射性同位体によって放出される信号を組織の第2の領域から放射性同位体によって放出される信号と比較する段階、及び
組織の第1の領域から放射性同位体によって放出される信号が組織の第2の領域から放射性同位体によって放出される信号より大きいか否かを判定する段階
を含んでなる方法。
【請求項49】
疾患が、急性及び慢性疼痛、炎症性疼痛、術後疼痛、ニューロパシー性疼痛、筋弛緩症、免疫抑制を必要とする病気又は疾患、炎症、アレルギー、緑内障、気管支拡張症、神経保護、骨粗鬆症及び骨格系の疾患、癌、神経変性疾患、アルツハイマー病、パーキンソン病(PD)、ハンティングトン病、多発性硬化症(MS)、筋肉痙攣、振顫、線維筋肉痛、狼瘡、慢性関節リウマチ、重症筋無力症、自己免疫疾患、過敏性腸症候群、間質性膀胱炎、片頭痛、掻痒症、エクセマ(excema)、脂漏症、乾癬、帯状疱疹、脳虚血、脳出血、頭蓋脳外傷、卒中、脊髄損傷、肝硬変、肝線維症、アテローム性動脈硬化症、鎮咳剤としての用途、喘息、悪心、嘔吐、胃潰瘍及び下痢からなる群から選択される、請求項48記載の方法。
【請求項50】
疾患が、多発性硬化症、慢性関節リウマチ、関節炎、全身性エリテマトーデス(SLE)、重症筋無力症、I型糖尿病、肝炎、乾癬、卒中、片頭痛、群発性頭痛、慢性変性疾患、パーキンソン病、アルツハイマー病、筋萎縮性側索硬化症、ハンティングトン舞踏病、刑務所関連神経変性、末梢性疼痛、内臓痛、ニューロパシー性疼痛、炎症性疼痛、関連痛、不整脈、高血圧、心筋虚血、筋肉痙攣、振顫、悪性脳腫瘍、皮膚腫瘍、肺腺癌、神経膠腫及び甲状腺上皮腫からなる群から選択される、請求項48記載の方法。
【請求項51】
疾患が、臓器移植での組織拒絶、吸収不良症候群、セリアック病、肺疾患、喘息、シェーグレン症候群、炎症性腸疾患及びリウマチ病からなる群から選択される免疫関連疾患である、請求項48記載の方法。
【請求項52】
CB2レセプターに関連する病気又は疾患を治療する方法であって、それを必要とする被験体を同定する段階、及び式Iの化合物の治療的に有効な量を被験体に投与する段階を含んでなる方法。
【請求項53】
病気又は疾患が、急性及び慢性疼痛、炎症性疼痛、術後疼痛、ニューロパシー性疼痛、筋弛緩症、免疫抑制を必要とする病気又は疾患、炎症、アレルギー、緑内障、気管支拡張症、神経保護、骨粗鬆症及び骨格系の疾患、癌、神経変性疾患、アルツハイマー病、パーキンソン病(PD)、ハンティングトン病、多発性硬化症(MS)、筋肉痙攣、振顫、線維筋肉痛、狼瘡、慢性関節リウマチ、重症筋無力症、自己免疫疾患、過敏性腸症候群、間質性膀胱炎、片頭痛、掻痒症、エクセマ(excema)、脂漏症、乾癬、帯状疱疹、脳虚血、脳出血、頭蓋脳外傷、卒中、脊髄損傷、肝硬変、肝線維症、アテローム性動脈硬化症、鎮咳剤としての用途、喘息、悪心、嘔吐、胃潰瘍及び下痢からなる群から選択される、請求項52記載の方法。
【請求項54】
病気又は疾患が、多発性硬化症、慢性関節リウマチ、関節炎、全身性エリテマトーデス(SLE)、重症筋無力症、I型糖尿病、肝炎、乾癬、卒中、片頭痛、群発性頭痛、慢性変性疾患、パーキンソン病、アルツハイマー病、筋萎縮性側索硬化症、ハンティングトン舞踏病、刑務所関連神経変性、末梢性疼痛、内臓痛、ニューロパシー性疼痛、炎症性疼痛、関連痛、不整脈、高血圧、心筋虚血、筋肉痙攣、振顫、悪性脳腫瘍、皮膚腫瘍、肺腺癌、神経膠腫及び甲状腺上皮腫からなる群から選択される、請求項52記載の方法。
【請求項55】
疾患が、臓器移植での組織拒絶、吸収不良症候群、セリアック病、肺疾患、喘息、シェーグレン症候群、炎症性腸疾患及びリウマチ病からなる群から選択される免疫関連疾患である、請求項52記載の方法。
【請求項56】
ポジトロン放出断層撮影法(PET)又は単光子放出コンピューター断層撮影法(SPECT)によるCB2イメージング方法であって、(a)式Iの放射性標識化合物の一定量を被験体に投与する段階、及び(b)PET又はSPECTによって被験体内における放射性標識化合物の分布を測定する段階を含んでなる方法。
【請求項57】
被験体はCB2レセプターに関連する病気又は疾患を有することが疑われる、請求項56記載の方法。
【請求項58】
病気又は疾患が、急性及び慢性疼痛、炎症性疼痛、術後疼痛、ニューロパシー性疼痛、筋弛緩症、免疫抑制を必要とする病気又は疾患、炎症、アレルギー、緑内障、気管支拡張症、神経保護、骨粗鬆症及び骨格系の疾患、癌、神経変性疾患、アルツハイマー病、パーキンソン病(PD)、ハンティングトン病、多発性硬化症(MS)、筋肉痙攣、振顫、線維筋肉痛、狼瘡、慢性関節リウマチ、重症筋無力症、自己免疫疾患、過敏性腸症候群、間質性膀胱炎、片頭痛、掻痒症、エクセマ(excema)、脂漏症、乾癬、帯状疱疹、脳虚血、脳出血、頭蓋脳外傷、卒中、脊髄損傷、肝硬変、肝線維症、アテローム性動脈硬化症、鎮咳剤としての用途、喘息、悪心、嘔吐、胃潰瘍及び下痢からなる群から選択される、請求項57記載の方法。
【請求項59】
病気又は疾患が、多発性硬化症、慢性関節リウマチ、関節炎、全身性エリテマトーデス(SLE)、重症筋無力症、I型糖尿病、肝炎、乾癬、卒中、片頭痛、群発性頭痛、慢性変性疾患、パーキンソン病、アルツハイマー病、筋萎縮性側索硬化症、ハンティングトン舞踏病、刑務所関連神経変性、末梢性疼痛、内臓痛、ニューロパシー性疼痛、炎症性疼痛、関連痛、不整脈、高血圧、心筋虚血、筋肉痙攣、振顫、悪性脳腫瘍、皮膚腫瘍、肺腺癌、神経膠腫及び甲状腺上皮腫からなる群から選択される、請求項52記載の方法。
【請求項60】
疾患が、臓器移植での組織拒絶、吸収不良症候群、セリアック病、肺疾患、喘息、シェーグレン症候群、炎症性腸疾患及びリウマチ病からなる群から選択される免疫関連疾患である、請求項57記載の方法。
【請求項61】
組織中におけるCB2レセプターの分布を決定する方法であって、式Iの放射性標識化合物を組織に投与する段階、及び組織の画像を得る段階を含んでなる方法。
【請求項62】
画像がX線フィルム上に生み出される、請求項61記載の方法。
【請求項63】
画像が崩壊放出物のパターンによって原子核乳剤上に生み出される、請求項61記載の方法。
【請求項64】
化合物がインビボで組織に投与される、請求項61記載の方法。
【請求項65】
化合物がインビトロで組織に投与される、請求項61記載の方法。
【請求項66】
下記のものから選択される化合物。
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−7−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−7−メチル−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
2−(2,6−ジクロロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−7−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)−7−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−7−メチルイミダゾ[1,2−a]ピリジン−2−イル)−3−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)イミダゾ[1,2−a]ピリジン−3−アミン、
2−(2,6−ジフルオロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)イミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−a]ピリジン−2−イル)−3−メトキシフェノール、
2−(3,5−ジクロロピリジン−4−イル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−5−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−5−メチル−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
2−(2,6−ジクロロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−5−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)−5−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−5−メチルイミダゾ[1,2−a]ピリジン−2−イル)−3−メトキシフェノール、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−6−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−6−メチル−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
2−(2,6−ジクロロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
2−(2−クロロ−6−フルオロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
2−(2,6−ジフルオロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメチルフェニル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
2−(2−クロロ−6−ニトロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−6−メチルイミダゾ[1,2−a]ピリジン−2−イル)−3−メトキシフェノール、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−8−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−8−メチル−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメチルフェニル)−8−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−8−メチルイミダゾ[1,2−a]ピリジン−2−イル)−3−メトキシフェノール、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−a]ピラジン−2−イル)−2−メトキシフェノール、
2−(2,6−ジクロロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)イミダゾ[1,2−a]ピラジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)イミダゾ[1,2−a]ピラジン−3−アミン、
2−(2,6−ジフルオロフェニル)−N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)イミダゾ[1,2−a]ピラジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメチルフェニル)イミダゾ[1,2−a]ピラジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2−フルオロ−6−メトキシフェニル)イミダゾ[1,2−a]ピラジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−a]ピリミジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(ピリジン−2−イル)イミダゾ[1,2−a]ピリミジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)イミダゾ[1,2−a]ピリミジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメチルフェニル)イミダゾ[1,2−a]ピリミジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−a]ピリミジン−2−イル)−3−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2−フルオロ−6−メトキシフェニル)イミダゾ[1,2−a]ピリミジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−c]ピリミジン−2−イル)−2−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(2,6−ジメトキシフェニル)イミダゾ[1,2−c]ピリミジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−c]ピリミジン−2−イル)−3−メトキシフェノール、
4−(3−(ベンゾ[d][1,3]ジオキソール−5−イルアミノ)−7−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
3−(2−(2−クロロ−6−フルオロフェニル)イミダゾ[1,2−a]ピリジン−3−イルアミノ)ベンゾニトリル、
4−(3−(ベンゾ[d][1,3]ジオキソール−5−イルアミノ)イミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
N−(ベンゾ[d][1,3]ジオキソール−5−イル)−2−(2−クロロ−6−フルオロフェニル)−5−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(ベンゾ[d][1,3]ジオキソール−5−イルアミノ)−5−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
4−(3−(ベンゾ[d][1,3]ジオキソール−5−イルアミノ)−6−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
N−(ベンゾ[d][1,3]ジオキソール−5−イル)−2−(2−クロロ−6−フルオロフェニル)−8−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(3−フルオロピリジン−2−イル)−7−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−3−イル)−7−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−2−イル)−7−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)イミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(3−フルオロピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−3−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−2−イル)イミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−5−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(3−フルオロピリジン−2−イル)−5−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−2−イル)−5−メチルイミダゾ[1,2−a]ピリジン−3−アミン、
4−(3−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イルアミノ)−6−メチルイミダゾ[1,2−a]ピリジン−2−イル)−2−フルオロ−6−メトキシフェノール、
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(3−フルオロピリジン−2−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン、及び
N−(2,3−ジヒドロベンゾ[b][1,4]ジオキシン−6−イル)−2−(6−フルオロピリジン−2−イル)−6−メチルイミダゾ[1,2−a]ピリジン−3−アミン。
【公表番号】特表2010−526836(P2010−526836A)
【公表日】平成22年8月5日(2010.8.5)
【国際特許分類】
【出願番号】特願2010−507716(P2010−507716)
【出願日】平成20年5月9日(2008.5.9)
【国際出願番号】PCT/US2008/063343
【国際公開番号】WO2008/141249
【国際公開日】平成20年11月20日(2008.11.20)
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
【公表日】平成22年8月5日(2010.8.5)
【国際特許分類】
【出願日】平成20年5月9日(2008.5.9)
【国際出願番号】PCT/US2008/063343
【国際公開番号】WO2008/141249
【国際公開日】平成20年11月20日(2008.11.20)
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
[ Back to top ]

