Fターム[2G043BA16]の内容
蛍光又は発光による材料の調査、分析 (54,565) | 検出物質 (3,793) | 生体関連物質(例;蛋白質) (2,552)
Fターム[2G043BA16]に分類される特許
2,461 - 2,480 / 2,552
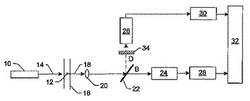
蛍光顕微鏡装置
本発明は、それを用いてサンプル(20)内にある磁気及び/又は電気感受性蛍光マーカ(21)の空間分布が決められる顕微鏡装置及び方法に関する。蛍光放射線(VF)は、サンプル(20)内の一次放射線(VE)により励起し、顕微鏡により撮像される。同時にサンプル(20)内において、空間的に不均一な磁場及び/又は電場(33)が発生し、これは例えば最小の場の強度の小さな焦点領域(22)を持つ。蛍光放射線の放出は、この焦点領域(22)において局所的に変更され、測定される強度分布(IFM)で観察されることができる。このようにして、顕微鏡の光学解像度よりも下のサイズを持つ領域(22)にある蛍光マーカ(21)の分布でさえも再現される。 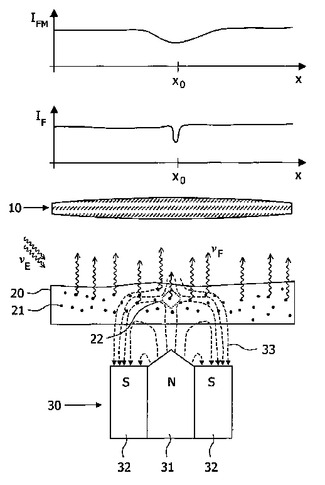 (もっと読む)
(もっと読む)
動的表面生成及び画像化を使用する、生物学的及び化学的物質の検出のためのシステム、方法、及び試薬
本発明は、溶液相/懸濁液相の分析フォーマットの利益と固相/側方流動の分析の簡易性を結合した検体の高感度検出技術を記載する。当該分析は、固形支持体としての磁性微粒子を使用して溶液相/懸濁相において実施され得る。続いて、磁性分離が、当該溶液の残留物から検体を分離するために実施され得る。洗浄ステップ後、蛍光シグナルは、磁性粒子表面から直接読み取られ得る。本発明は、蛍光ポリマー超消滅を使用するポータブルバイオ検出システム、及びそれとともに病原体の検出方法もまた記載する。  (もっと読む)
(もっと読む)
測定システムの1つ以上のパラメータを変更するための方法
測定システムの1つ以上のパラメータを変更する方法が提供される。1つの方法には、システムを利用して、試料を分析し、システムの分類チャネルから、試料中の粒子集団に関する値を生成するステップが含まれる。この方法には、その集団に関する値が位置する、分類空間内の領域を識別するステップも含まれる。さらに、この方法は、その領域の1つ以上の特性を利用して、その集団に関する最適化分類領域を決定するステップも含まれる。この最適化分類領域には、所定のパーセンテージの前記集団に関する値が含まれる。最適化分類領域は、追加試料中の粒子の分類に利用される。 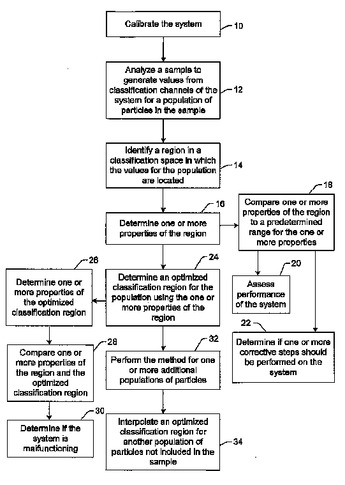 (もっと読む)
(もっと読む)
光学式画像化とポイント蛍光分光学とを組み合わせたインビボ医療診断のためのマイクロスケールコンパクトデバイス
【課題】生体細胞および生体組織の画像および蛍光データを得るためのUV源および蛍光検出器を含めた画像形成装置を含む輸送カプセルを使うことによって、ガン性および前ガン性の細胞を含めた異常細胞の存在を医師が検出するための方法および装置を提供すること。
【解決手段】本方法は、以下の工程を含む:蛍光データを得るために紫外線(UV)光源を使って生体組織を走査する工程;蛍光データおよび/または画像をラジオ高周波(RF)また他の適切な手段を使ってパーソナルコンピューター(PC)システムに転送する工程;PCにおいて画像および/または蛍光データを分析する工程;組織を前ガン細胞およびガン細胞と識別する工程;および必要に応じて、それらの正確な場所を決定し、そして計算された蛍光画像の正確さを評価する工程。
(もっと読む)
集積されたエミッションサイトを有するタンパク質インプリントポリマー
本発明は、タンパク質またはポリペプチドアナライトの存在を検出するための集積されたエミッションサイトを有するタンパク質またはポリペプチドインプリントポリマー(PIPIES)であって、アナライトに特異的な鋳型サイトを含むものを提供する。鋳型サイトに、またはその付近に、レポーター分子が選択的に配置される。PIPIESの調製のための方法およびアナライトの検出のためのその使用がさらに開示される。 (もっと読む)
生物学的サンプルにおける蛍光検出のための装置および方法
標本に起因するのではなく光学系に起因する発光の不均一性が、特殊な光学素子を使用することによって補正される、生物学的サンプルの蛍光検出のための装置および方法。この装置は、光源(105)を備え、この光源は、二色性ビームスプリッタ(110)を照射し、この二色性ビームスプリッタは、第一の光学素子(130)を通して、サンプル(122)のトレイを備えるサンプル領域(120)へと励起光を反射させる。この発光は、第一の光学素子(130)およびビームスプリッタ(110)を通り、検出器(125)へと再指向される。第一の光学素子(130)は、この発光を平行化し、そしてこの発光の不均一性を低下させる。 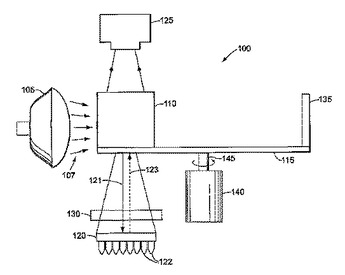 (もっと読む)
(もっと読む)
ダイナミックレンジを拡大する方法及びシステム
システムのダイナミックレンジの拡大の方法及びシステムを提供する。1つの方法は、粒子によって放射された蛍光を異なる強度を有する多重光路に分割し、多重信号を発生するための種々のチャネルを用いて多重光路内の蛍光を検出し、チャネルのどれがリニア範囲で動作しているかを多重信号に基づいて判定する。本方法は、異なる強度に対して補正するためにリニア範囲で動作中のチャネルによって発生された信号を変更する。別の方法は、異なる強度を有する光で多重照射域の粒子を照射し、多重信号を発生させるための多重照射域に位置している間に粒子によって放射された蛍光を別個に検出する。本方法は、信号のいずれがリニア範囲に位置するかを判定し、異なる強度に対して補正するためにリニア範囲にある信号を変更する。 (もっと読む)
網膜毒性のスクリーニング法
本発明は、蛍光検出可能なαvβ3及びαvβ5インテグリン特異的な作用物質及び網膜色素上皮細胞を用いる、被験物質を特徴付けする方法に関する。本発明はさらに、網膜色素上皮由来の細胞、インテグリンマーカー及び包装材料を含むキットに関する。 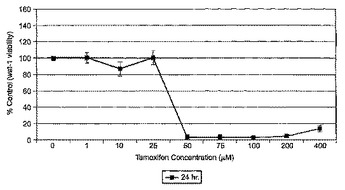 (もっと読む)
(もっと読む)
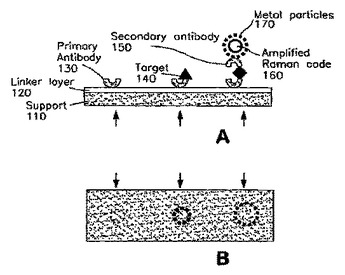
生体試料をアッセイするためにラマン活性プローブ構築物を使用するための方法および装置
体液中のタンパク質含有分析物などの生体試料中の分析物を検出するためのラマン活性またはSERS活性プローブ構築物を使用する種々の方法が提供される。本発明の方法が、試料中のタンパク質含有分析物または断片のアミノ酸組成についての情報を提供できるように、ラマン活性構築物におけるプローブ部分は、生体試料中の特定の公知の分析物に結合し、同定するように選択されるか、またはプローブ部分は、一定のアミノ酸に共通に見いだされる官能基と化学的に相互作用するようにデザインされる。患者試料のタンパク質プロフィールを作製することができるように、場合によっては、ラマン活性またはSERS活性プローブ構築物は、本発明の方法に使用したときに、特定のタンパク質含有分析物またはこのような分析物の型を同定することができる。ラマンのデータベースまたは正常な試料のSERSスペクトルと比較したときに、開示された方法を使用して患者の疾病状態を同定することができる。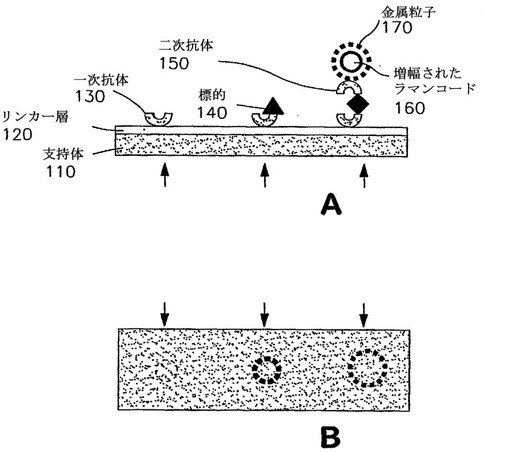
 (もっと読む)
(もっと読む)
多孔性バイオセンサーおよびラマン分光法を用いる生体分子の検出
本発明は、カスケードラマンセンシングによって、血清のような生体試料の内容物を分析するために用いられる方法を提供する。公知の分析物に対して特異的に結合するプローブを有する、蛍光を発生させるナノ多孔性バイオセンサーを、生体試料に接触させて、多孔性の半導体構造に共役させた一つまたはそれ以上の結合複合体を形成する。結合した複合体を、結合複合体に特異的に結合するラマン活性プローブに接触させて、バイオセンサーに光を照射するとバイオセンサーからの蛍光放出が得られる。これらの蛍光の放出は結合複合体からのラマンシグナルを生成する。結合複合体から生成されたラマンシグナルを検出して、結合したタンパク質含有分析物に関連するラマンシグナルが、試料中のタンパク質含有化合物の存在を示している。本発明の方法は、患者の試料のタンパク質プロフィールを提供するために有用である。本発明はまた、本発明の方法を実践するために有用な検出系を提供する。 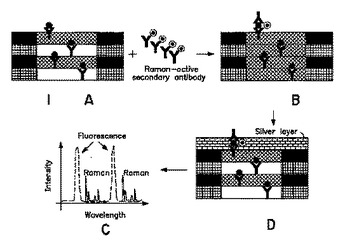 (もっと読む)
(もっと読む)
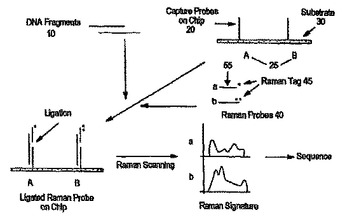
ヌクレオチド配列情報決定法
オリゴヌクレオチド・プローブのラマン・サインの検出に基づく核酸配列決定法が本発明において提供される。ラマン標識又は正の電荷を有するエンハンサーにより任意で標識された個々に捕獲された核酸プローブのラマン・サインが検出される。捕獲されたプローブの配列は、捕獲されたプローブ及び相補的な標的核酸のヌクレオチド配列を同定するために使用され、次いで、それが整列化され、核酸配列情報を入手するために使用される。もう一つの態様において、標的核酸に結合する標識されたオリゴヌクレオチド・プローブ(標識されたオリゴヌクレオチド・プローブは、第一標識及び第二標識を含んでおり、第一標識は、第二標識の光学的特性に影響を与えることができる)との標的核酸の結合を利用する、標的核酸の標的ヌクレオチド位置におけるヌクレオチド存在を決定するための方法が提供される。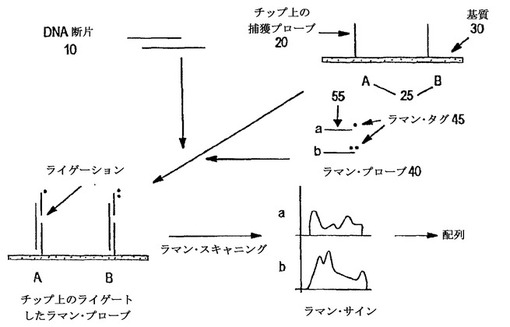
 (もっと読む)
(もっと読む)
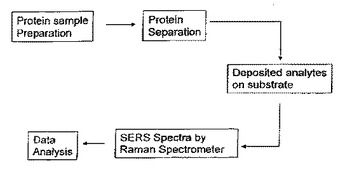
ラマン分光法を使用して生物試料のタンパク質プロファイルを得る方法
本発明は、例えば、特定の個人によって提供される試料のタンパク質プロファイルを得るために、生物試料のタンパク質含有量を分析するための方法を提供する。試料中のタンパク質およびタンパク質断片を化学的および/または物理的特性に基づいて分離し、固体基板上または流動中の液体の流れの離散的な位置に分離された状態で維持する。次いで、離散的な位置からのスペクトルが、離散的な位置の1つ以上の特定のタンパク質または断片の構造または識別についての情報を提供するように、離散的な位置において分離された状態のタンパク質または断片によって形成されるのでラマンスペクトルが検出される。離散的な位置のタンパク質または断片は、金または銀などの金属をコーティングされてもよいおよび/または分離されたタンパク質は、SERSスペクトルを提供するように化学的エンハンサーと接触されてもよい。本発明を実施する方法およびキットも提供されている。
 (もっと読む)
(もっと読む)
分子複製中のヌクレオチドの取り込みのラマン・モニタリングによる核酸配列決定
本明細書に開示された方法および装置は、ヌクレオチド、ヌクレオシド、および塩基の検出、ならびに核酸配列決定のために有用である。本方法は、表面増強ラマン分光法(SERS)を使用した、ヌクレオチド、ヌクレオシド、または塩基の検出を含む。検出は、核酸配列決定反応のような核酸重合反応の間のデオキシヌクレオチド三リン酸の取り込みを検出する核酸配列決定反応の一部であり得る。合成された新生鎖の核酸配列および鋳型鎖の相補配列が、重合反応の間のヌクレオチドの取り込みの順序を追跡することにより決定され得る。 (もっと読む)
分子複製中のヌクレオチドの取り込みのラマン・モニタリングによる核酸配列決定
本明細書に開示された方法および装置は、ヌクレオチド、ヌクレオシド、および塩基の検出、ならびに核酸配列決定のために有用である。本方法は、表面増強ラマン分光法(SERS)または表面増強コヒーレント・アンチ・ストークス・ラマン分光法(SECARS)を使用した、ヌクレオチド、ヌクレオシド、または塩基の検出を含む。検出は、核酸配列決定反応のような核酸重合反応の間のデオキシヌクレオチド三リン酸の取り込みを検出する核酸配列決定反応の一部であり得る。合成された新生鎖の核酸配列および鋳型鎖の相補配列が、重合反応の間のヌクレオチドの取り込みの順序を追跡することにより決定され得る。塩基を糖部分から切断することによるヌクレオチドまたはヌクレオシドのSERSシグナルを増強する方法が提供される。さらに、単一塩基の繰り返しを検出する方法が提供される。 (もっと読む)
蛍光測定器
試料表面において蛍光を生成し検出する装置で、試料表面より上の装置の高さが低減され、反射損および光散乱から生じる放出された蛍光の損失が最小にされる。装置は、光源(32)から横方向にその元の経路へ光を誘導し、試料表面またはその下にある照明ゾーン(30)上へその光を合焦する、3次元の湾曲した光反射表面(40)を含む。反射表面(40)は、さらに放出された蛍光を集光し誘導し少なくとも部分的に平行化して、横方向にその元の経路へおよび検出器(46)へ送る。 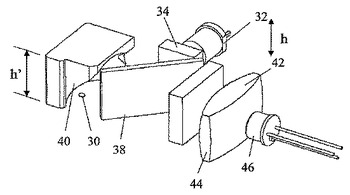 (もっと読む)
(もっと読む)
光学分析系、血液分析系、及び主成分の振幅を決定する方法
光学分析系(20)は、光信号の主成分の振幅を決定するように、配置される。その光学分析系(20)は、スペクトルの重み付けの関数によってその光信号を重み付けするための多変量光学素子(5,6)及びその重み付けされた光信号を検出するための検出器(7,8)を含む。その光信号は、その主成分及びそのスペクトルの重み付けの関数を設計するとき占められなかったさらなる成分を含む。従って、その検出された重み付けされた光信号は、その主成分の振幅に関係する部分及びそのさらなる成分のさらなる振幅に関係するさらなる部分を含む。その光学分析系(20)は、その検出された重み付けされた光信号を変調するための変調器素子(13)をさらに含む。その変調された検出された重み付けされた光信号とその検出された重み付けされた光信号との間の差は、その主成分の振幅に関係すると共に、このように、正確な方式でその主成分の振幅を決定することを許容する。血液分析系(40)は、このような光学分析系(20)を含む。主成分の振幅を決定する方法は、その光学分析系(20)を使用する。 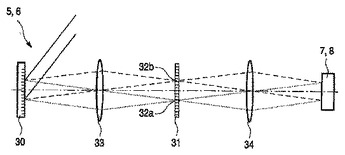 (もっと読む)
(もっと読む)
エネルギー移動に基づく光ナノワイヤバイオセンサ
本発明は、生体分子検出のためのナノワイヤの光特性の使用に関する。ナノワイヤを用いることの利点は、受容体分子と結合する高い比表面積、及び、担体の強い量子閉じ込めに起因する、大きさに依存する光特性である。即ち、異なった直径を持つナノワイヤは異なった色を示す。提案された変換機構は、生体分子からナノワイヤへのエネルギー移動又はその逆方向のエネルギー移動に基づく。 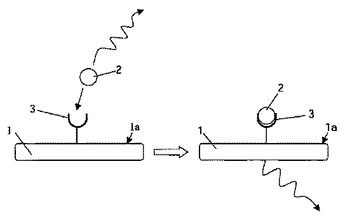 (もっと読む)
(もっと読む)
表面増強ラマン分光法(SERS)活性複合体ナノ粒子、前記の製造の方法及び前記の使用の方法
ナノ粒子、これを準備する方法及びナノ粒子の実施形態を使用してターゲット分子を検出する方法が開示される。例示するナノ粒子の一つの実施形態は、とりわけ、表面増強ラマン分光法活性複合体ナノ構造を含む。表面増強ラマン分光法活性複合体ナノ構造は、コアと、少なくとも一つのレポーター分子と、カプセル化物質を含む。レポーター分子は、コアに結合されている。レポーター分子は、イソチオシアン酸塩染料、多硫化有機染料、多ヘテロ硫化有機染料、ベンゾトリアゾール染料及びこれらの組み合わせから選択される。カプセル化物質はコア及びレポーター分子の上に配置される。カプセル化物質によるカプセル化の後に、レポーター分子は測定可能な表面増強ラマン分光法形跡を有する。 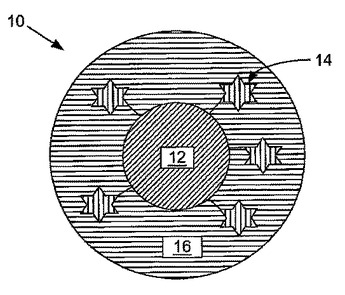 (もっと読む)
(もっと読む)
粒子三次元配列体を利用した反応容器及び反応装置
液体試料中の標的物質と粒子表面に固定された反応物質との遭遇確率を高め、反応効率を向上させることができる、粒子三次元配列体を利用した反応容器、及び該反応容器を利用した反応装置を提供することを目的とし、本発明により提供される反応容器は、液体試料を収容し得る反応室を有する反応容器本体と、前記反応室内に収納された固体支持体と、表面に所定の反応物質が固定された複数の粒子とを備えた反応容器であって、前記粒子が、前記固体支持体の表面に固定された状態で前記反応室内に三次元に配列していることを特徴とする。 (もっと読む)
病原微生物検出のための広視野法
病原微生物は、当該病原微生物からのラマン光分散光と供にそのスペクトル・パターンのデジタル・パターン認識により、広視野で検出され、そして分類される。 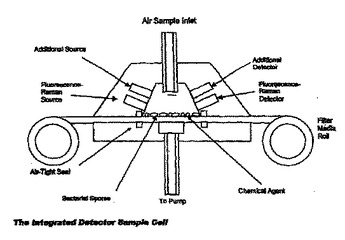 (もっと読む)
(もっと読む)
2,461 - 2,480 / 2,552
[ Back to top ]