Fターム[2G043JA01]の内容
蛍光又は発光による材料の調査、分析 (54,565) | 分光手段 (3,157) | 分光手段 (3,100)
Fターム[2G043JA01]の下位に属するFターム
Fターム[2G043JA01]に分類される特許
541 - 560 / 580
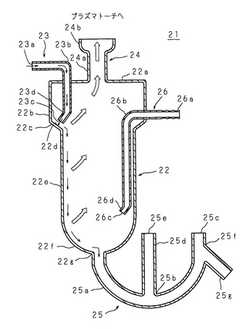
気液分離容器、及びICP発光分析装置
【課題】 試液から水素化物は定常的に安定して分離させる。
【解決手段】 ICP発光分析装置は水素化物発生装置を内部に組み込んでおり、プラズマトーチに直接的に水素化物発生装置の気液分離容器21を接続する。気液分離容器21は、逆L字状の導入管23の管先端23cを容器本体22の傾斜した内壁面22dに対向配置し、導入管23から流出する試液を内壁面22dに衝突させて水素化物を試液から安定的に分離させると共に、試液が容器本体22の内壁を伝って静かに流れ落ちるようにして測定分析の安定化を図る。
(もっと読む)
組み合わされた超音波撮像及び分光分子分析装置及び方法
本発明は。超音波及び分光技術により生物学的構造の組み合わされた撮像及び分析のための装置を提供する。本発明の診断装置は、超音波信号及び表面改善ラマン分光信号の同時取得のために適合されている。本発明は、特に、一方で、超音波エコー信号のために改善された反射効率を与え、他方で、表面改善ラマン分光を可能にする造影剤を用いる。造影剤は、従来の微小な気泡及び固体金属ナノ粒子又はそれらの組み合わせを有する。本発明は、それ故、血液の非侵襲的な生体内分析並びに血流の検出及び視覚化を効果的に提供する。 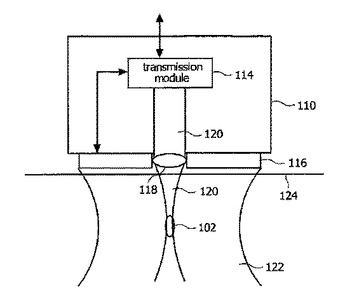 (もっと読む)
(もっと読む)
分光システムのためのオートフォーカス機構
本発明は、注目ボリュームの特性を決定するよう適合される分光システム(400)のためのオートフォーカス機構を提供する。注目ボリュームは、時間で変化する光学特性を持つ。本発明は、注目ボリュームの位置(428)を決定するため注目ボリュームの光学特性の揺らぎを測定するよう適合される測定手段を提供する。分光システムは、更に、決定された注目ボリュームへ励起ビーム(418)を焦点合わせし、分光分析のため注目ボリュームから発散する戻り放射線(420)を収集するよう更に適合される。好ましくは、励起ビーム(428)の非弾性的に散乱された放射線が、分光分析のため弾性的に散乱された放射線と分離される。励起ビームの弾性的に散乱された放射線は順に、注目ボリュームの光学特性の揺らぎを測定するため活用される。制御ループを利用することは、注目ボリューム、例えば毛細血管(450)の中心の位置を本質的に特定する揺らぎの振幅及び/又は強度を最大化することを可能にする。 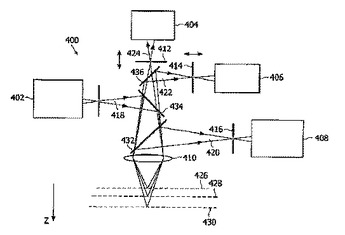 (もっと読む)
(もっと読む)
多重モード・スペクトル画像解析の方法および装置
多重モード・スペクトル画像解析の方法および装置が開示される。一つの実施態様において、本発明は、修正された照明プロファイルで対象物を照明する段階、照明された対象物の反射、透過、または蛍光画像を作成する段階、当該対象物をスキャンする段階、および光の状態を修正した後、当該反射光、透過光、または蛍光光の再解析を行う段階で構成される。本発明は、時間分解能が低い高スペクトル分解能画像および時間分解能が高い多重画像取得を行う他の画像解析手段と併用することが望ましい。  (もっと読む)
(もっと読む)
血液を収集して血液成分を分離するデバイス、血液成分を分離する方法及びデバイスの用途
本発明は、血液を収集し、毛管力により液体サンプルを吸収する流路によって液体サンプルとして血漿を分離するデバイス及び方法に関する。本発明の目的は、液体サンプルで流路を一様に満たし、効果的な分離を行うことにある。これを達成するため、脱気が、流路の入口領域で分離デバイスのすぐ下流側において主充填方向又は流路の長手方向に対して横断方向に行われる。 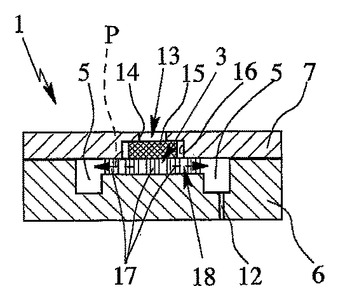 (もっと読む)
(もっと読む)
微小球におけるウィスパリングギャラリーモードを使用するバイオセンサー
標的分析物の存在を検出するためのバイオセンサーが開示される。バイオセンサーは、微小回転楕円状粒子から形成され、その表面上に固定される標的分析物に対する結合パートナーを有した。結合パートナーは、ヌクレオチド;ペプチド、タンパク質、酵素、抗体などであり得る。分析物がそのパートナーに結合する場合、微小回転楕円状粒子のウィスパリングギャラリーモード(WGM)プロファイルは、プロファイルピークが赤または青シフトするように変化する。固定化結合パートナーは、それらが蛍光、リン光、白熱光などを放出するように、フルオロフォアなどを含み得る。これらのフルオロフォアは、ナノ結晶または量子ドットの形態を取り得る。 (もっと読む)
少量の液状媒体を光によって分析または吸光測定するための装置
装置(1)は、相応する装置(7および9)並びに光ファイバー光導体(10および11)による集積されたビーム偏向部を有しており、これは液状媒体(2)の分析に使用される光(3)を例えば分光光度器、分光蛍光光度器等の測定装置において、装置(1)に設けられた、媒体に対する収容面(4)として構成された測定箇所へ導き、この測定箇所から分光光度器、分光蛍光光度器等の検出器へ戻す。ここでこの収容箇所(4)は測定箇所として平面状に装置(1)の上面に設けられており、使用位置において、カバー状の取り外し可能な反射部(8)によって覆われている。この反射部は試料ないし媒体(2)にも直接的に接触し、試料の載置前並びに測定箇所の洗浄のために取り外すことができる。  (もっと読む)
(もっと読む)
SERSによる化学基の増強検出のための層状プラズモン構造をもつ光センサ
センサに与えられた分析物80内の化学基の存在を検出するために、可視光レーザ励起ビーム60及びラマン分光検出器とともに使用する光センサ及び方法が開示される。センサには、基板10、基板10のセンサ表面上に形成されたプラズモン共鳴ミラー20、ミラー20上に配置されたプラズモン共鳴粒子層40、並びにミラー20及び粒子層40を隔てる約2〜40nm厚の光学的に透明な誘電体層30が含まれる。粒子層40は、i分析物分子80を結合するための被覆、ii50〜200nmの間の範囲内の実質的に均一な粒子サイズ及び形状、並びにiiiレーザ励起ビームの波長よりも少ない粒子間の間隔をもつプラズモン共鳴粒子の周期的アレイを有する。デバイスは、1012〜1014までの増幅定数で単一の分析物分子80を検出することができる。 (もっと読む)
光ファイバプローブ
本発明は、分光系、より具体的には、患者の心臓血管系内部の脆弱なアテローム性動脈硬化症プラークの生体内検出のための光ファイバプローブを提供する。脆弱なプラークの検出は、血液流中を流れる心臓マーカー分子の濃度レベルの測定に依存した場所に基づく。濃度レベル検出は、好ましくは、これらの濃度レベルの決定のための十分な感度をもたらす表面増感ラマン分光技法に基づく。制御された速度を用いた心臓血管系を通じた光ファイバプローブの移動の間の分光データの獲得は、心臓血管系内で脆弱なプラークを精密に位置付けることを可能にする。
 (もっと読む)
(もっと読む)
非侵襲血液分析用の測定ヘッド
本発明は、分光システム用の測定ヘッドを患者の皮膚の種々の異なる部分に取り付け及び固定する有効な方法を提供する。該測定ヘッドは、好ましくは、柔軟性のある取り扱いを提供すると共に、皮膚の種々の部分の複数の特性を考慮して非常に多様な付着領域を提供するような小型の設計を特徴とする。更に、該測定ヘッドは、対物レンズの光軸の横方向のずらしを必要としないような強固な且つ複雑でない光学設計を特徴とする。対物レンズと皮膚内の毛細血管との間の斯様な横断方向の相対移動は、好ましくは、皮膚を当該測定ヘッドの対物レンズに対して機械的にずらすことにより実行される。更に、本測定ヘッドは、該測定ヘッドと皮膚との間の接触圧を測定する1以上の圧力センサを有するように構成される。この圧力情報は、分光分析手段を校正すると共に、毛細血管の分光検査のための最適接触圧範囲を規定する所定の範囲内に接触圧を調節するために更に利用することができる。  (もっと読む)
(もっと読む)
生物学的細胞組織の分光分析用保護機構
本発明は、患者の関心体積中にある生物学的組織の特性を決定する分光分析系の保護機構を供する。分光系は高出力の放射線を利用し、かつ人体の感光性細胞組織が偶然に露光されるのを防ぐための保護機構を供するのが好ましい。本発明は、分光系の測定ヘッドが測定位置にあるか否かを検出するための様々な方法を提供する。測定ヘッドの測定位置は、たとえば、患者の皮膚の電気抵抗を測定する圧力センサの利用又は、関心体積の可視像を供する観察ビームの強度又は空間的構造を分析する光学的手段によって有効に決定することが可能である。  (もっと読む)
(もっと読む)
化学的マーキング又はトレーシングによる物体又は物質の確実な認証方法
本発明は,物体の理論的識別,物体の分光光度分析,標準として用いられるマーカーの決定,分光光度分析を通して得られたこの標準マーカーに関するデータと予め記憶された特定のデータとの比較,分光光度分析に供すべき補正量の計算,マーカーの存在の有無及びマーカーの強度の検出,物体を認証するコードの設定,及び,場合によっては,警報信号の送出を含む識別及び認証段階を含む方法に関する。 (もっと読む)
プラズマトーチスペクトロメータ
スペクトロメータはプラズマトーチ(12)と、トーチ内部に正常なプラズマ(P)を発生するための誘導コイル(40)とを有している。トーチ(12)は外管(20)及び内管(22)を有している。プラズマ(50)が正常プラズマ状態からトロイダル状又は不完全なプラズマ形状(52)にくずれると、フォトダイオード(70)が形状の変化を検出するので、プラズマトーチは、プラズマ形状(52)がトーチの外管(20)を溶融することを防止するべく停止することができる。 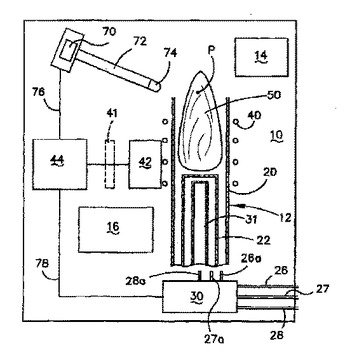 (もっと読む)
(もっと読む)
気体に放電を生成するためのシステムおよび方法
封止されたエンクロージャに含まれる気体に放電を生成する方法が開示される。方法は、RF周波数で螺旋状コイル共振器を駆動して高圧気体に放電を生成するのに十分なRF電磁界を生成するステップを含む。放電は、発光スペクトルを生成し、それは、気体の組成および不純物含量を決定するために、分光的に分析されてもよい。  (もっと読む)
(もっと読む)
合成有機無機ナノクラスター
【解決手段】レーザによって励起された際に、複数の表面増感ラマン信号(SERS)を生成する、複数の合成有機無機ナノクラスター(COIN)が提供される。前記複数のナノクラスターは、複数の金属粒子およびラマン活性な有機化合物を含む。適切なSERS信号を達成するために必要とされる前記金属は、前記ナノクラスターに固有であり、広い種類のラマン活性な複数の有機化合物とその複数の組み合わせとを前記ナノクラスター内に組み込むことができる。さらに、前記複数のナノクラスターを含む複数の重合マイクロ球、およびそれらの複数の作成方法が提供される。前記複数のナノクラスターおよび前記複数のマイクロ球は、例えば、複数の生物製剤の分子の多重検出のための検定に用いられ得る。
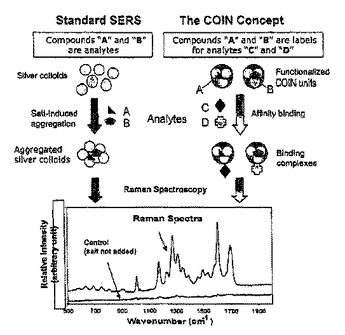 (もっと読む)
(もっと読む)
低温バックグラウンドターゲットに対するテラヘルツ波の受動的エミッションによる化学的物質及び生物学的物質の検出及び分析
サンプル(12)中の化学的物質及び生物学的物質を検出及び分析する装置(38)。装置(38)は、サンプル中の物質を検出するために、テラヘルツ周波数帯の、サンプル(12)からのエミッションを受動的に受け取る分光計(42)を含む。テレスコープ(46)又は他のデバイスは、分光計(42)の視野を制限するのに使用される。低温表面(16)は、サンプル(12)に対して分光計(42)とは反対側で、分光計(42)の視野を埋めるように配置される。低温表面(16)は、サンプル(12)に対して低温バックグラウンドをもたらして、バックグラウンドエミッションを低減し、サンプル(12)からのエミッションの検出を向上させる。  (もっと読む)
(もっと読む)
核共鳴蛍光画像化を用いた物質の適応走査
核共鳴蛍光を用いて適応走査することにより試料内の核種を検出するための方法は、前記標的試料を光子源からの光子で照らす段階と、1つのエネルギーチャンネルで信号を検出する段階と、前記検出した信号を用いて走査評価パラメータを決定する段階と、前記走査評価パラメータが検出効率基準を満たすか否かを判断する段階と、前記走査評価パラメータが前記検出効率基準を満たすように、1つ又は複数のシステムパラメータを調節する段階と、1つのエネルギーチャンネルにおける前記信号を所定の核種検出判定基準と比較して核種検出イベントを識別する段階とを含むことができる。別の実施形態では、1つのエネルギーチャンネルで信号を検出する前記段階は、前記標的試料から散乱する光子を検出する段階を更に含むことができる。別の実施形態では、1つのエネルギーチャンネルで信号を検出する前記段階は、前記標的試料を透過すると共に少なくとも1つの基準散乱体から散乱する光子を検出する段階を更に含むことができる。 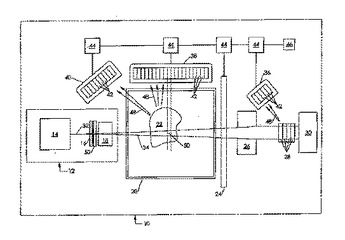 (もっと読む)
(もっと読む)
多孔性バイオセンサーおよびラマン分光法を用いる生体分子の検出
本発明は、カスケードラマンセンシングによって、血清のような生体試料の内容物を分析するために用いられる方法を提供する。公知の分析物に対して特異的に結合するプローブを有する、蛍光を発生させるナノ多孔性バイオセンサーを、生体試料に接触させて、多孔性の半導体構造に共役させた一つまたはそれ以上の結合複合体を形成する。結合した複合体を、結合複合体に特異的に結合するラマン活性プローブに接触させて、バイオセンサーに光を照射するとバイオセンサーからの蛍光放出が得られる。これらの蛍光の放出は結合複合体からのラマンシグナルを生成する。結合複合体から生成されたラマンシグナルを検出して、結合したタンパク質含有分析物に関連するラマンシグナルが、試料中のタンパク質含有化合物の存在を示している。本発明の方法は、患者の試料のタンパク質プロフィールを提供するために有用である。本発明はまた、本発明の方法を実践するために有用な検出系を提供する。 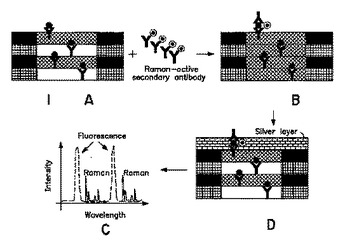 (もっと読む)
(もっと読む)
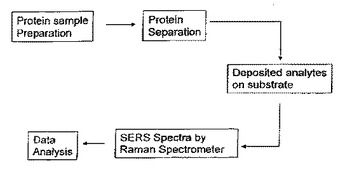
ラマン分光法を使用して生物試料のタンパク質プロファイルを得る方法
本発明は、例えば、特定の個人によって提供される試料のタンパク質プロファイルを得るために、生物試料のタンパク質含有量を分析するための方法を提供する。試料中のタンパク質およびタンパク質断片を化学的および/または物理的特性に基づいて分離し、固体基板上または流動中の液体の流れの離散的な位置に分離された状態で維持する。次いで、離散的な位置からのスペクトルが、離散的な位置の1つ以上の特定のタンパク質または断片の構造または識別についての情報を提供するように、離散的な位置において分離された状態のタンパク質または断片によって形成されるのでラマンスペクトルが検出される。離散的な位置のタンパク質または断片は、金または銀などの金属をコーティングされてもよいおよび/または分離されたタンパク質は、SERSスペクトルを提供するように化学的エンハンサーと接触されてもよい。本発明を実施する方法およびキットも提供されている。
 (もっと読む)
(もっと読む)
分子複製中のヌクレオチドの取り込みのラマン・モニタリングによる核酸配列決定
本明細書に開示された方法および装置は、ヌクレオチド、ヌクレオシド、および塩基の検出、ならびに核酸配列決定のために有用である。本方法は、表面増強ラマン分光法(SERS)を使用した、ヌクレオチド、ヌクレオシド、または塩基の検出を含む。検出は、核酸配列決定反応のような核酸重合反応の間のデオキシヌクレオチド三リン酸の取り込みを検出する核酸配列決定反応の一部であり得る。合成された新生鎖の核酸配列および鋳型鎖の相補配列が、重合反応の間のヌクレオチドの取り込みの順序を追跡することにより決定され得る。 (もっと読む)
541 - 560 / 580
[ Back to top ]