Fターム[2G045DA36]の内容
生物学的材料の調査、分析 (60,403) | 対象成分(有機物) (11,408) | ペプチド、タンパク質 (4,236)
Fターム[2G045DA36]の下位に属するFターム
Fターム[2G045DA36]に分類される特許
1,981 - 2,000 / 3,912
免疫系の活性化または細胞死の程度の検出のための方法
本発明は、免疫系の活性化、好ましくはNET形成の意味での免疫系の活性化、の検出方法、または非-腫瘍性組織中または体液中での細胞死の程度の検出方法に関するものであり、ここで遊離のDNAが個体由来のサンプル中で測定されるものである。さらに、少なくとも1つの容器中に蛍光色素とDNAスタンダードとをパッケージングすることを含む、個体中での免疫系の活性化の検出または細胞死の程度の検出のためのキットを製造する方法に関する。 (もっと読む)
G蛋白質共役型受容体49を用いた薬物のスクリーニング方法およびそれにより得られる薬物
【課題】本発明の課題は、G蛋白質共役型レセプター49およびそれと共役するG蛋白質を用いた新規なスクリーニング方法、それにより得られる物質およびその物質を有効成分とする医薬組成物を提供することにある。
【解決手段】本発明によれば、G蛋白質共役型レセプター49の活性を調節する作用を有する物質のスクリーニング方法であり、かつ、当該レセプターと共役するGq蛋白質ファミリーを含む系を用いたスクリーニング方法、それを利用することにより得られる物質およびその物質を有効成分とする医薬組成物が提供可能である。これにより、特に糖尿病に効果がある医薬組成物を提供することができる。
(もっと読む)
心不全を発生させる危険がある被検者を診断および/または処置するための手段および方法
本発明は、心不全を発生させる危険がある被検者を同定するための方法であって、(a)前記被検者の生物学的試料における1つ以上の生物学的マーカーのレベルを決定すること、(b)前記生物学的マーカーのレベルを同じ生物学的マーカーの標準レベルと比較すること、および(c)生物学的マーカーのレベルが心不全を発生させる危険を示すかどうかを決定することを含み、生物学的マーカーがクルッペル様因子15(KLF−15)、リソソーム内在性膜タンパク質2(LIMP−2)、それらのフラグメント、および/もしくは、それらの変異体であり、ならびに/または、生物学的マーカーがKLF15をコードスする遺伝子、LIMP−2をコードする遺伝子、それらのフラグメント、および/もしくは、それらの変異体である方法に関する。さらに本発明は、心不全を防止および/または処置するための予防および/または治療医薬品用の医薬品を調合するための、KLF15および/またはLIMP−2タンパク質、および/またはKLF15および/またはLIMP2をコードする遺伝子、および/または前記遺伝子および/またはタンパク質のフラグメントおよび/または変異体の使用に関する。 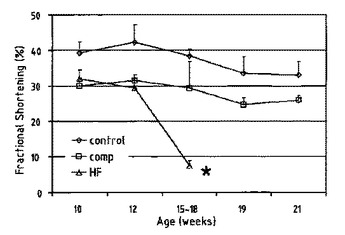 (もっと読む)
(もっと読む)
カートリッジシステム
【課題】患者のケア地点で容易に実行でき、従来のカートリッジ式アッセイシステムの問題点を改善したカートリッジシステムを提供する。
【解決手段】試薬コンポーネント及び処理コンポーネントが連結されてカートリッジをなし、試薬コンポーネント及び/又は処理コンポーネントはアッセイからの廃棄物を受容する少なくとも1つの区画を含み、試薬コンポーネントは、試薬の処理には、処理コンポーネントからの廃棄物の受容以外には関与しない、1つ以上の試薬を貯蔵する試薬コンポーネントと、1つ以上の試薬を処理する処理コンポーネントとを含むカートリッジシステムを提供する。更に、アナライトを検出する少なくとも1個の検出要素を含む検出コンポーネントを含むカートリッジシステム、なお更に、サンプルを調製するサンプル調製コンポーネントを含むカートリッジシステムを提供する。
(もっと読む)
表示式チュートリアルモジュールを具備する分析用計器
【課題】体液サンプル中の検体を測定する分析用計器を提供する。
【解決手段】体液サンプル(例えば、全血サンプル)中の検体(例えばグルコース)を測定する、表示式チュートリアルモジュールを含む分析用計器であって、表示式チュートリアルモジュールは、(画像表示装置を有する)ユーザーインターフェースと、メモリ装置とマイクロプロセッサとを含む。メモリ装置は、複数のチャプターを有するチュートリアルを保存する。複数のチャプターのそれぞれが分析用計器の使用を説明する少なくとも1つのチュートリアル画像を含む。マイクロプロセッサは、少なくともユーザーインターフェース及びメモリ装置を制御し、調整するように構成されている。更に、ユーザーインターフェース、マイクロプロセッサ及びメモリ装置は、ユーザーに対してチュートリアル画像を画像表示装置にイベント駆動式チャプター単位表示するように動作可能に統合され且つ構成されている。
(もっと読む)
筋緊張性ジストロフィーのためのタンパク質置換治療に関する組成物および方法
開示されるのは、ポリCUGおよびポリCCUG繰り返しRNAおよびこれら繰り返しRNA配列に結合するタンパク質の相互作用に関する組成物および方法である。また開示されるのは、ポリ(CUG)expまたはポリ(CCUG)expRNAのマッスルブラインドとの相互作用を阻害する工程を包含するか、または筋緊張性ジストロフィーにおけるスプライス異常の改善を引き起こすことによりDM1またはDM2を処置する方法である。 (もっと読む)
血中コレステロール降下作用を有する物質のスクリーニング方法
【課題】本発明は、ある被検化合物が、上記のLXRの場合のような副作用を生じることなく血中コレステロールを特異的に減少させる能力を有するかどうかをスクリーニングする方法を開発することを課題とする。本発明はまた、上記のLXRの場合のような副作用を生じることなく血中コレステロールを特異的に減少させることができる化合物を、選抜する方法を開発することを課題とする。
【解決手段】本発明の発明者らは、ヘテロダイマーを形成して細胞表面に発現することによりコレステロールを胆汁中に排出する機能を担うことが知られているATP結合カセットタンパク質(ABC)のファミリーに属する分子、ABC G5およびABC G8が関与する血中コレステロール減少の機序を明らかにし、これにより上述した課題を解決することができることを示した結果、本発明を完成するに至った。
(もっと読む)
グルタミニルシクラーゼに関連した新規遺伝子
本発明は、グルタミニルシクラーゼ(QC、EC 2.3.2.5)のアイソザイムである新規グルタミニル-ペプチドシクロトランスフェラーゼ様タンパク質(QPCTL)に、及びこれらのアイソザイムをコードする単離された核酸に関し、これらの全ては、新たな治療薬の発見のために、シクラーゼ活性を測定するために、及びこれらのグルタミニルシクラーゼアイソザイムに対する化合物の阻害活性を決定するために有用である。 (もっと読む)
冠動脈カテーテル法に起因する心臓合併症の診断のためのナトリウム利尿ペプチド
本発明は、冠動脈カテーテル法に起因する患者での心臓合併症の診断方法であって、(a)冠動脈カテーテル法の施術中またはその後に該患者から少なくとも1つのベースラインサンプルを取得するステップ、および続いて(b)冠動脈カテーテル法の後に該患者から少なくとも1つの被験サンプルを取得するステップ、(c)ベースラインサンプルと被験サンプルとの間で、ANP型ペプチドまたはその変異体レベルの変化を測定するステップを含み、ここでステップ(c)によるANP型ペプチドレベルの有意な低下が心臓合併症を示すものである方法を開示する。好ましい実施形態ではBNP型ペプチドも測定され、ここでBNP型ペプチドレベルの有意な増大が心臓合併症を示す。ANP型ペプチドおよびBNP型ペプチドはナトリウム利尿ペプチドの群に属する。好ましいペプチドは、ANP(心房性ナトリウム利尿ペプチド)およびBNP(脳ナトリウム利尿ペプチド)、ならびにそれらのそれぞれのN末端フラグメントであるNT−proANPおよびNT−proBNPである。本発明は冠動脈カテーテル法(カテーテルの導入)、例えば、血管造影法、血管形成術、バルーン拡張術、経皮冠動脈インターベンション(PCI)、またはステント移植に起因するかそれにより引き起こされる心臓合併症の早期診断を可能にする。検出可能な合併症の例としては、心筋虚血および心筋壊死が挙げられ、それらが無症候性または臨床的に明らかでなくとも検出可能である。本発明はまた、壊死マーカー(例えば、トロポニン)および炎症マーカー(例えば、インターロイキン)の追加的な測定を記載する。 (もっと読む)
細胞におけるターゲットタンパク質候補の発現を検出および/または定量する方法、ならびに小分子モデュレーターのターゲットタンパク質を同定する方法
本発明は、細胞におけるターゲットタンパク質候補の発現を検出および/または定量する方法、ならびに小分子モデュレーターのターゲットタンパク質を同定する方法に関するものである。 (もっと読む)
CRIg及びC3b:CRIg複合体の結晶構造
本発明は、マクロファージ特異的レセプターCRIg(以前はSTIgMAと呼ばれていたもの)と、補体C3のC3b及びC3cサブユニットとのその複合体(C3b:CRIg及びC3c:CRIg複合体)の結晶構造の決定に関する。本発明は更にCRIgアゴニスト及びアンタゴニストを含むCRIgに構造的及び/又は機能的に関連する分子をスクリーニングし同定するためのCRIg又はC3b:CRIg複合体の結晶構造の使用に関する。 (もっと読む)
昆虫特異的クモ毒素模倣物を同定する方法
本明細書には、rU−ACTX−Hv1a殺虫性毒素の三次元構造の少なくとも一部を模倣する候補分子を同定する方法であって、rU−ACTX−Hv1a殺虫性毒素の三次元構造を模倣する候補分子を同定する分子モデルを使用して、本明細書に開示するrU−ACTX−Hv1a殺虫性毒素の原子座標から作成した分子モデルを提供することと;同定される候補分子を提供することとを含む、方法が開示される。この方法は必要に応じて、U−ACTXのファーマコフォア残基をQ8、P9、N28およびV34と同定する分子モデルを使用することも含む。 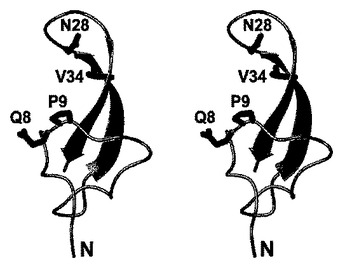 (もっと読む)
(もっと読む)
MN遺伝子およびタンパク質
【課題】MNタンパク質結合部位の位置、および脊椎動物細胞への接着について固定化MNタンパク質と競合し、細胞間接着および細胞内接触の形成を妨げる、MNタンパク質/ポリペプチドの同定法、および異常にMNタンパク質を発現する新生物発生前/腫瘍性脊椎動物細胞の成長を抑制する治療方法の提供。
【解決手段】MNタンパク質結合部位は、有機または無機分子、好ましくは有機分子、より好ましくは該部位に特異的に結合するタンパク質/ポリペプチドによりブロックできる治療標的である。MN特異的抗体の可変領域をコードするベクターおよび該領域を分離する柔軟なリンカーポリペプチド。前記有機または無機分子が、MNタンパク質を異常に発現する脊椎動物の前腫瘍性または腫瘍細胞の増殖を抑制する治療方法。
(もっと読む)
ネフローゼ症候群の疾患関連たんぱく質およびその使用
【課題】ネフローゼ症候群の病態判定に有効であり治療効果を迅速に反映する血清たんぱく質を見出し、それを用いた本疾患の治療モニタリング法や予後方法、そのためのキット、ならびにネフローゼ症候群の治療薬のスクリーニング方法を提供する。
【解決手段】ネフローゼ症候群の病態の判定方法であって、ネフローゼ症候群の被験者から試料を得ること、次いで試料中のMBL−プロテアーゼ イソフォーム2の量を調べることを含む方法。
(もっと読む)
特定の人の胃腸障害を診断する方法
特定の人における少なくとも1種の粘膜放出された神経内分泌消化管系成分を測定する方法、及び少なくとも1種の粘膜放出された神経内分泌消化管系成分の濃度、及び/又は少なくとも1種の粘膜放出された神経内分泌消化管系成分の濃度と少なくとも1種の粘膜放出された炎症性放出媒介物の濃度の割合に基づき、特定の人の障害を診断する方法が提供される。 (もっと読む)
肺気腫および結腸直腸癌に対して活性な薬剤の選択および確認用の動物モデル
本発明は、1つまたはそれ以上の機能性セストリンを産生しないかあるいは最適以下の量でのみ産生し、かつまた潜在型トランスフォーミング増殖因子β結合タンパク質4(ltbp4)を産生しないかあるいは最適以下の量でのみ産生する非ヒト動物モデル、それ由来の細胞および組織培養物に関する。また、本発明は、本発明の動物モデル、細胞または組織培養物を利用することによって示される肺気腫および/または結腸直腸癌を治療するための薬剤を選択する方法に関する。動物モデル、細胞または組織培養物は、可能性のある薬剤の効果、毒性および生物学的利用能の前臨床試験に適する。 (もっと読む)
ボレリア(Borrelia)抗原
本発明は、タンパク質をコードする単離された核酸分子、高度免疫血清反応性抗原をコードする単離された核酸分子、このような核酸分子を含むベクター、このようなベクターを含む宿主細胞、ボレリア種に由来する高度免疫反応性抗原、好ましくは高度免疫血清反応性抗原であるタンパク質、高度免疫血清反応性抗原、抗原、このようなタンパク質、高度免疫血清反応性抗原、または抗原を作製するための方法、このようなタンパク質、高度免疫血清反応性抗原、または抗原を発現する細胞を作製するための方法、このようなタンパク質、高度免疫血清反応性抗原、または抗原に結合する抗体、このような抗体を産生するハイブリドーマ細胞、このような抗体を作製するための方法、このような核酸分子、タンパク質、高度免疫血清反応性抗原、抗原、または抗体を含む薬学的組成物、医薬を製造するためのこのような核酸分子、タンパク質、高度免疫血清反応性抗原、抗原、または抗体の使用、このようなタンパク質、高度免疫血清反応性抗原、または抗原の相互作用活性を減少させるかまたは阻害することができるアンタゴニストを同定するための方法、感染症を診断するための方法、および感染症を治療するための方法に関する。より具体的には、このようなタンパク質、高度免疫血清反応性抗原または抗原は、ライム病ボレリアに起因するライム病または細菌感染症を引き起こす細菌病原体によって産生されるか、またはそれらに関連している。 (もっと読む)
長期持続性の医薬製剤
本発明は、長期持続性の治療用製剤とそれらの使用の方法へ向けられ、ここで該製剤は、1以上の調節配列へ機能可能的に連結した核酸配列を含むベクターを含む遺伝子修飾された微小器官を含み、ここで核酸配列は、エリスロポエチン又はインターフェロンαのような治療用ポリペプチドをコードする。 (もっと読む)
低カルボキシル化/非カルボキシル化オステオカルシンはベータ細胞増殖、インスリン分泌、インスリン感受性、耐糖能を増加させ、体脂肪量を減少させる
本発明は、エネルギー代謝ならびにガンマカルボキシラーゼ、オステオカルシン、およびアディポネクチンを含むOST-PTPシグナル伝達経路に関する障害を治療するならびに診断するための方法ならびに組成物に関する。そのような障害は、代謝症候群、耐糖能障害、糖尿病1型および2型、アテローム性動脈硬化症、ならびに肥満症を含むが、これらに限定されない。 (もっと読む)
哺乳類卵母細胞発達適格性の顆粒膜マーカーおよびその使用
本発明は子宮着床および生個体への発達のための卵母細胞の応答能に関連する。本発明は、より具体的には、卵母細胞吸引が補助生殖技術において行われるので、卵母細胞吸引の期間中に卵母細胞と一緒に採取される顆粒膜細胞において検出および測定されるマーカーに関連する。マーカーには、RT−PCRを使用して検出および測定されるチトクロームP450アロマターゼ(CYP19A1)、細胞分裂サイクル42(CDC42)、3−β−ヒドロキシステロイドデヒドロゲナーゼ1(3βHSD1)、セルピンペプチダーゼ阻害剤クレードEメンバー2(SERPINE2)およびアドレノドキシン(ADX)が含まれる。 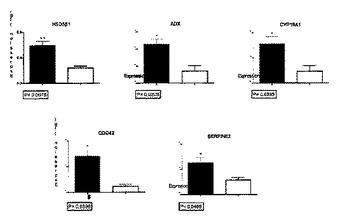 (もっと読む)
(もっと読む)
1,981 - 2,000 / 3,912
[ Back to top ]



