Fターム[4C065CC06]の内容
その他のN系縮合複素環 (61,549) | 第3の環 (4,735) | 6員複素環 (221) | N2個含有6員複素環 (94)
Fターム[4C065CC06]に分類される特許
41 - 60 / 94
新規四環系化合物
ヒスタミン受容体は、Gタンパク質共役7回膜貫通タンパク質のスーパーファミリーに属する。Gタンパク質共役受容体は、真核細胞において主要なシグナル伝達系の1つを構成する。ヒスタミン受容体は、大部分の末梢組織中および中枢神経系において見出される。ヒスタミン受容体を調節することができる化合物は、治療に使用してもよく、例えば、ヒスタミンアンタゴニストは、抗ヒスタミン剤として使用し得る。本開示は、個体においてヒスタミン受容体を調節するために使用し得る新規な四環系化合物に関する。この化合物は、一実施形態では、四環系[4,3−b]インドールである。認識力障害、精神病性障害、神経伝達物質が媒介する障害および/または神経細胞障害の治療を含めた種々の治療への用途におけるこの化合物の使用方法と同様に、この化合物を含む医薬組成物もまた提供する。 (もっと読む)
HIVインテグラーゼ阻害活性を有する多環性カルバモイルピリドン誘導体
【課題】抗ウイルス作用、特にHIVインテグラーゼ阻害活性を有する抗HIV薬の提供。
【解決手段】下記式の化合物(I)、及びそれを含有する抗HIV薬。
(式中、Z1は、NR4;R1は、水素または低級アルキル;Xは、単結合、O、S、SO、SO2およびNHから選択されるヘテロ原子基、または該ヘテロ原子基が介在していてもよい低級アルキレンもしくは低級アルケニレン;R2は、置換されていてもよいアリール;R3は水素、ハロゲン、ヒドロキシ、置換されていてもよい低級アルキル等;R4およびZ2は一緒になって環を形成し、多環性化合物(例えば、3環性または4環性化合物を含む)を形成する。)
(もっと読む)
重水素化カテコールおよびベンゾ[d][1,3]ジオキソールおよびその誘導体の合成
薬物性能における改善が、特定の認可された医薬品の活性薬剤の特定の部位に重水を組み込むことによって達成され得ることが報告された。例としては、パロキセチンおよびタダラフィルが挙げられる。上記の薬物は全て、ベンゾ[d][1,3]ジオキソール基を含む。パロキセチンおよびタダラフィル中の上記ベンゾ[d][1,3]ジオキソール基のメチレンジオキシ炭素は、重水素組み込みが、改善された薬物性能を提供すると報告された位置のうちの1つである。本発明は、d2−ベンゾ[d][1,3]ジオキソールの合成のための便利かつ効率的なプロセスを提供する。 (もっと読む)
ハロゲン含有のペリレンテトラカルボン酸誘導体及びそれらの使用
本発明は、式(I)で示され、その式中、Y1及びY2がO又はNRaもしくはNRbを表し、その際、Ra及びRbがHもしくはオルガニルを表し;Z1〜Z4がOもしくはSを表し;R11〜R14、R21〜R24がCl、Fを表し;その際また基R11〜R14、R21〜R24の1もしくは2つがCNを表してよく、かつ/又は基R11〜R14、R21〜R24の1つがHを表してよく;かつその際Y1がNRaを表し、Z1もしくはZ2がNRcを表してもよく、その際、Ra及びRcは一緒になって架橋基Xであって2〜5個の原子を有する基を表し;かつその際Y2がNRbを表す場合に、Z3もしくはZ4がNRdを表してもよく、その際、Rb及びRdは一緒になって架橋基Xであって2〜5個の原子を有する基を表す化合物、その製造方法と、前記化合物を、発光体材料、電荷輸送材料もしくは励起子輸送材料として用いる使用に関する。 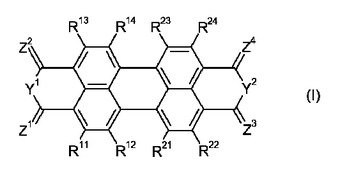 (もっと読む)
(もっと読む)
MK2阻害剤として有用なヘテロ環式化合物
本発明は、式(IA)または(IB)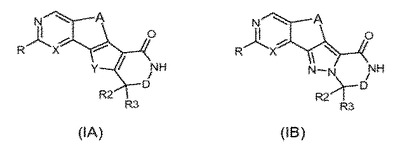
〔式中、記号R、X、A、Y、R2、R3およびDは本明細書に定義のとおりである〕で示される四環式化合物、例えば、MK−2またはTNF活性に依存する特定の疾患の処置におけるその使用、およびそれの製造方法を記載している。 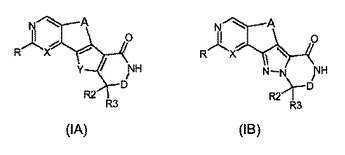 (もっと読む)
(もっと読む)
ピペラジニルオキソアルキルテトラヒドロ−β−カルボリンおよび関連類似体
式(I)のピペラジニルオキソアルキルテトラヒドロ−β−カルボリンおよび関連類似体が提供され、その調製方法および使用も提供される。このような化合物は、通常、in vivoまたはin vitroでヒスタミンH3受容体とのリガンド結合を調節するために使用してよく、特に、ヒト、飼い慣らされたコンパニオン・アニマルおよび家畜動物における種々の障害の治療において有用である。薬剤組成物および治療方法が提供され、ヒスタミンH3受容体を検出するための(例えば、受容体位置確認研究)、このようなリガンドの使用方法も提供される。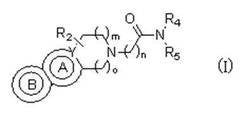
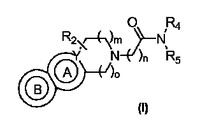 (もっと読む)
(もっと読む)
タダラフィルを含む薬剤の製造の方法
本発明は、タダラフィルを含む薬剤を製造するための方法に関する。前記方法において、タダラフィルは適切なアジュバントと混合されて、約100℃から約200℃、好ましくは約150℃から約200℃、とりわけ約200℃の温度に加熱される。 (もっと読む)
抗菌剤としての三環式含窒素化合物
本発明は、三環式含窒素化合物および抗菌剤としてのその使用に関する。Z1およびZ2は、独立して、CHおよびNから選択される。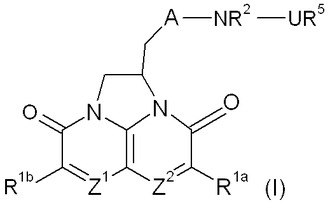
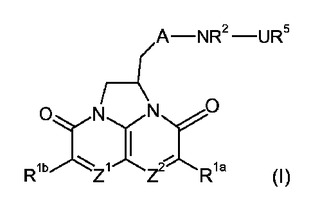 (もっと読む)
(もっと読む)
ミルタザピンの製造方法
【課題】2−(4−メチル−2−フェニルピペラジン−1−イル)ピリジン−3−メタノールを濃硫酸により閉環した反応液から、高い純度で、医薬品として安全に使用できるミルタザピンを簡便な方法により単離する方法を提供する。
【解決手段】2−(4−メチル−2−フェニルピペラジン−1−イル)ピリジン−3−メタノールを濃硫酸で閉環して得られた反応液を水で希釈した後、プロパノール存在下、アルカリ性にし、プロパノールでミルタザピンを抽出し、次いで当該抽出液からミルタザピンを結晶化させることを特徴とする、ミルタザピンの製造方法。
(もっと読む)
カフェイン類縁体
【課題】アデノシンレセプターに作用する新規な化合物を提供する。
【解決手段】一般式(1)あるいは一般式(2)で示されるカフェイン類縁体。
 (もっと読む)
(もっと読む)
新規なアミノピロロ[1,2−a]インドール及びアミノピリダジノ[1,6−a]インドール誘導体、それらの製造方法並びにそれらを含む医薬組成物
本発明は、式(I)[式中、Xは、CO又は式(II)であり、R1、R4は、水素、(C1〜C6)アルキル、(C1〜C6)アミノアルキル、(C1〜C6)ヒドロキシアルキル、アリール−(C1〜C6)アルキルであり、R2、R3は、水素、(C1〜C6)アルキル、(C1〜C6)アミノアルキル、(C1〜C6)ヒドロキシアルキルであるか、又は(R1とR2)、(R3とR4)は、それらを担持する炭素原子と一緒になって、炭素−炭素結合を規定し、R5、R6は、水素、(C1〜C6)アルキルであり、R7、R8は、水素、(C1〜C6)アルキル、アリール−(C1〜C6)アルキル、(C2〜C6)アルケニル、(C2〜C6)アルキニル、置換されている(C1〜C6)アルキル鎖又は置換されている(C1〜C6)アルキニル鎖であるか、或いは(R5とR8)、(R6とR7)は、それらを担持する炭素及び窒素原子と一緒になって、場合により置換されている、5、6又は7環員の複素環を規定するか、或いはR9は、水素、ハロゲン、(C1〜C6)アルキル、(C1〜C6)アルコキシ、ヒドロキシ、シアノ、ニトロ、(C1〜C6)ポリハロゲノアルキル、NR15R16、又は置換されている(C1〜C6)アルキル鎖であり、nは、整数0、1、2、3又は4であり、R10は、水素、(C1〜C6)アルキル、(C2〜C6)アルケニル、アリール−(C1〜C6)アルキル、(C1〜C6)ポリハロゲノアルキル、又は置換されている(C1〜C6)アルキル鎖であり、R11、R12は、−COOT又は−CH2O−U基であり、R13、R14は、水素又は(C1〜C6)アルキル基であるか、或いはそれらを担持する窒素原子と一緒になって、4〜8環員の複素環を規定し、R15、R16は、水素又は(C1〜C6)アルキル、(C2〜C6)アルケニルを表す]で示される化合物に関し;さらに本発明は、それらの鏡像異性体、ジアステレオ異性体、N−オキシド、及び薬学的に許容しうる酸又は塩基とのそれらの付加塩にも関する。用途は医薬である。 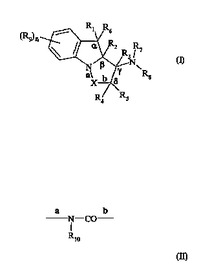 (もっと読む)
(もっと読む)
新規有害生物防除剤
【課題】有害生物防除剤として有用な新規化合物を提供する。
【解決手段】前記化合物は、式(1):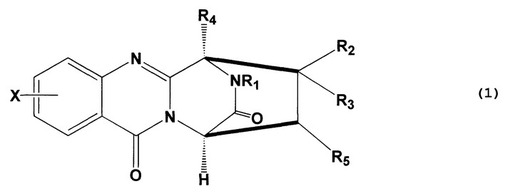
で表されるPF1198A誘導体(具体的には、例えば、9-クロロ-アラントリピノン)である。
(もっと読む)
キナーゼ阻害剤としてのピロロイソキノリン
式(I)の化合物またはその薬学的に許容される塩またはプロドラッグエステル:式中、基R1、R2、R3、R7およびXは、明細書中に定義の通りである。
【化1】
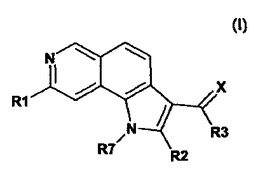 (もっと読む)
(もっと読む)
抗HIV剤としての1−ヒドロキシナフチリジン化合物
式I: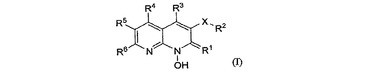
(式中、X及びR1からR6は本明細書に定義する通りである。)の1−ヒドロキシナフチリジン化合物(例えば1−ヒドロキシナフチリジン−2(1H)−オン化合物)はHIVインテグラーゼ及び/又はHIV RNase Hの阻害剤であると同時にHIV複製の阻害剤である。これらの化合物はHIV感染の予防及び治療と、エイズの発症の予防、遅延及び治療に有用である。これらの化合物は化合物自体又は医薬的に許容可能な塩としてHIV感染及びエイズに対して利用される。これらの化合物とその塩は場合によりHIV抗ウイルス剤、免疫調節剤、抗生物質及びワクチン等の他の抗HIV剤と併用して医薬組成物の成分として利用することができる。 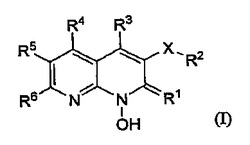 (もっと読む)
(もっと読む)
特定のアルキレンジアミンで置換された複素環
【課題】新規のNPY受容体、特にNPY1受容体の非ペプチド拮抗薬の提供。
【解決手段】特定のアルキレンジアミンで置換された、特定の、修飾単環、二環、又は三環式の複素環式コアをもつ化合物を用いる。
【効果】上記化合物は、受容体で神経ペプチドYの活性を阻害し、例えば、肥満及び過食のような摂食障害、及び特定の心臓血管系疾患、例えば高血圧を含む、神経ペプチドYの過多に関連した生理的障害を治療するのに有用である。
(もっと読む)
4−アミノ−ピリド[3,2−e]ピラジン、該化合物のホスホジエステラーゼ10の阻害剤としての使用、及び該化合物の製造方法
本発明は4−アミノ−ピリド[3,2−e]ピラジン、これらの製造方法、これらの化合物を含む医薬品及びこれらの化合物の薬理学的使用に関する。該化合物は、ホスホジエステラーゼ10の阻害剤であり、本発明による化合物の使用に影響され得るヒトを含むほ乳類の疾患を治療するための活性化合物として、中枢神経系においてホスホジエステラーゼ10活性を阻害する。更に詳細には、本発明は神経疾患及び精神疾患、例えば、症状として認知障害を含む精神病及び疾患の治療に関する。 (もっと読む)
有機電界効果トランジスタの製造方法
以下の工程:a)基板上に配置されたゲート構造と、ソース電極と、ドレイン電極とを有する基板を提供する工程と、b)前記基板のゲート構造と、ソース電極と、ドレイン電極とが配置された領域に、n型の有機半導体化合物を適用する工程とを含む有機電界効果トランジスタの製造方法において、前記のn型の有機半導体化合物が、式Iで示され、R1、R2、R3及びR4が、無関係に、水素、塩素もしくは臭素であるが、但し、これらの基の少なくとも1つは、水素ではなく、Y1が、OもしくはNRaであり、その際、Raが、水素もしくはオルガニル基であり、Y2が、OもしくはNRbであり、その際、Rbが、水素もしくはオルガニル基であり、Z1、Z2、Z3及びZ4が、Oであり、Y1がNRaの場合に、基Z1及びZ2の一方は、NRc基であってよく、その際、RaとRcは、一緒になって、末端の結合の間に2〜5個の原子を有する橋かけ基であり、Y2がNRbの場合に、基Z3及びZ4の一方は、NRd基であってよく、その際、RbとRdは、一緒になって、末端の結合の間に2〜5個の原子を有する橋かけ基である化合物から選択されることを特徴とする方法。 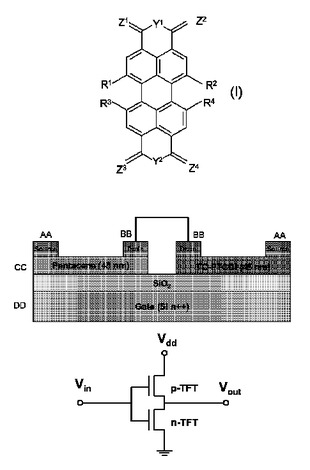 (もっと読む)
(もっと読む)
運動により誘発されるウマの肺出血の治療における5型ホスホジエステラーゼ阻害剤の使用
運動によって誘発されるウマの肺出血の治療における、新規な独立した治療方法としての5型ホスホジエステラーゼ阻害剤の使用が開示されている。この5型ホスホジエステラーゼ阻害剤は、それだけで作用する薬剤として、激しい運動を開始する約30分〜約7日前に、ウマに静脈内注射される。 (もっと読む)
環状化合物、その製造法および剤
【課題】新規な化合物又はその塩により、タキキニン受容体拮抗作用、特にサブスタンスP受容体拮抗作用を高める。
【解決手段】下記一般式で表される化合物又はその塩。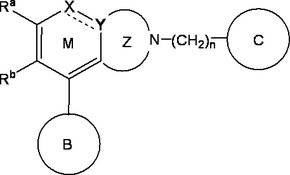
〔式中、M環は部分構造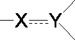
として−N=C<または−CS−N<を有する複素環を示し;RaおよびRbは、同一又は異なって水素原子又はM環における置換基を示し;B環は、置換基を有していてもよい環状炭化水素を示し;C環は、置換基を有していてもよい同素又は複素環を示し;Z環は置換されていてもよい含窒素複素環を示し;およびnは1ないし6の整数を示す。〕
(もっと読む)
HIV阻害性3,4−ジヒドロ−イミダゾ[4,5−b]ピリジン−5−オン
【化1】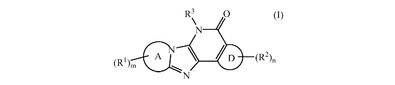
Aがピリジン、ピリミジン、ピラジン、ピリダジン、トリアジン、イミダゾール、ピラゾール、トリアゾール、テトラゾール、オキサゾール、イソオキサゾール、オキサジアゾール、チアゾール、イソチアゾール及びチアジアゾールを形成し;R1がハロ、シアノ、ニトロ、C1−6アルキル、ポリハロC1−6アルキル、−C1−6アルキル−OR4、−C(=O)−R5、−C(=O)−OR4、−C(=O)−NR6R7、−OR4、−O−C(=O)−C1−6アルキル、−O−C1−6アルキル−OR4、−O−C1−6アルキル−NR6R7、−O−C1−6アルキル−O−C(=O)−C1−6アルキル、−O−C1−6アルキル−C(=O)−OR4、−O−C1−6アルキル−C(=O)−NR6R7、−NR6R7、−NR8−C(=O)−R5、−NR8−C(=O)−OR4、−NR8−C(=O)−NR6R7、−NR8−C(=O)−C1−6アルキル−C(=O)−OR4、−NR8−C1−6アルキル−OR4、−NR8−C1−6アルキル−NR6R7、−NR8−C1−6アルキル−イミダゾリル、−NR8−SO2R9、−N=CH−NR6R7、−NH−C(=NH)−NH2、−SO2NR6R7及び−O−PO(OR8)2であり;Dがピリジン、ピリミジン、ピラジン、ピリダジン、ピロール、イミダゾール、ピラゾール、フラン、オキサゾール、イソオキサゾール、チオフェン、チアゾール及びイソチアゾールを形成し;R2がC1−6アルキル、ポリハロC1−6アルキル、ハロ、シアノ、−COOR4、−OR4及び−NR6R7であり;R3がフェニル、ピリジル、ピリミジニル、イミダゾピリジル、ピラゾロピリジル、トリアゾロピリジル、キノリン、イミダゾピリミジニル、ピラゾロピリミジニル、トリアゾロピリミジニル、ピリドピリミジニルであり;それらは場合により置換されていることができ;mが0、1、2又は3であり;nが0、1、2又は3である式(I)のHIV阻害性化合物、その塩、水和物、溶媒和物、N−オキシド又は立体異性体;これらの化合物を含有する製薬学的組成物、これらの化合物及び組成物の製造方法。 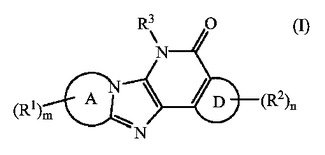 (もっと読む)
(もっと読む)
41 - 60 / 94
[ Back to top ]

