Fターム[4H006AA02]の内容
有機低分子化合物及びその製造 (186,529) | 発明の種類 (31,005) | 製造方法(←分離、精製、安定化) (14,615)
Fターム[4H006AA02]に分類される特許
14,441 - 14,460 / 14,615
水素化触媒の再生方法
不活性担体上のRu、Rh、Pd、Os、Ir及びPtからなる群から選択される少なくとも1種の触媒金属を含む使用ずみの水素化触媒を再生する方法であって、前記再生方法は本質的に、酸素の存在下で300〜700℃の温度における熱処理からなる。 (もっと読む)
方法
本発明は、放射性化合物を製造するのに用いる、前駆体に放射性カルボニル基を組み入れることによる、放射性化合物の新規製造方法に関する。これらの放射性化合物は、インビボでのイメージング技術、例えば陽電子放出断層撮影を含む多くの用途を有する。 (もっと読む)
ハロゲン化マグネシウム・アルコール付加物、その調製および用途
本発明はハロゲン化マグネシウム/アルコール付加物粒子類の調製方法に関し、前記方法は、不活性液体媒体中においてハロゲン化マグネシウム/アルコール付加物の溶融物を調製すること、前記ハロゲン化マグネシウム/アルコール付加物溶融物を高重力場において高速回転によって分散させハロゲン化マグネシウム/アルコール付加物溶融物の分散体を得ること、および前記溶融物分散体を冷却させハロゲン化マグネシウム/アルコール付加物の球状粒子類を形成させることを含む。さらに本発明は、本発明の方法によって調製したハロゲン化マグネシウム/アルコール付加物粒子類とオレフィン重合触媒調製におけるその用途に関する。 (もっと読む)
アルツハイマー病及び関連症状の治療
式(I)の化合物は、脳内へのβアミロイドの沈着を伴う疾病の治療において有用である。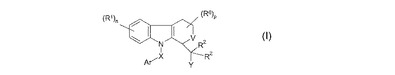
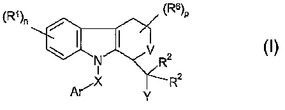 (もっと読む)
(もっと読む)
1−クロロ−3,3,3−トリフルオロプロペン(HCFC−1233zd)の低温での製造
フッ化水素との反応によって1,1,1,3,3−ペンタクロロプロパン(HCC−240fa)から1−クロロ−3,3,3−トリフルオロプロペン(HCFC−1233zd)を製造するための方法。それらの反応物質を、ルイス酸触媒またはルイス酸触媒の混合物の存在下、150℃より低い温度で、液相で反応させる。そして、反応で生成した塩化水素及びHCFC−1233zdを連続的に取り出し、そしてHCFC−1233zdを単離する。 (もっと読む)
ジヒドロフェナントレン単位を含む共役ポリマーとその使用
本発明は、式(I)の新規な構造単位を含む共役ポリマーに関する。本発明の材料は、ポリマー有機発光ダイオードにおいて用いられた際に、高められた効率とより長い駆動寿命により特徴づけられる。 (もっと読む)
ルイス酸を含むイオン液体の混合物
1種またはそれ以上のトリフラートもしくはビス(トリフルオロメチルスルホニル)イミド塩と、1種またはそれ以上のルイス酸の混合物を含み、ここで、混合物中のルイス酸のモル含量の総計が約0.01−98%である、イオン液体が提供され、それはルイス酸−触媒反応における触媒として有用である。 (もっと読む)
含フッ素アルキルエーテルの製造方法
穏やかな反応条件においても十分な反応速度が得られ、かつ反応後の蒸留等の後工程が効率的に実施できる、含フッ素アルキルエーテルの製造方法の提供。 反応容器内に非プロトン性極性溶媒、含フッ素エーテル、触媒、含フッ素アルキルアルコール、およびフッ素化オレフィンを導入した後、該含フッ素アルキルアルコールと該フッ素化オレフィンとを反応させて含フッ素アルキルエーテルを製造する方法であって、反応容器内に導入された、非プロトン性極性溶媒と含フッ素エーテルの2成分の比率が、質量比で非プロトン性極性溶媒/含フッ素エーテル=5/95〜80/20である含フッ素アルキルエーテルの製造方法。 (もっと読む)
1,3,3,3−テトラフルオロプロペンを製造するためのプロセス
本発明は、2段階プロセスにより1,3,3,3-テトラフルオロプロペン(HFC-1234ze)を製造するための経済的なプロセスを提供する。1-クロロ-3,3,3-トリフルオロプロペン(HCFC-1233zd)の1-クロロ-1,3,3,3-テトラフルオロプロパン(HCFC-244fa)および1,1,1,3,3-ペンタフルオロプロパン(HFC245fa)への弗化水素化が実施され、(HFC-1234)zeへの(HCFC-244)faの脱塩化水素および(HFC-245)faの脱弗化水素が続く。 (もっと読む)
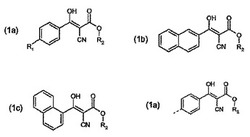
3−アリール−2−シアノ−3−ヒドロキシ−アクリル酸誘導体
【課題】3−アリール−2−シアノ−3−ヒドロキシ−アクリル酸誘導体
【解決手段】式
(式中、R1は水素原子、炭素原子数1乃至20のアルキル基、炭素原子数1乃至20の
アルコキシ基、CF3、炭素原子数6乃至10のアリール基を表すか、又は式
で表される基を表し、
R2は水素原子又は炭素原子数1乃至20のアルキル基を表す。)
で表される3−アリール−2−シアノ−3−ヒドロキシ−アクリル酸誘導体が開示されている。
該化合物は表面処理用の抗菌活性物質として用いられる。
(もっと読む)
過酸化ジアルキル類からのジアルキルエーテル類の除去
ジアルキルエーテル及び過酸化ジアルキルを含む混合物中のジアルキルエーテルの濃度を低減する方法であって、該混合物を強酸で処理することを含む方法が開示されている。 (もっと読む)
CPLA2阻害剤の製法
式(I):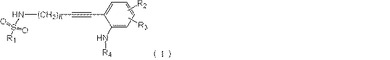
の化合物の調製法であって、化合物HC≡C−(CH2)n−NH2を化合物R1−SO2Clと反応させて、中間体化合物を生成させ、この中間体化合物を次いで式(II):
の化合物と反応させて、式(I)の化合物を生成させる方法。R1、R2、R3、R4およびnは特許請求の範囲において記載された定義を有する。式(I)の化合物は、cPLA2阻害剤である式(V):
のインドール誘導体の調製において有用である。 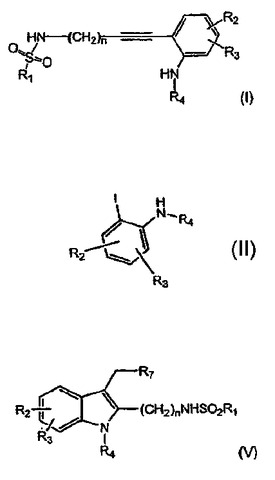 (もっと読む)
(もっと読む)
コーティングが施された触媒担体
【課題】プロピレンとアクロレインを高い収率で長期間にわたってアクロレインとアクリル酸にそれぞれ部分酸化する触媒担体を提供すること。
【解決手段】コーティング(3)が接着された表面(2)を有する触媒担体(1)であって、コーティング(3)が、総亀裂長さが少なくとも500m/m2となる長さ(5)を有する複数の亀裂(4)を有すると共に、少なくとも500N/m2の接着引張強度を有する触媒担体(1)、触媒担体のためのコーティングの製造方法、少なくとも1つの二重結合と酸素を含む有機分子の製造方法、吸水性ポリマーの製造方法、吸水性衛生用品の製造方法、化学製品、(メタ)アクリル酸の化学製品における使用に関する。
(もっと読む)
アルミナコート金属構造物及び触媒構造物
500℃〜750℃の間の温度である金属基板を、その上にセラミック先駆物質のスラリーの液滴を噴霧することによってセラミック層で被覆する。上記セラミックは、アルミナを含み、またわずか35質量%の分散性アルミナを有するアルミナゾル及びアルミナ粒子の混合物を噴霧することによってマクロ多孔性にされる。このやり方で、赤熱の表面に噴霧することによって、得られるセラミックと上記金属基板との非常に顕著な接着性の改良を導いた。次いで、触媒構造物を形成するために触媒的に活性な金属を上記セラミック層に配合してもよい。 (もっと読む)
ブチルヒドロキシアニソールの多形
ブチルヒドロキシアニソール(BHA)の新規な多形及びBHAの抗酸化特性を改善する方法を提供する。
 (もっと読む)
(もっと読む)
メルドニウム(Meldonium)塩、メルドニウム塩の調製方法、およびメルドニウム塩を主成分とする薬学的組成物
新規なメルドニウム塩、これらのメルドニウム塩を調製する方法、およびこれらのメルドニウム塩を主成分とする薬学的製剤について記載した。これらの塩の一般式はX−(CH3)3N+NHCH2CH2COOHで、その式のX−は、薬学的に受容可能な酸の中から選んだ酸のアニオンである。実際には、吸湿性がない、および/または熱的安定性が高い、および/または作用が持続する、フマル酸、リン酸、シュウ酸、マレイン酸およびパモ酸のメルドニウム水素塩、ならびにオロチン酸メルドニウムおよびガラクタル酸メルドニウムが特に適している。経口投与、非経口投与、直腸投与および経皮投与をするための、吸湿性がない、および/または熱的安定性が高い、および/または作用が持続する、3−(2,2,2−トリメチルヒドラジニウム)プロピオネートの塩を含む、新規な薬学的製剤も同じく記載している。 (もっと読む)
銀、バナジウムおよび推進剤金属を含有する多金属酸化物およびその使用
一般式I
Aga−cQbMcV2Od・eH2O I
(式中、aは0.3〜1.9の値であり、QはP、As、Sbおよび/またはBiから選択される1つの元素であり、bは0〜0.3の値であり、MはNb、Ce、W、Mn、Ta、Pd、Pt、Ruおよび/またはRhから選択される1つの金属であり、cは0.001〜0.5の値であり、ただし(a−c)は0.1以上であり、dは一般式Iの酸素以外の元素の原子価および頻度により決定される数であり、eは0〜20の値である)の多金属酸化物およびこれから製造される芳香族炭化水素の部分酸化のためのプレ触媒および触媒が記載される。
(もっと読む)
エチレンアミンの製造方法
本発明は、エチレンジアミン(EDA)を不均一系触媒の存在下で連続的に反応させることによって、エチレンアミンを製造するにあたり、反応を1つの反応塔中で実施する方法に関する。 (もっと読む)
置換アリールカルボン酸塩化物の製造方法
C1〜C20アルキル及び/又はハロゲンで一箇所以上で置換されたアリールカルボン酸塩化物(I)の製造方法において、第1段階において、C1〜C20アルキル及び/又はハロゲンで一箇所以上で置換された芳香族化合物(II)とCCl4とをフリーデル−クラフツ触媒の存在下で反応させて、相応のC1〜C20アルキル及び/又はハロゲンで一箇所以上で置換されたトリクロロメチル化芳香族化合物(III)を得て、そして第2段階において、トリクロロメチル化芳香族化合物(III)を触媒存在下で水処理又はプロトン酸処理して、アリールカルボン酸塩化物(I)を得る方法である。特に好ましい一実施形態は、トリクロロメチル化芳香族化合物(III)を中間生成物として単離することなく、かつ第1段階の溶剤中に溶解させて、第2段階において使用する。 (もっと読む)
アルキル化触媒及びアルキル化フェノールの製造方法
アルキル化触媒は金属酸化物からなり、表面積/体積比が約950〜約4000m2/m3である。 (もっと読む)
14,441 - 14,460 / 14,615
[ Back to top ]