Fターム[4C063EE05]の内容
Fターム[4C063EE05]に分類される特許
621 - 640 / 645
ニコチン誘導体の位置特異的合成
ニコチンアナログおよび誘導体を合成する方法が記載されている。本発明の方法は、C4位に置換基を有する鏡像異性的に純粋なニコチンアナログの位置特異的な製造に特に有用である。このような化合物の合成に有用な中間体も記載されている。 (もっと読む)
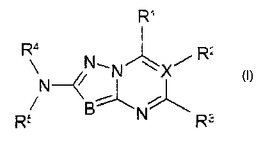
アミン誘導体
式(I)において、R1、R2、R3、R4、R5、BおよびXが請求項1に記載の意味を有する化合物は、チロシンキナーゼ、特にTIE−2、およびRafキナーゼ類の阻害薬であり、とりわけ腫瘍の治療のために使用することができる。
【化1】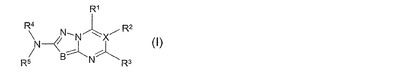
 (もっと読む)
(もっと読む)
A2Bアデノシンレセプターアンタゴニスト
喘息および下痢を含む、種々の症状を治療に有用なA2Bアデノシンレセプターアンタゴニストである新規化合物の合成法を開示する。 (もっと読む)
チアゾリジンジオンの製造方法
本発明は、チアゾリジンジオン前駆体のチアゾリジンジオン単位の5位にある環外二重結合の還元方法であって、a)塩基を含有する非エーテル溶媒中のチアゾリジンジオン前駆体の溶液又は懸濁液を製造する工程及びb)この溶液又は懸濁液を、亜ジチオン酸塩源泉と組み合わせる工程を含む方法を提供する。好ましい溶媒には、水性N,N−ジメチルホルムアミドが含まれる。亜ジチオン酸ナトリウムが好ましい亜ジチオン酸塩源泉である。特に、本件特許出願は、ピオグリタゾーン、ロジグリタゾーン及びトログリタゾーンの製造方法を開示する。
す。
(もっと読む)
イミダゾールの合成方法
本発明は、シアノ化合物をシリルアルキルイソシアニド化合物と反応させることによってイミダゾールを製造する方法を提供する。このようなイミダゾールは、有用な薬理学的活性化合物および/または薬理学的活性化合物の製造のための中間体である。  (もっと読む)
(もっと読む)
二座(Bipodal)配位子を有する金属錯体
本発明は、二極性配位子を有する新規の金属錯体に関する。このような化合物は、最も広い意味の電子産業に関連する、一連の異なるアプリケーションにおける機能性材料として利用される。 (もっと読む)
ピリミジン誘導体および中間体の製造方法
化合物(I)を化合物(II)と反応させて、化合物(III)を得、次いで化合物(IX)と反応させて、化合物(VIII)を得た後、好ましくは酵素反応により脱保護して、化合物(XII)を得る。本発明は、酵素阻害剤として有用なピリミジン誘導体および合成中間体の有利な製造方法を提供する。(式中、Pはアルキル基等を示し、R1およびR2はアルキル基等を示し、R3は置換基を有していてもよいアルキル基等を示し、R4は水素原子等を示し、R5は置換基を有していてもよいアラルキル基等を示し、Yは置換基を有していてもよいヘテロアリール基等を示す。) (もっと読む)
ロスバスタチン(E)−7−’4−(4−フルオロフェニル)−6−イソプロピル−2−’メチル(メチルスルホニル)アミノ!ピリミジン−5−イル!(3R,5S)−3,5−ジヒドロキシヘプタ−6−エン酸のカルシウム塩、および、それらの結晶質の中間体の製造方法
式(7):
(式中、Aは、アセタールまたはケタール保護基であり、Rは、アルキルである)で示される化合物からの、式(8)または式(10):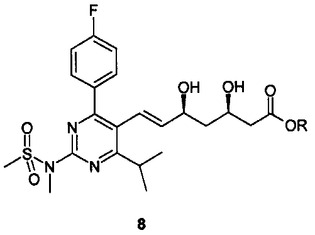

で示される単離された結晶化合物を介した、HMGCoAレダクターゼ阻害剤として有用な(E)−7−[4−(4−フルオロフェニル)−6−イソプロピル−2−[メチル(メチルスルホニル)アミノ]ピリミジン−5−イル](3R,5S)−3,5−ジヒドロキシヘプタ−6−エン酸のカルシウム塩の製造方法が説明される。式7、8および10で示される結晶質の中間体もまた説明される。 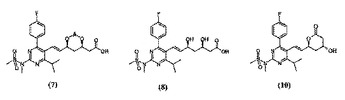 (もっと読む)
(もっと読む)
N−アミノ置換された複素環式化合物の製造方法
N−アミノ窒素複素環式化合物の製造のための改良方法が開示され、そして請求される。本発明の実施態様において、式(VI)の化合物が製造され、N−アミノ化の手段として、対応するインドール誘導体から出発し、そして引き続いて単一工程においてケト化合物との反応によってヒドラゾンを形成する。ヒドラゾンのさらなる還元及びピリジン化合物との引き続くカップリングにより、式VIの化合物又はその適切な塩が得られる。
【化1】
 (もっと読む)
(もっと読む)
新規な化合物
本発明は、式Ia又はIb:
【化1】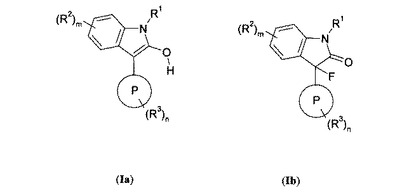
(式中、Pは、独立してN、OとSから選ばれる1又は2個のヘテロ原子を含み、その中で少なくとも1つのヘテロ原子が窒素である、5-又は6-員の芳香族複素環を表わし;R1は水素であり;R2はC1-6アルキル、シアノ、ハロゲン、(CO)OR10、及びCONR10R11から選ばれ; R3はC1-6アルキル、シアノ、ニトロ、(CO)OR4、C1-6アルキルNR4R5、OC2-6アルキルNR4R5、CONR4R5、及び(SO2)NR4R5から選ばれ;mは0、1、2、3又は4であり;nは0、1、2、3又は4である)
の遊離の塩基又はその塩としての新規化合物、それらの製造方法及びそこで使われる新規中間体、並びに、該治療的活性化合物を含む薬学的製剤、並びに、治療における該活性化合物の使用に関連する。  (もっと読む)
(もっと読む)
高眼圧症を治療するための眼用組成物
本発明は、緑内障または患者の眼における眼内圧の上昇につながる他の状態を治療するための、構造式Iの強力なカリウムチャンネルブロッカー化合物またはこれらの処方に関する。本発明は、哺乳動物種、特に、ヒトの眼に神経保護効果をもたらすためのこのような化合物の使用にも関する。 (もっと読む)
ベンゾオキサゾールアセトニトリル
本発明は、式(I)のベンゾオキサゾールアセトニトリルならびにそのようなベンゾオキサゾールアセトニトリルを含有する医薬調合物に関する。前記ベンゾオキサゾールアセトニトリルは、II型糖尿病、耐糖能不全、インスリン抵抗性、肥満、多嚢胞性卵巣症候群(PCOS)を含んで成る、インスリン抵抗性または高血糖によって媒介される代謝性障害の処置に有用である。さらに、本発明は、ベンゾオキサゾールアセトニトリル(I)の調製方法に関する。Aは、ピリミジニルである。Lは、第二もしくは第三アミノ基であるか、もしくはN、O、Sから選択される少なくとも1個のヘテロ原子を含有する3〜8員ヘテロシクロアルキルであり、またはLは、アシルアミノ部分である。R1は、水素、スルホニル、アミノ、CiC6−アルキル、C2〜C6−アルケニル、C2〜C6−アルキニルもしくはC1〜C6−アルコキシ、アリール、ハロゲン、カルボキシ、アミノカルボニル、シアノまたはヒドロキシを含んで成る、またはこれらから成る群より選択される。 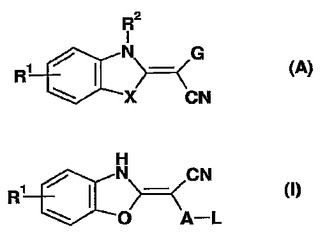 (もっと読む)
(もっと読む)
エナンチオピュアな化合物の製造方法
活性化されているカルボキシル基と反応することのできる少なくとも1種の官能基を含むエナンチオピュアな化合物の、前記化合物のエナンチオマーの混合物から出発する製造方法であって、
(a)前記エナンチオマーの混合物及びエナンチオピュアなアミノ酸に基づく試薬を含む反応媒体であって、当該試薬における前記アミノ酸の少なくとも1つのアミノ基が保護基によって保護されており、且つ当該試薬における前記アミノ酸の少なくとも1つのカルボキシル基が活性化されている反応媒体を、前記活性化されているカルボキシル基と反応することのできる官能基と、前記活性化されているカルボキシル基との反応を引き起こすのに適切な条件に付して、カルボニル結合を形成し;
(b)得られたジアステレオマーの混合物を分離操作に付し、本質的にジアステレオマーからなる少なくとも1つのフラクションを得て;
(c)前記フラクションの少なくとも一部を、前記保護基が本質的に安定な条件下で前記カルボニル結合の開裂段階に付し;及び
(d)エナンチオピュアな化合物及び少なくとも1つのアミノ基が前記保護基によって保護されている前記アミノ酸のエナンチオピュアな誘導体が回収される、
方法。
(もっと読む)
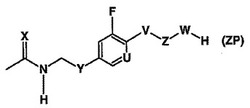
オキサゾリジノン‐キノロンハイブリッド調製用中間体
本発明は、化学的に安定なリンカーによってキノロンおよびオキサゾリジノンの薬理作用団が互いに結合した化合物の新規で効率的な合成のための中間体(ZP)に関する。 (もっと読む)
4−アリル−ニコチンアミド誘導体の製造方法
本発明は、一般式[式中、置換基は請求項1に定義されたとおりである]の化合物の製造方法であって、a)式Xの化合物と、式XIIIの化合物とを反応させて、式XIVa、XIVの化合物を得る工程と、b)式XIV/XIVaの化合物のOH/=O官能部分を、POCl3、PBr3、MeI、または(F3CSO2)2Oを含む群から選択される離脱基を含む試薬によって、離脱基Pに変換し、式XV[式中、Pは、ハロゲンまたはトリフロオロメタンスルホネートである]の化合物を形成する工程と、c)前記離脱基Pを、HR2によりR2に置換して、式XVIの化合物を形成する工程と、d)H2SO4、HCl、または酢酸を含む酸性媒体中で、ニトリル官能部分を加水分解して、式Iの化合物を得る工程とを含むことを特徴とする、製造方法に関する。式Iの化合物は、NK−1拮抗活性を有する治療上有効な化合物の製造のための有用な中間体である。 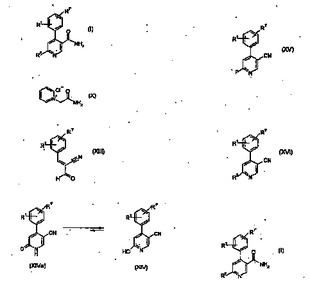 (もっと読む)
(もっと読む)
合成方法
式(I)で示されるキナゾリン−4−オン誘導体は、式(II)で示されるアミドを環化して、式(III)で示されるキナゾリン−4−オン誘導体を形成する工程を含む方法により製造することができる。
 (もっと読む)
(もっと読む)
PNAモノマーおよび前駆物質
本出願は、PNA(ペプチド核酸)オリゴマー製造用の一般式(I)のモノマーに関し、また、あらかじめ規定された配列のPNAオリゴマーおよびランダムな配列のPNAオリゴマーの両者についての合成方法を提供する。 (もっと読む)
立体障害N−ヒドロカルビルオキシアミンを製造するための過酸化水素触媒法
過酸化物または過酸化水素同等物、触媒量の過酸化物分解遷移金属塩、金属酸化物または金属−配位子錯体、活性化水素原子を含まない炭化水素溶剤、および不活性共溶剤を使用する方法によって、立体障害N−ヒドロカルビルオキシアミン(I)を、ヒンダードアミンN−オキシル化合物(II)から製造する。これらの化合物は、様々な有機基質の、熱および光安定剤として有用である。 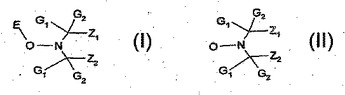 (もっと読む)
(もっと読む)
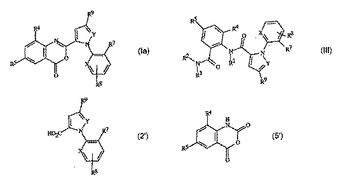
縮合オキサジノンの製造方法
縮合オキサジノンの製造方法を開示する。この方法では、第三級アミンの存在下で、カルボン酸を塩化スルホニルおよびイサト酸無水物と接触させる。ここで、該塩化スルホニル対該カルボン酸の公称モル比は約1.0〜1.5であり、そして該イサト酸無水物対該カルボン酸の公称モル比は約0.8〜1.2である。また、式(1a)の化合物を使用する式(III)の化合物の製造方法も開示され、該方法は式(1a)の縮合オキサジノンを、塩化スルホニルとして式LS(O)2Clの化合物、カルボン酸として式(2’)の化合物、およびイサト酸無水物として式(5’)の化合物を使用して上記方法によって製造することを特徴とする。
【化1】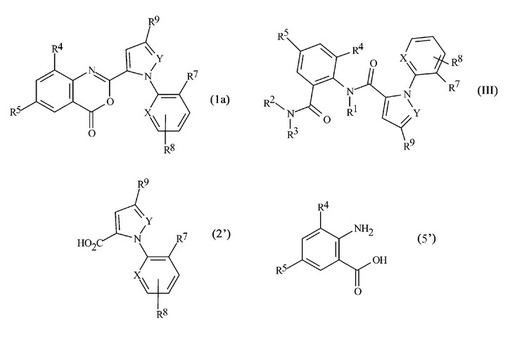
[式中、L、X、YおよびR1〜R9は、開示中に定義された通りである]
 (もっと読む)
(もっと読む)
液晶化合物
【課題】本発明は式Iの液晶化合物、その合成方法、その液晶媒体中での使用、式Iの化合物の少なくとも1種を含有する液晶媒体、およびこの媒体を含む電気光学ディスプレイに関する。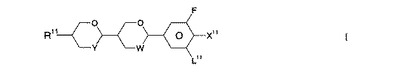
(式中、R11はアルキル基等、X11はF、OCF3、OCHF2等、L11はHまたはF、Y、WはO、CH2を表す。) 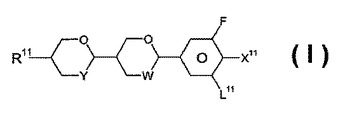 (もっと読む)
(もっと読む)
621 - 640 / 645
[ Back to top ]