ポリ(カプロラクトンフマレート)、ポリ(エチレングリコールフマレート)およびそれらのコポリマーに基づく親水性/疎水性ポリマーネットワーク
ポリ(エチレングリコールフマレート)を製造する改良された方法を開示する。また、ポリ(エチレングリコールフマレート)と、ポリ(プロピレンフマレート)(PPF)およびポリ(カプロラクトトンフマレート)(PCLF)等の疎水性ポリマーとを化学的に架橋または光架橋して、制御可能な親水性を有する種々のヒドロゲル(図1)を生成する方法を開示する。ヒドロゲルは、骨格再構築用途のための注入可能なin−situで硬化するスカフォードの作製に有用である。ヒドロゲルを含む注入可能な材料は、薬剤徐放において有用でありうる。
【発明の詳細な説明】
【技術分野】
【0001】
[関連出願の相互参照]
本出願は、2006年4月29日出願の米国特許仮出願第60/676,158号の優先権を主張するものである。
【0002】
[連邦政府の支援による研究に関する記載]
本件は、助成金番号AR45871及びEB03060での米国国立衛生研究所による支援を受けたものである。
【0003】
[発明の背景]
1.発明の分野
本発明は、ポリ(エチレングリコールフマレート)を製造する改良された方法、ならびに、ポリ(エチレングリコールフマレート)と、ポリ(プロピレンフマレート)およびポリ(カプロラクトンフマレート)等の疎水性ポリマーとを化学的に架橋または光架橋して、制御可能な親水性を有する種々のヒドロゲルを生成する方法に関する。ヒドロゲルは、組織工学用途および薬剤徐放用途のための生体適合性、生体吸収性の注入可能な、in−situで硬化するスカフォードとして有用である。
【背景技術】
【0004】
2.関連する分野の説明
骨再生に関する臨床的要求は多岐にわたっており、米国では、癒合を達成するために骨移植処置を必要とする骨格欠損を有する患者が、毎年、おおよそ1,000,000人いる。これらは、原発性および転移性腫瘍の切除、骨格傷害後の骨量減少、骨欠損に伴う初回および修正全関節形成術、脊髄関節固定術、ならびに骨粗しょう症性不全骨折後の骨梁の空隙から生じる申請を含む。骨移植材料の選択、作製および適用の際に行う現行の臨床上の決定は、しばしば多くの要素を含む。構造的展望から、外科的処置計画を決定する前に幾つかの決定に取り組む必要がある。
【0005】
骨格欠損を治療する現行の臨床上の方法は、骨の移植、または連続性を回復させるための他の材料の使用を含む。自己骨移植は、骨形成原細胞、骨誘導因子および治癒のための骨伝導マトリックスなどの必須要素をもたらすため、骨置換術のゴールドスタンダードになっている。しかし、自己移植骨の限られた供給量とドナー部位の病的状態の両方により、単独で用いることができるケースの範囲が制限される。同種移植骨は、豊富な供給量で利用できるが、自己移植骨と比較して低い移植片組み込み率、およびドナーからホスト(宿主)への病原体移行の可能性を含む欠点を有する。
【0006】
金属は、欠損部位での即時的な機械的支持を実現するが、宿主組織との理想的な全体にわたる一体化と言えるほどのものは示さず、金属の疲労破損前に骨が治癒しなければ疲労荷重のために結局失敗することもある。セラミック、例えば、β−リン酸三カルシウム(β−TCP)およびハイドロキシアパタイトは、両方とも、骨伝導性であり、ならびに金属プロステーシスの表面コーティングとして骨へのそれらプロステーシスの結合を強化するために臨床使用されている。粒子形態で、それらは、主として圧縮状態のポリマー複合材料に機械強度増加をもたらすが、ねじり力および曲げ力への抵抗性の強化にはあまり有効でない。ポリ(メチルメタクリレート)骨セメントは、注入または成形することができ、時には、空洞性欠損および分節性欠損(例えば、各々、巨細胞腫瘍の掻爬に起因するもの、または脊椎の転移性疾患における椎体の切除に起因するもの)の両方を充填するために使用される。しかし、発熱性重合反応中に温度が100℃まで上昇することがあり、放出される熱により局所組織は損傷の危険にさらされる。加えて、ポリ(メチルメタクリレート)は非生分解性であり、それ故、時間が経つにつれて疲労損傷が蓄積し、結局、機械的破損を被ることもある。
【0007】
合成生分解性ポリマーは、現在利用することができない治療選択肢を与えることができる。これらの材料は、事実上無限の供給量で製造することができ、それらの設計の自由度により、様々な機械的、生物学的、分解、および流動学的特性を有する広範なポリマーを合成することができる。例えば、それらの機械的特性および分解特性は、合成中にポリマーの分子量を変えることにより操作することができ、従って、特定の用途に合うように調整することができる。骨格再生用生体材料の注入可能な性質は、限られた接近容易性または不規則な形を有する欠損を充填するために理想的であろう。例えば、現在臨床使用されている低侵襲性内視鏡法により、注入可能な形態の生体材料を後側面横突間プロセスの脊椎固定のために挿入することができる。これは、移植材料を所定の位置に置くために現在は行わなければならない広範囲の露出および筋肉剥離からの外科的外傷を減少させるであろう。注入可能な材料は、周囲の皮質骨に大きな進入路用の穴を作らずに関節周囲骨折、骨粗しょう症性脊髄骨折又は骨嚢胞からの海綿状空隙に配置することができよう。これらの臨床の状況が、骨組織工学用の注入可能な生分解性ポリマー複合材料の開発の動機付けを表している。
【0008】
薬剤および成長因子等の生理活性分子の徐放(controlled release)は、疾患部位における細胞の機能および組織の形成を調節することができることから、組織工学の重要な側面となってきている。生分解性材料内への薬剤、タンパク質および他の生理活性剤の封入は、含有物質の放出プロファイルを制御する効果的な方法である。
【0009】
近年、開発されている注入可能な材料およびヒドロゲルは、これらの多岐にわたる医学的用途のための多くの設計基準を満たしている。ポリエチレングリコール(PEG)誘導性ポリ(エチレングリコールフマレート)(PEGF)は、注入可能なin−situで架橋性の生分解性ヒドロゲルとして開発された(Jo,Macromolecules,2001,34,2839;米国特許第6,884,778号および米国特許出願第2002/0028189号を参照)。PEGFは、ポリエチレングリコールとフマル酸クロリドとの縮重合によって合成されるフマレート部分を有するPEGの親水性オリゴマーである。このマクロマー中のフマレート基は、in−situで架橋、ならびに加水分解による生分解を可能にする。過硫酸アンモニウムとアスコルビン酸とから成る化学開始系を用いて、紫外光を必要とすることなくヒドロゲルを形成する(Temenoff,J.Biomed.Mater.Res.,2001,59,429を参照)。PEGFヒドロゲル上の骨髄ストローマ細胞(MSC)の付着は、モデル細胞接着特異的なペプチドを用いて研究された(Shin,J.Biomed.Mater.Res.,2002,61,169を参照)。モデルRGDペプチドを、分子量3400g/molのアクリル化PEGに結合した後、PEGFヒドロゲルに組み込んだ(Jo他、「機能化ポリマーネットワークの調製のためのGRGDペプチドによるオリゴ(ポリ(エチレングリコール)フマレート)マクロマーの修飾(Modification of Oligo(poly(ethylene glycol) fumarate) with a GRGD Peptide for the Preparation of Functionalized Polymer Networks)」,Biomacromolecules,2001,2,255を参照)。
【0010】
PEGFのPEG鎖長、架橋密度または初期ペプチド濃度を変えることによって、広範な物理特性を有するヒドロゲルが合成されうる。ペプチド濃度が増大すれば、930および2860g/molのPEG分子量を有するPEGFヒドロゲルへのMSCの付着が高まる。しかしながら、6090g/molのPEG分子量を有するPEGFヒドロゲルに付着したMSCの数は、ペプチド密度にかかわらず一定に保たれた。また、PEGFのPEG鎖長は細胞付着の程度に影響を与えた。例えば、PEGFヒドロゲル1g当たり1mmolペプチドがPEGFに組み込まれる場合、初期播種密度に対する細胞付着の程度は、930、2860および6090g/molのPEG分子量を有するPEGFについてそれぞれ、93.9±5.9%、64.7±8.2%、および9.3±6.6%であった。一方、PEGFヒドロゲルの架橋密度は、細胞付着に重大な影響を与えるものではなかった。細胞播種前に可溶性RGDの存在下で細胞がインキュベートされるときにRGD修飾ヒドロゲルへのMSC付着が競合的に阻害されたため、相互作用は配列特異的であった。これらの結果は、ペプチド濃度を変えることにより、PEGFヒドロゲルへの細胞付着が調節されることができることを示している。また、PEGFマクロマーは、N,N’−メチレンビスアクリルアミド(MBA)により架橋されて、間葉幹細胞のための細胞キャリアとしてin−situで架橋する注入可能なスカフォードを作製する(Jabbari,14th Int.Symp.Microencap.Proceed.,2000,54を参照)。この系は、場合によっては骨軟骨症の治療に有用である。過硫酸アンモニウムとN,N,N’,N’−テトラメチルエチレンジアミン(TMED)から成る酸化還元開始剤の新規な組み合わせをこの系において使用し、中性のpHを得た。間葉幹細胞(MSC)はこの注入可能な系に首尾良く播種された。完全な骨形成培地中で培養したこの封入MSCは、アルカリ性脱リン酸酵素活性を示し、21日までの間、ミネラル化マトリックスを増大させた。
【0011】
ポリ(プロピレンフマレート)(PPF)は、そのフマレート二重結合を通じて修飾又は架橋されうる不飽和直鎖状ポリエステルである。例えば、米国特許第5,733,951号明細書を参照。ポリ(ε−カプロラクトン)(PCL)は、周知の生分解性ポリマーであり、吸収性縫合糸としての使用がFDAにより認可されている。卓越した生体適合性および可撓性を有する。PCLは、一時的関節スペーサー(Elfick,Biomaterials,2002,23,4463−7を参照)および組織工学的皮膚(tissue-engineered skin)(Ng,Tissue Engineering,2001,7,441−55を参照)用の可能性ある材料として最近研究された。PCLセグメントおよびフマレートセグメントに基づく注入可能なコポリマー、ポリ(カプロラクトンフマレート)(PCLF)が研究されている。PCL単位の存在のため、PCLF鎖は、PPF鎖よりずっと可撓性である。このことにより、PCLFは、架橋剤を一切使用せずに自己架橋することができる。PCT国際公開WO2005/004811号パンフレットを参照。
【0012】
光架橋は、2つの高分子間または1つの高分子中の2つの異なる部分間の共有結合の形成である。光架橋は、インビボでの硬化を可能にし、これは、外科医の移植可能なポリマーの配置および取り扱いに大きな融通性をもたらす。他の架橋法を超える光架橋の主な利点は、重合の空間的および時間的制御、室温での速い硬化速度、ならびに移植中の成形の容易さおよび可撓性である(Anseth,Nature Biotechnology,1999,17,156−9を参照)。
【0013】
これまでのポリ(エチレングリコールフマレート)(PEGF)合成方法の主な欠点は、暗色のPEGF生成物、および重縮合におけるプロトンスカベンジャートリエチルアミンによる比較的低い反応効率である。
【発明の開示】
【発明が解決しようとする課題】
【0014】
従って、ポリ(エチレングリコールフマレート)を製造する改良された方法が必要とされる。また、ポリ(エチレングリコールフマレート)と、ポリ(プロピレンフマレート)(PPF)およびポリ(カプロラクトンフマレート)(PCLF)等の疎水性ポリマーとを化学的に架橋または光架橋して、制御可能な親水性、ならびに制御される膨潤特性および機械特性を有する種々のヒドロゲルを生成する。
【0015】
[発明の概要]
本発明では、金属塩プロトンスカベンジャー、好ましくはアルカリ金属炭酸塩プロトンスカベンジャー、最も好ましくは炭酸カリウムを用いて、ポリ(エチレングリコールフマレート)を調製する。本発明は、時間消費を大幅に減少させ、かつ最終生成物の分子量をより大きくする修飾PEGF合成プロセスを有する。例えば、この方法は、5000g/molを超える重量平均分子量を有するポリ(エチレングリコールフマレート)を調製することができる。
【0016】
新たに合成されたPEGFは、それ自体、またはポリ(プロピレンフマレート)(PPF)およびポリ(カプロラクトンフマレート)(PCLF)等の不飽和疎水性ポリマーと、化学的に架橋または光架橋され、制御可能な親水性、ならびに膨潤特性および機械特性を有する種々のヒドロゲルを生成することができる。ヒドロゲルは、骨格再構築用途のための注入可能なin−situで硬化するスカフォードを作製するのに有用でありうる。
【0017】
また、本発明は、カプロラクトンフマレート単位とエチレングリコールフマレート単位とを含むコポリマー(PEGF−co−PCLF)を製造するプロセスを提供する。
【0018】
ヒドロゲルを含む注入可能な材料はまた、種々の研究および臨床的側面、特に、薬剤徐放において有用でありうる。例えば、1つまたは複数の生理活性剤が、ヒドロゲルに添加されるか、またはヒドロゲル粒子内に取り込まれる。生理活性剤(複数可)は、所望の生理学的効果に応じて選択される。
【0019】
本発明のこれらのおよび他の特徴、態様、および利点は、以下の詳細な説明、図面、および添付の特許請求の範囲に鑑みて、より理解されるであろう。
【発明を実施するための最良の形態】
【0020】
[発明の詳細な説明]
1つの態様において、本発明は、ポリ(エチレングリコールフマレート)を製造する方法を提供する。本方法において、ポリエチレングリコールは、金属塩の存在下でフマル酸またはその塩(例えば、フマル酸クロリド)と反応する。この金属塩は、アルカリ金属塩、好ましくはアルカリ金属炭酸塩、最も好ましくは炭酸カリウムであってもよい。本方法は、従来の方法のような暗色の生成物の形成を防ぐ。また、本方法は、5000g/molを超える重量平均分子量を有するポリ(エチレングリコールフマレート)を調製することができる。
【0021】
別の態様において、本発明は、カプロラクトンフマレート単位とエチレングリコールフマレート単位とを含むコポリマー、およびPEGF−co−PCLFコポリマーを製造するプロセスを提供する。エチレングリコールフマレート単位は親水性であり、カプロラクトンフマレート単位は疎水性であるため、PEGF−co−PCLFコポリマーは両親媒性となる。これにより、親水性成分および親水性成分の両方の組成およびブロック長を調節することによってヒドロゲルの膨潤率を制御する1つのアプローチが提供される。例示的なコポリマーは、式
【化1】

(式中、nおよびmは整数である)を有する。
【0022】
PEGF−co−PCLFは、ポリカプロラクトンジオールと、ポリエチレングリコールと、フマル酸またはその塩とを反応させることによって調製することができる。PEGF−co−PCLFはまた、(i)ポリカプロラクトンジオールとフマル酸またはその塩とを反応させることによって調製される第1のポリマーと、(ii)ポリエチレングリコールとフマル酸またはその塩とを反応させることによって調製される第2のポリマーとを反応させることによって調製することができる。コポリマーは、組織再生用のスカフォードを調製するのに有用な架橋性の生分解性材料に組み込むことができる。
【0023】
さらに別の態様において、本発明は、ポリ(プロピレンフマレート)と架橋するポリ(エチレングリコールフマレート)を含む生分解性材料を提供し、これは組織再生用のスカフォードとして有用である。本材料は、ポリ(エチレングリコールフマレート)、ポリ(プロピレンフマレート)およびフリーラジカル開始剤または光開始剤を含む、架橋性の生分解性材料から生成することができる。好ましくは、本材料は自己架橋性である。本材料は光架橋性であってもよい。1つの形態において、本材料は注入可能な代用骨である。
【0024】
さらに別の態様において、本発明は、ポリ(カプロラクトンフマレート)と架橋するポリ(エチレングリコールフマレート)を含む生分解性材料を提供し、これは組織再生用のスカフォードとして有用である。本材料は、ポリ(エチレングリコールフマレート)、ポリ(カプロラクトンフマレート)およびフリーラジカル開始剤または光開始剤を含む、架橋性の生分解性材料から生成することができる。好ましくは、本材料は自己架橋性である。本材料は光架橋性であってもよい。1つの形態において、本材料は注入可能な代用骨である。
【0025】
従って、本発明は、組織再生用のスカフォードを調製するのに有用な光架橋性の生分解性材料を提供する。上記のように、本発明による例示的な材料としては、(i)カプロラクトンフマレート単位とエチレングリコールフマレート単位とを含むコポリマー、(ii)ポリ(エチレングリコールフマレート)とポリ(カプロラクトンフマレート)との配合物、または(iii)ポリ(エチレングリコールフマレート)とポリ(プロピレンフマレート)との配合物が挙げられる。光架橋性の生分解性材料は、光開始剤、例えば、ベンゾインおよびベンゾインエーテル化合物、ベンジルケタール化合物、アセトフェノン化合物、アミノアルキルフェノン化合物、ヒドロキシアルキルフェノン化合物、アシルホスフィンオキシド、アシルホスフィンスルフィド、フェニルグリオキシル酸化合物、ベンゾフェノン化合物、チオキサントン化合物、およびそれらの混合物を含む。1つの例示的な材料において、光開始剤はビスアシルホスフィンオキシドである。
【0026】
本材料は、注入可能な代用骨または注入可能な骨セメントであり得る。本材料の注入可能な性質により、限られた接近容易性または不規則な形の欠損を充填することができる。例えば、現在臨床使用されている低侵襲性内視鏡法により、注入可能な形態の本材料を後側面横突間プロセスの脊椎固定のために挿入することができる。注入可能な材料は、周囲の皮質骨に大きな進入路用の穴を作ることなく関節周囲骨折、骨粗しょう症性脊髄骨折または骨嚢胞からの海綿状空隙に配置することができる。
【0027】
本発明の材料の注入可能な性質に関して、注入の温度範囲は広く、混合物の融点と混合物に使用される溶媒の沸点との間であり得る。通常、ポリマー混合物は、便宜上、室温で注入される。
【0028】
本発明に係る生分解性材料は、自己架橋性でありうるため、架橋剤を含む必要がない。一般に、架橋剤は、架橋中、隣接する二重結合の架橋を助長するために使用される。本発明の自己架橋性および/または光架橋性の生分解性材料は、架橋剤を一切必要としないため、生物医学的用途における毒性の懸念を最小にする。しかし、架橋剤を使用することもできる。架橋剤の例としては、アクリレートモノマーがある。
【0029】
本発明の架橋性材料は、組織再生用のスカフォードの形成に適する。1つの形態において、本架橋性材料は、多孔性スカフォードの形成を可能にするポロゲンを含む。適するポロゲン類としては、多孔性スカフォードを形成するソルトリーチング(salt leaching)法において使用することができる塩結晶(例えば、塩化ナトリウム)が挙げられる。このタイプの粒子リーチング(particle leaching)法の例は、米国特許第6,436,426号、同第6,379,962号および同第5,514,378号において見出すことができる。ポロゲンは、PCT国際公開第2005/020849号パンフレットに記載されているようなヒドロゲルポロゲンであってもよい。ポロゲンの選択は、架橋プロセスにより左右されることがある。ポロゲンは、架橋フィルムの製造に用いることができるが、それは、ポロゲンの物理的性質および色に依存する。また、一部のポロゲンは、UV光を遮断し、その結果、光架橋手順を非効率にすることがある。従って、本発明の光架橋性の生分解性材料は、所望の最終製品に依存して、ポロゲンを含むこともあり、含まないこともある。
【0030】
本架橋性材料は、粒子または繊維強化材料をさらに含むことがある。ハイドロキシアパタイトが強化材料としての役割を果たすのが、特に有利である。骨無機質の組成に関する類似性、細胞機能の生理活性および促進、ならびに骨伝導性のためである。これらの強化材料は、単層カーボンナノチューブを含むこともある。
【0031】
本架橋性材料は、1つ以上の生理活性剤をさらに含むことがある。本明細書において用いる場合の「生理活性剤」は、限定ではないが、体内で局所的または全身的に作用する生理または薬理学的活性物質を包含する。生理活性剤は、疾病または疾患の治療、予防、診断、治癒または緩和のために使用される物質、または身体の構造もしくは機能に影響を及ぼす物質、または所定の生理環境に置かれた後、生理活性になるか、より活性になる物質である。生理活性剤としては、限定ではないが、酵素、有機触媒、リボザイム類、有機金属化合物、タンパク質、糖タンパク類、ペプチド類、ポリアミノ酸、抗体、核酸、ステロイド性分子、抗生物質、抗菌剤、サイトカイン類、成長因子、炭水化物、疎油性物質、脂質、細胞外基質、並びに/又はその個々の成分、製剤および治療薬が挙げられる。
【0032】
この架橋性の生分解性材料は、促進剤も含むことがある。促進剤の非限定的な例としては、トルイジン類(例えば、N,N−ジエチル−p−トルイジン(「DET」)およびN,N−ジメチル−o−トルイジン(「DMT」))、アセチルフェニルヒドラジン、マレイン酸、キニン類(例えば、ナフタキノンおよびアントラキノン)、ならびにアルキルメルカプタン類が挙げられる。多くの場合、光架橋プロセスでは促進剤が必要とされない。全ての手順が相当短い(例えば、30分未満)であるためである。
【0033】
本明細書において用いる場合、「生体適合性」材料は、重度のまたは漸増的反応とは対照的に、軽度の、多くの場合一時的な、移植反応しか誘発しないものである。本明細書において用いる場合、「生分解性」材料は、正常なインビボ生理条件下で、代謝または排泄され得る成分に分解するものである。本明細書において用いる場合、「生体吸収性」材料は、身体の化学的/生物学的作用に起因して、限られた期間をかけて分解するものである。「注入可能な」とは、本コポリマーを医療用注射器により一定部位に送達することができることを意味する。「自己架橋性」とは、本発明のポリマーの官能基と本発明の同じまたは別のポリマーの官能基との間の架橋を形成する架橋剤を用いることなく、本発明のポリマーの官能基が、本発明の同ポリマーまたは別のポリマーの官能基と架橋できることを意味する。「光架橋性」とは、光開始剤の存在下、光子(例えば、UV光)の適用により、本発明のコポリマーの官能基が、本発明の同じポリマーまたは別のポリマーの官能基と架橋できることを意味する。
【0034】
本明細書における用語「分子量」は、「重量平均分子量」(Mw=ΣiNiMi2/ΣiNiMi)を指す。様々な方法で重量平均分子量(Mw)を決定することができるとはいえ、利用する方法に依存して結果は多少異なり、ゲル透過クロマトグラフィーを利用するのが適便である。本明細書において用いる場合、用語「数平均分子量」(Mn)は、存在する全モル数で割った、ポリマーサンプル中の全ての分子の合計重量を指す(Mn=ΣiNiMi/ΣiNi)。様々な方法で数平均分子量を決定することができるとはいえ、利用する方法に依存して結果は多少異なり、ゲル透過クロマトグラフィーを利用するのが適便である。本明細書において用いる場合、用語「多分散性」は、材料の「重量平均分子量」を「数平均分子量」で割った比(Mw/Mn)を指す。
【実施例】
【0035】
以下の実施例は、本発明をさらに例証するために提示したものであり、いかなる点においても本発明を制限するためのものではない。
【0036】
A.ポリ(エチレングリコールフマレート)(PEGF)マクロマーの合成
ポリ(エチレングリコール)(PEG、Aldrich)を、トルエン中で共沸蒸留によって乾燥させた後、減圧下で排水して残存する微量の水を除去した。フマル酸クロリド、PEGおよび炭酸カリウムを、1:1:1.5のモル比となるように測った。PEG3.4Kのポリマー密度は、1.0926g/cm3である。PEGを塩化メチレンに溶解し(1:2(体積))、粉末炭酸カリウムと共に2Lの三つ口フラスコに入れた。この混合物を、オーバーヘッド機械式攪拌機を用いて攪拌し、スラリーを形成した。塩化メチレンに溶解したフマル酸クロリド(1:1体積比)をスラリーに滴下した。反応混合物を窒素ブランケット下で(フマル酸クロリド添加速度を変えることによって)50℃に維持した。さらなるフマル酸クロリドを随時添加して、攪拌を促した。フマル酸クロリド添加の完了後、混合物を、遠心分離管に移し、炭酸カリウムが完全に除去されるまで15分間4000rpmで遠心沈殿させた。その後、上澄みを石油エーテルに滴下して溶液からポリマーを取り除き、沈殿物を回転蒸発して、琥珀色の粘稠液を得た。表1は、PEGFを重合するための組成(formulations)を示す。
【0037】
【表1】

【0038】
B.ポリ(エチレングリコールフマレート)−co−ポリ(カプロラクトンフマレート)の合成
50g等量のPEG3.4KおよびPCL1250を共に、トルエン中で共沸蒸留によって乾燥させた後、減圧下で排水して残存する微量の水を除去した。フマル酸クロリド、PEGとPCLとの混合物中のヒドロキシル官能基の総量、ならびにK2CO3を、1:1:1.5のモル比となるように測った。予め生成したPCLジオールとPEGとの混合物を塩化メチレンに溶解し(1:2(体積))、粉末K2CO3と共に2Lの三つ口フラスコに入れた。この混合物を、オーバーヘッド機械式攪拌機を用いて攪拌し、スラリーを形成した。塩化メチレンに溶解したフマル酸クロリド(1:1体積比)をスラリーに滴下した。反応混合物を窒素と共に50℃に維持した。さらなるフマル酸クロリドを随時添加して、攪拌を促した。
【0039】
C.特性決定
ゲル浸透クロマトグラフィ(GPC)を用いて、本明細書中のポリマーの分子量および多分散性を求めた。GPCは、Model 515 HPLCポンプおよびModel 2410示差屈折率検出器に接続したWaters 717 PlusオートサンプラーGPCシステム(Waters,Milford,MA,USA)を用いて実施した。フーリエ変換赤外分光法(FTIR)スペクトルをNicolet 550分光計により得た。亜鉛セレン化物ATR結晶を用いて、全てのポリマーを分析した。機器の解像度は、1000cm-1の波数で4cm-1として規定された。プロトンおよび炭素核磁気共鳴スペクトル(NMR)スペクトルは、TMSを含有するCDCl3溶液を用いて、Varian Mercury Plus NMR分光計(1H=400.1 MHz、13C=100.6 MHz)により得られた。窒素雰囲気下、加熱速度10℃/分でTA機器DSC Q1000示差走査熱量測定機により示差走査熱量測定(DSC)を測定した。同じ熱履歴を維持するために、各試料を、室温から100℃に予備加熱し、5℃/分の冷却速度で−90℃まで冷却した。その後、−90℃から100℃までの加熱の間にDSC走査を記録した。TA model Q500サーマルアナリストを用いて熱重量分析(TGA)を行った。20℃/分の加熱速度で窒素を流しながら、TGAデータを得た。ポリマーの分子特性および物理特性を表2に示す。
【0040】
【表2】

【0041】
D.架橋プロセスおよびスカフォードの作製
1.熱架橋プロセス
過酸化ベンゾイル(BPO)をフリーラジカル開始剤として、N−ジメチルトルイジン(DMT)を促進剤として用いた。スカフォードを作製する一般的な手順は以下の通りである。100μLの開始剤溶液(250μLのNVP中に50mgのBPO)および40μLの促進剤溶液(980μLの塩化メチレン中に20μLのDMT)を1.5gのPEGF−co−PCLF(またはPEGF/PCLF、PEGF/PPF配合物)の塩化メチレン(500μL)溶液に添加し、十分混合した。マルチチャネル型チューブ形態等の種々のテフロン型に、重合させるスカフォードを移した。型を対流式オーブンに一晩入れて、架橋を促進させた。架橋後、型を周囲温度に冷却する前に、シリンダーまたはチューブを型から取り外した。
【0042】
2.光架橋プロセス
光架橋を、光開始剤ビスアシルホスフィンオキシド(BAPO、Ciba Geigy)を用いて、紫外線(UV)(λ=380〜315nm)により開始した。約75μLのBAPOの塩化メチレン溶液(1.5mLの塩化メチレンに300mgのBAPO)を1.5gのPEGF−co−PCLF(またはPEGF/PCLF、PEGF/PPF配合物)の塩化メチレン(500μL)溶液に添加し、十分混合した。この混合物を2つのガラスプレートおよび1mm厚のテフロンスペーサーによって形成される型に注ぎ入れ、型を30分間UV光の真下に置いて、架橋を促進させた。これにより、このような自己架橋性コポリマーおよび光架橋性コポリマーは、立体リソグラフィ等の様々な作製方法を用いて組織工学的なスカフォードを構築するのに有用である。
【0043】
3.スカフォード作製
PEGF−co−PCLF(またはPEGF/PCLF、PEGF/PPF配合物)とポロゲン(種々の粒度分布を有する塩)との混合物に対して、同様の架橋プロセスを行い、異なる多孔性を有するスカフォードを作製することができる。この多孔性はポロゲン含量によって制御することができる。架橋後、塩を、蒸留水中でスカフォードから3日間浸出させ、その間中、水を頻繁に換えた。スカフォードを真空中、少なくとも12時間乾燥させた。また、固体作製方法および光立体画法を使用して、PEGF−co−PCLF(またはPEGF/PCLF、PEGF/PPF)スカフォードを作製することができる。
【0044】
E.膨潤試験
架橋したPEGF−co−PCLF(またはPEGF/PCLF、PEGF/PPF配合物)フィルムを上記の化学架橋プロセスにより、2つのガラスプレートおよび1mm厚のテフロンスペーサーから成る型で作製した。フィルムをいくつかの小さい長方形キューブ(10mm×5mm)に切り取った。2つのキューブを塩化メチレンおよび水にそれぞれ浸漬させた。1週間後、キューブを溶媒から取り出し、それらの表面を重量測定前に吸い取ることによって乾燥させた。その後、キューブ中の溶媒を真空オーブン内で2時間排水して、乾燥したキューブを秤量した。膨潤率は、以下の式:
【数1】

により求めることができ、式中、WdおよびWsはそれぞれ、乾燥キューブおよび膨潤キューブの重量である。
【0045】
架橋したPEGFを検査して、水性環境中の膨潤特性を示した。図8aに示されるように、膨潤率は、PEGFを作製するのに用いられるPEGの長さに従って増大する。PCLFは疎水性であるため、水を吸収することはできないが、塩化メチレンおよびテトラヒドロフラン等の有機溶媒中で著しく膨潤する。PEGF−co−PCLFの両親媒性は、水中で106%(図8a)および塩化メチレン中で508%の平均膨潤率により立証することができる。また、これにより、親水性成分および親水性成分の両方の組成およびブロック長を調節することによってヒドロゲルの膨潤率を制御する1つのアプローチが提供される。図8bにおいて様々なPEGF3.4K組成を有するPEGF3.4KとPCLF530との配合物によって形成されたハイブリッドポリマーネットワークは、PCLF530ネットワークに関して0からPEGF3.4Kネットワークに関して4.5までの範囲の膨潤率の制御性を示した。これらのコポリマーは全て、異なる物理特性を有する様々な材料を調製するために、他の不飽和モノマー、マクロマーおよびポリマーとの共重合(または架橋)に適する。
【0046】
従って、ポリ(エチレングリコールフマレート)を製造する改良された方法、およびポリ(エチレングリコールフマレート)と、ポリ(プロピレンフマレート)およびポリ(カプロラクトンフマレート)等の疎水性ポリマーとを化学的に架橋または光架橋して、制御可能な親水性を有する種々のヒドロゲルを生成する方法を提供する。ヒドロゲルは、組織工学用途および薬剤徐放用途のための生体適合性、生体吸収性、注入可能な、in−situで硬化するスカフォードとして有用である。
【0047】
一定の実施態様を参照しながら相当詳細に本発明を説明したが、制限のためにではなく、例証のために提供した記載の実施態様以外によって本発明を実施することができることが、当業者には理解されるであろう。従って、添付の請求項の範囲は、本明細書に含まれている実施態様の記載に限定されるものではない。
【図面の簡単な説明】
【0048】
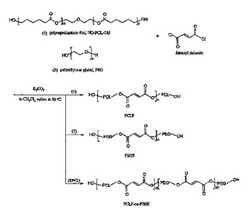
【図1】ポリ(カプロラクトンフマレート)(PCLF)、ポリ(エチレングリコールフマレート)(PEGF)およびPEGF−co−PCLFの合成スキームを示す図である。
【図2】ポリ(エチレングリコールフマレート)(PEGF)およびポリ(カプロラクトンフマレート)(PCLF)の概略的な架橋および膨潤プロセスを示す図である。
【図3】PCL530、PCLF530、PEG3.4K、PEGF3.4KおよびPEGF−co−PCLFのフーリエ変換赤外分光(FTIR)スペクトルを示す図である。
【図4】PCL530、PCLF530、PEG3.4K、PEGF3.4KおよびPEGF−co−PCLFの1H NMR(400.1MHz、CDCl3、基準 TMS)スペクトルを示す図であり、図中、Sは溶媒であり、およびアスタリスクは塩化メチレンによるシグナルを示す。
【図5】PCL530、PCLF530、PEG3.4K、PEGF3.4KおよびPEGF−co−PCLFの13C NMR(100.6MHz、CDCl3、基準 TMS)スペクトルを示す図であり、図中、Sは溶媒である。
【図6】本明細書中に記載の例示的なポリマーの示差走査熱量測定(DSC)曲線を示す図である。
【図7】PEGF、PEGおよびPEGF−co−PCLFの熱重量分析(TGA)サーモグラムである。
【図8a】時間の関数である水中における種々のポリマーネットワークの膨潤率を示す図である(25%、50%および75%はハイブリッドネットワーク中のPEGF3.4K組成物を表す)。
【図8b】PEGF3.4KおよびPCLF530と、種々のPEGF3.4K組成物との配合物によって形成されるハイブリッドネットワークの膨潤率を示す図である。
【技術分野】
【0001】
[関連出願の相互参照]
本出願は、2006年4月29日出願の米国特許仮出願第60/676,158号の優先権を主張するものである。
【0002】
[連邦政府の支援による研究に関する記載]
本件は、助成金番号AR45871及びEB03060での米国国立衛生研究所による支援を受けたものである。
【0003】
[発明の背景]
1.発明の分野
本発明は、ポリ(エチレングリコールフマレート)を製造する改良された方法、ならびに、ポリ(エチレングリコールフマレート)と、ポリ(プロピレンフマレート)およびポリ(カプロラクトンフマレート)等の疎水性ポリマーとを化学的に架橋または光架橋して、制御可能な親水性を有する種々のヒドロゲルを生成する方法に関する。ヒドロゲルは、組織工学用途および薬剤徐放用途のための生体適合性、生体吸収性の注入可能な、in−situで硬化するスカフォードとして有用である。
【背景技術】
【0004】
2.関連する分野の説明
骨再生に関する臨床的要求は多岐にわたっており、米国では、癒合を達成するために骨移植処置を必要とする骨格欠損を有する患者が、毎年、おおよそ1,000,000人いる。これらは、原発性および転移性腫瘍の切除、骨格傷害後の骨量減少、骨欠損に伴う初回および修正全関節形成術、脊髄関節固定術、ならびに骨粗しょう症性不全骨折後の骨梁の空隙から生じる申請を含む。骨移植材料の選択、作製および適用の際に行う現行の臨床上の決定は、しばしば多くの要素を含む。構造的展望から、外科的処置計画を決定する前に幾つかの決定に取り組む必要がある。
【0005】
骨格欠損を治療する現行の臨床上の方法は、骨の移植、または連続性を回復させるための他の材料の使用を含む。自己骨移植は、骨形成原細胞、骨誘導因子および治癒のための骨伝導マトリックスなどの必須要素をもたらすため、骨置換術のゴールドスタンダードになっている。しかし、自己移植骨の限られた供給量とドナー部位の病的状態の両方により、単独で用いることができるケースの範囲が制限される。同種移植骨は、豊富な供給量で利用できるが、自己移植骨と比較して低い移植片組み込み率、およびドナーからホスト(宿主)への病原体移行の可能性を含む欠点を有する。
【0006】
金属は、欠損部位での即時的な機械的支持を実現するが、宿主組織との理想的な全体にわたる一体化と言えるほどのものは示さず、金属の疲労破損前に骨が治癒しなければ疲労荷重のために結局失敗することもある。セラミック、例えば、β−リン酸三カルシウム(β−TCP)およびハイドロキシアパタイトは、両方とも、骨伝導性であり、ならびに金属プロステーシスの表面コーティングとして骨へのそれらプロステーシスの結合を強化するために臨床使用されている。粒子形態で、それらは、主として圧縮状態のポリマー複合材料に機械強度増加をもたらすが、ねじり力および曲げ力への抵抗性の強化にはあまり有効でない。ポリ(メチルメタクリレート)骨セメントは、注入または成形することができ、時には、空洞性欠損および分節性欠損(例えば、各々、巨細胞腫瘍の掻爬に起因するもの、または脊椎の転移性疾患における椎体の切除に起因するもの)の両方を充填するために使用される。しかし、発熱性重合反応中に温度が100℃まで上昇することがあり、放出される熱により局所組織は損傷の危険にさらされる。加えて、ポリ(メチルメタクリレート)は非生分解性であり、それ故、時間が経つにつれて疲労損傷が蓄積し、結局、機械的破損を被ることもある。
【0007】
合成生分解性ポリマーは、現在利用することができない治療選択肢を与えることができる。これらの材料は、事実上無限の供給量で製造することができ、それらの設計の自由度により、様々な機械的、生物学的、分解、および流動学的特性を有する広範なポリマーを合成することができる。例えば、それらの機械的特性および分解特性は、合成中にポリマーの分子量を変えることにより操作することができ、従って、特定の用途に合うように調整することができる。骨格再生用生体材料の注入可能な性質は、限られた接近容易性または不規則な形を有する欠損を充填するために理想的であろう。例えば、現在臨床使用されている低侵襲性内視鏡法により、注入可能な形態の生体材料を後側面横突間プロセスの脊椎固定のために挿入することができる。これは、移植材料を所定の位置に置くために現在は行わなければならない広範囲の露出および筋肉剥離からの外科的外傷を減少させるであろう。注入可能な材料は、周囲の皮質骨に大きな進入路用の穴を作らずに関節周囲骨折、骨粗しょう症性脊髄骨折又は骨嚢胞からの海綿状空隙に配置することができよう。これらの臨床の状況が、骨組織工学用の注入可能な生分解性ポリマー複合材料の開発の動機付けを表している。
【0008】
薬剤および成長因子等の生理活性分子の徐放(controlled release)は、疾患部位における細胞の機能および組織の形成を調節することができることから、組織工学の重要な側面となってきている。生分解性材料内への薬剤、タンパク質および他の生理活性剤の封入は、含有物質の放出プロファイルを制御する効果的な方法である。
【0009】
近年、開発されている注入可能な材料およびヒドロゲルは、これらの多岐にわたる医学的用途のための多くの設計基準を満たしている。ポリエチレングリコール(PEG)誘導性ポリ(エチレングリコールフマレート)(PEGF)は、注入可能なin−situで架橋性の生分解性ヒドロゲルとして開発された(Jo,Macromolecules,2001,34,2839;米国特許第6,884,778号および米国特許出願第2002/0028189号を参照)。PEGFは、ポリエチレングリコールとフマル酸クロリドとの縮重合によって合成されるフマレート部分を有するPEGの親水性オリゴマーである。このマクロマー中のフマレート基は、in−situで架橋、ならびに加水分解による生分解を可能にする。過硫酸アンモニウムとアスコルビン酸とから成る化学開始系を用いて、紫外光を必要とすることなくヒドロゲルを形成する(Temenoff,J.Biomed.Mater.Res.,2001,59,429を参照)。PEGFヒドロゲル上の骨髄ストローマ細胞(MSC)の付着は、モデル細胞接着特異的なペプチドを用いて研究された(Shin,J.Biomed.Mater.Res.,2002,61,169を参照)。モデルRGDペプチドを、分子量3400g/molのアクリル化PEGに結合した後、PEGFヒドロゲルに組み込んだ(Jo他、「機能化ポリマーネットワークの調製のためのGRGDペプチドによるオリゴ(ポリ(エチレングリコール)フマレート)マクロマーの修飾(Modification of Oligo(poly(ethylene glycol) fumarate) with a GRGD Peptide for the Preparation of Functionalized Polymer Networks)」,Biomacromolecules,2001,2,255を参照)。
【0010】
PEGFのPEG鎖長、架橋密度または初期ペプチド濃度を変えることによって、広範な物理特性を有するヒドロゲルが合成されうる。ペプチド濃度が増大すれば、930および2860g/molのPEG分子量を有するPEGFヒドロゲルへのMSCの付着が高まる。しかしながら、6090g/molのPEG分子量を有するPEGFヒドロゲルに付着したMSCの数は、ペプチド密度にかかわらず一定に保たれた。また、PEGFのPEG鎖長は細胞付着の程度に影響を与えた。例えば、PEGFヒドロゲル1g当たり1mmolペプチドがPEGFに組み込まれる場合、初期播種密度に対する細胞付着の程度は、930、2860および6090g/molのPEG分子量を有するPEGFについてそれぞれ、93.9±5.9%、64.7±8.2%、および9.3±6.6%であった。一方、PEGFヒドロゲルの架橋密度は、細胞付着に重大な影響を与えるものではなかった。細胞播種前に可溶性RGDの存在下で細胞がインキュベートされるときにRGD修飾ヒドロゲルへのMSC付着が競合的に阻害されたため、相互作用は配列特異的であった。これらの結果は、ペプチド濃度を変えることにより、PEGFヒドロゲルへの細胞付着が調節されることができることを示している。また、PEGFマクロマーは、N,N’−メチレンビスアクリルアミド(MBA)により架橋されて、間葉幹細胞のための細胞キャリアとしてin−situで架橋する注入可能なスカフォードを作製する(Jabbari,14th Int.Symp.Microencap.Proceed.,2000,54を参照)。この系は、場合によっては骨軟骨症の治療に有用である。過硫酸アンモニウムとN,N,N’,N’−テトラメチルエチレンジアミン(TMED)から成る酸化還元開始剤の新規な組み合わせをこの系において使用し、中性のpHを得た。間葉幹細胞(MSC)はこの注入可能な系に首尾良く播種された。完全な骨形成培地中で培養したこの封入MSCは、アルカリ性脱リン酸酵素活性を示し、21日までの間、ミネラル化マトリックスを増大させた。
【0011】
ポリ(プロピレンフマレート)(PPF)は、そのフマレート二重結合を通じて修飾又は架橋されうる不飽和直鎖状ポリエステルである。例えば、米国特許第5,733,951号明細書を参照。ポリ(ε−カプロラクトン)(PCL)は、周知の生分解性ポリマーであり、吸収性縫合糸としての使用がFDAにより認可されている。卓越した生体適合性および可撓性を有する。PCLは、一時的関節スペーサー(Elfick,Biomaterials,2002,23,4463−7を参照)および組織工学的皮膚(tissue-engineered skin)(Ng,Tissue Engineering,2001,7,441−55を参照)用の可能性ある材料として最近研究された。PCLセグメントおよびフマレートセグメントに基づく注入可能なコポリマー、ポリ(カプロラクトンフマレート)(PCLF)が研究されている。PCL単位の存在のため、PCLF鎖は、PPF鎖よりずっと可撓性である。このことにより、PCLFは、架橋剤を一切使用せずに自己架橋することができる。PCT国際公開WO2005/004811号パンフレットを参照。
【0012】
光架橋は、2つの高分子間または1つの高分子中の2つの異なる部分間の共有結合の形成である。光架橋は、インビボでの硬化を可能にし、これは、外科医の移植可能なポリマーの配置および取り扱いに大きな融通性をもたらす。他の架橋法を超える光架橋の主な利点は、重合の空間的および時間的制御、室温での速い硬化速度、ならびに移植中の成形の容易さおよび可撓性である(Anseth,Nature Biotechnology,1999,17,156−9を参照)。
【0013】
これまでのポリ(エチレングリコールフマレート)(PEGF)合成方法の主な欠点は、暗色のPEGF生成物、および重縮合におけるプロトンスカベンジャートリエチルアミンによる比較的低い反応効率である。
【発明の開示】
【発明が解決しようとする課題】
【0014】
従って、ポリ(エチレングリコールフマレート)を製造する改良された方法が必要とされる。また、ポリ(エチレングリコールフマレート)と、ポリ(プロピレンフマレート)(PPF)およびポリ(カプロラクトンフマレート)(PCLF)等の疎水性ポリマーとを化学的に架橋または光架橋して、制御可能な親水性、ならびに制御される膨潤特性および機械特性を有する種々のヒドロゲルを生成する。
【0015】
[発明の概要]
本発明では、金属塩プロトンスカベンジャー、好ましくはアルカリ金属炭酸塩プロトンスカベンジャー、最も好ましくは炭酸カリウムを用いて、ポリ(エチレングリコールフマレート)を調製する。本発明は、時間消費を大幅に減少させ、かつ最終生成物の分子量をより大きくする修飾PEGF合成プロセスを有する。例えば、この方法は、5000g/molを超える重量平均分子量を有するポリ(エチレングリコールフマレート)を調製することができる。
【0016】
新たに合成されたPEGFは、それ自体、またはポリ(プロピレンフマレート)(PPF)およびポリ(カプロラクトンフマレート)(PCLF)等の不飽和疎水性ポリマーと、化学的に架橋または光架橋され、制御可能な親水性、ならびに膨潤特性および機械特性を有する種々のヒドロゲルを生成することができる。ヒドロゲルは、骨格再構築用途のための注入可能なin−situで硬化するスカフォードを作製するのに有用でありうる。
【0017】
また、本発明は、カプロラクトンフマレート単位とエチレングリコールフマレート単位とを含むコポリマー(PEGF−co−PCLF)を製造するプロセスを提供する。
【0018】
ヒドロゲルを含む注入可能な材料はまた、種々の研究および臨床的側面、特に、薬剤徐放において有用でありうる。例えば、1つまたは複数の生理活性剤が、ヒドロゲルに添加されるか、またはヒドロゲル粒子内に取り込まれる。生理活性剤(複数可)は、所望の生理学的効果に応じて選択される。
【0019】
本発明のこれらのおよび他の特徴、態様、および利点は、以下の詳細な説明、図面、および添付の特許請求の範囲に鑑みて、より理解されるであろう。
【発明を実施するための最良の形態】
【0020】
[発明の詳細な説明]
1つの態様において、本発明は、ポリ(エチレングリコールフマレート)を製造する方法を提供する。本方法において、ポリエチレングリコールは、金属塩の存在下でフマル酸またはその塩(例えば、フマル酸クロリド)と反応する。この金属塩は、アルカリ金属塩、好ましくはアルカリ金属炭酸塩、最も好ましくは炭酸カリウムであってもよい。本方法は、従来の方法のような暗色の生成物の形成を防ぐ。また、本方法は、5000g/molを超える重量平均分子量を有するポリ(エチレングリコールフマレート)を調製することができる。
【0021】
別の態様において、本発明は、カプロラクトンフマレート単位とエチレングリコールフマレート単位とを含むコポリマー、およびPEGF−co−PCLFコポリマーを製造するプロセスを提供する。エチレングリコールフマレート単位は親水性であり、カプロラクトンフマレート単位は疎水性であるため、PEGF−co−PCLFコポリマーは両親媒性となる。これにより、親水性成分および親水性成分の両方の組成およびブロック長を調節することによってヒドロゲルの膨潤率を制御する1つのアプローチが提供される。例示的なコポリマーは、式
【化1】

(式中、nおよびmは整数である)を有する。
【0022】
PEGF−co−PCLFは、ポリカプロラクトンジオールと、ポリエチレングリコールと、フマル酸またはその塩とを反応させることによって調製することができる。PEGF−co−PCLFはまた、(i)ポリカプロラクトンジオールとフマル酸またはその塩とを反応させることによって調製される第1のポリマーと、(ii)ポリエチレングリコールとフマル酸またはその塩とを反応させることによって調製される第2のポリマーとを反応させることによって調製することができる。コポリマーは、組織再生用のスカフォードを調製するのに有用な架橋性の生分解性材料に組み込むことができる。
【0023】
さらに別の態様において、本発明は、ポリ(プロピレンフマレート)と架橋するポリ(エチレングリコールフマレート)を含む生分解性材料を提供し、これは組織再生用のスカフォードとして有用である。本材料は、ポリ(エチレングリコールフマレート)、ポリ(プロピレンフマレート)およびフリーラジカル開始剤または光開始剤を含む、架橋性の生分解性材料から生成することができる。好ましくは、本材料は自己架橋性である。本材料は光架橋性であってもよい。1つの形態において、本材料は注入可能な代用骨である。
【0024】
さらに別の態様において、本発明は、ポリ(カプロラクトンフマレート)と架橋するポリ(エチレングリコールフマレート)を含む生分解性材料を提供し、これは組織再生用のスカフォードとして有用である。本材料は、ポリ(エチレングリコールフマレート)、ポリ(カプロラクトンフマレート)およびフリーラジカル開始剤または光開始剤を含む、架橋性の生分解性材料から生成することができる。好ましくは、本材料は自己架橋性である。本材料は光架橋性であってもよい。1つの形態において、本材料は注入可能な代用骨である。
【0025】
従って、本発明は、組織再生用のスカフォードを調製するのに有用な光架橋性の生分解性材料を提供する。上記のように、本発明による例示的な材料としては、(i)カプロラクトンフマレート単位とエチレングリコールフマレート単位とを含むコポリマー、(ii)ポリ(エチレングリコールフマレート)とポリ(カプロラクトンフマレート)との配合物、または(iii)ポリ(エチレングリコールフマレート)とポリ(プロピレンフマレート)との配合物が挙げられる。光架橋性の生分解性材料は、光開始剤、例えば、ベンゾインおよびベンゾインエーテル化合物、ベンジルケタール化合物、アセトフェノン化合物、アミノアルキルフェノン化合物、ヒドロキシアルキルフェノン化合物、アシルホスフィンオキシド、アシルホスフィンスルフィド、フェニルグリオキシル酸化合物、ベンゾフェノン化合物、チオキサントン化合物、およびそれらの混合物を含む。1つの例示的な材料において、光開始剤はビスアシルホスフィンオキシドである。
【0026】
本材料は、注入可能な代用骨または注入可能な骨セメントであり得る。本材料の注入可能な性質により、限られた接近容易性または不規則な形の欠損を充填することができる。例えば、現在臨床使用されている低侵襲性内視鏡法により、注入可能な形態の本材料を後側面横突間プロセスの脊椎固定のために挿入することができる。注入可能な材料は、周囲の皮質骨に大きな進入路用の穴を作ることなく関節周囲骨折、骨粗しょう症性脊髄骨折または骨嚢胞からの海綿状空隙に配置することができる。
【0027】
本発明の材料の注入可能な性質に関して、注入の温度範囲は広く、混合物の融点と混合物に使用される溶媒の沸点との間であり得る。通常、ポリマー混合物は、便宜上、室温で注入される。
【0028】
本発明に係る生分解性材料は、自己架橋性でありうるため、架橋剤を含む必要がない。一般に、架橋剤は、架橋中、隣接する二重結合の架橋を助長するために使用される。本発明の自己架橋性および/または光架橋性の生分解性材料は、架橋剤を一切必要としないため、生物医学的用途における毒性の懸念を最小にする。しかし、架橋剤を使用することもできる。架橋剤の例としては、アクリレートモノマーがある。
【0029】
本発明の架橋性材料は、組織再生用のスカフォードの形成に適する。1つの形態において、本架橋性材料は、多孔性スカフォードの形成を可能にするポロゲンを含む。適するポロゲン類としては、多孔性スカフォードを形成するソルトリーチング(salt leaching)法において使用することができる塩結晶(例えば、塩化ナトリウム)が挙げられる。このタイプの粒子リーチング(particle leaching)法の例は、米国特許第6,436,426号、同第6,379,962号および同第5,514,378号において見出すことができる。ポロゲンは、PCT国際公開第2005/020849号パンフレットに記載されているようなヒドロゲルポロゲンであってもよい。ポロゲンの選択は、架橋プロセスにより左右されることがある。ポロゲンは、架橋フィルムの製造に用いることができるが、それは、ポロゲンの物理的性質および色に依存する。また、一部のポロゲンは、UV光を遮断し、その結果、光架橋手順を非効率にすることがある。従って、本発明の光架橋性の生分解性材料は、所望の最終製品に依存して、ポロゲンを含むこともあり、含まないこともある。
【0030】
本架橋性材料は、粒子または繊維強化材料をさらに含むことがある。ハイドロキシアパタイトが強化材料としての役割を果たすのが、特に有利である。骨無機質の組成に関する類似性、細胞機能の生理活性および促進、ならびに骨伝導性のためである。これらの強化材料は、単層カーボンナノチューブを含むこともある。
【0031】
本架橋性材料は、1つ以上の生理活性剤をさらに含むことがある。本明細書において用いる場合の「生理活性剤」は、限定ではないが、体内で局所的または全身的に作用する生理または薬理学的活性物質を包含する。生理活性剤は、疾病または疾患の治療、予防、診断、治癒または緩和のために使用される物質、または身体の構造もしくは機能に影響を及ぼす物質、または所定の生理環境に置かれた後、生理活性になるか、より活性になる物質である。生理活性剤としては、限定ではないが、酵素、有機触媒、リボザイム類、有機金属化合物、タンパク質、糖タンパク類、ペプチド類、ポリアミノ酸、抗体、核酸、ステロイド性分子、抗生物質、抗菌剤、サイトカイン類、成長因子、炭水化物、疎油性物質、脂質、細胞外基質、並びに/又はその個々の成分、製剤および治療薬が挙げられる。
【0032】
この架橋性の生分解性材料は、促進剤も含むことがある。促進剤の非限定的な例としては、トルイジン類(例えば、N,N−ジエチル−p−トルイジン(「DET」)およびN,N−ジメチル−o−トルイジン(「DMT」))、アセチルフェニルヒドラジン、マレイン酸、キニン類(例えば、ナフタキノンおよびアントラキノン)、ならびにアルキルメルカプタン類が挙げられる。多くの場合、光架橋プロセスでは促進剤が必要とされない。全ての手順が相当短い(例えば、30分未満)であるためである。
【0033】
本明細書において用いる場合、「生体適合性」材料は、重度のまたは漸増的反応とは対照的に、軽度の、多くの場合一時的な、移植反応しか誘発しないものである。本明細書において用いる場合、「生分解性」材料は、正常なインビボ生理条件下で、代謝または排泄され得る成分に分解するものである。本明細書において用いる場合、「生体吸収性」材料は、身体の化学的/生物学的作用に起因して、限られた期間をかけて分解するものである。「注入可能な」とは、本コポリマーを医療用注射器により一定部位に送達することができることを意味する。「自己架橋性」とは、本発明のポリマーの官能基と本発明の同じまたは別のポリマーの官能基との間の架橋を形成する架橋剤を用いることなく、本発明のポリマーの官能基が、本発明の同ポリマーまたは別のポリマーの官能基と架橋できることを意味する。「光架橋性」とは、光開始剤の存在下、光子(例えば、UV光)の適用により、本発明のコポリマーの官能基が、本発明の同じポリマーまたは別のポリマーの官能基と架橋できることを意味する。
【0034】
本明細書における用語「分子量」は、「重量平均分子量」(Mw=ΣiNiMi2/ΣiNiMi)を指す。様々な方法で重量平均分子量(Mw)を決定することができるとはいえ、利用する方法に依存して結果は多少異なり、ゲル透過クロマトグラフィーを利用するのが適便である。本明細書において用いる場合、用語「数平均分子量」(Mn)は、存在する全モル数で割った、ポリマーサンプル中の全ての分子の合計重量を指す(Mn=ΣiNiMi/ΣiNi)。様々な方法で数平均分子量を決定することができるとはいえ、利用する方法に依存して結果は多少異なり、ゲル透過クロマトグラフィーを利用するのが適便である。本明細書において用いる場合、用語「多分散性」は、材料の「重量平均分子量」を「数平均分子量」で割った比(Mw/Mn)を指す。
【実施例】
【0035】
以下の実施例は、本発明をさらに例証するために提示したものであり、いかなる点においても本発明を制限するためのものではない。
【0036】
A.ポリ(エチレングリコールフマレート)(PEGF)マクロマーの合成
ポリ(エチレングリコール)(PEG、Aldrich)を、トルエン中で共沸蒸留によって乾燥させた後、減圧下で排水して残存する微量の水を除去した。フマル酸クロリド、PEGおよび炭酸カリウムを、1:1:1.5のモル比となるように測った。PEG3.4Kのポリマー密度は、1.0926g/cm3である。PEGを塩化メチレンに溶解し(1:2(体積))、粉末炭酸カリウムと共に2Lの三つ口フラスコに入れた。この混合物を、オーバーヘッド機械式攪拌機を用いて攪拌し、スラリーを形成した。塩化メチレンに溶解したフマル酸クロリド(1:1体積比)をスラリーに滴下した。反応混合物を窒素ブランケット下で(フマル酸クロリド添加速度を変えることによって)50℃に維持した。さらなるフマル酸クロリドを随時添加して、攪拌を促した。フマル酸クロリド添加の完了後、混合物を、遠心分離管に移し、炭酸カリウムが完全に除去されるまで15分間4000rpmで遠心沈殿させた。その後、上澄みを石油エーテルに滴下して溶液からポリマーを取り除き、沈殿物を回転蒸発して、琥珀色の粘稠液を得た。表1は、PEGFを重合するための組成(formulations)を示す。
【0037】
【表1】

【0038】
B.ポリ(エチレングリコールフマレート)−co−ポリ(カプロラクトンフマレート)の合成
50g等量のPEG3.4KおよびPCL1250を共に、トルエン中で共沸蒸留によって乾燥させた後、減圧下で排水して残存する微量の水を除去した。フマル酸クロリド、PEGとPCLとの混合物中のヒドロキシル官能基の総量、ならびにK2CO3を、1:1:1.5のモル比となるように測った。予め生成したPCLジオールとPEGとの混合物を塩化メチレンに溶解し(1:2(体積))、粉末K2CO3と共に2Lの三つ口フラスコに入れた。この混合物を、オーバーヘッド機械式攪拌機を用いて攪拌し、スラリーを形成した。塩化メチレンに溶解したフマル酸クロリド(1:1体積比)をスラリーに滴下した。反応混合物を窒素と共に50℃に維持した。さらなるフマル酸クロリドを随時添加して、攪拌を促した。
【0039】
C.特性決定
ゲル浸透クロマトグラフィ(GPC)を用いて、本明細書中のポリマーの分子量および多分散性を求めた。GPCは、Model 515 HPLCポンプおよびModel 2410示差屈折率検出器に接続したWaters 717 PlusオートサンプラーGPCシステム(Waters,Milford,MA,USA)を用いて実施した。フーリエ変換赤外分光法(FTIR)スペクトルをNicolet 550分光計により得た。亜鉛セレン化物ATR結晶を用いて、全てのポリマーを分析した。機器の解像度は、1000cm-1の波数で4cm-1として規定された。プロトンおよび炭素核磁気共鳴スペクトル(NMR)スペクトルは、TMSを含有するCDCl3溶液を用いて、Varian Mercury Plus NMR分光計(1H=400.1 MHz、13C=100.6 MHz)により得られた。窒素雰囲気下、加熱速度10℃/分でTA機器DSC Q1000示差走査熱量測定機により示差走査熱量測定(DSC)を測定した。同じ熱履歴を維持するために、各試料を、室温から100℃に予備加熱し、5℃/分の冷却速度で−90℃まで冷却した。その後、−90℃から100℃までの加熱の間にDSC走査を記録した。TA model Q500サーマルアナリストを用いて熱重量分析(TGA)を行った。20℃/分の加熱速度で窒素を流しながら、TGAデータを得た。ポリマーの分子特性および物理特性を表2に示す。
【0040】
【表2】

【0041】
D.架橋プロセスおよびスカフォードの作製
1.熱架橋プロセス
過酸化ベンゾイル(BPO)をフリーラジカル開始剤として、N−ジメチルトルイジン(DMT)を促進剤として用いた。スカフォードを作製する一般的な手順は以下の通りである。100μLの開始剤溶液(250μLのNVP中に50mgのBPO)および40μLの促進剤溶液(980μLの塩化メチレン中に20μLのDMT)を1.5gのPEGF−co−PCLF(またはPEGF/PCLF、PEGF/PPF配合物)の塩化メチレン(500μL)溶液に添加し、十分混合した。マルチチャネル型チューブ形態等の種々のテフロン型に、重合させるスカフォードを移した。型を対流式オーブンに一晩入れて、架橋を促進させた。架橋後、型を周囲温度に冷却する前に、シリンダーまたはチューブを型から取り外した。
【0042】
2.光架橋プロセス
光架橋を、光開始剤ビスアシルホスフィンオキシド(BAPO、Ciba Geigy)を用いて、紫外線(UV)(λ=380〜315nm)により開始した。約75μLのBAPOの塩化メチレン溶液(1.5mLの塩化メチレンに300mgのBAPO)を1.5gのPEGF−co−PCLF(またはPEGF/PCLF、PEGF/PPF配合物)の塩化メチレン(500μL)溶液に添加し、十分混合した。この混合物を2つのガラスプレートおよび1mm厚のテフロンスペーサーによって形成される型に注ぎ入れ、型を30分間UV光の真下に置いて、架橋を促進させた。これにより、このような自己架橋性コポリマーおよび光架橋性コポリマーは、立体リソグラフィ等の様々な作製方法を用いて組織工学的なスカフォードを構築するのに有用である。
【0043】
3.スカフォード作製
PEGF−co−PCLF(またはPEGF/PCLF、PEGF/PPF配合物)とポロゲン(種々の粒度分布を有する塩)との混合物に対して、同様の架橋プロセスを行い、異なる多孔性を有するスカフォードを作製することができる。この多孔性はポロゲン含量によって制御することができる。架橋後、塩を、蒸留水中でスカフォードから3日間浸出させ、その間中、水を頻繁に換えた。スカフォードを真空中、少なくとも12時間乾燥させた。また、固体作製方法および光立体画法を使用して、PEGF−co−PCLF(またはPEGF/PCLF、PEGF/PPF)スカフォードを作製することができる。
【0044】
E.膨潤試験
架橋したPEGF−co−PCLF(またはPEGF/PCLF、PEGF/PPF配合物)フィルムを上記の化学架橋プロセスにより、2つのガラスプレートおよび1mm厚のテフロンスペーサーから成る型で作製した。フィルムをいくつかの小さい長方形キューブ(10mm×5mm)に切り取った。2つのキューブを塩化メチレンおよび水にそれぞれ浸漬させた。1週間後、キューブを溶媒から取り出し、それらの表面を重量測定前に吸い取ることによって乾燥させた。その後、キューブ中の溶媒を真空オーブン内で2時間排水して、乾燥したキューブを秤量した。膨潤率は、以下の式:
【数1】

により求めることができ、式中、WdおよびWsはそれぞれ、乾燥キューブおよび膨潤キューブの重量である。
【0045】
架橋したPEGFを検査して、水性環境中の膨潤特性を示した。図8aに示されるように、膨潤率は、PEGFを作製するのに用いられるPEGの長さに従って増大する。PCLFは疎水性であるため、水を吸収することはできないが、塩化メチレンおよびテトラヒドロフラン等の有機溶媒中で著しく膨潤する。PEGF−co−PCLFの両親媒性は、水中で106%(図8a)および塩化メチレン中で508%の平均膨潤率により立証することができる。また、これにより、親水性成分および親水性成分の両方の組成およびブロック長を調節することによってヒドロゲルの膨潤率を制御する1つのアプローチが提供される。図8bにおいて様々なPEGF3.4K組成を有するPEGF3.4KとPCLF530との配合物によって形成されたハイブリッドポリマーネットワークは、PCLF530ネットワークに関して0からPEGF3.4Kネットワークに関して4.5までの範囲の膨潤率の制御性を示した。これらのコポリマーは全て、異なる物理特性を有する様々な材料を調製するために、他の不飽和モノマー、マクロマーおよびポリマーとの共重合(または架橋)に適する。
【0046】
従って、ポリ(エチレングリコールフマレート)を製造する改良された方法、およびポリ(エチレングリコールフマレート)と、ポリ(プロピレンフマレート)およびポリ(カプロラクトンフマレート)等の疎水性ポリマーとを化学的に架橋または光架橋して、制御可能な親水性を有する種々のヒドロゲルを生成する方法を提供する。ヒドロゲルは、組織工学用途および薬剤徐放用途のための生体適合性、生体吸収性、注入可能な、in−situで硬化するスカフォードとして有用である。
【0047】
一定の実施態様を参照しながら相当詳細に本発明を説明したが、制限のためにではなく、例証のために提供した記載の実施態様以外によって本発明を実施することができることが、当業者には理解されるであろう。従って、添付の請求項の範囲は、本明細書に含まれている実施態様の記載に限定されるものではない。
【図面の簡単な説明】
【0048】
【図1】ポリ(カプロラクトンフマレート)(PCLF)、ポリ(エチレングリコールフマレート)(PEGF)およびPEGF−co−PCLFの合成スキームを示す図である。
【図2】ポリ(エチレングリコールフマレート)(PEGF)およびポリ(カプロラクトンフマレート)(PCLF)の概略的な架橋および膨潤プロセスを示す図である。
【図3】PCL530、PCLF530、PEG3.4K、PEGF3.4KおよびPEGF−co−PCLFのフーリエ変換赤外分光(FTIR)スペクトルを示す図である。
【図4】PCL530、PCLF530、PEG3.4K、PEGF3.4KおよびPEGF−co−PCLFの1H NMR(400.1MHz、CDCl3、基準 TMS)スペクトルを示す図であり、図中、Sは溶媒であり、およびアスタリスクは塩化メチレンによるシグナルを示す。
【図5】PCL530、PCLF530、PEG3.4K、PEGF3.4KおよびPEGF−co−PCLFの13C NMR(100.6MHz、CDCl3、基準 TMS)スペクトルを示す図であり、図中、Sは溶媒である。
【図6】本明細書中に記載の例示的なポリマーの示差走査熱量測定(DSC)曲線を示す図である。
【図7】PEGF、PEGおよびPEGF−co−PCLFの熱重量分析(TGA)サーモグラムである。
【図8a】時間の関数である水中における種々のポリマーネットワークの膨潤率を示す図である(25%、50%および75%はハイブリッドネットワーク中のPEGF3.4K組成物を表す)。
【図8b】PEGF3.4KおよびPCLF530と、種々のPEGF3.4K組成物との配合物によって形成されるハイブリッドネットワークの膨潤率を示す図である。
【特許請求の範囲】
【請求項1】
カプロラクトンフマレート単位と、
エチレングリコールフマレート単位と
を含むコポリマー。
【請求項2】
下式:
【化1】

(式中、nおよびmは整数である)
を有する、請求項1記載のコポリマー。
【請求項3】
ポリカプロラクトンジオールと、ポリエチレングリコールと、フマル酸またはその塩とを反応させることによって製造されるコポリマー。
【請求項4】
(i)ポリカプロラクトンジオールとフマル酸またはその塩とを反応させることによって調製される第1のポリマーと、(ii)ポリエチレングリコールとフマル酸またはその塩とを反応させることによって調製される第2のポリマーとを反応させることによって製造されるコポリマー。
【請求項5】
請求項1〜4のいずれか1項に記載のコポリマーを含む、組織再生用のスカフォード。
【請求項6】
カプロラクトンフマレート単位とエチレングリコールフマレート単位とを有するコポリマーと、
フリーラジカル開始剤または光開始剤と
を含む、架橋性の生分解性材料。
【請求項7】
自己架橋性である、請求項6記載の架橋性の生分解性材料。
【請求項8】
注入可能な代用骨である、請求項6記載の架橋性の生分解性材料。
【請求項9】
ポロゲンをさらに含む、請求項6記載の架橋性の生分解性材料。
【請求項10】
促進剤をさらに含む、請求項6記載の架橋性の生分解性材料。
【請求項11】
架橋剤を含まない、請求項6記載の架橋性の生分解性材料。
【請求項12】
粒子または繊維強化材料をさらに含む、請求項6記載の架橋性の生分解性材料。
【請求項13】
生理活性剤をさらに含む、請求項6記載の架橋性の生分解性材料。
【請求項14】
請求項6〜13のいずれか1項に記載の材料を含む、組織再生用のスカフォード。
【請求項15】
ポリ(プロピレンフマレート)と架橋するポリ(エチレングリコールフマレート)を含む、生分解性材料。
【請求項16】
ポリ(エチレングリコールフマレート)と、
ポリ(プロピレンフマレート)と、
フリーラジカル開始剤または光開始剤と
を含む、架橋性の生分解性材料。
【請求項17】
自己架橋性である、請求項16記載の架橋性の生分解性材料。
【請求項18】
注入可能な代用骨である、請求項16記載の架橋性の生分解性材料。
【請求項19】
ポロゲンをさらに含む、請求項16記載の架橋性の生分解性材料。
【請求項20】
促進剤をさらに含む、請求項16記載の架橋性の生分解性材料。
【請求項21】
架橋剤を含まない、請求項16記載の架橋性の生分解性材料。
【請求項22】
粒子または繊維強化材料をさらに含む、請求項16記載の架橋性の生分解性材料。
【請求項23】
生理活性剤をさらに含む、請求項16記載の架橋性の生分解性材料。
【請求項24】
請求項15〜23のいずれか1項に記載の材料を含む、組織再生用のスカフォード。
【請求項25】
ポリ(カプロラクトンフマレート)と架橋するポリ(エチレングリコールフマレート)を含む、生分解性材料。
【請求項26】
ポリ(エチレングリコールフマレート)と、
ポリ(カプロラクトンフマレート)と、
フリーラジカル開始剤または光開始剤と
を含む、架橋性の生分解性材料。
【請求項27】
自己架橋性である、請求項26記載の架橋性の生分解性材料。
【請求項28】
注入可能な代用骨である、請求項26記載の架橋性の生分解性材料。
【請求項29】
ポロゲンをさらに含む、請求項26記載の架橋性の生分解性材料。
【請求項30】
促進剤をさらに含む、請求項26記載の架橋性の生分解性材料。
【請求項31】
架橋剤を含まない、請求項26記載の架橋性の生分解性材料。
【請求項32】
粒子または繊維強化材料をさらに含む、請求項26記載の架橋性の生分解性材料。
【請求項33】
生理活性剤をさらに含む、請求項26記載の架橋性の生分解性材料。
【請求項34】
請求項25〜33のいずれか1項に記載の材料を含む、組織再生用のスカフォード。
【請求項35】
金属塩の存在下でポリエチレングリコールとフマル酸またはその塩とを反応させること
を含む、ポリ(エチレングリコールフマレート)を製造する方法。
【請求項36】
前記金属塩がアルカリ金属塩である、請求項35記載のポリ(エチレングリコールフマレート)を製造する方法。
【請求項37】
前記アルカリ金属塩がアルカリ金属炭酸塩である、請求項36記載のポリ(エチレングリコールフマレート)を製造する方法。
【請求項38】
前記アルカリ金属塩が炭酸カリウムである、請求項36記載のポリ(エチレングリコールフマレート)を製造する方法。
【請求項39】
5000g/molを超える重量平均分子量を有するポリ(エチレングリコールフマレート)を製造する、請求項36記載のポリ(エチレングリコールフマレート)を製造する方法。
【請求項1】
カプロラクトンフマレート単位と、
エチレングリコールフマレート単位と
を含むコポリマー。
【請求項2】
下式:
【化1】

(式中、nおよびmは整数である)
を有する、請求項1記載のコポリマー。
【請求項3】
ポリカプロラクトンジオールと、ポリエチレングリコールと、フマル酸またはその塩とを反応させることによって製造されるコポリマー。
【請求項4】
(i)ポリカプロラクトンジオールとフマル酸またはその塩とを反応させることによって調製される第1のポリマーと、(ii)ポリエチレングリコールとフマル酸またはその塩とを反応させることによって調製される第2のポリマーとを反応させることによって製造されるコポリマー。
【請求項5】
請求項1〜4のいずれか1項に記載のコポリマーを含む、組織再生用のスカフォード。
【請求項6】
カプロラクトンフマレート単位とエチレングリコールフマレート単位とを有するコポリマーと、
フリーラジカル開始剤または光開始剤と
を含む、架橋性の生分解性材料。
【請求項7】
自己架橋性である、請求項6記載の架橋性の生分解性材料。
【請求項8】
注入可能な代用骨である、請求項6記載の架橋性の生分解性材料。
【請求項9】
ポロゲンをさらに含む、請求項6記載の架橋性の生分解性材料。
【請求項10】
促進剤をさらに含む、請求項6記載の架橋性の生分解性材料。
【請求項11】
架橋剤を含まない、請求項6記載の架橋性の生分解性材料。
【請求項12】
粒子または繊維強化材料をさらに含む、請求項6記載の架橋性の生分解性材料。
【請求項13】
生理活性剤をさらに含む、請求項6記載の架橋性の生分解性材料。
【請求項14】
請求項6〜13のいずれか1項に記載の材料を含む、組織再生用のスカフォード。
【請求項15】
ポリ(プロピレンフマレート)と架橋するポリ(エチレングリコールフマレート)を含む、生分解性材料。
【請求項16】
ポリ(エチレングリコールフマレート)と、
ポリ(プロピレンフマレート)と、
フリーラジカル開始剤または光開始剤と
を含む、架橋性の生分解性材料。
【請求項17】
自己架橋性である、請求項16記載の架橋性の生分解性材料。
【請求項18】
注入可能な代用骨である、請求項16記載の架橋性の生分解性材料。
【請求項19】
ポロゲンをさらに含む、請求項16記載の架橋性の生分解性材料。
【請求項20】
促進剤をさらに含む、請求項16記載の架橋性の生分解性材料。
【請求項21】
架橋剤を含まない、請求項16記載の架橋性の生分解性材料。
【請求項22】
粒子または繊維強化材料をさらに含む、請求項16記載の架橋性の生分解性材料。
【請求項23】
生理活性剤をさらに含む、請求項16記載の架橋性の生分解性材料。
【請求項24】
請求項15〜23のいずれか1項に記載の材料を含む、組織再生用のスカフォード。
【請求項25】
ポリ(カプロラクトンフマレート)と架橋するポリ(エチレングリコールフマレート)を含む、生分解性材料。
【請求項26】
ポリ(エチレングリコールフマレート)と、
ポリ(カプロラクトンフマレート)と、
フリーラジカル開始剤または光開始剤と
を含む、架橋性の生分解性材料。
【請求項27】
自己架橋性である、請求項26記載の架橋性の生分解性材料。
【請求項28】
注入可能な代用骨である、請求項26記載の架橋性の生分解性材料。
【請求項29】
ポロゲンをさらに含む、請求項26記載の架橋性の生分解性材料。
【請求項30】
促進剤をさらに含む、請求項26記載の架橋性の生分解性材料。
【請求項31】
架橋剤を含まない、請求項26記載の架橋性の生分解性材料。
【請求項32】
粒子または繊維強化材料をさらに含む、請求項26記載の架橋性の生分解性材料。
【請求項33】
生理活性剤をさらに含む、請求項26記載の架橋性の生分解性材料。
【請求項34】
請求項25〜33のいずれか1項に記載の材料を含む、組織再生用のスカフォード。
【請求項35】
金属塩の存在下でポリエチレングリコールとフマル酸またはその塩とを反応させること
を含む、ポリ(エチレングリコールフマレート)を製造する方法。
【請求項36】
前記金属塩がアルカリ金属塩である、請求項35記載のポリ(エチレングリコールフマレート)を製造する方法。
【請求項37】
前記アルカリ金属塩がアルカリ金属炭酸塩である、請求項36記載のポリ(エチレングリコールフマレート)を製造する方法。
【請求項38】
前記アルカリ金属塩が炭酸カリウムである、請求項36記載のポリ(エチレングリコールフマレート)を製造する方法。
【請求項39】
5000g/molを超える重量平均分子量を有するポリ(エチレングリコールフマレート)を製造する、請求項36記載のポリ(エチレングリコールフマレート)を製造する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8a】


【図8b】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8a】


【図8b】


【公表番号】特表2008−539323(P2008−539323A)
【公表日】平成20年11月13日(2008.11.13)
【国際特許分類】
【出願番号】特願2008−509151(P2008−509151)
【出願日】平成18年4月28日(2006.4.28)
【国際出願番号】PCT/US2006/016156
【国際公開番号】WO2006/118987
【国際公開日】平成18年11月9日(2006.11.9)
【出願人】(500480919)メイヨ フオンデーシヨン フオー メデイカル エジユケーシヨン アンド リサーチ (18)
【Fターム(参考)】
【公表日】平成20年11月13日(2008.11.13)
【国際特許分類】
【出願日】平成18年4月28日(2006.4.28)
【国際出願番号】PCT/US2006/016156
【国際公開番号】WO2006/118987
【国際公開日】平成18年11月9日(2006.11.9)
【出願人】(500480919)メイヨ フオンデーシヨン フオー メデイカル エジユケーシヨン アンド リサーチ (18)
【Fターム(参考)】
[ Back to top ]

